-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neobvyklá příčina zvětšování břicha
A rare cause of increased abdominal size
We present a patient with an increased abdominal size and epigastric pain. Pseudomyxoma peritonei was diagnosed based on imaging studies. This is a rare clinical condition characterized by diffuse gelatinous collections in the abdomen and pelvis that are associated with mucinous implants on surfaces in the peritoneal cavity. It is caused by cystadenoma of the appendix, which leads to peritoneal seeding of mucus-producing cells. Mucins fill the peritoneal cavity. This condition has an indolent but progressive course and is fatal if untreated. The treatment of choice is radical surgical cytoreduction and heated intraperitoneal chemotherapy, which may have curative potential.
Key words:
pseudomyxoma peritonei – cystadenoma of the appendix – cytoreduction – HIPEC
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
26. 3. 2018Accepted:
28. 3. 2018
Autoři: K. Dvořák 1; J. Fulík 2
Působiště autorů: Oddělení gastroenterologie a hepatologie, Krajská nemocnice Liberec, a. s., Nemocnice Liberec 1; Chirurgická klinika 1. LF UK a IPVZ Nemocnice Na Bulovce, Praha 2
Vyšlo v časopise: Gastroent Hepatol 2018; 72(2): 119-121
Kategorie: Hepatologie: kazuistika
doi: https://doi.org/10.14735/amgh2018119Souhrn
Prezentujeme případ pacienta vyšetřovaného pro zvětšování břicha a bolesti v epigastriu. Na základě zobrazovacích metod byl diagnostikován pseudomyxom peritonea, vzácný klinický syndrom charakterizovaný přítomností akumulovaných gelatinózních kolekcí v dutině břišní a pánvi s mucinózními implantáty na peritoneu. Příčinou byl cystadenom apendixu a jeho buňky implantované v dutině břišní. Průběh onemocnění je sice indolentní, ale progresivní a neléčený vede ke smrti. Optimální léčbu pseudomyxomu peritonea představuje maximálně agresivní cytoredukční chirurgická léčba v kombinaci s hypertermickou intraperitoneální chemoterapií, která může mít kurativní potenciál.
Klíčová slova:
pseudomyxom peritonea – cystadenom apendixu – cytoredukce – HIPECPopis případu
Poslední pracovní den před Vánoci přišel do naší ambulance pacient, který byl odeslán praktickým lékařem k diagnostické punkci ascitu. Muž, 44 let, atletické postavy se dosud s ničím neléčil, byl nekuřák a abstinent. Udával bolesti břicha v epigastriu a kolem pupku v posledních 3 měsících, bolesti byly zejména na pohmat, při zatnutí břišních svalů potíže neměl. Základní biochemické parametry a krevní obraz byly normální, hmotnost měl stabilní. Sonograficky byl popsán nehomogenní hypoechogenní obsah v dutině břišní s maximem v epigastriu, také mezi střevními kličkami a dále normální játra se třemi ložisky charakteru hemangiomů. Na následném CT byl nález popsán jako „…výrazný septovaný ascites vyplňující celou dutinu břišní. Postkontrastně dochází k sycení sept i rozšířeného parietálního peritonea. V diferenciální diagnostice karcinomatóza, zánětlivé změny, hemoperitoneum po ruptuře hemangiomu…“ (obr. 1). Sonografický nález (obr. 2) při vyšetření pacienta na našem pracovišti se nejevil jako nález vhodný k punkci. Bylo naplánováno kontrolní CT za měsíc, nález se za tu dobu nezměnil. Byla vyslovena suspekce na pseudomyxom paritonea (PMP) a pacient byl odeslán na specializované pracoviště – Chirurgickou kliniku Nemocnice Na Bulovce.
Obr. 1. První CT vyšetření s nálezem galatinózních hmot vyplňujících dutinu břišní. Fig. 1. First abdominal CT scan showing the abdominal cavity filled with mucoid fluid. 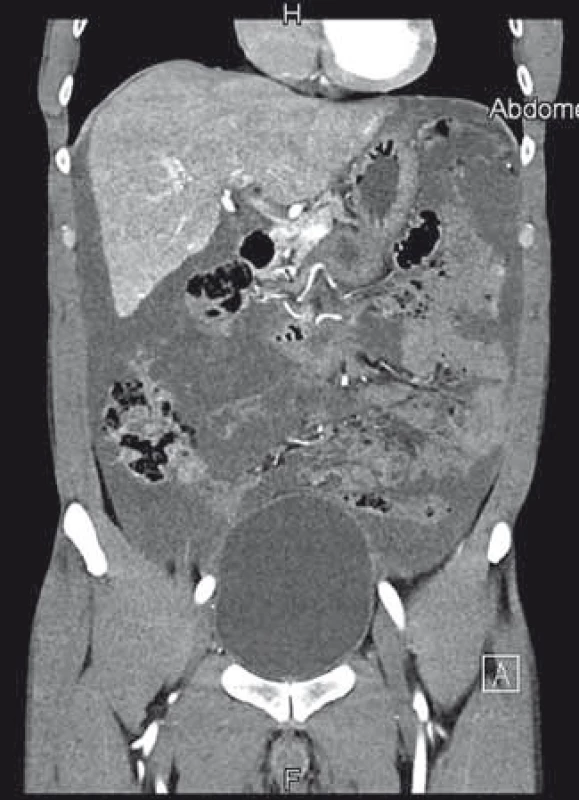
Obr. 2. Sonografické vyšetření břicha v době diagnózy – A. příčný řez epigastriem; B. hmoty pseudomyxomu peritonea (PMP) mezi pravou ledvinou (RK) a pravým jaterním lalokem (RLL); C. RLL. PB – tělo pankreatu, HA – hemangiom, GB – žlučník Fig. 2. Abdominal ultrasound at the time of diagnosis – A. transverse section; B. mucinous material of pseudomyxoma peritonei (PMP) between the right kidney (RK) and the right liver lobe (RLL); C. RLL. PB – pancreas body, HA – hemangioma, GB – gallbladder 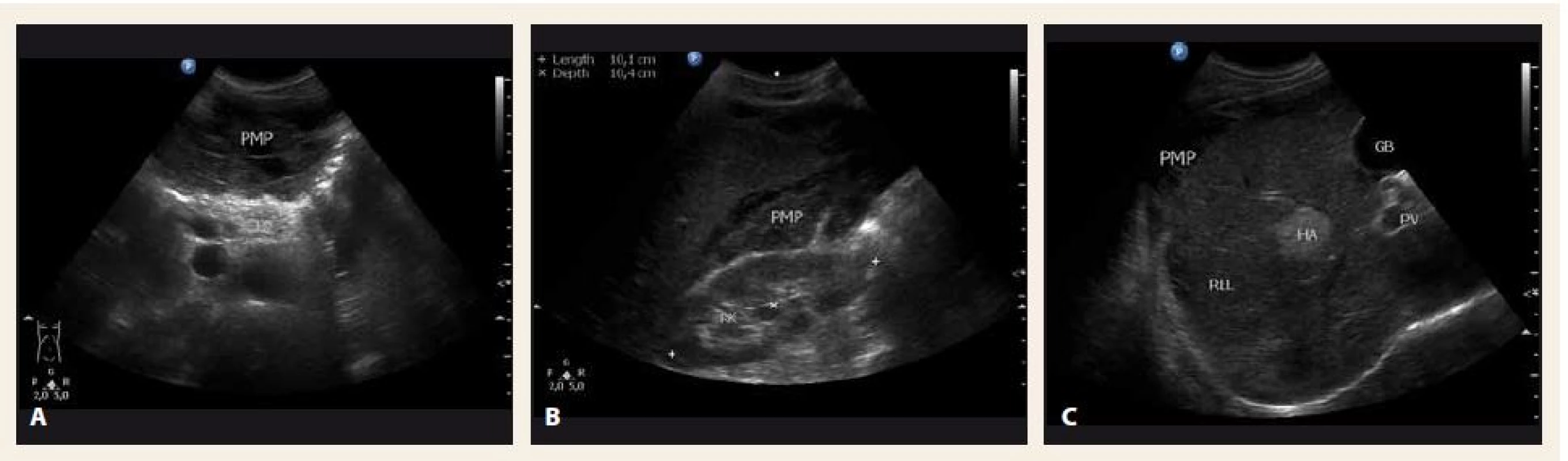
Diagnóza PMP byla potvrzena a pacient byl indikován k chirurgickému řešení. To spočívalo v přední a oboustranné laterální peritonektomii, omentektomii, apendektomii, splenektomii, debulkingu a hypertermické intraperitoneální chemoterapii (HIPEC), konkrétně HIPEC 90 min s použitím Mytomycine C 30 mg a EPIC (early postoperative intraperitoneal chemotherapy) 5 dní po operaci – aplikace 5-fluorouracylu. Chirurgický výkon trval 9 hod, pacient se po něm ale rychle zotavil. Na kontrolním CT za 6 měsíců byla popsána téměř úplná regrese patologického obsahu v dutině břišní (obr. 3), následná kontrola je za dalších 6 měsíců.
Obr. 3. CT břicha 6 měsíců po léčbě, kde je patrná prakticky kompletní regrese. Fig. 3. Abdominal CT 6 months after treatment with almost complete regression. 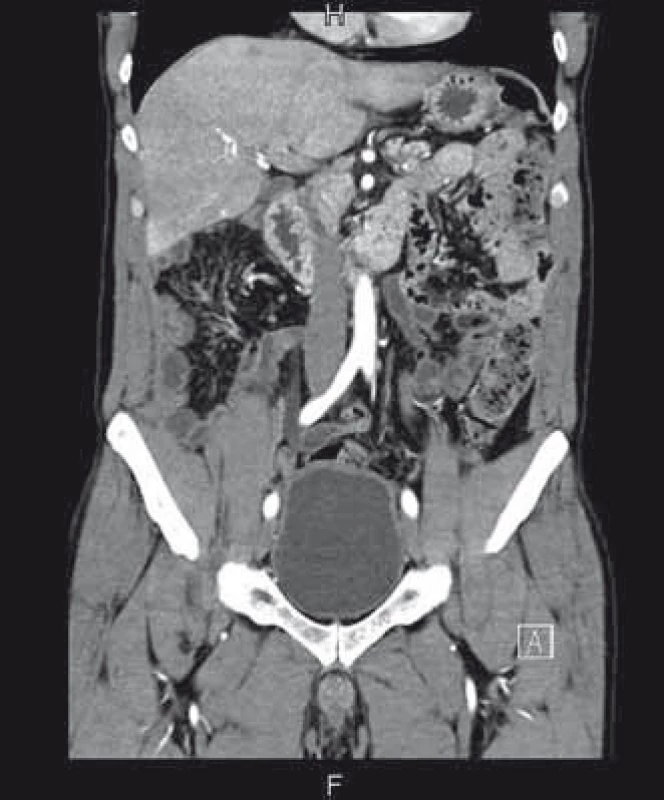
Pseudomyxom peritonea
PMP představuje vzácný klinický syndrom, kdy je dutina břišní vyplněna gelatinózními hmotami a přítomností mucinózních implantátů na peritoneu. Zdrojem je cystadenom apendixu, který svým růstem obturuje lumen. V apendixu se akumuluje mucin, což nakonec vede k jeho ruptuře. Na peritoneu se následně uchytí buňky produkující mucin, které proliferují a zaplňují dutinu břišní tímto gelatinózním obsahem [1]. Tento stav nakonec vede ke střevní obstrukci a neléčený končí smrtí. Označení PMP by mělo být omezeno na histologicky benigní peritoneální tumory, které jsou často asociovány s mucinózním adenomem apendixu – nyní bývají také označovány jako diseminovaná peritoneální adenomucinóza (DPAM) [2].
PMP je častější u žen, incidentálně bývá nacházen u 2 pacientek na 10 000 laparotomií [3]. Nejčastějším symptomem bývá u obou pohlaví zvětšování obvodu pasu, u mužů je druhým nejčastějším příznakem inguinální hernie přítomná u 25 % případů, u žen to je hmatná ovariální masa při rutinním vaginálním vyšetření [1].
CT je v literatuře uváděna jako metoda volby u pacientů s PMP [4]. Diagnostickým znakem PMP je lemování (scalloping) kontur jater a jiných abdominálních orgánů. Je patrná i dislokace střevních kliček centrálním směrem tlakem mucinózních hmot. Ložiska na CT dosahují nativně nízké denzity (5–20 HU), postkontrastně se minimálně sytí a mohou obsahovat kalcifikace [5]. Distribuce ložisek je v oblasti pravého subfrenického a retrohepatálního prostoru, velkého omenta, parakolicky a v malé pánvi [6]. Ultrazvuk zobrazí septovaný ascites a echogenní nepohyblivé peritoneální masy [7]. V diferenciální diagnostice PMP se uvádí peritonitida, karcinomatóza peritonea bez mucinózního ascitu a peritoneální sarkomatóza.
Optimální léčbou symptomatických pacientů s PMP/DPAM je agresivní chirurgická cytoredukce [2] s následným podáním HIPEC formou laváže (obr. 4). Cílem léčby je odstranit maximum postižených tkání, a omezit tak tvorbu mukózních hmot. Následné intraperitoneální podání chemoterapie (nejčastěji mitomycin C, cisplatina, oxaliplatina, gemcitabin, doxorubicin) umožňuje několikanásobný nárůst koncentrace cytostatika v dutině břišní ve srovnání se systémovým podáním. Význam hypertermie je dvojí. Jednak samotná vyšší teplota (41,5–43 °C) vede k destrukci nádorových buněk, dále také zlepšuje průnik cytostatik do nádorových buněk. I tak je penetrace do nádorové tkáně omezena do hloubky max. 2 mm, na větší rezidua tumoru HIPEC neúčinkuje [8,9]. Rekurence choroby vyžaduje opakované čím dál obtížnější chirurgické výkony kvůli adhezím a fibrotizaci tkání.
Obr. 4. Peritoneální laváž systémem HIPEC. Fig. 4. Peritoneal lavage with HIPEC system. 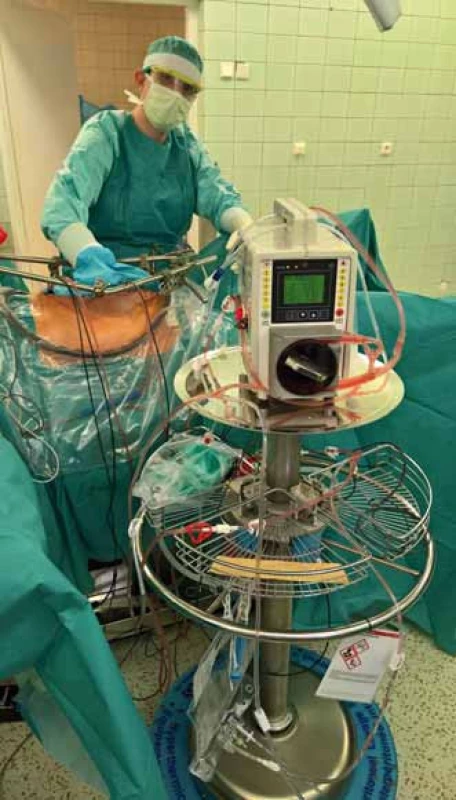
Tento postup má na specializovaných pracovištích dobré výsledky. Pětileté přežití pacientů s DPAM po cytoredukční chirurgické léčbě s intraperitoneální chemoterapií dosahovalo 81 %, u pacientů s peritoneální mucinózní karcinomatózou to bylo jen 59 % a 78 % u pacientů s přechodnými znaky [10]. Data z registru 2 298 pacientů, kteří podstoupili chirurgickou cytoredukci a HIPEC, zahrnující 1 419 pacientů s DPAM udávají 5-a 10leté přežití 81 a 70 % [10]. Tato metoda byla v ČR zavedena v 90. letech minulého století prof. Antošem v Nemocnici Na Bulovce, kde bylo tímto způsobem ošetřeno již více než 50 pacientů s PMP.
Diskuze
Popisujeme kazuistiku vzácného PMP, který byl zpočátku považován za ascites. Díky pro ascites netypickému sonografickému nálezu byl pacient ušetřen pokusu o punkci. Po přehodnocení nálezů zobrazovacích metod byl odeslán na pracoviště s odpovídající erudicí a vybavením. Podstoupil agresivní chirurgickou cytoredukční léčbu spolu s HIPEC, která může mít u těchto pacientů kurativní potenciál. V případě recidivy onemocnění by byla dalším krokem opět chirurgická cytoredukce spolu s HIPEC. Přežití pacientů s PMP je dle literárních údajů kolem 80 % po 5 letech a kolem 70 % po 10 letech. Neléčené onemocnění je fatální.
Tato práce byla podpořena grantem KNL VR170307.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 26. 3. 2018
Přijato: 28. 3. 2018
MUDr. Karel Dvořák, Ph.D.
Oddělení gastroenterologie a hepatologie
Krajská nemocnice Liberec, a. s.
Nemocnice Liberec
Husova 357/10
460 63 Liberec
Zdroje
1. Sugarbaker PH, Ronnett BM, Archer A et al. Pseudomyxoma peritonei syndrome. Adv Surg 1996; 30 : 233–280.
2. Ronnett BM, Zahn CM, Kurman RJ et al. Disseminated peritoneal adenomucinosis and peritoneal mucinous carcinomatosis. A clinicopathologic analysis of 109 cases with emphasis on distinguishing pathologic features, site of origin, prognosis, and relationship to „pseudomyxoma peritonei“. Am J Surg Pathol 1995; 19 (12): 1390–1408.
3. Hinson FL, Ambrose NS. Pseudomyxoma peritonei. Br J Surg 1998; 85 (10): 1332–1339.
4. Yalcin S, Ergül E, Korukluoglu B et al. Pseudomyxoma peritonei: what do we have? Int J Surg 2007; 15 (1): 1–9.
5. Psár R, Kala Z, Krátký J. Diferenciální diagnostika peritoneálních cystických lézí se zřetelem na pseudomyxom peritonea a echinokokovou cystu. Ces Radiol 2017; 71 (1): 74–78.
6. Levy D, Shaw J, Sobin L. Secondary tumors and tumorlike lesions of the peritoneal cavity: imaging features with pathologic correlation. Radiographics 2009; 29 : 347–373. doi: 10.1148/rg.292085189.
7. Hanbidge AE, Lynch D, Wilson SR. US of the peritoneum. Radiographics 2003; 23 (3): 663–684. doi: 10.1148/rg.233025712.
8. Los G, Verdegaal EM, Mutsaers PH et al. Penetration of carboplatin and cisplatin into rat peritoneal tumor nodules after intraperitoneal chemotherapy. Cancer Chemother Pharmacol 1991; 28 (3): 159–165.
9. Sugarbaker PH. Managing the peritoneal surface component of gastrointestinal cancer. Part 1. Patterns of dissemination and treatment options. Oncology (Williston Park) 2004; 18 (1): 51–59.
10. Chua TC, Moran BJ, Sugarbaker PH et al. Early-and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol 2012; 30 (20): 2449–2456. doi: 10.1200/JCO.2011.39. 7166.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2018 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Primární biliární cholangitida – doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu
- Neobvyklá příčina zvětšování břicha
- Infekce jaterní cysty při polycystóze jater jako zdroj sepse
- Terlipresin – stále nepostradatelný ve dvou indikacích
- Akutní poškození ledvin u pacientů s akutní pankreatitidou
- Léčba komplikované Crohnovy choroby vedolizumabem
- Kombinace endoskopické slizniční resekce a „full-thickness“ resekce v léčbě adenomu ascendens s příznakem „non-liftingu“
- Gastrointestinálne prejavy familiárnej stredomorskej horúčky – problém aj v strednej Európe?
- Populární sleeve gastrectomy – tubulizace žaludku v chirurgické léčbě těžké obezity a cukrovky 2. typu
- Životní jubileum prof. Zdeňka Marečka
- Pohľad na XXIII. Gastrofórum, Štrbské Pleso, 2018
- 6th Conference of Central European Hepatologic Col laboration
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: hepatologie
- Esomeprazol – S-izomer omeprazolu s výhodnějšími farmakologickými vlastnostmi a silnějším farmakodynamickým účinkem
- Hepatologie
- „Distální“ ulcerózní kolitida u seniora – jaký terapeutický postup zvolit?
- Hepatocelulárny karcinóm na strednom Slovensku – analýza kohorty 207 pacientov v nemocnici 3. stupňa
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Terlipresin – stále nepostradatelný ve dvou indikacích
- Primární biliární cholangitida – doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu
- Infekce jaterní cysty při polycystóze jater jako zdroj sepse
- Neobvyklá příčina zvětšování břicha
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



