-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hepatorenálny syndróm u pacientov s akútnou alkoholovou hepatitídou
Hepatorenal syndrome in patients with acute alcoholic hepatitis
Hepatorenal syndrome is functional kidney failure in patients with portal hypertension and ascites.
Patients:
20 patients (13 men, 7 women) with acute alcoholic hepatitis and hepatorenal syndrome type 1 were hospitalised at the Intensive Care Unit, 1st Dept. of Internal Medicine, University Hospital in Košice. All patients were treated with continual terlipressin infusion (1 mg daily, in case of low effect, dose increased to 2 mg daily) combined with albumin, mean treatment duration was 20.00 ± 11.69 days. Haemodialysis was indicated in 11 patients due to oligo-anuria with hyperhydratation, metabolic acidosis or hyperkalemia.Results:
A complete response to therapy (creatinine < 133 µmol/l) was seen in 6 patients (30%), a response to treatment (> 20% creatinine decrease) was observed in 18 patients (90%). Therapy led to an increase in natrium, diuresis and natriuresis and a decrease in serum creatinine and the Child-Pugh score. Hospital mortality was 40%. No pre-treatment parameter except for the grade of hepatic encephalopathy (serum creatinine, bilirubin and natrium, natriuresis, diuresis and Child-Pugh score) was associated with mortality, but patients who survived showed an improvement in liver functions after therapy (Child-Pugh score and bilirubin decrease).Conclusion:
Combined treatment with terlipressin and albumin improves renal functions in patients with acute alcoholic hepatitis and hepatorenal syndrome type 1, however, the survival of patients depends on an improvement in liver functions during the treatment.Key words:
hepatorenal syndrome – acute alcoholic hepatitis – terlipressin – albumin – renal functions – mortality
Autoři: P. Jarčuška 1; Ľ. Beňa 2; A. Timková 1; E. Veseliny 1; M. Janičko 1
Působiště autorů: I. interná klinika, LF UPJŠ a UN L. Pasteura Košice, Slovenská republika 1; Transplantcentrum, UN L. Pasteura Košice, Slovenská republika 2
Vyšlo v časopise: Gastroent Hepatol 2012; 66(2): 101-108
Kategorie: Hepatologie: původní práce
Souhrn
Hepatorenálny syndróm je funkčné zlyhanie obličiek u pacientov s portálnou hypertenziou a ascitom.
Súbor pacientov:
Na Jednotke intenzívnej starostlivosti I. internej kliniky Univerzitnej nemocnice v Košiciach bolo hospitalizovaných 20 pacientov (13 mužov, 7 žien) s akútnou alkoholovou hepatitídou a hepatorenálnym syndrómom 1. typu. Všetci pacienti boli liečení kontinuálnou infúziou terlipresínu (1 mg denne, pri neefektivite bola dávka zvýšená na 2 mg denne) v kombinácii s albumínom s priemerným trvaním liečby 20,00 ± 11,69 dňa. Hemodialýza bola indikovaná u 11 pacientov pre oligoanuriu s hyperhydratáciou, metabolickú acidózu alebo hyperkalémiu.Výsledky:
Kompletnú odpoveď na liečbu (sérový kreatinín < 133 µmol/l) 6 pacientov (30 %), odpoveď na liečbu (> 20 % pokles kreatinínu) dosiahlo 18 pacientov (90 %). Liečba viedla k zvýšeniu sérového sodíka, diurézy a natriurézy a k zníženiu sérového kreatinínu a k poklesu Child-Pughovej skóre. Nemocničná mortalita bola 40 %. Žiadny parameter pred liečbou, s výnimkou stupňa hepatálnej encefalopatie (sérový kreatinín, bilirubín, sodík, natriuréza, diuréza a Child-Pughovej skóre), nebol asociovaný s mortalitou, ale u pacientov, ktorí prežili, sme pozorovali zlepšenie hepatálnych funkcií po liečbe (pokles bilirubínu a Child-Pughovej skóre).Záver:
Kombinovaná liečba terlipresínom a albumínom zlepšuje obličkové funkcie u pacientov s hepatorenálnym syndrómom 1. typu, ale prežitie pacientov závisí od zlepšenia hepatálnych funkcií počas liečby.Kľúčové slová:
hepatorenálny syndróm – akútna alkoholová hepatitída – terlipresin – albumín – obličkové funkcie – mortalitaTabulky označené v textu w1-w8 naleznete na webových stránkách časopisu www.csgh.info.
Hepatorenálny syndróm (HRS) je funkčné zlyhanie obličiek spôsobené renálnou vazokonstrikciou v priamej príčinnej súvislosti s portálnou hypertenziou pri pokročilom ochorení pečene s ascitom. Funkčný pôvod hepatorenálneho syndrómu bol definitívne potvrdený štúdiou, ktorá ukázala, že oblička cirhotika s hepatorenálnym syndrómom získa normálnu funkciu po transplantácii pacientovi s chronickým renálnym zlyhaním a naopak, HRS je reverzibilný po transplantácii pečene [1].
Pri portálnej hypertenzii vzniká splanchnická vazodilatácia. Pri zníženom prietoku krvi obličkami dochádza k zvýšenej aktivite splanchnických vazokonstriktorov (renín-angiotenzín-aldosterónový systém, sympatikoadrenálny systém, endotelín 1 a 3 a iné), následkom čoho vzniká renálna vazokonstrikcia. Efekt týchto vazokonstrikčných pôsobkov sa neprejaví v splanchnickom riečisku, kde dochádza k fenoménu úniku (tzv. „escape“ fenoménu). V splanchnickom riečisku pretrváva vazodilatácia, v renálnom vazokonstrikcia, výsledkom je funkčné zlyhanie obličiek – obr. 1 [2].
Obr. 1. Splanchnické riečisko pri hepatorenálnom syndróme [8]. Fig. 1. Splanchnic bed with hepatorenal syndrome [8]. ![Splanchnické riečisko pri hepatorenálnom syndróme [8].
Fig. 1. Splanchnic bed with hepatorenal syndrome [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9736018530fb65d275f12961a2628ba5.png)
Vazokonstrikcia sa vyskytuje aj v mozgovej a hepatálnej cirkulácii, dôsledkom čoho môže byť hepatálna encefalopatia či progresia zlyhania pečene. Srdcový výdaj pri HRS môže byť znížený, normálny alebo zvýšený, vždy je však z hemodynamického hľadiska nedostatočný, pretože pacient má splanchnickú vazodilatáciu [3].
Arroyo et al v roku 1996 definovali diagnostické kritéria HRS [4]. Tieto sú uvedené v tab. 1. Na základe týchto kritérií možno HRS diagnostikovať už pri miernej retencii dusíkatých látok, čo umožní včasný terapeutický zásah. Tieto kritériá však majú zásadné nedostatky. Volumexpanzia fyziologickým roztokom sa nezdá byť optimálne zvolená, vzhľadom na možnosť prehľbenia retencie sodíka a vody. Najspornejším bodom tejto klasifikácie zostáva splnenie bodu „neprítomnosť baktériovej infekcie“, pretože je dobre známe, že mnohé baktériové infekcie môžu byť asociované so zvýraznením splanchnickej cirkulačnej dysfunkcie [5]. Navyše väčšina pacientov s HRS má niektorú z infekčných komplikácií, uvedený fakt je potvrdený aj v našom súbore, ktorý je publikovaný nižšie. Salerno et al v roku 2007 revidovali diagnostické kritériá hepatoreálneho syndrómu (tab. w1). Je potrebné poznamenať, že použitie albumínu v plazmaexpanzii pred určením diagnózy HRS je v našich podmienkach extrémne finančne náročné [6].
Tab. 1. Diagnostické kritériá hepatorenálneho syndrómu podľa „International Ascites Club“ [2]. Tab. 1. Diagnostic criteria of hepatorenal syndrome according to the International Ascites Club [2]. ![Diagnostické kritériá hepatorenálneho syndrómu podľa „International Ascites Club“ [2].
Tab. 1. Diagnostic criteria of hepatorenal syndrome according to the International Ascites Club [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8bb648550f014471a6aa35af583d33d8.png)
Podľa klinického priebehu sa priebeh HRS rozdeľuje na dva typy. Prvý typ je charakterizovaný progresívnou rapídnou redukciou obličkových funkcií, definovanou ako zdvojnásobenie počiatočných hladín kreatinínu v sére na hodnoty vyššie ako 220 μmol/l alebo 50% redukciu glomerulovej filtrácie na hodnoty nižšie ako 0,33 ml/s počas obdobia kratšieho ako 2 týždne. V patofyziológii hrá často významnú rolu popri popisovaných vazokonstrikčných mechanizmoch aj tzv. precipitujúci faktor, ktorý skokovo zhorší perfúziu obličiek (infekcia, krvácanie). Pri HRS 2. typu sa hodnota kreatinínu zvyšuje postupne a zriedkakedy presiahne 180 μmol/l [7].
Medzi precipitujúce faktory pre vývoj HRS patria akútna alkoholová hepatitída, infekčné komplikácie (hlavne spontánna baktériová peritonitída), krvácanie z hornej časti GITu, neadekvátna plazmaexpanzia po paracentéze, neadekvátna diuretická liečba [8]. Laboratórne a klinické nálezy, sociované s častejším vznikom HRS, sú uvedené v tab. w2 [9].
Súbor pacientov
Na jednotke intenzívnej starostlivosti 1. internej kliniky LF UPJŠ a UN L. Pasteura Košice hospitalizovali 20 pacientov (13 mužov a 7 žien) s diagnózou hepatorenálneho syndrómu 1. typu pri akútnej alkoholovej hepatitíde. Diagnóza hepatorenálneho syndrómu bola určená podľa kritérií Arroya et al v roku 1996 [4]. Priemerný vek pacientov bol 47,40 ± 14,64 roka. Závažnosť pečeňového ochorenia sme hodnotili podľa Child-Pughovej klasifikácie. Pri určení diagnózy hepatorenálneho syndrómu 1. typu boli 2 pacienti v štádiu Child-Pugh B a 18 pacientov v štádiu Child-Pugh C. Stupeň hepatálnej encefalopatie sme určili podľa mentálneho stavu, hodnoteného podľa West Haven kritérií. Všetkým pacientom sme cielene zisťovali výskyt infekčných komplikácií (bronchopneumónie, uroinfekcie, spontánnej baktériovej peritonitídy, spontánnej bakteriémie, kanylovej sepsy, kožných infekcií a event. iných infekčných komplikácií).
Všetci pacienti boli po určení diagnózy HRS 1. typu iniciálne liečení kontinuálnou 24-hodinovou infúziou terlipresínu v dávke 1 mg v 250 ml fyziologického roztoku. Pacienti dostávali denne infúziu 20 g albumínu. Po evakuačnej punkcii ascitu dostali pacienti navyše 4–6 g albumínu na liter evakuovaného ascitu. Pri neefektivite liečby bola dávka terlipresínu zvýšená na 2 mg denne. Priemerná dľžka podávania terlipresínu bola 20,00 ± 11,69 dňa.
Hemodialýza bola indikovaná pri oligúrii a súčasnej hyperhydratácii, pri progresii akútnej renálnej insuficiencie, napriek vyššie uvedenej liečbe a pri hodnotách draslíka v sére nad 6 mmol/l. Pri hypotenzii bola indikovaná vazoaktívna podpora kontinuálnou infúziou dopamínu. Umelá pľúcna ventilácia bola indikovaná po dohovore s anesteziológom, pri jej indikácii mali všetci pacienti globálnu respiračnú insuficienciu pri závažnej bronchopneumónii.
Pri štatistickom porovnaní súborov s merateľnými hodnotami sme vypočítali priemer a smerodajnú odchýlku. Potom sme hodnotili rozdiel medzi smerodajnými odchýlkami Fischerovým testom. V prípade, keď nebola zhoda v smerodajných odchýlkach medzi oboma súbormi, na zhodnotenie štatistickej významnosti rozdielov sme použili dvojvýberový Studentov t-test s nerovnosťou rozptylov. V prípade, keď bola zhoda v smerodajných odchýlkach medzi oboma súbormi, na zhodnotenie štatistickej významnosti rozdielov sme použili dvojvýberový Studentov t-test s rovnosťou rozptylov. Relatívne početnosti boli porovnávané χ2-testom zhody rozdelení. Pre hodnotenie efektu liečby na kvantitatívne parametre sme použili Wilcoxonov test.
Výsledky
U 6 pacientov došlo po liečbe terlipresínom a albumínom k normalizácii hodnoty sérového kreatinínu (30 %), u ďalších 12 pacientov došlo po liečbe k poklesu hladiny sérového kreatinínu aspoň o 20 % v porovnaní s hodnotami pred liečbou. Dvaja pacienti (10 %) boli nonresponderi na liečbu terlipresínom a albumínom.
V tab. 2 sú uvedené priemerné hodnoty sérového kreatinínu, diurézy, sodíka v sére, natriurézy, bilirubínu a Child-Pughovej skóre pred liečbou hepatorenálneho syndrómu a pri jej ukončení. Po liečbe hepatorenálneho syndrómu došlo k singifikantnému zlepšeniu všetkých sledovaných parametrov okrem Child-Pughovej skóre.
Tab. 2. Vybrané parametre pacientov s akútnou alkoholovú hepatitídou a HRS 1. typu pred liečbou a po liečbe. Tab. 2. Selected pre- and post-treatment parameters in patients with acute alcoholic hepatitis and Type 1 HRS. 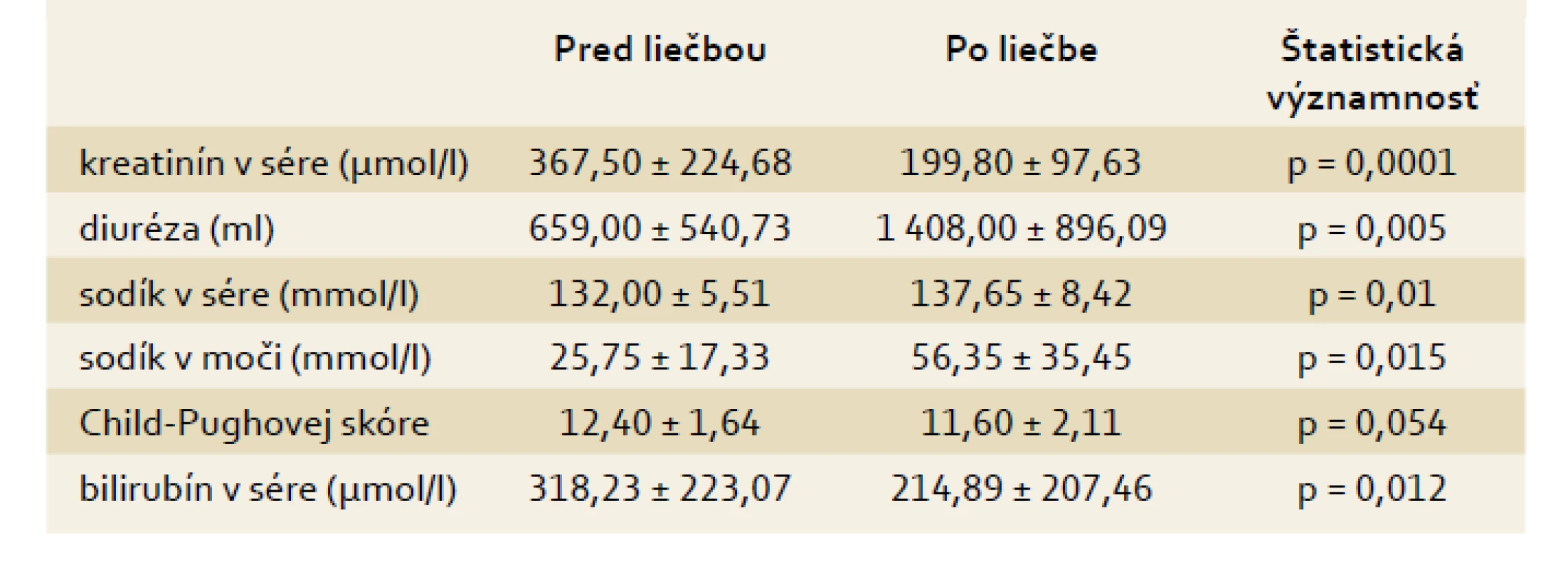
U pacientov s akútnou alkoholovou hepatitídou a HRS 1. typu sa počas hospitalizácie vyskytlo 2,65 ± 1,09 infekčných komplikácií. V tab. w3 sú uvedené infekčné komplikácie pri akútnej alkoholovej hepatitíde s hepatorenálnym syndrómom 1. typu. Okrem infekčných komplikácií uvedených v tab. 1 pacient mal herpes simplex, 1 pacient mal spontánnu bakteriémiu, 1 pacient akútnu cholecystitídu, 1 pacient akútnu pankreatitídu diagnostikovanú súčasne s HRS pri prijatí, 1 pacient inflamáciu bronchiektázií a 1 pacient infikované dekubity.
V tab. 3 sú uvedení pacienti, ktorí vyžadovali hemodialýzu, vazoaktívnu podporu dopamínom, liečbu hepatálnej encefalopatie a umelú pľúcnu ventiláciu v obidvoch skupinách počas liečby HRS. Priemerný počet hemodialýz na 1 pacienta bol 4,25 ± 11,69. Priemerný stupeň hepatálnej encefalopatie bol 2,25 ± 1,45. Šiesti pacienti mali IV. stupeň hepatálnej encefalopatie, traja pacienti III. stupeň hepatálnej encefalopatie, traja pacienti II. stupeň hepatálnej encefalopatie a šiesti pacienti I. stupeň hepatálnej encefalopatie. 7 pacienti zomreli počas liečby hepatorenálneho syndrómu terlipresínom a albumínom, 1 pacient zomrel po ukončení liečby hepatorenálneho syndrómu (pokles hladiny kreatinínu po liečbe viac ako 20), celková nemocničná mortalita pacientov s akútnou alkoholovou hepatitídou a HRS 1. typu bola 40 %.
Tab. 3. Ďalšia liečba pacientov s akútnou alkoholovou hepatitídou s HRS. Tab. 3. Further treatment of patients with acute alcoholic hepatitis and HRS. 
S cieľom určiť nezávislé faktory mortality sme pacientov s akútnou alkoholovou hepatitídou a HRS 1. typu, ktorých sme liečili vyššie uvedenou schémou liečby, rozdelili do 2 skupín. V prvej skupine boli pacienti, ktorí napriek liečbe HRS v nemocnici zomreli. V druhej skupine sú pacienti, ktorí boli prepustení v zlepšenom stave do ambulantnej starostlivosti (12 pacientov). V tab. 4 je porovnanie veku, dľžky podávania terlipresínu, počtu hemodialýz, počtu infekčných komplikácií a priemerného maximálneho stupňa hepatálnej encefalopatie v priebehu liečby HRS medzi oboma skupinami. Pacienti, ktorí zomreli, mali signifikantne vyšší počet infekčných komplikácií a signifikantne vyšší stupeň hepatálnej encefalopatie v porovnaní s pacientmi, ktorí prežili. V tab. w4 je porovnanie sérového kreatinínu, diurézy, sodíka v sére, natriurézy, bilirubínu v sére a Child-Pughovej skóre medzi oboma skupinami pred liečbou hepatorenálneho syndrómu, v tab. 5 sú tie isté parametre porovnané pri ukončení liečby hepatorenálneho syndrómu. Pred začatím liečby neboli medzi oboma skupinami signifikantné rozdiely, avšak pri ukončení liečby mali pacienti, ktorí počas hospitalizácie zomreli, signifikantne vyššie hodnoty kreatinínu v sére, bilirubínu v sére a Child-Pughovej skóre v porovnaní s pacientmi, ktorí prežili. V tab. w5 je porovnanie sérového kreatinínu, diurézy, sodíka v sére, natriurézy, bilirubínu v sére a Child-Pughovej skóre u pacientov s akútnou alkoholovou hepatitídou, ktorí zomreli počas hospitalizácie pred začatím liečby hepatorenálneho syndrómu a pri jej ukončení, v tab. 6 sú porovnané tie isté parametre v skupine pacientov s akútnou alkoholovou hepatitídou, ktorí prežili pred začatím liečby hepatorenálneho syndrómu a pri jej ukončení. U pacientov, ktorí zomreli, nedošlo pri ukončení liečby k signfikantnému zlepšeniu renálnych parametrov ani hepatálneho nálezu (bilirubín a Child-Pughovej skóre), u pacientov, ktorí prežili, sa signifikantne zlepšili všetky parametre, okrem hladín sodíka v sére. V tab. w6 je porovnaný počet pacientov s úplnou normalizáciou kreatinínu v sére, so znížením hodnôt kreatinínu v sére aspoň o 20 %, so zvýšením diurézy aspoň o 20 %, so zvýšením sodíka v sére, so zvýšením natriurézy, s poklesom sérového bilirubínu, so zhoršením alebo zlepšením Child-Pughovej skóre medzi oboma skupinami pacientov pri ukončení liečby HRS. U žiadneho pacienta, ktorý zomrel, nedošlo k úplnej normalizácii sérového kreatinínu, naopak v skupine pacientov, ktorí prežili, nemal nikto zistené zhoršenie Child-Pughovej skóre, tieto rozdiely sú signifikantné. V tab. w7 sú hodnotené infekčné komplikácie medzi oboma skupinami pacientov. Napriek tomu, že pacienti ktorí zomreli, mali signifikantne vyšší počet infekčných komplikácií v porovnaní s pacientmi, ktorí prežili, pri hodnotení frekvencie výskytu jednotlivých druhov infekčných komplikácií počas liečby HRS neboli zistené signifikantné rozdiely medzi jednotlivými skupinami. V tab. w8 sú porovnaní pacienti, ktorí vyžadovali hemodialýzu, vazoaktívnu podporu dopamínom, liečbu hepatálnej encefalopatie a umelú pľúcnu ventiláciu v obidvoch skupinách počas liečby HRS. V skupine pacientov, ktorí zomreli, sme zistili signifikantne vyšší počet pacientov, ktorí dostávali vazoaktívnu podporu dopamínom alebo boli liečení umelou pľúcnou ventiláciou, v porovnaní so skupinou pacientov, ktorí prežili.
Tab. 4. Charakteristika súboru pacientov s akútnou alkoholovu hepatitídou a HRS 1. typu vo vzťahu k mortalite. Tab. 4. Characteristics of a cohort of patients with acute alcoholic hepatitis and Type 1 HRS in relation to mortality. 
Tab. 5. Vybrané parametre pacientov s akútnou alkoholovou hepatitídou a HRS pri ukončení liečby HRS a ich vzťah k mortalite. Tab. 5. Selected parameters in patients with acute alcoholic hepatitis and HRS after HRS therapy and their relation to mortality. 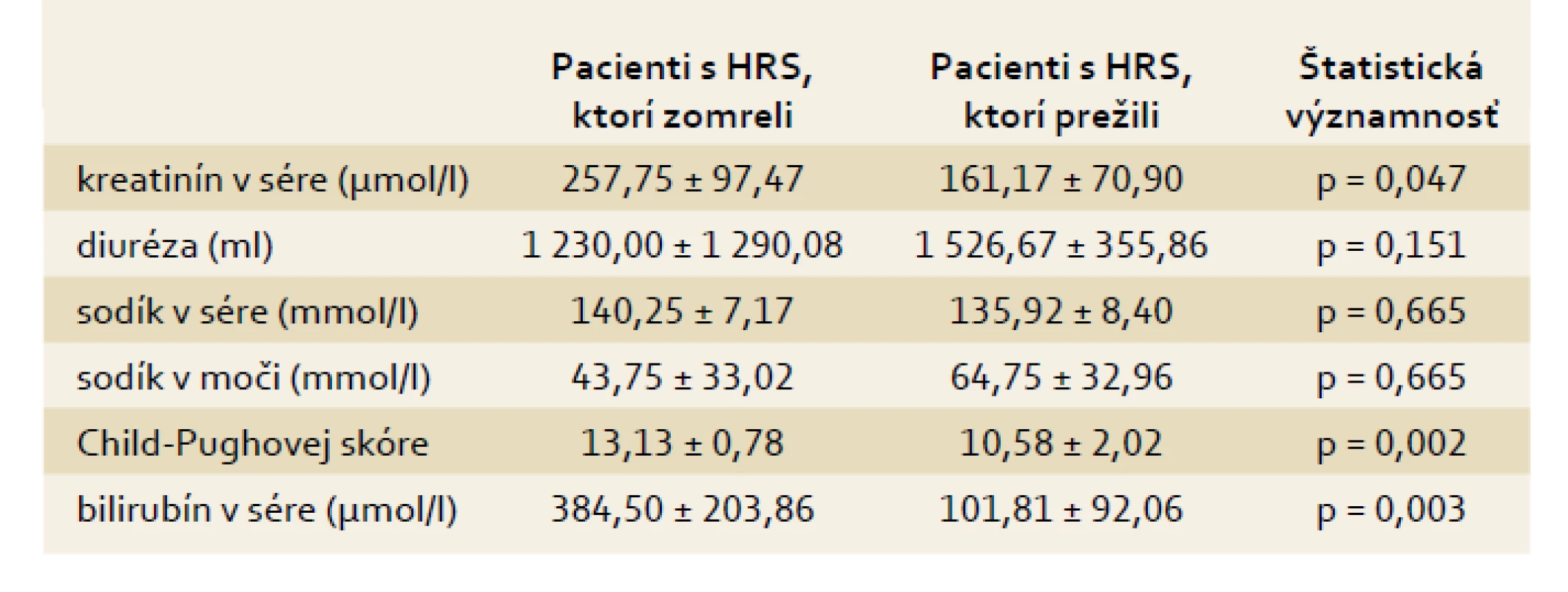
Tab. 6. Vybrané parametre pacientov s akútnou alkoholovou hepatitídou a HRS, ktorí prežili, pred liečbou a po liečbe HRS. Tab. 6. Selected parameters in patients with acute alcoholic hepatitis and HRS who survived, before and after HRS therapy. 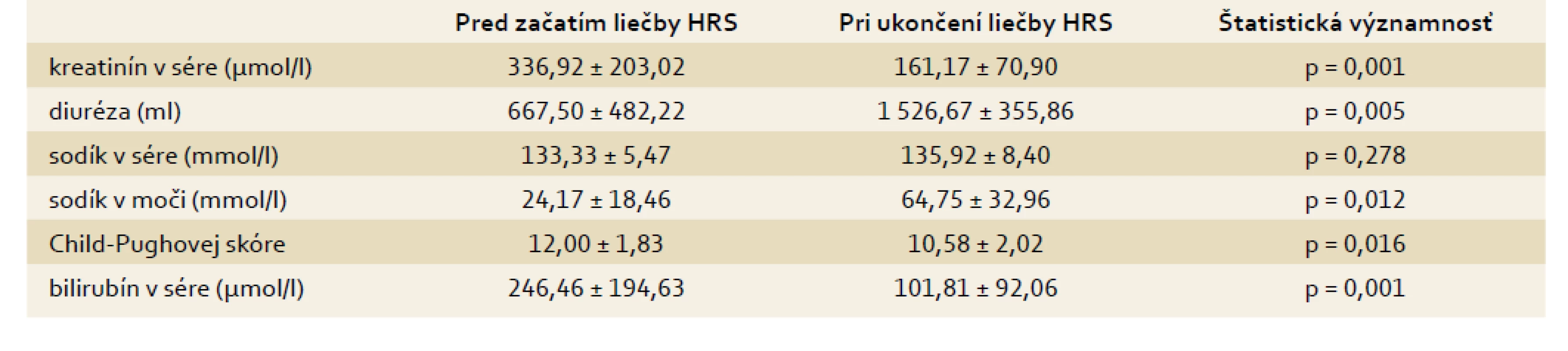
Diskusia
Alkoholová hepatitída je často komplikovaná vznikom HRS 1. typu. Liečba pentoxifylínom, ktorý je inhibítorom syntézy tumor necrosis faktora alfa, vedie u pacientov s akútnou alkoholovou hepatitídou približne k štvornásobnému zníženiu výskytu HRS, mortalita po 4 týždňoch hospitalizácie sa znížila z 46 na 25 % [10]. Pentoxifylín, v dávke 400 mg 3krát denne perorálne u pacientov s akútnou alkoholovou hepatitídou ťažkého stupňa v porovnaní s prednisolonom v dávke 40 mg denne počas 28 dní, znížil nielen trojmesačnú mortalitu pacientov (35,29 vs 14,71 %, p = 0,04), ale pri liečbe pentoxifylínom sa vôbec nevyskytol HRS 1. typu, avšak u pacientov liečených prednisolonom, ktorí zomreli v priebehu 3 mesiacov, bol výskyt HRS 1. typu 50 % [11]. Uvedené štúdie dokazujú, že liečba pentoxifylínom znižuje u pacientov s akútnou alkoholovou hepatitídou výskyt HRS 1. typu a zlepšuje prežívanie pacientov s touto diagnózou. U pacientov so spontánnou baktériovou peritonitídou môže podanie albumínu spolu s antibiotickou liečbou zabrániť vzniku HRS 1. typu. Sort et al v roku 1999 liečili 63 pacientov so spontánnou baktériovou peritonitídou cefotaximom v štandardných dávkach i.v., druhá skupina (63 pacientov) okrem cefotaximu dostala v prvý deň antibiotickej liečby albumín v dávke 1,5 g/kg hmotnosti a v tretí deň albumín v dávke 1 g/kg hmotnosti i.v. K vyliečeniu infekcie došlo u 94 % pacientov liečených cefotaximom a 98 % pacientov liečených cefotaximom a albumínom (NS). Autori zistili zhoršenie renálnych funkcií u 21 pacientov liečených cefotaximom (33 %) a 6 pacientov liečených cefotaximom a albumínom (10 %) (p = 0,002). Pacienti liečení cefotaximom mali po ukončení liečby vyššie hodnoty plazmatickej renínovej aktivity v porovnaní s pacientmi liečenými cefotaximom a albumínom. Počas hospitalizácie zomrelo 18 pacientov liečených cefotaximom (29 %) a iba 6 pacientov liečených cefotaximom a albumínom (10 %) (p = 0,01). Trojmesačná mortalita bola v skupine pacientov liečených cefotaximom 41 %, v skupine pacientov liečených cefotaximom a albumínom iba 22 % (p = 0,03). Hoci pridanie albumínu k antibiotickej liečbe u cirhotikov so spontánnou baktériovou peritonitídou je finančne nákladnou záležitosťou, môže viesť k redukcii vzniku HRS 1. typu a k zníženiu mortality pacientov [12].
Na diagnózu HRS je potrebné myslieť u pacientov s cirhózou pečene a precipitujúcimi faktormi, ktoré boli popísané vyššie. V diferenciálnej diagnostike musíme uvažovať o iných ochorenia obličiek, ak pacient má proteinúriu, erytrocytúriu alebo abnormálny ultrazvukový nález obličiek. Vykonanie biopsie obličky je indikované veľmi zriedkavo, hlavne u pacientov, ktorí sú kandidáti na kombinovanú transplantáciu pečene a obličiek. Pacienti s HRS by mali byť starostlivo monitorovaní (bilancia príjmu tekutín, diuréza, artériový tlak, vitálne funkcie). Je potrebné monitorovať centrálny žilový tlak, aby sa zabránilo hyperhydratácii. Pacienti by mali ležať na jednotke intenzívnej alebo semiintenzívnej starostlivosti (A1). Po určení diagnózy HRS je potrebné odstrániť všetky precipitujúce faktory. Liečbu diuretikami je potrebné vysadiť pri určení diagnózy HRS. Neexistujú údaje, ktoré by potvrdzovali výhodnosť podávania furosemidu pri HRS 1. typu. Furosemid môže byť efektívny na zvýšenie diurézy u hyperhydratovaných pacientov. Spironolaktón je kontraindikovaný, pretože je vysoké riziko život ohrozujúcej hyperkalémie (A1). Aktívne pátrať po infekcii kultivačným vyšetrením krvi, moču a ascitu, infekciu okamžite liečiť. Pacienti, ktorí nemajú znaky infekcie, by mali pokračovať v profylaktickom užívaní antibiotík (C1) [13].
Neliečený HRS 1. typu má 90 % mortalitu v priebehu 10 týždňov, väčšinou v priebehu prvého mesiaca od určenia diagnózy [9]. V liečbe HRS sú používané splanchnické vazokonstriktory spolu s albumínom alebo TIPS [3]. Ortega et al v roku 2002 liečili 21 za sebou idúcich pacientov s HRS (16 pacientov s HRS 1. typu, 5 pacientov s HRS 2. typu) terlipresínom v dávke 0,5–2 mg každé 4 hod až do poklesu hodnoty kreatinínu pod 133 µmol/l alebo do 15 dní. 13 pacientov dostalo albumín v dávke 1 g/kg hmotnosti v prvý deň a 20–40 g denne v nasledujúce dni. Kreatinín po liečbe poklesol u pacientov liečených terlipresínom a albumínom z 310 ± 44 na 133 ± 9 µmol/l, u pacientov, ktorí boli liečení monoterapiou terlipresínom, bol pokles kreatinínu iba minimálny (z 318 ± 53 na 301 ± 62 µmol/l). Kompletnú odpoveď na liečbu (pokles kreatinínu pod 133 µmol/l ) dosiahlo 77 % pacientov liečených terlipresínom a albumínom a iba 25 % pacientov liečených monoterapiou albumínom [14]. V našom súbore pacientov s akútnou alkoholovou hepatitídou sme použili menšie dávky terlipresínu, ktorý bol podávaný kontinuálne a menšie dávky albumínu, kompletnú odpoveď dosiahlo 30 % pacientov a u 90 % liečených pacientov došlo po liečbe k poklesu kreatinínu aspoň o 20 %. Liečba viedla k signifikantnému zvýšeniu diurézy a natriurézy a sodíka v sére a signifikantnému poklesu sérového kreatinínu.
Podľa doporučení EASL je terlipresín v bolusovej dávke 1 mg/4–6 hod v kombinácii s albumínom liekom voľby pri HRS 1. typu. Cieľom liečby je zlepšiť renálne funkcie, pri kompletnej odpovedi kreatinín poklesne pod 133 μmol/l. Ak kreatinín nepoklesne v priebehu 3 dní aspoň o 25 %, je potrebné postupne zvyšovať dávku terlipresínu až na maximálnu dávku 2 mg/4 hod. U pacientov s parciálnou odpoveďou (kreatinín v sére neklesne pod 133 μmol/l) a u pacientov, u ktorých nedôjde k poklesu kreatinínu v sére, je potrebné po 14 dňoch liečbu ukončiť. Kontraindikáciou liečby HRS terlipresínom je pokročilá ischemická choroba srdca, pacienti by mali mať monitorované arytmie, možnú prítomnosť splanchnickej alebo digitálnej ischémie či hyperhydratáciu, pri týchto príčinách je potrebné zvážiť modifikáciu alebo zastavenie liečby. Rekurencia HRS po vysadení liečby nie je častá, liečba terlipresínom by mala byť opakovaná a veľmi často je znova úspešná (A1) [13]. V našom súbore nedošlo k recidíve HRS u žiadneho pacienta. Dobrými prognostickými faktormi pre dosiahnutie kompletnej odpovede sú nízka hodnota bilirubínu a kreatinínu pred liečbou, vzostup stredného artériového tlaku o 5 torrov a pokles kreatinínu o 0,5 mg/dl na 3. deň liečby. Alternatívnymi vazokonstriktormi sú oktreotid a alfa adrenergní agonisti (norardenalín alebo midodrin). Oktreotid by mal byť podávaný v dávke 100 μg podkožne 3krát denne, podľa potreby možno dávku zdvojnásobiť. Výhodou použitia midodrinu je perorálne podávanie, iniciálna dávka by mala byť 7,5 mg 3krát denne, v prípade potreby možno zvýšiť dávku na 12,5 mg denne. Noradrenalín by mal byť podávaný v kontinuálnej infúzii v dávke 0,5–3 mg na hodinu až do dosiahnutia hodnoty sérového kreatinínu pod 133 μmol/l. So splanchnickými vazokonstriktormi by mal byť súčasne podávaný albumín v infúzii v dávke 1 g/kg hmotnosti v prvý deň a 20–40 g denne v nasledujúce dni [15]. Systematická analýza randomizovaných kontrolovaných štúdií ukázala, že liečba splanchnickými vazokonstriktormi (10 štúdií s terlipresínom, terlipresínom a albumínom, noradrenalínom a albumínom a okteotidom a albumínom) redukuje 15-dňovú mortalitu v porovnaní s neliečenými pacientmi alebo pacientmi liečenými albumínom [16].
Použitie transjugulárnej intrahepatálnej spojky (TIPS) u pacientov s HRS 1. typu môže zlepšiť glomerulovú filtráciu a znížiť aktivitu renín-angiotenzín-aldosterónového systému. Tento výkon však rutinne nie je vhodný pre pacientov s Child-Pughovej skóre viac ako 12 a hodnotou bilirubínu nad 86 μmol/l, teda pre väčšinu pacientov s HRS 1. typu. Zavedenie TIPS môže u pacientov HRS zlepšiť nielen renálne parametre, ale aj progresiu do HRS 1. typu [15].
Náhradná obličková liečba (najčastejšie hemodialýza) by mala byť použitá u pacientov, ktorí neodpovedajú na liečbu vazokonstriktormi a spľňajú kritériá pre túto liečbu. Existujú iba limitované údaje o arteficiálnych systémoch suportujúcich funkciu pečene, ďalšie štúdie sú potrebné (B1) [13]. Z nášho súboru sme z 20 pacientov museli dialyzovať 11 pacientov. Dialýza bola indikovaná pri hyperhydratácii a súčasnej oligoanúrii, pri progresii akútnej renálnej insuficiencie napriek liečbe terlipresínom a albumínom a pri hyperkalémii. Alternatívnou liečbou je aj albumínová dialýza, ktorá môže viesť k poklesu hladín bilirubínu, urey, kreatinínu, amoniaku, zlepšeniu stupňa hepatálnej encefalopatie a zvýšeniu hodnôt sodíka v sére a v moči aj hodnoty stredného artériového tlaku [17,18]. U pacientov s akútnou alkoholovou hepatitídou ťažkého stupňa a HRS 1. typu však iba jeden z piatich pacientov prežil 3 mesiace bez vykonania transplantácie pečene [19].
V súbore pacientov s HRS pri akútnej alkoholovej hepatitíde neboli pri začatí liečby HRS signifikantné rozdiely v diuréze, natriuréze, hladine sodíka v sére, v kreatiníne v sére, v bilirubíne v sére ani v Child-Pughovej skóre. Podľa vstupných laboratórnych parametrov pred liečbou v našom súbore pacientov nevieme predikovať mortalitu pacientov s HRS. Pri ukončení liečby nedošlo u pacientov, ktorí zomreli v nemocnici, k singifikantnému zlepšeniu hepatálnych ani renálnych parametrov. U troch zo siedmych pacientov došlo dokonca k zhoršeniu Child-Pughovej skóre. U pacientov, ktorí prežili došlo nielen k signifikantnému zlepšeniu renálnych parametrov (diuréza, nautriuréza, kreatinín), ale aj hepatálnych parametrov (bilirubín, Child-Pughovej skóre). Len v tejto skupine pacientov sme dosiahli kompletnú reverzibilitu hepatorenálneho syndrómu (u 50 % pacientov, ktorí prežili). Pacienti, ktorí v priebehu hospitalizácie zomreli, mali pri ukončení liečby nielen vyššie hodnoty kreatinínu, ale aj horší hepatálny nález (Child-Pughovej skóre, celkový bilirubín) v porovnaní s pacientmi, ktorí prežili. U pacientov, ktorí zomreli, bol vyšší výskyt infekčných komplikácií, vyšší stupeň hepatálnej encefalopatie, títo pacienti vyžadovali častejšie podanie dopamínu pre systémovú hypotenziu a častejšie potrebovali umelú pľúcnu ventiláciu pre respiračnú insuficienciu pri bronchopneumónii. Uvedené skutočnosti nás oprávňujú urobiť záver, že nie vstupné parametre pred liečbou HRS, ale dynamika hepatálneho nálezu v priebehu liečby má rozhodujúci vplyv na mortalitu pacientov s HRS 1. typu. U pacientov, ktorí zomreli, nedochádzalo k zlepšeniu hepatálneho nálezu, objavovali sa komplikácie a liečba terlipresínom a albumínom bola málo efektívna.
V období, keď ešte nebola známa efektívna liečba HRS, bola mortalita po transplantácii pečene v tejto skupine veľmi vysoká [20]. Restuccia et al v roku 2004 zisťovali, ako ovplyvní podanie analógov vazopresínu v predtransplantačnom období prognózu pacientov po transplantácii pečene. Transplantovaných bolo 9 pacientov (6 pacientov s HRS 1. typu, 3 pacienti s HRS 2. typu), ktorým bol v predtransplantačnom období liečený HRS analógmi vazopresínu, kontrolný súbor 27 pacientov bol vybraný podľa veku, pokročilosti ochorenia pečene a typu imunosupresie po transplantácii pečene, priemerná dľžka sledovania pacientov bola v skupine pacientov s HRS 1 137 dní, u kontrolnej skupiny 1 579 dní. Neboli zistené rozdiely vo výskyte akútnej renálnej insuficiencie po transplantácii pečene (22 % v skupine pacientov s HRS pred transplantáciou, 30 % v kontrolnej skupine), ťažších infekčných komplikácií (22 % v skupine pacientov s HRS pred transplantáciou pečene, 44 % v kontrolnej skupine), vo výskyte akútnej rejekcie (33 % v skupine pacientov s HRS pred transplantáciou, 41 % v kontrolnej skupine), dľžke pobytu na jednotke intenzívnej starostlivosti po transplantácii pečene (6 ± 1 deň v skupine pacientov s HRS pred transplantáciou, 8 ± 1 deň v kontrolnej skupine), v celkovej dľžke hospitalizácie po transplantácii pečene (27 ± 4 dňa v skupine pacientov s HRS pred transplantáciou, 31 ± 4 dňa v kontrolnej skupine) ani v počte podaných transfúzií (11 ± 3 transfúzií v skupine pacientov s HRS pred transplantáciou pečene, 10 ± 2 transfúzií v kontrolnej skupine pacientov). Trojročné prežitie bolo v skupine pacientov s HRS pred transplantáciou pečene 100 %, v kontrolnej skupine 85 % (p = 0,16). Na základe uvedenej štúdie možno povedať, že HRS pred transplantáciou pečene je potrebné vždy liečiť, pacienti s úspešne liečeným HRS majú po transplantácii pečene rovnakú prognózu ako pacienti, ktorí v predtransplantačnom období nemali HRS [21].
Transplantácia pečene je najlepšia liečba HRS 1. aj 2. typu (A1). Pacienti, ktorí odpovedajú na liečbu vazokonstriktormi, by mali byť liečení iba transplantáciou pečene. Pacienti, ktorí neodpovedali na liečbu a vyžadujú pred transplantáciou dialýzu, by mali byť liečení iba transplantáciou pečene, po ktorej sa upravia obličkové funkcie. Pacienti, ktorí vyžadujú prolongovanú náhradnú obličkovú liečbu (> 12 týždňov), by mali byť navrhnutí na kombinovanú transplantáciu pečene a obličiek (B2) [13].
Záver
HRS 1. typu je závažnou komplikáciou pacientov s akútnou alkoholovou hepatitídou. Liečba terlipresínom a albumínom je efektívna hlavne u pacientov, u ktorých dochádza počas liečby HRS k zlepšeniu hepatálneho nálezu. Kompletnú reverzibilitu HRS sme docielili iba u pacientov, ktorí prežili.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 25. 2. 2012
Přijato: 15. 3. 2012
doc. MUDr. Peter Jarčuška, PhD.
I. interná klinika LF UPJŠ a UN L. Pasteura
Trieda SNP 1, 040 11 Košice
petjarc@yahoo.com
Zdroje
1. Koppel MH, Coburn JW, Mims MM et al. Transplantation of cadaveric kidneys from patients with hepatorenal syndrome. Evidence for the functional nature of renal failure in advanced liver disease. N Engl J Med 1969; 289(25): 1367–1371.
2. Henriksen JH. Cirrhosis: ascites and hepatorenal syndrome. Recent advances in pathogenesis. J Hepatol 1995; 23 (Suppl 1): 25–30.
3. Salerno F, Gerbes A, Ginès P et al. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Postgrad Med J 2008; 84(998): 662–670.
4. Arroyo V, Ginès P, Gerbes AL et al. Definiton and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis. Hepatology 1996; 23(1): 164–176.
5. Epstein M, Goligorsky MS. Endothelin and nitric oxide in hepatorenal syndrome: a balance reset. J Nephrol 1997; 10(3): 120–135.
6. Salerno F, Gerbes A, Ginès P et al. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut 2007; 56(9): 1310–1318.
7. Lata J, Šenkyřík M. Hepatorenální syndrom. Interní Med pro Prax 2002; 4(1): 7–9.
8. Jarčuška P, Fraenkel E, Fehér J. Hepatorenalis szindróma. Orv Hetil 2005; 146(40): 2073–2081.
9. Ginès A, Escorell A, Ginès P et al. Incidence, predictive factors and prognosis of the hepatorenal syndrome in cirrhosis with ascites. Gastroenterology 1993; 105(1): 229–236.
10. Akriviadis E, Botla R, Briggs W et al. Pentoxyfylline improves short-term survival in severe acute alcoholic hepatitis: a double-blind, placebo-controlled trial. Gastroenterology 2000; 119(6): 1637–1648.
11. De BK, Gangopadhyay S, Dutta D et al. Pentoxifylline versus prednisolone for severe alcoholic hepatitis: a randomized controlled trial. World J Gastroenterol 2009; 15(13): 1613–1619.
12. Sort P, Navasa M, Arroyo V et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999; 341(6): 403–409.
13. European Association for the Study of the Liver. EASL clinical practical guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010; 53(3): 397–417.
14. Ortega R, Ginès P, Uriz J et al. Terlipressin therapy with and without albumin for patients with hepatorenal syndrome: results of prospective, nonrandomized study. Hepatology 2002; 36(4): 941–948.
15. Pereira G, Guevara M, Gines P. Management of hepatorenal syndrome. In: Gines P, Forns X, Abraldes JG et al (eds). Therapy in Liver Diseases. Barcelona: Elsevier Doyma 2010 : 227–234.
16. Gluud LL, Christensen K, Christensen E et al. Systematic review of randomised trials on vasoconstrictor drugs for hepatorenal syndrome. Hepatology 2010; 51(2): 576–584.
17. McIntyre CW, Fluck RJ, Freeman JG et al. Characterization of treatment dose delivered by albumin dialysis in the treatment of acute renal failure associated with severe hepatic dysfunction. Clin Nephrol 2002; 58(5): 376–383.
18. Mitzner SR, Klammt S, Peszynski P et al. Improvement of multiple organ functions in hepatorenal syndrome during albumin dialysis with the molecular adsorbent recirculating system. Ther Apher 2001; 5(5): 417–422.
19. Jalan R, Sen S, Steiner C et al. Extracorporeal liver support with molecular adsorbents recirculating system in patients with severe acute alcoholic hepatitis. J Hepatol 2003; 38(1): 24–31.
20. Lafayette RA, Paré G, Schmid CH et al. Pretransplant renal dysfunction predicts poorer outcome in liver transplantation. Clin Nephrol 1997; 48(3): 159–164.
21. Restuccia T, Ortega R, Guevara M et al. Effect of treatment of hepatorenal syndrome before transplantation on post transplantation outcome. A case-control study. J Hepatol 2004; 40(1): 140–146.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Dobré zprávyČlánek Správná odpověď na kvíz
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2012 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Hepatorenálny syndróm u pacientov s akútnou alkoholovou hepatitídou
- Správná odpověď na kvíz
- Graft vs host disease jako neobvyklá komplikace po transplantaci jater
- Liečba achalázie – súčasný prístup a vlastné skúsenosti
- Analýza těkavých plynů ve vydechovaném vzduchu u nemocných s idiopatickými střevními záněty
- Súčasný prístup k anémii u pacientov s nešpecifickými črevnými zápalmi
- Mezinárodní konsenzus ke sledování aktivity nemoci u pacientů s Crohnovou chorobou: Výsledky projektu IBD AHEAD 2011
- XVIst Hradec days of gastroenterology and hepatology
- Prof. Jiří Nevoral on the occasion of his 70th birthday
- 20 let členem výboru České gastroenterologické společnosti (ČGS)
- Esomeprazol – první inhibitor protonové pumpy „druhé“ generace
- Dobré zprávy
- Doporučený postup pro léčbu a diagnostiku hepatocelulárního karcinomu
- Histopatologická diagnóza hepatocelulárního karcinomu
- Nález v distálnom duodene, ktorý by nemal prekvapiť
- Rotorův syndrom podmiňuje porucha jaterního vychytávání konjugovaného bilirubinu
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hepatorenálny syndróm u pacientov s akútnou alkoholovou hepatitídou
- Súčasný prístup k anémii u pacientov s nešpecifickými črevnými zápalmi
- Liečba achalázie – súčasný prístup a vlastné skúsenosti
- Prof. Jiří Nevoral on the occasion of his 70th birthday
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



