-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam měření portosystémového tlakového gradientu (HVPG) u pacientů s cirhózou
Importance of portosystemic pressure gradient measurement (HVPG) in patients with liver cirrhosis
Liver cirrhosis is a serious disease shortening life expectancy. An unavoidable consequence of cirrhosis is portal hypertension, which usually limits the prognosis by its complications. Portal hypertension is a prognostic factor for cirrhosis decompensation, variceal bleeding and even mortality in cirrhotic patients. In the evaluation of portal hypertension, hepatic venous pressure gradient (HVPG) measurement is used. Measurement of HVPG is used in clinical praxis in the following situations: diagnosis of portal hypertension; evaluation of the prognosis of patients with cirrhosis; monitoring the treatment efficacy in the prevention of variceal bleeding; management of acute variceal bleeding. Decrease of HVPG under 12 mm Hg or at least by 20% from the initial value in the treatment with beta-blockers is associated with a lower risk of bleeding from varices or other complications. HVPG over 20 mm Hg is associated with a high risk of early rebleeding from esophageal varices and can influence decisions on early TIPS. HVPG measurement is an invasive, but simple, reproducible and safe catheterization technique with minimum complication rate. Broadly speaking, the most frequent complication is incorrect interpretation of obtained values. HVPG measurement should be a routine technique in centres specializing in the treatment of patients with liver diseases.
Key words:
cirrhosis – hepatic venous pressure gradient – variceal bleeding – portal hypertension
Autoři: R. Brůha; J. Petrtýl
Působiště autorů: IV. interní klinika – klinika gastroenterologie a hepatologie, VFN a 1. LF UK v Praze
Vyšlo v časopise: Gastroent Hepatol 2011; 65(3): 143-148
Kategorie: Hepatologie: přehledná práce
Souhrn
Jaterní cirhóza je závažným stavem, který výrazně zkracuje život nemocného. Prognóza je většinou limitována komplikacemi portální hypertenze, která je nevyhnutelným důsledkem jaterní cirhózy. Výše portální hypertenze je prognostickým faktorem dekompenzace cirhózy, krvácení z jícnových varixů i samotné mortality pacientů s cirhózou. V hodnocení portální hypertenze se používá metoda měření jaterního žilního tlakového gradientu (HVPG – Hepatic Venous Pressure Gradient). Měření HVPG se v klinické praxi využívá při: diagnostice portální hypertenze; zjištění prognózy pacientů s jaterní cirhózou, stanovení či změně léčebného postupu v prevenci krvácení z jícnových varixů a při stanovení postupu v léčbě akutního krvácení z varixů. Snížení HVPG pod 12 mm Hg či o 20 % oproti výchozí hodnotě při léčbě betablokátory významně sníží riziko krvácení z varixů i dalších komplikací portální hypertenze. Hodnota HVPG vyšší než 20 mm Hg je spojena s vysokým rizikem recidivy krvácení z jícnových varixů a může posloužit v rozhodování o časném TIPS. Měření HVPG je sice invazivní, ale jednoduchá, reprodukovatelná a poměrně bezpečná katetrizační metoda s minimem komplikací. Nejčastější komplikací v širším pojetí je nesprávná interpretace naměřených hodnot. Měření HVPG by mělo být rutinní metodou v centrech specializovaných na léčbu pacientů s jaterními chorobami.
Klíčová slova:
cirhóza – portosystémový tlakový gradient – krvácení z jícnových varixů – portální hypertenzeCirhóza jater vzniká postupným vývojem chronického jaterního onemocnění, jehož důsledkem je přestavba lobulární a vaskulární architektury v cirhotické uzly [1]. Nevyhnutelnou součástí jaterní cirhózy je přítomnost portální hypertenze, která je odpovědná za většinu život ohrožujících komplikací samotné cirhózy. Mezi tyto komplikace patří především vývoj jícnových a žaludečních varixů a krvácení z nich, ascites a hepatorenální syndrom [2].
Portální hypertenze je definována jako zvýšení tlakového rozdílu mezi portální žilou a systémovým žilním řečištěm. Portální hypertenzi lze přesně objektivizovat pouze invazivním měřením tlaku v portální žíle a v jaterní žíle. Přímé měření tlaku v portální žíle je však příliš invazivní a navíc neposkytuje informaci o skutečném tlakovém gradientu ve vztahu k systémovému žilnímu oběhu – absolutní hodnota krevního tlaku v portální žíle neříká nic o portální hypertenzi, pokud současně neznáme hodnotu tlaku v jaterní či dolní duté žíle. Například u pacienta s pravostranným srdečním městnáním může tlak v portální žíle dosahovat zdánlivě abnormálně vysokých hodnot, ale tlakový rozdíl bude normální vzhledem ke zvýšenému tlaku v pravé síni a velkých žilách.
Proto se k hodnocení výše portální hypertenze využívá metoda nepřímého měření přeneseného portálního tlaku při katetrizaci jaterních žil, která umožní i současné změření tlaku ve volné jaterní žíle. Metoda nepřímého měření přeneseného portálního tlaku prostřednictvím zaklínění katétru v periferii jaterní žíly byla poprvé popsána před 60 lety [3]. Teprve v posledním desetiletí se však tato metoda dostává do běžné klinické praxe. Touto metodou měříme tlak v jaterních sinusoidách, který jak u zdravých jater, tak u většiny pacientů s jaterními chorobami odpovídá tlaku v portální žíle. Pouze u nemocí spojených s presinusoidální portální hypertenzí (např. schistozomiáza, primární biliární cirhóza) je tlak v sinusoidách podstatně nižší než v portální žíle, a tím měření tlaku v zaklínění neodpovídá portálnímu tlaku. U většiny pacientů s jaterní cirhózou etylické či virové etiologie se však můžeme na nepřímé měření tlaku v portální žíle spolehnout [4].
Tlak ve volné jaterní žíle označujeme FHVP (Free Hepatic Venous Pressure – volný tlak v jaterní žíle) a tlak v zaklínění WHVP (Wedged Hepatic Venous Pressure – tlak v zaklínění jaterní žíly). Rozdíl těchto dvou hodnot označujeme jako HVPG (Hepatic Venous Pressure Gradient – tlakový gradient z jaterní žíly). U většiny pacientů s jaterní cirhózou odpovídá HVPG skutečnému tlakovému rozdílu mezi portální žilou a systémovým žilním řečištěm.
HVPG u zdravého člověka nepřesahuje 4–5 mm Hg, hodnoty přesahující tuto hranici odpovídají portální hypertenzi. Jícnové varixy se začínají tvořit při hodnotách HVPG kolem 10 mm Hg a tato hodnota také definuje přítomnost klinicky významné portální hypertenze [5]. Další mezní hodnotou HVPG je 12 mm Hg – riziko krvácení z jícnových varixů souvisí právě s touto hodnotou [6].
Metoda katetrizace jaterních žil je sice invazivní vyšetření, jeho komplikace jsou však poměrně malé. Nejrizikovějším místem je punkce centrální žíly (vena jugularis, subclavia či femoralis). V souvislosti s manipulací s katétrem v oblasti pravé síně se mohou objevit srdeční arytmie, ty se však téměř vždy upraví po vytažení či upravení polohy katétru. Nelze ani vyloučit alergickou reakci na podání kontrastní látky.
Základní podmínkou správného měření HVPG je dodržení standardního postupu [7]. Výkon se provádí pod skiaskopickou kontrolou u pacienta po nočním lačnění v poloze na zádech. Po punkci centrální žíly a implantaci zavaděče (obr. 1) zasuneme do žilního řečiště katétr, který zavedeme do jaterní žíly (pravé či střední) a změříme tlak ve volné jaterní žíle – FHVP (obr. 2). Ke změření WHVP (obr. 3) se často používala metoda se zaklíněním katétru v periferii jaterní žíly; lépe je však využít balonkový katétr, který v jaterní žíle nafoukneme tak, aby se kompletně uzavřela. Sinusoidální tlak tak měříme z větší oblasti než při pouhém „zaklínění“ v periferii a výsledek měření je spolehlivější [8]. Pozici v zaklínění lze ověřit aplikací malého množství kontrastní látky do katétru. Měření HVPG provádíme s pomocí tlakového snímače napojeného na monitorovací systém vybavený modulem pro vyšetření invazivního krevního tlaku. Snímač musí být kalibrován na hodnoty žilního krevního tlaku a kalibraci musíme provádět před každým měřením. Samotné odečítání hodnot tlaku (FHVP či WHVP) provádíme až po dostatečném ustálení křivky a opakujeme nejméně třikrát. Výsledná hodnota je aritmetickým průměrem naměřených hodnot. Křivku bychom měli zaznamenávat na papír.
Obr. 1. Zavaděč v oblasti horní duté žíly. Zahájení katetrizace jaterních žil punkcí jugulární žíly. Fig. 1. Introducer in the superior vena cava. Initial phase of hepatic vein catheterization – jugular vein puncture. 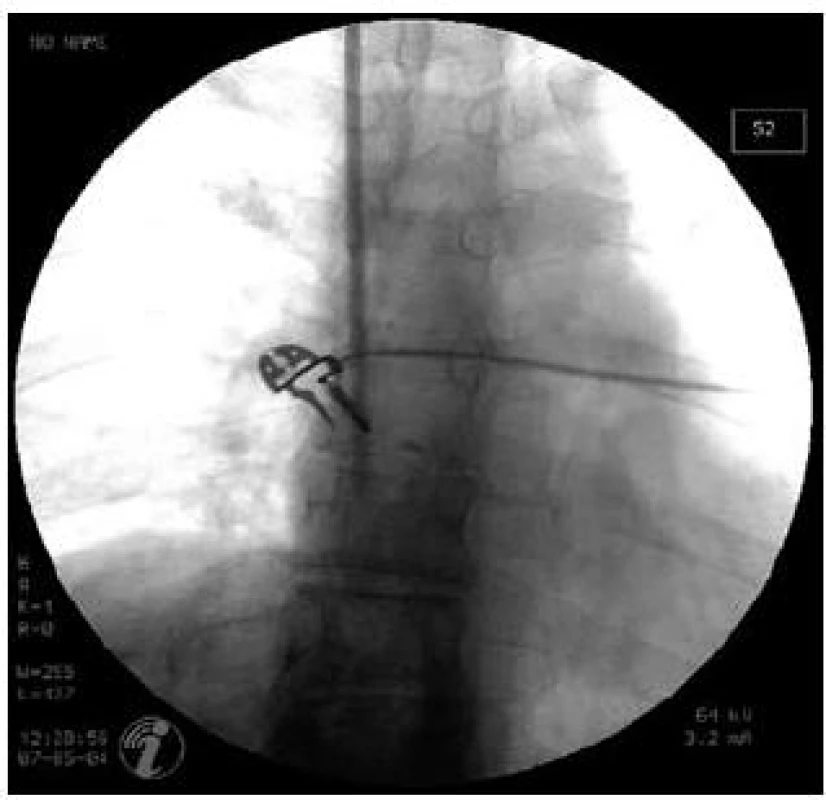
Obr. 2. Pozice katétru v jaterní žíle při odečítání FHVP. Fig. 2. Position of catheter in hepatic vein in FHVP measurement. 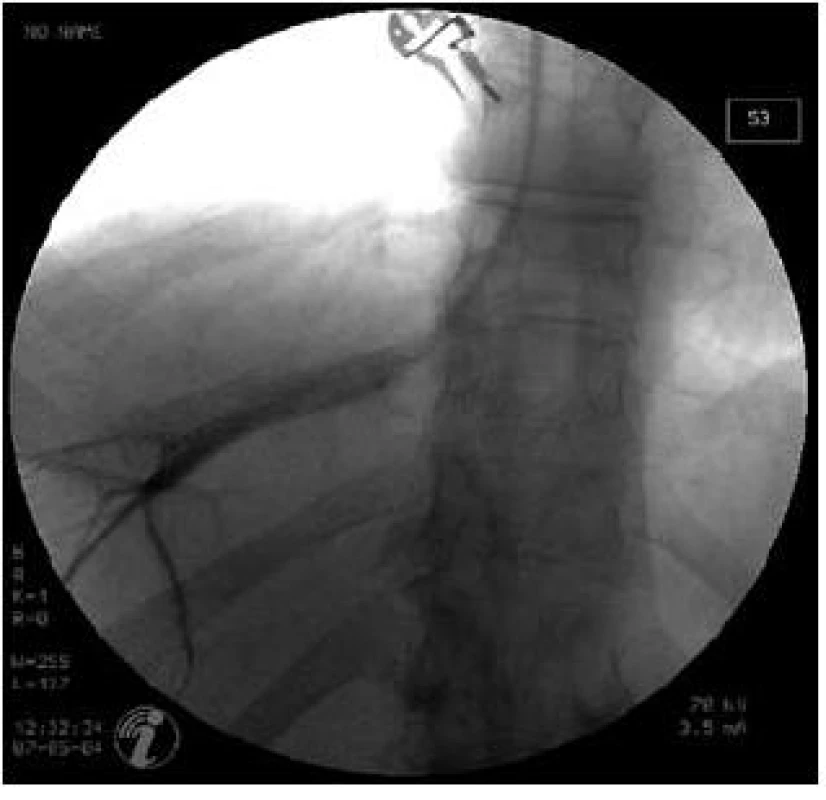
Obr. 3. Pozice katétru v zaklínění při měření WHVP a zobrazení periferní větve portální žíly pomocí retrográdního nástřiku kontrastní látky. Fig. 3. Position of catheter in WHVP measurement. Retrograde visualization of portal vein using contrast medium injection. 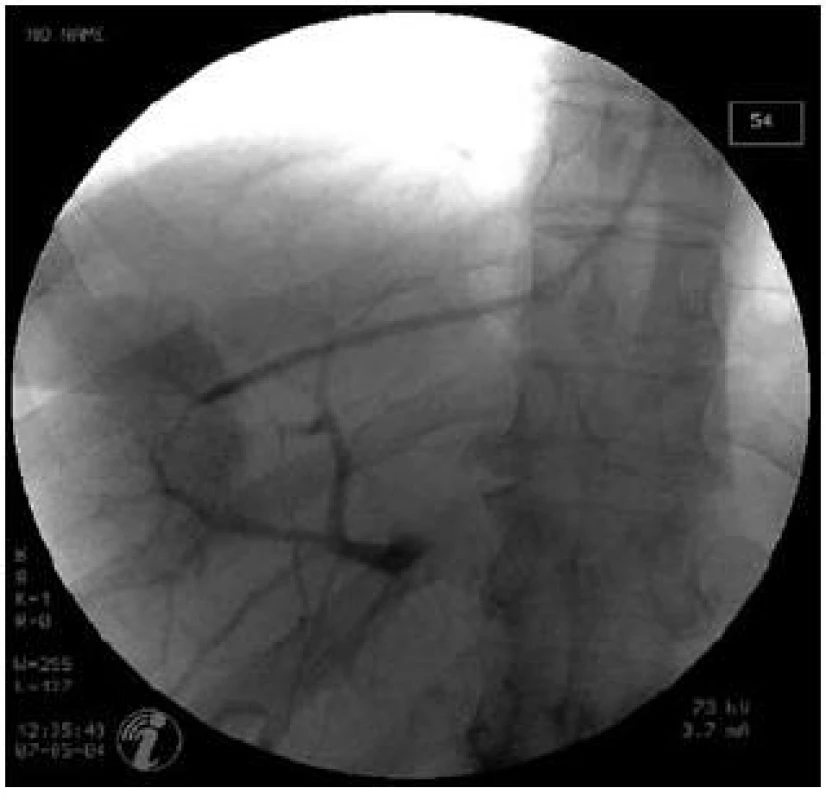
Limitace metody: Vyšetření HVPG je poměrně snadnou metodou za ideálních podmínek. Je třeba si však uvědomit, že při hodnocení účinnosti léčby betablokátory rozhoduje často rozdíl jen 1 mm Hg a špatný odečet hodnoty z monitoru může zkreslit celé vyšetření. Jsou situace, kdy je katetrizace jaterních žil komplikována například obtížnou punkcí centrální žíly, atypickým odstupem jaterních žil či atypickým uložením jater (např. při velkém ascitu). V jaterním parenchymu mohou být přítomny veno-venózní spojky, které snižují výslednou hodnou WHVP (obr. 4). Další technické komplikace mohou souviset s dosud nediagnostikovaným uzávěrem jaterních žil (obr. 5).
Obr. 4. Veno-venózní spojky v jaterním parenchymu. Nástřik při katetrizaci jaterních žil. Fig. 4. Veno-venous communication in liver parenchyma. Contrast medium injection during hepatic vein catheterization. 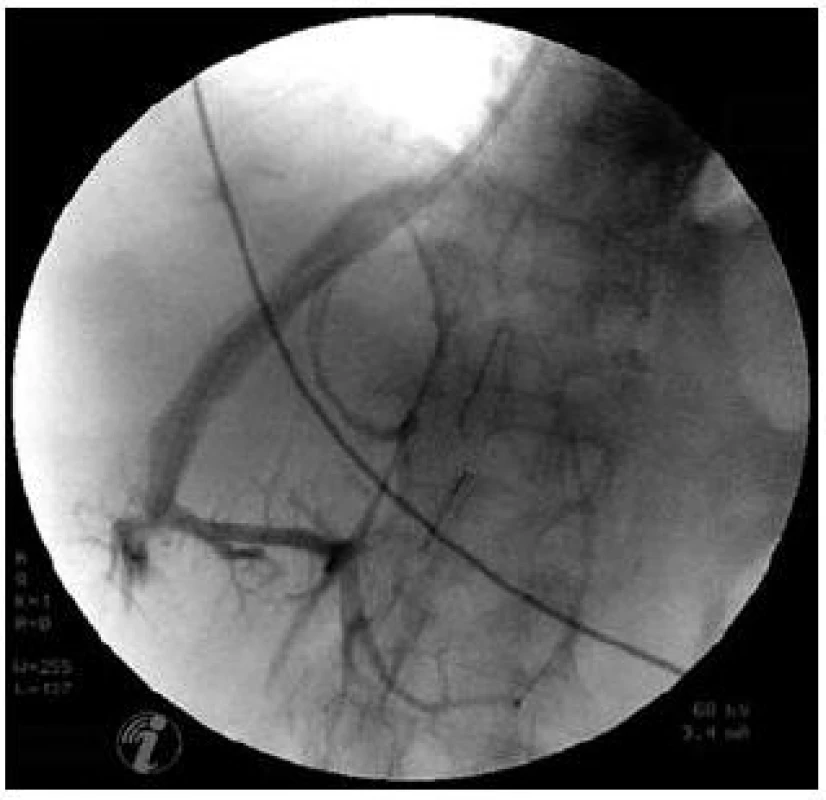
Obr. 5. Katetrizace jaterních žil u pacienta s Budd-Chiariho syndromem. Fig. 5. Hepatic vein catheterization in a patient with Budd-Chiari syndrome. 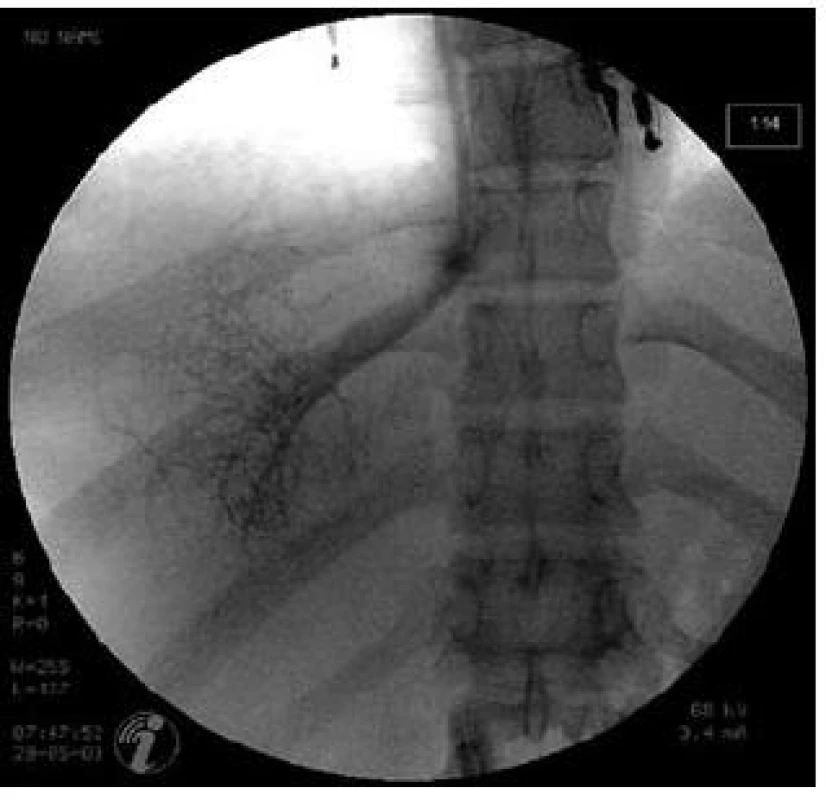
Všechny tyto obtížné situace lze řešit jen s dokonalou znalostí anatomie cévního řečiště, rutinní zkušeností s punkcí centrální žíly, dostatečnými zkušenostmi s katetrizačními technikami a zázemím nezbytným k řešení komplikací. Další nezbytnou podmínkou správného měření HVPG je odpovídající technické vybavení.
Klinické využití HVPG
Léčba akutního krvácení z varixů
Několik prací hodnotilo souvislost mezi výší HVPG a úspěchem léčby akutního krvácení z jícnových varixů [9–11]. K měření HVPG by v tomto případě mělo dojít velmi časně po krvácení – nejlépe do 24 hod. Hodnoty HVPG vyšší než 16 či 20 mm Hg byly v této souvislosti spojeny s významně horší úspěšností standardní farmakologické či endoskopické léčby a měly být vodítkem při časné indikaci k TIPS. Většina starších prací však hodnotila význam měření HVPG u pacientů, u nichž nebyl aplikován současný standardní léčebný postup při akutním krvácení – tj. kombinace farmakologické a endoskopické léčby a preventivní podávání antibiotik. Význam časného měření HVPG při standardním léčebném postupu u pacientů s krvácením z jícnových varixů byl hodnocen teprve nedávno [12]. Je pravdou, že i v této práci byla hodnota HVPG vyšší než 20 mm Hg spojena s významně horší úspěšností léčby, ale prakticky podobný prognostický význam měly základní klinické parametry – Child-Pugh skóre, hypotenze a známky šoku při přijetí pacienta. Při současné léčbě krvácení z jícnových varixů je mortalita relativně nízká (10–20 %) a ve zmiňované práci bylo 78 % pacientů, kteří měli HVPG vyšší 20 mm Hg úspěšně léčeno standardním postupem a nepotřebovalo TIPS. Ještě nedávno platilo, že indikací k urgentnímu TIPS by měla být klinická situace (tj. pokračující krvácení či časná recidiva krvácení) a ne jen samotná vysoká hodnota HVPG. Objevují se však názory [13,14], že samotná vysoká hodnota HVPG by měla být indikací k zavedení TIPS. Z těchto důvodů nebylo dosud definitivní postavení měření HVPG při akutním krvácení z jícnových varixů v klinické praxi stanoveno.
Sekundární prevence krvácení z varixů
Bylo publikováno několik studií, které hodnotí přínos opakovaného měření HVPG v sekundární prevenci krvácení z jícnových varixů [15–17]. Podrobná metaanalýza studií hodnotících opakované měření HVPG po krvácení z jícnových varixů prokázala, že pokles HVPG pod 12 mm Hg či alespoň o 20 % oproti výchozí hodnotě při léčbě betablokátory je spojen s významně nižším počtem recidiv krvácení [18]. Není však zřejmé, jaká je nejvhodnější doba k provedení opakovaného měření HVPG po zahájení léčby betablokátory. V některých studiích to bylo s odstupem až tří měsíců, zdá se však, že kratší doba je vhodnější (2–4 týdny). K hodnocení účinnosti betablokátorů lze též využít sledování změny HVPG po jednorázové i.v. aplikaci propranololu [19]. Čím delší je interval od vstupního měření, tím větší je pravděpodobnost, že se u pacienta objeví recidiva krvácení předtím, než se kontrolní měření HVPG uskuteční. Časnější měření HVPG tak dříve odhalí pacienty nereagující na léčbu betablokátory dostatečným poklesem portálního tlaku, kteří jsou indikování k jiné léčbě.
Hodnocení léčebné odpovědi je složité. Neexistuje nepřímá neinvazivní metoda, která by přesně posoudila výši portální hypertenze. Zlatým standardem v hodnocení portální hypertenze je tedy stále katetrizace jaterních žil a změření jaterního tlakového žilního gradientu. Nepřímo se lze orientovat změnou srdeční frekvence – pokles o 25 % či pod 55/min by měl znamenat pozitivní odpověď. Lze tak orientačně titrovat dávku betablokátoru, ale na tento parametr se nelze vždy spolehnout [20].
Sekundární prevence krvácení z jícnových varixů je tak jasnou indikací k opakovanému měření HVPG (metoda léčby „a la carte“ [21]), neboť nedostatečná účinnost betablokátorů by měla vést ke změně léčby – tj. přidání nitrátů či provedení endoskopické ligace jícnových varixů. Žádná jiná metoda krom opakovaného měření HVPG tuto informaci nedá. Podobný postup byl zmiňován i na konsenzuální konferenci Baveno 5 [22], existují však i názory, že rutinní měření HVPG v této indikaci a v podmínkách denní rutinní klinické praxe není nutné [23]. Hlavním argumentem je nedostatek studií na větším počtu pacientů.
Primární prevence krvácení z varixů
K této problematice je k dispozici méně údajů. Zdá se, že pravděpodobnost krvácení z jícnových varixů je vyšší u pacientů, u kterých nedošlo při léčbě betablokátory k dostatečnému snížení HVPG [24]. Není však jasné, co v této souvislosti znamená „dostatečné“ snížení HVPG. Ví se, že farmakologické snížení HVPG pod 12 mm Hg zamezí kompletně prvnímu krvácení [25], nebylo však prokázáno, že snížení HVPG o více než 20 % oproti výchozí hodnotě má v této situaci podobný účinek. Není zcela zřejmé, zda opakované měření HVPG u pacientů léčených v primární prevenci krvácení z varixů má dostatečný klinický význam [26].
Současné provedení jaterní biopsie transjugulární cestou
Určitým „bonusem“ katetrizace jaterních žil je možnost provést současně transjugulární jaterní biopsii [27]. Je to poměrně bezpečná metoda umožňující získat vzorek jaterní tkáně i za podmínek, kdy je klasická perkutánní biopsie příliš riziková. Opakovaným vpichem navíc získáme vzorky z různých částí jater [28], což může být výhodné například při hodnocení stagingu virových hepatitid [29].
Prognóza nemocných s jaterní cirhózou
Vývoj jaterní cirhózy u jednotlivého pacienta je složité přesně odhadnout. Pro hodnocení pokročilosti onemocnění se používá Child-Pugh klasifikace a v poslední době též MELD (Model for End-stage Liver Disease ) skóre. Jedním z dalších možných prognostických faktorů je výše portální hypertenze daná hodnotou HVPG [30]. Je známo, že hodnota HVPG je jedním z nejlepších nezávislých prognostických parametrů v hepatologii [31,32].
Měření HVPG je doporučováno provádět u všech pacientů s jaterní cirhózou jako screeningové vyšetření na přítomnost klinicky významné portální hypertenze (tj. HVPG > 10 mm Hg) [22], neboť tito pacienti jsou ohroženi rozvojem komplikací cirhózy [33]. Bylo prokázáno, že výše HVPG je zásadní pro tvorbu jícnových varixů [34], tvorbu ascitu [35], krvácení z jícnových varixů [6] a je prediktivním faktorem přežití pacientů s etylickou jaterní cirhózou po krvácení z jícnových varixů [36]. Je též prokázáno, že farmakologické ovlivnění HVPG snižuje riziko prvního krvácení z jícnových varixů [37] i jeho recidivy [38].
Vysoká hodnota HVPG je spjata s rizikem vývoje hepatocelulárního karcinomu [39], změna HVPG při antivirové léčbě má význam pro další vývoj jaterní choroby [40].
Jedním z prognostických kritérií při akutní alkoholové hepatitidě může být též hodnota HVPG. Rondon et al popsali, že mezi pacienty s akutní alkoholovou hepatitidou, kteří měli při časném měření HVPG pod 22 mm Hg, zemřelo jen 13 %, zatímco ve skupině s hodnotou nad 22 mm Hg byla mortalita 66 % [41].
Závěr
Význam měření HVPG bude v budoucnosti spočívat především ve stanovení prognózy pacientů s jaterní cirhózou. Hodnota HVPG měřená jednorázově či opakovaně může předpovídat projevy dekompenzace jaterní cirhózy, výše portální hypertenze je nezávislým prognostickým faktorem pacientů s jaterní cirhózou. Snížení portálního přetlaku v průběhu farmakologické léčby betablokátory vede ke snížení počtu komplikací cirhózy a k prodloužení přežití [42].
Měření HVPG by tak v dnešní době mělo být běžnou praxí v péči o pacienty s jaterní cirhózou ve specializovaných centrech (tab. 1,2). Většímu rozšíření metody mimo specializovaná centra brání především cena výkonu a nedostatek zkušeností s tímto vyšetřením.
Tab. 1. Význam opakovaného měření HVPG v prevenci krvácení z jícnových varixů. Tab. 1. Significance of repeated HVPG measurement in the prevention of bleeding from oesophageal varices. 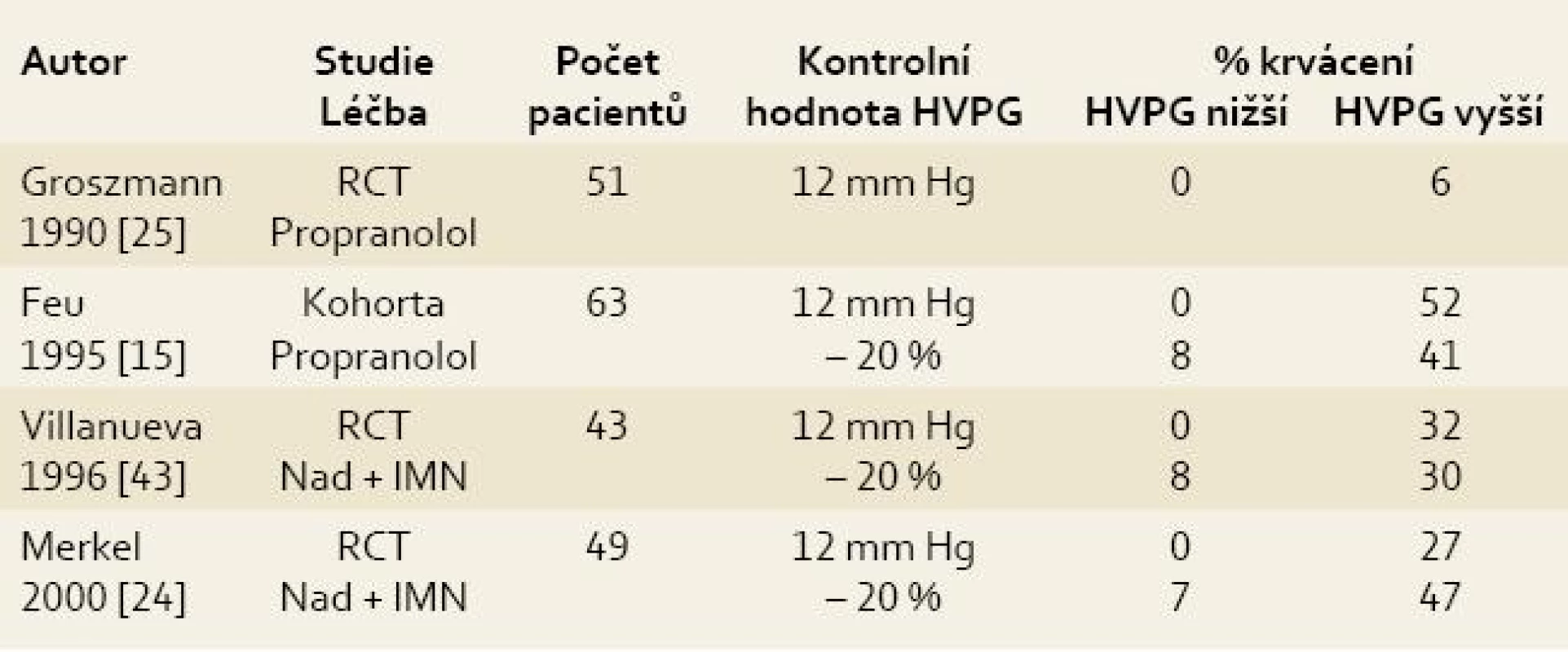
RCT – randomizovaná kontrolní studie; Nad – nadolol; IMN – isosorbidmononitrát Tab. 2. Indikace k měření HVPG. Tab. 2. Indication for HVPG measurement. 
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Podporováno: IGA MZČR NT 11247-4.
doc. MUDr. Radan Brůha, CSc.
IV. interní klinika VFN a 1. LF UK v Praze
U Nemocnice 2, 128 08 Praha 2
bruha@cesnet.cz
Zdroje
1. Brodanová M et al. Klinická hepatologie. Praha: Grada Avicenum 1993.
2. Sherlock S, Dooley J. Nemoci jater a žlučových cest. České vydání, Nadační fond ČHS 2004.
3. Myers JD, Taylor WJ. An estimation of portal venous pressure by occlusive cathetrization of ahepatic venule. J Clin Invest 1951; 30 : 662–663.
4. Thalheimer U, Leandro G, Samonakis DN et al. Assessment of the agreement between wedge hepatic vein pressure and portal vein pressure in cirrhotic patients. Dig Liver Dis 2005; 37(8): 601–608.
5. De Franchis R. Evolving consensus in portal hypertension. Report of the Baveno IV consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol 2005; 43(1): 167–176.
6. Garcia-Tsao G, Groszmann RJ, Fisher RL et al. Portal pressure, presence of gastroesophageal varices and variceal bleeding. Hepatology 1985; 5(3): 419–424.
7. Groszmann RJ, Wongcharatrawee S. The hepatic venous pressure gradient: anything worth doing should be done right. Hepatology 2004; 39(2): 280–282.
8. Zipprich A, Winkler M, Seufferlein T et al. Comparison of balloon vs. straight catheter for the measurement of portal hypertension. Aliment Pharmacol Ther 2010; 32(11–12): 1351–1356.
9. Ready JB, Robertson AD, Goff JS et al. Assessment of the risk of bleeding from esophageal varices by continuous monitoring of portal pressure. Gastroenterology 1991; 100(5 Pt 1): 1403–1410.
10. Villanueva C, Ortiz J, Minana J et al. Somatostatin treatment and risk stratification by continuous portal pressure monitoring during acute variceal bleeding. Gastroenterology 2001; 121(1): 110–117.
11. Avgerinos A, Armonis A, Stefanidis G et al. Sustained rise of portal pressure after sclerotherapy, but not band ligation, in acute variceal bleeding in cirrhosis. Hepatology 2004; 39(6): 1623–1630.
12. Abraldes JG, Villanueva C, Banares R et al. Hepatic venous pressure gradient and prognosis in patients with acute variceal bleeding treated with pharmacologic and endoscopy therapy. J Hepatol 2008; 48(2): 229–236.
13. García-Pagán JC, Caca K, Bureau C et al. Early TIPS (Transjugular Intrahepatic Portosystemic Shunt) Cooperative Study Group. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med 2010; 362 : 2370–2379.
14. Monescillo A, Martínez-Lagares F, Ruiz-del-Arbol L et al. Influence of portal hypertension and its early decompression by TIPS placement on the outcome of variceal bleeding. Hepatology 2004; 40(4): 793–801.
15. Feu F, Garcia-Pagan JC, Bosh J et al. Relation between portal pressure response to pharmacotherapy and risk of recurrent variceal haemorrhage in patients with cirrhosis. Lancet 1995; 346 : 1056–1059.
16. McCormick PA, Patch D, Greenslade L et al. Clinical vs hemodynamic response to drugs in portal hypertension. J Hepatol 1998; 28(8982): 1015–1019.
17. Villanueva C, Lopez-Balaguer JM, Aracil C et al. Maintenance of hemodynamic response to treatment for portal hypertension and influence on complications of cirrhosis. J Hepatol 2004; 40(5): 757–765.
18. Albillos A, Banares R, Gonzales M et al. Value of the hepatic venous pressure gradient to monitor drug therapy for portal hypertension: a meta-analysis. Am J Gastroenterol 2007; 102(5): 1116–1126.
19. Villanueva C, Aracil C, Colomo A et al. Acute hemodynamic response to beta-blockers and prediction of long-term outcome in primary prophylaxis of variceal bleeding. Gastroenterology 2009; 137(1): 119–128.
20. De Franchis R. Updating consensus in portal hypertension: report of the Baveno III consensus workshop on definitions, methodology and therapeutic strategies in portal hypertension. J Hepatol 2000; 33(5): 846–852.
21. Bureau C, Péron JM, Alric L et al. „A La Carte“ treatment of portal hypertension: Adapting medical therapy to hemodynamic response for the prevention of bleeding. Hepatology 2002; 36(6): 1361–1366.
22. de Francis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol 2010; 53 : 762–768.
23. Thalheimer U, Bellis L, Puoti C et al. Should we routinely measure portal pressure in patients with cirrhosis, using hepatic venous pressure gradient (HVPG) as a guide for prophylaxis and therapy of bleeding and rebleeding? Eur J Intern Med 2011; 22(1): 5–7.
24. Merkel C, Bolognesi M, Sacerdoti D et al. The hemodynamic response to medici treatment of portal hypertension as a predictor of clinical effectiveness in the primary profylaxis of variceal bleeding in cirrhosis. Hepatology 2000; 32(5): 930–934.
25. Groszmann RJ, Bosh J, Grace ND et al. Hemodynamic events in a prospective randomized trial of propranolol versus placebo in the prevention of a first variceal hemorrhage. Gastroenterology 1990; 99: 1401–1407.
26. Hicken BL, Sharara AI, Abrams GA et al. Hepatic venous pressure gradient measurements to assess response to primary prophylaxis in patients with cirrhosis: a decision analytical study. Aliment Pharmacol Ther 2003; 17(1): 145–153.
27. Kalambokis G, Manosou P, Vibhakorn S et al. Transjugular liver biopsy–indications, adequacy, quality of specimens, and complications–a systematic review. J Hepatol 2007; 47(2): 284–294.
28. Vibhakorn S, Cholongitas E, Kalambokis G et al. A comparison of four - versus three-pass transjugular biopsy using a 19-G Tru-Cut needle and a randomized study using a cassette to prevent biopsy fragmentation. Cardiovasc Intervent Radiol 2009; 32(3): 508–513.
29. Cholongitas E, Senzolo M, Standish R et al. A systematic review of the quality of liver biopsy specimen.Am J Clin Pathol 2006; 125(5): 710–721.
30. Armonis A, Patch D, Burroughs A. Hepatic venous pressure measurement: an old test as a new prognostic marker in Cirrhosis? Hepatology 1997; 25(1): 245–248.
31. Vorobioff J, Groszmann RJ, Pibacea E et al. Prognostic value of hepatic venous pressure gradient measurement in alcoholic cirrhosis: a 10-year prospective study. Gastroenterology 1996; 111(3): 701–709.
32. Triantos CK, Nikolopoulou V, Burroughs AK. Review article: the therapeutic and prognostic benefit of portal pressure reduction in cirrhosis, Aliment Pharmacol Ther 2008; 28(8): 943–952.
33. Ripoll C, Groszmann R, Garia-Tsao G et al: Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis. Gastroenterology 2007; 133(2): 481–488.
34. Bosch J, Mastai R, Krawetz D et al. Hemodynamic evaluation of the patients with portal hypertension. Semin Liver Dis 1986; 6(4): 309–317.
35. Morali GA, Sniderman KW, Deitel KM et al. Is sinusoidal portal hypertension a necessary factor for the development of hepatic ascites? J Hepatol 1992; 16(1–2): 249–250.
36. Vorobioff J, Groszmann RJ, Picabea E et al. Prognostic value of sequential measurement of portal pressure in alcoholic cirrhotic patients (Abstract). Hepatology 1994; 20 : 103A.
37. Conn HO, Grace ND, Bosch J et al. Propranolol in the prevention of the first haemorrhage from esophagogastric varices: a multicenter, randomised clinical trial. Hepatology 1990; 13(5): 902–912.
38. Feu F, Garcia-Pagan JC, Bosch J et al. Relation between portal pressure response to pharmacotherapy and risk of recurrent variceal haemorrhage in patients with cirrhosis. Lancet 1995; 345(8982): 1056–1059.
39. Ripoll C, Groszmann RJ, Garcia-Tsao G et al. Hepatic venous pressure gradient predicts development of hepatocellular carcinoma independently of severity of cirrhosis. J Hepatol 2009; 50(5): 923–928.
40. Burroughs AK, Grossmann RJ, Bosch J et al. Assessment of therapeutic benefit of antiviral therapy in chronic hepatitis C: is hepatic venous pressure gradient a better end point? Gut 2002; 50(3): 425–427.
41. Rincon D, Lo Iacono O, Ripoll C et al. Prognostic value of hepatic venous pressure gradient for in-hospital mortality of patients with severe acute alcoholic hepatitis. Aliment Pharmacol Ther 2007; 25(7): 841–848.
42. Abraldes JG, Tarantino I, Turnes J et al. Hemodynamic response to pharmacological treatment of portal hypertension and long-term prognosis of cirrhosis. Hepaology 2003; 37(4): 902–908.
43. Villanueva C, Balanzó J, Novella MT et al. Nadolol plus isosorbide mononitrate compared with sclerotherapy for the prevention of variceal rebleeding. N Engl J Med 1996; 334(25): 1624–1629.
44. Bruha R, Vitek L, Petrtyl J et al: The effect of carvedilol on portal hypertension depends on the severity of endothelial activation and inflammatory changes. Scand J Gastroenterol 2006; 41(12): 1454–1463.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Vítejte na palubě!Článek Sérové hodnoty hyaluronové kyseliny souvisejí se stupněm jaterní fibrózy i portální hypertenzíČlánek Radiální endosonografie vs esofagogastroduodenoskopie v detekci jícnových a žaludečních varixů
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2011 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Vítejte na palubě!
- Význam Evropské gastroenterologické federace (UEGF) se zvyšuje a může být příkladem politickým strukturám
- Hepatologie na počátku třetího tisíciletí
- Biochemické hodnotenie účinku silymarínu a praziquantelu na fibrogenézu pečene pri experimentálnej infekcii larvami parazitického helminta Mesocestoides vogae (Cestoda)
- Sérové hodnoty hyaluronové kyseliny souvisejí se stupněm jaterní fibrózy i portální hypertenzí
- Radiální endosonografie vs esofagogastroduodenoskopie v detekci jícnových a žaludečních varixů
- Doporučený postup pro diagnostiku a léčbu krvácení do zažívacího traktu při portální hypertenzi
- Význam měření portosystémového tlakového gradientu (HVPG) u pacientů s cirhózou
- Hepatocelulární karcinom – diagnostika a terapie z pohledu klinického onkologa
- Neobvyklá komplikace chronické pankreatitidy
- Kvantitativní imunochemický test krvácení do stolice v populačním screeningu kolorektálního karcinomu
-
Jaké nesteroidní antirevmatikum zvolit u nemocných se zvýšeným rizikem gastrointestinální toxicity?
Komentář ke studii CONDOR - Pohled na (intervenční) léčbu akutní pankreatitidy se mění
- Nácvik aplikace OTSC klipů na porcinních modelech
- Americká gastroenterologie – lépe již bylo?
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Význam měření portosystémového tlakového gradientu (HVPG) u pacientů s cirhózou
- Hepatocelulární karcinom – diagnostika a terapie z pohledu klinického onkologa
- Neobvyklá komplikace chronické pankreatitidy
- Sérové hodnoty hyaluronové kyseliny souvisejí se stupněm jaterní fibrózy i portální hypertenzí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



