-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Řešená problematika reprodukční medicíny v České republice 2020
Solved problems of reproductive medicine in the Czech Republic 2020
Introduction: During the 30th symposium of assisted reproduction held on November 11, 2020 in Brno, the solved problems in reproductive medicine in the Czech Republic in 2020 were presented. The selected topics have concerned not only current issues in the field of clinical embryology and genetics as well as gynecology, but also legislation and ethics. Discussed topics: 1. How much time does the doctor have in the CAR (centrum of assisted reproduction) outpatient clinic per patient and how does the embryologist communicate with clients? 2. Reproduction and PGT-M in oncology patients and patients at risk with hereditary oncogenic mutations. 3. Non-invasive genetic testing of embryos from culture medium. 4. Genome editing. 5. What is the need to monitor hormonal levels in stimulation protocols? 6. Monitoring and embryo selection for transfer/kryo. 7. Is it time to change the law on donor remuneration? Methods: The topics were prepared in advance by authorized members of our company with the task of elaborating theses, which they presented in a separate conference block. The presentation and the discussion were broadcast directly from the broadcast studio at Hotel International via an online connection. After the conference, all discussion topics and comments were incorporated. Conclusion: The work presents the state of the solved problems of reproductive medicine in the Czech Republic.
Keywords:
current topics – assisted reproduction – in vitro fertilisation – reproductive medicine – PGT – genome editing – embryo monitoring
Autoři: Ventruba P. 1; Žáková J. 1; Řežábek K. 2; Veselá K. 3; Tauwinklová G. 3; Trávník P. 3; Ješeta M. 1; Mardešić T. 4; Crha I. 1; Jelínková L. 4; Rumpík D. 5
Působiště autorů: Gynekologicko-porodnická klinika LF MU a FN Brno 1; Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze 2; REPROMEDA Biology Park, Brno 3; PRONATAL Sanatorium, Praha 4; Klinika reprodukční medicíny a gynekologie, Zlín 5
Vyšlo v časopise: Ceska Gynekol 2021; 86(2): 140-147
Kategorie: Vzdělávací článek
doi: https://doi.org/10.48095/cccg2021140Souhrn
Úvod: V průběhu 30. sympozia asistované reprodukce konaného 11. listopadu 2020 v Brně byla prezentována problematika řešená v reprodukční medicíně v ČR v roce 2020. Vybraná témata se týkala aktuálních otázek z oblasti klinické embryologie a genetiky, gynekologie, ale i legislativy či etiky. Řešená témata: 1. Kolik času má lékař v ambulanci centra asistované reprodukce na pacientku a jak s klienty komunikuje embryolog? 2. Reprodukce a preimplantační genetické testování monogenních chorob (PGT-M) u onkologických pacientů a pacientů v riziku s hereditárními onkogenními mutacemi. 3. Neinvazivní genetické testování embryí z kultivačního média. 4. Editace genomu. 5. Jaká je potřeba monitorování hormonálních hladin ve stimulačních protokolech? 6. Monitoring a výběr embrya pro transfer/ kryokonzervaci. 7. Nastal čas změnit zákon o odměňování dárců/ dárkyň? Metodika: Témata předem připravili pověření členové naší společnosti s úkolem vypracovat teze, které prezentovali v samostatném konferenčním bloku. Prezentace i s diskuzí byla vysílána přímo z vysílacího studia v Hotelu International online připojením. Po skončení konference byly všechny diskuzní náměty a připomínky zapracovány. Závěr: Práce předkládá stav řešených problémů reprodukční medicíny v ČR.
Klíčová slova:
aktuální témata – asistovaná reprodukce – in vitro fertilizace – reprodukční medicína – PGT – editace genomu – monitoring embryí
Úvod
V průběhu jubilejního 30. sympozia asistované reprodukce konaného 11. listopadu 2020 v Brně byla formou tezí prezentována řešená problematika v reprodukční medicíně v České republice v roce 2020. Výborem Sekce asistované reprodukce ČGPS ČLS JEP bylo vybráno 7 aktuálních témat a předsedajících. Vybraná témata se tradičně týkala aktuálních otázek z oblasti klinické embryologie a genetiky, gynekologie, ale i legislativy či etiky. Online forma konference v době vládních protikovidových opatření neumožnila tradiční formu lunch table discussion s moderátory.
Materiál a metodika
Výstupem jednotlivých diskuzních témat byly stručné souhrny, které byly připraveny předem a prezentovány jednotlivými moderátory v samostatném odpoledním konferenčním bloku. Cílem naší práce je předložit přehled stávajícího stavu aktuálních témat současně se závěry a doporučeními širší odborné veřejnosti.
Výsledky
Řešená témata reprodukční medicíny
1. Kolik času má lékař v ambulanci centra asistované reprodukce na pacientku a jak s pacientkami// pacienty komunikuje embryolog?
Předsedající: MU Dr. K. Řežábek, CSc.
Téměř všechna ambulantní pracoviště napříč medicínskými obory objednávají pacienty na určitý konkrétní čas. Zamezí se tak dlouhému čekání pacientů, v době covidu se i významně sníží expozice riziku v čekárně. Je důležité dobře nastavit intervaly mezi jednotlivými pacienty. Cílem je ekonomické využití času lékaře (celého týmu vč. prostor a přístrojů), zároveň ale provést vyšetření beze spěchu, rizika chyb a nedodělků. Časový tlak na lékaře vede k odsouvání části práce „na příště“.
Manažeři center asistované reprodukce (CAR) preferují z ekonomických důvodů čas co nejkratší. Bohužel k tomu vede i úhradový systém zdravotních pojišťoven, kde je mnohdy pro zisk bodů výhodnější rozložit výkony do dvou návštěv, byť by bylo možné je provést současně. Agregované platby (např. za in vitro fertilizaci – IVF), které již finančně nerozlišují jednotlivé výkony, jsou v tom osvobozující. Z hlediska flexibility je pro pacientky výhodné, když mohou být na jakýkoli typ návštěv (folikulometrie, rozpis, nová pacientka atd.) objednány kdykoli v průběhu dne. Ambulance, kde je ultrazvukový přístroj takřka standardní součástí, to umožňuje. I pro lékaře je příjemné, když se mu typy vyšetření střídají. Proto používáme objednávání flexibilní, kdy pacientka vždy konzultuje s objednávající sestrou plánovaný cíl návštěvy. Zcela zásadní je spolupráce se sestřičkami/ koordinátorkami (zapsání identifikačních údajů, základní informace, podpisy souhlasů, vysvětlení aplikace léků a jejich vydání atd.) a dobře funkční software. Tak se ušetří mnoho času lékaře.
Časové potřeby v CAR: nový neplodný pár vyžaduje minimálně 30 min za předpokladu, že s ním předtím koordinátorka nebo zdravotní sestra provede základní zápis do softwaru a probere základní údaje. Jako efektivní se ukazuje provést následnou návštěvu se zhodnocením výsledků a rozhodnutím další léčby na dálku, tedy telefonicky nebo prostřednictvím videokonference. Pacientka ušetří čas s cestou, zdravotnické zařízení ušetří ambulanci s plným vybavením, protože konzultaci lze provést z jakékoli místnosti s počítačem. Významně k tomu přispěla možnost zaslat e-recept, což ale v IVF nelze vždy využít. Zkušenost ukazuje, že lékař musí mít tyto pacientky napsané v rozvrhu práce na určitý čas, jinak se může stát, že se opomenou nebo na ně přijde řada až večer – zatímco ony očekávají telefonát lékaře už od rána.
V průměru je potřeba 20 min na pacientku v ambulanci lékaře. Lékař pacientku vyšetří a vše s ní probere, také mnohdy zakládá cyklus pro vytištění rozpisu léků pacientce (a evidenci v Národním registru asistované reprodukce), žádá pojišťovnu o jeho schválení, píše o tom zápis do dekurzu, někdy píše i zprávu gynekologovi nebo žádanky na doplňující vyšetření. Je v tom i malá rezerva na složitější pacientky nebo na zpoždění dané dopravou. Je dobré, když pacientky počítají s tím, že je vhodné přijít již pár minut před stanoveným časem, a naopak vnímají, že může dojít k posunu jejich času o přibližně 15 min z důvodu provozu ambulance.
Embryolog komunikuje s pacientkami v ČR od nulové komunikace až po osobní kontakt. Naše zkušenost ukazuje, že u pacientek směřujících po odběru oocytů k embryotransferu je dobré, když s nimi embryolog probere situaci osobně. Po punkci folikulů se s pacientkou setkají a konzultují, jaké metody – s ohledem na počet a kvalitu oocytů a spermií – lze použít v jejich konkrétním případě. Je to i společensky vhodné a pacientky (i embryologové) si toho cení. Další komunikace s laboratoří probíhá telefonicky, např. stanovení dne transferu, informace o vývoji embryí, zamrazení nadbytečných embryí, preimplantační genetické testování (PGT). Pacientka má už nicméně konkrétní představu, s kým hovoří. U dárkyň vajíček ani u kryoembryotransferů při použití embryí jak vlastních, tak vzniklých z přijatých oocytů, nevnímáme komunikaci embryologa s pacientkou jako přínosnou.
2. Reprodukce a PGT-M u onkologických pacientů a pacientů v riziku s hereditárními onkogenními mutacemi
Předsedající: MU Dr. K. Veselá, Ph.D.
Problematika onkofertility, zejména u žen s karcinomem prsu, je v odborné literatuře široce diskutována, vč. mezinárodních analýz a doporučení [1]. K této problematice byly vydány guidelines jak evropské, tak i americké odborné společnosti. Ačkoli se incidence karcinomu prsu zvyšuje s věkem, představuje nejčastěji diagnostikovanou malignitu u žen v reprodukčním věku, každoročně je diagnostikováno 10,5 % nových případů u pacientek mladších 45 let [2]. U mladších žen bývají nádory prsu agresivnější a vyžadují gonadotoxickou léčbu a následnou endokrinní terapii u nádorů exprimujících hormonální receptory, což může zásadně ovlivnit jejich fertilitu. Zvyšující se povědomí o nádorech prsu, časná diagnostika a možnosti léčby zvýšily podíl přežití u pacientek s karcinomem prsu. Vzhledem ke globálnímu trendu odloženého rodičovství roste populace mladých žen s karcinomem prsu diagnostikovaným před ukončením reprodukce. Přibližně 50 % mladých žen v okamžiku diagnózy vyslovuje obavy z následné neplodnosti, avšak jen 10 % využije možností pro zachování plodnosti. Vzhledem k vlivu na kvalitu života by měly být u pacientek s tumorem v reprodukčním věku řešeny otázky zachování plodnosti brzy po stanovení diagnózy. Pacientky přeživší po léčbě karcinomu, které obdržely adjuvantní systémovou terapii, mají 14% naději na otěhotnění s pregnancy rate o 40 % nižší než v běžné populaci.
Je proto důležité, aby pacientky s karcinomem prsu v reprodukčním věku byly informovány o potenciálním negativním vlivu onkologické léčby na plodnost a zachování plodnosti, a pokud mají zájem o uchování plodnosti, mají být odeslány k odborníkovi pro reprodukční medicínu, který je informuje o současných možnostech [3].
V současné době již existují důkazy, že těhotenství u pacientek přeživších onkologickou léčbu karcinomu prsu není spojeno se zvýšeným rizikem návratu onemocnění bez ohledu na hormonální status. Řízená ovariální stimulace u onkologických pacientek je bezpečná metoda a není spojena s rizikem rekurence nádoru, nebyl zjištěn rozdíl v přežívání bez recidivy mezi těhotnými a netěhotnými pacientkami.
Pro snížení případného rizika krátkodobé expozice vysokým hladinám estradiolu jsou používány alternativní a bezpečné protokoly ovariální stimulace s využitím inhibitorů aromatázy, případně s použitím tamoxifenu. Preferovaným protokolem pro cykly určené pro zachování fertility jsou kombinace gonadotropinů s letrozolem. Užití těchto protokolů dává výtěžek obecně 45 % gravidit na transfer embrya.
Důležitou změnou v postupech zachování fertility je zavedení random start protokolů ovariální stimulace. Tyto protokoly umožňují začít ovariální stimulaci i v pozdní folikulární a luteální fázi menstruačního cyklu, kdykoli během cyklu. Ukázalo se, že tyto protokoly dávají podobné množství získaných oocytů i oocytů oplozených. Zdržení onkologické léčby se tak redukuje na přibližně dva týdny [4]. Byly vypracovány i protokoly dvojí stimulace během jednoho menstruačního cyklu umožňující získání více oocytů.
Kryokonzervace embryí a oocytů jsou nejefektivnějšími metodami uchování fertility u onkologických pacientek. Kryokonzervace ovariální tkáně představuje experimentální metodu uchování plodnosti, při níž se chirurgicky odejme kůra ovarií a kryokonzervuje se.
Jednou z navržených experimentálních metod uchování fertility u onkologických pacientek je podání analog gonadotropiny uvolňujícího hormonu (GnRH), což je neinvazivní, snadno aplikovatelný a metody asistované reprodukce nevyžadující postup. Užití analog GhRH je založeno na hypotéze, že jejich podání vyvolá klid v ovariích, což může snížit negativní účinky chemoterapie. Ovariální rezervu aplikace GnRH přímo ovlivnit nemůže, protože primordiální folikuly nejsou citlivé na působení folikuly stimulujícího hormonu (FSH) [5]. Význam publikací o účinnosti metody snižuje skutečnost, že jejich soubory nebyly randomizovány, chyběly kontroly a údaje o dlouhodobějším efektu. Pokud nelze dosáhnout těhotenství s vlastními embryi, je možné použít darované oocyty nebo embrya.
S problematikou onkofertility úzce souvisí prevence přenosu onkogenních mutací na další generace. Jedinou plně odborně a eticky akceptovatelnou metodou při použití vlastních gamet je preimplantační genetické testování onkogenních mutací. Tato metoda je akceptovatelná pro většinu řádně poučených párů (tab. 1).
Tab. 1. Přednosti a nedostatky metod uchování plodnosti u onkologických pacientů.
Tab. 1. Advantages and disadvantages of fertility preservation methods in cancer patients.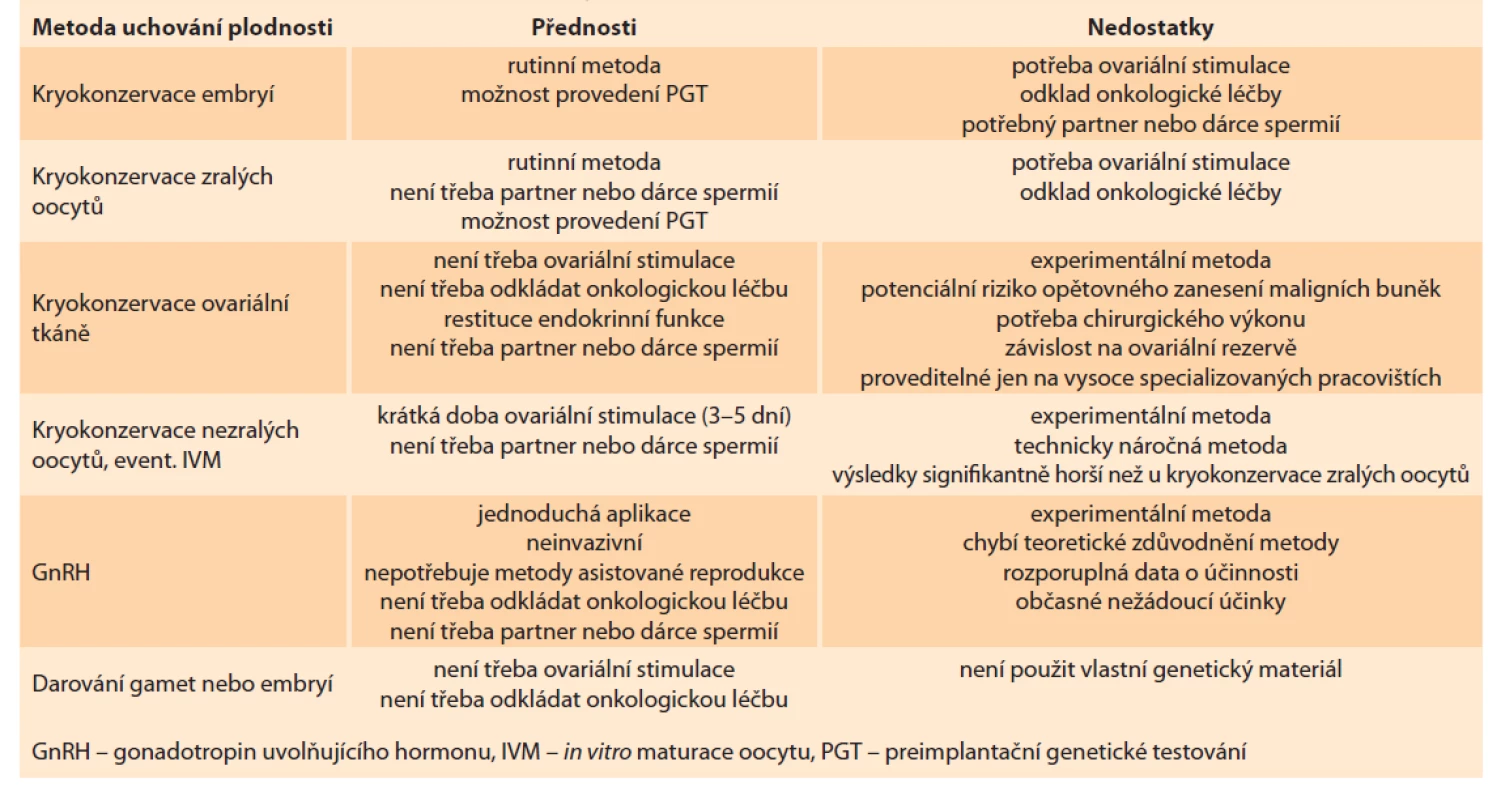
3. Neinvazivní genetické testování embryí z kultivačního média
Předsedající: RNDr. G. Tauwinklová, prof. MU Dr. P. Trávník, DrSc.
Cílem diskuze bylo zjistit informovanost odborné veřejnosti o možnostech neinvazivního preimplantačního genetického testování ze vzorku kultivačního média (NiPGT-A) a jejich připravenosti metodu v budoucnu používat. Většina odborníků je o vývoji metody informována jen částečně (53,3 %), za dobře informované se považuje 46,7 % osob. Možnost, že by neinvazivní testování mohlo nahradit PGT založené na biopsii embrya, připouští 26,7 % odborníků, 53,3 % to připouští s podmínkou a 20,0 % se domnívá, že biopsii nenahradí. Pokud by testování média podalo pouze přibližnou informaci o přítomnosti aneuploidií, použilo by je 40,0 % respondentů, nepoužívalo 33,3 % a rozhodnuto není 26,7 %. Řadu variant přinesly odpovědi na otázku o možném původu DNA v kultivačním médiu. Většina respondentů se domnívá, že zdrojem DNA jsou lyzované, poškozené, vyloučené buňky (41,2 %), dále jsou to apoptotické buňky (23,5 %). Zbývající odpovědi zahrnovaly buňky ICM (vnitřní masa buněk; inner cell mass) a trofektodermu nebo buňky embrya bez bližšího určení (11,8 %), exocytózu (5,9 %), kumulární buňky (5,9 %), metabolity (5,9 %) nebo maternální a embryonální buňky (5,9 %).
Z odpovědí je zřejmé, že informovanost o existenci a možnostech neinvazivního testování aneuploidií není velká. Řada odborníků uvažuje o možnosti použití metody, avšak existují pochybnosti o její specifitě a senzitivitě dané především nedostatečnou informací o původu DNA v kultivačním médiu. Je nepochybné, že buňky nesecernují DNA, ta je uvolňována pouze z buněk zaniklých. Buňky vyvíjejícího se embrya zanikají převážně apoptózou, která nastává v případě optimálního kultivačního prostředí. Je důsledkem nízkého vývojového potenciálu buněk daného např. přítomností aneuploidií. Přítomnost aneuploidií ovlivňuje vitalitu buněk embrya různou intenzitou, která závisí zejména na postiženém chromozomu a typu poruchy. Je známo, že trizomie, na rozdíl od monozomií autozomů, mají větší šanci na pokračování vývoje v časném embryonálním stadiu a že trizomie chromozomů 13, 18 a 21 se mohou u zlomku embryí vyvíjet až do porodu a vést ke vzniku závažných vrozených vad. Z uvedeného vyplývá, že senzitivita i specifita metody může být ovlivněna typem přítomných aneuploidií.
Yeung et al uvádějí, že metoda NiPGT-A měla v jejich provedení senzitivitu 81,6 %, specificitu 48,3 %, pozitivní prediktivní hodnotu 82,6 % a negativní prediktivní hodnotu 46,7 %, pokud jde o zjištění ploidie [6]. Lledo et al považují za hlavní problémy metody kontaminaci maternální DNA, mozaicizmus a nízkou citlivost dostupných metod při malém množství získané DNA. Podle jejich názoru je cestou ke zlepšení výsledků zdokonalení kultivace embryí a odběru vzorku kultivačního média [7].
4. Editace genomu
Předsedající: doc. Ing. M. Ješeta, Ph.D.
Na podzim roku 2020 získaly J. A. Doudna a E. Charpentier Nobelovu cenu za chemii za objev systému CRISPR-Cas9, který dokáže efektivně editovat DNA. Rozvoj na poli molekulární genetiky a bioinformatiky je rapidní a přináší nové poznatky, které činí metody editace genomu čím dál více dostupnější. Pomalu se blíží doba, kdy bude možné efektivně editovat genom lidských embryí. Zvládnutí této metody má potenciál pro další rozvoj zdravotnictví. Nicméně využití techniky editace genomu se setkává s množstvím etických otázek. V roce 2015 byl zorganizován první summit o editaci lidského genomu a jedním ze závěrů bylo: „Ve výzkumu cílených zásahů do dědičné informace budeme pokračovat, protože slibují lidstvu významné přínosy. Nebudeme si ale zahrávat s tím, že by se z embryí s upravenou dědičnou informací narodily děti.“ Sama J. A. Doudna několikrát zdůraznila, že nejsme připraveni efektivně používat CRISPR-Cas9 systém u lidských embryí [8].
I přes tato prohlášení bylo v roce 2016 povoleno editování lidských embryí ve Velké Británii pro výzkumné účely max. do 14 dní jejich vývoje a poté musí být zlikvidována. V roce 2018 se v Číně dokonce narodila dvojčata Lulu a Nana po editaci genů metodou CRISPR-Cas9. Postup neprošel obvyklým schvalovacím procesem a nerespektoval mezinárodní prohlášení, přesto byl realizován. V celém světě se zvedla vlna nevole a negativních reakcí ve snaze regulovat tuto situaci a zabránit dalším experimentům hazardujícím s lidským životem. Evropská společnost pro lidskou reprodukci a embryologii (ESHRE) vydala 22. 2. 2019 prohlášení, ve kterém podporuje přijetí moratoria na využití CRISPR-Cas9 pro klinické využití [9].
Toto velice živé téma se nepřímo dotýká i českých center asistované reprodukce, která jsme proto oslovili jednoduchým dotazníkem. Získali jsme reakce a názory 24 embryologů, kteří pracují ve 13 centrech (tab. 2). Na naši úvodní otázku, zda je respondent zásadně proti, či zda je za určitých podmínek ochoten akceptovat editaci genů, se čtyři embryologové (16,7 %) vyjádřili, že zásadně nesouhlasí s tímto postupem. V další sérii otázek jsme chtěli upřesnit názory těch, kteří jsou ochotni akceptovat tento postup. První dotaz byl zaměřen na to, zda povolit editaci lidského genomu již nyní. Pouze jeden respondent (4,2 %) souhlasil s vyžitím této metody v současnosti. Dále jsme se ptali na možnosti, zda povolit editaci genů u experimentálních embryí, která budou po 14 dnech zlikvidována, a zda povolit editace genů u závažných genetických onemocnění. Čtyři odpůrci této metody zcela nesouhlasili, pro všechny ostatní je tento postup akceptovatelný. Již tak jednotný názor této skupiny nebyl u chronických onemocnění, která mohou mít především v pozdějším věku závažný průběh (např. Huntingtonova choroba či diabetes mellitus 2. typu). S tímto způsobem zásahu do genomu souhlasilo pouze 45,8 % dotázaných (11 osob) a 37,5 % dotázaných bylo proti, dva neví, jeden respondent by chtěl vždy posuzovat případy individuálně a jeden připouští tuto možnost v budoucnu. Na dotaz zaměřený na editaci genů, které přímo nesouvisejí se zdravotním problémem, bylo dle očekávání 100 % negativních odpovědí.
Tab. 2. Názory českých embryologů na editaci lidského genomu.
Tab. 2. Opinions of Czech embryologists on editing the human genome.
V posledním dotazu na způsob právní regulace použití techniky editace lidského genomu na lidských embryích bylo možné zvolit současně více variant. Dotázaní měli na výběr, zda preferují regulaci na globální úrovni, celoevropské, státní (upravené zákonem) a/ nebo stačí vyhláška příslušného ministerstva. Nejvíce dotázaných (15 osob) si myslí, že regulace by měla být zákonem dané země, jedenáct hlasů bylo pro regulaci globální a deset respondentů preferuje regulaci na evropské úrovni. Žádný z respondentů si nemyslí, že by měla být regulace pouze na úrovni ministerstva upravená vyhláškou.
Otázka editace lidského genomu je velice významná a může v budoucnu výrazně zasáhnout do rozvoje zdravotnictví. Jde o velice kontroverzní metodu, kterou 4 z 24 oslovených českých embryologů zcela odmítají. Většina je ochotná v budoucnu akceptovat využití této metody pro experimentální účely a předcházení závažným genetickým chorobám. Více než 40 % respondentů je ochotno akceptovat editaci lidského genomu i u chorob bezprostředně neohrožujících život pacientů s výrazným projevem až v dospělém věku. Žádný z dotázaných nesouhlasí s použitím bez spojení s genetickou chorobou či zdravotním problémem.
5. Jaká je potřeba monitorování hormonálních hladin při současných stimulačních protokolech v souvislosti s IVF?
Předsedající: MU Dr. T. Mardešić, CSc.
V začátcích asistované reprodukce bylo intenzivní a frekventní monitorování hormonálních hladin v IVF cyklech automatickou a nezbytnou součástí léčby. Kromě významu pro praxi (detekce luteinizace in situ, časování odběrů oocytů) přineslo toto období obrovský nárůst poznatků pro reprodukční endokrinologii. Následné zavedení agonistů GnRH a později antagonistů GnRH do stimulačních protokolů (reverzibilní blokáda hypofýzy a dokonalá kontrola nad sekrecí gonadotropinů) znamenalo významný ústup od potřeby monitorovat hormonální hladiny a klinické rozhodování se z větší části opíralo o ultrazvukové nálezy (folikulogeneze, endometrium). S rozvojem reprodukční medicíny (stejně jako v jiných medicínských oborech) je stále větší důraz kladen na „personalizaci“ a individualizaci poskytované péče. V této souvislosti se otázka sledování hormonálních hladin opět dostává do popředí zájmu [10,11].
Zejména s významným pokrokem kryokonzervace, která umožnila stále častěji využívanou segmentaci IVF (odložení embryotransferu), je identifikace optimálního nastavení reprodukčního cyklu možností, jak zvýšit úspěšnost asistované reprodukce. Racionální monitorování hormonálních hladin může výrazně ovlivnit klinické rozhodování a strategii léčby.
Poměrně opomíjeným hormonem je progesteron (P): vyšetření hladiny P na začátku cyklu před zahájením stimulace může detekovat perzistující corpus luteum, významně zvýšená hladina progesteronu v periovulačním období (v den podání „triggeru“) je indikací pro „freeze-all“ a monitorování progesteronu po punkci folikulů před embryotransferem pomáhá individualizovat luteální fázi [11,12].
Při plánování kryotransferu do spontánního ovulačního cyklu umožní sledování hladiny 17-beta-estradiolu, FSH a luteinizačního hormonu (LH), optimální načasování přenosu stejně jako rozhodnutí o punkci folikulů v souvislosti s IVF v nativním nestimulovaném cyklu. Nízká hladina může být kontraindikací indukce ovulace agonisty GnRH. Racionální monitorování hormonálních hladin tak může snížit počet cyklů s opakovaným selháním implantace po přenosu kvalitních embryí.
6. Monitoring a výběr embryí pro transfer/ kryokonzervaci
Předsedající: MVDr. L. Jelínková, CSc.
První popis morfokinetiky embryí pochází z roku 1929. Práce se týkala králičích embryí kultivovaných in vitro [13]. Vývoj lidských embryí in vitro byl rámcově popsán v roce 1985. Podrobný monitoring lidských preimplantačních embryí byl publikován na výroční konferenci ESHRE 1996 v Maastrichtu, následně v 1997 v Human Reproduction. Průkopníci v tomto oboru byli Diana Payne, Thorir Hardarson a další. Do rutinní praxe v IVF laboratořích se monitoring embryí dostal díky dostupnosti přístrojů s vestavěnou kamerou. Během posledních 10 let se rozšířilo použití time-lapse v IVF laboratořích po celém světě.
Dnes se stal monitoring embryí standardem a v návaznosti na to bylo publikováno množství prací s cílem objektivně vybrat embrya s nejvyšším vývojovým potenciálem. Nesporná výhoda time-lapse je nerušená kultivace embryí v naprosto standardních podmínkách.
Lepší výsledky při použití monitoringu dokazují početné publikace. Pribenszky et al uvádějí signifikantní zvýšení klinických těhotenství ze 40 na 51 %, nárůst porodů z 31 na 44 % a pokles časných těhotenských ztrát z 21 na 15 % [14].
Méně optimistický je závěr Cochrane Library Review, kdy autor uzavírá analýzu: „Není dostatečný důkaz pro rozdíl v podílu živě narozených, abortů, časných úmrtí a klinických těhotenství za použití time-lapse systému ať s použitím software pro selekci embryí, nebo bez, ve srovnání s klasickou kultivací.“ Zdůvodňuje to vysokým rizikem bias při randomizaci v analyzovaných pracích [15]. Zlepšení výsledků je dáno jednak stabilním prostředím během kultivace a rovněž díky nesrovnatelně většímu množství informací o vývoji jednotlivých embryí, které zůstává při klasické inkubaci skryto.
Time-lapse přináší obrovské množství dat, jen při zaznamenání obrazu v pěti rovinách každých 5 min získáme u jednoho embrya za 6 dní kultivace 8 640 snímků. Bez použití softwaru není možné takové množství údajů zhodnotit. Současné automatické či semiautomatické hodnocení embryí stále vyžaduje intervenci embryologa.
Automatický výběr embrya na základě vybraných parametrů nabízí mezi jinými software 5 KIDScore™ pro Embryoscope (Vitrolife). Hodnocení je založeno na dvou morfologických a pěti morfokinetických parametrech (verze 2). Reignier et al potvrzují pozitivní korelaci mezi KIDScore a procentem implantace, v závěru ale uvádí, že finální hodnocení embryologem je absolutně nezbytné [16].
Pro objektivní posouzení vývojového potenciálu embrya je nutné využití umělé inteligence.
Dosud publikované výsledky automatického či semiautomatického hodnocení vývoje embrya často nedosahují uspokojivou úroveň, často kvůli nesprávnému výběru hodnocených parametrů. Pro zlepšení predikce implantace embryí je do softwaru nutné zahrnout i údaje o pacientech.
7. Nastal čas změnit zákon o odměňování dárců/ dárkyň?
Předsedající: MU Dr. D. Rumpík, Ph.D.
Podle zákona č. 296/ 2008 Sb., o zajištění jakosti a bezpečnosti lidských tkání a buněk určených k použití u člověka a o změně souvisejících zákonů (zákon o lidských tkáních a buňkách), a podle vyhlášky č. 422/ 2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidských tkání a buněk určených k použití u člověka, je možná pouze kompenzace nákladů vzniklých s darováním a odběrem buněk a tkání. Výši úhrad účelně vynaložených výdajů však určuje konkrétní CAR. Vzhledem k rostoucímu počtu příjemkyň oocytů narůstá potřeba nových dárkyň. Částka za kompenzaci dárkyním se rovněž neúměrně zvyšuje [17]. Jak naše odborná společnost SAR ČGPS ČLS JEP, tak i MZ ČR doporučují nastavení hranice pro kompenzaci za dárcovství vajíček na 1 000 € s ohledem na zahraniční praxi některých států, tedy v našich podmínkách na úrovni cca 25 000 Kč. Odborná společnost současně doporučuje zahájit diskuzi o regulaci kompenzací pro náhradní matky v IVF cyklech s využitím náhradního mateřství [18,19].
Diskuze
Dvanáctá polední diskuze u kulatých stolů v Hotelu International v Brně, tradiční součást programu výročních sympozií asistované reprodukce SAR ČGPS ČLS JEP, se bohužel v rámci vládních proticovidových opatření nemohla uskutečnit. Toto setkání nejvýznamnějších odborníků z reprodukční medicíny z ČR a SR zahrnující gynekology, embryology, andrology, urology, psychology, endokrinology, genetiky a další je unikátní a kuloární diskuze mnohdy přináší významné výstupy. Organizace diskuzních témat se v předchozích letech snažila co nejvíce aktuálních informací zpřístupnit co nejširšímu spektru posluchačů a závěry a doporučení byly vždy ihned po obědě prezentovány moderátory v přeplněném auditoriu. Proto bylo rozhodnuto zachovat tento blok v jubilejním 30. ročníku, i když v pozměněném online režimu. Vybraná témata předem připravili pověření členové naší společnosti s úkolem vypracovat teze, které prezentovali v samostatném konferenčním bloku. Prezentace i s diskuzí probíhala přímo z vysílacího studia v Hotelu International online připojením. Po skončení konference byly všechny diskuzní náměty a připomínky zapracovány do textu této práce a naší snahou bylo předložit vám stávající stav řešených problémů reprodukční medicíny v ČR.
Jako i v předchozích letech uvádí některé letošní téma aktuální stav, postupy a trendy v jednotlivých centrech, jiné má konkrétní doporučení. Klinické téma času lékaře v ambulanci na pacientku, a jak s ní komunikuje embryolog, se po několika letech vrátilo a určitě si zaslouží další prostor. Tři genetická témata jsou dokladem narůstajícího požadavku na mezioborovou spolupráci reproduktologů s genetiky a onkology. Potřeba a význam monitorování hormonálních hladin ve stimulačních protokolech provází vývoj asistované reprodukce od samého počátku. Se zaváděním nových diagnostických vyšetření, léků, stimulačních protokolů i terapeutických možností a postupů a se současným voláním po individualizaci poskytované péče je diskuze na toto téma v popředí zájmu a nezbytná. Embryologické téma monitorování a výběru embryí pro transfer (ET) či kryokonzervaci je přetřásáno téměř čtvrt století a s novými technikami je rovněž stále významné a aktuální. Etickou a legislativní problematiku reprodukční medicíny zastupuje téma, zda není čas změnit zákon o odměňování dárců a dárkyň. Návrh naší odborné společnosti o zastropování platby za darovaná vajíčka na cca 1 000 € by mohl najít širokou podporu.
Věříme, že předložené teze a doporučení budou zajímavé a přínosné nejen pro odbornou, ale i laickou veřejnost. Naše práce navazuje na předchozí přehledy aktuálních témat a řešených problémů v reprodukční medicíně v ČR v letech 2012 a 2015 publikované v časopise Česká gynekologie [20,21].
Závěr
1. Kolik času má lékař v ambulanci CAR na pacientku a jak s klienty komunikuje embryolog? Nový neplodný pár vyžaduje minimálně 30 min za předpokladu, že s ním předtím koordinátorka nebo zdravotní sestra provede základní zápis do softwaru a probere základní údaje. V průměru je potřeba 20 min na pacientku v ambulanci lékaře. Embryolog komunikuje s pacientkami v ČR od nulové komunikace až po osobní kontakt.
2. Reprodukce a PGT-M u onkologických pacientů a pacientů v riziku s hereditárními onkogenními mutacemi. Těhotenství u pacientek po onkologické léčbě karcinomu prsu není spojeno se zvýšeným rizikem návratu onemocnění. Řízená ovariální stimulace je bezpečná metoda a není spojena s rizikem rekurence nádoru. Kryokonzervace embryí a oocytů jsou nejefektivnějšími metodami uchování fertility u onkologických pacientek.
3. Neinvazivní genetické testování embryí z kultivačního média. Informovanost o existenci a možnostech neinvazivního testování aneuploidií není velká. Řada odborníků uvažuje o možnosti použití metody, avšak existují pochybnosti o její specifitě a senzitivitě dané především nedostatečnou informací o původu DNA v kultivačním médiu.
4. Editace lidského genomu může v budoucnu výrazně zasáhnout do rozvoje zdravotnictví. Jde o velice kontroverzní metodu, kterou někteří odborníci zcela odmítají. Většina je ochotná v budoucnu akceptovat využití této metody pro experimentální účely a předcházení závažným genetickým chorobám.
5. Jaká je potřeba monitorování hormonálních hladin ve stimulačních protokolech? Tato otázka se opět dostala do popředí zájmu. Zejména se stále častějším odložením ET zvyšuje optimální nastavení reprodukčního cyklu úspěšnost asistované reprodukce. Racionální monitorování hormonálních hladin může výrazně ovlivnit klinické rozhodování a strategii léčby.
6. Monitoring a výběr embrya pro ET a kryokonzervaci je dnes standardem. Četné publikace prokazují zlepšení výsledků. Automatické hodnocení nemá často uspokojivou úroveň, vyhodnocení embryologem je nezbytné.
7. Nastal čas změnit zákon o odměňování dárců/ dárkyň? Naše odborná společnost SAR ČGPS ČLS JEP stejně jako MZ ČR doporučuje limit kompenzace za dárcovství vajíček 25 000 Kč a zahájit diskuzi o regulaci kompenzací pro náhradní matky v IVF cyklech.
Doručeno/ Submitted: 23. 2. 2021
Přijato/ Accepted: 26. 3. 2021
prof. MU Dr. Pavel Ventruba DrSc., MBA
Gynekologicko-porodnická klinika
LF MU a FN Brno
Jihlavská 20
602 00 Brno
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Dedikace: Práce vznikla za podpory projektu MZ ČR – RVO (FNBr 65269705) a projektu AZV MZ ČR č. NV-18-08-00412.
Dedication: The work was supported by the Ministry of Health of the Czech Republic – RVO (FNBr:65269705) and AZV (NV-18-08-00412).
Zdroje
1. Vuković P, Kasum M, Raguž J et al. Fertility preservation in young women with early-stage breast cancer. Acta Clin Croat 2019; 58(1): 147–156. doi: 10.20471/ acc.2019.58.01.19.
2. National Cancer Institute – Surveillance, Epidemiology and End Results Program. Cancer stat facts: female breast cancer. 2017 [online]. Available from: http:/ / seer.cancer.gov/ statfacts/ html/ breast.html.
3. Kasum M, Beketić-Orešković L, Orešković S. Subsequent pregnancy and prognosis in breast cancer survivors. Acta Clin Croat 2014; 53(3): 334–341.
4. Lambertini M, Del Mastro L, Pescio MC et al. Cancer and fertility preservation: international recommendations from an expert meeting. BMC Med 2016; 14 : 1. doi: 10.1186/ s12916-015-0545-7.
5. Blumenfeld Z. How to preserve fertility in young women exposed to chemotherapy? The role of GnRH agonist cotreatment in addition to cryopreservation of embryo, oocytes, or ovaries. Oncologist 2007; 12(9): 1044–1054. doi: 10.1634/ theoncologist.12-9-1044.
6. Yeung QS, Zhang YX, Chung JP et al. A prospective study of non-invasive preimplantation genetic testing for aneuploidies (NiPGT-A) using next-generation sequencing (NGS) on spent culture media (SCM). J Assist Reprod Genet 2019; 36(8): 1609–1621. doi: 10.1007/ s10 815-019-01517-7.
7. Lledo B, Morales R, Ortiz JA et al. Consistent results of non-invasive PGT-A of human embryos using two different techniques for chromosomal analysis. Reprod Biomed Online 2021; 42(3): 555–563. doi: 10.1016/ j.rbmo.2020.10.021.
8. Doudna JA. The promise and challenge of therapeutic genome editing. Nature 2020; 578(7794): 229–236. doi: 10.1038/ s41586-020-1978-5.
9. Lander ES, Baylis F, Zhang F et al. Adopt a moratorium on heritable genome editing. Nature 2019; 567(7747): 165–168. doi: 10.1038/ d415 86-019-00726-5.
10. Fauser BC, Devroey P. Reproductive biology and IVF: ovarian stimulation and luteal phase consequences. Trends Endocrinol Metab 2003; 14(5): 236–242. doi: 10.1016/ s1043-2760(03)00075-4.
11. Yovich J, Conceicao JL, Stanger JD. Mid-luteal serum progesterone concentration govern implantation rates for cryopreserved embryo transfers conducted under hormone replacement. Reprod Biomed Online 2015; 31(2): 180–191. doi: 10.1016/ j.rbmo.2015.05.005.
12. Thomsen LH, Kesmodel US, Erb K et al. The impact of luteal serum progesterone levels on live birth rates – a prospective study of 602 IVF/ ICSI cycles. Hum Reprod 2018; 33(8): 1506–1516. doi: 10.1093/ humrep/ dey226.
13. Lewis WH, Gregory PW. Cinematographs of living developing rabbit-eggs. Science 1929; 69(1782): 226–229. doi: 10.1126/ science.69. 1782.226-a.
14. Pribenszky C, Nilselid AM, Montag M. Time-lapse culture with morphokinetic embryo selection improves pregnancy and live birth chances and reduces early pregnancy loss: a meta-analysis. Reprod Biomed Online 2017; 35(5): 511–520. doi: 10.1016/ j.rbmo.2017.06.022.
15. Armstrong S, Bhide P, Jordan V et al. Time-lapse systems for embryo incubation and assessment in assisted reproduction. Cochrane Database Syst Rev 2019; 5(5): CD011320. doi: 10.1002/ 14651858.CD011320.pub4.
16. Reignier A, Girard JM, Lammers J et al. Performance of day 5 KIDScore™ morphokinetic prediction models of implantation and live birth after single blastocyst transfer. J Assist Reprod Genet 2019; 36(11): 2279–2285. doi: 10.1007/ s10815-019-01567-x.
17. Rumpíková T, Oborná I, Belasková S et al. The attitudes of IVF patients treated in the Czech Republic towards informing children born after gamete donation. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2018; 162(1): 26–31. doi: 10.5507/ bp.2017.050.
18. Rumpík D, Rumpíková T, Pohanka M et al. Gestational surrogacy in the Czech Republic. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2019; 163(2): 155–160. doi: 10.5507/ bp.2018.040.
19. Rumpík D, Rumpíková T, Ventruba P et al. Surogátní mateřství v České republice – naše praktické zkušenosti. In: Ptáček R, Bartůněk P (eds). Kontroverze současné medicíny. Praha: Mladá fronta 2016 : 89–94.
20. Ventruba P, Žáková J, Trávník P et al. Aktuální otázky asistované reprodukce v České republice. Ceska Gynekol 2013; 78(4): 392–398.
21. Ventruba P, Žáková J, Ješeta M et al. Současná témata reprodukční medicíny v České republice. Ceska Gynekol 2016; 81(3): 234–240
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2021 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Analýza vybraných perinatologických ukazovateľov v Slovenskej republike v rokoch 2007–2018
- “Bloodless surgery” a gynekologické pacientky hlásící se k víře Svědků Jehovových
- Obrovský fibroadenom prsu v těhotenství
- Poranění análního sfinkteru při porodu a anální inkontinence
- Současné možnosti prevence a terapie ovariálního hyperstimulačního syndromu
- Kvalita života a sexualita u žen s močovou inkontinencí
- Obštrukcia dolného močového traktu plodu: aktuálny prehľad možnosti intrauterinnej diagnostiky a liečby
- Řešená problematika reprodukční medicíny v České republice 2020
- Význam měření pupečníkového interleukinu-6, prokalcitoninu a C-reaktivního proteinu v diagnostice systémové zánětlivé odpovědi plodu
- Nový nástroj pro personalizaci ovariální stimulace: výsledky studie CERES při použití nového gonadotropinu – folitropinu delta
- Výsledky liečby gestačnej trofoblastovej neoplázie v Slovenskej republike v rokoch 1993–2017
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současné možnosti prevence a terapie ovariálního hyperstimulačního syndromu
- Obrovský fibroadenom prsu v těhotenství
- Poranění análního sfinkteru při porodu a anální inkontinence
- Nový nástroj pro personalizaci ovariální stimulace: výsledky studie CERES při použití nového gonadotropinu – folitropinu delta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



