-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Endovaskulární rekanalizace a zrychlení diagnostiky vede ke zlepšení výsledků léčby ischemických cévních mozkových příhod
Endovascular recanalization and fast diagnosis improve results of ischemic stroke therapy
The benefit of mechanical thrombectomy over intravenous thrombolysis was definitively proved by several studies in 2015. It is relevant for proximal, large artery occlusions in the anterior circulation with onset of clinical symptoms lasting 6 hours. Two trials published in 2018 showed that in patients who are selected using CT perfusion or MR diffusion weighted imaging, thrombectomy significantly improves outcome even up to 24 hours from onset. The benefit of the vertebrobasilar circulation, where occlusion of large arteries occurs in 7 % cases, has not been proved by randomised studies yet. However, mechanical thrombectomy is performed in this arterial territory because of very poor prognosis of nonrecanalized occlusions there.
Patients with acute ischemic stroke should be transferred to comprehensive stroke centres. These centres should provide parenchymal CT imaging and CT arteriography. These two modalities provide sufficient information to determine eligibility for endovascular treatment in the first 6 hours from stroke onset. Physicians performing endovascular therapy of stroke must be properly trained in clinical neuroscience, neuroimaging and neurointerventions. Success rate of this therapy depends on its organization which includes fast transport of patients, fast clinical and diagnostic evaluation, fast decisions, and availability of trained interventional team.
Keywords:
ischemic stroke, mechanical thrombectomy, stent retriever, neurointervention
Autoři: Antonín Krajina 1; Dagmar Krajíčková 2
Působiště autorů: Radiologická klinika LF UK a FN Hradec Králové 1; Neurologická klinika LF UK a FN Hradec Králové 2
Vyšlo v časopise: Čas. Lék. čes. 2018; 157: 188-194
Kategorie: Přehledový článek
Souhrn
V roce 2015 několik studií prokázalo zlepšení klinického výsledku léčby při použití mechanické trombektomie oproti intravenózní trombolytické léčbě při léčbě akutních ischemických mozkových příhod. Do studií byli zahrnuti pouze pacienti s uzávěry proximálních mozkových tepen v přední cirkulaci a se vznikem příznaků do 6 hodin. Další dvě studie publikované v roce 2018 prokázaly, že u pacientů indikovaných na základě perfuzního CT nebo difuzně vážené MR perfuze mechanická trombektomie zlepšuje klinický výsledek i do 24 hodin od vzniku příznaků. Ve vertebrobazilárním povodí, kde se uzávěry velkých tepen vyskytují zhruba v 7 % z celkového počtu léčených, nejvyšší stupeň evidence zatím chybí. Nicméně tyto výkony jsou pro špatnou prognózu u neléčených nemocných indikovány a prováděny bez ohledu na stupeň doporučení.
Pacienti s ischemickou mozkovou příhodou by měli být převezeni do center cerebrovaskulární péče k provedení nativního CT a CT angiografie. Tyto zobrazovací modality podávají dostatečnou informaci k indikování endovaskulární léčby do 6 hodin od vzniku příznaků. Lékaři, kteří provádějí tyto výkony, musejí mít dostatečnou erudici v neuroradiologii, neurologii a intrakraniální katetrizaci. Úspěšnost této léčby závisí na organizaci péče, zvláště na rychlém transportu, rychlosti klinického a diagnostického vyšetření, rychlosti rozhodnutí a dostupnosti zkušeného intervenčního týmu.
Klíčová slova:
ischemická cévní mozková příhoda, mechanická trombektomie, stent retriever, neurointervence
Úvod
Ischemická cévní mozková příhoda (iCMP) je ve středním a vyšším věku nejčastější příčinou invalidity a druhou nejčastější příčinou smrti. Snížení úmrtnosti na iCMP je multifaktoriální. Vedle zintenzivnění prevence a snížení kardiovaskulárního rizika k němu vedlo i zlepšení velmi časné péče o tyto pacienty (1).
iCMP je definována jako trvání neurologických příznaků více než 24 hodin. Zásadní pro účinnou léčbu je její časná diagnostika a léčba. Mezi nejzávažnější příznaky patří náhle vzniklá paréza končetin, postižení VII. hlavového nervu a fatická porucha. Vedle toho se iCMP může projevit vedlejšími příznaky, které musejí být přítomné alespoň dva, aby klinická diagnóza iCMP byla dostatečně specifická (2).
Příčinou iCMP je uzávěr mozkových tepen, který vede v postiženém povodí k nekróze mozkové tkáně. Ložisko nekrózy se časem zvětšuje v závislosti na dostatečnosti postranního řečiště, jež může více či méně dočasně udržovat ischemickou mozkovou tkáň vitální. Dostatečnost tohoto postranního řečiště je individuální a poskytuje tak různě dlouhý časový úsek pro provedení léčebného zákroku. Kauzální léčbou je rekanalizace uzavřené tepny.
Dle mechanismu vzniku uzávěru byly iCMP rozděleny na případy, kdy uzávěr vzniká při ateroskleróze velké tepny (ve 20–40 % všech případů), kdy se jedná o kardioembolický uzávěr (ve 20–30 % všech případů), kdy dochází k okluzivní nemoci malých tepen (v 15–25 % všech případů), kdy probíhá jako jiné infarkty známé etiologie (v 5 % všech případů) či jako infarkty neurčitelné etiologie (ve 20–40 % všech případů). U části nemocných se uplatní více než jedna z těchto příčin (3). Tento přehledový článek se bude zabývat pouze tzv. uzávěry velkých tepen, tedy mozkových tepen, jejichž uzávěr lze prokázat pomocí angiografie provedené výpočetní tomografií (CTA).
K zajištění akutní péče o nemocné s iCMP existuje v České republice od roku 2010 dobře fungující dvoustupňová síť cerebrovaskulárních center s danými kompetencemi (4) a byly vypracovány směrnice pro léčbu iCMP (5).
Historie léčby ischemických cévních mozkových příhod
Historie pokusů o rekanalizaci sahá do roku 1958, kdy byly publikovány 3 případy uzávěru intrakraniálních tepen. Poprvé bylo angiograficky dokumentováno uvolnění embolického uzávěru intravenózní infuzí plazminu (6). Zhruba o 20 let později si Herrmann Zeumer všiml, že v okamžiku uzávěru dojde k neurologickým projevům ischemie a tento stav se časem ještě zhoršuje. Progrese příznaků v čase vedla k myšlence možnosti terapeutického ovlivnění. Použitím intraarteriálního podání trombolytika navigovaného angiografií provedl první úspěšné rekanalizace akutních uzávěrů ve vertebrobazilárním povodí (7). Tato metoda se rozšířila a vedla k prospektivní randomizované studii PROACT (Prolyse in Acute Cerebral Thromboembolism), jež potvrdila pozitivní výsledky lokální intraarteriální infuze mikrokatétrem zavedeným k embolu (8). Objem krevní sraženiny však nedovolil u řady pacientů plnou rekanalizaci a rovněž infuze trvala 1–2 hodiny, během nichž byl přítok krve do ischemické mozkové tkáně nadále nedostatečný.
V roce 1994 Barnwell publikoval soubor pacientů, jejichž uzávěr byl léčen kombinací lokální trombolýzy a mechanickým rozrušením embolu pomocí mikrovodiče, čímž bylo dosaženo zvětšení povrchu krevní sraženiny. Její mechanické narušení působilo synergicky s lokálně podaným trombolytikem (9).
Dalším posunem bylo použití mikrolasa, zařízení k zachycení a vytažení cizích těles z cévního systému (10, 11). Krevní sraženina tak byla poprvé extrahována z mozkových tepen. Následně byla vyvinuta zařízení podobná pružné spirále – MERCI (Mechanical Embolus Removal in Cerebral Ischemia) (12), která byla zavedena přímo do trombu nebo za uzávěr a při stahování byl krevní tok dočasně zastaven nafouknutím balónku na konci pracovního katétru (13). Současnou aspirací během stahování zachyceného embolu bylo sníženo riziko jeho ztráty a reembolizace a navíc dočasným otočením toku krve ve vnitřní karotické tepně se zvýšila efektivita metody jako takové.
Později se retrahovatelný a odpoutatelný stent používaný k remodelaci tepen při léčbě mozkových aneuryzmat (13) ukázal jako efektivnější v záchytu embolů (14) než zařízení první generace a začal být používán tak masivně a účinně, že vedl k zásadnímu obratu v endovaskulární léčbě. Řada později vyvinutých zařízení má více či méně podobnou stavbu upoutaného snadno do mikrokatétru retrahovatelného stentu, který je rozepnut v místě uzávěru a měkký trombus se protlačí do lumen stentu a ve většině případů je pak vcelku extrahován. Při stahování rozepnutého stentu nedochází k významnému poškození endotelu tepen (15).
Další metodou, která se rozvinula paralelně s mechanickou trombektomií pomocí stent retrieverů, je aspirační trombektomie založená na možnosti zavést relativně široký katétr až do místa embolu a podtlakem ho nasát (16).
V roce 2013 byly publikovány tři randomizované studie, jejichž výsledky nepotvrdily významný klinický efekt v endovaskulárně léčené skupině oproti nemocným léčeným intravenózním podáním trombolytik (17–19).
Až zrychlení jak diagnostiky, tak přesunu pacienta umožnilo v randomizovaných kontrolních studiích prokázat, že mechanická trombektomie vede k významně lepšímu klinickému výsledku po 90 dnech než doposud standardní intravenózní podání tkáňového aktivátoru plazminogenu (20–24). Potvrdily to i jejich metaanalýzy (25, 26). Následně byla tato metoda zapracována do směrnic pro léčbu iCMP jak americkými, tak i evropskými odbornými společnostmi (27–30).
Hodnocení pacienta před léčbou a po léčbě
K rychlé komunikaci mezi lékaři různých odborností byly vypracovány škály hodnocení tíže neurologického deficitu (NIHSS – National Institutes of Health Stroke Scale) (31), k hodnocení klinického výsledku, ale i stavu pacienta před vznikem iktu se používá modifikovaná Rankinova škála (mRS). Skóre ≤ 2 značí soběstačnost (32).
K hodnocení nativního vyšetření mozku pomocí CT se používá skóre Alberta Stroke Program Early CT Sign (ASPECTS). Je založeno na hypodenzitách a smazání rozlišení bílé a šedé mozkové hmoty v 10 oblastech v povodí střední mozkové tepny. Relativně malé okrsky v hloubce hemisféry, jejichž infarkt vede k těžkému deficitu, jsou stavěny na roveň daleko větším úsekům mozkové kůry ve dvou úrovních – v úrovni bazálních ganglií a nad ní (33).
K lokalizaci uzávěru mozkové tepny je standardně využívána CT angiografie (CTA). Tato vyšetřovací metoda hodnotí extra - a intrakraniální tepenné řečiště a lokalizuje tepenný uzávěr. K endovaskulární léčbě je vhodný tzv. uzávěr velké tepny (dle frekvence sestupně: M1 pro úsek a. cerebri media; M2 pro úsek a. cerebri media, intrakraniální a. carotis interna; současný, tzv. tandemový uzávěr extrakraniální a. carotis interna a M1; uzávěry a. basilaris a a. cerebri posterior). Modifikací CTA je tzv. třífázová CTA, která navíc přináší informaci o průtoku tepnami v ischemické zóně, kde je průtok zpomalen (34,35). CTA v jedné fázi neposkytuje informaci o tom, zda se tepny za uzávěrem vůbec plní.
K hodnocení perfuzního vyšetření (CTP), kdy jsou měřeny různé parametry rychlosti a objemu průtoku intravenózně podané jódové kontrastní látky v mozkové tkáni, byla vypracována kritéria hodnocení pro tkáň nekrotickou, tkáň s významně sníženou perfuzí (tzv. zachranitelná zóna ischémie po obnovení přímého arteriálního zásobení) a zóna tzv. benigní hypovolémie. K hodnocení stupně rekanalizace na konci endovaskulárního výkonu byla zavedena stupnice TICI (Trombolysis In Cerebral Infarction) (36).
K hodnocení rychlosti jednotlivých kroků byly stanoveny maximální časové limity transportu uvnitř centra, k provedení CT vyšetření, k provedení punkce femorální tepny a rovněž časy do dosažení maximální rekanalizace. Tyto časové údaje jsou pak součástí zdravotnické dokumentace a jsou pravidelně vyhodnocovány v programech kvality daného centra (29, 30). Dále byly stanoveny minimální požadavky na erudici a vzdělání lékařů provádějících katetrizační léčbu iCMP. Tak jako ve všeobecných směrnicích přijatých většinou světových odborných společností (37) i v České republice je požadována doložená znalost a praxe v neuroradiologii, neurologii a intervenční radiologii (38).
Protokol diagnostického zobrazení
Všeobecné diagnostické zobrazení je efektivní, když vede ke změně léčby, která zlepšuje klinický výsledek. Nativní CT je významně efektivní u podezření na iCMP, protože vyloučí pacienty s krvácením. V 50 % případů by CT mělo být provedeno do 20 minut od jejich přijetí. Nativní CT provedené do 4,5 hodiny od vzniku příznaků by mělo dostačovat k rozhodnutí o podání intravenózní trombolýzy, kterou by další kontrastní CT vyšetření nemělo oddálit (29).
CTA je indikovaná bez ohledu na renální funkce (sérovou hladinu kreatininu) a musí zobrazit vedle intrakraniálních tepen i tepny od úrovně aortálního oblouku (obr. 1). CTP u pacientů s iCMP s příznaky trvajícími < 6 hodin není doporučeno (29). CTP je indikované u pacientů s neznámou dobou vzniku příznaků nebo s příznaky trvajícími > 6 hodin. Zde je možné na základě nativního CT, CTA a CTP indikovat nemocné s pomalou progresí iCMP k revaskularizačnímu výkonu v období až do 24 hodin (29).
Obr. 1. CT angiografie pacienta s akutním uzávěrem střední mozkové tepny vpravo 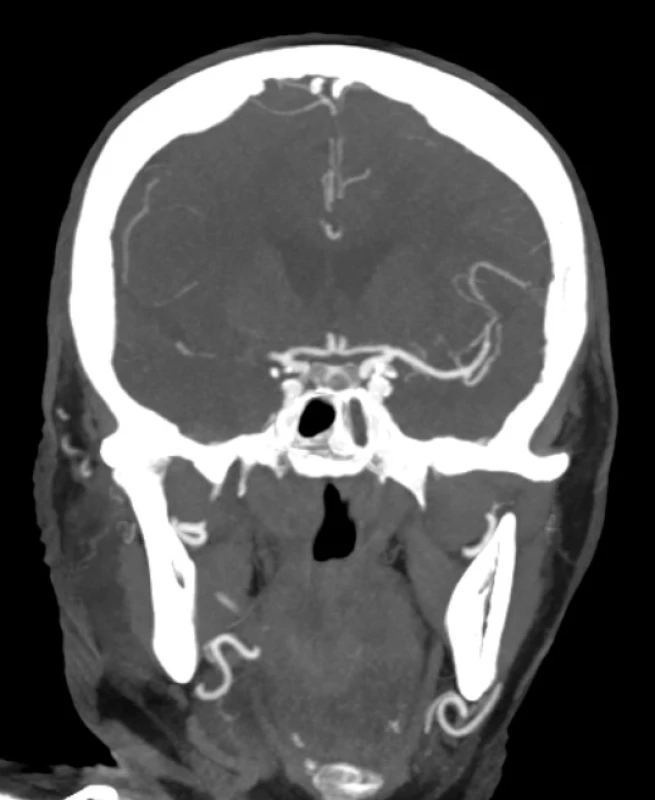
Všeobecná strategie CT vyšetření mozku a průchodnosti mozkových tepen je založena na principu co nejrychleji a nejjednodušeji zobrazit aktuální rozsah ischémie a úroveň tepenného uzávěru.
Při rychlém stanovení ASPECTS se nově uplatňují softwarové programy a odečítání CT vyšetření na dálku – teleradiologie, jež může zčásti nahradit přítomnost zkušeného radiodiagnostika k zajištění nepřetržité služby (39).
Obr. 1 CT angiografie pacienta s akutním uzávěrem střední mozkové tepny vpravo
Mechanická trombektomie
Mechanická trombektomie je prováděna v návaznosti na CT vyšetření v nepřetržitém provozu. Obvyklý tým lékař, dvě asistující sestry a radiologický asistent je neurologem uvědomen předem, stejně jako anesteziologický tým zajišťující životní funkce a sedaci ke zklidnění nemocného, či dokonce intubační anestezii, pokud je pacient nestabilní, nespolupracující nebo se u něj objevilo riziko aspirace. Vždy je nutno udržovat systolický krevní tlak v úrovni mezi 140 a 180 mmHg. Při déletrvající hypotenzi se ischémie prohlubuje rychleji, stejně jako při hyperglykémii > 14 mmol/l, kterou je třeba korigovat. Na ostatní laboratorní vyšetření se nedoporučuje čekat (29).
Výkon se nejčastěji provádí katétrem zavedeným z femorální tepny do postiženého řečiště s jeho nástřikem, optimálně na dvojprojekční angiografické lince (obr. 2). Následně je zaveden pracovní katétr s balónkem na konci do extrakraniálního úseku vnitřní karotické tepny. Jeho šíře je volena dle průměru tepny, její vinutosti a přítomnosti ateromatózního postižení. Tímto katétrem je zaveden mikrokatétr, který je pomocí mikrovodiče navigován skiaskopicky až za úroveň uzávěru (obr. 3). Dle směrnic by měl být přednostně použitým zařízením stent retriever (29). Někteří operatéři upřednostňují aspirační trombektomii, pokud jsou přístupové tepny přímé a poddajné.
Obr. 2. Angiografie provedená na počátku mechanické trombektomie u stejného pacienta 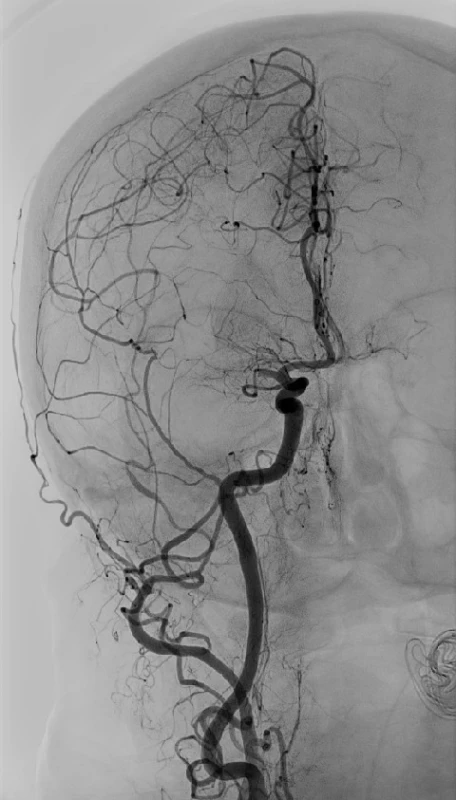
Obr. 3. Částečně obnovená perfuze střední mozkové tepny po zavedení stent retrieveru. V této pozici je upoutaný stent ponechán několik minut a pak je za kontroly skiaskopie a zastavení toku naplněním balónku na konci pracovního katétru vytažen. Zároveň je přes pracovní katétr vytvářen podtlak a aspirována krev z přívodné tepny. 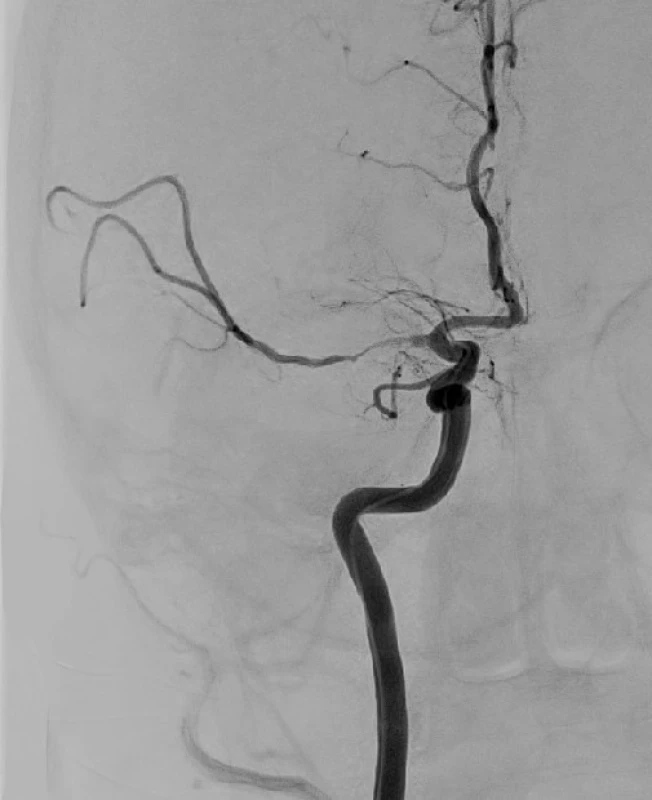
Při stahování stent retrieveru je balónek na konci pracovního katétru naplněn tak, aby uzavřel tepnu. Během stahování upoutaného stentu se zachycenou krevní sraženinou za skiaskopické kontroly je přes postranní rameno pracovního katétru vytvářen podtlak 20 ml injekční stříkačkou až do doby vtažení stentu do lumen katétru. Pak je stent vytažen a z pracovního katétru volně vytéká krev nebo ji lze volně aspirovat připojenou injekční stříkačkou. Následně je balónek desuflován a je provedena kontrolní angiografie ve dvou projekcích (obr. 4 a 5). Po obnovení plné průchodnosti tepen obvykle snižujeme systolický tlak k prevenci hyperperfuzního syndromu. Místo vpichu je ošetřeno uzavíracím zařízením. Pacient je dle stavu extubován co nejdříve a do 24 hodin je provedeno kontrolní CT vyšetření.
Obr. 4. a 5 Kontrolní angiografie s plným obnovením toku (TICI 3) v zadopřední a boční projekci 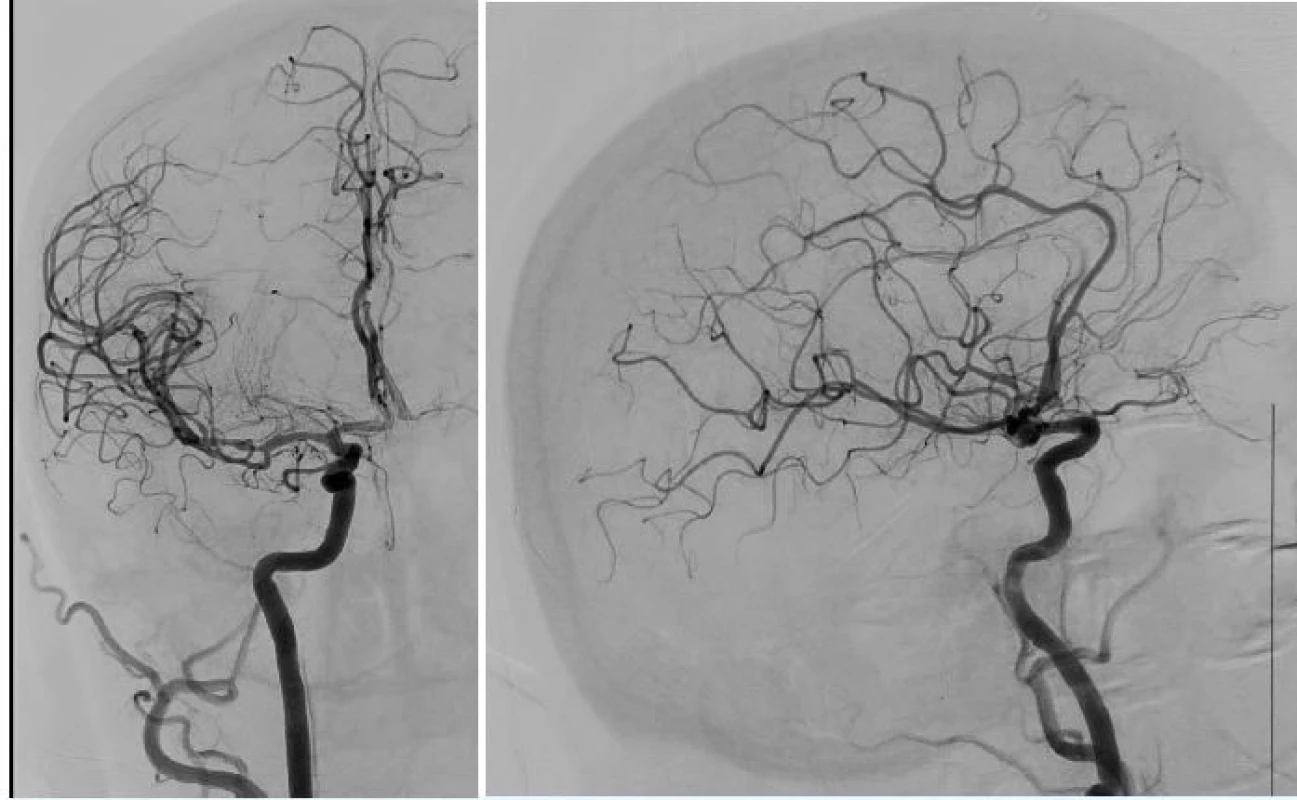
Efektivita zařízení s přihlédnutím k lokálním anatomickým poměrům, jako je vinutost přístupových tepen a jejich rigidita u starších nemocných, je hodnocena dle výsledku po prvním stažení stent retrieveru (obr. 6) (40). Selhání může být způsobeno tím, že uzávěr není embolický, ale je následkem trombózy nasedající na stenózu. Zde se tepna po protažení stent retrieveru znovu uzavírá a je nutné zavést intrakraniální stent (41, 42) Zavedení stentu, ať extrakraniální či intrakraniální, vyžaduje různě intenzivní antikoagulační léčbu. Endovaskulární manipulací v mozkových tepnách může dojít k jejich perforaci (43) a k dalším komplikacím (44).
Výsledky endovaskulární léčby
Současnou praxi v endovaskulární léčbě může charakterizovat registr spíše než studie, ve kterých byla uplatňována více či méně různá selekce nemocných. Registr Trevo (Thrombectomy Revascularization in Large Vessel Occlusion) je největším z nich a naše pracoviště se na něm podílela (45). Zahrnul 2008 nemocných léčených v 76 centrech v letech 2014–2017. Medián neurologického deficitu dle NIHSS činil 18, v registru bylo 54,7 % pacientů s uzávěrem M1, 18,7 % s uzávěrem M2, 17,8 % s uzávěrem vnitřní krkavice a 7,1 % s uzávěrem v zadní cirkulaci. Medián času od vzniku příhody do přijetí do nemocnice byl 180 minut. S použitím stent retrieveru Trevo (Stryker, USA) bylo dosaženo rekanalizace TICI 2b a 3 v 63 % případů při prvním zavedení a po více zavedeních (v průměru 1,7) v 92,8 %, s mediánem trvání výkonu 33 minut. Medián času od vzniku příhody do revaskularizace činil 277 minut. Funkční nezávislosti ve 3 měsících bylo dosaženo u 55,2 % pacientů. Ve skupině 143 pacientů tohoto registru s iCMP ve vertebrobazilární cirkulaci bylo dosaženo nezávislosti ve 3 měsících v 51,8 % případů. Celková mortalita v registru činila 14 % v 90 dnech léčby (45).
Výsledky endovaskulární léčby vyjádřené mRS v 90 dnech závisejí na faktorech, jež lze ovlivnit, a dále na těch, které ovlivnit nelze, jako věk, tíže neurologického deficitu před léčbou, doba trvání příznaků a komorbidity pacienta. Mezi faktory, které ovlivnit lze, patří doba vyšetřovacího procesu, rychlost transportu v rámci centra, rychlost a úspěšnost endovaskulární rekanalizace. Jak již bylo zmíněno, hyperglykémie a hypotenze mají rovněž negativní vliv na průběh akutní ischémie. Strategie postupu je zde založena na principu, že po dobu od přijetí pacienta – dokud není vyloučena indikace k revaskularizační léčbě – nesmí dojít k žádné časové prodlevě.
Významně vyšší efekt endovaskulární léčby oproti intravenózní trombolytické léčbě u uzávěrů velkých tepen v přední cirkulaci byl dokázán několika kvalitními prospektivními randomizovanými studiemi (20–25). Ve vertebrobazilárním povodí, kde se uzávěry velkých tepen vyskytují zhruba v 7 % z celkového počtu léčených, nejvyšší stupeň evidence zatím chybí. Nicméně tyto výkony jsou pro špatnou prognózu u neléčených nemocných indikované a prováděné bez ohledu na stupeň doporučení (46).
V České republice je péče o pacienty s iCMP organizována jejich transportem rychlou záchrannou službou na pracoviště patřící do sítě iktových center (4), která jsou akreditována pro diagnózu pomocí CT a možnost podání intravenózní trombolýzy v případě splnění indikačních kritérií. Pacienti, kteří u kterých je potvrzen uzávěr velké tepny na základě CTA a splňují kritéria pro endovaskulární léčbu, jsou neprodleně transportováni do center vysoce specializované cerebrovaskulární péče (CVSCVP), která jsou povinna je přijmout. CVSCVP pracují současně i jako iktová centra pro svůj spád. Je vysoce pravděpodobné, že pokud by byl nemocný na základě klinického vyšetření diagnostikován jako vysoce suspektní z hlediska uzávěru velké tepny (47), byl by transport přímo do vyššího centra s výhodou vzhledem k ušetření času (48).
Rychlost šíření nekrózy závisí na mohutnosti kolaterál. V závislosti na jejich dostatečnosti lze určit na základě CTA – a ještě specifičtěji třífázové CTA – pacienty s dobrými kolaterálami, a tedy tzv. pomalé progresory, a pacienty s malými kolaterálami, které je možné označit za rychlé progresory. Reprezentanty pomalých progresorů jsou nemocní s tandemovými uzávěry. Zde dlouhodobá přítomnost extrakraniální stenózy vede k jejich otevření a hypertrofii a v okamžiku vzniku uzávěru extrakraniální krkavice a současné embolizace do střední mozkové tepny se ischémie šíří pomaleji. Druhým extrémem jsou tzv. T uzávěry intrakraniální vnitřní krkavice, která je uzavřena spolu s počátečními úseky přední a střední mozkové tepny. Kolaterály se zde uplatňují jen minimálně a nekróza se šíří rychle. Výsledky studií mohou být ovlivněny proporcemi těchto odlišných skupin pacientů, tedy selekcí nemocných s upřednostněním těch s lepší prognózou.
Z daného vyvozujeme, že čas šíření nekrózy plyne každému pacientovi různě rychle. Další studie potvrdily příznivý efekt rekanalizace v časovém období 6–16 i 6–24 hodin (49, 50). Výběr pacientů v těchto časových oknech probíhal dle perfuzních vyšetření s průkazem zachranitelné tkáně. V klinické praxi se takto nastavená kritéria týkají jen malé skupiny nemocných (51, 52).
Kromě času do rekanalizace se na příznivém výsledku přímo úměrně uplatňuje stupeň rekanalizace hodnocený škálou TICI. Během stahování embolů či jejich aspirace může dojít k jejich rozdrobení a embolizaci po krevním proudu do větví původně proximálně uzavřené větve nebo do a. cerebri anterior či a. cerebri posterior, pokud dominantně odstupuje z vnitřní krkavice. Dále může část embolu zůstat v místě původního uzávěru. Vzácně se může jednat o trombózu nasedající na stenózu intrakraniální krkavice nebo střední mozkové tepny.
Toto vše jsou faktory ovlivňující stupeň rekanalizace. Reembolizace je nezávislými hodnotiteli konečné angiografie nalezena až v 15 % případů. TICI 3 a TICI 2b rekanalizace je dosaženo až v 90 % případů. Rozdíly mezi jednotlivými typy stent retrieverů nejsou významné, rovněž aspirační techniky nejsou úspěšnější ve srovnání se stent retrievery, u nichž je vyšší stupeň evidence. Příznivě se na stupni rekanalizace podílí použití balónkového pracovního katétru, a to jednak omezením rizika reembolizace, jednak možností použít efektivní aspiraci (13).
Krvácení do ischémie po rekanalizační léčbě je relativně časté. Bývá většinou bez dalšího zhoršení neurologického stavu, pokud se jedná o krvácení typu hemoragické infarzace typu 1 a 2. Vývoj expanzivního hematomu typu 1 a 2 je většinou symptomatický a vede ke zhoršení průběhu iCMP a výsledku léčby. Na vznik symptomatického krvácení má vliv rozsah nekrózy, podaná intravenózní trombolýza, nekorigovaná hypertenze a vyšší věk.
Poslední skupinou faktorů ovlivňujících výsledek jsou komorbidity nemocného včetně přidružených klinických komplikací iCMP.
Je logické, že nemocní vyššího věku budou mít i po úspěšné rekanalizaci nižší šanci na soběstačnost po léčbě. Ve výše citovaném registru Trevo bylo funkční nezávislosti dosaženo v 62,2 % případů u pacientů mladších 80 let, oproti tomu ve skupině nad 80 let bylo soběstačnosti dosaženo pouze ve 33,7 % (45). Podobný vztah nepřímé úměry mezi dobrým výsledkem a zvyšujícím se věkem byl potvrzen i v dalších registrech a metaanalýzách.
Alespoň dvě studie prokázaly přímý vliv na časový interval od příjezdu do nemocnice do provedení CT, nikoliv na čas od vzniku iktu do příjezdu do centra a na výsledek léčby (53). Vysvětlení může spočívat ve vyřazování nemocných, kteří nesplňují indikační kritéria pro léčbu (tzv. time reset fenomén) (54).
Další vývoj endovaskulární léčby
V současnosti jsou naplánovány studie zjišťující přínos časné rekanalizace u pacientů s rozsáhlou časnou ischémií na CT – ASPECTS 3–5. Cílem studie TENSION (Efficacy and Safety of Thrombectomy in Stroke with Extended Lesion and Extended Time Window), která je podpořena Evropskou unií, je vedle soběstačnosti (mRS ≤ 2) i hodnocení rozdílu v zastoupení ve vyšších stupních Rankinovy škály (mRS > 2) (55).
Dále bude optimalizován diagnostický proces a vytvářena síť akreditovaných center. V tomto ohledu je péče v České republice díky cerebrovaskulární sekci České neurologické společnosti ČLS JEP a sekci intervenční neuroradiologie České společnosti intervenční radiologie ČLS JEP velmi dobře zorganizována (56, 57).
Další studie ukáží možnosti slibné prosté aspirační trombektomie, kterou – jak naznačuje současná studie – lze dosáhnout zrychlení rekanalizace (58). Otázkou je, zda bude výhodné preferovat přímo mechanickou trombektomii a za určitých podmínek vynechat intravenózní trombolýzu (59). Rovněž zvýšení evidence pro endovaskulární léčbu ve vertebrobazilárním řečišti bude objasněno probíhajícími studiemi (60). Ve studiu vzniku a prevence kardioembolické iCMP sehraje roli zkoumání embolů extrahovaných z mozkového řečiště (61, 62).
Závěr
Zrychlení diagnostického procesu, jeho standardizace a průkaz jednoznačného zlepšení klinického výsledku použitím mechanické trombektomie oproti samotné intravenózní léčbě iCMP vedly k zásadní změně strategie léčby pacientů s ischemickým iktem. Díky časně zavedené organizaci péče o pacienty s iCMP je Česká republika na jednom z předních míst zemí Evropské unie v počtu endovaskulárně léčených nemocných na 1 milion obyvatel (56).
Dedikace
Autoři věnují tento článek doc. MUDr. Zdeňkovi Černochovi, CSc. (1924–2001), významnému českému neuroradiologovi.
Prohlášení o střetu zájmů
Prof. MUDr. Antonín Krajina, CSc., EBIR, působí jako hlavní vyšetřující registru Trevo sponzorovaného Stryker Neurovascular v České republice, člen řídicího výboru registru Trevo a spoluřešitel výzkumných grantů AZV MZ ČR No 17-31016A a 16-30965A.
Seznam zkratek
ASPECTS - Alberta Stroke Program Early CT Sign
CT - výpočetní tomografie
CTA - CT angiografie
CTP - CT perfuze
iCMP - ischemická cévní mozková příhoda
MERCI - Mechanical Embolus Removal in Cerebral Ischemia
mRS - modifikovaná Ranskinova škála
NIHSS - National Institutes of Health Stroke Scale
PROACT - Prolyse in Acute Cerebral Thromboembolism
TENSION - Efficacy and Safety of Thrombectomy in Stroke with Extended Lesion and Extended Time Window
TICI - Thrombolysis In Cerebral Ischemia
TREVO - Thrombectomy Revascularization in Large Vessel Occlusion
Adresa pro korespondenci
prof. MUDr. Antonín Krajina, CSc., EBIR
Radiologická klinika LF UK a FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
Tel.: 495 836 201
E-mail: antonin.krajina@fnhk.cz
Zdroje
1. Jauch EC, Saver JL, Adams HP et al. Guidelines for the early management of patients with acute ischemic stroke. Stroke 2013; 44 : 870–947.
2. MZ ČR. Péče o pacienty s cerebrovaskulárním onemocněním v České republice. Věstník MZ ČR 2010, částka 2.
3. Ornello R, Degan D, Tiseo C et al. Distribution and temporal trend from 1993 to 2015 of ischemic stroke subtypes. A systematic review and metaanalysis. Stroke 2018; 49 : 814–819.
4. MZ ČR. Péče o pacienty s akutní cévní mozkovou příhodou. Věstník MZ ČR 2012, částka 10.
5. Kolektiv autorů. Doporučení pro rekanalizační léčbu akutního mozkového infarktu – verze 2016. Česká a slovenská neurologie a neurochirurgie 2016; 79/112(2): 231–234.
6. Sussman BJ, Fitch TSP, Plainfield NJ. Thrombolysis with fibrinolysin in cerebral arterial occlusion. JAMA 1958; 167 : 1705–1709.
7. Zeumer H, Hacke W, Kolman HL, Poeck K. Lokale Fibrinolysetherapie bei Basilaris Thrombose. Dtsch med Wochenschr 1982; 107(19), 728–731.
8. Furlan A, Higashida R, Wechsler L et al. The PROACT II study: a randomized controlled trial. Prolyse in acute cerebral thromboembolism. JAMA 1999; 282(21): 2003–2011.
9. Barnwell SL, Clark WM, Nguyen TT et al. Safety and efficacy of delayed intraarterial urokinase therapy with mechanical clot disruption for thromboembolic stroke. AJNR 1994; 15(10): 1817–1822.
10. Chopko BW, Kerber C, Wong W, Georgy B. Transcatheter snare removal of acute middle cerebral artery thromboembolism: technical case report. Neurosurgery 2000; 46 : 1529–1531.
11. Krajina A, Krajíčková D, Špriňar Z a kol. Mechanická perkutánní extrakce embolu při akutní cévní mozkové příhodě: kasuistika a přehled literatury. Česká a slovenská neurologie a neurochirurgie 2005; 65/101 : 51–57.
12. Smith WS, Sung G, Starkman S et al. Safety and efficacy of mechanical embolectomy in acute ischemic stroke. Results of the MERCI trial. Stroke 2005; 36 : 1432–1440.
13. Nguyen TN, Malisch T, Castonguay AC et al. Balloon guide catheter improves revascularization and clinical outcomes with the Solitaire device. Analysis of the North American Solitaire Acute Stroke registry. Stroke 2014; 45 : 141–145.
14. Nogueira RG, Lutsep HL, Gusta R et al. TREVO versus MERCI retrievers for thrombectomy revascularisation of large vessel occlusions in acute ischaemic stroke (TREVO 2): a randomised trial. Lancet 2012; 380 : 1231–1240.
15. Power S, Matouk C, Casoubon LK et al. Vessel wall magnetic resonance imaging in acute ischemic stroke. Effects of embolism and mechanical thrombectomy on arterial wall. Stroke 2014; 45 : 2330–2334.
16. Turk AS, Spiotta A, Frei D et al. Initial clinical experience with the ADAPT technique: a direct aspiration first pass technique for stroke thrombectomy. J Neurointerv Surg 2014; 6 (3): 231–237.
17. Broderick JP, Palesch YY, Demchuk AM et al. Endovascular therapy after intravenous t-PA versus t-PA alone for stroke. N Engl J Med 2013; 368 : 893–903.
18. Kidwell CS, Jahan R, Saver JL. Endovascular treatment for acute ischemic stroke. N Engl J Med 2013; 368 : 2434–2435.
19. Ciccone A, Valvassori L, Nichelatti M et al. Endovascular treatment for acute ischemic stroke. N Engl J Med 2013; 368 : 904–913.
20. Berkhemmer OA, Fransen PS, Beumer D et al.; MR CLEAN Investigators. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med 2015; 372 : 11–20.
21. Goyal M, Demchuk AM, Menon BK et al.; the ESCAPE Trial Investigators. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015; 372 : 1019–1030.
22. Campbell BC, Mitchell PJ, Kleinig TJ et al.; EXTEND-IA Investigators. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med 2015; 372 : 1009–1018.
23. Saver JL, Goyal M, Bonafe A et al.; SWIFT PRIME Investigators. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. N Engl J Med 2015; 372 : 2285–95.
24. Jovin TG, Chamorro A, Cobo E et al.; REVASCAT Trial Investigators. Thrombectomy within 8 hours after symptom onset in ischemic stroke. N Engl J Med 2015; 372 : 2296–306.
25. Saver JL, Goyal M, van der Lught A et al.; the HERMES Collaborators. Time to treatment with endovascular thrombectomy and outcomes from ischemic stroke: a metaanalysis. JAMA 2016; 316(12): 1279–1288.
26. Goyal M, Menon BK, van Zwam WH et al. Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomised trials. Lancet 2016; 387 (10029): 1723–1731.
27. Powers WJ, Derdeyn CP, Biller J et al. Focused update of the 2013 Guidelines for the early management of patients with acute ischemic stroke regarding endovascular treatment: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2015; 46 : 3020–3035.
28. Wahlgren N, Moreira T, Michel P et al; ESO-LSU, ESO, ESMINT, ESNR and EAN. Mechanical thrombectomy in acute ischemic stroke: consensus statement by ESO – Karolinska Stroke Update 2014/2015, supported by ESO, ESMINT, ESNR and EAN. Int J Stroke 2016; 11 : 134–147.
29. Powers WJ, Rabinstein AA, Ackerson T et al. 2018 Guidelines for the early management of patients with acute ischemic stroke. Stroke 2018; 49 : 1–65.
30. Sacks D, Baxter B, Campbell BCV et al. Multisociety consensus quality improvement revised consensus statement for endovascular therapy of acute ischemic stroke. J Vasc Interv Radiol 2018; 29 : 441–453.
31. Goldstein LB, Samsa GP. Reliability of the National Institute of Health Stroke Scale. Extension to non-neurologists in the context of a clinical trial. Stroke 1997; 28 : 307–310.
32. Dijkland SA, Voormolen DC, Venema E et al. Utility-weighted modified Rankin scale as primary outcome in stroke trials. A simulation study. Stroke 2018; 49 : 965–971.
33. Barber PA, Demchuk AM, Zhang J et al. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy: ASPECTS Study Group – Alberta Stroke Programme Early CT Score. Lancet 2000; 355 : 1670–1674.
34. Menon BK, d’Esterre CHD, Oazi EM et al. Multiphase CT angiography: a new tool for the imaging triage of patients with acute ischemic stroke. Radiology 2015; 275(2): 510–520.
35. Volný O, Cimflová P, Kadlecová P et al. Single-phase versus multiphase CT angiography in middle cerebral artery clot detection – benefits for less experienced radiologists and neurologists. J Stroke Cerebrovasc Dis 2017; 26(1): 19–24.
36. Yoo AJ, Simonsen CZ, Prabhakaran S et al. Cerebral Angiographic Revascularization Grading Collaborators. Refining angiographic biomarkers of revascularization. Improving outcome prediction after intra-arterial therapy. Stroke 2013; 44 : 2509–2512.
37. Fiehler J, Cognard C, Gallitelli M et al. European recommendations on organisation of interventional care in acute stroke (EROICAS). Int J Stroke 2016; 11(6): 701–716.
38. Krajina A, Krajíčková D. Role neuroradiologa v léčbě ischemických cévních mozkových příhod. Česká radiologie 2015; 69(2): 87–92.
39. Meyer BC. Telestroke evolution: from maximization to optimization. Stroke 2012; 43 : 2029–2030.
40. Zaidat OO, Castonguay AC, Linfante I et al. First pass effect. A new measure for stroke thrombectomy devices. Stroke 2018; 49 : 660–666.
41. Chang Y, Kim BM, Band OY et al. Rescue stenting for failed mechanical thrombectomy in acute ischemic stroke. Stroke 2018; 49 : 958–964.
42. Fiehler J. Failed thrombectomy in acute ischemic stroke. Return of the stent? Stroke 2018; 49 : 811–812.
43. Leishangthem L, Satti SR. Vessel perforation during withdrawal of Trevo ProVue stent retriever during mechanical thrombectomy for acute ischemic stroke. J Neurosurg 2014; 121 : 995–998.
44. Behme D, Gondecki L, Fiethen S et al. Complication of mechanical thrombectomy for acute ischemic stroke – a retrospective single-center study of 176 cases. Neuroradiol 2014; 56 : 467–476.
45. Binning MJ, Bartolini B, Baxter B et al. Trevo 2000: Results of the largest real-world registry for stent retriever for acute ischemic stroke. Stroke 2018; 49, in press.
46. Schonewille WJ, Wijman CA, Michel P et al.; BASICS Study Group. Treatment and outcomes of acute basilar artery occlusion in the Basilar Artery International Cooperation Study (BASICS): a prospective registry study. Lancet Neurol 2009; 8 : 724–730.
47. Gall S, Demchuk A. Clinical and technological approaches to the prehospital diagnosis of large vessel occlusion. Stroke 2018; 49 : 1036–1043.
48. Krajíčková D, Krajina A, Vítková E a kol. Zabezpečí současná logistika nemocným s akutním uzávěrem velké tepny v přední cirkulaci stejnou šanci na dobrý výsledek? Česká a slovenská neurologie a neurochirurgie 2018; 81/114(3): 338–344.
49. Albers GW, Marks MP, Kemp S et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging. N Engl J Med 2018; 378 : 708–718.
50. Nogueira RG, Jadhav AP, Haussen DC et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018; 378 : 11–21.
51. Jadhav A P, Desa SM, Kenmuir CL et al. Eligibility for endovascular trial enrollment in the 6 - to 24-hour time window. Stroke 2018; 49 : 1015–1017.
52. Saposnik G, Strbian D. Enlightenment and challenges offered by DAWN Trial (DWI or CTP assessment with clinical mismatch in the triage of wake up and late presenting strokes undergoing neurointervention with Trevo). Stroke 2018; 49 : 498–500.
53. Ribo M, Molina CA, Cobo E et al. Association between time to reperfusion and outcome is primarily driven by the time from imaging to reperfusion. Stroke 2016; 47 : 999–1004.
54. Fiehler J. The time-reset effect. Thrombectomy trials challenge the existence of a time window. Clin Neuroradiol 2017; 27 : 3–5.
55. Bendszus M, Bonekamp S, Berge E et al. A randomized controlled trial to test efficacy and safety of thrombectomy in stroke with extended lesion and extended time window (TENSION). Int J Stroke 2018, in press.
56. Volný O, Krajina A, Belasková S et al. Mechanical thrombectomy performs similarly in real world practice: a 2016 nationwide study from the Czech Republic. J Neurointervent Surg 2018; 10(8): 741–745.
57. Krajina A, Roček M, Köcher M a kol. Vývoj počtu endovaskulárních neurointervenčních metod v České republice v letech 2013–2016. Česká radiologie 2017; 71(2): 110–115.
58. Lapergue B, Blanc R, Gory B et al. Effect of endovascular contact aspiration vs stent retriever on revascularization in patients with acute ischemic stroke and large vessel occlusion. The ASTER randomized clinical trial. JAMA 2017; 318(5): 443–452.
59. Fischer U, Kaesmacher J, Molina C A et al. Primary thrombectomy in tPA (tissue-type plasminogen activator) eligible stroke patients with proximal intracranial occlusions. Stroke 2018; 49 : 265–269.
60. Saber Tehrani AS, Kattah JC, Kerber KA et al. Diagnosing stroke in acute dizziness and vertigo. Pitfalls and pearls. Stroke 2018; 49 : 788–795.
61. De Meyer SF, Andersson T, Baxter B et al. Analyses of thrombi in acute ischemic stroke: A consensus statement on current knowledge and future directions. Int J Stroke 2017; 12(6): 606–614.
62. Krajičková D, Krajina A, Šteiner I et al. Fibrin clot architecture in acute ischemic stroke treated with mechanical thrombectomy with stent-retrievers – cohort study. Circ J 2018; 82 : 866–873.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
-
Všechny články tohoto čísla
- Úvodem
- Zobrazovací metody 21. století
- Hybridní zobrazení PET/MR u karcinomu prostaty
- Ultrazvukové vyšetření s kontrastní látkou
- CT angiografie koronárních tepen – současné možnosti a budoucí perspektivy v diagnostice ischemické choroby srdeční
- Klinická kardiologie
- Endovaskulární rekanalizace a zrychlení diagnostiky vede ke zlepšení výsledků léčby ischemických cévních mozkových příhod
- Terapie nádorů postihujících játra metodami intervenční radiologie
- Vertebroplastika a epiduroskopie očima intervenčního radiologa
- Importovaná kožná parazitóza
- Standardizovaný pacient a sestavování kurikula – inspirace z konference AMEE 2017
- ISBER 2017 – mezinárodní konference o biobankách
- Biobanky – diskuse o terminologii
-
Slavnostní řeč profesora Pavla Pafka při převzetí Ceny J. E. Purkyně
(20. června 2018, zámek Libochovice) - Vzpomínka na prof. Vladimíra Pacovského
- 75 let prof. MUDr. Jana Kvasničky, DrSc.
- Zemřel prof. MUDr. Václav Zamrazil, DrSc.
- Zemřel prof. MUDr. Jaroslav Rybka, DrSc.
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hybridní zobrazení PET/MR u karcinomu prostaty
- CT angiografie koronárních tepen – současné možnosti a budoucí perspektivy v diagnostice ischemické choroby srdeční
- Ultrazvukové vyšetření s kontrastní látkou
- Terapie nádorů postihujících játra metodami intervenční radiologie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



