-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hidradenitis suppurativa – symptomy, diagnostika a léčba
Hidradenitis suppurativa – symptoms, diagnostics, and therapy
Hidradenitis suppurativa is a chronic skin disorder characterized by recurrent inflammatory nodules, fistulas, abscesses, and scarring mainly in the intertriginous areas with terminal hair and apocrine glands. Hidradenitis suppurativa manifests usually after puberty, in the third life decade and persists for many years. The prevalence of the disease is estimated to be 0,5 % in the Czech Republic. Women are most often affected in the axillary and inguinal parts, while men in the perianal and gluteal areas.
The exact pathogenesis is still unknown. It is assumed that hyperkeratosis of the hair follicle leads to its occlusion, dilatation and further rupture when keratin and bacteria are spilled into the dermis causing a massive inflammatory reaction. Smoking and obesity belong to the main triggering factors.
Without therapy, the disease is chronic and progressive. The standard therapy depends on the extension of the disorder. For not extensive lesions, treatment consists of topical antiseptics, antibiotics or long - term therapy with systemic antibiotics. In more advanced stages, systemic therapy with TNF-α antagonists is needed. Further therapeutic modality is surgical intervention and wide excision of the affected area. Nevertheless, recurrences in the adjacent tissue cannot be avoided.Keywords:
hidradenitis suppurativa, acne inversa, therapy, adalimumab
Autoři: Monika Arenbergerová; Robert Artur Dahmen; Petr Arenberger
Působiště autorů: Dermatovenerologická klinika 3. LF UK a FNKV, Praha
Vyšlo v časopise: Čas. Lék. čes. 2017; 156: 127-132
Kategorie: Přehledový článek
Souhrn
Hidradenitis suppurativa je chronické onemocnění s přítomností recidivujících zánětlivých nodulů, secernujících píštělí, abscesů a jizvení zejména v místech kožních záhybů, kde se vyskytují terminální vlasy a apokrinní žlázy. Choroba se manifestuje po pubertě, nejčastěji ale ve třetí dekádě s přetrváváním nemoci do vyššího věku. Její prevalence se v Česku pohybuje kolem 0,5 %. Axilární a ingvinální postižení je častější u žen, perianální a gluteální lokality převažují u mužů.
Přesná etiopatogeneze choroby není známa, primární je hyperkeratóza vedoucí k okluzi vlasového folikulu s následným rozšířením až rupturou jeho infundibula, která podnítí rozsáhlou zánětlivou reakci v okolí. Kouření a obezita se řadí mezi potenciální vyvolávající faktory.
Léčebný postup je závislý na stadiu onemocnění, v iniciálních fázích se uplatňuje lokální terapie antibiotiky, antiseptiky nebo dlouhodobé systémové podávání antibiotik. U pokročilejších forem se v poslední době osvědčili antagonisté TNF-α. Další léčebnou možnost představuje chirurgické odstranění celé postižené oblasti, nicméně ani pak nejsou vyloučené recidivy onemocnění v okolí excidované oblasti.Klíčová slova:
hidradenitis suppurativa, acne inversaHISTORIE
Názvy hidradenitis suppurativa (HS), intertriginózní akné, apokrinní akné, acne inversa a morbus Verneuil jsou užívány jako synonyma nebo se jedná o historická pojmenování stejné choroby. Jako první tuto nemoc popsal francouzský chirurg Aristide Verneuil již v roce 1854. Onemocnění pojmenoval hidrosadénite phlegmoneuse, neboť předpokládal, že jde o zánět potních žláz. Představa, že HS je nemocí apokrinních žláz, převládala až do roku 1956, kdy Pillsbury za hlavní patogenetický mechanismus označil retenční hyperkeratózu vedoucí k okluzi vlasového folikulu s následným rozšířením až rupturou jeho infundibula, která podnítí rozsáhlou zánětlivou reakci. Plewig a Steger vycházeli z folikulárního původu choroby a zavedli v roce 1989 termín acne inversa, čímž zohlednili odlišnou (inverzní) lokalizaci oproti klasické akné (1).
DEFINICE
HS je charakterizována svým klinickým obrazem, chronickým průběhem a častými vzplanutími nemoci. Konsenzus v definici HS přinesl druhý kongres organizovaný Hidradenitis Suppurative Foundation (San Francisco, 2009). HS je chronické, zánětlivé, recidivující onemocnění, které se zpravidla manifestuje po pubertě bolestivými, v hloubce uloženými, zánětlivými projevy v oblastech s apokrinními žlázami, nejčastěji v axilární, ingvinální a anogenitální oblasti (2).
EPIDEMIOLOGIE
Výskyt HS v populaci se uvádí v poměrně širokém rozmezí 0,3–1 %, přičemž přesná prevalence není bezpečně známa, ale je možné, že je častější, než ukazují provedená šetření, vzhledem k malému povědomí o této chorobě v lékařské komunitě (3). Nemoc postihuje ženy i muže, ženské pohlaví však více než 3× častěji než mužské. Muži mívají častěji postiženou perianální oblast, přičemž se o klasickou androtropii nejedná.
HS se objevuje obvykle u mladých dospělých, průměrný věk při jejím vzniku je asi 21 let. Vzácně byl popsán výskyt před pubertou a začátek nemoci před 11. rokem měla < 2 % pacientů. Většina případů u dětí souvisí s předčasným nástupem puberty. U žen bývá ústup projevů pozorován po menopauze.
ETIOPATOGENEZE
Genetická predispozice hraje při vzniku HS nepochybně významnou roli. Pozitivní rodinnou anamnézu identifikoval Jemec ve 26 % případů (4). Nottinghamská studie již před 30 lety nalezla u familiární formy hidradenitis suppurativa autosomálně dominantní dědičnost, pro kterou mluví i novější práce (5). Fakt, že je výskyt nemoci u blízkých příbuzných nižší, než by se čekalo, lze vysvětlit ne zcela jasným vymezením choroby, různým stupněm penetrance genu a snad i hormonálním ovlivněním genové exprese. K ozřejmení, zda se u HS podílí jeden nebo více genů, byly zahájeny molekulárně genetické studie.
Patogeneticky dnes platí za prokázané, že podobně jako u acne vulgaris začíná HS vznikem komedonu, k němuž dochází na podkladě hyperkeratózy folikulárního ústí (6). Okluze vede k rozšiřování a posléze k ruptuře folikulu, na niž navazuje granulomatózní zánětlivá reakce v okolním vazivu. V jejím průběhu se tvoří hnisavé abscesy, které někdy komunikují s povrchem formou píštělí. Opakující se proces vede k šíření do plochy i hloubky, za současného jizvení. Tento mechanismus poprvé histologicky prokázal Plewig (7). Zjistil rovněž, že apokrinní žlázy nejsou primárně postiženy a k jejich zánětu dochází až později sekundárně.
Také bakteriální infekce je zřejmě sekundární záležitost. Podílí se na ní aerobní i anaerobní flóra. Nejčastější je Staphylococcus aureus, v hlubších úsecích byly zachyceny koaguláza-negativní stafylokoky, o jejichž možném patogenním působení se nově opět diskutuje. Význam je přikládán i bakterii Streptococcus milleri, mikroorganismu, který často kolonizuje gastrointestinální a ženský genitální trakt. Highet et al. udávají, že výskyt Streptococcus milleri výrazně koreluje s aktivitou HS (8). Jiné studie jeho výskyt při HS nepotvrdily. Z anaerobních kmenů jsou nejčastěji přítomné Peptostreptococcus spp., Prevotella spp., mikroaerofilní streptokoky, Fusobacterium spp. aj. Izolováno bylo i Propionibacterium acnes. Spektrum osídlení se liší podle toho, zda jde o lokalizaci axilární, nebo perianální, kde bývají zjišťované Escherichia coli, Klebsiella a Proteus, spolu s anaerobní flórou. Lze říci, že nález mikroorganismů není u HS konstantní a může se měnit případ od případu.
Některé studie poukazují na koincidenci HS s metabolickým syndromem, zejména s diabetem nebo poruchou glukózové tolerance (10–33 %) (3). HS může být sdružena s endokrinopatiemi, např. s Cushingovým syndromem a akromegalií. Hormonální souvislosti jsou nápadné především u androgenů. Předpoklad, že se v patogenezi HS významně uplatňuje zvýšená periferní konverze androgenů v apokrinních žlázách, nebyl potvrzen prací, která by srovnávala aktivitu androgen-konvertujících enzymů u osob s HS a u zdravých jedinců. Onemocnění se zhoršuje před menstruací, po menarche a naopak se zlepšuje v těhotenství a po menopauze. U postižených žen byla zjištěna snížená hladina globulinu vázajícího pohlavní hormony (SHBG), takže by se teoreticky dalo uvažovat o hyperandrogenismu, který může mít na onemocnění stimulující vliv. Hormonální původ onemocnění zatím není spolehlivě objasněn, protože SHBG je snížen také u obézních žen, což bývá většinou typické i pro ženy s HS, a ani jiné parametry hyperandrogenismu nejsou u žen s tímto onemocněním přítomné.
U HS nebyla nalezena primární porucha buněčné nebo humorální imunity, zvlášť závažné stavy mohou mít snížené množství T lymfocytů. Současný výskyt HS a pyoderma gangrenosum nebo morbus Crohn stejně jako příznivý efekt podání cyklosporinu A, resp. antagonistů tumor nekrotizujícího faktoru alfa (TNF-α) u obou těchto stavů by ale mohl na poruchu imunity poukazovat (9). Aktuální další výzkum se orientuje na toll-like receptory, cytokiny a antimikrobiální peptidy ve vlasovém folikulu, a to zejména u apokrinní žlázy. Často jsou zjišťované patologické laboratorní hodnoty, zejména vysoká sedimentace, zvýšení hladiny C-reaktivního proteinu, leukocytóza, snížení železa v séru a změny v elektroforéze sérových proteinů. Dále jsou v bioptických vzorcích kůže postižené HS prokázané zvýšené hladiny cytokinů (TNF-α, IL-1β, IL-10, IL-17) ve srovnání se zdravou kůží. Všechny zmíněné parametry korelují s chronickým zánětlivým procesem.
VYVOLÁVAJÍCÍ FAKTORY
Ve studii s 302 pacienty, která sledovala rizikové faktory pro vznik HS, se potvrdilo, že nejčastějšími faktory spojenými s HS jsou kouření a nadváha. Pacienti s HS bývají často kuřáci (v 70–88 % případů), oproti 23–46 % v ostatní populaci (3). Předpokládá se, že by kouření mohlo poškozovat chemotaxi neutrofilů. Nejsou však k dispozici pozorování, která by potvrdila příznivý efekt přerušení kouření nebo snížení počtu cigaret na průběh HS. Asociace s obezitou a nadváhou zvyšuje riziko s každou jednotkou body mass indexu. Redukce váhy je tedy pro omezení progrese onemocnění klíčová.
Chemické dráždění deodoranty a mechanická iritace při vyholování či depilaci má při vzniku HS zřejmě jen přídatný význam. Podobně může přispívat zvýšené tření v intertriginózních lokalizacích, zejména u obézních osob, k zesílení postižené kůže a folikulární hyperkeratóze.
Ojedinělé jsou popisy vzniku HS při terapii lithiem. Lithium může uvolnit lyzosomální enzymy a zvýšit chemotaxi polynukleárů, a přispět tak k rozvoji zánětlivého procesu. HS de novo se objevila i u některých pacientů, kteří užívali sirolimus po orgánové transplantaci.
KLINICKÝ OBRAZ A SYMPTOMY ONEMOCNĚNÍ
Predilekcí HS jsou zejména intertriginózní lokalizace. Nejčastěji jde o axily, perianální a ingvinální oblasti. Zasažen bývá i genitál a postižení se může šířit na gluteální krajinu (obr. 1). Zduření typu elephantiasis nostras může vést k monstróznímu zbytnění hlavně na skrotu. Méně časté je postižení šíje a kštice, kůže prsou a submamárních rýh nebo pupku. Vzácně se ložiska tvoří i jinde po těle (např. na končetinách). Ve 38–45 % případů je postižena pouze jedna lokalizace.
Obr. 1. Gluteální postižení hidradenitis suppurativa 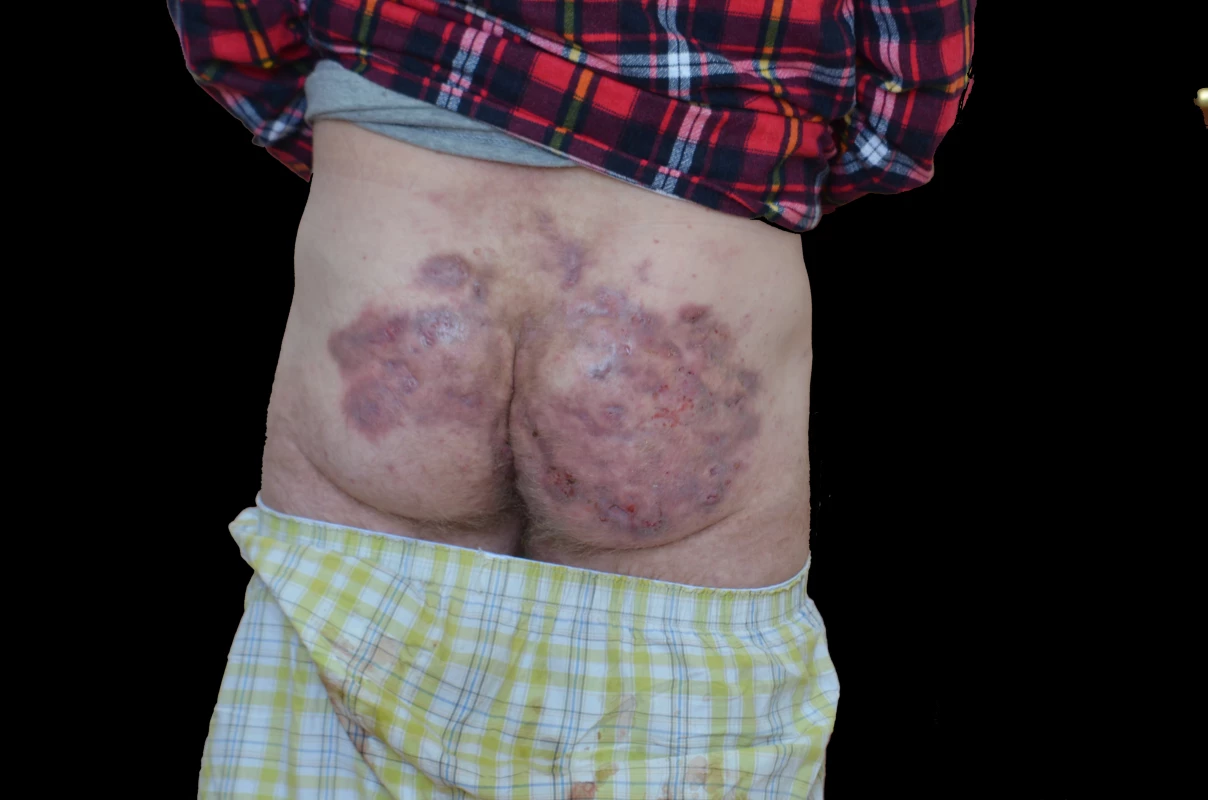
V časném stadiu se zjišťují obrovské komedony a bývají hmatné tuhé nebolestivé uzly v podkoží. Postupně se tyto uzly zvětšují, splývají a mění se v abscesy. V pozdním stadiu je pro HS typické postižení větších ploch, kde je kůže indurovaná, tmavě zbarvená a zánětlivě infiltrovaná. Jsou zde četné uzly, abscesy a podkoží prostupují epitelem vystlané sinusy a píštěle hnisavě secernující na povrch. Krvavě hnisavý mastný sekret silně zapáchá, což bývá pro nemocné značným společenským problémem. Postižená oblast je bolestivá, zejména při gluteálním zasažení bývá pro bolest silně ztížené i sezení. Fibrotizace vede ke vzniku jizev, jež prostupují nově vznikající zánětlivá ložiska. V axilách mohou mít jizvy za následek vznik dermatogenních kontraktur, které významně snižují hybnost ramene a mohou se podílet na artrotických změnách kloubu. Typickou známkou předcházející HS jsou polyporózní komedony. Závažnost onemocnění je definována klasifikací podle Hurleyho (tab. 1). Mírné formy HS se vyskytují nejčastěji, jak ukazuje studie s náhodně vybranými 302 pacienty s HS. Lehká forma (Hurley I) byla zaznamenána u 68,2 % pacientů, středně těžká forma (Hurley II) u 27,6 % a nejtěžší forma (Hurley III) u 3,9 %.
HS se může vyskytnout s dalšími jednotkami, kterým je společné zánětlivé postižení vlasového folikulu. O tzv. aknetriádě hovoříme při současném výskytu HS, acne conglobata a postižení kštice ve smyslu perifolliculitis capitis abscedens et suffodiens. Je-li přítomen ještě pilonidální sinus, jde o tzv. aknetetrádu.
Současný výskyt HS byl popsán i s dalšími chorobami, které s ní sdílejí folikulární okluzi: morbus Fox-Fordyce, pityriasis rubra pilaris, acanthosis nigricans, steatocystoma multiplex a morbus Dowling-Degos.
Tab. 1. Klasifikace hidradenitis suppurativa podle Hurleyho 
KOMPLIKACE
HS může vést jizvením ke kontrakturám, které mohou omezit hybnost příslušného kloubu. Podobně jako acne conglobata se může i HS vyskytnout současně s artritidou (10). Ta je séronegativní, typicky asymetrická a nejčastěji postihuje jedince středního věku. Zasaženým kloubem může být koleno, kotník či loket, ale také sakroilické skloubení. Artritida sdružená s HS může přicházet i v rámci SAPHO syndromu (synovitis, acne, pustulosis palmoplantaris, hyperostosis, osteitis).
Závažnou, ale vzácnou komplikací je vznik spinaliomu, zejména po dlouhém trvání HS, nejčastěji u mužů v perianální lokalitě (11). Vzhledem k obtížnosti časné diagnostiky je prognóza většinou nepříznivá. Vyvolávajícím faktorem je zřejmě chronické zánětlivé dráždění. V případech s maligním bujením činí průměrná doba trvání HS do vzniku nádoru 19 let.
Komplikací neléčené choroby jsou píštěle do uretry, močového měchýře, rekta nebo peritonea jako následek chronického zánětu a hnisání. Rozsáhlé projevy HS s těžkým celkovým stavem mohou vyvolat bakteriální meningitidu, pneumonii nebo sepsi zakončenou exitem.
Onemocnění svým charakterem významně ovlivňuje psychiku nemocného. Proto jsou velmi časté například chronické depresivní stavy doprovázející HS.
DIFERENCIÁLNÍ DIAGNOSTIKA
V časném stadiu je třeba odlišit furunkl a karbunkl, v pozdním stadiu ostatní granulomatózní procesy s tvorbou píštělí jako tuberculosis cutis colliquativa, pyodermia vegetans, aktinomykózu, lymphogranuloma inguinale nebo hlubokou trichofycii. Myslet musíme i na perianální píštěle včetně jejich výskytu při morbus Crohn. Současný výskyt HS a Crohnovy nemoci je sice ojedinělý, ale jedná se o nepříjemnou komplikaci. Tsianos et al. dokonce spekulují, že HS je jednou z kožních manifestací Crohnovy nemoci (12). Kolonoskopické vyšetření by proto mělo proběhnout ve všech nejasných případech i při absenci trávicích obtíží.
OVLIVNĚNÍ KVALITY ŽIVOTA
Výrazná změna kvality života byla pozorována i u mírnějších forem HS. Studie se 114 pacienty, která vyhodnocovala dotazník dermatologického indexu kvality života (DLQI), zaznamenala velmi vysoké skóre zejména u 1. otázky, hodnotící úroveň bolesti a svědění. Studie sledující 61 pacientů s HS pomocí několika různých dotazníků zaměřených na kvalitu života ukázala ovlivnění kvality života statisticky vyšší (p < 0,001) než u neurofibromatózy, psoriázy či atopické dermatitidy, zejména při posuzování psychosociálních parametrů (3).
PRŮBĚH A PROGNÓZA
Spontánní vyhojení je možné, ale velmi vzácné. Dojít k němu může jen u počínajících projevů s jedním nebo několika málo menšími uzly. Zpravidla je průběh chronicky progredující s postupným postižením větších okrsků a dalších lokalizací. U žen bývá ústup projevů pozorován po menopauze.
LÉČBA
Lokální léčba
Lokální léčba 1% klindamycinem je efektivní zejména v nižších stadiích HS. Účinnost byla ověřena v zaslepené placebem kontrolované studii s pacienty trpícími HS I. stupně nebo mírného II. stupně dle Hurleyho škály. Doporučené dávkování je 2× denně po dobu 3 měsíců u počínajících nebo nevelkých ložisek HS. Pokud během tohoto období nedojde ke klinické odpovědi, je třeba zvolit jiný způsob léčby. Jemec et al. srovnávali ve dvojitě zaslepené randomizované studii efekt lokálního 1% klindamycinu podávaného 2× denně a systémového tetracyklinu 2× 500 mg po dobu 3 měsíců. Mezi oběma léčebnými postupy nebyly zjištěny významnější rozdíly (13).
Systémová léčba – antibiotika
Tetracyklin 500 mg 2× denně se doporučuje jako první krok v léčbě 1. linie u pacientů se středně těžkou HS podle celkového hodnocení lékařem (PGA) nebo u rozsáhlejšího stupně I a mírného stupně II podle Hurleyho, především při absenci hlubokých zánětlivých lézí (abscesů) po dobu až 4 měsíců (14). Pokud během této doby nedojde ke klinické odpovědi, je třeba přistoupit k jinému způsobu léčby.
Klindamycin 300 mg 2× denně v kombinaci s rifampicinem 600 mg 1× denně nebo 300 mg 2× denně je indikovaný při přítomnosti aktivních zánětlivých projevů v každém stadiu onemocnění. Efekt této kombinační léčby byl hodnocen v několika klinických studiích. Tři klíčové studie verifikovaly úspěšnost této terapie (14). Maximální efekt byl pozorován v 10. týdnu, u některých pacientů se pomocí této léčby podařilo dosáhnout plné remise trvající průměrně 5 měsíců. Léčebná kombinace klindamycinu a rifampicinu se doporučuje jako terapie 1. linie u pacientů se středně závažnou až těžkou HS (stupně II dle Hurleyho) po dobu 10 týdnů. Pokud po 10. týdnu nedojde ke klinické odpovědi, je třeba přistoupit k dalším léčebným modalitám. Při gastrointestinálních obtížích spojených s klindamycinem je možné jej nahradit minocyklinem v dávce 100 mg denně. Zejména u pacientů s pokročilou HS s mnohočetnými píštělemi je efekt této terapeutické kombinace pouze omezený.
Další variantu představuje perorální trojkombinace: rifampicin, moxifloxacin a metronidazol v 3měsíčním terapeutickém režimu, která tlumí zápach, sekreci i bolestivost postižených míst. Nejčastějším popsaným nežádoucím účinkem byly gastrointestinální obtíže a kandidová vulvovaginitida.
Antibiotická léčba je doporučována jak k předoperační přípravě pacienta (měsíc před zákrokem), tak v pooperačním průběhu, aby se zabránilo infekčním komplikacím.
Systémová léčba – adalimumab
Adalimumab se doporučuje jako druhý krok v léčbě 1. linie u pacientů se středně těžkou až těžkou HS, kteří netolerovali perorálně podávaná antibiotika nebo na ně nereagovali. Doporučené dávkování je 160 mg v 0. týdnu, 80 mg ve 2. týdnu a počínaje 4. týdnem pak 40 mg každý týden. Pokud do 12. týdne nedojde ke klinické odpovědi, tj. poklesu počtu abscesů a zánětlivých nodulů/uzlů alespoň o 25 % ve srovnání s výchozím stavem při zahájení biologické terapie, nebude ze zdravotního pojištění dále hrazena a je třeba přistoupit ke změně léčby.
Účinnost a bezpečnost adalimumabu v terapii HS byla potvrzena v multicentrické randomizované kontrolované studii PIONEER (15). PIONEER I a II jsou dvě dvojitě slepé placebem kontrolované studie fáze III s podobným designem posuzující dvě období. V 1. období byli pacienti náhodně rozděleni v poměru 1 : 1 do ramene s adalimumabem 40 mg týdně nebo do ramene B s placebem. Ve 2. období byli probandi 24 týdnů léčeni ve větvi s adalimumabem 1× týdně nebo každý druhý týden anebo placebem. Primárním cílem studie bylo hodnocení léčebné odpovědi, která byla definována jako 50% redukce v počtu abscesů a zánětlivých nodulů od 1. vyšetření a zároveň bez nových abscesů a píštělí v týdnu 12.
Do PIONEER I bylo zařazeno 307 a do PIONEER II 326 pacientů s HS Hurley II a III. Léčebná odpověď ve 12. týdnu byla statisticky signifikantně vyšší ve skupině s adalimumabem oproti placebu: 41,8 vs. 26,0 % v PIONEER I (p = 0,003) a 58,9 vs. 27,6 % v PIONEER II (p < 0,001). V PIONEEER II bylo ve 12. týdnu zaznamenáno snížení bolesti, počtu lézí a zlepšení v modifikovaném skóre podle Sartoriusové. Závažné nežádoucí účinky se vyskytly v obou ramenech srovnatelně málo často. Na základě těchto výsledků byl adalimumab schválen americkým Úřadem pro kontrolu léků a potravin (FDA) a Evropskou lékovou agenturou (EMA) pro léčbu středně těžké a těžké formy HS. Relapsy onemocnění po ukončení léčby adalimumabem byly zaznamenány až u 70 % pacientů, a proto se doporučuje s léčbou pokračovat, dokud trvá léčebná odpověď a pacient terapii toleruje.
Od 1. června 2017 je adalimumab plně hrazený ze zdravotního pojištění v léčbě aktivní středně těžké až velmi těžké formy HS u dospělých pacientů, kteří neodpovídali na 3měsíční terapii perorálními antibiotiky nebo ji netolerují. Dlouhodobě jsou biologickou terapií léčeni respondeři, tedy pacienti, u kterých je po 12 týdnech léčby adalimumabem dosaženo poklesu počtu abscesů a zánětlivých nodulů/uzlů alespoň o 25 % dle PGA ve srovnání s výchozím stavem při zahájení léčby.
I na našem pracovišti jsou pacienti s pokročilým onemocněním po selhání antibiotické terapie léčení adalimumabem (obr. 2 a 3).
Obr. 2. Perianální hidradenitis suppurativa s přechodem do gluteální krajiny před a po 6 měsících terapie adalimumabem 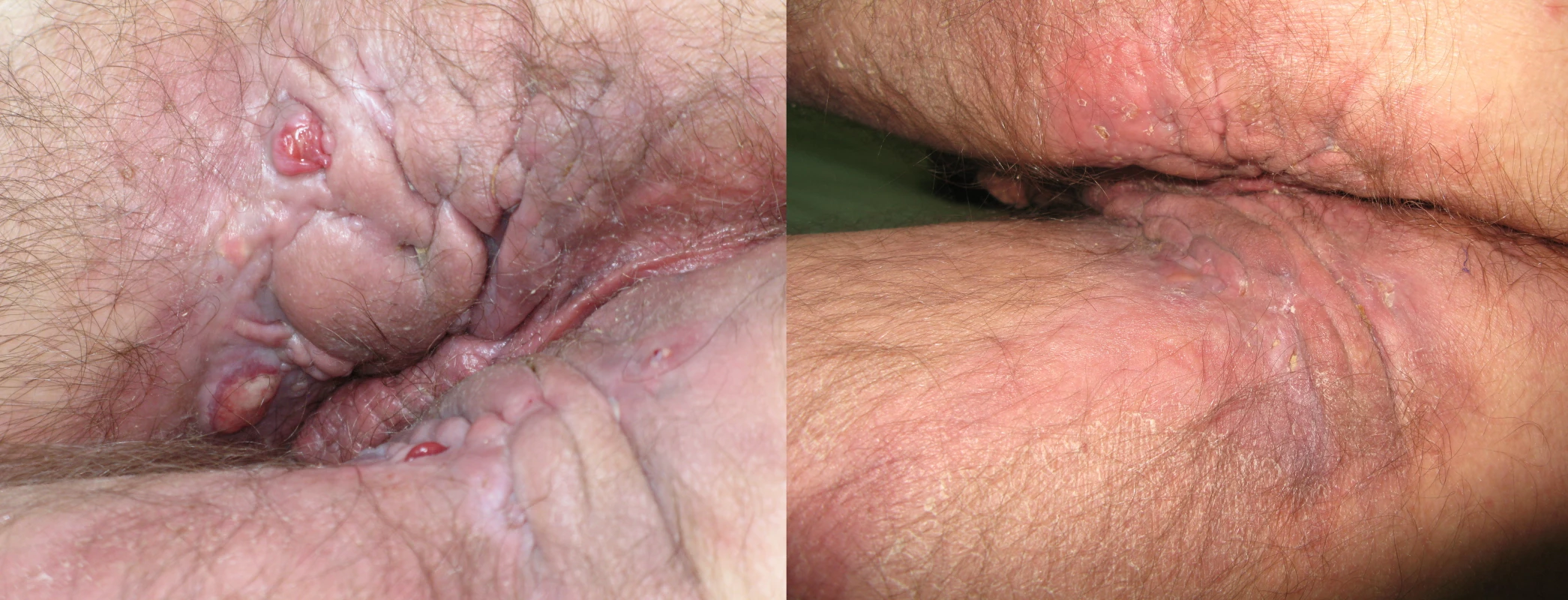
Obr. 3. Axilární hidradenitis suppurativa – před a po 3 měsících terapie adalimumabem 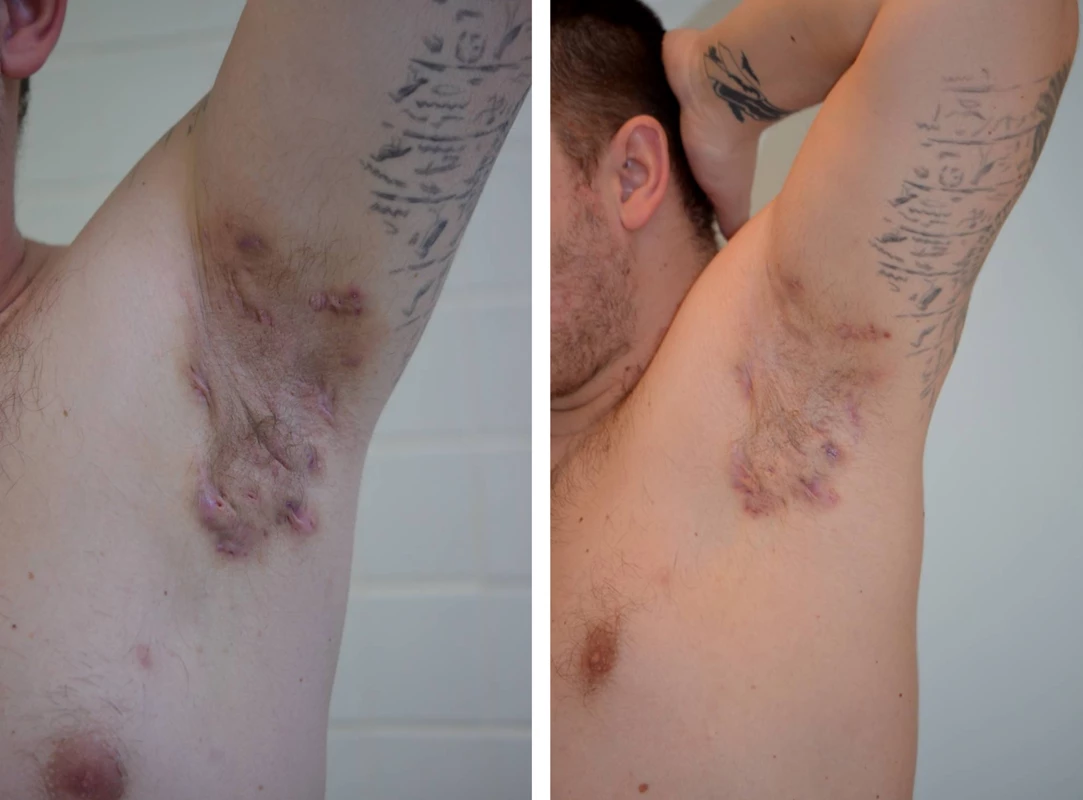
Chirurgická léčba
Přechodnou úlevu od bolesti a místního napětí přinášejí incize abscesů s následnou drenáží, které ale nemají vliv na dynamiku onemocnění. Důležité je odlišit absces od zánětlivého nodulu, u kterého incize není indikována. Přítomnost abscesu se projeví zvýšením teploty v postižené oblasti, zbělením kůže ve středu projevu, horečkou, poruchami spánku a výraznou bolestivostí s maximem v noci.
Metodou volby u těžkých forem HS je chirurgické odstranění veškeré postižené tkáně. Pouze při menším rozsahu lze zákrok provést v místním znecitlivění a ambulantně. Častěji je vzhledem k rozsahu operace nutná hospitalizace a někdy výkon i v celkové anestezii. Tumescenční anestezie není příliš vhodná, neboť průnik anestetika v jizevnaté nebo hnisavě rozpadlé tkáni je výrazně omezen.
Před zákrokem je třeba aspekcí i palpací pečlivě stanovit rozsah kožních změn a ten zakreslit na operovanou oblast. Patologicky postižená kůže a podkoží musejí být excidovány široce do zdravé tkáně, často až k fascii. Zákrok lze provést skalpelem, elektrochirurgicky nebo laserem (CO2).
V názoru na další postup hojení nepanuje jednota. Menší ránu je možno uzavřít primární suturou. Vzniklá rána však obvykle bývá velkého rozsahu. Většina autorů pak upřednostňuje ponechání rány ke spontánnímu zhojení (obr. 4). To trvá podle velikosti rány 2–3 měsíce. Hospitalizaci lze často ukončit již po týdnu a další hojení následně probíhá ambulantně. Kosmetické i funkční výsledky jsou dobré, třebaže jizvení v axilách někdy vede k určitému omezení abdukce paže. Postupně však jizva měkne a rozsah pohybu se zvětšuje i za přispění rehabilitace.
Obr. 4. Radikální excize postižené oblasti hidradenitidou a ponechání k hojení per secundam 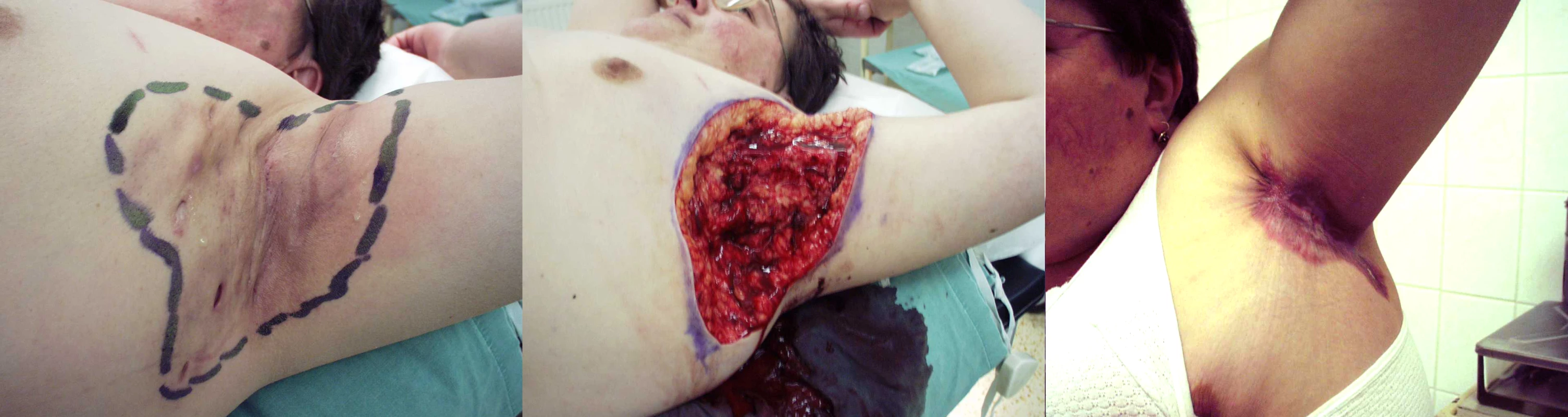
Rychlejšího zhojení lze dosáhnout pomocí kožního transplantátu. Vzhledem k obvykle velké ráně je třeba užít dermoepidermální (případně meshovaný) transplantát. Kosmetické a funkční výsledky se od spontánního hojení výrazně neliší.
Někteří autoři upřednostňují krytí rány pomocí laloku. Pokud to velikost rány dovolí, je možné použít např. transpoziční lalok podle Limberga. Požívány jsou i fasciokutánní laloky z paže nebo ze zad. To jsou však již náročnější zákroky, které mohou být spojené s některými komplikacemi a výraznější morbiditou. Měly by proto být vyhrazeny jen pro speciální případy.
Recidivy po radikální excizi nastávají asi ve 27 % případů. Obvykle se objeví cca za 20 měsíců po operaci. Nezvykle vysoký počet recidiv (50 %) byl zjištěn při submamární lokalizaci HS. Proto se zde chirurgický zákrok jednoznačně nedoporučuje. S recidivami se setkáváme jednak tam, kde excize nebyla dostatečně hluboká, častěji se však jedná o novou manifestaci choroby v okrajích, které nebyly do excize zavzaty. Pacienta je na možnost recidiv nutno upozornit, stejně jako na případný vznik chorobných ložisek v jiné lokalizaci. Pravidelné kontroly jsou proto vhodné.
V klinické praxi se nevylučuje ani současná chirurgická léčba a systémová terapie adalimumabem. Pacienti, kteří byli léčeni anti-TNF po operaci se zahájením terapie 14–21 dní od uzavření rány, z této léčby profitovali. Vykazovali významně méně rekurencí v operovaných oblastech v pořadí axily, třísla, trup a gluteální oblast a zároveň i hojení nemocných na kombinované léčbě probíhalo rychleji (16).
Excize postižené oblasti pomocí CO2 laseru je rezervována pro mírné formy choroby. Srovnání chirurgické a laserové excize provedli ve své retrospektivní studii Lapins et al. Laserová depilace jako prevence nových projevů je zatím ve stadiu zkoumání.
Opichy botulotoxinem ukázaly v jednotlivých případech dobrý efekt, zatímco fotodynamická terapie nepřinesla očekávané výsledky.
Náročnost chirurgického zákroku a dlouhý postup hojení jsou nepříjemné jak pro lékaře, tak pro pacienta. Přesto je u nemocných obvyklá trpělivost a vděčnost za zákrok, který je zbaví často mnohaleté a velmi obtěžující choroby.
Psychologický aspekt léčby
Závěrem je třeba zdůraznit, že kromě klasické i moderní terapie je s ohledem na specifika onemocnění třeba zvolit citlivý psychologický přístup, který pacientovi vysvětlí celou problematiku a dodá mu optimismus při řešení jeho chronických obtíží.
Korespondenční adresa:
doc. MUDr. Monika Arenbergerová, Ph.D.
Dermatovenerologická klinika 3. LF UK a FN Královské Vinohrady
Šrobárova 50
100 34 Praha 10
Tel.: 267 162 348
e-mail: arenbergerova@email.cz
Zdroje
1. Plewig G, Steger M. Acne inversa (alias acne triad, acne tetrade or hidradenitis suppurativa). In: Marks R, Plewig G (eds.): Acne and Related Disorders. Martin Dunitz, London, 1989 : 345–357.
2. Hidradenitis Suppurativa Foundation, 7895 via Belfiore, San Diego, California 92129, www.hs.foundation.org
3. Zouboulis CC, Desai N, Emtestam L et al. European S1 guideline for the treatment of hidradenitis suppurativa/acne inversa. J Eur Acad Dermatol Venereol 2015; 29 : 619–644.
4. Jemec G, Heidenheim M, Nielsen NH et al. The prevalence of hidradenitis suppurativa and its potential precursor lesions. J Am Acad Dermatol 1996; 35 : 191–194.
5. Fitzsimmons JS, Guilbert PR. A family study of hidradenitis suppurativa. J Med Genet 1985; 22 : 367–373.
6. Kurzen H, Kurokawa I, Jemec GB et al. What causes hidradenitis suppurativa? Exp Dermatol 2008; 17 : 455–456.
7. Rödder-Wehrmann O, Küster W, Plewig G et al. Acne inversa. Diagnosis and therapy. Hautarzt 1991; 42 : 5–8.
8. Highet AS, Warren RE, Staughton RC et al. Streptococcus milleri causing treatable infection in perineal hidradenitis suppurativa. Br J Dermatol 1980; 103 : 375–381.
9. Machet L, Samimi M, Delage M et al. Systematic review of the efficacy and adverse events associated with infliximab treatment of hidradenitis suppurativa in patients with coexistent inflammatory diseases. J Am Acad Dermatol 2013; 69 : 649–650.
10. Porter ML, Kimball AB et al. Comorbidities of hidradenitis suppurativa. Semin Cutan Med Surg 2017; 36 : 55–57.
11. Yuan JT, Naik HB et al. Complications of hidradenitis suppurativa. Semin Cutan Med Surg 2017; 36 : 79–85.
12. Tsianos EV, Dalekos GN, Tzermias C et al. Hidradenitis suppurativa in Crohn’s disease. A further support to this association. J Clin Gastroenterol 1995; 20 : 151–153.
13. Jemec GB, Wendelboe P. Topical clindamycin versus systemic tetracycline in the treatment of hidradenitis suppurativa. J Am Acad Dermatol 1998; 39 : 971–974.
14. Gulliver W, Zouboulis CC, Prens E et al. Evidence-based approach to the treatment of hidradenitis suppurativa/acne inversa, based on the European guidelines for hidradenitis suppurativa. Rev Endocr Metab Disord 2016; 17 : 343–351.
15. Kimball AB, Okun MM, Williams DA et al. Two phase 3 trials of adalimumab for hidradenitis suppurativa. N Engl J Med 2016; 375 : 422–434.
16. DeFazio MV, Economides JM, King KS et al. Outcomes after combined radical resection and targeted biologic therapy for the management of recalcitrant hidradenitis suppurativa. Ann Plast Surg 2016; 77 : 217–222.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Komorbidity psoriázyČlánek Androgenní alopecie ženČlánek Mezoterapie v trichologiiČlánek Psychologie ztráty vlasůČlánek RecenzeČlánek Prof. Jiří Horák zemřel
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Uplynulých třicet let české dermatovenerologie
- Bazaliom a možnosti jeho terapie
- Lymphogranuloma venereum (lymphogranuloma inquinale, morbus Nicolas-Favre-Durand)
- Komorbidity psoriázy
- Chronická kopřivka – nové pohledy na diagnostiku a léčbu onemocnění
- Hidradenitis suppurativa – symptomy, diagnostika a léčba
- Hirsutismus – etiopatogeneze, diagnostika a léčba
- Choroby postihující kůži kštice
- Androgenní alopecie žen
- Mezoterapie v trichologii
- Psychologie ztráty vlasů
- Poruchy vodního a elektrolytového metabolismu a změny acidobazické rovnováhy u pacientů s ascitickou cirhózou jater
- Povinnosti a oprávnění poskytovatele zdravotních služeb v souvislosti s podáváním stížností
- Posvátné okrsky boha lékařství Asklépia ve starověkých Athénách
- Bengt Ingemar Samuelsson (*1934)
- Recenze
- Prof. Zdeněk Mařatka (1914–2010) a světová gastroenterologie
- 59. Purkyňův den v Libochovicích
- Prof. Jiří Horák zemřel
- Zemřel profesor MUDr. Jiří Mazánek, DrSc.
- Zemřela profesorka Jana Zvárová
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Bazaliom a možnosti jeho terapie
- Choroby postihující kůži kštice
- Hirsutismus – etiopatogeneze, diagnostika a léčba
- Androgenní alopecie žen
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



