-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny
Immune mediated necrotizing myopathy associated with statin treatment
Immune mediated necrotizing myopathy (IMNM) is an acquired inflammatory myopathy. One form of the disease is associated with serum anti-HMGCR autoantibodies and significant proportion of patients has a history of statin treatment. The disease is rare with the incidence estimated around 2−3 cases/100 000 statin treated individuals. In contrast to direct statin toxicity, anti-HMGCR associated IMNM is an induced autoimmune disease.
Patients suffer particularly from severe muscle weakness, which may be occasionally totally immobilizing. Very high serum creatine kinase levels are usually detected. HMGCR (3-hydroxy-3-methylglutarylcoenzyme A reductase) is a pharmacological target of statins and the fact that patients develop autoantibodies against the enzyme suggests a possible effect of statins in induction of HMGCR antigenicity. Muscle histopathology shows predominant muscle fibre necrosis usually without concomitant lymphocytic infiltrates.
Most of the patients require long-term treatment with glucocorticoids or immunosuppressive drugs. In resistant cases use of intravenous immunoglobulins may be necessary as the only effective approach to improve the disease.Keywords:
inflammatory myopathy, muscle necrosis, statins, HMGCR
Autoři: Jiří Vencovský
Působiště autorů: Revmatologický ústav
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 319-323
Kategorie: Přehledový článek
Souhrn
Imunitně zprostředkovaná nekrotizující myopatie (IZNM) patří mezi zánětlivé získané myopatie a jedna její forma je asociována s přítomností anti-HMGCR autoprotilátek a častou předchozí léčbou statiny. Jedná se o indukované autoimunitní onemocnění, které se vyskytuje velmi vzácně; incidence se odhaduje na 2−3 případy na 100 000 léčených statiny. Frekvence onemocnění pravděpodobně stoupá.
Nemoc je charakterizována významnou svalovou slabostí, která je někdy až imobilizující, a vysokými sérovými hladinami kreatinkinázy. HMGCR (3-hydroxy-3-methylglutaryl-koenzym A reduktáza) je farmakologickým cílem statinů a fakt, že nemocní s IZNM vyvinou protilátky proti tomuto enzymu, naznačuje možnou účast statinů v indukci antigenicity. Histopatologicky je převládajícím nálezem větší množství nekrotických svalových vláken, většinou bez doprovodného lymfocytového zánětlivého infiltrátu.
Téměř všichni nemocní vyžadují dlouhodobou léčbu glukokortikoidy a imunosupresivy. U rezistentních případů může být jediným efektivním nástrojem ke zvládnutí nemoci použití intravenózních imunoglobulinů.Klíčová slova:
zánětlivá myopatie, nekróza svalu, statiny, HMGCÚvod
Idiopatické zánětlivé myopatie tvoří heterogenní skupinu vzácnějších získaných zánětlivých a imunitně zprostředkovaných onemocnění příčně pruhované svalové tkáně (1) (viz tab. 1). Imunitně zprostředkovaná nekrotizující myopatie (IZNM), někdy nazývaná také nekrotizující autoimunitní myopatie (NAM), je poměrně nově rozeznávané onemocnění, které se mezi tyto choroby řadí. Nemoc je definována především histopatologickým obrazem, jímž se odlišuje od ostatních IZM (2) (viz tab. 2). Dominantním nálezem je nekróza svalových vláken, většinou bez doprovodného lymfocytového zánětlivého infiltrátu, který je jinak pro zánětlivé myopatie velmi typický, i když se mezi jednotlivými formami liší z hlediska umístění či složení.
Tab. 1. Jednotky řazené mezi idiopatické zánětlivé myopatie (IZM) 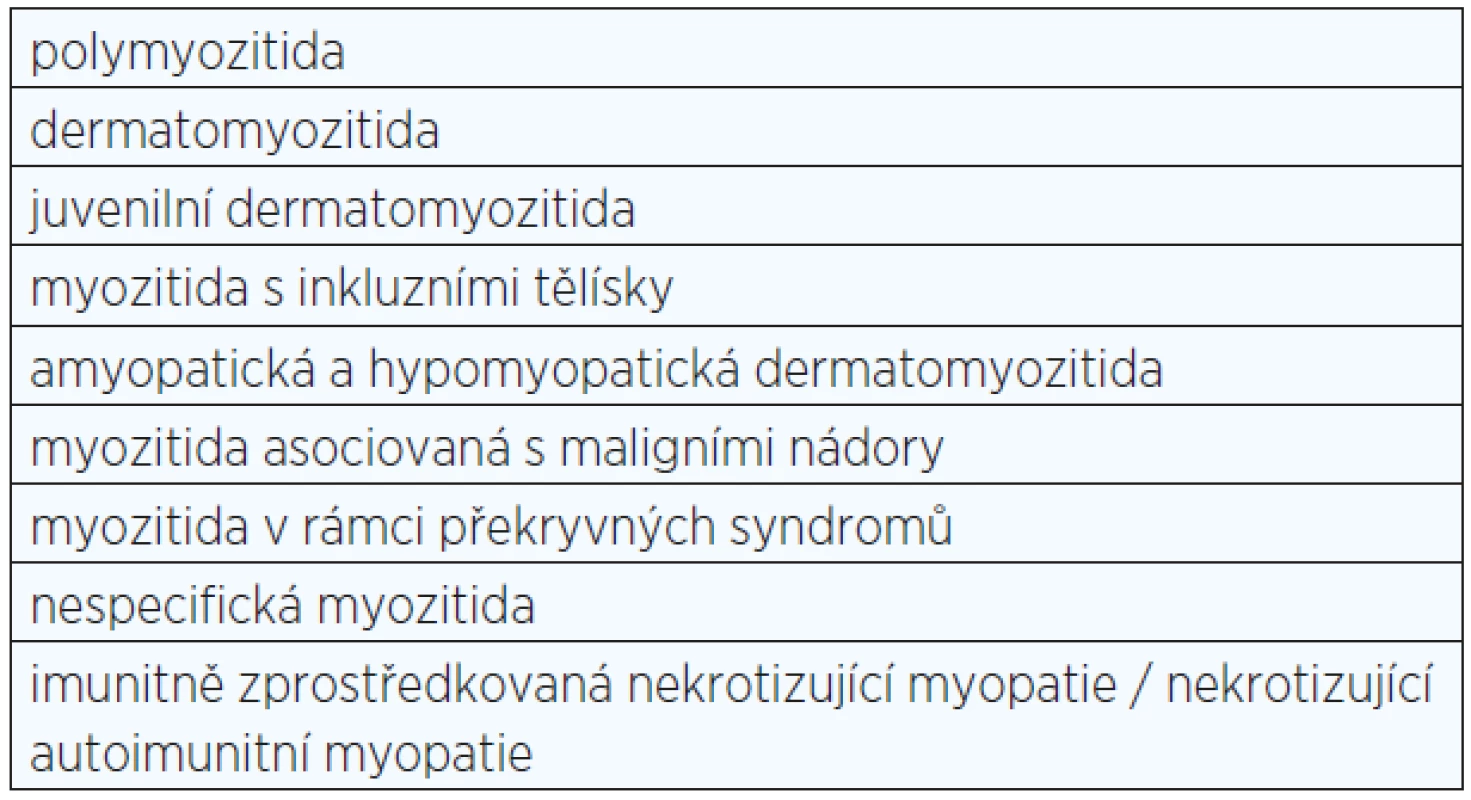
Tab. 2. Hlavní diagnostická kritéria pro imunitně zprostředkovanou nekrotizující myopatii (IZNM) podle 119. zasedání ENMC (část týkající se IZNM) (2) 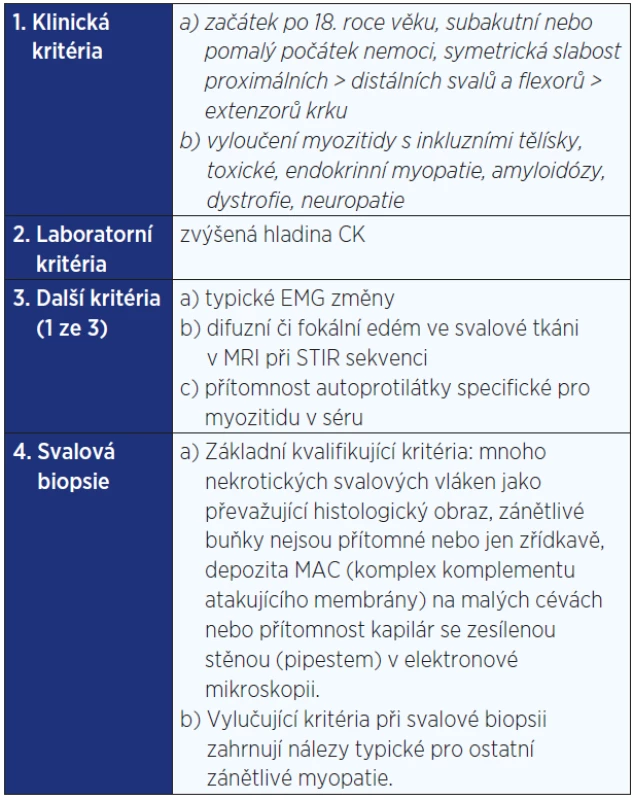
Již po nějakou dobu známe nekrotizující myopatii asociovanou s přítomností anti-SRP (signal recognition particle) autoprotilátek, což je onemocnění závažné, někdy vedoucí až k obrazu rhabdomyolýzy, probíhající chronicky a špatně odpovídající na léčbu. V posledních několika letech jsme však svědky výskytu onemocnění, které je klinicky této formě nekrotizující myopatie podobné, ale má odlišnou autoprotilátkovou asociaci a významné procento nemocných, kteří užívali v předchorobí statiny. Současné rozdělení nekrotizujících myopatií uvádí tab. 3, přičemž z hlediska frekvence převažují první dvě formy. Obraz nekrotizující myopatie se může vzácně objevit i u jiných nezánětlivých onemocnění, především u toxických myopatií vyvolaných léčivy nebo užíváním drog, u hypotyreózy, metabolických myopatií nebo také u svalových dystrofií (např. dysferlinopatie či facioskapulohumerální svalové dystrofie) (3).
Tab. 3. Formy imunitně zprostředkované nekrotizující myopatie (IZNM) 
Pro všechny IZNM platí, že postihují dospělou populaci, začínají subakutně či chronicky, způsobí svalovou slabost zejména v proximálních částech končetin a většinou probíhají bez výraznějších myalgií, resp. myalgie nejsou dominantním symptomem. Bývají značně zvýšené koncentrace enzymů pocházejících ze svalové tkáně (především kreatinkináza [CK]) a v elektromyografii se ukáže myogenní nález. V histologickém obrazu převažují nekrotické změny (viz obr. 1). Pokud je nějaký zánětlivý infiltrát, není nijak typicky lokalizován, je skromný a je tvořen převážně makrofágy. Pro autoimunitní původ IZNM svědčí především častá přítomnost specifických autoprotilátek v séru, nálezy imunitních depozit ve svalové biopsii a odpověď na imunosupresivní léčbu.
Obr. 1. Histologický nález u imunitně zprostředkované nekrotizující myopatie a anti-HMGCR protilátkami: a) nekrotická svalová vlákna bez zánětlivé infiltrace makrofágy (barvení hematoxylin a eozin), b) hyperexprese molekul HLA I na povrchu svalových vláken u IMNM. 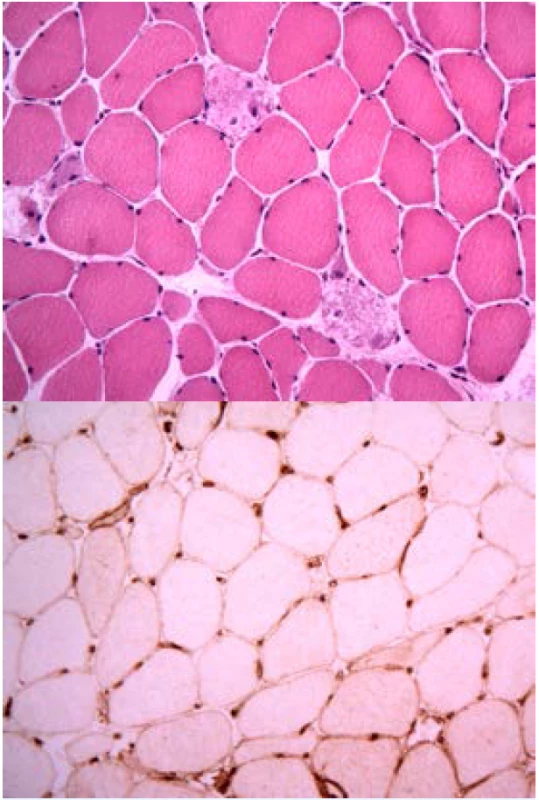
IZNM byly jako samostatná skupina v rámci IZM definovány před poměrně krátkou dobou, a proto jsou stále diskutovány jejich příznaky a známky, které se v některých případech mohou odlišovat od výše zmíněného klasického popisu. Pohled na tuto skupinu nemocí se tedy neustále vyvíjí, na čemž se podílí i skutečnost, že patogenetické mechanismy vzniku poškození nebyly dosud plně objasněny. Nejnovějším přírůstkem do skupiny těchto onemocnění je IZNM s pozitivitou anti-HMGCR protilátek, která je velmi pravděpodobně asociována s předchozí léčbou statiny u značného procenta pacientů (4). Toto onemocnění se sice vyskytuje velmi vzácně, nicméně pro jeho závažnost a potřebu zahájit imunosupresivní terapii je důležitá včasná diagnostika, a tedy dobrá informovanost o jeho klinickém a laboratorním obrazu. Je to také onemocnění, které do jisté míry napomáhá pochopit, jakým způsobem může dojít ke vzniku autoimunitní reakce v organismu, i když samozřejmě řada těchto aspektů zůstává stále nejasných.
IZNM asociovaná s pozitivitou anti-HMGCR protilátek a léčbou statiny
IZNM spjatá s anti-HMGCR protilátkami (HMGCR = 3-hydroxy-3-methylglutaryl-koenzym A reduktáza) se rychle stala nejvýznamnější jednotkou mezi imunitně zprostředkovanými nekrotizujícími myopatiemi. O její existenci se ví zhruba od roku 2010 (5). Zdá se, že frekvence výskytu této formy stoupá (6). Při zpětné identifikaci jsme v naší kohortě nemocných s IZM mezi roky 2004 a 2007 nenašli ani jednoho nemocného s anti-HMGCR pozitivní IZNM, v letech 2008 – 2011 v průměru 2 nemocné ročně, ale od roku 2012 diagnostikujeme a léčíme ročně kolem 10 nových nemocných s touto chorobou (6).
Již dlouhou dobu je známo, že statiny mohou vyvolávat přímou toxickou myopatii. Její obraz sahá od asymptomatické elevace CK, přes stavy, kdy je tato elevace CK doprovázena svalovými bolestmi či svalovou slabostí, až po těžší či těžké stavy rhabdomyolýzy s možným akutním selháním ledvin (7). Výskyt mírné elevace CK a případně tolerovatelných myalgií se odhaduje ve velmi širokém rozmezí od < 1 až do 25 %. Závažnější formy jsou však řídké. Myalgie či elevace CK se mohou objevit kdykoli v průběhu léčby a obvykle odezní za několik týdnů až měsíců po vysazení statinu. Roli pravděpodobně hraje i genetická predispozice, např. v transmembránovém transportéru hepatocytů.
Jen velmi vzácně obtíže perzistují i po vysazení statinů a případně se dále zhoršují. Ke konci minulého desetiletí se začaly množit popisy případů přetrvávající myopatie i po ukončení statinové léčby. Ukázalo se, že základní patologií u těchto nemocných jsou nálezy nekrotizujících změn ve svalové biopsii, které většinou nejsou doprovázeny infiltrativními zánětlivými změnami ve svalové tkáni. Řada nemocných měla přítomné autoprotilátky proti HMGCR (farmakologický cíl statinů) a jejich stav se začínal vylepšovat až po podání glukokortikoidů nebo dalších imunosupresiv (5, 8).
Mezi první popisy onemocnění patří kohorta z Johns Hopkins z roku 2010 (5). Při vyšetření séra 26 nemocných s nekrotizující myopatií nejasné etiologie byla u 16 z nich (62 %) zjištěna dosud neznámá protilátka precipitující dvojici proteinů o molekulové hmotnosti 200 a 100 kDa. Následně bylo prokázáno, že se jedná o protilátku zaměřenou proti katalytické doméně molekuly HMGCR. 10 ze 16 nemocných (63 %), u nichž byla tato nová autoprotilátka objevena, dostávalo v minulosti statiny. Zpočátku byla identifikace anti-HMGCR protilátek obtížná a omezená na vyšetření radioaktivní imunoprecipitací séra s extraktem ze svalové tkáně. Relativně brzo se však podařilo vyvinout spolehlivou detekci anti-HMGCR protilátek metodou ELISA.
Takto bylo vyšetřeno 750 nemocných s podezřením na autoimunitní myopatii (9). Protilátky proti HMGCR byly prokázány v séru 45 nemocných (6 %). Téměř všichni tito nemocní měli svalovou slabost a velmi výrazně zvýšenou hladinu kreatinkinázy. Svalová biopsie potvrdila ve 42 případech nekrotizující myopatii. 30 z celkem 45 nemocných s prokázanou pozitivitou anti-HMGCR protilátek bylo v minulosti léčeno statiny, přičemž v podskupině nemocných starších 50 let bylo statiny léčeno 92 % osob. Nemocní s polymyozitidou či dermatomyozitidou stejného věku měli v anamnéze užití statinů jen mezi 25 a 37 %. Většina pacientů s pozitivními anti-HMGCR protilátkami vyžadovala imunosupresivní léčbu a při snížení dávek docházelo k relapsům onemocnění.
Ne všichni nemocní s nekrotizující myopatií a anti-HMGCR protilátkami však mají vysledovatelnou léčbu statiny v anamnéze (10). Údaje se výrazně liší podle typu publikovaných kohort od 44 do 100 % asociace (11). Velmi nedávno byl popsán podíl jen 18 % jedinců užívajících statiny ve skupině s anti-HMGCR pozitivní myopatií ve srovnání se 4 % u ostatních zánětlivých myopatií (12). Většina publikací však neuvádí, zda je sledováno užívání statinů v době vzniku onemocnění nebo kdykoli v anamnéze, i třeba řadu měsíců před klinickou manifestací choroby. V naší kohortě nemocných s anti-HMGCR-pozitivní IZNM byla frekvence užití statinů přes 90 %, ovšem zjišťovali jsme jejich podávání kdykoli v předchorobí. Výskyt IZNM, která je spjata s anti-HMGCR protilátkami, v posledních několika letech stoupá a je dáván do souvislosti se stále frekventnějším používáním statinů (6). Zdá se, že je rozdíl v klinickém průběhu a odpovědi na terapii mezi nemocnými, kteří mají anti-HMGCR-pozitivní IZNM, ale brali či nebrali statiny. Ti, kteří statiny neužívali, bývají většinou mladší, méně často patří do bělošské populace a hůře odpovídají na léčbu imunosupresivy (10).
Zatím se zdá, že existuje část nemocných, kteří mají anti-HMGCR pozitivní nekrotizující myopatii, ale statiny prokazatelně nedostávali. Zajímavou souvislost s anti-HMGCR-pozitivní IZNM u pacienta, který statiny nikdy nebral, uvedl nedávno Mammen (ústní sdělení). Pacient užíval doplňky stravy obsahující hlívu ústřičnou. Ukazuje se, že hlíva ústřičná (Pleurotus ostreatus), obsahuje až 2,8 % lovastatinu v suché váze, což při denním příjmu doporučovaných 2× 250 mg suché houby může znamenat významný příjem statinu (14 mg lovastatinu). Sami jsme pozorovali podobnou pacientku s denním příjmem 500 mg prášku z hlívy ústřičné, u které se vyvinula mírnější anti-HMGCR-pozitivní myopatie. Tato pacientka však měla v anamnéze také podávání statinů. Hlíva ústřičná nemusí být jediným přírodním zdrojem, látka skoro stejná jako lovastatin je produkována plísní v červené fermentované rýži a výtažek z ní či rýže samotná mohou být zdrojem příjmu statinu. Souvislost s přímou toxicitou červené rýže je známá, včetně popisu rhabdomyolýzy způsobené přímým toxickým účinkem. Atorvastatin byl nalezen v povrchových vodách v Kanadě, existuje i popis nálezu velmi malého množství atorvastatinu v pitné vodě ve Španělsku (13).
Zda závisí vznik IZNM na dávce statinu, není nikde dokumentováno. Souvislost je zmiňována se všemi používanými statiny, nejčastěji uváděný atorvastatin nejspíše odráží jeho nejrozšířenější použití.
Je nutné zdůraznit, že tento typ IZNM je velmi raritní a naprostá většina nemocných, kteří užívají statiny, nemoc nedostane (14). Odhaduje se, že incidence onemocnění činí přibližně 2−3 případy na 100 000 pacientů léčených statiny (4). Nemoc se může projevit poměrně brzy po zahájení užívání statinů, ale často také až po řadě měsíců nebo let.
Histopatologie anti-HMGCR pozitivní IZNM
Klasický histopatologický obraz je popisován u většiny nemocných – tedy převaha nekrotických vláken, bez výraznějšího lymfocytového zánětlivého infiltrátu, s tím že nadpoloviční část nemocných má přítomnou expresi molekul HLA I na povrchu svalových vláken. Může být přítomná i abnormální morfologie kapilár a ve stěně cév a na povrchu nekrózou nepostižených svalových vláken se najdou depozita komplexu proteinů patřících k terminální fázi aktivace komplementu (MAC − membrane attack complex) (15).
Většina pacientů nemá lymfocytovou zánětlivou infiltraci, ale makrofágy jsou detekovatelné a u části nemocných se v poslední době popisuje možnost přítomnosti mírnějšího lymfocytového infiltrátu v perivaskulární oblasti. Toto je ale spíše častější u anti-HMGCR-negativních pacientů. Ojediněle jsou také popisovány malé infiltráty lymfocytů v endomysiu.
Mechanismus vzniku nekrotizující myopatie s anti-HMGCR protilátkami
Přesný mechanismus vzniku nekrotizující myopatie s pozitivitou protilátek proti HMGCR zatím není znám. Víme, že statiny blokují aktivitu enzymu HMGCR. U pacientů s IZNM zřejmě organismus reaguje snahou o zvýšení aktivity enzymu jeho nadprodukcí, zejména ve svalové tkáni. Pacienti, kteří užívají statiny, mají více HMGCR především ve svalech. U nemocných s anti-HMGCR pozitivní nekrotizující myopatií je prokázána vyšší exprese HMGCR ve svalových vláknech (9). To se týká zejména nově se obnovujících, regenerujících vláken.
Co způsobí ztrátu tolerance vůči HMGCR a tvorbu autoprotilátek proti tomuto enzymu, není jasné. Spekuluje se o možnosti změny antigenicity enzymu s navázaným statinem, kdy může dojít k odhalení kryptických epitopů, které organismus není naučen tolerovat. K tomu může přispívat zvýšená exprese HMGCR ve svalových vláknech, a tedy i zvýšená nabídka proteinu imunitnímu systému. Přítomnost HLA-DR1*11 : 01 zřejmě usnadňuje imunitní reakci, vyúsťující do produkce anti-HMGCR protilátek (16). V běžné populaci je asi 7 % HLA-DR1*11 : 01-pozitivních jedinců, zatímco u nemocných s anti-HMGCR protilátkami nejméně 65 %, takže je jasné, že musí být přítomen nějaký další predisponující faktor. Spekuluje se, že HLA-DR1*11 : 01 může hrát roli v procesu antigenní prezentace HMGCR. Protože u nemocných s IZNM je ve svalech prokazována hyperexprese HLA molekul I. třídy (normální svalové buňky neexprimují HLA I), je možné zvažovat přídatnou roli některých dalších HLA molekul.
Na přímou účast HMGCR může ukazovat myší model onemocnění, ve kterém byl gen pro HMGCR ve svalech vyřazen (17). Nedostatek HMGCR ve svalech u myší vedl k těžkému svalovému poškození, manifestujícímu se vysokou hladinou CK a nekrózou vláken s celkovým obrazem rhabdomyolýzy. Poškození je způsobeno přerušením metabolické dráhy syntézy cholesterolu, protože u těchto myší dokáže podání kyseliny mevalonové, která je produktem působení HMGCR, zabránit vývoji svalového poškození. Není těžké si představit, že statiny, ale i anti-HMGCR protilátky, mohou aktivitu HMGCR omezovat a vést k podobným důsledkům. Tyto teorie podporují také nálezy asociací hladin anti-HMGCR protilátek s hladinami CK a stupněm svalové slabosti (11, 18).
U žádného z pacientů, kteří jsou léčeni statiny a nemají známky nekrotizující myopatie, i když mají třeba známky přímé statinové toxicity, nebyly nalezeny anti-HMGCR protilátky (14). IZNM asociovaná s pozitivitou anti-HMGCR protilátek tedy nepatří do spektra přímých toxických myopatií způsobených statiny. Pokud se objeví závažnější symptomy postižení svalů při léčbě statiny, které přetrvávají i po jejich vysazení, a pacient má pozitivní anti-HMGCR protilátky, jedná se s vysokou pravděpodobností o léčbou indukované imunitně podmíněné onemocnění.
Klinické příznaky
Klinicky mají nemocní s anti-HMGCR protilátkami svalovou slabost jako naprosto převažující příznak. Slabost bývá nejčastěji mírná až střední, omezující významně schopnosti nemocného, ale dovolující většinou základní fungování a sebeobsluhu. Nezřídka však bývá svalová slabost těžká a někdy i zcela imobilizující. Jen velmi vzácně jsou přítomné i další symptomy, např. dysfagie. Orgánové postižení, jaké můžeme vidět u polymyozitidy nebo jiných forem autoimunitních nekrotizujících myopatií, např. plicní či kardiální, u IZNM asociované s pozitivitou anti-HMGCR protilátek zcela chybí.
Recentně bylo popsáno mírně zvýšené riziko asociace s maligním onemocněním u nemocných s IZNM a anti-HMGCR protilátkami (21). Pokud se objeví autoimunitní nekrotizující myopatie, u které se neprokážou žádné autoprotilátky, pak pravděpodobnost asociace s maligním onemocněním prudce vzrůstá.
Diagnostika IZNM
Diagnóza IZNM je založena na histologickém nálezu ve spojení s odpovídajícím klinickým obrazem. Pro IZNM je typický subakutní nástup proximální symetrické svalové slabosti, postihující horní i dolní končetiny. Nemocní mívají obtíže se vstáváním ze židle, s chůzí do schodů, nejsou schopni zvedat předměty. Při těžším průběhu mohou být zcela upoutáni na lůžko. Svalová slabost může být doprovázena myalgiemi, ale většinou nejsou myalgie dominantní a daleko větší problémy činí svalová slabost. Někdy jsou přítomné i nespecifické příznaky jako únava a hubnutí. Typické jsou vysoké hodnoty CK, většinou vyšší než 10násobek horní hranice normy, respektive poměrně často i nad 50násobek normy.
U všech nemocných s nekrotizující myopatií ve svalové biopsii je třeba v první řadě vyloučit toxickou myopatii navozenou drogami a léčivy (např. alkohol, kokain, statiny, fibráty). Ta obvykle odeznívá po vysazení vyvolávající noxy. Zvláště u mladších nemocných a při pomalejším rozvoji příznaků je třeba pátrat po možné svalové dystrofii, důležitou roli při tom hraje imunohistochemické vyšetření svalové biopsie. V závislosti na klinických souvislostech je třeba také zvážit screening k vyloučení malignity. U většiny nemocných s IZNM lze detekovat některou z autoprotilátek zmíněných na počátku článku, což potvrzuje autoimunitní původ onemocnění a je indikací k zahájení imunosupresivní léčby.
Léčba
Terapeuticky pacienti reagují na podání glukokortikoidů. Doporučované dávky prednisonu jsou variabilní, ale většinou se pohybují kolem 1 mg/kg váhy, jde tedy o vysoké dávky (4). Často je potřebné přidat imunosupresivní léčbu, např. methotrexát, azathioprin, cyklofosfamid nebo mykofenolát mofetil. Tato terapie má efekt u části nemocných, ale při pokusech o její ukončení onemocnění často vzplane; většinou lze dosáhnout stabilizace při nižších udržovacích dávkách. Potřebná doba léčby je spíše v řádu roků než měsíců. Část nemocných ale na tuto léčbu prakticky vůbec nereaguje.
V literatuře jsou údaje o efektu intravenózních imunoglobulinů (IVIg) (19), což potvrzují naše omezené zkušenosti u 2 pacientů. I léčbu pomocí IVIg je však pravděpodobně nutné podávat dlouhodobě, při pokusu o snížení dávky či prodloužení intervalu jsme pozorovali akutní vzplanutí onemocnění. Jak dlouho, v jakých dávkách nebo zda je možné léčbu pomocí IVIg nahradit méně nákladnou terapií, jsou zatím zcela otevřené otázky. Většina nemocných je zároveň léčena glukokortikoidy a případně dalším imunosupresivem. Nedávno byly publikovány výborné výsledky u jinak rezistentních pacientů léčených IVIg bez konkomitantní léčby glukokortikoidy, což ukazuje na dominantní efekt této léčby (20). Pacienti s anti-HMGCR protilátkami, kteří nebyli v minulosti léčeni statiny, však bývají k léčbě IVIg rezistentní. Existují i zprávy o dobrém efektu rituximabu, ale o této terapii je ještě méně zpráv než o léčbě pomocí IVIg (19). Raritně byla také použita plazmaferéza.
Poděkování:
Podpořeno projektem MZ ČR koncepčního rozvoje výzkumné organizace 023728 − Revmatologický ústav.
Obrázky laskavě poskytl prof. MUDr. Josef Zámečník, Ph.D., Ústav patologie a molekulární medicíny 2. LF UK a FN Motol v Praze.
Seznam použitých zkratek
CK kreatinkináza
HMGCR 3-hydroxy-3-methylglutaryl-koenzym A reduktáza
IVIg intravenózní imunoglobuliny
IZM idiopatické zánětlivé myopatie
IZNM imunitně zprostředkovaná nekrotizující myopatie
MAC komplex komplementu atakující membrány
NAM nekrotizující autoimunitní myopatie
SRP signal recognition particle
Adresa pro korespondenci:
prof. MUDr. Jiří Vencovský, DrSc.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Tel.: 234 075 340
e-mail: vencovsky@revma.cz
Zdroje
1. Dalakas MC. Inflammatory muscle diseases. N Engl J Med 2015; 372 : 1734–1747.
2. Hoogendijk JE, Amato AA, Lecky BR et al. 119th ENMC international workshop: trial design in adult idiopathic inflammatory myopathies, with the exception of inclusion body myositis, 10–12 October 2003, Naarden, The Netherlands. Neuromuscul Disord 2004; 14 : 337–345.
3. Zámečník J, Manďáková P, Cibula A et al. Je to skutečně myozitida? Význam imunohistochemie svalové tkáně v diferenciální diagnostice zánětlivých myopatií. Česká revmatologie 2005; 13 : 138–145.
4. Mammen AL. Statin-associated autoimmune myopathy. N Engl J Med 2016; 374 : 664–669.
5. Christopher-Stine L, Casciola-Rosen LA, Hong G et al. A novel autoantibody recognizing 200-kd and 100-kd proteins is associated with an immune-mediated necrotizing myopathy. Arthritis Rheum 2010; 62 : 2757–2766.
6. Klein M, Mann H, Pleštilová L et al. Increasing incidence of immune-mediated necrotizing myopathy: single-centre experience. Rheumatology (Oxford) 2015; 54 : 2010–2014.
7. Alfirevic A, Neely D, Armitage J et al. Phenotype standardization for statin-induced myotoxicity. Clin Pharmacol Ther 2014; 96(4): 470–476.
8. Grable-Esposito P, Katzberg HD, Greenberg SA et al. Immune-mediated necrotizing myopathy associated with statins. Muscle Nerve 2010; 41 : 185–190.
9. Mammen AL, Chung T, Christopher-Stine L et al. Autoantibodies against 3-hydroxy-3-methylglutaryl-coenzyme A reductase in patients with statin-associated autoimmune myopathy. Arthritis Rheum 2011; 63 : 713–721.
10. Mammen AL. Necrotizing myopathies: beyond statins. Curr Opin Rheumatol 2014; 26 : 679–683.
11. Allenbach Y, Drouot L, Rigolet A et al. Anti-HMGCR autoantibodies in European patients with autoimmune necrotizing myopathies: inconstant exposure to statin. Medicine (Baltimore) 2014; 93 : 150–157.
12. Watanabe Y, Uruha A, Suzuki S et al. Clinical features and prognosis in anti-SRP and anti-HMGCR necrotising myopathy. J Neurol Neurosurg Psychiatry 2016; 87 : 1038–1044.
13. Khan U, Nicell J. Human Health Relevance of Pharmaceutically Active Compounds in Drinking Water. AAPS J 2015; 17 : 558–585.
14. Mammen AL, Pak K, Williams EK et al. Rarity of anti-3-hydroxy-3-methylglutaryl-coenzyme A reductase antibodies in statin users, including those with self-limited musculoskeletal side effects. Arthritis Care Res (Hoboken) 2012; 64 : 269–272.
15. Stenzel W, Goebel HH, Aronica E. Review: immune-mediated necrotizing myopathies – a heterogeneous group of diseases with specific myopathological features. Neuropathol Appl Neurobiol 2012; 38 : 632–646.17.
16. Mammen AL, Gaudet D, Brisson D et al. Increased frequency of DRB1*11 : 01 in anti-HMG-CoA reductase-associated autoimmune myopathy. Arthritis Care Res (Hoboken) 2012; 64 : 1233–1237.
17. Osaki Y, Nakagawa Y, Miyahara S et al. Skeletal muscle-specific HMG-CoA reductase knockout mice exhibit rhabdomyolysis: A model for statin-induced myopathy. Biochem Biophys Res Commun 2015; 466 : 536–540.
18. Werner JL, Christopher-Stine L, Ghazarian SR et al. Antibody levels correlate with creatine kinase levels and strength in anti-HMG-CoA reductase associated autoimmune myopathy. Arthritis Rheum 2012; 64 : 4087–4093.
19. Ramanathan S, Langguth D, Hardy TA et al. Clinical course and treatment of anti-HMGCR antibody-associated necrotizing autoimmune myopathy. Neurol Neuroimmunol Neuroinflamm 2015; 2(3): e96.21.
20. Mammen AL, Tiniakou E. Intravenous immune globulin for statin-triggered autoimmune myopathy. N Engl J Med 2015; 373(17): 1680–1682.
21. Allenbach Y, Keraen J, Bouvier AM et al. High risk of cancer in autoimmune necrotizing myopathies: usefulness of myositis specific antibody. Brain 2016; 139 : 2131–2135.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Editorial
- 15 let zkušeností s biologickou léčbou zánětlivých revmatických onemocnění v národním registru ATTRA
- Časná diagnostika spondyloartritid
- Diferenciální diagnostika monoartritid
- Osteoartróza ručních kloubů
- Raynaudův fenomén
- Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny
- Kardiovaskulární riziko u revmatických onemocnění
- Vybrané kapitoly z intenzivní péče
- Ceny předsednictva ČLS JEP za nejlepší vědecké práce za rok 2015
- 70 let profesora Vladimíra Paličky
- Životní jubileum prof. MUDr. Rostislava Koďouska, DrSc.
- Zemřel prof. MUDr. PhDr. Eugen Strouhal, DrSc.
- Jubilanti – listopad 2016
- Přednáškové večery Spolku českých lékařů (listopad − prosinec 2016)
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika monoartritid
- Osteoartróza ručních kloubů
- Raynaudův fenomén
- Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



