-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba chronické myeloidní leukémie – méně běžný pohled na moderní postupy
Therapy of Chronic Myeloid Leukemia. Uncommon View of the Modern Approaches
Chronic myeloid leukemia has got an outstanding position among the other oncology diseases, particularly due to specific chromosomal abnormality called Philadelphia chromosome, its molecular consequence BCR/ABL fusion gene and its biologic product BCR/ABL tyrosinekinase, which is responsible for the leukemic transformation of the hematopoetic cells. We can see a real revolution in the treatment of the chronic myeloid leukemia in the last few years. The authors pay attention to the developement of the new drugs in the large historical consequences from the beginning in the 19th century (describing leukemia first time) to the introduction of the new small specific molecules into the clinical practice.
Key words:
chronic myeloid leukemia, tyrosinkinase, BCR/ABL, targeted therapy.
Autoři: J. Mayer 1; D. Žáčková 1; H. Klamová 2; M. Doubek 1
Působiště autorů: Interní hematoonkologická klinika FN, Brno 1; Ústav hematologie a krevní transfuze, Praha Česká leukemická skupina – pro život (The CzEch Leukemia Study Group – for Life, CELL) 2
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 206-210
Kategorie: Přehledový článek
Souhrn
Chronické myeloidní leukémii přísluší mezi ostatními onkologickými onemocněními výsadní postavení, které je dáno mimo jiné existencí pro ni specifické chromozomální abnormality – tzv. Philadelphského chromozómu, jejího molekulárního důsledku – fúzního genu BCR/ABL a jeho biologického produktu – konstitutivně aktivovaného enzymu tyrosinkinázy BCR/ABL, zodpovědného za transformaci normální krvetvorby v leukemickou. V posledních letech jsme svědky převratných objevů na poli léčby této choroby. Autoři sdělení popisují cestu vedoucí k vývinu cílené necytostatické terapie zasahující přímo molekulární podstatu choroby v širokých historických souvislostech, od počátků poznání choroby jako takové v 19. století až po uvedení nových specifických molekul blokujících patologickou tyrosinkinázovou aktivitu do klinické praxe.
Klíčová slova:
chronická myeloidní leukémie, tyrosinkináza, BCR/ABL, cílená terapie.Cílem následujícího krátkého přehledu je podat informace o moderní terapii z hlediska jejího vývoje, zamyslet se nad tím, jak byla tato moderní, vysoce účinná, ale také extrémně drahá léčba vlastně objevena. Jde o mimořádně zajímavou a napínavou historii s velmi úspěšným dílčím koncem, kterým je současný stav, ale také s neméně zajímavou budoucností. Je to ukázka nesmírné akcelerace pokroku v poslední době a toho, jakého obrovského množství poznatků z mnoha oborů bylo třeba, než byla jejich kvantita taková, že přešla v novou kvalitu – moderní tyrosin-kinásové inhibitory, které kompletně změnily terapii chronické myeloidní leukémie.
Chronická myeloidní leukémie (CML) je maligní klonální myeloproliferativní onemocnění charakterizované expanzí transformovaných primitivních hematopoetických progenitorových buněk. Přirozený průběh onemocnění je charakterizován přechodem z relativně benigní chronické fáze do rychle fatální blastické krize v průběhu 3–5 let. Blastické krizi často předchází tzv. fáze akcelerace. Nejde o frekventní onemocnění, roční incidence je asi 1–2 případy na 100 000 obyvatel (1).
Objev leukémie a kořeny donedávna standardní léčby
První poznání leukémií spadá do první poloviny 19. století. Termín „leukémie“, zprvu „bílá krev“ poprvé použil v roce 1847 Virchow (obr. 1).
Obr. 1. Publikace, ve které byl poprvé použit termín leukémie 
Následujících 100 let jako by se nic nedělo. Kumulovaly se však další poznatky, které posléze vyústily v objev cytostatik. Ve druhé polovině 19. století již byly leukémie rozděleny na akutní a chronické (2), byl použit termín myelogenní leukémie (3) a zavedena sternální punkce pro diagnostiku (4). Klíčové bylo také zavedení speciálního barvení krevních buněk (5).
První světová válka přinesla objev toxických bojových látek. Jednou z nich byl yperit nebo-li hořčičný plyn (mustard gas). Již krátce po válce byl publikován vliv této látky na krevní obraz (6). Této práci dominuje krásný graf ukazující dynamiku bílých krvinek a závěr: „…hořčičný plyn působí toxicky na kostní dřeň, a tak skrze snížení počtu až úplné vymizení leukocytů cirkulujících v krevním oběhu zásadně negativně ovlivňuje schopnost odolávat sekundárním infekcím právě tak, jak se u těchto forem otrav plyny pozoruje …“ Za druhé světové války sice bojové látky nebyly použity, ale byly shromažďovány pro případ potřeby. V prosinci 1943 napadly německé letouny spojenecký přístav Bari v jižní Itálii. Útok byla mimořádně úspěšný a vedl ke katastrofě, při níž také explodovala loď vezoucí 100 tun yperitu. Tato krutá příhoda spolu s velmi podrobným rozborem toxických reakcí u lidí byla publikována v dnes ne běžně čteném časopise „The Military Surgeon“ (7). Poznatky o toxicitě yperitu vedly k odhalení jeho antiproliferativních vlastností a záhy byly syntetizovány další chemicky podobné látky, které zahájily éru protinádorové cytostatické chemoterapie. Byly to alkylační látky, mnohé používané dodnes (např. busulfan, cyklofosfamid, melfalan). Prvním syntetizovaným cytostatikem byl velmi blízký příbuzný yperitu, nitrogen mustard. Chemické struktury látek jsou uvedeny na obrázku 2. První zpráva o jeho klinickém použití vyšla v roce 1946 (8). V úvodu je zmínka, že práce je výsledkem kooperace „ ... Úřadu pro chemické válečnictví, Armády Spojených států amerických, Národní komise pro výzkum obrany…“ a dalších institucí. Toto krátké sdělení z doby před 60 lety shrnulo téměř jako sudička, co dostanou cytostatika do vínku: těžké lokální reakce při aplikaci mimo žílu, nevolnost a zvracení, útlum kostní dřeně a efekt dočasného trvání. Přestože jsou tyto látky svojí genezí, mechanismem účinku a vedlejšími účinky v podstatě drastické, zůstávají, bohužel, dodnes stále pilířem mnohých onkologických postupů. V případě CML tomu tak bylo donedávna, ale dnes se naštěstí situace dramaticky změnila. Od konce 2. světové války k tomu ale vedla ještě velmi dlouhá a klikatá cesta (obr. 2).
Obr. 2. Mustard gas (a) a nitrogen mustard (b) 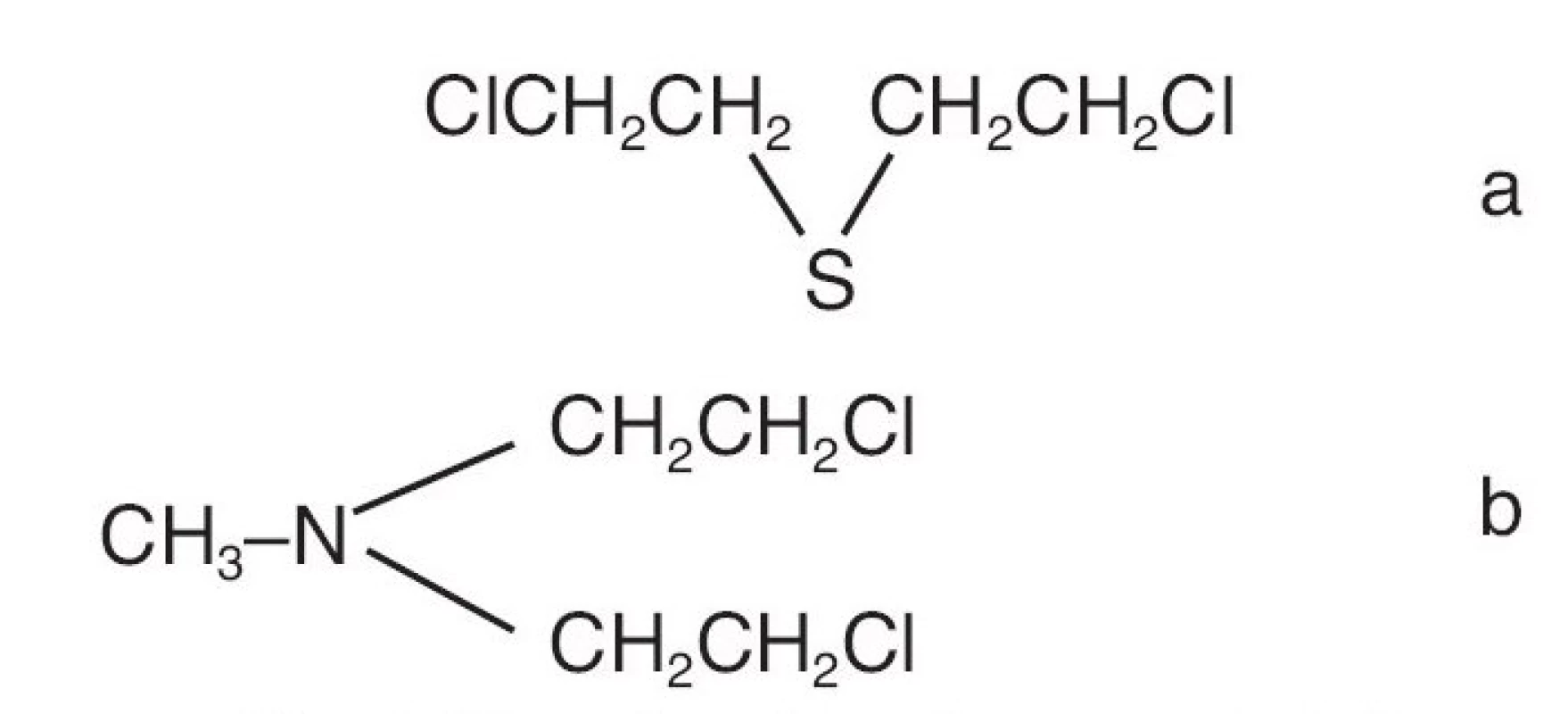
První pozitivní výsledky léčby cytostatiky stimulovaly intenzivní výzkum v této oblasti, který trval desetiletí. Nelze upřít, že cytostatika byla a jsou schopná, přes všechna svoje dramatická omezení, řadu nemocných vyléčit, nebo jim prodloužit život. Jedním z prvních cytostatik byl busulfan (myleran), o jehož syntéze a prvním klinickém použití se můžeme dočíst v roce 1953 (9). V této první práci je popsáno 19 nemocných a již tehdy bylo vidět, že lék chorobu nevyléčí. Přesto se stal na dlouhou dobu klíčovou látkou v terapii CML.
Hydroxyurea byla známa již od roku 1869, ale její protinádorový efekt byl systematicky studován až od konce 50. let 20. století. Výsledkem byla studie fáze I publikovaná v roce 1963 (10). Také hydroxyurea je jako užitečná látka používána dodnes, přestože chorobu nevyléčí.
Alogenní transplantace krvetvorných buněk mají svoje kořeny také ve 2. světové válce. Svržení atomové bomby na jejím konci a následná studená válka s vysokým rizikem globálního jaderného konfliktu stimulovaly výzkum nemoci z ozáření a možností její léčby. Cesta ke klinickým transplantacím byla nelehká a blokovaná řadou neznalostí, zvláště v problematice HLA systému, imunosuprese a oportunních infekcí. Transplantace se začaly pomalu dostávat do klinické praxe od 70. let 20. století (11). První práce o alogenních transplantacích u CML byla publikována v roce 1978 (12). Popisovala 14 nemocných v pokročilé fázi onemocnění a medián přežití byl 43 dnů s jedním přežívajícím 16 měsíců, než došlo k fatálnímu relapsu. Od té doby byla publikována záplava dalších prací týkajících se transplantací krvetvorných buněk u CML a tato metoda se postupně stala jednou z rutinních léčebných procedur. Technologie alogenních transplantací se v průběhu času výrazně vylepšily a pro CML specificky byl zásadní objev možnosti vyléčit relaps imunoterapií pomocí transfuzí dárcovských lymfocytů (13) a zavedení tzv. nemyeloablativních transplantací (transplantací po přípravném režimu s redukovanou intenzitou) (14). Dnes lze transplantacemi dosáhnout velmi dobrých výsledků (15), nicméně tato léčebná metoda stále nepřekonala zcela kruciální problém, a sice kvalifikované oddělení žádoucí imunologické reakce transplantátu proti tumoru od nežádoucí, mnohdy fatální reakce transplantátu proti hostiteli (graft vs. host disease – GvHD). A tak se i dnes, bohužel, může stát, že přežití konkrétního nemocného je podobné mediánu přežití z první výše zmíněné práce o transplantacích u CML, neboli že nemocný na následky vlastní transplantace zemře. Mnoho nemocných má také po transplantaci nezanedbatelné dlouhodobé problémy. I tato metoda, přestože řadu nemocných vyléčila, nebo jim výrazně prodloužila život, se nyní u CML ocitá pod nezadržitelným tlakem moderních cílených léků a je výrazně na ústupu (obr. 3) (16). Dnes je již jako metoda první linie používána výjimečně. Autologní transplantace nikdy nepřekročily rámec experimentální procedury (obr. 3).
Obr. 3. Vývoj alogenních transplantací krvetvorných buněk pro CML v Evropě v posledních letech (upraveno dle (16)) cP – chronická fáze 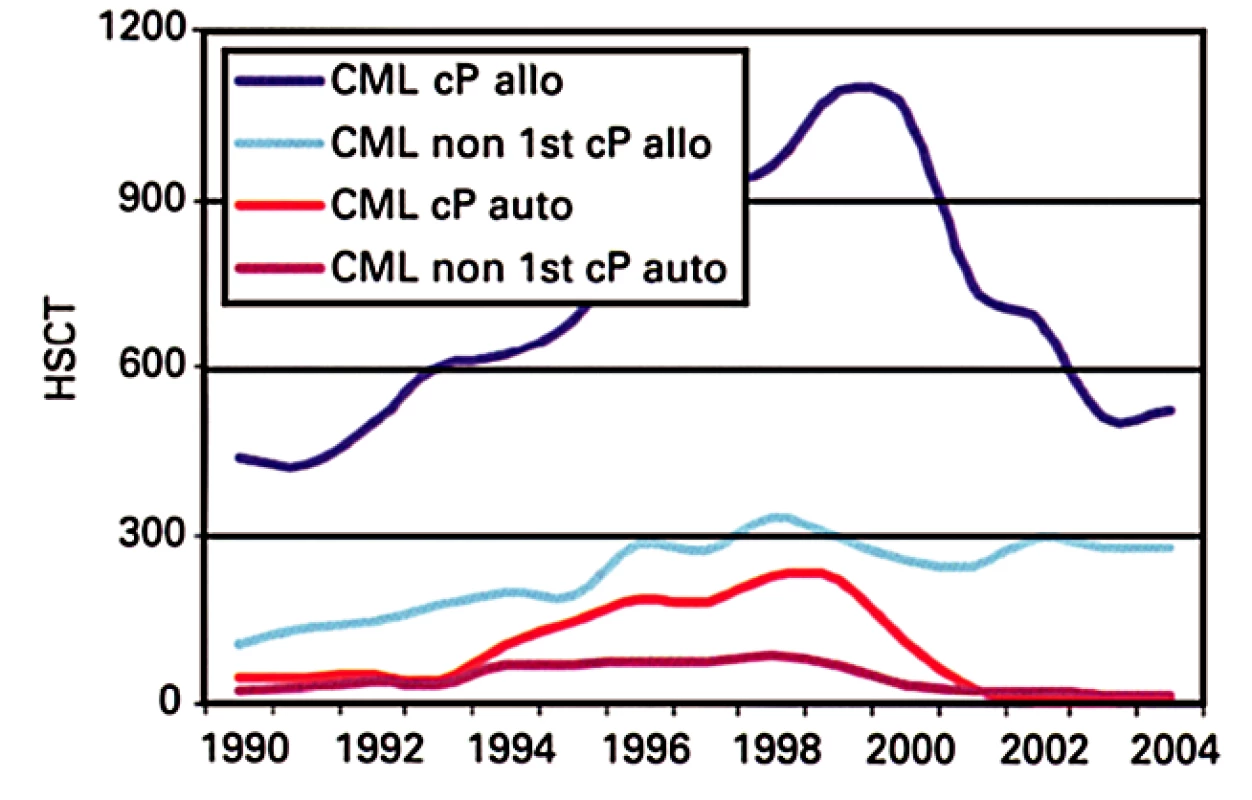
Alogenní transplantace je, bohužel, i po více než 30 letech klinického používání a téměř 50 letech bádání nutno hodnotit jako poměrně necitlivou a z dnešního pohledu přece jen technologicky zastaralou metodu. Zastaralost spočívá zejména v nespecifické a tvrdé eliminaci imunity a krvetvorby příjemce, které je dosaženo celotělovým ozářením a/nebo cytostatiky, tedy prostředky s „válečnými kořeny“. Pro představu, dávka celotělového ozáření bývá u transplantací kolem 10 Gy, tedy asi jako ve vzdálenosti 500–1000 metrů od místa, nad nímž explodovala hirošimská bomba.
Z výše uvedeného vyplývá, že chemoterapie anebo transplantace krvetvorných buněk jsou vlastně prastaré metody. V terapii CML se výrazně uplatnil i jeden novější postup, terapie interferonem alfa. První práce na toto téma byla publikována v roce 1983 (17) a vzbudila obrovský zájem. Záhy se tato léčba stala novým standardem u CML. Technologie genetického inženýrství později farmaceutickým firmám umožnila vyrábět interferon ve velkém. Nicméně i použití interferonu se nyní výrazně zredukovalo. Byť se nejedná o toxickou protinádorovou chemoterapii, také interferon není prost řady vedlejších účinků a nemá zcela specifický účinek na CML. Využívalo se jeho antiproliferačních a imunomodulačních vlastností.
Molekulární podstata nemoci
Ideální by bylo pro každou nemoc poznat její molekulární podstatu a tu cíleně ovlivnit. V onkologii je to zatím spíše výjimka než pravidlo, ale tento trend je jistě do budoucna jediný možný a nyní je v intenzivním vývoji. CML je unikátní modelový příklad. K elegantním účinným tabletkám s minimem vedlejším účinků však vedla velmi složitá a napínavá cesta, plná zásadních objevů. Kořeny rozvoje molekulární cílené terapie můžeme najít v době, kdy chemoterapie zažívala svůj rozkvět a transplantace byly zcela v počátcích – před érou klinické aplikace. Stručně zmíníme některé klíčové práce. Většinou byly publikovány ve špičkových vědeckých časopisech, jako je Science, Nature a Cell.
1960. Philadelphský chromozóm. V tom roce popsali dva autoři ze Spojených států amerických z Philadelphie své pozorování malého chromozómu u 7 nemocných s CML (18). Zdálo se jim, že je to jediná leukémie, kde lze takovou abnormalitu konzistentně najít. Přestože jejich sdělení tvořily 3 malé odstavečky, bylo to sdělení zásadní (obr. 4). Jejich závěr byl velmi prorocký: „ … nálezy naznačují možný vztah mezi pozorovanou chromozomální abnormalitou a chronickou granulocytární leukémií …“ (obr. 4).
Obr. 4. První publikace o dnes tzv. Philadelphském chromozómu 
1973. Chromozomální translokace. Onen malý chromozóm popsaný v předchozím odstavci je chromozómem 22, z něhož je velká část translokována na chromozóm 9 a naopak, z chromozómu 9 je malá část translokována na chromozóm 22. Dnes to bereme jako samozřejmost a označujeme t(9;22). Že by se mohlo jednat o translokaci, bylo ale popsáno až v roce 1973 (19). Tato práce obsahuje domněnku, že: „ … by se mohlo jednat o dosud nerozpoznanou translokaci mezi dlouhým raménkem 22. a dlouhým raménkem 9. chromozómu, tvořící chromozóm 9q+…. “
1982. Role ABL. ABL gen je lidský homolog v-abl onkogenu Abelsonova viru myší leukémie. Vir byl popsán Abelsonem v roce 1970 (20). V roce 1982 bylo ukázáno, že lidský ABL gen je lokalizován na chromozómu 9 (21): „… nyní můžeme prokázat, že lidské ekvivalenty genů c-fes a c-abl jsou umístěny na lidských chromozómech 15, resp. 9. Je zajímavé, že oba tyto chromozómy se podílejí na specifických přestavbách nalézaných u určitých typů lidských nádorových onemocnění …“
V témže roce se ukázalo, že ABL gen je účasten translokace u nemocných s CML (22): „ … náš závěr je takový, že u CML je gen c-abl translokován z chromozómu 9 na chromozóm 22q-. Tento nález je přímou ukázkou reciproké výměny mezi dvěma chromozómy a naznačuje, že gen c-abl sehrává roli ve vzniku CML …“
Všechna tato mimořádně závažná zjištění jednoznačně ukazovala správným směrem k patogenezi CML s obviněním ABL genu. Záhy následovaly další objevy.
1984. Definice BCR. Groffen et al. v tomto roce publikovali práci, v níž ukázali, že ke zlomům na 22. chromozómu dochází v relativně malé oblasti, kterou nazvali BCR (breakpoint cluster region = oblast bodů zlomu) (23): „ … u 17 pacientů byla zlomová místa na chromozómu nalezena v ohraničené oblasti o velikosti 5,8 kb, pro kterou navrhujeme termín oblast bodů zlomu (breakpoint cluster region – bcr). Vysoká specifita nálezů chromozomálních zlomů v bcr u pacientů s Ph1-pozitivní CML je silným předpokladem účasti bcr u tohoto typu leukémie …“
1984. ABL tyrosin-kinázová aktivita v buňkách s translokací t(9;22). Konopka et al. v tomto roce ukázali, že v buňkách buněčné linie K562, které nesou tuto translokaci, je abnormální ABL protein s jasnou tyrosinkinázovou aktivitou (24): „ … v leukemické buněčné linii K562 jsme detekovali abnormální lidský protein c-abl (P210) s tyrosinkinázovou aktivitou. Tento pozměněný protein c-abl může mít důležitý vztah k mechanismu aktivace tohoto onkogenu …“
1985. Fúzní protein BCR-ABL. Na podkladě analýzy RNA se ukázalo, že se v případě CML jedná o fúzní transkript 2 genů, BCR a ABL (25): „ … charakterizace 8-kb RNA specifické pro chronickou myeloidní leukémii ukazuje, že jde o fúzní transkript dvou genů. Fúzní protein coby jeho produkt je pravděpodobně zapojen do maligního procesu …“
1990. Důkaz patogenetické role BCR-ABL. V této době již byl pokrok v dalších oblastech molekulární biologie a bylo možné transfekovat gen BCR-ABL do myších krvetvorných buněk a tyto buňky transplantovat jiným syngenním myším. Ukázalo se, že příjemci rozvinuli různé hematologické choroby, mezi nimiž dominovala myeloproliferace podobná CML (26): „ … tyto výsledku ukazují, že exprese proteinu P210 může dát vznik chronické myeloidní leukémii …“
Specifická, cílená léčba blokací BCR-ABL tyrosin-kinázové aktivity
Pokroky v molekulární biologii, biochemii a strukturální biologii umožnily syntetizovat různé látky s účinkem v cílené blokaci určitých proteinových katalytických schopností. V roce 1988 byla publikována práce o malých molekulách, schopných inhibovat tyrosin-kinázovou aktivitu receptoru pro epidermální růstový faktor (EGF – epidermal growth factor) (27). Autoři práci uzavírají úvahou o možnosti racionálního návrhu selektivních blokátorů různých tyrosin-kináz. Tyto látky by měly mít antiproliferativní účinky ve specifických patologických podmínkách vázaných na určité tyrosin-kinázy. Pro tyto látky byl navržen termín tyrphostiny.
1996. CGP 57148B = STI 571= imatinib. V roce 1996 byla publikována experimentální práce o látce, tehdy označované jako CGP 57148B, později označené jako STI 571 (signal transduction inhibitor = inhibitor přenosu signálů) a ještě později jako imatinib, látce, kterou nyní známe jako lék Glivec (28) (obr. 5). CGP 57148 byla syntetizována farmaceutickou firmou CIBA Pharmaceutical Division (Ciba-Geigy v roce 1996 fúzovala s firmou Sandoz za vzniku firmy Novartis). Tato látka blokovala autofosforylaci v-Abl a receptoru pro PDGF a také inhibovala růst v-abl- transformovaných buněk. Ve stejném roce byly též publikovány práce, které ukazovaly, že tato látka tlumí růst buněk exprimujících BCR-ABL protein in vitro i in vivo (myší model) (29, 30). Byly tedy položeny základy pro její využití jako léku pro CML: „ … proliferace a nádorová formace buněk exprimujících Bcr-Abl byla touto sloučeninou specificky inhibována. Tato látka může být užitečná v terapii bcr-abl pozitivních leukémií … léčebný režim zaručující nepřetržitou blokádu fosforylační aktivity Bcr-Abl, podaný v intervalu 11 dní, vyléčil 87–100 % pokusných myší…“ (obr. 5).
Obr. 5. Chemická struktura imatinibu 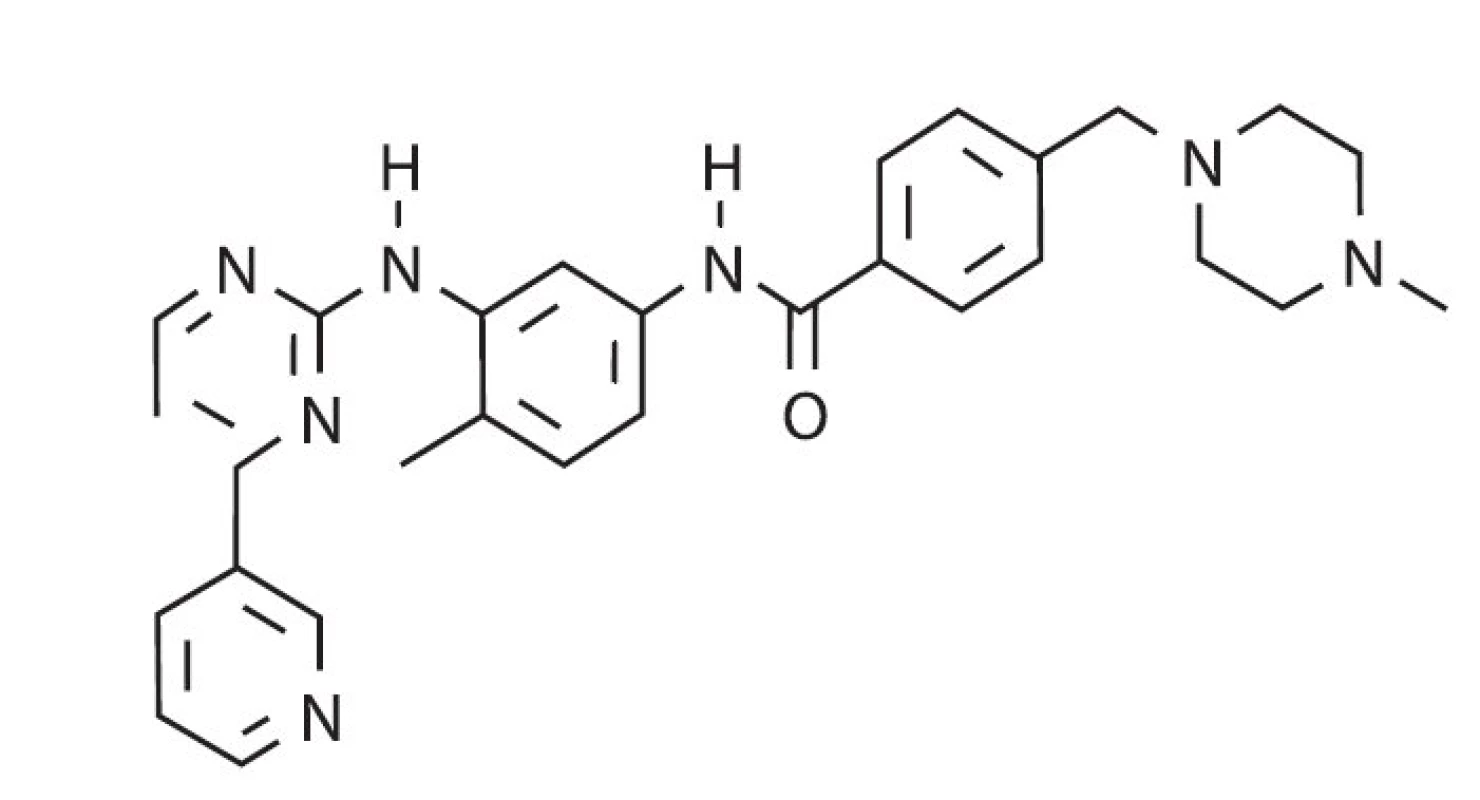
1999. Klinické využití STI 571. V roce 1999 bylo na sjezdu Americké hematologické společnosti (The American Society of Hematology) referováno o využití tohoto specifického blokátoru pro léčbu CML (31). Bylo konstatováno, že: „ … tato data ukazují, že specifický inhibitor tyrosinkinázy Abl je u CML vysoce účinný… tato studie je příkladem úspěšného vývoje léku založeného na existenci pro lidský nádor specifické molekulární abnormality …“
Závěr
Vzhledem k tomu, že výše uvedená práce shrnuje historii objevu inhibitorů tyrosin-kinázové aktivity fúzního proteinu BCR-ABL pro terapii CML, mohli bychom na tomto místě skončit. Je však vhodné přidat některé doplňující informace. Mechanismus účinku imatinibu byl podrobněji objasněn krystalografickými daty (32). Záhy se také ukázalo, jak je příroda dynamická, a byla popsána rezistence na imatinib (33).
Imatinib (lék Glivec) zcela zásadně změnil terapii CML k lepšímu a za relativně krátkou dobu jeho klinického používání již bylo publikováno obrovské množství dat a studií (34). Vzhledem k tomu, že se princip cílené terapie CML ukázal jako nesmírně účinný, byly brzy studovány další látky podobného mechanismu účinku. Takovou látkou, která je již nyní regulérně registrovaná, je dasatinib (lék Sprycel) (35). Dasatinib blokuje i tzv. Src kinázy a je vhodným lékem ke zvládání případů rezistentních na imatinib. Jeho význam jako léku první linie pro CML se intenzivně studuje.
Bádání o CML se posunulo zásadně dál do dalších tajů podstaty molekulární patogeneze choroby. Studuje se leukemická kmenová buňka, rezistence na imatinib a testují se nové léky. O některých těchto otázkách bylo, nebo v nejbližší budoucnosti bude v České republice přehledně pojednáno (36–38).
Nutno zmínit, že tento nebývalý pokrok je možný jen v součinnosti s novými poznatky zvláště na poli molekulární biologie, chemie, strukturální biologie, informatiky a dalších oblastí. Nepochybně se tedy v blízké budoucnosti dočkáme dalších nových léků, vedoucích ke zlepšení naší zatím mnohdy neuspokojivé léčby.
Zkratky
bcr – oblast bodů zlomu (breakpoint cluster region)
CML – chronická myeloidní leukémie
EGF – epidermální růstový faktor (epidermal growth factor)
GvHD – graft vs. host disease
STI 571 – inhibitor přenosu signálů (signal transduction inhibitor)
prof. MUDr. Jiří Mayer, CSc.
Interní hematoonkologická klinika FN
Jihlavská 20, 625 00 Brno
fax: +420 532 233 609, e-mail: jmayer@fnbrno.cz
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Probiotics and the skinČlánek Laureáti Nobelovy ceny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Venózny ulkus – súčasné pohľady na etiopatogenézu, diagnostiku a terapiu
- Léčba chronické myeloidní leukémie – méně běžný pohled na moderní postupy
- Postižení periferního nervového systému a míra motorického postižení u Parkinsonovy nemoci: korelační studie
- Vývoj respirační morbidity dětí ve vztahu k jejich expozici pasivnímu kouření
- Allgemeine Klinische Psychologie
- Parenterálna nutrícia pred resekčným výkonom na hornom gastrointestinálnom trakte
- Rizikové faktory vzniku atelektázy po plicní lobektomii
- Analoga somatostatinu v léčbě karcinoidu
- Stimulace sakrálního nervu v léčbě neurogenní anální inkontinence
- K životnímu jubileu doc. MUDr. Aleny Lobovské, CSc.
- Alfred Kohn, profesor histologie na Německé univerzitě v Praze
- HISTORICKÉ LÉKAŘSKÉ NÁSTROJE A POMŮCKY,
- Acute respiratory tract infections: a potential trigger for the acute coronary syndrome
- Probiotics and the skin
- Suicide in China: unique demographic patterns and relationship to depressive disorder
- Immunology of asthma and chronic obstructive pulmonary disease
- Epidemiologic and clinical features of anaphylaxis in Korea
- Doc. MUDr. Vladimír Puchmayer, CSc.
- Prof. MUDr. Marie Pešková, DrSc.
- Spolek lékařů českých v Praze
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rizikové faktory vzniku atelektázy po plicní lobektomii
- Analoga somatostatinu v léčbě karcinoidu
- Stimulace sakrálního nervu v léčbě neurogenní anální inkontinence
- Parenterálna nutrícia pred resekčným výkonom na hornom gastrointestinálnom trakte
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



