-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv umělé plicní ventilace na orgánové funkce
Autoři: D. Astapenko 1,2; V.- Černý 1 8
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové, Hradec Králové 1; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové, Hradec Králové 2; Dept. of anaesthesiology, perioperative medicine and intensive care, Hospital Bory, Bratislava, Slovak Republic 3; Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně v Ústí nad Labem, Masarykova, nemocnice v Ústí nad Labem, Ústí nad Labem 4; Klinika anesteziologie a resuscitace, Fakultní nemocnice Královské Vinohrady, Praha 5; Department of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Nova Scotia, Canada 6; Technická univerzita v Liberci 7; Constantine the Philospher University in Nitra, Faculty of Social Sciences and Health Care, Slovak Republic 8
Vyšlo v časopise: Anest. intenziv. Med., 33, 2022, č. 5, s. 223-224
Kategorie: Klinická fyziologie
doi: https://doi.org/10.36290/aim.2022.045Úvod
Umělá plicní ventilace (UPV) představuje jeden z nejčastějších postupů přístrojové podpory orgánových funkcí v intenzivní péči. Aplikace pozitivního přetlaku do dýchacích cest a plicního parenchymu je spojena s řadou změn, které (v různé míře klinické významnosti) ovlivňuji fyziologii nejenom dýchacího systému, ale i ostatních orgánů či tkání. Znalost dopadů UPV na fyziologické funkce organismu je zásadní nejenom z pohledu nastavování parametrů ventilační podpory, ale rovněž pro správnou interpretaci všech orgánových změn, které jsou s poskytováním UPV spojeny.
Interakce dýchacího a oběhového sytému v průběhu umělé plicní ventilace a jejich klinická manifestace
Ventilace a výměna plynů v plicích je podmíněna změnami pleurálního tlaku. Při nádechu dochází ke kontrakci bránice a mezižeberních svalů, což generuje podtlak v pleurálním prostoru následovaný pohybem vzduchu do plic. Při výdechu, který je za klidových podmínek pasivní, se vzduch pohybuje opačným směrem, zásadní roli při zpětném „smršťování“ plic má plicní elastance. Cyklické tlakové změny pleurálního tlaku se přenáší nejen na plíce, ale i na srdce, velké cévy (ale i ostatní tkáně). Podtlak generovaný nádechem usnadňuje žilní návrat a vede ke zvýšení tepového objemu s poklesem tepové frekvence. Při výdechu dochází naopak ke snižování žilního návratu v důsledku zvýšení nitrohrudního tlaku, současně dochází k mírnému zvýšení tepové frekvence.
Cyklické výkyvy tepové frekvence v průběhu dechového cyklu se označují jako tzv. respirační arytmie a vyskytují se zejména u mladších jedinců.
Z fyzikální podstaty dochází během UPV ke změnám tlaku v pleurálním prostoru. Ventilátorem generovaný přetlak (vůči atmosférickému tlaku) v dýchacích cestách je hlavní hnací silou distální distribuce sloupce během inspiria, expirium je pasivní. Při umělém nádechu v tlakově kontrolovaném režimu je dýchací okruh ventilátoru „natlakován“ na předem definovanou hodnotu (Pinsp). Tento tlak se přenáší přes plicní parenchym do pleurálního prostoru, na srdce a velké cévy umístěné v mediastinu. Dochází ke snížení žilního návratu a snížení tepového objemu komor. Dolní dutá žíla bývá v důsledku zvýšeného nitrohrudního tlaku distendována. V průběhu inspiria během UPV dochází rovněž ke snížení afterloadu komor (tab. 1). Zvýšení pleurálního tlaku během inspiria může vést k oběhové nestabilitě z důvodu redukce preloadu. Kolísání srdečního výdeje v závislosti na UPV se využívá v predikci odpovědi na tekutinovou terapii a stavu prealoadu.
Tab. 1. Tlakové poměry v pleurálním prostou a důsledky na pohyb vzduchu a kardiopulmonální interakce 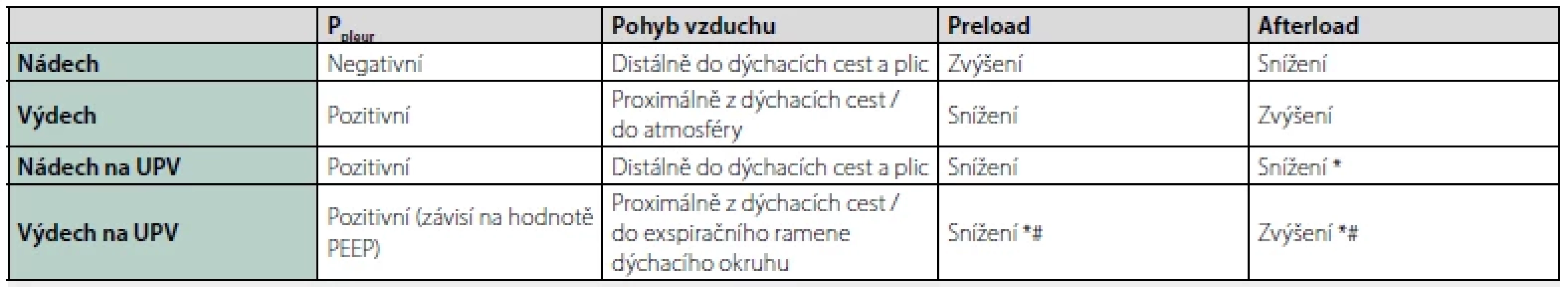
Ppleur – pleurální tlak, *(výsledná změna závisí na intramurálním tlaku levé komory, volemii, nitrohrudním tlaku, nastavení UPV), # (relativně k výchozí hodnotě) Poznámka: Pozitivní tlak v pleurálním prostoru vzniká za fyziologických okolností jen při kašli, kýchání nebo usilovném výdechu proti odporu (Valsalvův manévr). Skutečnost, že pacienti na UPV mají v pleurálním prostoru trvale pozitivní tlak je nutno zohlednit vždy, když hledáme možné příčiny oběhové nestability v konkrétní klinické situaci.
Poškození plic
Plicní intersticium při UPV neplní tak dostatečně jednu ze svých klíčových biologických funkcí – mechanická podpora plicních alveolů při jejich distenzi během inspiria. Naopak, umělým vdechem dochází ke stlačování vaziva intersticiální tkáně. Mechanické působení na plicní parenchym je jedním z podkladů ventilátorem indukovaného plicního poškození (tzv. VILI – ventilator induced lung injury) (obr. 1) [1]. K poškození plic umělou plicní ventilací dochází nejenom v rámci konvenční UPV, ale může k němu dojít i v souvislosti s použitím tzv. neinvazivní ventilace, což se dostalo do popředí zájmu během pandemie covidu-19, kdy část pacientů byla ventilována zpočátku neinvazivně [2]. Nadměrným dechovým úsilím, nerovnoměrným rozložením ventilace a perfuze a asynchronie s nastaveným ventilačním režimem vedly často k tzv. pacientem indukovanému plicnímu poškození (P‑SILI – patient self-inflicted lung injury) [3]. Novým konceptem, který se snaží minimalizovat pacientovu asynchronii s modalitou UPV je nejen plíce protektivní nastavení ventilace, ale i sedace [4].
Obr. 1. Mikroanatomie plicní respirační jednotky a změny ve funkci intersticiálního vaziva při umělé plicní ventilaci 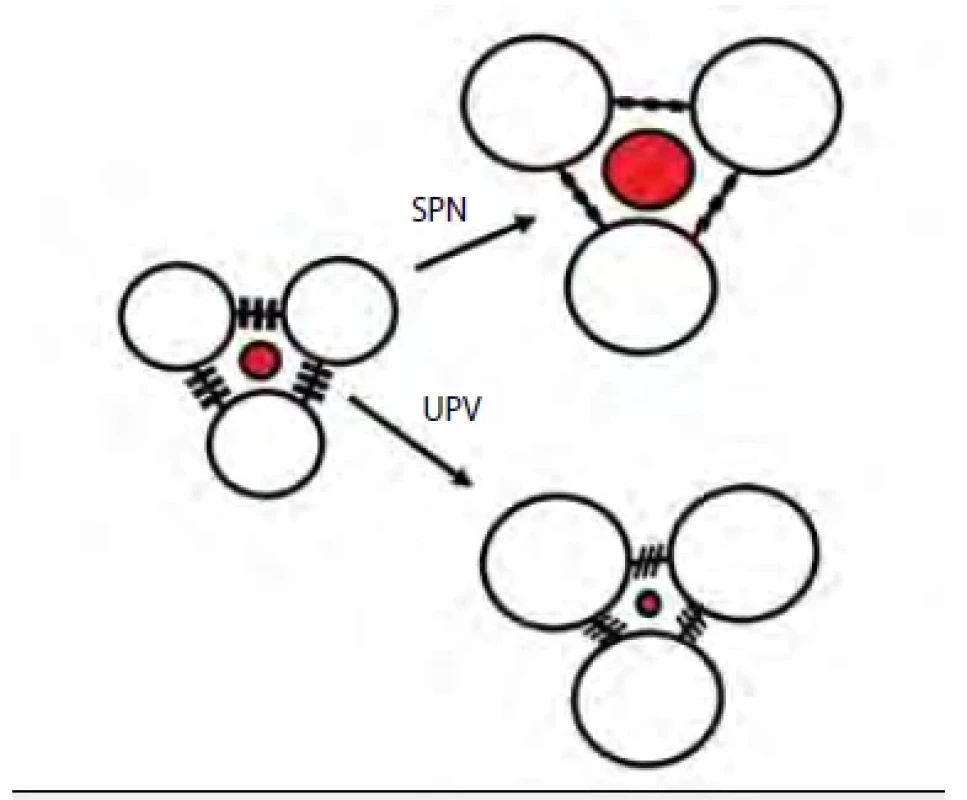
SPN – spontánní dýchání, UPV – umělá plicní ventilace Důsledkem VILI (a potažmo i P‑SILI) je intracelulární stres alveolárních pneumocytů, porucha tvorby surfaktantu a indukce zánětové odpovědi plicního parenchymu. Plíce začnou produkovat cytokiny, které o vzniklém nebezpečí pro plíce „informují“ okolní tkáně a orgány a v konečném důsledku tak může dojít ke vzniku dysfunkce či selhání jiných orgánů, aniž by tyto byly primárně jakkoliv postiženy (např. syndrom pulmo‑renální, pulmo‑hepatální atd.). Patofyziologické konsekvence UPV na okolních orgánech znázorňuje obrázek 2.
Obr. 2. Patofyziologické konsekvence umělé plicní ventilace na okolních orgánech 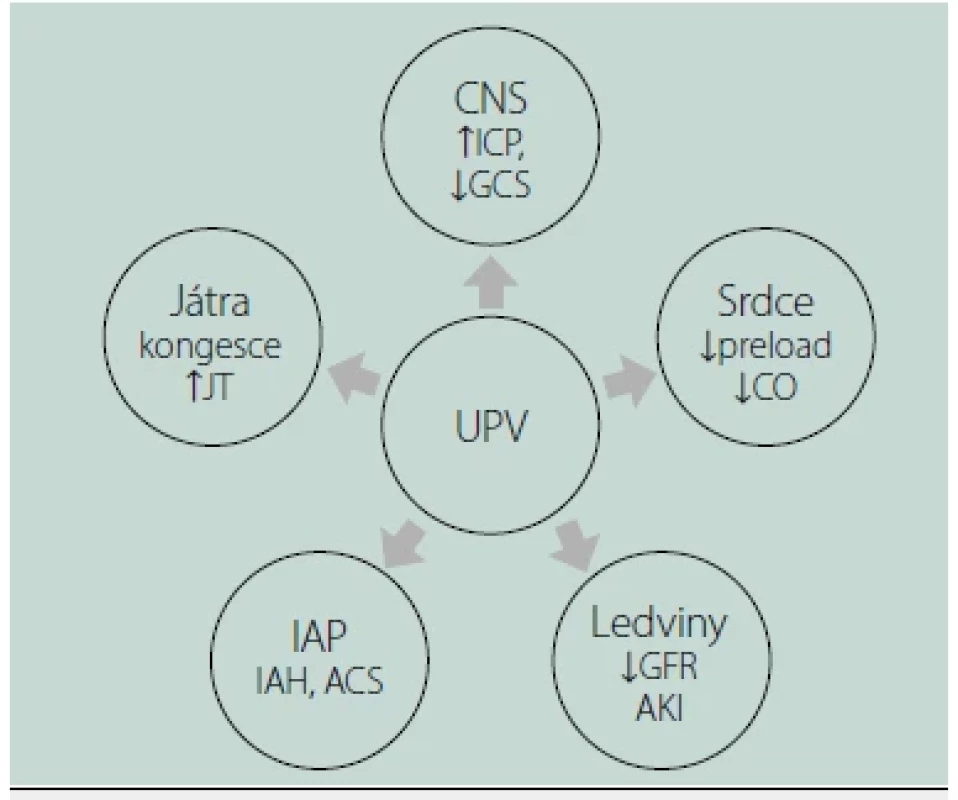
ACS – břišní kompartment syndrom, AKI – akutní selhání ledvin, CNS – centrální nervový systém, CO – srdeční výdej, GCS – Glasgow Coma Scale, GFR – glomerulární filtrace, IAH – nitrobřišní hypertenze, IAP – nitrobřišní tlak, ICP – intrakraniální tlak, JT – jaterní transaminázy Další (pato)fyziologické souvislosti umělé plicní ventilace
Ventilace pozitivním tlakem ovlivňuje kromě dýchacího a oběhového systému i ostatní orgány a tkáně. Hlavním mechanismem je (v různé míře klinické významnosti) ovlivnění žilního návratu, zpomalení žilní drenáže a související kongesce v parenchymatózních orgánech (zejména orgány dutiny břišní, ledviny, mozek). Pozitivní přetlak navíc působí nefyziologicky na plicní parenchym, který na to není evolučně adaptován. Žilní kongesce a intersticiální edém jsou dnes považovány za významné mechanismy podílející se na vzniku dysfunkce parenchymatózních orgánů (např. akutní renální selhání) v průběhu kritických stavů [5].
Body k zapamatování
- Umělá plicní ventilace zásadním způsobem mění tlakové poměry v hrudníku.
- Umělá plicní ventilace je zdroj iatrogeního poškození plic.
- Zánětová reakce plicní tkáně vyvolaná umělou plicní ventilací může vést k poškození vzdálených orgánů.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. David Astapenko, Ph.D., MBA
Článek přijat k tisku: 27. 11. 2022
Cit. zkr: Anest intenziv Med. 2022;33(5):223-224
Zdroje
1. Silva PL, Ball L, Rocco PRM, Pelosi P. Physiological and Pathophysiological Consequences of Mechanical Ventilation. Semin Respir Crit Care Med Semin Respir Crit Care Med. 2022;43(3):321-34.
2. Sullivan ZP, Zazzeron L, Berra L, Hess DR, Bittner EA, Chang MG. Noninvasive respiratory support for COVID-19 patients: when, for whom, and how? J Intensive Care. 2022 Jan 15;10(1):3. doi: 10.1186/s40560-021-00593-1. PMID: 35033204; PMCID: PMC8760575.
3. Kouch M, Evans L. Is Time-of-Flight Ready for Take Off to Measure Patient Self-Inflicted Lung Injury? Crit Care Med. 2022;50(1):168-70.
4. Kassis EB, Beitler JR, Talmor D. Lung-protective sedation: moving toward a new paradigm of precision sedation. Intensive Care Med. 2022 Oct 14. doi: 10.1007/s00134-022 - 06901-z. Epub ahead of print. PMID: 36239747.
5. Husain-Syed F, Slutsky AS, Ronco C. Lung-Kidney Cross-Talk in the Critically Ill Patient. Am J Respir Crit Care Med. 2016 Aug 15;194(4):402-14. doi: 10.1164/rccm.201602-0420CP. PMID: 27337068.
6. Malbrain MLNG, De Keulenaer BL, Khanna AK. Continuous intra-abdominal pressure: is it ready for prime time? Intensive Care Med. 2022 Oct;48(10):1501-1504. doi: 10.1007/ s00134-022-06780-4. Epub 2022 Aug 4. PMID: 35925322; PMCID: PMC9468118.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek XIV. konference AKUTNĚ.CZ
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2022 Číslo 5- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- PR negramotnost anesteziologů?
- Terminologie a praxe paliativní péče na jednotkách intenzivní péče v České republice: výsledky studie PEOpLE‑C19
- Impakt faktor – jak poznat ten „pravý“?
- Suxamethonium – stále potřebné?
- Podvodné (predátorské) časopisy
- Vliv umělé plicní ventilace na orgánové funkce
- Dvojnásobné farmakologické jubileum
- Komentář k článku: Rokuroniem indukovaný anafylaktický šok v těhotenství úspěšně léčený podáním sugammadexu
- European Airway Conference (EAC) 2022
- XIV. konference AKUTNĚ.CZ
- Zpráva z 35. kongresu Evropské společnosti intenzivní medicíny (ESICM)
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Suxamethonium – stále potřebné?
- Vliv umělé plicní ventilace na orgánové funkce
- Impakt faktor – jak poznat ten „pravý“?
- PR negramotnost anesteziologů?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



