-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prenatální diagnostika syndromu Noonanové u plodů se zvýšeným šíjovým projasněním a normálním karyotypem
Prenatal diagnosis of Noonan syndrome in fetuses with increased nuchal translucency and a normal karyotype
Objective: Noonan syndrome (NS), one of the most common RASopathies, has an estimated incidence of 1 in 1,000–2,500 live births. In the prenatal period increased nuchal translucency, hygroma colli, hydrops fetus, congenital heart disease, kidney defects, larger amount of amniotic fluid can be observed in affected fetuses with this syndrome. In the fetuses with normal karyotype and no microdeletion/microduplication syndromes the examination of selected genes for RASopathies was added. The aim of the study was to evaluate the clinical benefit of massively parallel sequencing (MPS) of susceptible fetal DNA for NS, i.e., the diagnostic yield on the one hand and the proportion of detected variants of unknown significance (VOUS) on the other.
Design: Clinically diagnostic.
Setting: Centrum prenatální diagnostiky, Brno, s.r.o; Cytogenetická laboratoř Brno, s.r.o.
Methods: Samples of amniotic fluid or chorionic villus were analyzed. Selected genes associated with RASopathies were analyzed in case of the negative result of karyotype and array-CGH. A panel of twenty genes was investigated by MPS.
Results: In the two-years period, Noonan syndrome was detected in 10 from 95 investigated fetuses. This represents a 10.5% diagnostic efficiency of the method. DNA variants of unknown significance were detected in 10 fetuses. A segregation analysis helped to clarify their meaning in six fetuses.
Conclusion: MPS allows fast molecular-genetic diagnosis of RASopathies already in the prenatal period. This method contributes to the clarification not only of phenotypic manifestations in already born individuals but also of ultrasound findings in fetuses with both normal karyotype and aCGH.
Keywords:
RASopathies – Noonan syndrome – nuchal translucency – NT – fetal hydrops – cystic hygroma – heart defect – massively parallel sequencing – MPS
Autoři: M. Matyášová 1; Z. Dobšáková 1; M. Hiemerová 1; J. Kadlecová 1; D. Nikulenkov Grochová 1; E. Popelínská 1; E. Svobodová 1; P. Vlašín 2
Působiště autorů: Cytogenetická laboratoř Brno, s. r. o, vedoucí laboratoře RNDr. E. Popelínská 1; Centrum prenatální diagnostiky Brno, s. r. o, jednatelé MUDr. P. Vlašín a MUDr. M. Čuprová 2
Vyšlo v časopise: Ceska Gynekol 2019; 84(3): 195-200
Kategorie: Klinicky diagnostická studie
Souhrn
Cíl studie: Syndrom Noonanové (NS), jedna z nejčastějších RASopatií, má odhadovanou incidenci 1 z 1000 až 2500 živě narozených jedinců. V prenatálním období lze u postižených plodů s tímto syndromem pozorovat zvýšené šíjové projasnění, hygroma colli, hydrops plodu, vrozené srdeční vady, vady ledvin, lymfatické vaky nebo větší množství plodové vody. U plodů s těmito nálezy byla při nálezu normálního karyotypu a po vyloučení mikrodelečních/mikroduplikačních syndromů doplněna prenatální diagnostika i o vyšetření vybraných genů pro RASopatie. Cílem studie bylo zhodnotit klinický přínos masivně paralelního sekvenování (MPS, massively parallel sequencing) DNA plodů suspektních pro NS, tj. diagnostickou výtěžnost na jedné straně a podíl detekovaných variant nejasného významu na straně druhé.
Typ studie: Klinicky diagnostická.
Název a sídlo pracoviště: Centrum prenatální diagnostiky, Brno, s.r.o.; Cytogenetická laboratoř Brno, s.r.o.
Metodika: Analyzovány byly vzorky plodových vod, resp. choriových klků. Z nich izolovaná DNA byla po zjištění normálního karyotypu a array-CGH (aCGH) postoupena k analýze genů asociovaných s RASopatiemi metodou MPS.
Výsledky: Ve sledovaném dvouletém období byl NS potvrzen celkem u 10 z 95 vyšetřovaných plodů. To představuje 10,5% diagnostickou výtěžnost metody. Celkem u 10 plodů byla detekována varianta DNA nejasného významu (VOUS, variants of unknown significance), následná segregační analýza pomohla objasnit její význam u šesti plodů.
Závěr: MPS umožňuje rychlou molekulárně-genetickou diagnostiku RASopatií již v prenatálním období. Tato metoda tak přispívá k objasnění nejen fenotypových projevů u již narozených jedinců, ale také ultrazvukových nálezů u plodů s normálním karyotypem i aCGH.
Klíčová slova:
RASopatie – syndrom Noonanové – šíjové projasnění – NT – hydrops plodu – cystický hygrom – srdeční vada – masivně paralelní sekvenování – MPS
ÚVOD
RASopatie představují skupinu syndromů, jejichž příčinou jsou zárodečné mutace v genech, které kódují komponenty signální dráhy RAS/MAPK [2]. Tato dráha je klíčová pro regulaci proliferace, diferenciace a přežívání buněk [4]. Do této skupiny patří řada onemocnění, např. syndrom Noonanové (OMIM #163950), CBL syndrom (#613563), Costello syndrom (#218040), hereditární gingivální fibromatóza (#135300), Jaffe Campanacciho syndrom (#162200), kardio-facio-kutánní syndrom (#115150), Legius syndrom (#611431), LEOPARD syndrom (#151100), Neurofibromatosis-Noonan syndrom (#601321), neurofibromatóza typu 1 (#162200), neurofibromatóza typu 2 (#101000), Noonan like syndrome with loose anagen hair (#607721), Watsonův syndrom (#193520) [9]. Přestože má každý syndrom svůj jedinečný fenotyp, nacházíme mezi nimi i řadu společných znaků. Jedná se například o kraniofaciální dysmorfismy, kardiovaskulární malformace, kožní, oční, svalové a kosterní abnormality, poruchy kognitivních schopností, hypotonii a zvýšené riziko vzniku nádorových onemocnění [2, 10]. Molekulárně genetická metoda masivně paralelního sekvenování (MPS) umožňuje nalézt kauzální variantu DNA, a tím pomoci specifikovat konkrétní syndrom RASopatií.
Poměrně častým onemocněním ze skupiny RASopatií je syndrom Noonanové (NS) s autozomálně dominantním typem dědičnosti. Incidence NS je přibližně 1 z 1000–2500 živě narozených jedinců. Jedinci s tímto syndromem jsou charakterizováni faciálním dysmorfismem (např. hypertelorismus, širší kořen nosu, nízko posazené uši, široký krk), nízkou postavou, srdeční vadou různého typu (nejčastěji pulmonální stenóza, hypertrofická kardiomyopatie, defekt atriálního septa), defekty hrudníku a páteře, mentální retardací různého stupně atd. [9].
NS se může projevovat již intrauterinně. Při ultrazvukovém vyšetření plodu mohou být patrné určité abnormality, jako jsou zvýšené šíjové projasnění (NT) a/nebo vrozená srdeční vada, vady ledvin, hygroma colli, lymfatické vaky, hydrops plodu, ascites, hydrothorax, polyhydramnion [3].
Nejčastější příčinou NS je zárodečná varianta v genu PTPN11 (přibližně 50 % všech pacientů s NS), dále pak v genech SOS1 (11 %), RAF1 (5 %), KRAS (1,5 %), či A2ML1, BRAF, LZTR1, MAP2K1, NRAS, RASA2, RIT1, RRAS, SHOC2 [1, 5].
Od října 2016 byla v Cytogenetické laboratoři Brno zavedena metoda masivního paralelního sekvenování genů asociovaných s RASopatiemi. Plody vyšetřené v Centru prenatální diagnostiky Brno a na externích pracovištích s patřičnými ultrazvukovými nálezy suspektními pro NS byly indikovány k danému vyšetření MPS. Vzhledem k vyšetřování prenatálních vzorků byl v laboratoři nastaven harmonogram metody pro nižší počet vzorků, což zajišťuje zkrácení časové prodlevy od odběru vzorku po vydání výsledku.
MATERIÁL A METODIKA
V dvouletém období (10/2016 až 11/2018) bylo vyšetřeno 95 prenatálních vzorků suspektních pro NS. Jednalo se o vzorky DNA izolované z plodových vod, resp. choriových klků; primárních, resp. kultivovaných. Izolace DNA na našem pracovišti probíhala pomocí magnetického izolátoru MagCoreNucleic Acid Extrator (RBC Bioscience), nebo byla dodána již izolovaná DNA. Vždy byla provedena kontrola potenciální kontaminace vzorku mateřskou DNA. Vzorky byly postoupeny k analýze RASopatií za podmínky normálního výsledku karyotypu a array-CGH (mikrodelece/mikroduplikace).
MPS analyzuje dvacet vybraných genů, jejichž mutace jsou podle dosavadních poznatků asociovány s vývojem RASopatií. Analýza je prováděna podle protokolu HaloPlex HS (Agilent, HPST). Připravená knihovna vzorků je následně sekvenována přístrojem MiSeq (Illumina, Genetica). Data jsou filtrována (podle populační frekvence, konsekvence) a podrobně zkoumána za pomoci několika bioinformatických nástrojů a databází (např. SureCall – Agilent, NCBI ClinVar, MutationTaster, HumanSplicingFinder, NSEuroNet, interní databáze aj.). Vybrané varianty DNA jsou klasifikovány do pěti tříd podle predikovaného klinického významu (s nejvyšší pravděpodobností patogenní, potenciálně patogenní, varianta nejasného významu, potenciálně benigní, benigní) [11]. Vybrané varianty jsou potvrzovány Sangerovým sekvenováním. Toto sekvenování slouží také pro zjištění, zda se jedná o de novo původ varianty, případně k segregační analýze v rodině daného probanda.
VÝSLEDKY
Z 95 vyšetřených plodů se suspektními ultrazvukovými nálezy pro NS bylo pro tento syndrom pozitivních deset (kauzální varianty byly detekovány v genech LZTR1, PTPN11, RAF1, RIT1). To představuje 10,5% diagnostickou výtěžnost. Nejvíc změn bylo nalezeno v genech PTPN11 (40 %) a RAF1 (30 %). Ultrazvukové nálezy, resp. patologicky anatomické pitevní nálezy těchto deseti plodů jsou zapsány v tabulkách 1 a 2. Detekované kauzální varianty DNA u jednotlivých plodů shrnuje tabulka 3.
Tab. 1. Ultrazvukové nálezy u plodů pozitivních na syndrom Noonanové 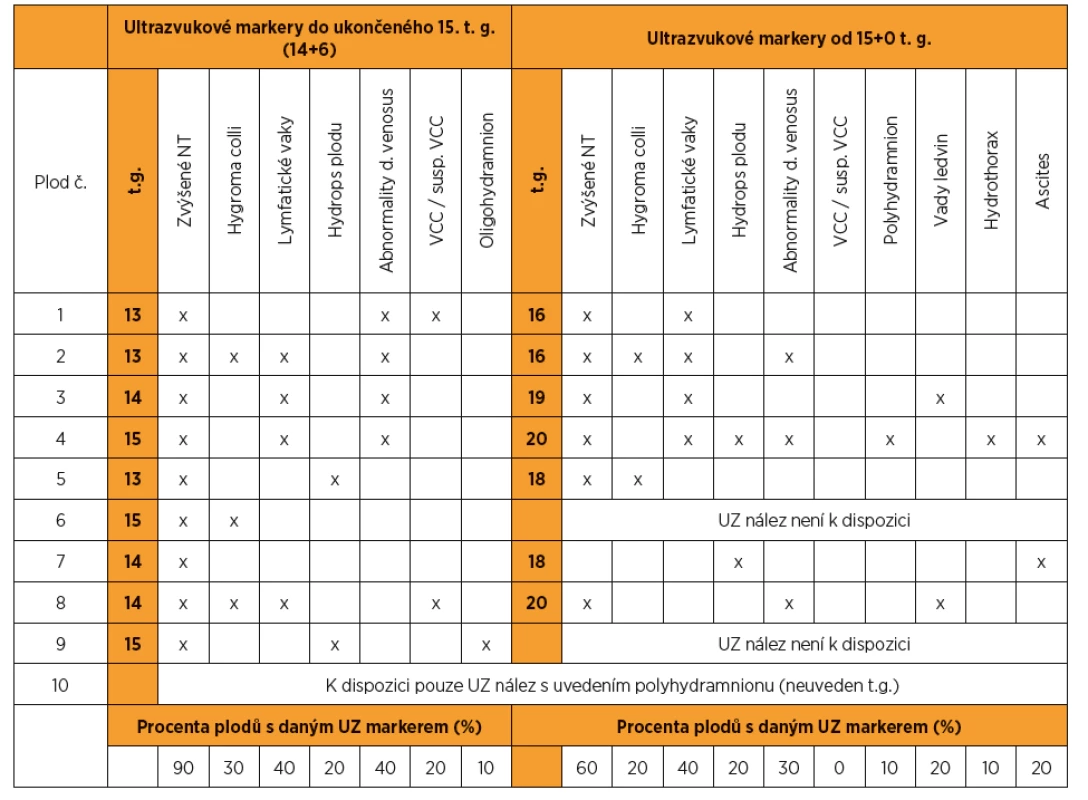
Tab. 2. Patologicky-anatomické pitevní nálezy u plodů pozitivních na syndrom Noonanové (NA – není k dispozici) 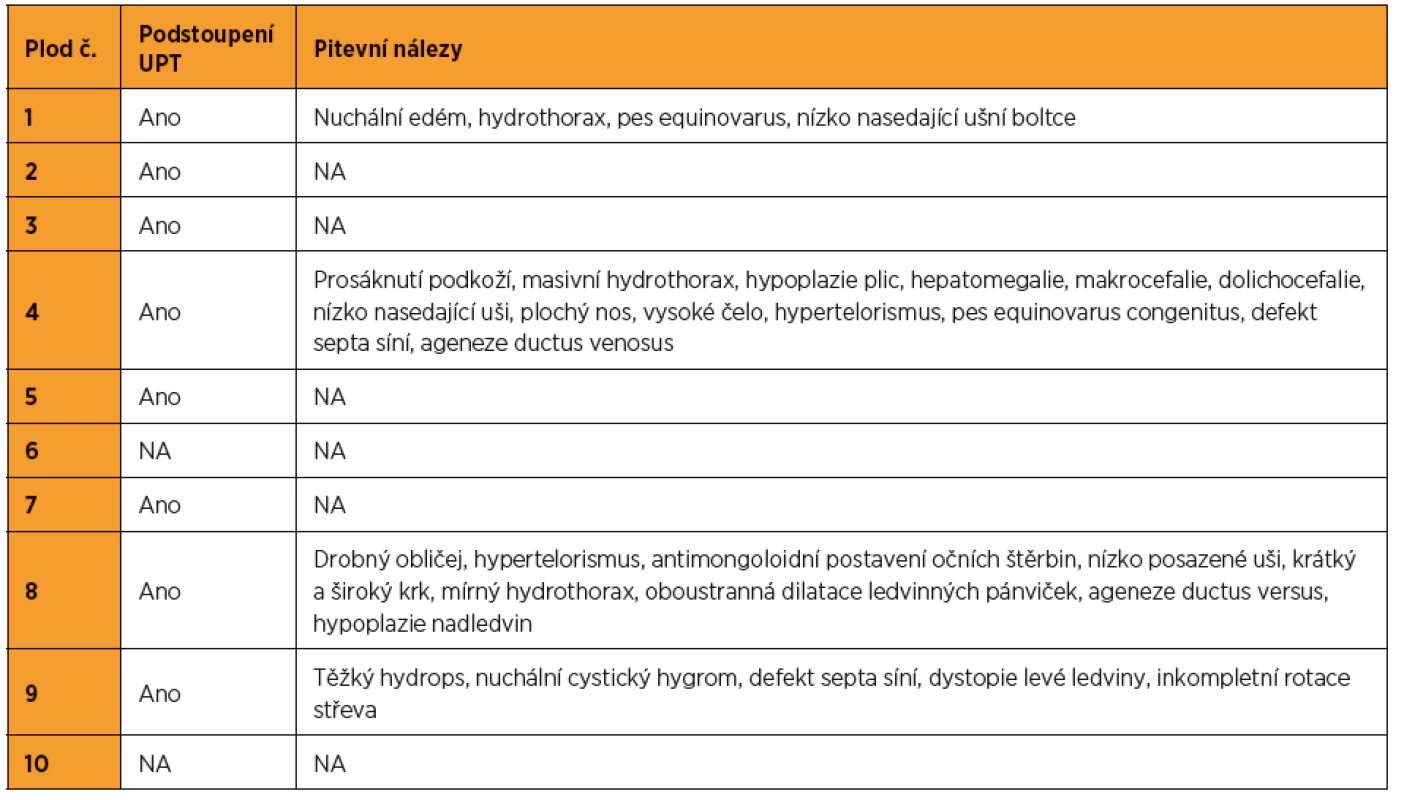
Tab. 3. Kauzální varianty DNA detekované u plodů pozitivních na syndrom Noonanové (referenční genom – hg19, NA – nelze publikovat z důvodu nesouhlasu rodičů) 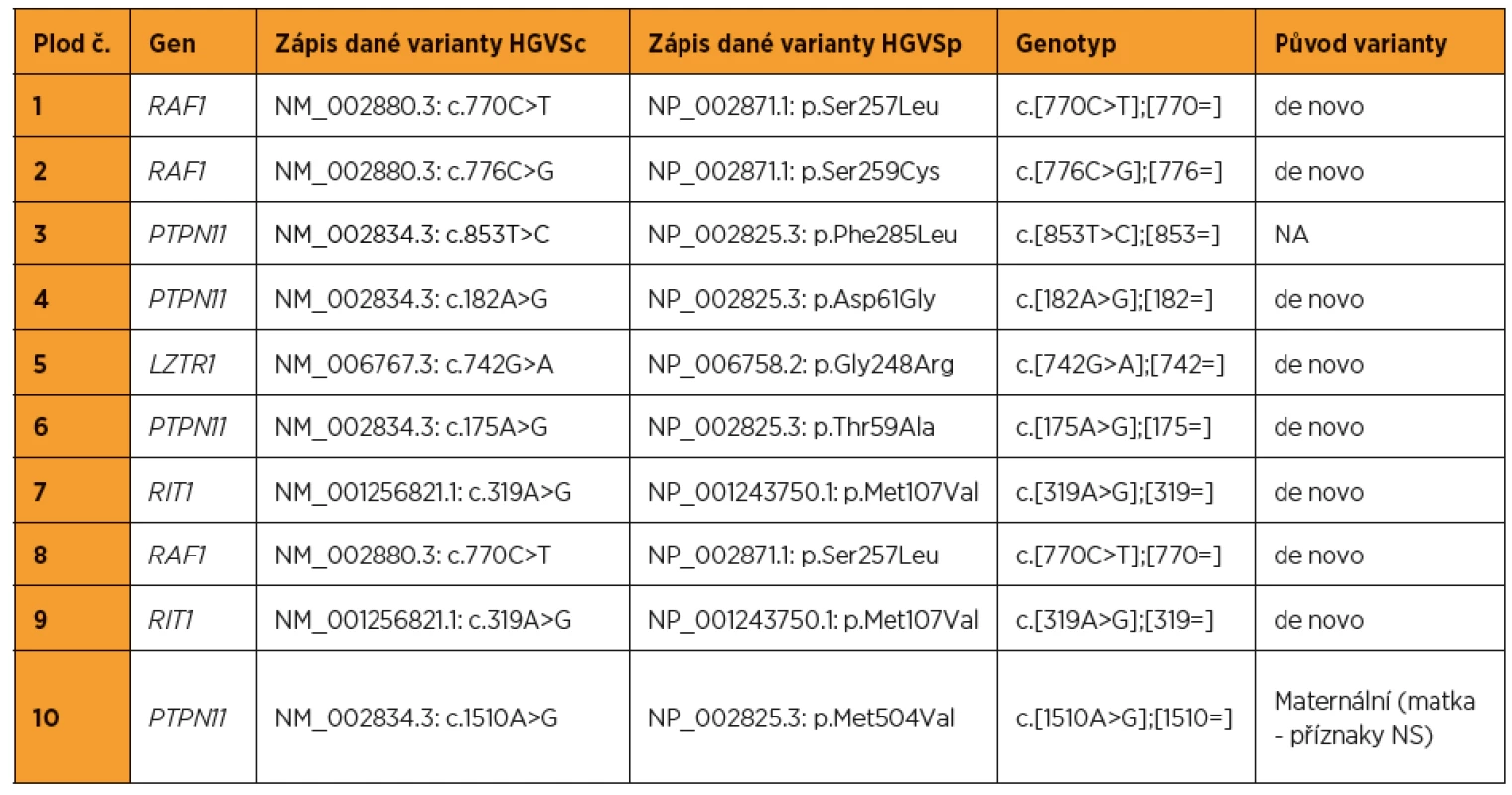
U jednoho z deseti plodů pozitivních pro NS (10 %) bylo do ukončeného 15. t. g. patrné pouze zvýšené NT (viz tab. 1 – plod 7), u ostatních plodů byly přítomny i jiné ultrazvukové nálezy.
Jako kazuistiku budeme dále prezentovat případ plodu č. 7 (tab. 1, obr. 1). V 13+3 t. g. bylo změřeno NT s hodnotou 6,0 mm, žádný další nález nebyl detekován. V 13+5 t. g. byla provedena amniocentéza. V 17+0 t. g. byl již patrný celkový hydrops plodu s prosáknutím podkoží a ascites. Bylo provedeno molekulárně-genetické vyšetření QF-PCR na detekci aneuploidií chromozomů 13, 18, 21, X a Y s negativním výsledkem. Negativní závěr měl také karyotyp a metoda array-CGH. Masivně paralelním sekvenováním panelu genů pro RASopatie byla nalezena s vysokou pravděpodobností patogenní varianta pro NS. Jednalo se o variantu NM_001256821.1: c.319A>G, NP_001243750.1: p.Met107Val v genu RIT1. Po provedení vyšetření rodičů byl stanoven de novo původ varianty u plodu. Autoři Milosavljević et al. ve svém článku [8] detekovali stejnou záměnu u plodu s vážnými abnormalitami (hygroma colli, hydrops plodu, ascites, polyhydramnion).
Obr. 1. Zvýšené šíjové projasnění u plodu č. 7 (NT 6,0 mm; 13+3 t. g.) 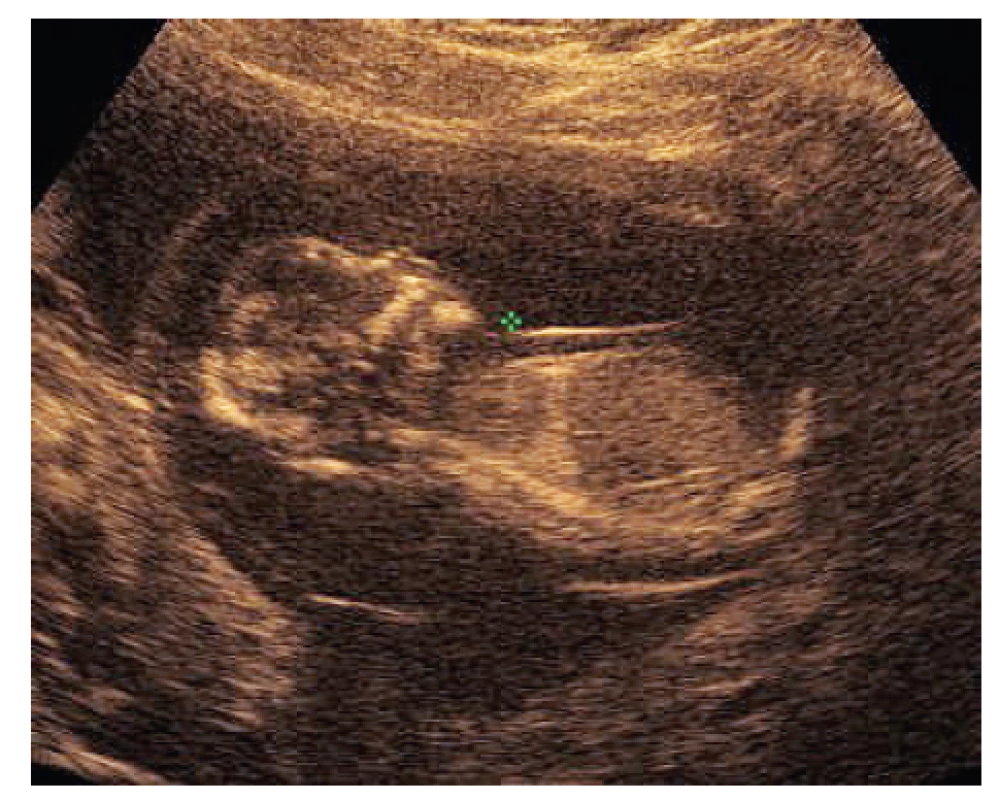
Kromě potenciálně patogenních/s nejvyšší pravděpodobností patogenních variant DNA jsou metodou MPS detekovány také varianty nejasného významu (VOUS, variants of unknown significance). Tyto změny DNA představují, především v prenatální diagnostice, komplikaci pro genetickou konzultaci. Jedna z možností pro objasnění jejich vlivu je vyšetření rodičů daného probanda na přítomnost dané varianty DNA. Varianty VOUS byly nalezeny celkem u deseti z 95 vyšetřených plodů (10,5 %). Jeden plod měl tyto varianty dvě. Varianty VOUS jsme rozdělili na tři podskupiny: VOUS – pravděpodobně benigní (pět variant u pěti plodů; 5,3 %; zděděno po jednom zdravém rodiči), VOUS – nejasný význam (pět variant u čtyř plodů; 4,2 %; k dispozici nebyla segregační analýza, resp. fenotyp rodičů), VOUS – pravděpodobně patogenní (jedna varianta u jednoho plodu; 1,1 %; de novo). Distribuci jednotlivých podskupin VOUS a i patogenních kauzálních variant DNA znázorňuje graf 1. Nejvíce variant VOUS bylo detekováno v genech LZTR1 (čtyři varianty; 36,4 %) a A2ML1 (tři varianty; 27,3 %), a dále pak v genech CBL, PTPN11, RAF1 a SOS2 (po jedné variantě; po 9,1 %).
Graf 1. Genová specifická distribuce variant DNA u prenatálních vzorků 
DISKUSE
Zvýšené nuchální projasnění v záhlaví plodu je standardně používáno jako screeningový marker především pro Downův syndrom, ale i jiné chromozomální abnormality [7, 12]. V minulosti již bylo vydáno více publikací popisujících asociaci tohoto ultrazvukového markeru také se syndromem Noonanové. Autoři Lee et al. (2009) [6] provedli mutační analýzu genu PTPN11 u více než 100 plodů (průměrný gestační věk 14,9 t. g.) s indikacemi na NS. Prevalence kauzálních mutací v daném genu u plodů s izolovaným cystickým hygromem byla 11 %, vyšší prevalence byla pozorována za předpokladu, že cystický hygrom byl asociován s dalším ultrazvukovým nálezem (24 %). Autoři Ali et al. (2017) [1] na základě svých zkušeností uvedli, že u 10 % euploidních plodů (průměrně 12. t. g.) se zvýšeným NT byly přítomny kauzální mutace pro syndrom Noonanové.
Výše zmíněná studie koresponduje s naší zkušeností, kdy jsme u jednoho z deseti pozitivních plodů pro NS pozorovali do ukončeného 15. t. g. pouze zvýšené NT.
Výsledkem analýzy MPS bývají také změny DNA s nejasným klinickým významem. Tyto varianty ztěžují interpretaci výsledku. Pro možné objasnění jejich vlivu je nutné doplnit i vyšetření rodičů probanda a dalších pokrevných příbuzných (např. sourozenců).
ZÁVĚR
Masivně paralelní sekvenování lze aplikovat pro molekulárně-genetickou diagnostiku syndromu Noonanové i dalších RASopatií. Sekvenování je indikováno při normálním výsledku karyotypu a array-CGH. Indikačními kritérii jsou zvýšené šíjové projasnění, hygroma colli, lymfatické vaky, hydrops plodu, ascites, srdeční vady, polyhydramnion a další nálezy. Prenatální diagnostika RASopatií (syndromu Noonanové) je významným přínosem k objasnění dosud standardními metodami nevysvětlitelných ultrazvukových nálezů.
Poděkování
Za spolupráci děkujeme lékařům Centra prenatální diagnostiky Brno, s.r.o.; MUDr. Čutkovi (Centrum lékařské genetiky, České Budějovice); MUDr. Grečmalové a MUDr. Gřegořové (OLG, FN Ostrava); MUDr. Hořínové (Nemocnice Jihlava); MUDr. Hůrkové (Prediko Zlín); MUDr. Hyjánkovi (Genetika Ostrava, s.r.o.; U.S.G POL, s.r.o.); MUDr. Polákovi, CSc. (U.S.G POL, s.r.o.); MUDr. Veselé (Všeobecná fakultní nemocnice Praha); MUDr. Všetičkovi (Genetika Ostrava, s.r.o.) a dalším spolupracujícím lékařům.
Mgr. Monika Matyášová
Cytogenetická laboratoř Brno
Veveří 39
602 00 Brno
e-mail: cytogenetika@cytogenetika.cz
Zdroje
1. Ali, MM., Chasen, ST., Norton, ME. Testing for Noonan syndrome after increased nuchal translucency. Prenatal Diagnosis, 2017, 37, p. 750–753.
2. Aoki, Y., Niihori, T., Inoue, S., Matsubara, Y. Recent advances in RASopathies. J Hum Genet, 2016, 61, p. 33–39.
3. Croonen, EA., Nillesen, WM., Stuurman, KE., et al. Prenatal diagnostic testing of the Noonan syndrome genes in fetuses with abnormal ultrasound findings. Eur J Hum Gen, 2013, 21, p. 936–942.
4. Hernández-Martín, A., Torrelo, A. Rasopathies: developmental disorders that predispose to cancer and skin manifestations. Actas Dermosifiliograf, 2011, 102, p. 402–416.
5. Chen, P., Yin, J., Yu, H., et al. Next-generation sequencing identifies rare variants associated with Noonan syndrome. PNAS, 2014, 111(31), p. 11473–11478.
6. Lee, KA., Williams, B., Roza, K., et al. PTPN11 analysis for the prenatal diagnosis of Noonan syndrome in fetuses with abnormal ultrasound findings. Clin Genet, 2009, 75, p. 190–194.
7. Loucký, J., Springer, D., Zima, T. Možnosti screeningu Downova syndromu v České republice. Čes Gynek, 2008, 73(3), p. 160–162.
8. Milosavljević, D., Overwater E., Tamminga, S., et al. Two cases of RIT1 associated Noonan syndrome: further delineation of the clinical phenotype and review of the literature. AJMG, part A. 2016, p. 1874–1880.
9. OMIM – Online mendelian inheritance in man. [online]. 2018. [cit. 2018-10-15]. Dostupné z: http://www.omim.org/.
10. Rauen, KA. The RASopathies. Ann Rev Genomics. Hum Genet, 2013, 14, p. 355–369.
11. Richards, S., Aziz, N., Bale, S., et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendattion of the American college of medical genetics and genomics and the association for the molecular pathology. Genet Med, 2015, p. 1–20.
12. Sonek, JD., Nicolaides, KH., Janků, P. Screening v 11.–13.+6 týdnu těhotenství. Čes Gynek, 2012, 77(2). p. 92–104.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína Dětská kardiologie Endokrinologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2019 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Individualizace chirurgického managementu karcinomů děložního hrdla IA1, IA2
- Endometrial Receptivity Analysis – nástroj ke zvýšení podílu implantovaných embryí v programu asistované reprodukce
- NK buňky nejen v endometriu, ale i v ovulačním cervikálním sekretu u žen se sníženou plodností
- Echogenní fokusy fetálního srdce z pohledu dětského kardiologa
- Prenatální diagnostika syndromu Noonanové u plodů se zvýšeným šíjovým projasněním a normálním karyotypem
- Srovnání výsledků vaginálních porodů a porodů císařským řezem: průřezová studie v terciárním centru na severovýchodě Brazílie
- Lokálně pokročilý kolorektální karcinom v těhotenství
- Primární synoviální sarkomy ovaria a děložní tuby – popis jednoho případu a přehled literatury
- Změny ve FIGO stagingu karcinomu děložního hrdla
- Význam 3D ultrazvukového vyšetření CNS plodu
- Riziko tromboembolie v souvislosti s in vitro fertilizací
- Vaginismus – koho zajímá?
- Děložní adenomyóza: patogeneze, diagnostika, symptomatologie a léčba
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Děložní adenomyóza: patogeneze, diagnostika, symptomatologie a léčba
- Echogenní fokusy fetálního srdce z pohledu dětského kardiologa
- Vaginismus – koho zajímá?
- Lokálně pokročilý kolorektální karcinom v těhotenství
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



