-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pokroky v terapii myelodysplastického syndromu
Promising treatment modalities in the therapy of myelodysplastic syndromes
Background: Myelodysplastic syndromes (MDS) are a highly heterogenous group of diseases, which is refl ected in the need for a wide range of therapeutic approaches. At this time, the only curative option is allogeneic hematopoietic stem cell transplantation. However, given the median age of MDS patients (around 70) and all the associated risks of transplantation, this remains a viable option for only a small percentage of patients. As such, the main therapeutic approaches are supportive therapy, growth factors, immunosuppression and, as of this century, the fi rst innovative approaches of immunomodulatory and hypomethylation therapy. Yet, patient responses to most of these therapies (with the exception of immunomodulatory therapy for “5q - syndrome“) do not exceed 40%. It is therefore imperative to continuously be looking for new promising approaches for MDS therapy. Only in recent years, with advancements in the knowledge of pathogenesis and molecular genetics, new interesting drugs have begun to emerge. Purpose: This summarizing article provides an overview of new therapeutic options, even those in the early stages of clinical trials.
Keywords:
myelodysplastic syndrome – treatment – new approaches
Autoři: A. Jonášová
Působiště autorů: I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze
Vyšlo v časopise: Klin Onkol 2021; 34(5): 356-365
Kategorie: Přehledy
doi: https://doi.org/10.48095/ccko2021356Souhrn
Východiska: Myelodysplastický syndrom (MDS) je velmi heterogenní onemocnění, což se odráží v terapii potřebou široké škály terapeutických přístupů. Zatím jediným skutečně kurativním přístupem je alogenní transplantace kmenových buněk. Transplantace se všemi svými riziky je ale s ohledem na medián věku nemocných s MDS (kolem 70 let) řešením jen pro malou část z nich. Hlavní terapeutické postupy jsou proto reprezentovány podpůrnou terapií, růstovými faktory, imunosupresí a od začátku tohoto tisíciletí i prvními inovativními přístupy imunomodulační a hypometylační terapie. Odpovědi ale u většiny výše zmiňovaných postupů (vyjma imunomodulační terapie pro „5q - syndrom“) nepřesahují 40 % a přežívání nemocných s agresivními formami MDS je stále krátké. Proto je v terapii MDS nutné hledat stále nové perspektivní přístupy. Až v posledních letech s pokrokem znalostí v patogenezi a molekulární genetice se začínají objevovat nové zajímavé léky. Cíl: Tento souhrnný článek přináší přehled o zcela nových terapeutických možnostech, často i v raných fázích klinického zkoušení.
Klíčová slova:
terapie – myelodysplastický syndrom – nové postupy
Úvod
Myelodysplastický syndrom představuje heterogenní skupinu klonálních chorob hemopoetické kmenové buňky charakterizovaných inefektivní krvetvorbou, periferní cytopenií, morfologickou dysplazií a nebezpečím transformace do akutní myeloidní leukemie (AML). Incidence ve věku nad 60 let se pohybuje kolem 30/ 100 000 osob, což činí MDS jednu z nejčastějších hematologických malignit v této věkové kategorii (graf 1) [1]. I přes stálý intenzivní výzkum je MDS jednou z nejobtížněji řešitelných hematologických malignit. Jak ukazuje incidence MDS, jde o onemocnění staršího věku a tak jak stárne naše populace, roste také počet nemocných s MDS našich ambulancích. Dnešní starší nemocní jsou často relativně fit, žijí aktivní život, a proto roste i počet kandidátů intenzivnější terapie. Příliv nových léčebných možností není sice tak rychlý, jako je tomu např. u mnohočetného myelomu či lymfoproliferativních chorob, ale přesto i u MDS zaznamenáváme recentně přísun nových nadějnějších preparátů.
Graf 1. Incidence myelodysplastického syndromu podle věku a pohlaví [1]. ![Incidence myelodysplastického syndromu podle věku a pohlaví [1].](https://pl-master.mdcdn.cz/media/image_pdf/5580e1b0ad411f24de8cdddd8a7ddfcc.png?version=1634902924)
S ohledem k volbě terapie dělíme nemocné s MDS na nižší a vyšší rizikové skupiny, pomáhá nám při tom skórovací systém IPSS (International Prognostic Scoring System) a nověji revidovaný IPSS-R, který kombinuje více faktorů [2,3]. Graf 2 ukazuje, jak rozdílné je přežívání nemocných v jednotlivých kategoriích IPSS-R. Nízce rizikoví nemocní mají IPSS-R velmi nízké a nízké. Mezi nízce rizikové nemocné lze zařadit část nemocných se středním rizikem. Nemocní vysoce rizikoví mají skóre vysoké a velmi vysoké a patří sem i rizikovější část nemocných se středním rizikem. Riziko je dnes hodnoceno i podle přítomnosti ně kte rých mutací [4]. Právě s přílivem výsledků molekulární genetiky, se sekvenováním nové generace a s identifikací souboru prognosticky méně či více významných mutací je vzrůstající snaha implementovat mutační stav do skórovacích systémů a algoritmů terapie. Nicméně vzhledem k mnohým dalším faktorům, jako je velká různorodost mutací u MDS, jejich variabilní kombinace či vliv variantní alelické frekvence, je implementace mutačního stavu do prognostických systémů ještě nedořešená. Jak ale ukážeme v dalším textu, je existence určitých mutací již využívána k cílené terapii u nemocných s MDS.
Graf 2. Kaplan-Meierovy křivky mediánů celkového přežití u nemocných v jednotlivých kategoriích IPSS-R systému [3]. ![Kaplan-Meierovy křivky mediánů celkového přežití u nemocných v jednotlivých kategoriích IPSS-R systému [3].](https://pl-master.mdcdn.cz/media/image_pdf/e425e5ce3a126aea9b69c87c188eec18.png?version=1634902955)
IPSS-R – revidovaný mezinárodní prognostický skórovací systém, OS – celkové přežití Terapie nízce rizikových nemocných
Cíle terapie nízce rizikových nemocných jsou: eliminace či zmírnění cytopenie, zlepšení kvality života a snaha o prodloužení délky života (overall survival – OS). Základní současné možnosti dostupné terapie u nízce rizikových nemocných s MDS ukazuje schéma 1.
Schéma 1. Základní možnosti terapie nízce rizikových skupin s ohledem na charakter cytopenií. 
Terapie anemie
V terapii nízce rizikových nemocných je dominujícím problémem léčba anemie, asi 90 % nemocných je anemických a 60 % vyžaduje dříve nebo později transfuze. Transfuzní dependence a její tíže jsou přitom faktory snižujícími nejen kvalitu, ale i délku života nemocných (graf 3) [5]. Vzhledem k tomu, že jsou zatím mnozí nemocní stále odkázáni na podávání transfuzí, je aspoň jistý pozitivní posun pro tyto nemocné zavedení chelatační terapie, která vede ke zlepšení OS chronicky transfundovaných nízce rizikových nemocných [6]. U nás je tato terapie reprezentována nejčastěji perorálním preparátem deferasiroxem (Exjade, Novartis), jehož nová, dobře tolerovaná tabletová forma umožnuje relativně široké použití [7].
Graf 3. Kaplan Meierovy křivky přežívání v závislosti na tíži transfuzní závislosti [5]. ![Kaplan Meierovy křivky přežívání v závislosti na tíži transfuzní závislosti [5].](https://pl-master.mdcdn.cz/media/image_pdf/63c9fe865c10e5d00048dae490d97206.png?version=1634903019)
Analýza 474 nízce rizikových nemocných s myelodysplastickým syndromem.
NTB – bez transfuzní závislosti (medián celkového přežití 8 let; 95% CI 6,6–9,5), LTB – nízká transfuzní závislost (medián celkového přežití 6,2 roku; 95% CI 4,2–8,1), HTB – vysoká transfuzní závislost (medián celkového přežití 3,1 roku; 95% CI 2,4–3,8) (p < 0,001)Na prvém místě terapie anemie stále stojí erytropoetiny. Přestože jsou erytropoetiny používány v terapii anemie již téměř několik dekád a dnes již četné literární údaje doložily jejich aktivitu, až zcela nedávno byly povoleny lékovými agenturami. K tomu zásadně přispěly výsledky dvou randomizovaných studií, které byly publikovány v roce 2018 [8,9]. Na I. interní klinice – klinice hematologie 1. LF UK a VFN v Praze jsme hodnotili našich prvních 60 nemocných s MDS léčených biosimilárními léky – přípravkem Binocrit (Sandoz). Neshledali jsme žádné rozdíly v efektu ve srovnání s rekombinantními erytropoetiny a ani žádné neočekávané nežádoucí účinky. Ve shodě s jinými autory můžeme použití biosimilárních léků v terapii anemie nemocných s MDS doporučit [10]. Nicméně přes všechna pozitiva erytropoetinů, vč. vynikající tolerance, je třeba říci, že u těžší anemie, a zvláště pak u transfuzně dependentních nemocných, se odpověď pohybuje pouze kolem 15–20 %.
Erytropoetiny jsou také minimálně účinné u specifické podskupiny nemocných s MDS a delecí dlouhého raménka 5. chromozomu (del(5q)). Pakliže jde o nemocné s nižším rizikem, del(5q) a transfuzní závislostí, jsou dnes tito nemocní kandidáty léčby imunomodulačním preparátem lenalidomidem (Revlimid, Celgene-BMS). První velké studie MDS 003 a MDS 004 používající lenalidomid v monoterapii anemie u nemocných s del(5q) popisují erytrocytární odpověď (IWG 2006 – international working group kritéria z roku 2006, Hb navýšení ≥ 1,5 g/ dl) u 70 % nemocných a dosažení transfuzní nezávislosti u 60 % [11–13]. Jak ukazuje naše práce v Leukemia Research 2018, je možné ještě další posílení efektu lenalidomidu a navýšení počtu respondentů přidáním erytropoetinu či erytropoetinu ještě v kombinaci s prednisonem, čímž je možno dosáhnout až 80–90% odpovědi či odpovědi u nemocných, u nichž anemie na monoterapii lenalidomidem relabuje [14]. Recentní analýzy ukazují, že u nemocných léčených lenalidomidem je též dosaženo prodloužení OS a snížení rizika transformace do AML ve srovnání s historickou skupinou [15]. Již delší dobu je snaha zvýšit aktivitu lenalidomidu i u nemocných bez del(5q), z nichž odpovídá přibližně pouze 15 % nemocných [16]. Nově byla prezentována studie demonstrující zvýšení počtu respondentů v této skupině MDS opět použitím kombinace lenalidomidu s erytropoetiny, a to i u nemocných již refrakterních na erytropoetin [17]. K dosažení erytrocytární odpovědi vede tato kombinace u 38 % nemocných.
Dalšími nadějnými kandidáty v terapii anemie nízce rizikových nemocných s MDS jsou léky účastnící se blokády dráhy TGF-β (transformig growth factor beta). Do této skupiny patří luspatercept a galunisertib. Nejdále jsou studie s luspaterceptem (Reblozyl, Celgene - BMS), modifikovaným IIB receptorem aktivinu, který inhibuje dráhu SMAD2/ 3 blokádou GDF11 (growth differentiation factor – ligand TGF-β dráhy) a vede k potenciaci diferenciace a růstu červené řady (obr. 1) [18,19]. Luspatercept byl povolen v terapii anemických, transfuzně závislých nemocných v letošním roce Evropskou lékovou agenturou, a to specificky u podskupiny s nižším rizikem a věnečkovitými sideroblasty, u nichž vede k transfuzní nezávislosti téměř u 50 % [18,19]. Zvláště dobře odpovídají nemocní s mutací genu SF3B1. Práce autorů Garcia Menero et al prezentovaná na ASH meetingu 2019 ukazuje, že luspatercept má pravděpodobně i trilineární aktivitu [20]. Je také efektivní u nemocných, kteří již dostávali erytropoetin, na který však neodpověděli či anemie relabovala. Samozřejmě běžně dosud ti, kteří selhali v odpovědi na erytropoetin, byli odkázáni jen na opakované transfuze nebo na čekání na vhodnou studii. Pro tyto nemocné se vedle luspaterceptu zdá též perspektivní inhibitor telomeráz imetelstat [21]. Efektivitu má asi u 30–40 % erytropoetin refrakterních nemocných. Studie s tímto preparátem v ČR právě probíhá (NCT02598661). Stále ale u těchto léků hovoříme o odpovědi kolem 30–40 % v nejlepších případech, stejně tak jako u luspaterceptu u specificky nemocných s MDS s věnečkovitými sideroblasty se SF3B1 mutací o odpovědi téměř 50 %. Je tedy třeba hledat nové cesty, a to i pro kombinační terapie. Zde se jeví perspektivní zcela nový preparát roxadustat, orální inhibitor prolyl hydroxylázy HIF (hypoxia inducing factor) faktoru. Má multifaktoriální efekt: zvyšuje produkci erytropetinu, zvyšuje citlivost receptorů na progenitorech erytrocytární řady k erytropoetinu a naopak inhibuje hepcidin a následně pak zvyšuje resorpci železa. Jde tedy o komplexní ovlivnění anemie. Efektivita tohoto léku byla prokázána u anemických nemocných s renální insuficiencí [22]. Vývoj roxadustatu je vázán na práce nobelistů v medicíně za rok 2019 (William G. Kaelin Jr., Peter J. Ratcliff e a Gregg L. Semenza). Podle předběžných dat otevřené studie fáze II (n = 24) u erytropoetin refrakterních, transfuzně dependentních nemocných s MDS je dosahováno odpovědi v podobě transfuzní nezávislosti u 38 % a u více než 58 % nemocných dochází k redukci potřeby transfuzí [23]. Nyní probíhá studie fáze III (NCT03263091). S ohledem na výše udávaná procenta výsledků u jednotlivých preparátů a jejich různé mechanizmy efektu si dovedeme představit navýšení efektu jejich kombinacemi. Kombinační terapie u anemických nemocných bude velmi pravděpodobně budoucností léčby anemie obecně, problémem bude jistě finanční zátěž pro pojišťovny.
Obr. 1. Luspatercept – mechanizmus účinku (inhibice SMAD2/3 signální dráhy). 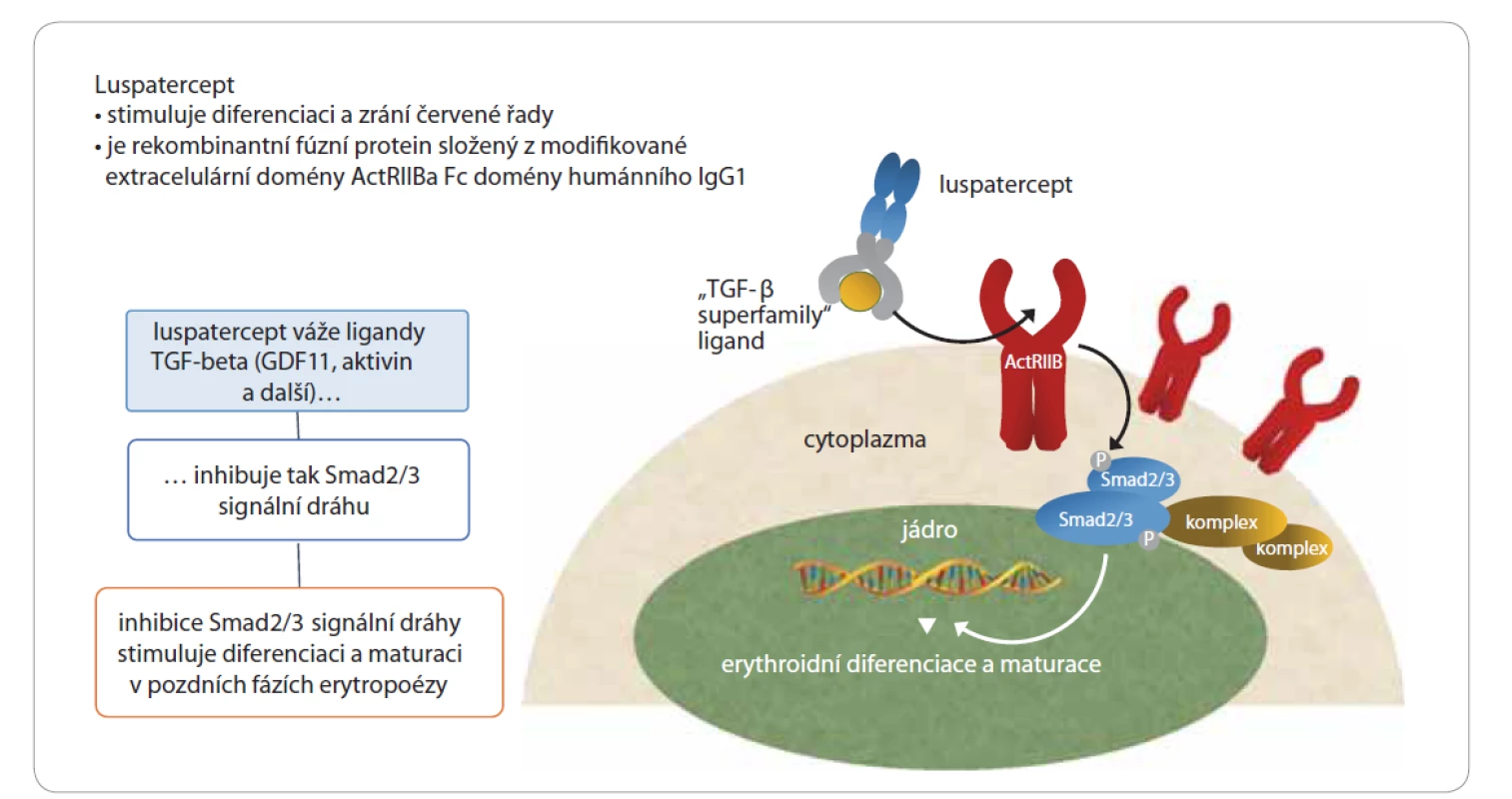
ActRIIB – receptor typu IIB pro activin, GDF11– růstový diferenciační faktor 11, TGF beta – transformující růstový faktor beta Novinky v terapii trombocytopenie
Významným problémem nemocných s MDS je trombocytopenie. Vyskytuje se až u 65 % a je příčinnou úmrtí asi u 14–24 % nemocných s MDS. Dosud nejsou k dispozici mimo klinické studie žádné preparáty. Známy jsou dva nadějné léky. Oba shodně působí přes aktivaci trombopoetinového receptoru. První je romiplostim (Nplate, Amgen) – jde o fúzní protein, analog trombopoetinového receptoru. U MDS proběhla, a to i v ČR, fáze III klinického zkoušení, která byla předčasně ukončena pro podezření na možnou potenciaci progrese onemocnění (docházelo k nárůstu blastů). Nicméně protože tento efekt nebyl nikdy jednoznačně potvrzen a romiplostim měl u 50 % trombocytopenických nemocných výborný efekt, probíhá nyní akademická studie EUROPE s velmi nadějnými průběžnými výsledky [24,25]. Obdobné výsledky má i studie fáze I se 47 % odpovědí v terapii eltrombopagem (Revolade, Novartis) [26]. Naše dosud nepublikovaná data ukazují též trilineární odpovědi u terapie těmito preparáty.
V terapii cytopenií nízce rizikových nemocných není možno nezmínit demetylační látky. Již v první studii Silvermana et al byla dokumentována efektivita azacitidinu (Vidaza, Celgene-BMS) v podobě hematologického zlepšení u MDS s nižším rizikem asi u 60 % nemocných [27]. V současné době byla ukončena analýza randomizované studie fáze III s perorálním azacitidinem (CC-486) u nemocných s nižším rizikem s trombocytopenií a transfuzní dependencí a práce byla odeslána do časopisu Journal of Clinical Oncology. Velkou výhodou tohoto preparátu je perorální aplikace a velmi dobrá tolerance.
Terapie vysoce rizikových nemocných
Základní cíle terapie vysoce rizikových nemocných jsou: eliminace patologického klonu, tedy snaha o eradikaci onemocnění u mladších nemocných, kteří unesou intenzivní terapii, prodloužení OS, prevence a posun doby do AML transformace a samozřejmě obdobně jako u nízce rizikových nemocných zlepšení cytopenií a kvality života.
Základní přístupy při současných možnostech terapie nemocných s vysokým rizikem MDS ukazuje schéma 2.
Schéma 2. Základní postupy léčby nemocných s myelodysplastickým syndromem s vyšším rizikem. 
Alogenní transplantace kmenových buněk
Intenzivní terapie – jediná, která zatím vede k trvalému vyléčení – je stále předu MDS s nižším rizikem asi u 60 % nemocných [27]. V současné době byla ukončena analýza randomizované studie fáze III s perorálním azacitidinem (CC-486) u nemocných s nižším rizikem s trombocytopenií a transfuzní dependencí a práce byla odeslána do časopisu Journal of Clinical Oncology. Velkou výhodou tohoto preparátu je perorální aplikace a velmi dobrá tolerance. Terapie vysoce rizikových nemocných Základní cíle terapie vysoce rizikových nemocných jsou: eliminace patologického klonu, tedy snaha o eradikaci onemocnění u mladších nemocných, kteří unesou intenzivní terapii, prodloužení OS, prevence a posun doby do AML transformace a samozřejmě obdobně jako u nízce rizikových nemocných zlepšení cytopenií a kvality života. Základní přístupy při současných možnostech terapie nemocných s vysokým rizikem MDS ukazuje schéma 2. Alogenní transplantace kmenových buněk Intenzivní terapie – jediná, která zatím vede k trvalému vyléčení – je stále předu MDS s nižším rizikem asi u 60 % nemocných [27]. V současné době byla ukončena analýza randomizované studie fáze III s perorálním azacitidinem (CC-486) u nemocných s nižším rizikem s trombocytopenií a transfuzní dependencí a práce byla odeslána do časopisu Journal of Clinical Oncology. Velkou výhodou tohoto preparátu je perorální aplikace a velmi dobrá tolerance. Terapie vysoce rizikových nemocných Základní cíle terapie vysoce rizikových nemocných jsou: eliminace patologického klonu, tedy snaha o eradikaci onemocnění u mladších nemocných, kteří unesou intenzivní terapii, prodloužení OS, prevence a posun doby do AML transformace a samozřejmě obdobně jako u nízce rizikových nemocných zlepšení cytopenií a kvality života. Základní přístupy při současných možnostech terapie nemocných s vysokým rizikem MDS ukazuje schéma 2. Alogenní transplantace kmenových buněk Intenzivní terapie – jediná, která zatím vede k trvalému vyléčení – je stále představována pouze alogenní transplantací. Vzhledem k mediánu věku nemocných s MDS, který se pohybuje kolem 70 let, a vzhledem k četným přidruženým komorbiditám u starších pacientů je ale reálně kandidátů vhodných k transplantaci jen malé procento. Přínosem je zde používání redukovaných přípravných režimů s nižší toxicitou pro starší nemocné [28]. Jak správně připravit nemocné k transplantaci, je stále otázkou. Zdá se zřejmé, že lepší výsledky mají nemocní s menším počtem blastů před samotnou transplantací. V tomto případě se jeví jako výhodné použití azacitidinu, který je méně toxický než intenzivní chemoterapie, a nemocní vstupují k samotné transplantaci v lepším stavu [29]. Jaké terapie a režimy použít k prevenci a snížení počtu relapsů, které jsou relativně vysoké u transplantací s redukovaným režimem, je stále předmětem četných studií a tvoří samostatné téma.
Medikamentózní léčba
Jak ukazují mnohé výsledky recentních studií v terapii vysoce rizikových nemocných, není dosud překonán již výše zmíněný azacitidin. Tvoří základ terapie na jedné straně s již potvrzeným benefitem delšího přežívání proti standardním terapiím představovaným nízce dávkovanou nebo i intenzivní terapií jako u AML, na druhé straně je jasné, že v monoterapii většinou nevede k eradikaci onemocnění, dlouhodobým kompletním remisím či k opravdu dlouhodobým odpovědím. Naše první analýza provedená v rámci spolupráce České kooperativní MDS skupiny podobně jako naše poslední data 638 nemocných s mediánem OS 14,9 měsíců ukazují velmi dobře, jak je stále terapeuticky problematický MDS s vyšším rizikem a jak nezbytné je zlepšení výsledků monoterapie azacitidinem [30]. Prodloužení přežívání a zvýšení procenta odpovědí bude pravděpodobně dosaženo jenom dobře vytvořenou kombinační terapií. Na tomto místě jmenujeme nové perspektivní preparáty použité zatím v raných fázích klinických studií v kombinacích prakticky vždy s azacitidinem. Sem patří intenzivně citovaná kombinace azacitidinu s BCL-2 inhibitorem venetoklaxem (Venclyxto, Abbvie), který je již v USA povolen v terapii AML u nemocných, kteří nejsou kandidáty intenzivní terapie. U MDS máme zatím data pouze z výsledků fází I a II. Za všechny uvádíme nejnovější studii 57 nemocných s MDS s vysokým rizikem, kdy byla použita tato kombinace v primoterapii (NCT02942290). Celková odpověď (overal response rate – ORR) byla 77 % se 45% kompletní remisí (complete remission – CR) [31]. Medián OS nebyl dosažen (graf 4). Na posledním ASH (American Society of Haematology) meetingu 2020 bylo prezentováno několik dalších studií potvrzujících vysoké procento ORR a CR této kombinace, a to i u relabovaných či refrakterních chorob. S identifikací specifických mutací u nemocných s MDS se rozvíjí též možnost terapeutického využití inhibitorů těchto mutací. Jde o skutečně cílenou terapii. Sem patří kombinace azacitidinu s inhibitory IDH1,2 (izocitrát dehydrogenáza; IDH1 inhibitor – ivosidenib, IDH2 inhibitor – enasidenib). Z dosud raných fází menších klinických studií u MDS jsou pozoruhodné průběžné výsledky studie fáze II (NCT03383575). Jde o terapii enasidenibem v kombinaci s azacitidinem u nemocných s IDH2 mutací jak refrakterních/ relabovaných při terapii azacitidinem, tak u azacitidin naivních nemocných (dosud azacitidinem neléčeni). Ve studii bylo dosaženo 85% ORR a 77% CR + mCR (molecular complete remission) u azacitidin naivních nemocných [32]. U nemocných, kteří již selhali na monoterapii azacitidinem, byla ORR 56 % a 39 % CR+mCR. Téměř provokativní jsou též výsledky inovativní terapie s použitím APR-246. Jde o první malou molekulu, která se kovalentně váže na protein p53, vede ke stabilizaci tohoto proteinu, zástavě buněčného cyklu a následně k apoptóze buňky. Tento preparát selektivně indukuje apoptózu buněk s mutací TP53. Ve studii fáze Ib/ II se zařazením 45 nemocných bylo dosaženo 87% ORR s 53% CR. U nemocných s izolovanou mutací TP53 bylo dosaženo 67% CR [33]. Graf 5 znázorňuje počty a trvání CR. V současné době probíhá v USA fáze III randomizované studie s APR - 246 v kombinaci s azacitidinem proti samotnému azacitidinu (NCT03745716).
Graf 4. Kaplan Meierovy křivky přežívání v závislosti na dosažení dřeňové remise u nemocných léčených kombinací azacitidinu a venetoklaxu [13,30]. ![Kaplan Meierovy křivky přežívání v závislosti na dosažení dřeňové remise u nemocných
léčených kombinací azacitidinu a venetoklaxu [13,30].](https://pl-master.mdcdn.cz/media/image_pdf/c80865312eab51bb367060ffe5e961bf.png?version=1634903122)
mCR – dřeňová remise (< 5 % myeloblastů), OS – celkové přežití Graf 5. Aktuální stav v době analýzy 45 nemocných léčených APR-246 v kombinaci s azacitidinem (medián sledování 10,5 měsíce) [33]. ![Aktuální stav v době analýzy 45 nemocných léčených APR-246 v kombinaci s azacitidinem
(medián sledování 10,5 měsíce) [33].](https://pl-master.mdcdn.cz/media/image_pdf/8c7a87ca7c8c5c56986c6751ed8de15c.png?version=1634903149)
AML – akutní myeloidní leukemie, CR – kompletní remise, mCR – dřeňová remise, HI – hematologické zlepšení, MDS – myelodysplastický syndrom, MLFS – morfologický stav bez leukemie, NE – nehodnoceno, NR – bez odpovědi, SD – stabilizace onemocnění
Zelené a světle modrozelené linie ukazují vysoké procento dosažení kompletních a dřenových remisí.Zajímavé jsou též výsledky studie fáze I používající kombinaci azacitidinu magrolimabem (dříve 5F9) – protilátkou proti CD47 (makrofágový „immune checkpoint“). Blokáda CD47 indukuje fagocytózu leukemických kmenových buněk v AML modelech. Do studie bylo zařazeno 43 nemocných (18 s MDS s vyšším rizikem, 25 AML). ORR byla 100 % u 13 hodnotitelných azacitidin naivních léčených nemocných s MDS, CR byla 54 % a mCR 39 % [34]. Perspektivní kombinací pravděpodobně bude též kombinace azacitidinu s perorálním rigosertibem, multikinázovým inhibitorem (inhibice PLK a PI3K kináz), který zatím byl ve studii u nemocných, kteří přestali odpovídat nebo byli primárně refrakterní na azacitidin [35]. Do nitrobuněčných procesů též zasahuje další látka, a to inhibitor ubiquitinace pevnedistat, který inhibuje NEDD8-aktivační enzym (NAE). NAE je důležitý pro aktivaci cullin-závislé ubikvitin ligázy. Inhibice NAE pomocí pevonedistatu interferuje s ubikvitinací a degradací určitých proteinů v proteazomu, což při jejich akumulaci nakonec vede k buněčné smrti. Ve studii fáze Ib u AML dosahuje kombinace azacitidinu s pevonedistatem u starší AML populace, tj. u pacientů nevhodných pro intenzivní terapii, 50% ORR s 20% CR [36]. Výsledky studie fáze II u MDS (pevonedistat v kombinaci s azacitidinem) jsou nyní připravovány k publikaci a velmi nadějná již byla předběžná data prezentovaná na letošním ASCO meetingu. Ve skupině nemocných s MDS s vysokým rizikem bylo dosaženo v rameni pevonedistat + azacisotidin významných rozdílů proti ramenu monoterapie s azacitidinem (OS 23,9 vs. 19,1 měsíce; CR 51,7 vs. 26,7 %). Ještě nadějnější byly výsledky ve skupině AML do 30 % blastů ve dřeni, kde byl rozdíl OS 23 vs. 16 měsíců [37].
Nutné je též zmínit imunitní protinádorovou terapii. Na rozdíl od terapie solidních nádorů a v hematologii Hodgkinova lymfomu v terapii MDS výsledky raných fází studií s nivolimabem, ipilimumabem a zatím i pembrolizumabem nepřinesly významnější výsledky. Nadějnější může být nová generace těchto látek. V ČR v současné době probíhají studie fáze II a III používající kombinaci azacitidinu a MBG453, což je monoklonální anti-TIM-3 protilátka (NCT03946670, NCT04266301).
T-cell imunoglobulin domain and mucin domain-3 (TIM-3) je receptor s inhibičním efektem, hrající roli v získané a primární imunitě. Je silně exprimován na povrchu leukemických buněk a MDS blastů. Blokáda tohoto receptoru může vést k obnově protinádorové imunity. Předběžná data zatím ukazují jeho velmi dobrou snášenlivost a minimální toxicitu [38].
V neposlední řadě je třeba zmínit velmi optimistické výsledky průběžné analýzy naší akademické otevřené randomizované studie AZA-G (kombinace azacitidinu s G-CSF – faktor stimulující kolonie granulocytů – oproti azacitidinu v monoterapii). Studie vychází z našich preklinických dat, která ukazují synergický efekt azacitidinu a G-CSF na diferenciaci myeloidní řady [39]. Tato studie, která probíhá na I. interní klinice ve VFN v Praze, dokládá efektivitu předléčení G-CSF vyšším ORR (77 %), CR (48 %) a delším OS u nemocných léčených kombinační terapií (medián OS 22 vs. 14 měsíců) (graf 6) [40]. Velkou výhodou této studie je okamžité klinické využití naší kombinace, neboť oba léky jsou k dispozici v běžné praxi. Finální analýza 80 léčených nemocných se nyní připravuje k publikaci. Souhrn nových perspektivních preparátů v kombinaci s demetylační terapií (většinou azacitidinem) ukazuje tab. 1.
Graf 6. Kaplan Meierovy křivky přežívání nemocných léčených azacitidinem v kombinaci s G-CSF (G-AZA) proti azacitidinu v monoterapii (AZA) [40]. ![Kaplan Meierovy křivky přežívání nemocných léčených azacitidinem v kombinaci
s G-CSF (G-AZA) proti azacitidinu v monoterapii (AZA) [40].](https://pl-master.mdcdn.cz/media/image_pdf/8eb00844a554ce7a5339572b8e3275a6.png?version=1634903175)
Statisticky významný rozdíl přežívání (p = 0,0373).
G-CSP – faktor stimulující kolonie granulocytůTab. 1. Souhrn dostupných dat výsledků studií nových preparátů v terapii myelodysplastického syndromu s vysokým rizikem v kombinaci s demetylační terapií. 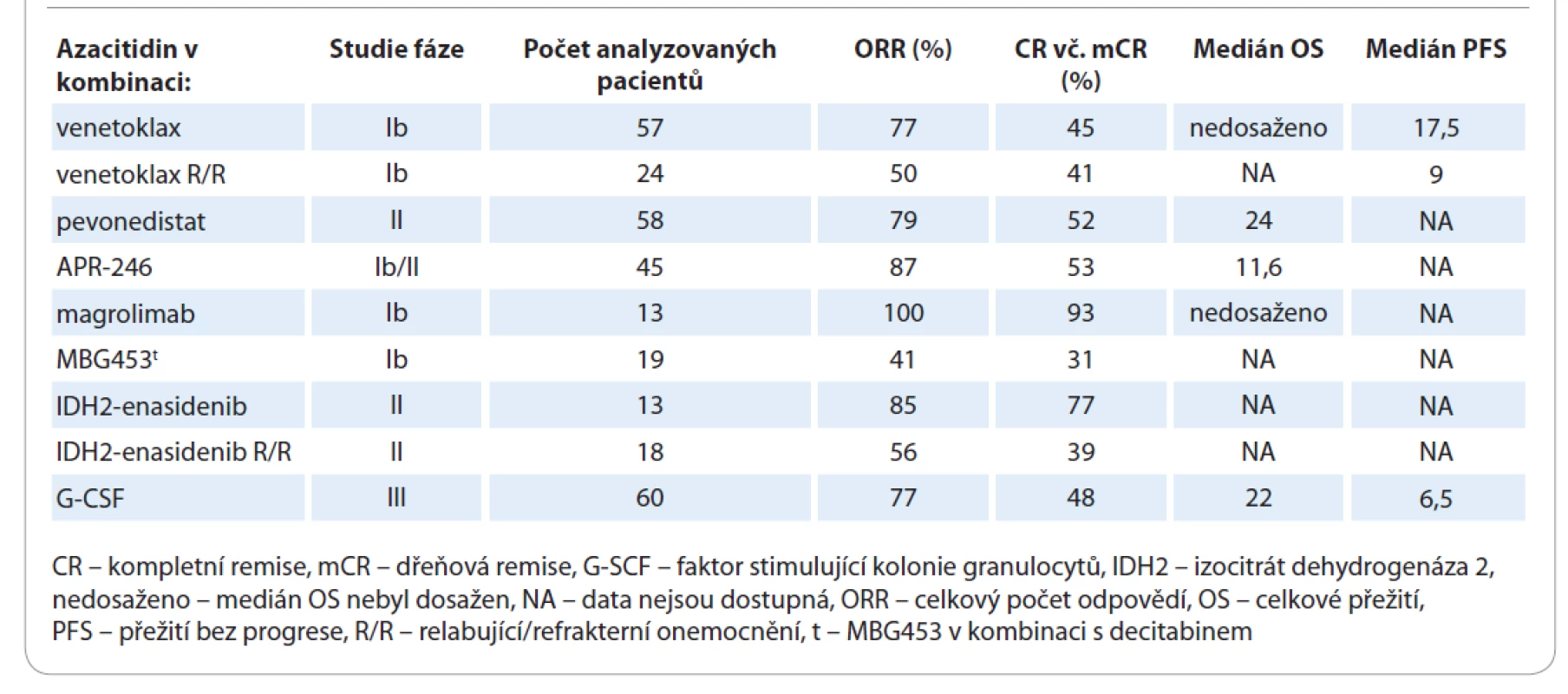
K inovacím v terapii azacitidinu patří i přesnější stanovení respondentů. Sem lze zařadit zajímavou práci využívající umělé inteligence, analyzující průběžně laboratorní nálezy u nemocných léčených azacitidinem a identifikující již v prvních 90 dnech terapie pravděpodobné dobré respondenty, u nichž má smysl nadále pokračovat v terapii, na rozdíl od nemocných s negativními výsledky, kteří jsou vhodnými kandidáty nových studiových preparátů [41].
Závěr
Myelodysplastický syndrom je onemocnění definované jako samostatná hematologická jednotka, byť s velkou různorodostí svých podskupin, již přibližně čtyři dekády. Incidence tohoto někdy vysoce maligně se chovajícího onemocnění stále stoupá. Kurativní terapie je reprezentována jen transplantací periferních kmenových buněk. Tato léčba má ale mezi nemocnými s MDS pouze málo kandidátů.
Ostatní v současné době dostupné léky vedou „jen“ ke zlepšení kvality života či k prodloužení přežívání. V posledních letech se ale s rychlým pokrokem ve znalosti patogeneze onemocnění a s rozvojem molekulární genetiky objevují ně kte ré cílené nové nadějné preparáty, které by mohly přinést další pozitivní krok v terapii MDS. Mnohé z nich jsou v perorální formě, a navíc by mnohé mohly vzhledem k cílenému zásahu do určitých drah vzájemně potencovat své účinky.
Poděkování
RNDr. Denise Krejčí z Ústavu zdravotnických informací a statistiky ČR za spolupráci, poskytnutí dat o incidenci a prevalenci a za jejich analýzu s ohledem k věku, pohlaví a výskytu v ČR.
Práce vznikla za podpory grantů: AZV č. 16 - 27790A, GAČR č. 18-01687S.
This work was supported by the following grants: Agency for Medical Research (AZV) No. 16 - 27790A, and Grant Agency of the Czech Republic (GA ČR) No. 18-01687S.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
doc. MUDr. Anna Jonášová, Ph.D.
I. interní klinika – klinika hematologie 1. LF a VFN
U Nemocnice 2
128 00 Praha 2
e-mail: anna.jonasova@vfn.cz
Obdrženo/Submitted: 18. 1. 2021
Přijato/Accepted: 23. 2. 2021
Zdroje
1. Rollison DE, Howlader N, Smith MT et al. Epidemiology of myelodysplastic syndromes and chronic myeloproliferative disorders in the United States, 2001–2004, using data from the NAACCR and SEER programs. Blood 2008; 112(1): 45–52. doi: 10.1182/ blood-2008-01-134858.
2. Greenberg P, Cox C, LeBeau MM et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89(6): 2079–2088.
3. Greenberg PL, Tuechler H, Schanz J et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood 2012; 120(12): 2454–2465. doi: 10.1182/ blood-2012-03-420489.
4. Bejar R, Stevenson KE, Caughey BA et al. Validation of a prognostic model and the impact of mutations in patients with lower-risk myelodysplastic syndromes. J Clin Oncol 2012; 30(27): 3376–3382. doi: 10.1200/ JCO.2011.40.7379.
5. Monserrat AS, Pomares H, Alonso E et al. Impact of red blood cell transfusion burden status in patients with lower-risk MDS. Blood 2019; 134(Supplement 1): 3031.
6. Neukirchen J, Fox F, Kündgen A et al. Improved survival in MDS patients receiving iron chelation therapy – a matched pair analysis of 188 patients from the Düsseldorf MDS registry. Leuk Res 2012; 36(8): 1067–1070. doi: 10.1016/ j.leukres.2012.04.006.
7. Cermak J, Jonasova A, Vondrakova et. al. A comparative study of deferasirox and deferiprone in the treatment of iron overload in patients with myelodysplastic syndromes Leuk Res 2013; 37(12): 1612–1615. doi: 10.1016/ j. leukres.2013.07.021.
8. Fenaux P, Santini V, Platzbecker U et al. A phase 3 randomized, placebo-controlled study assessing the efficacy and safety of epoetin-α in anemic patients with low-risk MDS. Leukemia 2018; 32(12): 2648–2658. doi: 10.1038/ s41375-018-0118-9.
9. Platzbecker U, Symeonidis A, Oliva EN et al. A phase 3 randomized placebo-controlled double-blind trial of darbepoetin alfa in the treatment of anemia in patients with low and intermediate-1 risk myelodysplastic syndromes. Leukemia 2017; 31(9): 1944–1950. doi: 10.1038/ leu.2017.192.
10. Castelli R, Deliliers GL, Colombo R et al. Biosimilar epoetin in elderly patients with myelodysplastic syndromes improves anemia, quality of life and brain function. Ann Hematol 2014; 93(9): 1523–1529. doi: 10.1007/ s00277 - 014-2070-8.
11. List A, Kurtin S, Roe DJ et al. Effi cacy of lenalidomide in myelodysplastic syndromes. N Engl J Med 2005; 352(6): 549–557. doi: 10.1056/ NEJMoa041668.
12. Fenaux P, Giagounidis A, Mufti GJ et al. A randomized phase 3 study of lenalidomide versus placebo in RBC transfusion-dependent patients with low-/ intermediate - 1-risk myelodysplastic syndromes with del5q. Blood 2011; 118(14): 3765–3776. doi: 10.1182/ blood-2011-01-330126.
13. Cheson BD, Greenberg PL, Bennett JM et al. Clinical application and proposal for modifi cation of the International working group (IWG) response criteria in myelodysplasia. Blood 2006; 108(2): 419–425. doi: 10.1182/ blood - 2005-10-4149.
14. Jonasova A, Neuwirtova R, Zemanova Z et al. Lenalidomide treatment in lower risk myelodysplastic syndromes - The experience of a Czech hematology center. (Positive eff ect of erythropoietin ± prednisone addition to lenalidomide in refractory or relapsed patients). Leuk Res 2018; 69 : 12–17. doi: 10.1016/ j.leukres.2018.03.015.
15. Hellström-Lindberg E, Giagounidis A, Fenaux P et al. Update on the safety and long-term outcomes in lenalidomide - treated patients with red blood cell transfusiondependent low-/ int-1-risk myelodysplastic syndromes and del(5q). Haematologica 2012; 97 (Suppl 1): 358–359.
16. Santini V, Almeida A, Giagounidis A et al. Randomi zed phase III study of lenalidomide versus placebo in RBC transfusion-dependent patients with lower - -risk non-del(5q) myelodysplastic syndromes and ineligible for or refractory to erythropoiesis-stimulating agents. J Clin Oncol 2016; 34(25): 2988–2996. doi: 10.1200/ JCO.2015.66.0118.
17. List AF, Sun Z, Verma A et al. Combined treatment with lenalidomide and epoetin alfa leads to durable responses in patients with epo-refractory, lower risk non-deletion 5q [Del(5q)] MDS: fi nal results of the E2905 intergroup phase III study – an ECOG-ACRIN cancer research group study. Blood 2019; 134(Supplement 1): 841.
18. Fenaux P, Platzbecker U, Mufti GJ et al. Luspatercept in patients with lower-risk myelodysplastic syndromes. N Engl J Med 2020; 382(2): 140–151. doi: 10.1056/ NEJMoa1908892.
19. Platzbecker U, Germing U, Götze KS et al. Luspatercept for the treatment of anaemia in patients with lower-risk myelodysplastic syndromes (PACE-MDS): a multicentre, open-label phase 2 dose-fi nding study with long-term extension study. Lancet Oncol 2017; 18(10): 1338–1347. doi: 10.1016/ S1470-2045(17)30615-0.
20. Garcia-Manero G, Mufti GJ, Fenaux P et al. Hematologic improvement – neutrophil and –platelet in the MEDALIST trial: multilineage data from a phase 3, randomized, double-blind, placebo-controlled study of luspatercept to treat anemia in patients with very low-, low-, or intermediate-risk myelodysplastic syndromes (MDS) with ring sideroblasts (RS) who require red blood cell (RBC) transfusions. Blood 2019; 134 (Supplement 1): 4243.
21. Platzbecker U, Steensma DP, Van Eygen K et al. Imerge: a study to evaluate imetelstat (GRN163L) in transfusiondependent subjects with IPSS low or intermediate-1 risk myelodysplastic syndromes (MDS) that is relapsed/ refractory to erythropoiesis-stimulating agent (ESA) treatment. Blood 2019; 134(Supplement 1): 4248.
22. Chen N, Hao C, Peng X et al. Roxadustat for anemia in patients with kidney disease not receiving dialysis. N Engl J Med 2019; 381(11): 1001–1010. doi: 10.1056/ NEJMoa1813599.
23. Henry, DH, Glaspy J, Harrup RA et al. Roxadustat (FG4592; ASP1517; AZD9941) in the treatment of anemia in patients with lower risk myelodysplastic syndrome (LR-MDS) and low red blood cell (RBC) transfusion burden (LTB). Blood 2019; 134 (Supplement 1): 843.
24. Fenaux P, Muus P, Kantarjian H et al. Romiplostim monotherapy in thrombocytopenic patients with myelodysplastic syndromes: long-term safety and effi cacy. Br J Haematol 2017; 178(6): 906–913. doi: 10.1111/ bjh.14792.
25. Platzbecker U, Kubasch AS, Giagounidis A et al. Biomarkers of response to romiplostim in patients with lower-risk myelodysplastic syndrome (MDS) and thrombocytopenia – results of the Europe trial by the Emsco network. Blood 2019; 134 (Supplement 1): 2998.
26. Oliva EN, Alati C, Santini V et al. Eltrombopag versus placebo for low-risk myelodysplastic syndromes with thrombocytopenia (EQoL-MDS): phase 1 results of a single-blind, randomised, controlled, phase 2 superiority trial. Lancet Haematol 2017; 4(3): e127–e136. doi: 10.1016/ S2352-3026(17)30012-1.
27. Silverman LR, Demakos EP, Peterson BL et al. Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome: a study of the cancer and leukemia group B. J Clin Oncol 2002; 20(10): 2429–2440. doi: 10.1200/ JCO.2002.04.117.
28. Scott BL, Pasquini MC, Logan BR et al. Myeloablative versus reduced-intensity hematopoietic cell transplantation for acute myeloid leukemia and myelodysplastic syndromes. J Clin Oncol 2017; 35(11): 1154–1161. doi: 10.1200/ JCO.2016.70.7091.
29. Damaj G, Duhamel A, Robin M et al. Impact of azacitidine before allogeneic stem-cell transplantation for myelodysplastic syndromes: a study by the Société Française de Greff e de Moelle et de Thérapie-Cellulaire and the Groupe-Francophone des Myélodysplasies, J Clin Oncol 2012; 30(36): 4533–4540. doi: 10.1200/ JCO.2012.44.3499.
30. Jonášova A, Čermák J, Červínek L et al. První zkušenosti České MDS skupiny s terapií 5-azacytidinem u nemocných s myelodysplastickým syndromem s vyšším rizikem (IPSS střední 2 a vysoké riziko), akutní myeloidní leukemií do 30 % myeloblastů a chronickou myelomonocytární leukemií II. Tranfuze Hematol dnes 2013; 19(3): 125–133.
31. Garcia JS, Wei A, Borate U et al. Safety, effi cacy, and patient-reported outcomes of venetoclax in combination with azacitidine for the treatment of patients with higherrisk myelodysplastic syndrome: a phase 1b study. Blood 2020; 136 (Supplement 1): 55–57.
32. Carpentier GR, DeZern AE, DiNardo CD et al. Preliminary results from the phase II study of the IDH2-inhibitor enasidenib in patients with high-risk IDH2-mutated myelodysplastic syndromes (MDS). Blood 2019; 134 (Supplement 1): 678.
33. Sallman DA, DeZern AE, Garcia-Manero G et al. Phase 2 results of APR-246 and azacitidine (AZA) in patients with TP53 mutant myelodysplastic syndromes (MDS) and ol - igoblastic acute myeloid leukemia (AML). Blood 2019; 134(Supplement 1): 676.
34. Sallman DA, Asch AS, Monzr M et al. The fi rst-in-class anti-CD47 antibody magrolimab (5F9) in combination with azacitidine is eff ective in MDS and AML patients: ongoing phase 1b results. Blood 2019; 134 (Supplement 1): 569.
35. Navada SC, Fruchtman SM, Odchimar-Reissig R et al. A phase 1/ 2 study of rigosertib in patients with myelodysplastic syndromes (MDS) and MDS progressed to acute myeloid leukemia. Leuk Res 2018; 64 : 10–16. doi: 10.1016/ j.leukres.2017.11.006.
36. Swords ET, Cotre S, Maris MB et al. Pevonedistat, a fi rst-in-class NEDD8-activating enzyme inhibitor, combined with azacitidine in patients with AML. Blood 2018; 131(13): 1415–1424. doi: 10.1182/ blood-2017-09-805 895.
37. Ades L, Watts JM, Radinoff A et al. Phase II study of pevonedistat (P) + azacitidine (A) versus A in patients (pts) with higher-risk myelodysplastic syndromes (MDS)/ chronic myelomonocytic leukemia (CMML), or low-blast acute myelogenous leukemia (LB AML) (NCT02610777). J Clin Oncol 2020; 38(5). doi: 10.1200/ JCO .2020.38.15 suppl.7506.
38. Zeidan AM, Miyazaki Y, Platzbecker U et al. A randomized, double-blind, placebo-controlled, phase II study of MBG453 added to hypomethylating agents (HMAs) in patients (pts) with intermediate, high, or very high risk myelodysplastic syndrome (MDS): stimulus-MDS1. Blood 2019; 134 (Supplement 1): 4259.
39. Curik N, Burda P, Stopka T et al. 5-azacitidine in aggressive myelodysplastic syndromes regulates chromatin structure at PU.1 gene and cell diff erentiation capacity. Leukemia 2012; 26(8): 1804–1811. doi: 10.1038/ leu.2012.47.
40. Stopka T, Jonasova A, Minařík et al. Randomizovaná otevřená akademická studie: srovnání standardního podání azacytidinu oproti azacytidinu s preinkubací G-CSF u myelodysplastického syndromu vyššího rizika – interim analýza. Myelodysplastic Syndrome News 2019; 7(2): 12–15.
41. Radakovich N, Sekeres MA, Nazha A et al. Predicting response to hypomethylating agents in patients with myelodysplastic syndromes (MDS) using artifi cial intelligence (AI). Blood 2019; 134 (Supplement1): 2089.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie Hematologie a transfuzní lékařství Praktické lékařství pro dospělé
Článek Anotace knihyČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2021 Číslo 5- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Myelodysplastický syndrom, refrakterní anemie a O2 sensing
- Místo a důležitost kyseliny hyaluronové při nežádoucích účincích radioterapie
- Vztah mezi polymorfizmy genů nukleotidové excizní reparace a náchylností ke kožnímu melanomu
- Pokroky v terapii myelodysplastického syndromu
- Informace z České onkologické společnosti
- eHealth v medicíně a onkologii – nové horizonty klinické praxe
- Osobnosti a ich prínos pre rozvoj radiačnej onkológie
- Klinické hodnoty dvou lncRNA signální dráhy estrogenového receptoru u invazivního duktálního karcinomu prsu
- Kabozantinib v léčbě metastatického karcinomu ledviny – finální analýza dat ze čtyř onkologických center v České republice
- Anotace knihy
- Reiradiace rekurentních spinálních metastáz karcinomu štítné žlázy řízená magnetickou rezonancí bez kovových artefaktů
- Odborné stanovisko k péči o pacienty s implantovanými kardiostimulátory a kardiovertery-defibrilátory s indikací k radioterapii – souhrn pro profese v oblasti radiační onkologie
- Aktuality z odborného tisku
- Skupina léků anti-HER2 pro pacientky s karcinomu prsu se rozrostla o preparát Phesgo
- Spomienka na prof. MUDr. Ivana Kozu, DrSc.
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Osobnosti a ich prínos pre rozvoj radiačnej onkológie
- Skupina léků anti-HER2 pro pacientky s karcinomu prsu se rozrostla o preparát Phesgo
- Pokroky v terapii myelodysplastického syndromu
- Místo a důležitost kyseliny hyaluronové při nežádoucích účincích radioterapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



