-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Deukravacitinib – nová perorální modalita cílené terapie psoriázy
25. 6. 2024
Pro české pacienty bude brzy k dispozici nový přípravek pro systémovou léčbu středně těžké až těžké psoriázy – první zástupce nové třídy inhibitorů tyrosinkinázy 2 (TYK2) deukravacitinib, který má prokázanou trvalou účinnost po dobu až 4 let. Na 19. kongresu českých a slovenských dermatovenerologů mu bylo věnováno sympozium, v jehož rámci prof. MUDr. Petra Cetkovská, Ph.D., z Dermatovenerologické kliniky LF UK a FN Plzeň a prof. MUDr. Petr Arenberger, DrSc., z Dermatovenerologické kliniky 3. LF UK a FNKV v Praze prezentovali data dokládající jeho vyšší klinickou účinnost v porovnání s placebem a apremilastem, dobrou bezpečnost a přetrvávající odpověď z hlediska PASI75, PASI90, PASI100 a sPGA 0/1 a konzistentní bezpečnostní profil až do 208. týdne léčby.
Mechanismus účinku deukravacitinibu
Klíčové dráhy v patofyziologii psoriázy zahrnují aktivaci imunitních buněk přes osu interleukin 23 – pomocné T lymfocyty 17 (IL-23–TH17). Deukravacitinib je selektivní inhibitor TYK2, která zprostředkovává imunitní a prozánětlivou signalizaci uplatňující se v patofyziologii některých autoimunitních onemocnění, jako je psoriáza, psoriatická artritida, Crohnova nemoc, ulcerózní kolitida, ankylozující spondylitida či Sjögrenův syndrom.
Deukravacitinib je malá molekula, která se váže na regulační doménu TYK2 a blokuje signalizaci přes IL-23, IL-12 a interferon (IFN) typu I, ale neovlivňuje signalizaci přes Janusovy kinázy (JAK) 1, 2, 3 (viz obr. 1). Brání tak diferenciaci pomocných T lymfocytů (TH1, TH17) a B lymfocytů, sekreci IFN-γ a maturaci dendritických buněk, ale neovlivňuje například hematopoezu, vrozenou a adaptivní imunitní odpověď, tvorbu osteoklastů či přežití neuronů. Kromě psoriázy se deukravacitinib uplatňuje i u jiných, výše uvedených onemocnění.
Obr. 1. Mechanismus účinku deukravacitinibu

Design a průběh klinických studií fáze III s deukravacitinibem v léčbě psoriázy
Účinnost a bezpečnost deukravacitinibu v léčbě psoriázy byla hodnocena v randomizovaných dvojitě zaslepených studiích POETYK PSO-1 a 2 a v jejich otevřeném prodloužení POETYK PSO-LTE. Do těchto studií byli zařazeni pacienti se středně těžkou až těžkou ložiskovou psoriázou s Indexem plochy a závažnosti psoriázy (PASI − Psoriasis Area Severity Index) ≥ 12, skóre statického Celkového hodnocení lékařem (sPGA − static Physician's Global Assessment) ≥ 3 a plochou postiženého tělesného povrchu (BSA − Body Surface Area) ≥ 10 %. Deukravacitinib v dávce 6 mg 1× denně v nich byl porovnáván s placebem a apremilastem (s titrací dávky na 30 mg 2× denně p.o.).
Po 16 týdnech léčby byl porovnán podíl pacientů s dosažením alespoň 75% zlepšení skóre PASI (PASI75) a sPGA 0/1 ve skupině s deukravacitinibem a s placebem (primární sledovaný parametr). Poté byli pacienti původně randomizovaní k podávání placeba převedeni na deukravacitinib. Po 24 týdnech byli pacienti ve studii POETYK PSO-1, kteří nedosáhli ≥ PASI50 s apremilastem, převedeni na deukravacitinib, pacienti ve studii POETYK PSO-2 na aktivní léčbě apremilastem nebo deukravacitinibem byli při dosažení ≥ PASI75 převedeni na placebo a při ztrátě odpovědi zpět na deukravacitinib. Po 52 týdnech léčby byli všichni pacienti způsobilí k účasti v dlouhodobém otevřeném prodloužení studie, kde všichni dostávali deukravacitinib 6 mg 1× denně.
Hodnocená populace pacientů
Do studií POETYK PSO-1 a 2 bylo zařazeno celkem 1683 pacientů průměrného věku 46,6 roku, přičemž 2/3 z nich tvořili muži. Průměrná délka trvání psoriázy byla 18,7 roku, průměrné skóre PASI 21,2 a dle sPGA mělo 79,8 % středně těžkou psoriázu a 20,2 % těžkou psoriázu. Předchozí systémovou léčbu psoriázy užívalo 57,5 % zařazených, u 34,8 % se jednalo o biologickou léčbu. Více než 60 % pacientů mělo na začátku léčby středně těžkou až těžkou psoriázu v oblasti hlavy. Demografické charakteristiky byly v jednotlivých terapeutických skupinách srovnatelné.
Účinnost během prvního roku léčby
Míra dokončení 16 týdnů léčby ve studiích POETYK PSO-1 a 2 byla vysoká a činila u deukravacitinibu 92,5 %, resp. 89,4 %, u placeba 87,9 %, resp. 83,5 % a u apremilastu 86,3 %, resp. 85,4 %.
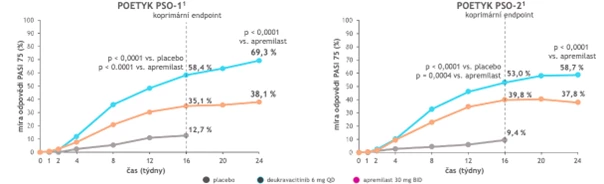
Po 16 týdnech dosáhl PASI75 významně větší podíl pacientů ve skupině s deukravacitinibem v porovnání s placebem (p < 0,0001) i s apremilastem (p < 0,0001 v POETYK PSO-1; p = 0,0004 v POETYK PSO-2). Tento významný rozdíl mezi rameny s deukravacitinibem a s apremilastem byl pozorován i ve 24. týdnu (p < 0,0001; viz obr. 2). Z pacientů na deukravacitinibu, kteří dosáhli PASI75 ve 24. týdnu a pokračovali v léčbě, si 82,5 % ve studii POETYK PSO-1 a 80,4 % ve studii POETYK PSO-2 udrželo odpověď PASI75 v 52. týdnu.
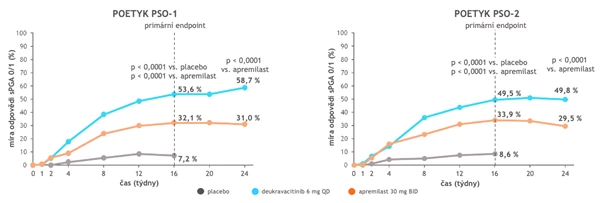
Podobně tomu bylo i z hlediska sPGS. V obou studiích dosáhl sPGA 0/1 v 16. týdnu významně větší podíl pacientů s deukravacitinibem v porovnání s placebem (p < 0,0001) i apremilastem (p < 0,0001). Tento významný rozdíl mezi skupinou s deukravacitinibem a apremilastem přetrvával rovněž ve 24. týdnu (p < 0,0001; viz obr. 3). Nástup účinku deukravacitinibu byl velmi rychlý. Významný rozdíl v PASI v porovnání s placebem byl pozorován již po 1 týdnu léčby.
Obr. 2 Dosažení PASI75 po 16 týdnech léčby deukravacitinibem, apremilastem nebo placebem ve studiích POETYK PSO-1 a 2
Obr. 3 Dosažení sPGA 0/1 po 16 týdnech léčby deukravacitinibem, apremilastem nebo placebem ve studiích POETYK PSO-1 a 2
Přínos deukravacitinibu byl zjištěn i z hlediska sekundárních sledovaných parametrů. Po 16 týdnech léčby dosáhlo v obou studiích významně více pacientů s deukravacitinibem téměř úplného vyhojení kůže (PASI90) v porovnání s placebem (p < 0,0001) i apremilastem (p = 0,0002, resp. p = 0,0046), zmírnění psoriázy v oblasti hlavy (ssPGA 0/1) v porovnání s placebem i s apremilastem (všechna p < 0,0001) a zlepšení kvality života dle Dermatologického indexu kvality života pacienta (DLQI − Dermatology Life Quality Index) 0/1 v porovnání s placebem (p < 0,0001) i apremilastem (p = 0,0088, resp. p < 0,0001).
Tento statisticky významný rozdíl mezi rameny s deukravacitinibem a apremilastem byl pozorován také ve 24. týdnu pro všechna hodnocení. U pacientů, kteří dostávali kontinuální léčbu deukravacitinibem, se od 16. do 52. týdne udržely odpovědi PASI75 a sPGA 0/1.
Prodloužené sledování po dobu 4 let
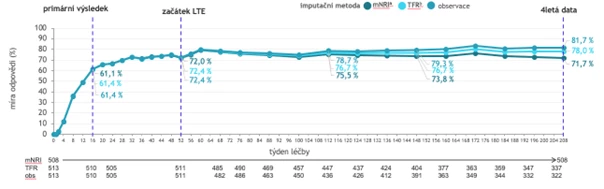
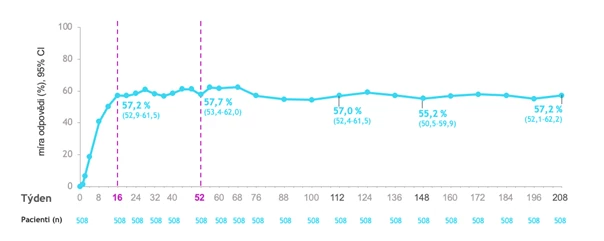
Zcela aktuální jsou 4letá data ze studie POETYK PSO-LTE. Ukazují, že vysoký podíl pacientů s odpovědí PASI75 při kontinuální léčbě deukravacitinibem přetrvával během celých 4 let. Na konci 4. roku činil 81,7 % (viz obr. 4). Podobně přetrvával po celé 4 roky léčby podíl pacientů s PASI90, který ve 208. týdnu činil 54,7 %. Při kontinuální léčbě deukravacitinibem se po dobu 4 let držel na vysokých hodnotách také podíl pacientů s sPGA 0/1 (57,2 % na konci 4. roku; viz obr. 4).
Obr. 4 Přetrvávající vysoký podíl pacientů s dosažením PASI75 a sPGA 0/1 po dobu 4 let při kontinuální léčbě deukravacitinibem ve studii POETYK PSO-LTE
Bezpečnostní profil
Jak ukazují integrovaná data ze studií POETYK PSO-1 a 2, výskyt nežádoucích příhod byl během prvních 16 týdnů léčby srovnatelný při podávání deukravacitinibu (55,7 %), apremilastu (57,6 %) i placeba (49,6 %). U deukravacitinibu se nejčastěji jednalo o nazofaryngitidu (9,0 %), infekce horních dýchacích cest (5,5 %), bolesti hlavy (4,5 %) a průjem (4,4 %). Závažné nežádoucí příhody byly popsány u 1,8 % pacientů s deukravacitinibem, u 1,2 % s apremilastem a u 2,9 % s placebem, k přerušení léčby vedly nežádoucí příhody u 2,4 %, resp. 5,2 %, resp. 3,8 % léčených.
Mezi 16. a 52. týdnem léčby nebyly pozorovány žádné nové bezpečnostní signály. Kožní příhody zvláštního významu zahrnovaly folikulitidu a akné a vyskytly se u 2,0 %, resp. u 2,1 % pacientů s deukravacitinibem. Všechny případy byly mírné až středně těžké, léčbu deukravacitinibem přerušil 1 nemocný s folikulitidou.
Kumulativní souhrn bezpečnosti po dobu 2 a 3 let ukázal, že kromě mírně vyšší míry výskytu infekce COVID-19 zůstal výskyt nežádoucích příhod po dobu 3 let konzistentní s daty ze základních jednoročních studií. Z důvodu nežádoucích příhod ukončilo léčbu deukravacitinibem během 3 let 2,4 % léčených.
Závěr
Deukravacitinib v rámci klinických hodnocení a dlouhodobé – až 4 roky trvající – léčby prokázal superioritu ve všech sledovaných parametrech účinnosti v porovnání s placebem i apremilastem. Klinické výsledky účinnosti zahrnující PASI75, PASI90, PASI100 a sPGA 0/1 přetrvávaly u pacientů, kteří byli nepřetržitě léčeni deukravacitinibem, od počátku léčby až do 208. týdne.
Deukravacitinib má příznivý bezpečnostní profil. Mezi nejčastější nežádoucí účinky patří infekce horních cest dýchacích, bolest hlavy a průjem. Vzhledem k tomu, že mechanismus účinku deukravacitinibu spočívá v selektivní inhibici TYK2, na rozdíl od inhibitorů JAK při jeho podávání nehrozí neutropenie, anémie, změny počtu trombocytů, abnormality lymfocytů, zvýšení jaterních enzymů, dyslipidémie ani zvýšení kreatininu v séru.
Po rozhodnutí o úhradě ze zdravotního pojištění by měl být deukravacitinib v Česku k dispozici podle odhadů od října či listopadu 2024. Tento nový lék s pohodlným perorálním podáváním 1× denně bez iniciální titrace rozšíří portfolio terapeutických možností u dospělých se středně těžkou až těžkou ložiskovou psoriázou, kteří jsou kandidáty systémové léčby.
(zza)
Zdroje:
1. Cetkovská P. Jak deukravacitinib funguje a co to znamená z hlediska bezpečnosti léčby? 19. kongres českých a slovenských dermatovenerologů, Olomouc, 6.–8. 6. 2024.
2. Arenberger P. Deukravacitinib v léčbě psoriázy a jeho 4letá data. 19. kongres českých a slovenských dermatovenerologů, Olomouc, 6.–8. 6. 2024.1787-CZ-2400039
Zkrácenou informaci o přípravku naleznete zde.
Obchodní sdělení společnosti Bristol-Myers Squibb, spol. s r. o.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Dermatologie
Nejčtenější tento týden- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- INFOGRAFIKA: Světový den boje proti rakovině... aneb jaké výzvy stojí před českou onkologií?
- AI pomůže personalizovat léčbu fibrilace síní
- Česká gastroenterologie jde s dobou. Už 80 let
- Původní český test ALBA pro odhalení mírných kognitivních deficitů získal certifikaci MZ ČR
Mohlo by vás zajímat- Přidání perorálního acetazolamidu (Diluran) k topické léčbě dorzolamidem může vést k dalšímu snížení nitroočního tlaku u některých dětí s glaukomem
- Nová fixní kombinace pro léčbu akné – 1,2% klindamycinfosfát a 0,025% tretinoin
- Léčba zánětů spojivek a mazových žlázek víčka v primární péči
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- Porovnání aplikace neomycinu/polymyxinu-B jeden den nebo jednu hodinu před operací katarakty
- Časné přidání kortikosteroidů v lokální léčbě bakteriální keratitidy
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




