-
Medical journals
- Career
Úbytek kostní hmoty u androgen deprivační terapie: naléhavý problém pacientů s karcinomem prostaty – naše zkušenosti
Authors: Prof. MUDr. Dalibor Pacík, CSc. 1; as. MUDr. Vítězslav Vít 1; prim. MUDr. Jana Katolická, Ph.D. 2; RNDr. Jiří Jarkovský, Ph.D. 3
Authors‘ workplace: Urologická klinika LF MU, FN Brno 1; Onkologicko-chirurgické oddělení, FN u sv. Anny Brno 2; Institut biostatistiky a analýz, MU Brno 3
Published in: Urol List 2011; 9(1): 60-64
Overview
Androgenní deprivační terapie (ADT) hraje v dnešní době nezastupitelnou roli v léčbě pacientů s lokálně pokročilým nebo metastazujícím karcinomem prostaty. Její přínos pro prognózu pacientů s tímto onemocněním je nepochybný; méně se hovoří o úbytku kostní hmoty, ke kterému v důsledku této léčby dochází. Úbytek kostní hmoty vlivem ADT (tzv. CTIBL – Cancer Treatment Induced Bone Loss) vede v konečném důsledku ke zvýšené morbiditě i mortalitě a ke zvýšeným celospolečenským nákladům. Na našem souboru 104 pacientů jsme zjišťovali výskyt osteoporózy a osteopenie na základě měření kostní denzity (BMD – Bone Mineral Density). Následující článek nabízí výsledky našeho šetření a zamýšlí se nad novou možností léčby CTIBL, kterou představuje plně humánní monoklonální protilátka denosumab.
Klíčová slova:
androgenní deprivační terapie, BMD, RANKL, denosumab, karcinom prostaty, patologické frakturyÚvod
Vyloučíme-li diagnózu „jiného zhoubného novotvaru kůže“ (zastoupeného především bazaliomem), byl karcinom prostaty v roce 2006 podle údajů Národního onkologického registru nejčastěji diagnostikovaným onkologickým onemocněním mužů u nás s počtem 4 829 nových případů, čímž předstihl v incidenci i karcinom plic [1]. O dva roky později, v roce 2008, již bylo hlášeno 5 719 nových onemocnění, což představuje hrubou incidencí 113,1/100 000 obyvatel. Nárůst incidence a prevalence nádorů prostaty je vysvětlován stárnutím populace a zdokonalením a dostupností diagnostických metod, především pak vyšetřováním prostatického specifického antigenu (PSA). S tím souvisí i zvyšující se podíl záchytu v časných stadiích tohoto onemocnění, kdy dvě třetiny případů jsou hlášeny ve stadiu I nebo II (obr. 1). Tím lze vysvětlit stabilizovanou mortalitu navzdory zvyšující se incidenci (obr. 2).
Image 1. Karcinom prostaty – zastoupení klinických stadií. 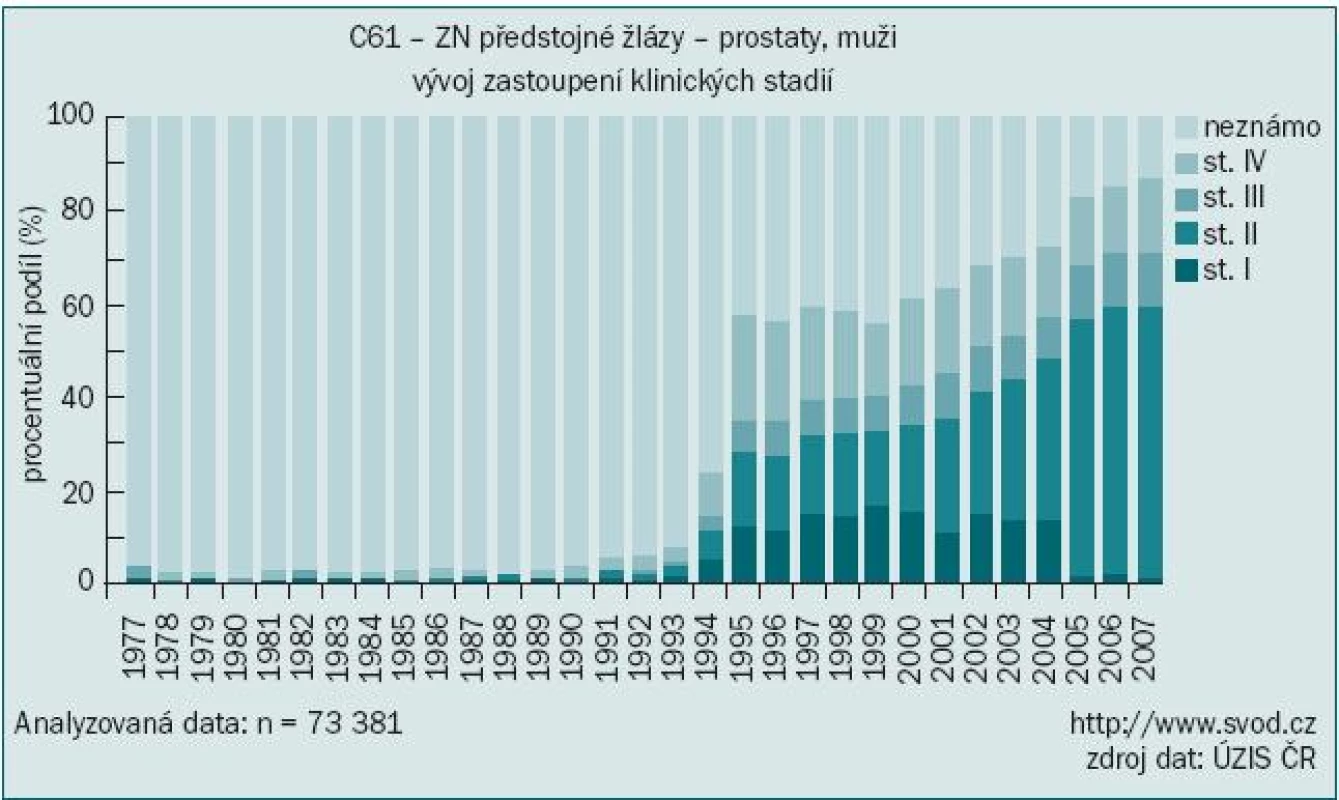
Image 2. Věkově standardizovaná incidence a úmrtnost podle evropského standardu na 100 000 obyvatel. 
Androgenní deprivační léčba a úbytek kostní hmoty
Mezi základní léčebné modality karcinomu prostaty patří androgen deprivační léčba, která tvoří základ léčby diseminovaného onemocnění [2,3]. Časté je její užití i u pacientů s lokálně pokročilým onemocněním, kde prokazatelně zlepšuje celkové přežití i přežití bez známek nemoci v adjuvanci po radioterapii [4,5], případně u pacientů po radikální prostatektomii a pánevní lymfadenektomii s pozitivními uzlinami [6] a u pacientů se vzrůstající hladinou PSA po selhání primární léčby.
Vedle chirurgické léčby se při ADT uplatňují nejčastěji LHRH analoga, která zpětnovazebním mechanizmem vedou k down regulaci androgenních receptorů s cílem snížit hladinu testosteronu a dihydrotestosteronu na kastrační úroveň, a tím omezit růstové stimuly pro prostatické nádorové buňky.
Účinná léčba však přináší i nežádoucí účinky. Pacienti jsou často postaveni před nutnost vyrovnat se s erektilní dysfunkcí, gynekomastií a změnou v oblasti pohlavních orgánů. Okolí pacientů může trpět jejich výkyvy nálad, depresemi a ztrátou energie. Vedle těchto zjevných nežádoucích účinků ADT jsou pacienti ohroženi i plíživými změnami lipidového spektra, rozvojem metabolického syndromu a hypertenze, jež s sebou přináší riziko vzniku nebo zhoršení kardiovaskulárních chorob a s nimi spojené mortality. Pro minimalizaci těchto rizik je důležité doporučení směřující k úpravě režimu pacientů včetně cvičení a racionální diety, což může současně zlepšit kvalitu jejich života, včetně zmírnění deprese a únavy.
Jedním ze skrytých rizik androgenní deprivační léčby (ADT) je snížení denzity kostního minerálu, které může vést až k iatrogenně navozené osteopenii a osteoporóze a s nimi spojenými patologickými frakturami [7]. Hovoříme o úbytku kostní hmoty v důsledku ADT (tzv. CTIBL – Cancer Treatment Induced Bone Loss), ve které hraje klíčovou roli signální dráha zahrnující RANKL (ligand receptoru aktivujícího nukleární faktor kappa B).
Je nutno si uvědomit, že věkový průměr mužů s diagnózou karcinomu prostaty je poměrně vysoký – tři čtvrtiny pacientů je starších 65 let. V tomto věku je zdraví kosti ohroženo fyziologickým úbytkem kostního minerálu, který postihuje muže obdobným mechanizmem, jaký známe u postmenopauzální osteoporózy u žen. Muži tvoří přibližně 20 % všech pacientů s diagnostikovanou osteoporózou. Přestože z celkového počtu fraktur proximálního femuru jich připadá na muže 25–30 %, mortalita v prvním roce po prodělané fraktuře je dvojnásobná ve srovnání se stejně postiženými ženami [9]. U mužů nad 75 let je riziko úmrtí v průběhu jednoho roku po fraktuře 20,7 % ve srovnání se 7,5% rizikem u žen.
Role RANK ligandu v patogenezi CTIBL
Pro úbytek kostní hmoty je charakteristická snížená mechanická odolnost, která predisponuje kost k frakturám. Pevnost kosti je dána množstvím kostního minerálu, kvalitou organické kostní matrix a mikroarchitekturou kosti. Pro udržení této pevnosti je důležité zachování rovnováhy mezi odbouráváním kosti a její novotvorbou. V 90. letech minulého století prokázaly studie na transgenních myších, že tato rovnováha je dána poměrem RANK ligandu a osteoprotegerinu. RANKL je polypeptid z rodiny TNF receptorů. Vazbou na svůj receptor RANK na povrchu myeloidních progenitorových buněk umožní diferenciaci a maturaci těchto prekurzorů, jejichž fúzí vznikají velké polynukleární osteoklasty. Vazba RANKL na receptor na povrchu zralých osteoklastů vede k jejich aktivaci a inhibicí apoptózy též k jejich prodlouženému přežívání. Tomu fyziologicky brání osteoprotegerin (OPG), solubilní glykoprotein secernovaný osteoblasty. Vazbou na RANK ligand brání jeho interakci s RANK na osteoklastech a následné osteoklastogenezi a akcelerované osteoresorpci.
Produkce OPG je stimulována řadou faktorů, z nichž nejdůležitější roli hrají estrogeny. V důsledku poklesu hladiny estrogenů u postmenopauzálních žen dochází k nedostatečnému secernování OPG a rozvoji postmenopauzální osteoporózy. U mužů je dostatečné množství OPG zajištěno přeměnou androgenů na estrogeny za účasti enzymu aromatázy. Při hormonálně ablativní terapii, ať již chirurgické, či chemické za použití LHRH analog, dochází v důsledku poklesu hladiny androgenů k nedostatečné přeměně na estrogeny. Následný nedostatek osteoprotegerinu vede k převaze osteoresorpce nad osteoformací. Výsledkem je úbytek kostní hmoty, destrukce kosti a zvýšený sklon k frakturám i u mužů, u kterých ještě nedošlo k rozvoji kostních metastáz.
ADT představuje velmi významný rizikový faktor – úbytek kostní hmoty v důsledku ADT je devítinásobný ve srovnání s mladými zdravými muži a pětinásobný oproti postmenopauzálním ženám [8]. Riziko fraktury roste s délkou podávání ADT [10]. Ze srovnání 3 887 pacientů s nemetastazujícím karcinomem prostaty léčených LHRH agonisty a 7 774 pa - cientů bez ADT vyplynula statisticky signifikantně kratší doba do první fraktury ve skupině pacientů s ADT podávanou déle než rok.
Shahinian ve své studii z roku 2005 ukázal, že jeden z pěti mužů, kteří byli léčeni LHRH agonisty, utrpěl do 4 let patologickou frakturu. Riziko fraktury bylo nepřímo úměrné počtu dávek ADT. Při počtu dávek ≥ 9 bylo riziko fraktury vyšší o 45 %, u orchiektomie dokonce o 54 %.
Výsledky sledování kostní denzity pacientů s karcinomem prostaty v rámci pracoviště Urologické kliniky FN Bohunice
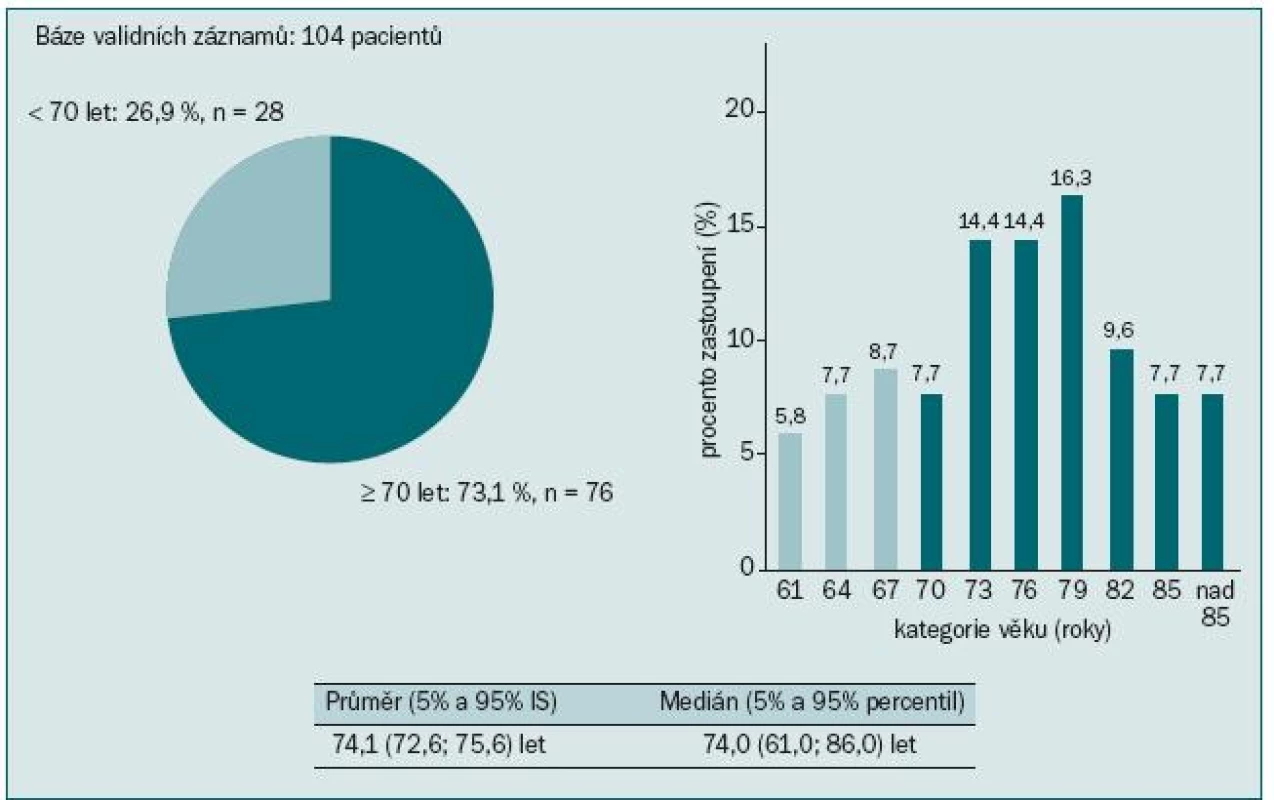
V našem souboru 104 pacientů jsme sledovali výskyt osteoporózy a osteopenie u pacientů užívajících ADT. 73,1 % pacientů bylo starších 70 let, průměrný věk pacientů byl 74,1 let (obr. 3). Většina pacientů (95,2 %) měla hodnoty testosteronu pod kastrační hodnotou (1,7 nmol/l) (obr. 4). Údaje o délce užívání ADT jsme měli k dispozici u třetiny pacientů. Všichni dostávali ADT po dobu ≥ 10 měsíců. Měření kostní denzity bylo provedeno na DXA přístrojích HOLOGIC DISCOVERY (98,1 % pacientů) a LUNAR PRODIGY (1,9 % pacientů). Osteoporóza byla u pacientů diagnostikována, pokud měli T-skóre ≤ -2,5, za osteopenické byli pacienti označeni, pokud měli v měřených místech skeletu (bederní páteř, proximální femur, krček femuru, distální 1/3 předloktí) T-skóre ≤ -1,0 a > -2,5. Normální denzita předpokládá T-skóre > -1,0. Riziko fraktury bylo určeno za pomoci Z-skóre, které porovnává kostní denzitu vyšetřovaného jedince s průměrnými hodnotami stejně starých jedinců téhož pohlaví. Hodnoty Z-skóre pod -1,0 určuje pacienty s vyšším rizikem zlomeniny.
Image 4. Hladina testosteronu. 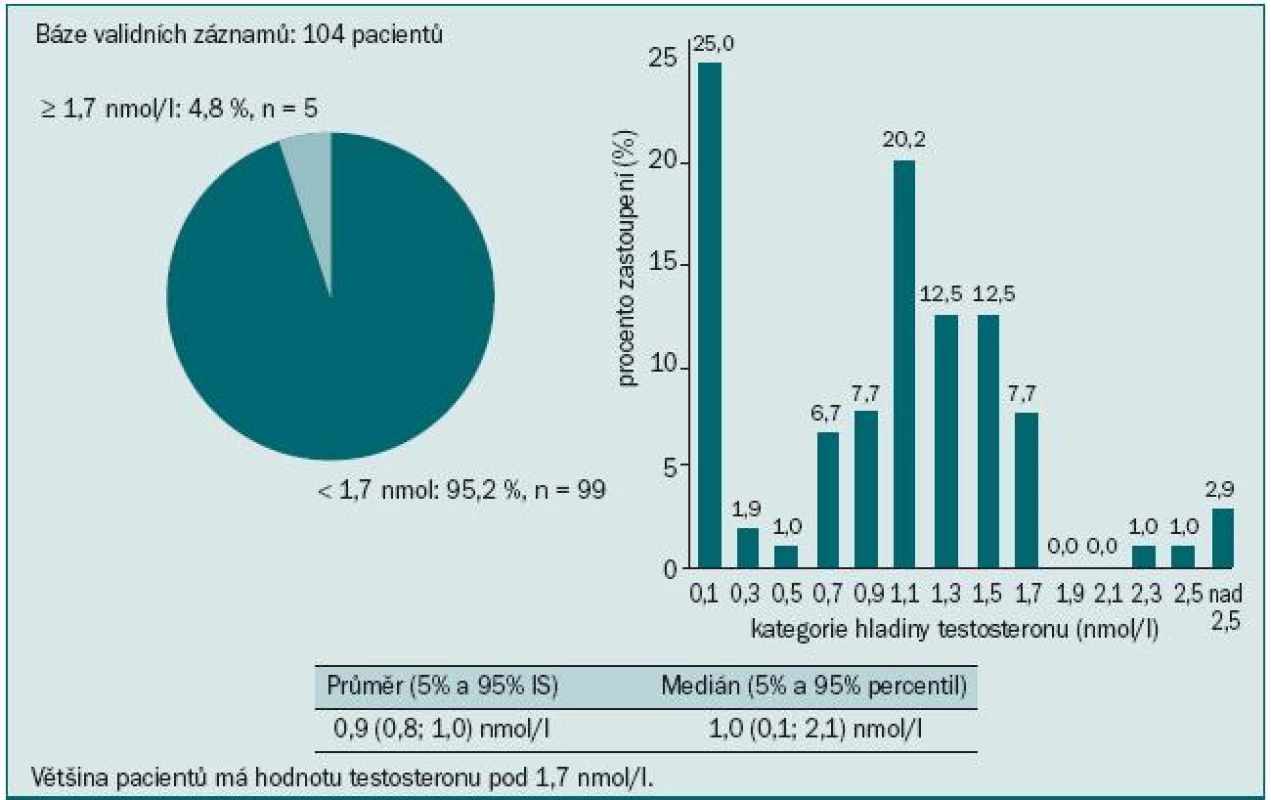
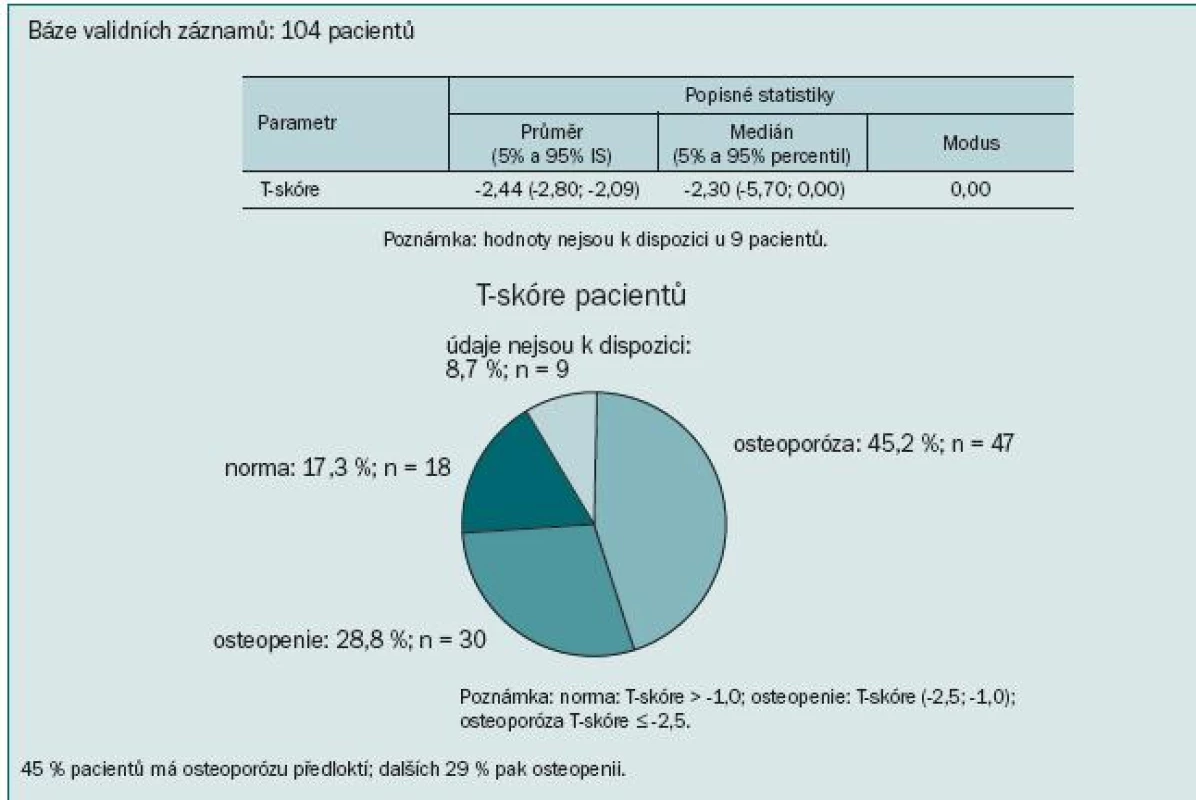
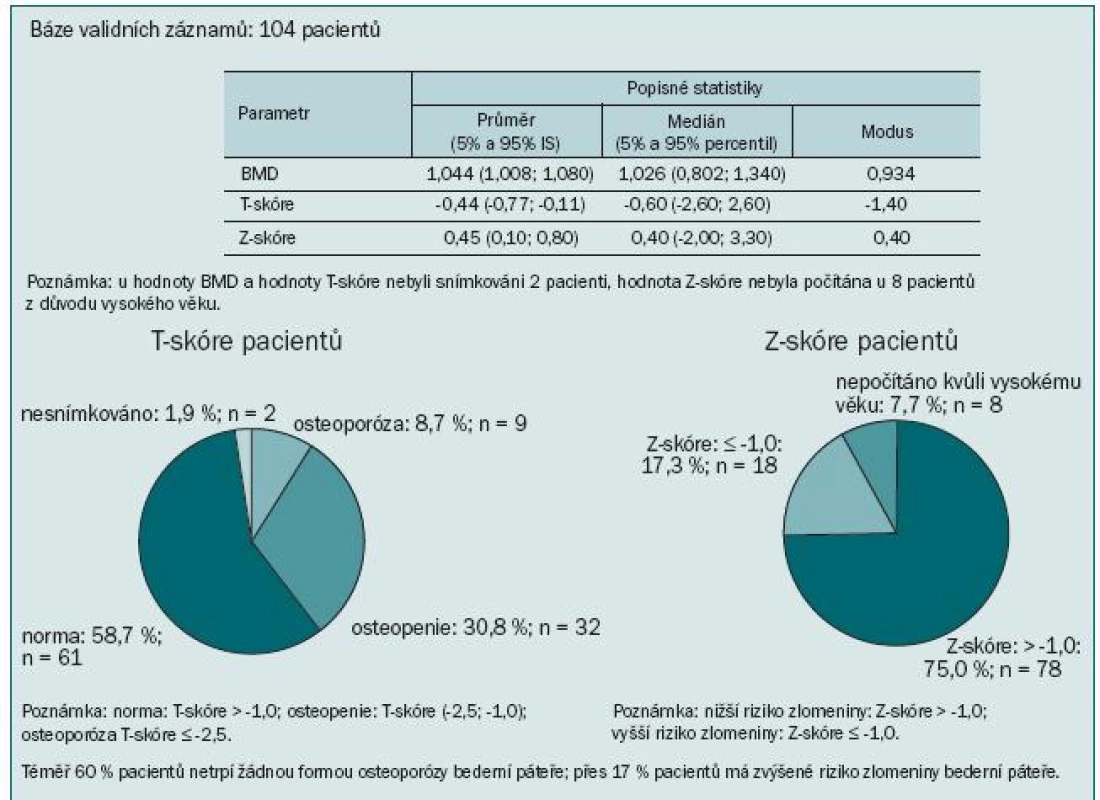
Výsledky ukázaly kostní postižení srovnatelné s literárními údaji: u 74 % pacientů jsme zaznamenali T-skóre -1,0 v oblasti páteře, proximálního femuru nebo krčku femuru, to znamená snížený úbytek kostní hmoty proti normě téměř u 3/4 pacientů. Z toho 17,3 % pacientů mělo BMD v rozmezí hodnot pro osteoporózu a 56,7 % pacientů mělo osteopenii. Obzvláště alarmující je více než 64% výskyt osteoporózy nebo osteopenie v oblasti krčku levé kosti stehenní. Průměrná hodnota BMD se pohybovala v této lokalizaci v oblasti osteopenie (obr. 5). Přitom většina patologických fraktur se vyskytuje v osteopenickém terénu. Ještě vyšší míru ohrožení jsme pozorovali při měření kostní denzity v distální třetině radia: T-skóre ≤ -2,5 svědčící pro osteoporózu jsme zaznamenali u 45 % pacientů a osteoporózu nebo osteopenii dokonce u 74 % (obr. 6). To je v souladu se známou skutečností, že Collesova fraktura patří mezi první známky osteoporózy. Mnohem závažnější však jsou kompresivní fraktury obratlů, obzvláště pokud vedou k míšní kompresi, a fraktury krčku kosti stehenní spojené s výrazným snížením kvality života, imobilizací a nutností hospitalizace.
Image 5. Krček levého proximálního femuru. 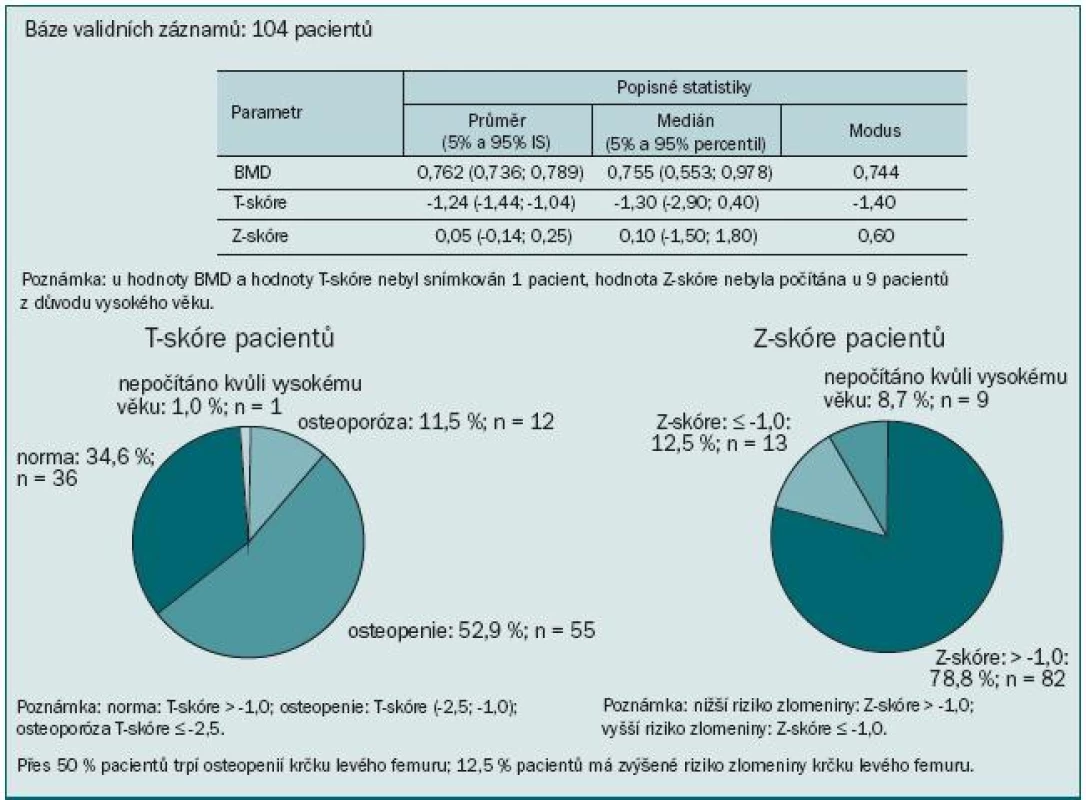
V naší populaci pacientů jsme pozorovali statisticky významnou závislost BMD krčku levé kyčle na věku: pacienti ve věku nad 70 let měli osteoporózu nebo osteopenii v 72,4 %, zatímco u pacientů do 70 let se tento nález vyskytoval jen v 44,4 % (p = 0,018) (obr. 7). Každý osmý pacient z našeho souboru měl zvýšené riziko fraktury krčku kosti stehenní a každý šestý měl zvýšené riziko kompresivní fraktury v oblasti L1–L4 páteře (obr. 8). Výsledky mohou být poněkud zkresleny dalšími faktory přispívajícími k rozvoji osteoporózy, jako např. komorbiditami, kouřením v anamnéze, výskytem osteoporózy v rodině, výchozí BMD, léčbou glukokortikoidy ap. Přesto je zřejmé, že naše vlastní klinické zkušenosti potvrdily četnost a závažnost této problematiky, stejně jako naléhavou potřebu věnovat jí daleko větší pozornost než doposud.
Image 7. Závislost osteopenie a osteoporózy na věku. 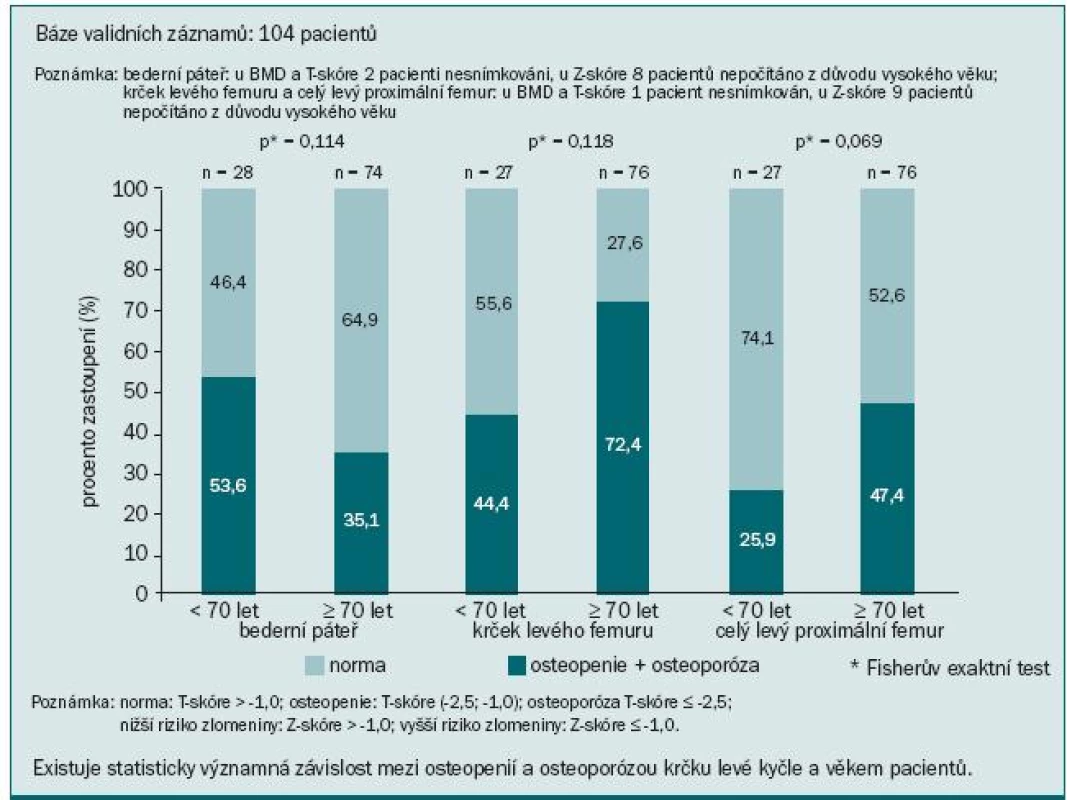
Bylo prokázáno, že fraktury jsou u pacientů s karcinomem prostaty spojené se sníženou kvalitou života a kratším přežitím [11,12]. Z uvedeného vyplývá přínos léčby, jež by dokázala snížit riziko patologických fraktur u těchto pacientů.
Denosumab – nová možnost léčby CTIBL
Od června roku 2010 je schválen první léčivý přípravek pro léčbu úbytku kostní hmoty – plně humánní protilátka denosumab cílená proti RANK ligandu. Působí inhibici RANK ligandu, a napodobuje tak funkci endogenního osteoprotegerinu. Podkladem pro registraci denosumabu byla dvojitě zaslepená studie fáze III s 1 468 pacienty publikovaná v roce 2009 v New England Journal of Medicine, v níž Smith demonstroval účinek denosumabu na kostní denzitu a incidenci vertebrálních fraktur u pacientů s nemetastazujícím karcinomem prostaty užívajícím kontinuální ADT po dobu 6 měsíců.
V jednom rameni byl podáván subkutánně denosumab v dávce 60 mg každých šest měsíců, v druhém rameni dostávali pacienti placebo. Primárním cílem studie bylo stanovení kostní denzity v bederní páteři po dvou letech, sekundárním cílem bylo určení BMD v ostatních lokalizacích a dopad na incidenci vertebrálních fraktur ve 24 měsících.
Během této doby došlo v rameni s denosumabem ke zvýšení BMD v oblasti bederní páteře o 5,6 %, v rameni s placebem došlo naopak k poklesu o 1,0 %. Rozdíl byl vysoce statisticky signifikantní (p < 0,001) od prvního měsíce až do ukončení studie. Obdobně byl v rameni s denosumabem signifikantně vyšší i nárůst kostní denzity v oblasti proximálního femuru, krčku kosti stehenní a distální třetiny radia ve srovnání s kontrolní skupinou. Nemocní, kteří dostávali denosumab, měli během 36 měsíců sníženou incidenci nových vertebrálních fraktur (1,5 % vs 3,9 % placebo) (RR = 0,38; 95% CI, 0,19–0,78; p = 0,006) [13].
Závěr
Hormonální ablace pacientů s karcinomem prostaty vede k velmi častému úbytku kostní hmoty, jenž ohrožuje pacienty patologickými frakturami a následným snížením kvality života a zvýšenou morbiditou a mortalitou. Monoklonální protilátka denosumab zvyšuje kostní denzitu, snižuje riziko vertebrálních fraktur, a představuje tak významný přínos v léčbě těchto pacientů.
prof. MUDr. Dalibor Pacík, CSc.1
as. MUDr. Vítězslav Vít1
prim. MUDr. Jana Katolická, Ph.D.2
RNDr. Jiří Jarkovský, Ph.D.31Urologická klinika LF MU, FN Brno
2Onkologicko-chirurgické oddělení, FN u sv. Anny Brno
3Institut biostatistiky a analýz, MU BrnoUrologická klinika FN Brno
Jihlavská 20, 625 00 Brno
dpacik@fnbrno.cz
Sources
1. ÚZIS ČR, Aktuální informace č. 6/2009.
2. Heidenreich A, Aus G, Bolla M et al. EAU guidelines on prostate cancer. Eur Urol 2008; 53 : 68–80.
3. Loblaw DA, Virgo KS, Nam R et al. Initial hormonal management of androgensensitive metastatic, recurrent, or progressive prostate cancer: 2006 update of an American Society of Clinical Oncology practice guideline. J Clin Oncol 2007; 25 : 1596–6050.
4. Bolla M. Adjuvant hormonal treatment with radiotherapy for locally advanced prostate cancer. Eur Urol 1999; 35 (Suppl 1): S23–S26.
5. Bolla M, Collette L, Blank L et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002; 360 : 103–108.
6. Messing EM, Manola J, Sarosdy M et al. Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N Engl J Med 1999; 341 : 1781–1788.
7. Higano CS. Side effects of androgen deprivation therapy: monitoring and minimizing toxicity. Urology 2003; 61 : 32–38.
8. Maillefert JF, Sibilia J, Michel F et al. Bone mineral density in men treated with synthetic gonadotropin-releasing hormone agonists for prostatic carcinoma. J Urol 1999; 161 : 1219–1222.
9. Cooper C. The crippling consequences of fractures and their impact on quality of life. Am J Med 1997 (suppl); 103 : 12S–17S.
10. Smith MR, Lee WC, Brandman J, Wang Q, Botteman M, Pashos CL. Gonadotropin-releasing hormone agonists and fracture risk: a claims-based cohort study of men with nonmetastatic prostate cancer. J Clin Oncol 2005; 23 : 7897–903.
11. Weinfert K, Li Y, Castel L et al. The impact of skeletal-related events on health-related quality of life of patients with metastatic prostate cancer. Ann Oncol 2002; 13 (suppl 5, abstr 662): 180.
12. Oefelein MG, Ricchiuti V, Conrad W et al. Skeletal fractures negatively correlate with overall survival in men with prostate cancer. J Urol 2002; 168 : 1005–1007.
13. Smith MR, Egerdie B, Toriz NH et al. Denosumab in Men Receiving Androgen-Deprivation Therapy for Prostate Cancer. N Engl J Med 2009; 361 : 745–755.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2011 Issue 1-
All articles in this issue
- Technika odběru štěpu ze sliznice dutiny ústní při rekonstrukci močové trubice: hodnocení pooperačních komplikací a spokojenosti pacientů
- Léčba striktury uretry: dorzální lalok z bukální sliznice – zlatý standard
- Poranění močových cest a genitálu
- Neurourologické vyšetření a léčba
- Stresová močová inkontinence u žen: diagnostika a léčba na základě hodnocení AUA Guidelines
- Perkutánní nefrolitotomie (PNL): přehled užívaných technik a novinek v této oblasti
- Hormonální terapie při léčbě karcinomu prostaty: jak léčit karcinom a neuškodit pacientovi
- Úbytek kostní hmoty u androgen deprivační terapie: naléhavý problém pacientů s karcinomem prostaty – naše zkušenosti
- EAU Guidelines pro léčbu poranění močové trubice
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba striktury uretry: dorzální lalok z bukální sliznice – zlatý standard
- Hormonální terapie při léčbě karcinomu prostaty: jak léčit karcinom a neuškodit pacientovi
- Poranění močových cest a genitálu
- Technika odběru štěpu ze sliznice dutiny ústní při rekonstrukci močové trubice: hodnocení pooperačních komplikací a spokojenosti pacientů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career