-
Medical journals
- Career
IMUNOFLUORESCENČNÍ ANALÝZA PROAPOPTICKÝCH SIGNÁLNÍCH MOLEKUL V BUŇKÁCH LIDSKÉHO MELANOMU PO FOTODYNAMICKÉ TERAPII
Authors: Robert Bajgar 1; Hana Kolářová 1; Svatopluk Binder 1; Adéla Dašková 1,2; Hana Lenobelová 1; Klára Pížová 1,2; Kateřina Tománková 1
Authors‘ workplace: Ústav lékařské biofyziky, Lékařská fakulta, Univerzita Palackého, Olomouc 1; Ústav molekulární a translační medicíny, Lékařská fakulta, Univerzita Palackého, Olomouc 2
Published in: Lékař a technika - Clinician and Technology No. 1, 2013, 43, 15-18
Category: Original research
Overview
Fotodynamická terapie (PDT) je spojená s oxidačním poškozením biomolekul, jejichž funkční porucha je natolik významná, že vede k zániku buňky. Z toho důvodu našla své uplatnění v léčbě řady onkologických, kardiovaskulárních, kožních a očních nemocí. Zánik buněk po PDT probíhá procesem apoptózy anebo nekrózy, které provází aktivace různých biomolekul.
V předkládané práci jsme se pomocí imunofluorescenční metody ELISA zabývali detekcí kaspázy 3 a 9, poly ADP-ribóza polymerázy (PARP) v jejich aktivních formách, a uvolněním proapoptotického proteinu cytochromu c u buněk lidského melanomu, které byly vystaveny fotodynamické terapii.Klíčová slova:
apoptóza, fotodynamická terapie, ELISAÚvod
Fotodynamická terapie (PDT) se v posledních letech stává alternativní metodou v léčbě řady onkologických, kardiovaskulárních, kožních a očních nemocí. Jedná se o nový způsob léčby, který využívá fotodynamicky aktivních látek, tzv. sensitizerů, a účinek světla k tvorbě reaktivních forem kyslíku.
Zánik buněk po PDT probíhá procesem apoptózy nebo nekrózy. Nekróza je forma buněčné smrti, která nastává po výrazném poškození buňky. Původně se myslelo, že nekróza je neřízený proces. Novodobé studie však ukazují, že existuje určitá forma nekrózy, která je geneticky regulována [1]. Apoptóza je však buňkou naprogramovaná řízená smrt, při které nedochází k masivnímu uvolnění buněčného obsahu do okolí a podporuje imunitní systém v boji proti patologicky změněné tkáni. Apoptoticky změněná tkáň uvolňuje do svého okolí velké množství částí buněčných struktur, cytokinů a řadu prozánětlivých faktorů, které pak mohou nastartovat velmi žádanou specifickou imunitní odpověď [2]. I když apoptotický proces může být spuštěn tisíce různými agens, v buňce existuje pouze několik signálních drah, které řídí a vedou buňku k jejímu zániku. Do dnešního dne bylo objeveno 14 specifických proteáz (kaspáz), které za normálních okolností jsou v buňce přítomny v neaktivním stavu a k jejich aktivaci dochází působením pro-apoptotických signálních molekul [3,4,5]. Nádorové buňky jsou charakteristické nejenom svojí nekontrolo-vatelnou proliferací, ale také neschopností anebo sníženou schopností aktivovat apoptózu v důsledku určité poruchy v jejich signálních drahách [6,7]. Tedy komplexní znalost účinku PDT na nádorové buňky, která by zahrnovala také způsob a míru aktivace těchto významných apoptotických proteáz včetně jejich zná-mých aktivátorů, by bezpochyby přispěla ke zvýšení účinnosti této terapie.
V předešlé práci [8] jsme ukázali, že na buňkách lidského melanomu G361 v přítomnosti ftalocyaninového sensitizeru dochází při PDT k významné změně mitochondriálního membránového potenciálu. Z toho důvodu jsme se zaměřili na kaspázy, které jsou přímo anebo nepřímo aktivovány při mitochondriálním poškození, konkrétně na kaspázu 9 a 3, dále proapopto-tický mitochondriální protein cytochrom c, který se uvolňuje do cytozolu buňky, a jaderný protein poly ADP-ribóza polymeráza (PARP). Tato polymeráza je aktivována v eukaryotických buňkách bezprostředně po poškození jejich DNA [9]. U nádorových buněk byla zjištěna dokonce zvýšená její exprese a aktivita [10]. Aktivní kaspáza 3 vstupuje do jádra, kde štěpí PARP, čímž tak zabrání opravě poškozené DNA a buňka následně zmírá.
Ke zjištění aktivních a neaktivních kaspáz, uvolněného (cytozolového) a mitochondriálního cytochromu c, a rozštěpené polymerázy PARP po PTD byla zvolena imunologická metoda ELISA.
Materiál a metody
Fotodynamická terapie
1,5x106 buněk buněčné kultury lidského melanomu G361 bylo kultivováno v přítomnosti ftalocyaninového sensitizeru 50 μM ZnAlPcS2. Za 24 hodin byly buňky osvětleny červeným světlem (660 nm se šířkou píku v polovině maxima 25 nm) po dobu 15 minut s celko-vou vyzářenou hustotou energie 15 J/cm2. Kontrolními vzorky byly buňky kultivováné bez sensitizeru a bez osvětlení, bez sensitizeru a s osvětlením, a se sensitize-rem, ale bez následného osvětlení.
Imunologická analýza ELISA
Primární protilátka proti cytochromu c (myší) byla zakoupena od firmy Invitrogen, ostatní (králičí) pak od firmy Cell Signaling. Jako sekundární protilátky byly zvoleny fluorescenční konjugáty Alexa Fluor 488 nm (protimyší) a Alexa Fluor 594 nm (protikráličí). Imunologická analýza byla provedena po 6 hodinách od ozáření. Pro analýzu kaspáz a PARP byly buňky trypsinizovány (1 %, zastaveno 10% FSA), centrifugovány při 800 ot/min po dobu 5 min, solubilizovány v blokujícím fosfátovém pufru (PBS obsahující 5% normální kozí sérum a 0,3 % Triton X-100) a ponechány blokování ve speciálních 96 jamkových destičkách firmy NUNC (NUNC-Immunoplate maxisorp) při pokojové teplotě. Po 1 hodině byl blokující roztok odstraněn a přidány primární protilátky (1 : 200, v PBS pufru obsahující 1% BSA a 0,3 % Triton X-100). Navázání primárních protilátek probíhalo při 4°C přes noc. Druhý den byly jamky promyty 3x PBS (s 5 minutovou inkubací) a následně po dobu 2 hodin a za pokojové teploty byly vzorky inkubovány se sekun-dárními protilátkami s navázaným fluorochromem (1 : 200, v PBS pufru obsahující 1% BSA a 0,3 % Triton X-100). Na závěr byly jamky opět 3x promyty a změřena fluorescence na readeru Synergy HT.
Analýza cytochromu c v cytozolové a mitochondriální frakci
Adherované buňky byly na ledě mechanicky seškrabány z povrchu Petriho misky a solubilizovány v 750 μl ledově vychlazeného pufru (10 mM Tris-Cl, 0,3 M sacharóza a koktail proteázových inhibitorů (Sigma-Aldrich), pH 7,5). Odstředěním při 10 000 ot/min po dobu 45 minut byla získána cytozolová frakce. Pelet byl pak resuspendován v ledově vychlaze-ném pufru (10 mM Tris-Cl, 150 mM NaCl, koktail proteázových inhibitorů a 1% Triton X-100), sonifikován 3x 20 s na ledě a stočen při 13 000 ot/min po dobu 45 minut. Získaný supernatant byl využit pro analýzu mitochondriální frakce cytochromu c. ELISA cytochromu byla provedena obdobně jako u výše popsané analýzy kaspáz a PARP, jen s tím rozdílem, že nebyl použit detergent. Intenzita fluorescence byla měřena na spektrometru Tecan a přepočtena na jednotku celkové-ho proteinu v analyzovaném vzorku, který byl stanoven pomocí proteinového činidla (BioRad).
Výsledky
Analýza kaspáz a PARP
V případě analýzy kaspáz a PARP byla provedena v metodice řada úprav. Během 6 nezávislých experimentů byl zvýšen počet buněk pro vyšší výtěžek, byly použity speciální adsorpční destičky firmy NUNC, inhibitory proteáz, dále bylo redukováno množství detergentu ve snaze zvýšit adsorpci proteinu na povrchu jamky, prodlouženy časy inkubace a také byla provedena solubilizace pomocí ultrazvuku. Nicméně veškeré snahy nepřispěly k detekci analyzovaných proteinů. Fluorescenční signál byl velice slabý a významně se nelišil od pozadí (nespecificky navázaných sekundárních protilátek, výsledky nejsou prezentovány).
Analýza cytochromu c
Největší množství cytochromu c bylo změřeno v mitochondriální frakci u buněk vystavených účinku PDT. Oproti tomu se množství cytochromu c v cytozolové frakci u těchto buněk významně nelišilo od kontrolních vzorků (obr. 1).
Image 1. Relativní množství cytochromu c stanovené-ho pomocí ELISA metody, vyjádřené jako relativní intenzita fluorescence navázaných sekundárních proti-látek, která je vztažena na jednotku množství všech proteinů v analyzovaných vzorcích – cytozolová frakce (sloupce bez vybarvení), mitochondriální frakce (šedé sloupce). Analýza cytochromu c byla provedena na buňkách G361 vystavených účinku PDT. Zobrazená data reprezentují průměrné hodnoty a směrodatné odchylky ze 3 nezávislých měření. 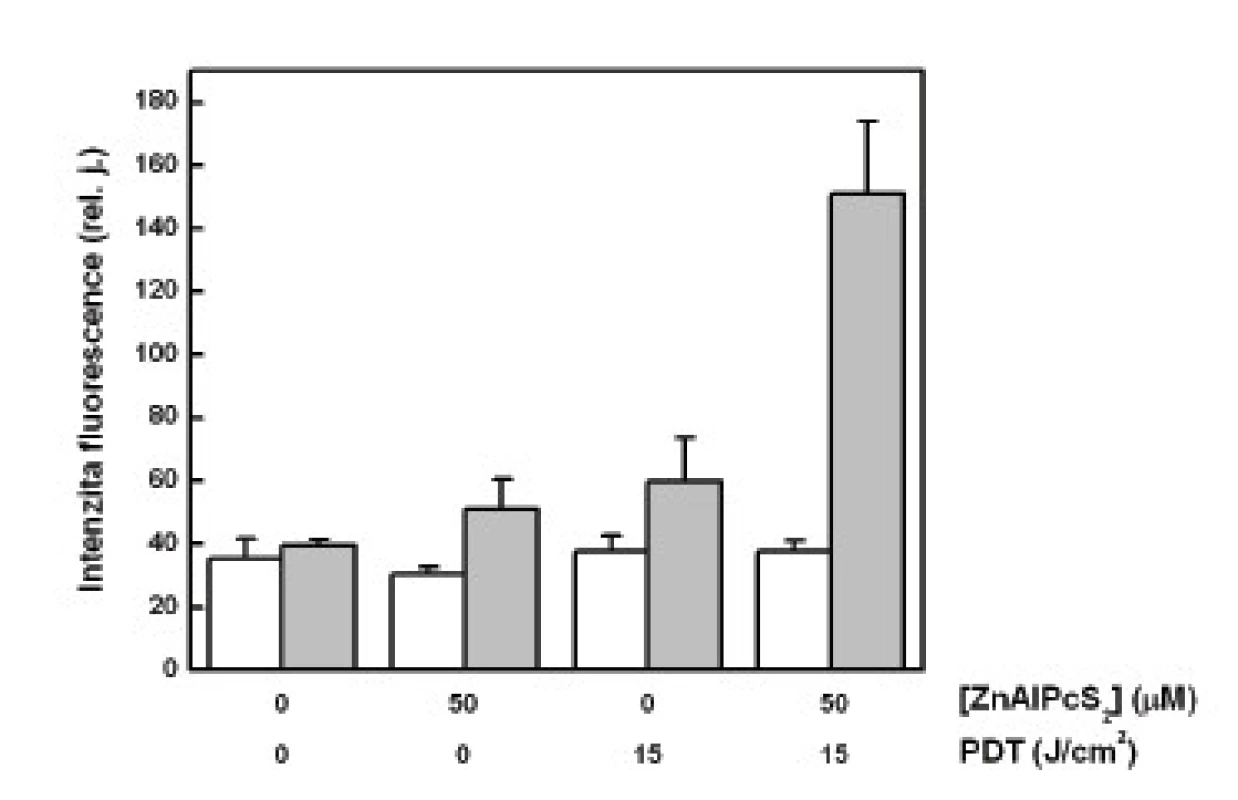
Při určení množství cytochromu c byla intenzita fluorescence navázaných sekundárních protilátek vztažena na jednotku celkového množství proteinů v měřeném vzorku. Při tomto měření jsme zjistili, že nejmenší koncentrace proteinů obsahují právě vzorky mitochondriálních frakcí buněk podrobených PDT (obr. 2). Změřené menší množství proteinů v cytozolové frakci u těchto buněk už nevykazovalo tak markantní rozdíl. Menší množství proteinů, a to jak v cytozolových frakcí, tak i v mitochondriálních frakcí, bylo změřeno u buněk vystavených účinku samotného sensitizeru bez osvětlení a také u buněk osvětlených červeným světlem.
Image 2. Celkové množství proteinů v analyzovaných vzorcích – cytozolová frakce (sloupce bez vybarvení), mitochondriální frakce (šedé sloupce). Analýza protei-nů byla provedena na buňkách G361 vystavených účinku PDT. Zobrazená data reprezentují průměrné hodnoty a směrodatné odchylky ze 3 nezávislých měření. 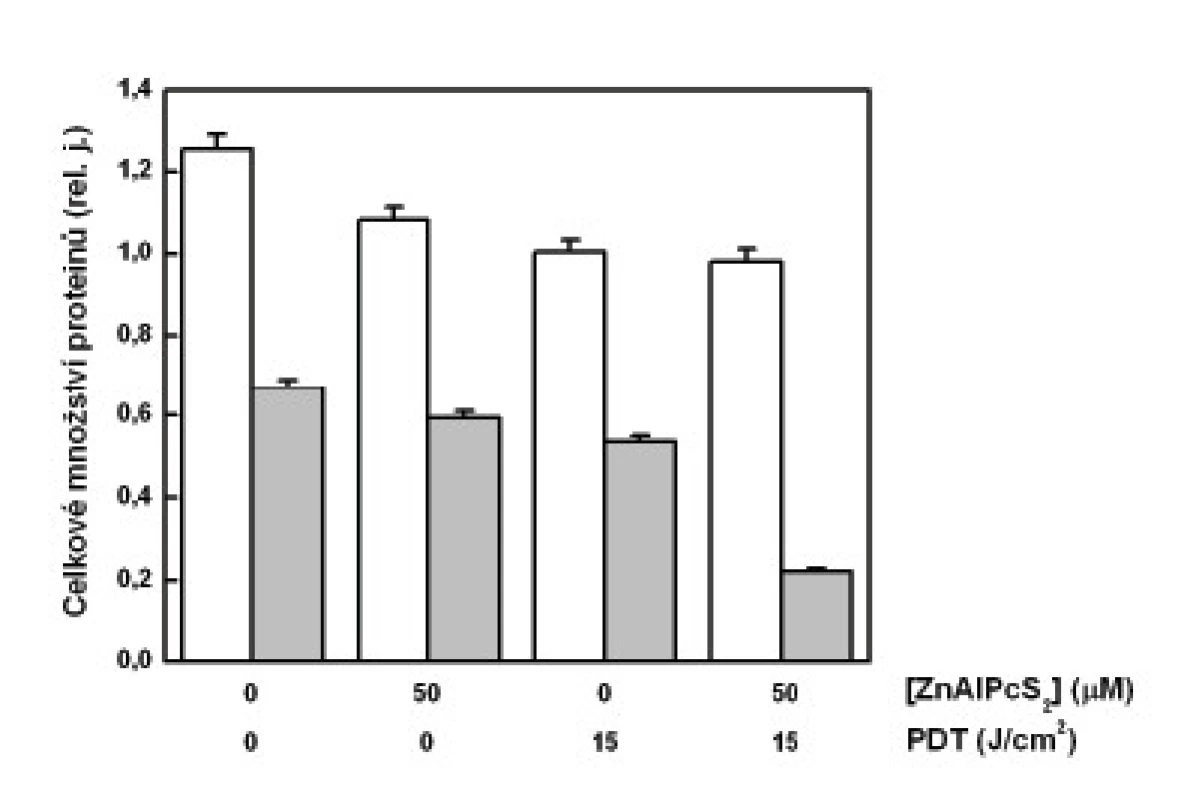
Diskuze
V předložené práci jsme se zabývali imunologickou analýzou určitých významných proapoptotických signálních molekul, které jsou aktivovány v buňkách lidského melanomu po aplikaci fotodynamické terapie. Pro analýzu kaspáz, PARP a cytochromu c bylo vyvinuto několik metod, využívající jak nespecifických, tak specifických značených protilátek [11,12,13]. Pro jejich kvantifikaci se hojně používá Western blot nebo ELISA metody, využívající sekundárních protilátek s navázanou křenovou peroxidázou, která přeměňuje určitý substrát (např. luminol) na luminiscenční produkt. Liu a kolektiv, kteří se zabývali detekcí PARP, dosáhli citlivosti u této metody 30 pg/ml [13]. Saunders a kolektiv při kvantitativním měření kaspázy 3 aktivované staurosporinem u buněk T-lymfoblastové leukémie Jurkat získali přibližně stejných výsledků, pokud použili k její analýze imunoblot a nebo ELISA metodu, využívající streptavidin peroxidázy k detekci biotinylovaných protilátek (6,6 ng resp. 5,3 ng /106 buněk) [14]. K detekci proteinů in situ se používá ELISA, kde na sekundární protilátky je navázán fluorochrom. My jsme použili tuto imunohistochemickou metodu s fluorescenčními sekundárními protilátkami k analýze kaspáz 3 a 9 a jaderného proteinu PARP. Avšak, jak ukazují naše výsledky, zdá se, že tato metoda není vhodná pro kvantitativní analýzu těchto látek in vitro. Na druhou stranu je třeba se zmínit, že u některých nádorových buněk bylo zjištěno, že vykazují sníženou expresy a aktivitu těchto poslů buněčné smrti [15,16] (Khavami, Kumar), jako např. u buněk karcinomu prsu MCF7, které postrádají kaspázu 3 v důsledku genové mutace [17], což snižuje nebo dokonce samo osobě znemožňuje jejich analýzu. Avšak u námi studovaných buněk G361 podobné zjištění nebylo publikováno. Naopak při studiu účinku látek indol-3 octové kyseliny a křenové peroxidázy na buňkách lidského melanomu G361 byl změřen pomocí imunoblotu zvýšený nárůst kaspázy 3 a 9 a také PARP [18].
Při naší analýze cytochromu c jsme očekávali jeho zvýšené uvolnění do cytozolu u buněk podrobených PDT. Bohužel, jak ukazují naše výsledky, relativně nejvíce cytochromu c bylo nalezeno právě v mitochondriích těchto buněk, pokud vyjádříme jeho množství na celkový obsah proteinů ve vzorku. To jsme učinili z důvodu nutné korekce, neboť u kontrolních, volně proliferujích buněk je analyzované množství těchto látek větší než u poškozených buněk vystavených PDT. Otázkou je, zda je tato korekce správná, neboť jiné proteiny mohou být z mitochodrií uvolňovány mnohem snáz než cytochrom c a uměle tak zvýšit jeho relativní množství. To potvrzují i výsledky zobrazené v grafu na obr. č. 2, které zřetelně ukazují na významné poškození mitochondrií po PDT. V mitochondriální frakci těchto buněk byla změřena nejnižší hodnota celkového množství proteinů.
Závěr
Na základě získaných výsledků a přihlédnutím k me-todice usuzujeme, že ELISA, využívající fluorochrom konjugovaný na sekundární protilátky, není vhodnou metodou pro analýzu námi studovaných proapopto-tických proteinů. Jednak pro jejich špatné adsorpční vlastnosti a malé celkové množství. Určitý podíl nese i nízká citlivost přístroje, který byl použit k měření intenzity fluorescenčního signálu. Analýza buněčných pochodů na molekulární úrovni při PDT je nezbytně nutná, avšak se domníváme, že je potřeba zvolit jinou mnohonásobně výnosnější metodu než je ELISA, jako například Western blot. Ta je sice mnohem pracnější, ale postrádá několikanásobné vymývání lehce adherovaných, relativně malých, proteinů, a tím možných ztrát při jejich analýze.
Poděkování
Práce vznikla za podpory výzkumných projektů MSM 6198959216, CZ.1.05/2.1.00/01.0030 a LF 2011/009.
Kontakt na hlavního autora
MUDr. Robert Bajgar, Ph.D.
Ústav lékařské biofyziky
Lékařská fakulta Univerzity Palackého v Olomouci
Hněvotínská 3, 775 15 Olomouc
Sources
[1] Portt, L., Norman, G., Clapp, C., Greenwood, M., Greenwood, M.T.: Anti-apoptosis and Cell Survival: a Review, Biochim. Biophys. Acta, 1831 (2011), pp. 238-259.
[2] Mahoney, J.A., Rosen, A.: Apoptosis and Autoimmunity, Curr. Opin. Immunol., 17 (2005), pp. 583-588.
[3] Salvesen, G.S., Dixit, V.M.: Caspases: Intracellular Signaling by Proteolysis, Cell, 91 (1997), pp. 443-446.
[4] Thornberry, N.A., Lazebnik, Y.: Caspases: Enemies Within, Science, 281 (1998), pp. 1312-1316.
[5] Chowdhury, I., Tharakan, B., Bhat, G.K.: Caspases - an Update, Comp. Biochem. Physiol. B Biochem. Mol. Biol., 151 (2008), pp. 10-27.
[6] Yang, L.: Dysfunction of the Apoptotic Pathway in Cancer Cells. In: Application of Apoptosis to Cancer Treatment (Ed: M. Sluyser), Springer, Dordrecht, 2005, pp. 1–28.
[7] Fischer, U., Janssen, K., Schulze-Osthoff, K.: Cutting-edge Apoptosis-based Therapeutics: a Panacea for Cancer?, BioDrugs, 21 (2007), pp. 273–297.
[8] Krestyn, E., Kolarova, H., Bajgar, R., Tomankova, K.: Photodynamic Properties of ZnTPPS(4), ClAlPcS(2) and ALA in Human Melanoma G361 Cells, Toxicol. In Vitro, 24 (2010), pp. 286-291.
[9] Amé, J.C., Spenlehauer, C., de Murcia, G.: The PARP Superfamily, Bioessays, 26 (2004), pp. 882-893.
[10] Otsuki, Y., Li, Z., Shibata, M.A.: Apoptotic Detection Methods - from Morphology to Gene, Prog. Histochem. Cytochem., 38 (2003), pp. 275-339.
[11] Willingham, M.C.: Cytochemical Methods for the Detection of Apoptosis, J. Histochem. Cytochem., 47 (1999), pp. 1101-1110.
[12] Huerta, S., Goulet, E.J., Huerta-Yepez, S., Livingston, E.H.: Screening and Detection of Apoptosis, J. Surg. Res., 139 (2007), pp. 143-156.
[13] Liu, X., Palma, J., Kinders, R., Shi, Y., Donawho, C., Ellis, P.A., Rodriguez, L.E., Colon-Lopez, M., Saltarelli, M,, LeBlond, D., Lin, C.T., Frost, D.J., Luo, Y., Giranda, V.L.: An Enzyme-linked Immunosorbent Poly(ADP-ribose) Polymerase Biomarker Assay for Clinical Trials of PARP Inhibitors, Anal. Biochem., 381 (2008), pp. 240-247.
[14] Saunders, P.A., Cooper, J.A., Roodell, M.M., Schroeder, D.A., Borchert, C.J., Isaacson, A.L., Schendel, M.J., Godfrey, K.G., Cahill, D.R., Walz, A.M., Loegering, R.T., Gaylord, H., Woyno, I.J., Kaluyzhny, A.E., Krzyzek, R.A., Mortari, F., Tsang, M., Roff, C.F.: Quantification of Active Caspase 3 in Apoptotic Cells, Anal. Biochem., 284 (2000), pp. 114-124.
[15] Ghavami, S., Hashemi, M., Ande, S.R., Yeganeh, B., Xiao, W., Eshraghi, M., Bus, C.J., Kadkhoda, K., Wiechec, E., Halayko, A.J., Los, M.: Apoptosis and Cancer: Mutations Within Caspase Genes, J. Med. Genet., 46 (2009), pp. 497–510.
[16] Kumar, S.: Caspase 2 in Apoptosis, the DNA Damage Response and Tumour Suppression: Enigma No More?, Nat. Rev. Cancor, 9 (2009), pp. 897–903.
[17] Janicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G.: Caspase-3 is Required for DNA Fragmentation and Morphological Changes Associated with Apoptosis, J. Biol. Chem., 273 (1998), pp. 9357–9360.
[18] Kim, D.S., Jeon, S.E., Park, K.C.: Oxidation of Indole-3-acetic Acid by Horseradish Peroxidase Induces Apoptosis in G361 Human Melanoma Cells, Cell Signal., 16 (2004), pp. 81-88.
Labels
Biomedicine
Article was published inThe Clinician and Technology Journal

2013 Issue 1-
All articles in this issue
- MOŽNOSTI VYUŽITÍ ANALÝZY PŘEŽÍVÁNÍ V BIOMEDICÍNĚ A TECHNICE
- SROVNÁNÍ RŮZNÝCH PŘÍSTUPŮ HRANOVÉ DETEKCE KONČETINOVÝCH TEPEN V PODÉLNÉM ŘEZU ULTRAZVUKOVÉHO OBRAZU
- IMUNOFLUORESCENČNÍ ANALÝZA PROAPOPTICKÝCH SIGNÁLNÍCH MOLEKUL V BUŇKÁCH LIDSKÉHO MELANOMU PO FOTODYNAMICKÉ TERAPII
- Fototoxický vliv porfyrinových sensitizerů a viditelného záření na gram-pozitivní methicilin-rezistentní kmen S. aureus
- 13C-methacetinový dechový test u pacientů s jaterní cirhózou a dekompenzovaným srdečním selháním
- Testing of automatized rehabilitation device designed for elderly by industrial robot
- Specific behaviour of the blood sedimentation processes examined by the electrochemical impedance microsensor
- Development of biomedical information systems: MSL concept of e-learning – pilot study results
- The Clinician and Technology Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- MOŽNOSTI VYUŽITÍ ANALÝZY PŘEŽÍVÁNÍ V BIOMEDICÍNĚ A TECHNICE
- 13C-methacetinový dechový test u pacientů s jaterní cirhózou a dekompenzovaným srdečním selháním
- Fototoxický vliv porfyrinových sensitizerů a viditelného záření na gram-pozitivní methicilin-rezistentní kmen S. aureus
- SROVNÁNÍ RŮZNÝCH PŘÍSTUPŮ HRANOVÉ DETEKCE KONČETINOVÝCH TEPEN V PODÉLNÉM ŘEZU ULTRAZVUKOVÉHO OBRAZU
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

