-
Medical journals
- Career
Transarteriální chemoembolizace pomocí „drug eluting beads“ (TACE DEB) u nemocných s radikálně neodstranitelným hepatocelulárním karcinomem (HCC)
Authors: V. Třeška; P. Duras; H. Mírka; T. Skalický; O. Vyčítal; J. Brůha; J. Opatrný; V. Liška; A. Sutnar
Authors‘ workplace: Radiodiagnostická klinika FN a LFUK v Plzni, přednosta: prof. MUDr. B. Kreuzberg, CSc. ; Chirurgická klinika FN a LFUK v Plzni, přednosta: Prof. MUDr. V. Třeška, DrSc.
Published in: Rozhl. Chir., 2014, roč. 93, č. 2, s. 63-69.
Category: Original articles
Práce podpořena Výzkumným záměrem P 36, UK v Praze.
Overview
Úvod:
Incidence HCC celosvětově stoupá. Resekce a transplantace jater jsou radikálními léčebnými metodami, které lze však využít jen u 25 % nemocných. TACE je pak metodou paliativní léčebné volby u nemocných primárně chirurgicky neřešitelných.Materiál a metoda:
35 nemocných (27 mužů a 8 žen) průměrného věku 73,4±7,2 roku s HCC o kumulativním průměru 83,8±36,3 mm bylo léčeno TACE DEB s doxorubicinem. 28krát se jednalo o solitární, 7krát o mnohočetný HCC. 31 nemocných bylo klasifikováno jako Child A, 4 jako Child B. Hodnotili jsme celkové, tumor specifické a bezpříznakové přežívání nemocných jeden rok po výkonu a jejich korelaci s věkem, pohlavím, počtem a celkovým průměrem nádorových ložisek a komplikací výkonu.Výsledky:
30denní mortalita, morbidita byla 0, resp. 8,6 %. U 25,7 % nemocných se objevil po výkonu tzv. postembolizační syndrom. Opakované TACE jsme provedli u 14 (40 %) nemocných z důvodu progrese HCC. U dvou nemocných (5,7 %) jsme po TACE provedli resekci jater. Dle RECIST kritérií nedošlo u žádného nemocného ke kompletní odpovědi po TACE, k částečné odpovědi došlo u 17,1 % a stabilní onemocnění bylo u 37,1 % nemocných. U 25,7 % nemocných došlo k progresi HCC. Jednoroční celkové přežití, tumor specifické a bezpříznakové přežití po TACE bylo 69,7 %, resp. 88,9 a 49,3 % nemocných. Lepší přežívání (p<0,02) bylo u osob mladších 75 let v porovnání se staršími nemocnými. U ostatních sledovaných parametrů jsme nenalezli statistické rozdíly. Horší bezpříznakové přežívání (p<0,01) měli nemocní s komplikacemi po výkonu.Závěr:
TACE je metodou paliativní léčebné volby u nemocných s HCC radikálně chirurgicky neřešitelným. V prvním roce po TACE nedochází až u poloviny nemocných k progresi HCC. Lepší výsledky jsou dosaženy u nemocných mladších věkových skupin a tam, kde nejsou komplikace výkonu.Klíčová slova:
hepatocelulární karcinom – TACE DEB – výsledky léčbyÚvod
HCC je jednou z nejčastějších malignit. Celosvětově je na 5. místě ve výskytu u mužů a 8. místě u žen. Ročně je diagnostikováno více než 660 000 nových případů HCC. Bohužel jen 25 % nemocných s diagnostikovaným HCC je vhodných k radikální léčbě, tj. resekci nebo transplantaci jater. TACE jako paliativní léčba je metodou volby u radikálně neřešitelných HCC. TACE způsobuje částečnou nekrózu nádoru, umožňuje udržet nádor řadu měsíců pod kontrolou a zlepšuje přežívání nemocných v porovnání s jinými paliativními postupy [1,2].
Materiál a matodika
TACE DEB jsme na Chirurgické klinice FN a LFUK v Plzni začali ve spolupráci s radiology provádět od roku 2008. Indikací byli nemocní, u kterých vzhledem k pokročilosti nádoru, významné polymorbiditě nebo k lokalizaci HCC nebylo možné provést jaterní resekci nebo transplantaci jater. Od 1. 1. 2008 do 30. 5. 2013 jsme tak léčili 35 nemocných, z toho 27 mužů a 8 žen průměrného věku 73,4±7,2 roku. 28krát se jednalo o solitární, 7krát o mnohočetný HCC. Celkový průměr HCC byl 83,8 ± 36,3 mm. 31 nemocných bylo klasifikováno jako Child A, 4 jako Child B, kde TACE byla užita jako metoda volby z důvodu špatného celkového stavu nemocných ve většině případů v důsledku kardiálních či plicních onemocnění (Tab. 1).
Table 1. Soubor nemocných s HCC léčených TACE DEB (2008-2013) Tab. 1: Group of patients with HCC treated with TACE DEB (2008-2013) 
Ve stručnosti uvádíme metodiku TACE, kterou používáme na našem pracovišti. Využíváme metodiku TACE DEB, což je transarteriální chemoembolizace pomocí částic uvolňujících léčivo (drug eluting beads ). Jedná se o hydrogelové mikrosféry na bázi polyvinyl alkoholu schopné navázat chemoterapeutikum v kontrolované dávce. Částice jsou aplikovány mikrokatétrem do cílové oblasti, kde dochází k protrahovanému uvolnění léčiva do okolní nádorové tkáně [3,4] za současné ischemizace ložiska nádoru. Je tak maximalizován lokální cytotoxický efekt a zároveň výrazně omezena systémová toxicita. Jako chemoterapeutikum používáme doxorubicin v celkové dávce do 150 mg [5,6].
Transarteriální selektivní či superselektivní chemoembolizaci provádíme punkčním přístupem z třísla nebo z levého podpaží. Po místním znecitlivění je provedena punkce arteria femoralis communis, resp. arteria brachialis, zavedeno 5F zaváděcí pouzdro. Sondáž přívodních nutritivních větví je provedena diagnostickým katétrem, nejčastěji typu Cobra 5F, který zároveň slouží jako vodicí katétr pro selektivní zavedení mikrokatétru. K chemoembolizaci používáme mikrosféry DC Bead™ (Biocompatibles UK, Surrey, UK), které jsou dostupné v rozmezí velikostí 70–900 μm, nejčastěji jsou pro výkon kombinovány velikosti 100–300 μm a 300–500 μm, u lézí s jemnější vaskularizací používáme mikrosféry o velikosti 70–150 μm. Vazebná kapacita částic DC Bead je částečně závislá na jejich velikosti, pro doxorubicin platí hodnota 25 mg/ml do velikosti 500 μm, větší částice jsou schopné navázat 37,5 mg/ml, teoreticky až 45 mg/ml. Částice pak aplikujeme selektivně do oblasti nádoru (Obr. 1, 2). Po aplikaci je žádoucí, aby došlo k vyplnění nádorové vaskularizace se zřetelnou redukcí toku až zástavou toku krve v přívodné tepně. Kontrolní vyšetření výpočetní tomografií provádíme s odstupem 4–6 týdnů po TACE a dále ve zvyklých intervalech při dispenzarizaci nemocných (Obr. 3). Efekt TACE hodnotíme pomocí kritérií RECIST 1.1 (Response Evaluation Criteria in Solid Tumors) – 7.
Image 1. Nepravidelné expanzivní ložisko v pravém jaterním laloku – magnetická rezonance (T1). Fig. 1: Transverse contrast-enhanced fat-suppressed T1- weighted gradient-echo image in the venous phase shows irregular expansive nodule in the right liver lobe. 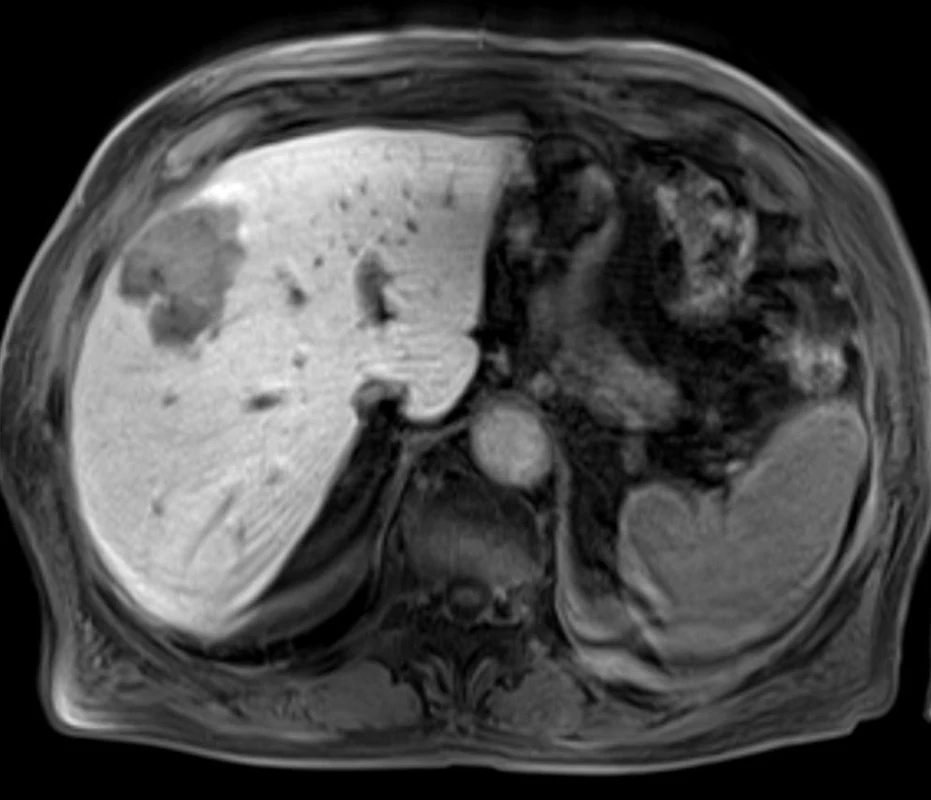
Image 2. Superselektivní nástřik nutritivní tepénky mikrokatétrem před chemoembolizací – digitální subtrakční angiografie. Fig. 2: Super-selective angiography of the nodule-nutritive branch by means of a microcatheter before chemoembolization. 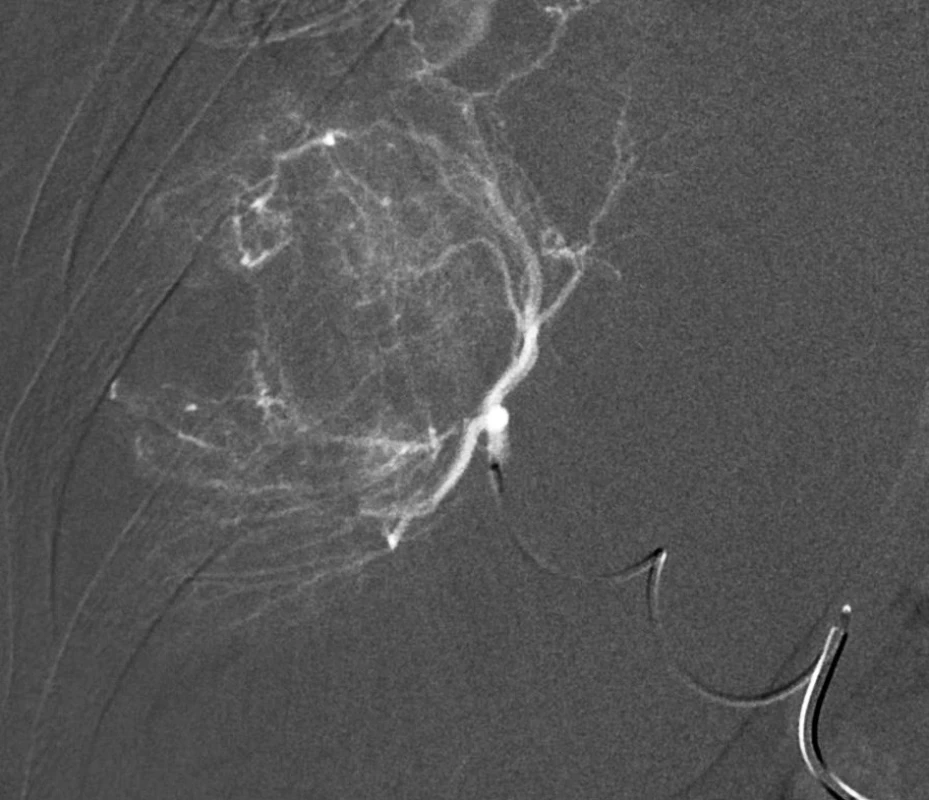
Image 3. Výpočetní tomografie za 11 měsíců po TACE DEB, nekróza ložiska, redukce objemu. Fig. 3: Computed tomography image 11months past TACEDEB, nodule necrosis, reduction of volume. 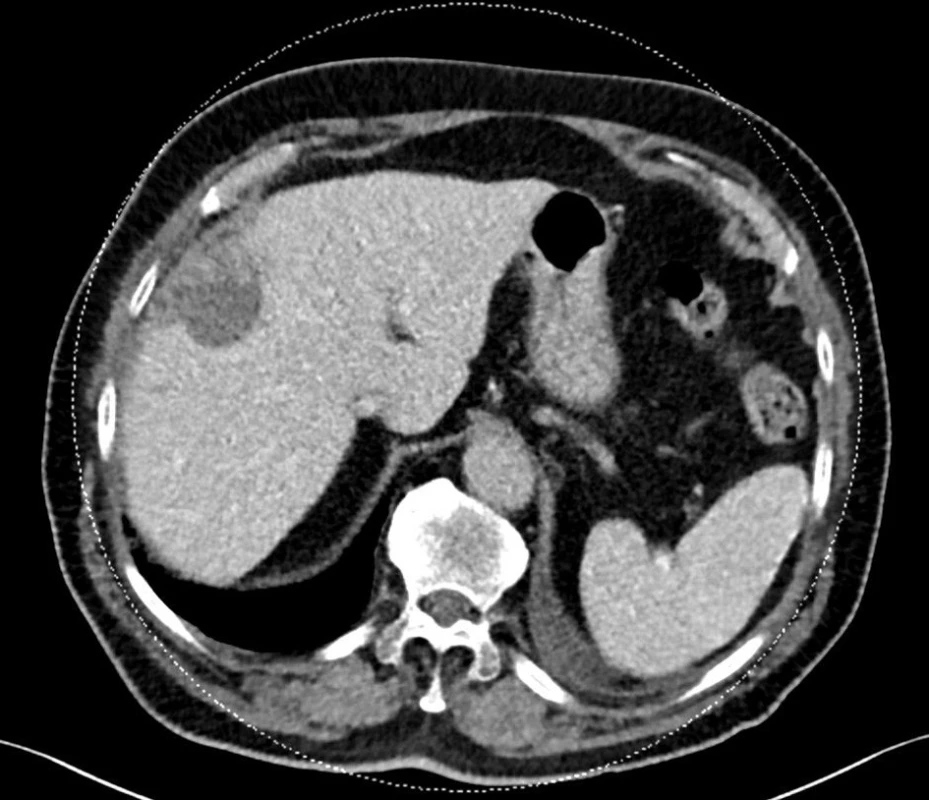
V celém souboru nemocných jsme hodnotili celkové – OS (overal survival), tumor specifické – DSS (disease specific survival) a bezpříznakové – DFI (disease free interval) přežívání a jejich korelaci s věkem, pohlavím, počtem a celkovým průměrem nádorových ložisek a komplikací výkonu.
Statistická analýza byla provedena s užitím softwaru SAS 9.3 (SAS Institute Inc., Cary, NC, USA). Pro měřené parametry v celém souboru a v jednotlivých skupinách a podskupinách byly počítány základní statistické údaje jako průměr, směrodatná odchylka, rozptyl, medián, mezikvartilové rozpětí, minimum, maximum. U kategorických proměnných byly zkoumány jejich frekvence. Analýza přežití (overall survival, disease specific survival) a doby do progrese onemocnění (DFI) byla zpracována pomocí tzv. Kaplan-Meier křivek přežití. Rozdíl jednotlivých křivek přežití v závislosti na zkoumaných faktorech byl testován pomocí tzv. Log-rank testu a Wilcoxon testu. Pomocí Coxova regresního modelu jsme kvantifikovali rizika událostí (tzv. Hazard Ratio +95 % CI) jednotlivých faktorů ve vztahu ke zkoumaným událostem. Statistická významnost byla stanovena na hladině α = 5 %.
Výsledky
Do 30 dní po výkonu nezemřel žádný nemocný. Sedm nemocných zemřelo v intervalu 7–12 měsíců po TACE na progresi HCC. Výkon se komplikoval u 3 nemocných (8,6 %) tvorbou abscesu v játrech (řešeno drenáží pod CT kontrolou) a embolizací do plicnice. U 9 nemocných (25,7 %) se projevil tzv. postembolizační syndrom charakterizovaný sub - až febriliemi, bolestí v nadbřišku, který po několika dnech symptomatické léčby vymizel. U dvou nemocných (5,7 %) došlo k významné redukci nádorové masy po TACE DEB a mohli jsme provést radikální resekci jater ve smyslu segmentektomie S8 a u druhého nemocného po embolizaci pravé větve portální žíly pak pravostrannou hepatektomii. U 14 (40 %) nemocných jsme provedli opakovaně (nejvíce 3krát) TACE DEB z důvodů velikosti a počtu ložisek v jaterním parenchymu a dále pro progresi ve smyslu nových ložisek HCC.
Odpověď HCC hodnocená dle RECIST 1.1 kritérií po 6 měsících od TACE (u nemocných s TACE v roce 2013 pak po 3 měsících) byla: k CR (kompletní odpověď) nedošlo u žádného nemocného, k PR (částečná odpověď) byla u 6 (17,1 %), stabilní onemocnění (SD) bylo u 13 (37,1 %) a k progresi onemocnění (PD) došlo u 9 (25,7 %) nemocných. Z různých důvodů jsme nemohli hodnotit sedm nemocných (tři byli krátce po výkonu, čtyři se nedostavili ke kontrolám) – Tab. 2.
Table 2. Léčebná odpověď dle RECIST 1.1 kritérií Tab. 2: Treatment response – RECIST 1.1 criteria 
Jeden rok po TACE přežívá 69,7 % nemocných (Obr. 4). Z hlediska přežívání jsme nenalezli rozdíly ve věku, pohlaví, počtu a průměru ošetřených ložisek, komplikace výkonu. Jednoroční tumor specifické přežití (DSS) bylo 88,9 % (Obr. 5). Pokud jsme hodnotili DSS ve vztahu k věku nemocných, pak významně lepší (p<0,02) bylo přežívání u osob mladších 75 let v porovnání se staršími nemocnými (Obr. 6). U ostatních sledovaných parametrů jsme nenalezli statistické rozdíly. Jednoroční bezpříznakové přežívání (DFI) bylo 49,3 % (Obr. 7). Horší DFI (p<0,01) měli nemocní s komplikacemi po výkonu (počítáno včetně postembolizačního syndromu) – Obr. 8.
Image 4. Celkové přežívání nemocných Fig. 4: Overal survival 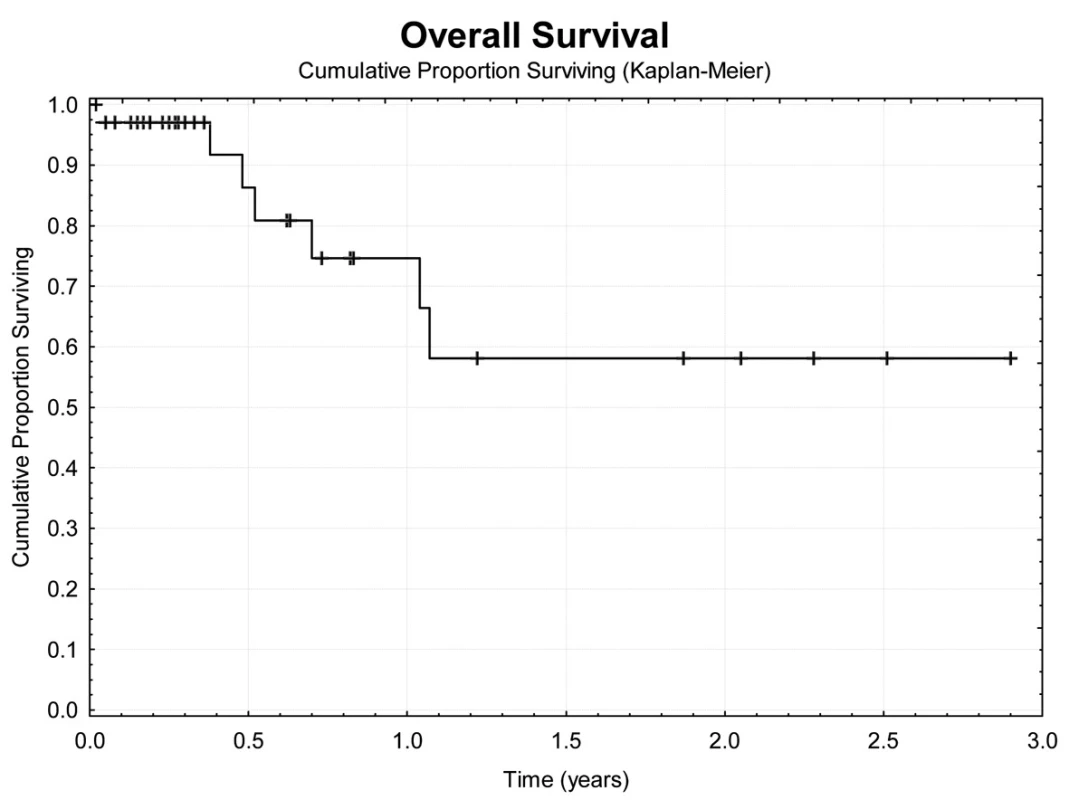
Image 5. Tumor specifické přežívání nemocných Fig. 5: Tumor specific survival 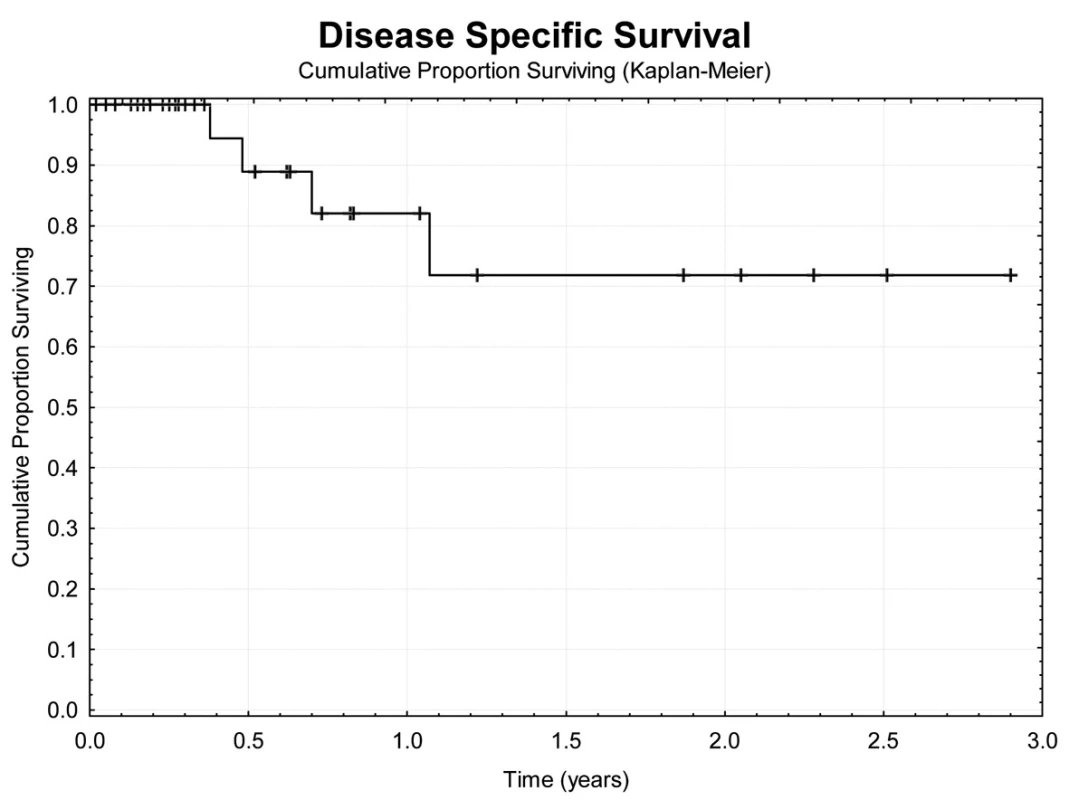
Image 6. Tumor specifické přežívání nemocných v závislosti na věku Fig. 6: Age dependent tumor specific survival 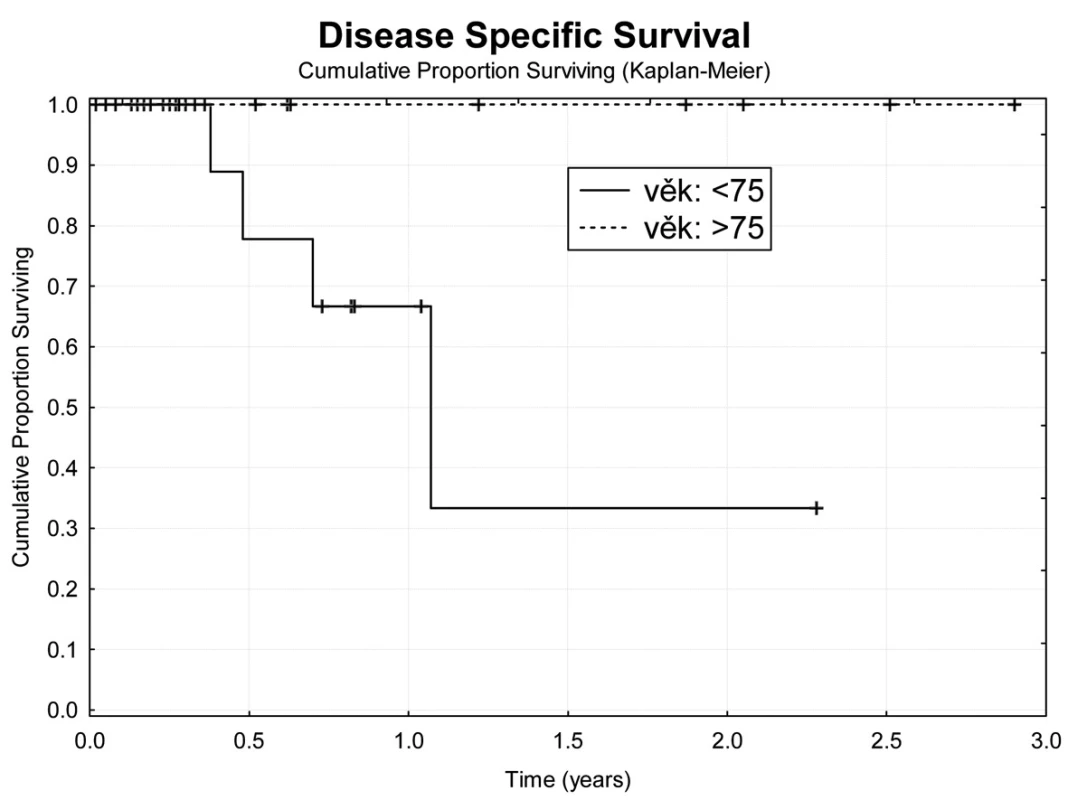
Image 7. Bezpříznakové přežívání nemocných Fig. 7: Disease free survival 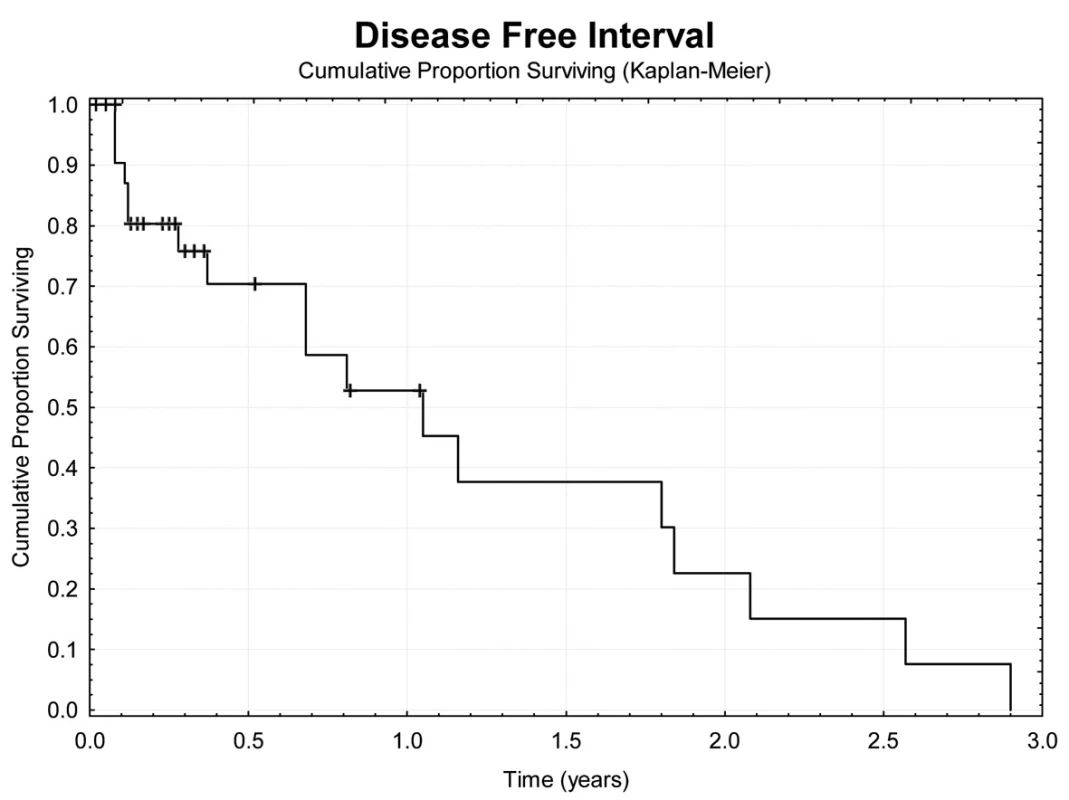
Image 8. Bezpříznakové přežívání nemocných s komplikacemi TACE Fig. 8: Disease free survival in patients with TACE complications 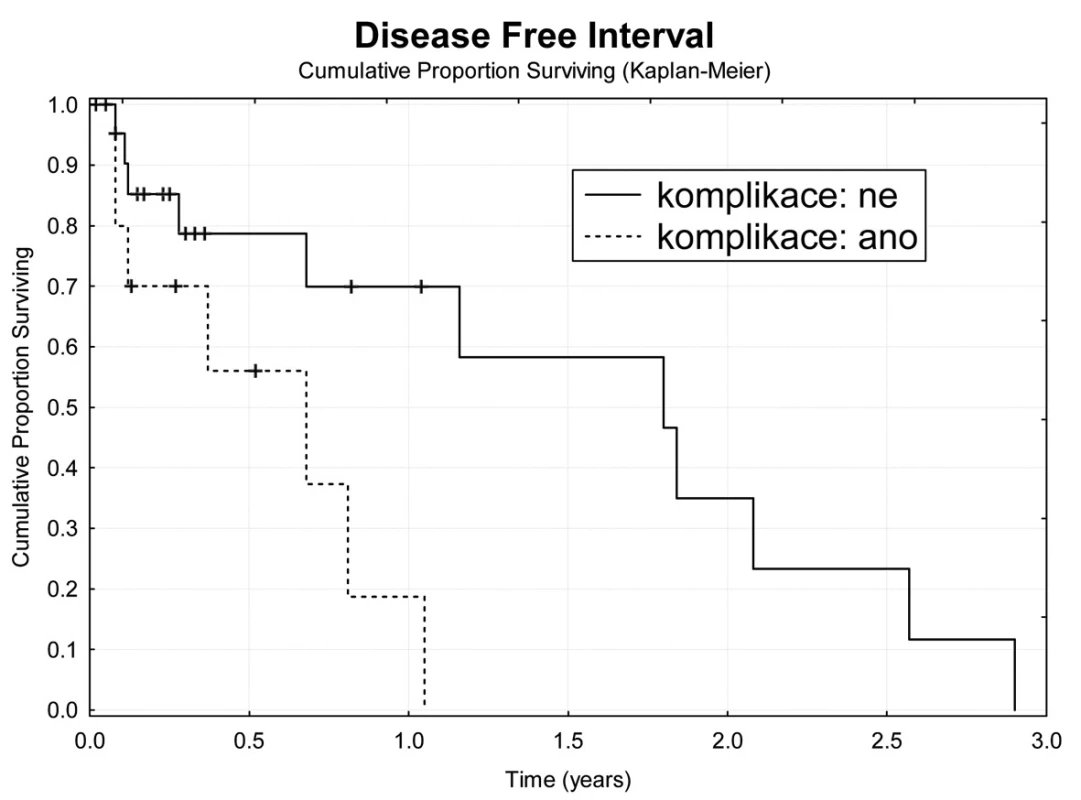
Diskuze
HCC je jedním z nejčastějších nádorů v populaci s vysokou mortalitou. Bohužel většina nádorů je diagnostikována pozdě v době, kdy nelze použít optimální léčbu, jakou jsou radikální chirurgická resekce nebo transplantace jater.
TACE je metodou volby u nemocných s radikálně neodstranitelným HCC. V posledních letech byla ověřena v řadě studií jako významná metoda paliativní léčebné volby u výše uvedených nemocných [8,9,10]. Pravděpodobně největší studií TACE doposud publikovanou je studie japonských autorů [11] zabývající se využitím TACE u malých nádorů (<5 cm). Nicméně studií, které hodnotí TACE u nádorů velkých (>5 cm), je poměrně málo [12,13]. Touto problematikou se zabývá i naše studie, kde průměrná velikost HCC byla 8,4 cm.
TACE je metoda, která využívá přímého působení chemoterapeutika v místě nádoru s kombinací ischemie nádoru v důsledku embolizace jeho arteriálního zásobení. Klasický způsob TACE, který používá aplikaci chemoterapeutika do nádoru a embolizaci přívodných tepen lipiodolem, je zatížen větším systémovým efektem chemoterapeutika. Z tohoto důvodu byla vyvinuta nová metoda (TACE DEB), která využívá postupného a trvalého uvolňování chemoterapeutika (doxorubicinu) do nádoru z mikrosfér, což minimalizuje jeho systémový efekt. Navíc mikrosféry blokují arteriální zásobení HCC a tím vedou rovněž k jeho ischemii a následné nekróze.
Vedle základní indikace TACE, kterou jsou radikálně inoperabilní nádory, se stále více diskutuje o využití TACE u primárně operabilních malých ložisek (<2 cm v průměru), kde někteří autoři uvádějí srovnatelné výsledky s operačním řešením [14,15]. Naše stanovisko k tomuto postupu je zatím zdrženlivé a dáváme přednost radikálnímu postupu včetně využití termoablačních metod. TACE je indikována dále jako „downstaging“ či „downsizing“ metoda u primárně inoperabilních tumorů k docílení jejich operability, nebo tzv. Milánských kritérií k dosažení transplantability nemocného. V naší sestavě jsme mohli po TACE radikálně resekovat HCC u dvou nemocných.
TACE je metoda bezpečná. 30denní mortalita je nižší než 0,5 %, v našem souboru nezemřel žádný nemocný. Jedno a dvouleté přežívání se uvádí mezi 60–67 %, resp. 30–35 %, což odpovídá i našim výsledkům. Nicméně je třeba si uvědomit, že většina prací neodlišuje malá solitární ložiska, kde efekt TACE je největší, od velkých inoperabilních a často vícečetných ložisek, kde výsledky jsou samozřejmě horší. TACE je tolerována nemocnými v bezprostředním období po výkonu celkem dobře. U některých nemocných je třeba symptomatické léčby tzv. postembolizačního syndromu, kdy příznaky spontánně ustupují do 5–7 dní po výkonu. V některých případech je nutné opakování TACE z hlediska velikosti či progrese HCC a u těchto nemocných se postembolizační syndrom vyskytuje v podstatně menším procentu, než je tomu u primárních výkonů. Jen výjimečně jsou uváděny případy selhání jater a ledvin, což pravděpodobně souviselo s dávkou a typem použitého chemoterapeutika [16].
Významná odpověď HCC hodnocená RECIST kritérii přichází u 17–62 % případů, zatímco kompletní odpověď jen u 0–5 %. V našem souboru jsme nedosáhli u žádného nemocného kompletní odpovědi, nicméně k parciální odpovědi došlo u 17,1 % nemocných. Za významnou považujeme skutečnost, že do 6 měsíců od TACE nedošlo k progresi HCC u plných 37 % nemocných. Obecně se uvádí, že k častější rekurenci HCC po TACE dochází u nemocných ve stadiu Child B a dále u vícečetných ložisek v porovnání se solitárními ložisky HCC. Souvisí to pravděpodobně s obecně horší prognózou HCC u nemocných s pokročilejším stadiem jaterního onemocnění. Znamená to, že TACE není v žádném případě radikální metodou, a zde je na místě do jisté míry kritika výše uvedených prací, které srovnávají efekt TACE s radikální chirurgickou léčbou u malých HCC.
Lepší jednoroční výsledky dosažené v naší studii u nemocných mladších 75 let a nemocných bez komplikace výkonu je obtížné hodnotit a zobecňovat vzhledem k nedostatkům této studie, kterým jsou poměrně malý počet nemocných, retrospektivní analýza a krátká doba sledování. Obecně se dá říci, že hlavní indikací nemocných k TACE byla jejich polymorbidita, která vylučovala provedení resekčního výkonu. Ta byla pravděpodobně i příčinou horších výsledků u nastalých komplikací výkonu a u nemocných vyššího věku.
V poslední době se diskutuje o možnostech zvýšení efektu HCC pomocí kombinace TACE radiofrekvenční ablací (RFA) nebo aplikací koncentrovaného etanolu (PEI – percutaneous ethanol injection) do embolizovaného ložiska [17,18]. Dlouhodobé celkové a bezpříznakové přežívání nemocných při kombinaci TACE s RFA je lepší u nemocných s průměrem HCC větším 3 cm a s vícečetnými ložisky HCC v porovnání se samotnou TACE nebo RFA. Pokud jde o malá (<3 cm) ložiska HCC, pak není rozdílu při použití kombinace metod oproti samostatným metodám. Z hlediska posloupnosti obou léčebných metod je lepší nejprve aplikovat TACE a následně RFA vzhledem k omezení tzv. „cooling“ efektu proudící krve v místech aplikace RFA, čímž se zvyšuje terapeutický efekt RFA. Dále po TACE dochází k edému a tvorbě zánětu v ložisku HCC v důsledku ischemie, což dále zvyšuje termoablační efekt RFA. Kombinace TACE s PEI dává lepší dlouhodobé výsledky v porovnání s monoterapií opět u velkých HCC, kde nedostatečný efekt TACE ve smyslu tvorby nekrózy a nedostatečná difuze koncentrovaného etanolu v nádoru a jeho vymývání proudem arteriální krve jsou do jisté míry redukovány kombinací obou metod. Obě metody se používají také jako tzv. „bridging“ metody u nemocných s HCC na čekací listině k transplantaci jater. Dále se zkouší využití kombinace TACE s radioterapií nebo HIFU (high – intensity focused ultrasound), avšak výsledky těchto kombinací se velmi různí. Výsledky II. fáze studie SPACE [19] ukazují, že také kombinace sorafenibu s TACE může oddálit časnou progresi onemocnění po TACE. V poslední době se zkouší podávání radioizotopů (Yttrium 90) vázaných na mikrosférách k brachyterapii pomocí tzv. transarteriální radioembolizace (TARE), nicméně na výsledky této metody si budeme muset ještě počkat.
Závěr
TACE DEB je nepochybně metodou paliativní léčebné volby u nemocných, kde nelze využít radikální léčebné metody, kterými jsou resekce a transplantace jater. Lepších dlouhodobých výsledků jsme dosáhli u nemocných mladších 75 let a dále tam, kde nenastaly závažné komplikace výkonu. I přes kvalitní dlouhodobé výsledky TACE DEB u nemocných se solitárním HCC malého průměru uváděné v literatuře se domníváme, že TACE DEB nemá takový léčebný potenciál jako radikální chirurgické nebo termoablační metody, které proto doporučujeme využít i u této skupiny nemocných.
Prof. MUDr. Vladislav Třeška, DrSc.
U Českého dvora 11
326 00 Plzeň
e-mail: treska@fnplzen.cz
Sources
1. Lewis AL, Gonzales V, Lloyd AW, et al. DC Bead™. In vitro characterization of a drug-delivery device for transarterial chemoembolization. J VascIntervRadiol 2006;17 : 335–342.
2. Hong K, Khwaja A, Liapi E, et al. New intra-arterial drug delivery system for the treatment of liver cancer: Pre-clinical assessment in a rabbit model of liver cancer. Clinical Cancer Research 2006;12 : 2563–2567.
3. Taylor RR, Tang Y, Gonzales V, et al. Irinotecan drug eluting beads for use in chemo-embolization: In Vitro and In vivo evaluation of drug release properties. European Journal of Pharmaceutical Sciences 2007;30 : 7–14.
4. Guan YS, He Q, Wang MQ. Transcatheter arterial chemoembolization: History for more than 30 years.ISRN Gastroenterology 2012;2 : 1–8.
5. Sato Y, Watanabe H, Sone M, Onaya H, Sakamoto N, et al. Tumor response evaluation criteria for HCC (hepatocellular carcinoma) treated using TACE (transcatheter arterial chemoembolization): RECIST (response evaluation criteria in solid tumors) version 1.1 and mRECIST (modified RECIST): JIVROSG-0602. Upsala J Med Sci 2013;118 : 16–22.
6. Kalva PS, Igbal SI, Yeddula K, Blaszkowsky LS, Akbar A, et al. Transarterial chemoembolization with Doxorubicin –eluting microspheres for inoperable hepatocellular carcinoma. Gastrointest Cancer Res 2011;4 : 2–8.
7. Hsu KF, Chu CH, Chan DC. Superselective transarterial chemoembolization vs hepatic resection for resectable early-stage hepatocellular carcinoma in patients with Child-Pugh class a liver function. Eur J Radiol 2011;81 : 466–471.
8. Chapman WC, Doyle MBM, Stuart JE. Outcomes of neoadjuvant transarterial chemoembolization to downstage hepatocellular carcinoma before liver transplantation. Ann Surg 2008;4;617–624.
9. Takayasu K, Arii S, Ikai I, Omata M, Okita K, et al. Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients. Gastroenterology 2006;131 : 461–9.
10. Miyayama S, Yamashiro M, Okuda M, Yoshie Y, Sugimori N, et al. Chemoembolisation for the treatment of large Hepatocellular carcinoma. J Vasc Interv Radiol 2010;21 : 1226–34.
11. Lo CM, Ngan H, Tso WK, Liu CL, Lam CM, et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 2002;35 : 1164–71.
12. Paul SB, Gamanagatti S, Sreenivas V, Chyndrashekhara SH, Mukund A, et al. Trans-arterial chemoembolization (TACE) in patients with unresectable hepatocellular carcinoma: Experience from a tertiary care centre in India. Indian J Radiol Imaging 2011;21 : 113–120.
13. Malagari K, Pomoni M, Sotirchos VS, Moschouris H, Bouma E. Long-term recurrence analysis post drug eluting bead (DEB) chemoembolization for hepatocellular carcinoma. Hepato-Gastroenterology 2013;60 : 1413–1419.
14. Wang S, Zhuang L, Meng Z. Hepatocellular carcinoma more than 3 cm in diameter: A systematic review of transcatheter arterial chemoembolization plus percutaneous ethanol injection versus transcatheter arterial chemoembolization alone. Gastroenterology 2013;2 : 42–49.
15. Ni JY, Liu SS, Sun HL, Chen YT. Meta-analysis of radiofrequency ablation in combination with transarterial chemoembolization for hepatocellular carcinoma. WJS 2013;19 : 3872–3882.
16. Liao M, Huang J, Zhang T, Wu H. Transarterial chemoembolization in combination with local therapies for hepatocellular carcinoma: A meta-analysis. PLoS ONE 2013;8: e68453.
17. Zan SB, Li DF, Dong SI. Transcatheter arterial chemoembolization (TACE) combined with percutaneous ethanol injection (PEI) for the treatment of primary hepatocellular carcinoma (HCC). China Modern Doctor 2008;46 : 84–85.
18. Xu GH, Wen HC, Li ZW. Evaluation of hepatic chemoembolization and percutaneous ethanol injection in the treatment of HCC. Chinese J Radiol 2002;21 : 66–68.
19. Kubala E. Hepatocelulární karcinom – stávající možnosti léčby. Acta Medicinae 2013;8 : 79–81.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 2-
All articles in this issue
- Deset let endovenózní ablace varixů, úspěchy, neúspěchy a budoucnost
- Transarteriální chemoembolizace pomocí „drug eluting beads“ (TACE DEB) u nemocných s radikálně neodstranitelným hepatocelulárním karcinomem (HCC)
- Problematika klostridiové kolitidy na chirurgickém pracovišti
- Využití acelulárních biologických xenotransplantátů v lokální léčbě Lyellova syndromu
- Využití telemetrického monitorování intrakraniálního tlaku v diferenciální diagnostice idiopatické nitrolební hypertenze – kazuistika
- Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta
- Problematika stanovení bezpečných resekčních okrajů u nádorů parenchymatózních orgánů
- Problematika stanovení bezpečných resekčních okrajů patologem v mamární onkochirurgii
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Problematika stanovení bezpečných resekčních okrajů u nádorů parenchymatózních orgánů
- Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta
- Problematika stanovení bezpečných resekčních okrajů patologem v mamární onkochirurgii
- Problematika klostridiové kolitidy na chirurgickém pracovišti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

