-
Medical journals
- Career
Potenciálne možnosti využitia kreatinfosfátu vo vnútornom lekárstve
Authors: Matej Vnučák 1; Renáta Michalová Jr 1; Karol Graňák 2; Jakub Benko 1; Marián Mokáň 1
Authors‘ workplace: I. interná klinika JLF UK a UNM, Martin, Slovenská republika 1; Chirurgická klinika a Transplantačné centrum JLF UK a UNM, Martin, Slovenská republika 2
Published in: Vnitř Lék 2019; 65(1): 30-36
Category:
Overview
Adenozíntrifosfát (ATP) je základnou jednotkou celulárneho energetického metabolizmu, avšak počas situácií so zvýšeným dopytom po energii bunka vyvinula metabolicky inertné molekuly fosfagény, medzi ktoré zaraďujeme aj kreatínfosfát (CrP). Momentálne existuje veľmi málo recentných publikácií so zameraním na benefit suplementácie CrP vo vnútornom lekárstve, jeho potenciálne využitie je hlavne v kardiológii pri akútnom infarkte myokardu, pri akútnom alebo chronickom srdcovom zlyhávaní. Ďalším odborom s potenciálnym využitím kreatínfosfátu je nefrológia – u dialyzovaných pacientov, ev. v geriatrii pri prevencii vzniku osteoporózy v skupine postmenopauzálnych žien. V nasledujúcom článku prenášame prehľad štúdií popisujúcich pozitívne účinky podávania CrP v špecifických skupinách pacientov vnútorného lekárstva.
Kľúčové slová:
ATP – fosfagény – ischémia – kreatínfosfát
Úvod
Kreatín (Cr) je vo všeobecnosti známy hlavne v oblasti športového lekárstva ako bezpečný nutričný doplnok užívaný na zväčšenie svalovej hmoty, zvýšenie výkonu prevencia chorobou indukovanej svalovej atrofie spolu so zlepšením rehabilitácie [1]. Kreatín má okrem vyššie uvedeného pleiotrópny efekt, kedy jeho hlavná úloha spočíva v aktivácii kreatín/kreatínkinázového systému (Cr/CK) s následným vyrovnávaním nadbytku, resp. v mnohých prípadoch, dočasného deficitu energie (hypoxia, ischémia). V nasledujúcom článku načrtneme potenciálne výhody suplementácie fosforylovanej formy kreatínu kreatínfosfátu (PCr) vo vnútornom lekárstve (tab).
Table 1. Potenciálne využitie kreatínfosfátu vo vnútornom lekárstve 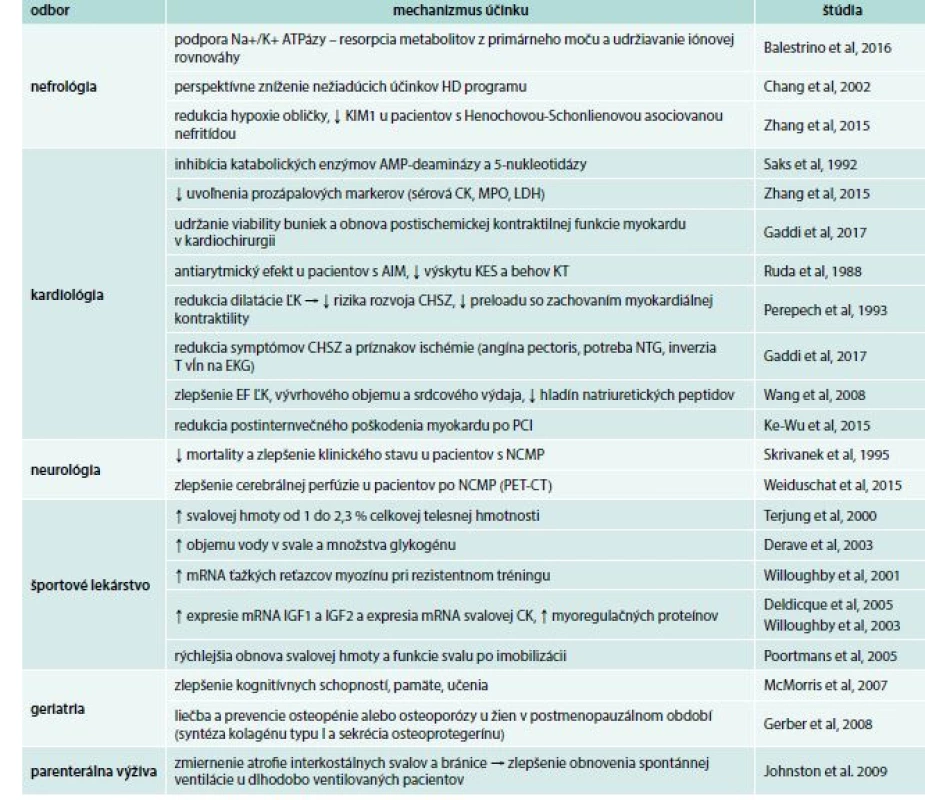
AIM – akútny infarkt myokardu AMP – adenozínmonofosfát CK – kreatínkináza EF – ejekčná frakcia HD – hemodialýza CHSZ – chronické srdcové zlyhávanie IGF – insulin like growth factor KES – komorové extrasystoly KIM-I – kidney ijury molecule 1 KT – komorová tachykardia LDH – laktátdehydrogenáza ĽK – ľavá komora MPO – myeloperoxidáza NCMP – náhla cievna mozgová príhoda NTG – nitroglycerín PCI – perkutánna koronárna intervencia V rámci adekvátneho pochopenia suplementácie PCr je nutné načrtnúť základný molekulárny a celulárny princíp uchovávania energie. Aj napriek tomu, že adenozíntrifosfát (ATP) reprezentuje základnú jednotku energie vo všetkých organizmoch a bunkách, hodnoty ATP nie sú zvyšované pri vysokých energetických požiadavkách bunky, pretože pri zvýšení koncentrácie ATP v cytoplazme buniek môže dôjsť k zvýšenej koncentrácii vodíkových iónov, uvoľnených pri štiepení ATP na adenozíndifosfát (ADP) a fosfát, ktoré acidifikujú cytosol. Tento proces vedie k inhibícii ATPázy (napr. aktín-myozínovej svalovej ATPázy s následnou inhibíciou svalovej kontrakcie) a mnohých iných celulárnych procesov. Na základe vyššie uvedeného evolúcia eukarytoických organizmov vyvinula iný spôsob uchovávanie energie vo forme metabolicky inertných molekúl – fosfagénov, medzi ktoré patrí práve PCr spolu s jeho kinázou (kreatínkináza – CK) katabolyzujúcou reverzibilnú reakciu premeny kreatínu na kreatínfosfát. Fosfagény sú fosforylované guanidínové substancie asociované s energetickým stavom bunky a hydrolýzou ATP katalyzované príslušnou fosfagén-asociovanou kinázou. Najrozšírenejší fosfagénový systém ja práve zmienený systém PCr/CK. Úloha fosfagénov v intracelulárnej energetike je regulovať hladinu anorganického fosfátu a hladiny ATP, ktoré ovplyvňujú glykogenolýzu, nárazníkové systémy vodíkových protónov a intracelulárny transport energie [3].
Denné straty kreatínu sú u 70 kg vážiaceho mladého jedinca mužského pohlavia 1,7 % celkového množstva kreatínu v tele – 2 g kreatínu denne [4]. Kreatín je substancia, ktorú môžeme suplementovať alebo vzniká v ľudskom organizme endogénnou syntézou. Západoeurópskou diétou (tzv. western diet) sme schopní kompenzovať straty kreatínu na 50 %, zvyšných 50 % denných strát kompenzujeme endogénnou syntézou [5]. Kreatín sa nachádza len v živočíšnych produktoch – mäso, hydina, mlieko a mliečne produkty. Obsah kreatínu v živočíšnom svalstve je približne 30 mmol/kg, z toho tretina sa konvertuje na kreatinín počas tepelnej úpravy. Množstvo kreatínu v kravskom mlieku je 0,6 mmol/l [6]. Z vyššie uvedeného vyplýva, že vegetariáni musia denné straty kreatínu kompenzovať dominantne jeho endogénnou syntézou.
Endogénna syntéza prebieha v niekoľkých krokoch – prvým je presun amidínovej skupiny aminokyseliny arginínu na aminoskupinu glycínu v obličkách, katalyzovanú enzýmom AGAT (L-arginínglycínamidinotransferáza) s výsledným produktom guanidinoacetát (GAA) a vedľajšieho produktu ornitínu. Následne je GAA transportovaná do pečene, v ktorej v druhom kroku, za účasti enzýmu GAMT (guanidinacetátmetyltransferáza), dochádza k metylácii amidínovej skupiny GAA, pričom donorom metylovej skupiny je metionín. Výsledný produkt je kreatín (N-metylguanidínacetát) a homocysteín. Na endogénnu syntézu kreatínu sú potrebné 3 aminokyseliny: arginín, glycín a metionín. Zjednodušenú schému endogénnej syntézy kreatínu ukazuje obr a schéma. Kreatín a CK sa zúčastňujú veľkého množstva bioenergetických procesov a sú dôležité v bunkách s vysokými energetickými požiadavkami (priečne pruhovaný, hladký, srdcový sval, mozog, neuróny, fotoreceptory sietnice, senzorické bunky vnútorného ucha) [7]. Vysoké koncentrácie izoforiem CK sú prítomné v množstve subtypov epiteliálnych buniek, ktoré nezaraďujeme do kategórie buniek s vysokými energetickými požiadavkami, avšak potrebujú veľkú energetickú podporu na procesy ako napr. mitóza buniek, resorpcia alebo sekrécia. V koži je systém subtypov CK lokalizovaných v keratinocytoch, v mazových žľazách a vo vlasových folikuloch [8] indikujúcich podiel systému CK/PCr na proliferácii kože a raste vlasov, podľa niektorých štúdií lokálna aplikácia krémov s vysokým obsahom kreatínu poukazovala na vyššiu ochranu pred UV indukovaným oxidatívnym poškodením kože a mutagenézou in vivo [9].
Obr. Endogénna syntéza kreatínu 
AGAT – L-arginínglycín midinotransferáza GAA – guanidínacetát GAMT – guanidinacetátmetyltransferáza HA – hepatálna artéria HV – hepatálna žila PV – portálna žila SAM – S-adenozylmetionín SAH – S-adenozylhomocysteín Schéma. Zjednodušená schéma reverzibilnej reakcie kreatín/kreatínkinázového systému 
Využitie v nefrológii
Vo všeobecnosti prevláda názor, že suplementácia kreatínu zhoršuje renálne funkcie. Súvisí to hlavne s faktom, že kreatín je zamieňaný s kreatinínom, ktorý je cyklický degradačný produkt kreatínu vznikajúci jeho neenzymatickou konverziou až do okamihu ich ekvilibria. Zvýšené hodnoty kreatinínu poukazujú na zníženú funkciu obličiek, pri suplementácii kreatínu je jeho zvýšenie, na základe vyššie uvedeného, opodstatnené. Na druhej strane, kreatín je dôležitý pre zachovanie funkcie obličiek. CK je vo vysokej miere exprimovaná v epiteliálnych bunkách obličky a CK/PCr systém podporuje sodíkovo-draslíkovú ATPázu v obličke [10], teda sa podieľa na udržiavaní iónovej rovnováhy a resorpcii metabolitov z primárneho moču. Vyššie uvedené fakty podporuje dvojito zaslepená, placebom kontrolovaná štúdia zahŕňajúca mužov bez významného predchorobia, s dennou suplementáciou kreatínu 10 g po dobu 3 mesiacov, bez akéhokoľvek nežiadúceho účinku na obličky a ich funkcie. V prípadovej štúdii pacienta so solitárnou obličkou a mierne redukovanou glomerulárnou filtráciou a suplementáciou kreatínu 20 g denne po dobu 3 mesiacov nedošlo k deteriorácii renálnych parametrov [11]. U pacientov s chronickým obličkovým ochorením v hemodialyzačnom (HD) programe, s nízkobielkovinovou diétou, môže po čase dôjsť k alterácii energetického metabolizmu priečne pruhovaného a srdcového svalu, rezultujúceho do straty svalovej hmoty, spolu s výskytom slabosti a únavy. Práve z týchto dôvodov, suplementácia kreatínu môže byť víziou na zníženie nežiadúcich účinkov chronického HD programu.
Nejednoznačnou otázkou však ostáva stanovenie optimálneho príjmu bielkovín, keďže pacienti s CKD sú ohrození malnutríciou, resp. nadmerným príjmom bielkovín vedúcim k hyperfiltrácii a následnej progresii chronického obličkového ochorenia. Podľa Medzinárodnej nefrologickej spoločnosti je dôležitá reštrikcia príjmu bielkovín v závislosti od stupňa poškodenia a redukcie glomerulárnej filtrácie a prítomnosti komorbidít (diabetes mellitus) [12]. Z hľadiska kvalitatívneho zloženia bielkovín bol porovnávaný vegetariánskej diéty s diétou, v ktorej bolo prijímanie červeného mäsa: štúdie poukázali, že nie je dôležitá skladba proteínov, ale ich absolútne prijaté denné množstvo [13]. Na základe vyššie uvedeného a podpory kreatínu v udržiavaní resorpcie metabolitov z primárneho moču a jeho zloženia výlučne v živočíšnych produktoch (mäse) by bolo optimálne (aj z hľadiska zastúpenia esenciálnych mastných kyselín) prijímať živočíšne bielkoviny. Avšak užívane výlučne vegetariánskej stravy má u pacientov s chronickým obličkovým ochorením má iné benefity – dostupnosť fosforu v rastlinnej strave je 30–50 % vs 70–80 % v živočíšnej strave, pričom v rastlinnej potrave je vysoké zastúpenie fytátov pôsobiacich ako prirodzené viazače fosforu [14]. Ďalším pozitívnym efektom príjmu rastlinných bielkovín je znižovanie inzulínovej rezistencie, zmierňovanie metabolickej acidózy zvýšeným množstvom prirodzených bikarbonátov tvoriacich aniónov (citrát, laktát a iné) [15].
Optimálnou metódou suplementácie Cr, by bolo pridanie Cr do hemodialyzačného roztoku, na zvýšenie kompliancie pacienta, ktorý často užíva práškové formy liekov (kalciové viazače a iné) [16].
Recentne bolo publikovaných niekoľko štúdií s využitím a pozitívnym efektom suplementácie CrP. Podávanie CrP pacientom s Henochovou-Schönleinovou purpurou znížilo koncentráciu molekuly KIM1 (Kidney Injury Molecule 1), a teda redukuje hypoxiu obličiek, spolu s možnou prevenciou včasného obličkového poškodenia u pacientov s Henochovou-Schönleinovou asociovanou nefritídou [17].
Medzi ďalšie potenciálne pozitívne účinky kreatínu patrí zmierňovanie toxického účinku liekov ovplyvňujúcich bioenergetiku bunky a mitochondrie, medzi ktoré patrí doxorubicín akumulujúci sa v mitochondriách s ovplyvnení ich funkcie spolu s inhibíciou izoforiem CK [18].
Kreatín a nárast svalovej hmoty
V spoločnosti prevláda názor, že suplementácia kreatínu spôsobuje nárast svalovej hmoty. Vo vedeckej obci sa názory rozchádzajú – Terjung et al [19] potvrdzujú nárast svalovej hmoty o 1–2 kg – od 1 do 2,3 % celkovej telesnej hmotnosti. Na druhej strane, vyše 30 % výskumov daný fakt nepotvrdil, a teda nepredpokladajú koreláciu medzi suplementáciou kreatínu a nárastom svalovej hmoty [20].
Rozdielnosť uvedených výskumov môže byť podmienená rôznou cieľovou vzorkou probandov – jedinci so sedavým spôsobom života, aktívne športujúci jedinci a s rozdielnymi suplementačnými protokolmi (denná dávka a celková doba suplementácie). Z pohľadu nárastu čistej svalovej hmoty (tzv. fat free) potvrdila väčšina štúdií benefit pri suplementácii kreatínu v porovnaní s kontrolnou vzorkou neužívajúcich kreatín. Príčinou je zmena štruktúry svalovej hmoty dvomi spôsobmi. Prvým spôsobom je retencia vody v svale – užívanie kreatínu (20 g po dobu 6 týždňov) spôsobilo zníženú dennú diurézu o 600 ml denne s následným zvýšeným obsahom vody v svalovom vlákne. Druhým spôsobom je zvyšovanie obsahu glykogénu vo svale (zvýšenie je signifikantnejšie pri súčasne vykonávanom silovom tréningu), ktorý tiež potencuje zvýšenie vody v svalovom tkanive, keďže 1 g glykogénu je sprevádzaný 2–3 g vody [21]. Okrem vyššie uvedených mechanizmov má suplementácia kreatínu efekt na expresiu svalov-špecifických génov a regulačných signálov proteosyntézy. Wiloughby et al [22] potvrdili zvýšenú expresiu mRNA ťažkých reťazcov myozínu u jedincov vykonávajúcich silový tréning a súčasne užívajúcich kreatín. Taktiež bolo dokázaná zvýšená expresia mRNA IGF1 a IGF2 (insulinlike growth factor) [23] a expresia mRNA svalovej kreatinkinázy s konkomintantým zvýšením myoregulačných proteínov (myogenín a iné) [24] pri suplementácii kreatínu. Potenciálnym benefitom suplementácie kreatínu môže byť okrem športového lekárstva aj rehabilitácia. V štúdii [25] imobilizovali pravú dolnú končatinu prostredníctvom dlahy po dobu 2 týždňov, kedy došlo k poklesu svalovej hmoty o 10 % a poklese svalového výkonu o 25 %. V skupine pacientov so suplementáciou kreatínu došlo k rýchlejšej obnove svalovej hmoty a funkcie svalu.
Starší pacienti
Suplementácia kreatínu u pacientov vo veku nad 65 rokov, ktorí zväčšia konzumujú menšie množstvo potravy a mäsa, a teda majú nízke hodnoty kreatínu v tkanivách, je relevantná v liečbe sarkopénie. Viaceré výskumy dokázali zlepšenie svalovej funkcie a nárast svalovej hmoty pri suplementácii kreatínu [26]. Pri dennej dávke 4-krát 5 g kreatínu denne po dobu 2 týždňov sa zlepšili kognitívne schopnosti pacientov [27], pamäť, učenie a duševný výkon [28]. Okrem vyššie uvedeného bol dokázaný efekt kreatínu u starších mužov a žien v postmenopauzálom období, v spojení s cvičením, na zvýšenie svalového výkonu a kostnej denzity [29]. Práve preto suplementácia kreatínu môže byť prospešná v liečbe prevencie osteopénie alebo osteoporózy u žien v postmenopauzálnom období, stimuláciou syntézy kolagénu typu I a sekréciou osteoprotegerínu v kostných bunkách [30].
Parenterálna výživa
Jedinci dlhodobo hospitalizovaní na jednotke intenzívnej starostlivosti rovnako ako dlhodobo chorí pacienti, napr. pacienti v terminálnom štádiu malígneho ochorenia s kachexiou, s obmedzeným perorálnym príjmom, sú plne dependentní na parenterálnej výžive. Substitúcia kreatínu má potenciálny efekt na zmiernenie atrofie interkostálnych svalov a bránice, a teda zlepšenie obnovenia spontánnej ventilácie, zvlášť u dlhodobo ventilovaných pacientov [31].
Využitie v kardiológii
CrP patrí medzi prvé substancie, ktorých koncentrácia sa znižuje počas ischémie, anoxie a pri toxických kardiomyopatiách. Tak isto ako v stresových situáciách (hypoxia) kardiomyocyty zvyšujú vychytávanie exogénneho CrP. Práve toto poznanie poukazuje na fakt, že extracelulárny prísun CrP môže kompenzovať energetický deficit buniek, práve z dôvodu inhibície katabolických enzýmov adenozínmonofosfátu (AMP) – AMP-deaminázy a 5-nukleotidázy. Pokiaľ je enzým 5-nukleotidáza inhibovaný, adenínová štruktúra AMP je zachovaná, vzhľadom na fakt, že reakcia adenylátkinázy je reverzibilná, môže pokračovať syntéza ADP a teda aj ATP [32]. Zhang et al v roku 2015 dokázali, že suplementácia Cr redukovala uvoľnenie určitých prozápalových markerov, napr. sérovej CK, myeloperoxidázy (MPO) a laktátdehydrogenázy (LDH) v ischemicko-reperfúznych experimentoch, ktorých zníženie bolo priamo úmerné zmenšeniu rozsahu infarktu [33]. Klinické využitie suplementácie CrP je hlavne v kardiochirurgii – pri výmene chlopne, ev. bypassových operáciách pridaním do kardioplegických roztokov, keďže CrP hrá signifikantnú úlohu v udržaní viability buniek a obnove postischemickej kontraktilnej funkcie myokardu [34]. Mnohé zo štúdii poukazujú na benefitujúci účinok pridania CrP do kardioplegického roztoku vyššou úspešnosťou spontánnej obnovy rytmu na sínusový po kardiochirurgických operáciách.
Ďalším pozitívnom efektom suplementácie CrP je u pacientov s akútnym infarktom myokardu (AIM). Ruda et al v roku 1988 popísali antiarytmický efekt CrP podávaného intravenózne do 6 hod po nástupe symptómov (bolus 2 g i.v. s následnou kontinuálnou aplikáciou 4 g/hod počas 2 hod) – 24-hodinový monitoring EKG poukázal na nižší výskyt predčasných komorových sťahov a nižší výskyt behov komorovej tachykardie v skupine pacientov, ktorým bol podávaný CrP [35]. Viaceré štúdie potvrdzujú pozitívny vplyv CrP v uvoľnení myokardiálnych enzýmov a teda redukciu poškodenia kardiomyocytov, pričom ani jedna zo štúdií nepopisuje signifikantné nežiadúce účinky. Suplementácia CrP v totálnej dávke 30 g počas 6 dní od primomanifestácie AIM výrazne redukovala dilatáciu ľavej komory, a teda rozvoj kongestívneho srdcového zlyhávania znižovaním preloadu, so zachovaním myokardiálnej kontraktility, bez relevantného ovplyvnenia hemodynamiky [36]. Štúdia 1 174 pacientov s chronickým srdcovým zlyhávaním, ktorí boli náhodne rozdelení do 2 skupín (739) s podávaním CrP v dennej dávke 2 g intravenózne po dobu 3 týždňov k štandardnej terapii (nitráty, digoxín, diuretiká), s kontrolnou skupinou 435 pacientov bez suplementácie CrP, poukázala na významnú redukciu hlavných symptómov a príznakov ischémie (angína pectoris, potreba sublingválnej aplikácie nitroglycerínu, inverzia T vĺn na EKG) spolu s nárastom ejekčnej frakcie ľavej komory, znížením cievnej rezistencie a redukcie predčasných komorových sťahov [34]. U pacientov podstupujúcich perkutánnu koronárnu intervenciu, podávanie CrP redukovalo postinternvečné poškodenie myokardu v liečenej skupine [37].
Ďalšie využite podávania CrP má perspektívu u pacientov s cerebrálnym poškodením (anoxia alebo ischémia), kedy systém CK/CrP môže do istej miery kompenzovať stupeň poškodenia. Skrivanek et al v roku 1995 porovnávali skupinu pacientov s cerebrálnou ischémiou, ktorí mimo štandardnú terapiu dostávali CrP v celkovej dávke 34 g intravenózne počas 3 dní, v liečenej skupine došlo k menšiemu výskytu úmrtí a k zlepšeniu klinického stavu v porovnaní s kontrolnou skupinou pacientov bez aditívnej terapie CrP [38]. Pravdepodobnosť klinického benefitu podávania CrP (32 g celkovo počas 5 dní) naznačila otvorená štúdia: u pacientov, ktorým podávali CrP a podrobili PET-CT, štúdia poukázala na zlepšenie mozgového prietoku v porovnaní s kontrolnou skupinou, ktorá CrP nedostávala [39].
Nežiadúce účinky
Okrem vyššie spomínaného všeobecne uznávaného názoru potenciálnych nežiadúcich účinkov na renálne funkcie, nadmerná konverzia kreatínu na sarkozín môže spôsobovať vznik cytotoxických substantcií – metylamín, formaldehyd, s potenciálne karcinogénnym efektom v bunkách. V štúdii porovnávali koncentrácie vyššie zmienených substancií pred a po suplementácii 21 g kreatínu denne v priebehu 14 dní. Hodnota metylamínu v moči za 24 hod bola 0,69 ± 0,06 pred a 6,41 ± 1,45 mg (9-násobný vzostup) a množstvo formaldehydu 64,78 ± 16,28 µg pred a 290,4 ± 66,3 µg za 24 hod po suplementácii kreatínu (4,5-násobný vzostup). Na základe spomenutého, krátkodobá suplementácia kreatínu zvyšuje jeho konverziu na sarkozín a mikrobiálnou enzymatickou reakciou na metylamín, ktorý potenciálne vzniká v čreve s potenciálnym poškodením intestinálneho epitelu. Okrem iného môže metylamín spôsobovať poškodenie endotelu v obličkách, resp. v cievach s rozvojom mikroangiopatie v glomeruloch, avšak nič z vyššie uvedeného nebolo pozorované v zmienenej štúdii [33].
Záver
Z pohľadu celulárnej energetiky je základnou a dôležitou molekulou ATP, avšak počas akútnych stavov vysokého dopytu po energii (ischémia, hypoxia, anoxia) boli prirodzene vyvinuté mechanizmy uvoľnenia energie z metabolicky inertných molekúl – fosfagénov, medzi ktoré zaraďujeme kreatínfosfát. Momentálne existuje málo publikácií venujúcich sa pozitívnemu efektu suplementácie CrP. V kardiológii hľadá uplatnenie, aj podľa platných odporúčaní a indikácií Štátneho ústavu pre kontrolu liečiv pridaním do kardioplegických roztokov počas kardiochirurgických výkonov, jeho pozitívne účinky boli dokázané u pacientov s akútnym alebo chronickým srdcovým zlyhávaním, ev. pri akútnom koronárnom syndróme. Ďalšou perspektívou je suplementácia CrP u starších pacientov na zlepšenie kognitívneho statusu, u postmenopauzálnych žien ako spomalenie progresie alebo zabránenie vzniku osteoporózy, osteopénie a u kriticky chorých pacientov s nízkym perorálnym príjmom na zníženie nežiadúcich účinkov spojených s dlhodobou umelou pľúcnou ventiláciou. Ďalším potenciálnym prínosom je suplementácia Cr u dialyzovaných pacientov, ev. podľa nových výskumov aj u pacientov s Henochovou-Schönleinovou purpurou. Z pohľadu nežiaducich účinkov je dávkovanie kreatínu prísne individuálne, dlhodobo je nutné sledovať renálne parametre, zvlášť u pacientov s preexistujúcim obličkovým ochorením, aj keď sa direktný efekt na zhoršenie renálnych funkcií nepotvrdil. Tak isto je nutné brať ohľad na synergický efekt suplementácie kreatínu, spolu s pestrou racionálnou stravou a adekvátnym cvičením, v liečbe sarkopénie ev. nárastu svalovej hmoty.
MUDr. Matej Vnučák
I. interná klinika JLF UK a UNM, Martin, Slovenská republika
Doručeno do redakce 15. 2. 2018
Přijato po recenzi 9. 6. 2018
Sources
- Solomons GS, Wyss M et al. Creatine and creatinekinase in health and disease. Springer: Dordrecht (NL) 2007. ISBN 978–1-4020–6485–2.
- Ellington WR. Evolution and physiological roles of phosphagen systems. Annu Rev Physiol 2001; 63 : 289–325. Dostupné z DOI: <http://dx.doi.org/10.1146/annurev.physiol.63.1.289>.
- Wyss M, Kaddurah-Daouk R. Creatine and creatinine metabolism. Physiol Rev 2000; 80(3): 1107–1213. Dostupné z DOI: <http://dx.doi.org/10.1152/physrev.2000.80.3.1107>.
- Stead LM, Brosnan JT, Brosnan ME et al. Is it time to reevaluate methyl balance in humans? Am J Clin Nutr 2006; 83(1): 5–10. Dostupné z DOI: <http://dx.doi.org/10.1093/ajcn/83.1.5>.
- Harris RC, Lowe JA, Warnes K et al. The concentration of creatine in meat, off al and commercial dogfood. Res Vet Sci 1997; 62(1): 58–62.
- Wallimann T, Tokarska-Schlattner M, Neumann D et al. The phospho-creatine circuit: molecular and cellular physiology of creatinekinases, sensitivity to free radicals and enhancement by creatine supplementation. In: Saks VA (ed). Molecular Systems Bioenergetics : Energy for Life Wiley‐VCH Verlag 2007 : 195–264. ISBN 9783527621095 (on-line). ISBN (print): 9783527317875. Dostupné z DOI: <http://dx.doi.org/10.1002/9783527621095.ch7>.
- Schlattner U, Tokarska-Schlattner M, Wallimann T. Mitochondrial creatinekinase in humanhealth and disease. Biochim Biophys Acta 2006; 1762(2): 164–180. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bbadis.2005.09.004>.
- Lenz H, Schmidt M, Welge V et al. The creatine kinase system in human skin: protective effects of creatine against oxidative and UV damage in vitro and in vivo. J Invest Dermatol 2005; 124(2): 443–452. Dostupné z DOI: <http://dx.doi.org/10.1111/j.0022–202X.2004.23522.x>.
- Balestrino M, Sarocchi M, Adriano E et al. Potential of creatine of phospho creatine supplementation in cerebrovascular disease and in ischemic heart disease. Amino Acids 2016; 48(8): 1955–1967. Dostupné z DOI: <http://dx.doi.org/10.1007/s00726–016–2173–8>.
- Gualano B, Ferreira DC, Sapienza MT et al. Effect of short-term high-dose creatine supplementation on measured GFR in a young man with a single kidney. Am J Kidney Dis 2010; 55(3): 7–9. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2009.10.053>.
- [National Kidney Foundation]. K/DOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Diabetes and Chronic Kidney Disease. Am J Kidney Dis 2007; 49(2 Suppl 2): S1-S180.
- Anderson JW, Blake JE, Turner J et al. Effects of soy protein on renal function and proteinuria in patients with type 2 diabetes. Am J Clin Nutr 1998; 68(6 Suppl): 1347–1353. Dostupné z DOI: <http://dx.doi.org/10.1093/ajcn/68.6.1347S>.
- Pagenkemper J. Planning a vegetarian renal diet. J Ren Nutr 1995; 5(4): 234–238. Dostupné z DOI: <https://doi.org/10.1016/1051–2276(95)90009–8>.
- Hung CJ, Huang PC, Li YH et al. Taiwanese vegetarians have higher insulin sensitivity than omnivores. Br J Nutr 2006; 95(1): 129–135.
- Trilok G, Draper HH Sources of protein-induced endogenous acid production and excretion by human adults. Calcif Tissue Int 1989; 44(5): 335–338.
- Chang CT, Wu CH, Yang CW et al. Creatine monohydrate treatment all eviates muscle cramps associated with haemodialysis. Nephrol Dial Transplant 2002; 17(11): 1978–1981.
- Zhang J, Zeng H, Wang N et al. Beneficial effects of creatine phosphate sodium for the treatment of Henoch-Schonlein purpura in patients with early renal damage detected using urinary kidney injury molecule-1 levels. Eur J Pediatr 2016; 175(1):49–55. Dostupné z DOI: <https://doi: 10.1007/s00431–015–2601-x>.
- Tokarska-Schlattner M, Dolder M, Gerber I et al. Reduced creatine-stimulated respiration in doxorubicin challenged mitochondria: particular sensitivity of the heart. Biochim Biophys Acta 2007; 1767(11): 1276–1284. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bbabio.2007.08.006>.
- Terjung RL, Clarkson P, Eichner ER et al. American College of Sports Medicine round table: the physiological and health effects of oral creatine supplementation. Med Sci Sports Exerc 2000; 32(3): 706–717.
- McConell GK, Shinewell J, Stephens TJ et al. Creatine supplementation reduces muscle in adenosinemonophosphate during endurance exercise in humans. Med Sci Sports Exerc 2005; 37(12): 2054–2061.
- Derave W, Eijnde BO, Verbessem P et al. Combined creatine and protein supplementation in conjunction with resistance training promotes muscle GLUT-4 content and glucose tolerance in humans. J Appl Physiol 2003; 94(5): 1910–1916. Dostupné z DOI: <http://dx.doi.org/10.1152/japplphysiol.00977.2002>.
- Willoughby DS, Rosene J. Effects of oral creatine and resistance training on myosin heavy chain expression. Med Sci Sports Exerc 2001; 33(10): 1674–1681.
- Deldicque L, Louis M, Theisen D et al. Increased IGF mRNA in human skeletal muscle after creatine supplementation. Med Sci Sports Exerc 2005; 37(5): 731–736.
- Willoughby DS, Rosene JM. Effects of oral creatine and resistance training on myogenic regulatory factor expression. Med Sci Sports Exerc 2003; 35(6): 923–929. Dostupné z DOI: <http://dx.doi.org/10.1249/01.MSS.0000069746.05241.F0>.
- Poortmans JR, Kumps A, Duez P et al. Effect of oral creatine supplementation on urinary methylamine, formaldehyde, and formate. Med Sci Sports Exerc 2005; 37(10): 1717–1720.
- Louis M, Poortmans JR, Francaux M et al. No effect of creatine supplementation on human myofibrillar and sarcoplasmic protein synthesis after resistance exercise. Am J Physiol Endocrinol Metab 2003; 285(5): E1089-E1094. Dostupné z DOI: <http://dx.doi.org/10.1152/ajpendo.00195.2003>.
- Rae C, Digney AL, McEwan SR et al. Oral creatine monohydrate supplementation improves brain performance: a double-blind, placebo-controlled, cross-over trial. Proc Biol Sci 2003; 270(1529): 2147–2150. Dostupné z DOI: <http://dx.doi.org/10.1098/rspb.2003.2492>.
- McMorris T, Mielcarz G, Harris RC et al. Creatine supplementation and cognitive performance in elderly individuals. Neuropsychol Dev Cogn B Aging Neuropsychol Cogn 2007; 14(5): 517–528. Dostupné z DOI: <http://dx.doi.org/10.1080/13825580600788100>.
- Chilibeck PD, Chrusch MJ, Chad KE et al. Creatinemonohydrate and resistance training increase bone mineral content and density in older men. J Nutr Health Aging 2005; 9(5): 352–353.
- Gerber I, Gerber H, Dora C et al. Creatine supplementation stimulates collagen type I and osteoprotegerin secretion of healthy and osteopenic primary human osteoblast-like cells in vitro. Bone 2008; 42(Suppl 1): S21–S22. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2007.12.021>.
- Johnston AP, Burke DG, MacNeil LG et al. Effect of creatine supplementation during cast-induced immobilization on the preservation of muscle mass, strength, and endurance. J Strength Cond Res 2009; 23(1): 116–120.
- Saks VA, Dzhaliashvili IV, Konorev EA et al. Molecular celular aspects of the cardioprotective mechanism of phosphocreatine. Biokhimiia 1992; 57(12): 1763–1784.
- Zhang W, Zhang H, Xing Y. Protective effects of phosphocreatine administered post - treatment combined with ischemic post-conditioning on rathearts with myocardial ischemia/reperfusion injury. J Clin Med Res 2015; 7(4): 242–247. Dostupné z DOI: <http://dx.doi.org/10.14740/jocmr2087w>.
- Gaddi AV, Galuppo P, Yang J. Creatine phosphate administration in cell energy impairment conditions: A summary of past and present research. Heart Lung Circ 2017; 26(10): 1026–1035. Dostupné z DOI: <http://dx.doi.org/10.1016/j.hlc.2016.12.020>.
- Ruda M, Samarenko MB, Afonskaya NI et al. Reduction of ventricular arrhythmias by phosphocreatine (Neoton) in patients with acute myocardial infarction. Am Heart J 1988; 116(2 Pt 1): 393–397.
- Perepech NB, Nedoshivin AO, Kutuzova AE. Exogenous phosphocreatine in the prevention and treatment of cardiac insufficiency in patients with myocardial infarction. Klin Med 1993; 71(1): 19–22.
- Ke-Wu D, Xu-Bo S, Ying-Xin Z et al. The effect of exogenous creatine phosphate on myocardial injury after percutaneous coronary intervention. Angiology 2015; 66(2): 163–168. Dostupné z DOI: <http://dx.doi.org/10.1177/0003319713515996>.
- Skrivanek O, Kalvach P, Benetin J et al. Kreatinfosfát v léčbě akutních ischemických iktů. Prakticky Lekar 1995; 75(7–8): 347–351.
- Weiduschat N, Mao NX, Beal MF et al. Usefulness of proton and phosphorus MR spectroscopic imaging for early diagnosis of Parkinson’s disease. J Neuro imaging 2015; 25(1): 105–110. Dostupné z DOI: <http://dx.doi.org/10.1111/jon.12074>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2019 Issue 1-
All articles in this issue
- Preskripce a dávkování inhibitorů RAAS u pacientů s chronickým srdečním selháním v registru FAR NHL
- Neceliakální glutenová/pšeničná senzitivita: stále více otázek než odpovědí
- Diagnostická úskalí celiakie
- Potenciálne možnosti využitia kreatinfosfátu vo vnútornom lekárstve
- Systémová zánětlivá reakce s vysokými hodnotami CRP jako dominantní příznak mnohočetného myelomu
- Priame perorálne antikoagulanciá v onkológii v klinickej praxi
- Spojenie akromegálie a Klinefelterovho syndrómu u jedného pacienta
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Systémová zánětlivá reakce s vysokými hodnotami CRP jako dominantní příznak mnohočetného myelomu
- Diagnostická úskalí celiakie
- Neceliakální glutenová/pšeničná senzitivita: stále více otázek než odpovědí
- Potenciálne možnosti využitia kreatinfosfátu vo vnútornom lekárstve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

