-
Medical journals
- Career
Karcinóm prištítneho telieska
Authors: Ivana Ságová 1; Matej Stančík 1; Peter Kentoš 2; Dušan Pávai 2; Daniela Kantárová 1; Anton Vaňuga 2; Peter Vaňuga 2
Authors‘ workplace: I. Interná klinika JLF UK a UN Martin, Slovenská republika 1; Národný endokrinologický a diabetologický ústav, Ľubochňa, Slovenská republika 2
Published in: Vnitř Lék 2017; 63(2): 139-144
Category: Case Reports
Overview
Karcinóm prištítneho telieska je vzácna endokrinná malignita, predstavujúca menej ako 1 % zo všetkých prípadov primárnej hyperparatyreózy. Presná etiológia ochorenia nie je známa. Za rizikové faktory sa považujú predchádzajúca rádioterapia v oblasti krku, terminálne štádium obličkového zlyhania, genetické faktory, a to najmä mutácia génu HPRT2/CDCT73. Charakteristickým znakom je indolentný, avšak progresívny rast s trendom pre lokálnu inváziu ako aj metastázovanie v pokročilom štádiu ochorenia. Z klinických prejavov dominujú príznaky závažnej, obvykle rezistentnej hyperkalcémie vyžadujúcej intenzívnu terapiu, často s nutnosťou dialyzačnej liečby. Najlepšou liečebnou metódou je skorá kompletná chirurgická resekcia. Chemoterapia a rádioterapia sú zvyčajne neúčinné. Včasná diagnostika karcinómu prištítnych teliesok je jedinou možnosťou v ovplyvnení morbidity a mortality pacientov trpiacich týmto ochorením.
Kľúčové slová:
diagnostika – hyperparatyreóza – karcinóm prištítnych teliesok – liečbaÚvod
Karcinóm prištítneho telieska (KPT) je zriedkavá endokrinná malignita predstavujúca 0,005 % všetkých zhubných nádorov [1]. Väčšina karcinómov prištítneho telieska sa vyznačuje produkciou parathormónu (PTH) s následnou hyperkalcémiou, v 10–25 % môžu byť hormonálne afunkčné [2]. Prevalencia karcinómu u oboch pohlaví je približne rovnaká. V porovnaní s adenómom prištítnych teliesok sa výskyt karcinómu popisuje o dekádu skôr, najmä medzi 40. až 50. rokom života [3]. Vyššia incidencia paratyreoidálneho karcinómu je prezentovaná u pacientov s anamnézou rádioterapie v oblasti krku, s terminálnym štádiom renálneho zlyhania a syndróme hyperparatyreózy – tumoru čeluste (HPT–TČ), zriedkavého autosomálne dominantného familiárneho syndrómu. Vznik syndrómu je spôsobený mutáciou HRPT2/CDC73 génu lokalizovaného na chromozóme 1q31. Gén sa skladá z 17 exónov kódujúcich proteín parafibromin – tumor supresorový proteín [4]. Mutácie génu HRPT2/CDC73 pri HPT-TČ sú rozptýlené po celej kódujúcej oblasti a predpokladá sa, že väčšina z nich spôsobí inaktiváciu alebo predčasné skrátenie kódovaného proteínu [5]. Pri syndróme hyperparatyreóza – tumor čeluste sa u postihnutých jedincov môže vyvinúť primárna hyperparatyreóza v dôsledku adenómu prípadne karcinómu prištítnych teliesok, tumor hornej/dolnej čeluste, menej často tumoru obličiek a maternice [6–8]. Približne 25 % pacientov so zrejme sporadickým karcinómom prištítnych teliesok má mutáciu HRPT2/CDC73 génu, 10 % predstavujú asymptomatickí nosiči [8]. Diagnostika paratyreoidálneho karcinómu je problematická, nakoľko klinické aj histologické črty, ktoré môžu definitívne odlíšiť jeho malígnu, alebo benígnu povahu v skorom štádiu, sú nejednoznačné. Charakteristickým znakom je jeho indolentný rast s trendom pre lokálnu inváziu. Stanovenie diagnózy je založené na prítomnosti symptómov rezistentnej hyperkalcémie spôsobenej autonómnou nadprodukciou PTH vedúcej k postihnutiu kostí, gastrointestinálneho traktu, obličiek, ako aj rastu samotného tumoru. Metastázy objavujúce sa v pokročilejších štádiách ochorenia sú jediným jednoznačným kritériom malignity. Metastatické ochorenie najčastejšie postihuje pľúca alebo kosti. Najlepšou liečebnou metódou je včasná kompletná chirurgická resekcia. Hoci nález vláknitej kapsuly a tkanivovej invázie môže napomôcť k stanoveniu diagnózy, v mnohých prípadoch je postihnutá žľaza makroskopicky na nerozoznanie od benígneho atypického adenómu. Adekvátny chirurgický prístup je teda závislý na predoperačnom podozrení a skúsenostiach operatéra. Chemoterapia a rádioterapia zvyčajne nie sú účinné, ale novšie metódy, ako katetrizačná arteriálna embólia a rádiofrekvenčná ablácia, predstavujú sľubnú paliatívnu liečbu u vybraných pacientov. Medikamentózna liečba cinakalcetom, vnútrožilovými bisfosfonátmi, forsírovanou diurézou pomocou kľučkových diuretík sú užitočným dodatkom pre kontrolu hyperkalcémie.
Kazuistika
49-ročná pacientka s primárnou hyperparatyreózou (PH) bola 6 mesiacov sledovaná spádovým endokrinológom. V 1. mesiaci od stanovenia diagnózy PH bol u pacientky okrem ľahko elevovanej hladiny kalcémie a PTH, sonograficky verifikovaný hypoechogénny uzol v pravom laloku štítnej žľazy. Scintigrafické vyšetrenie prištítnych teliesok bolo bez patomorfologického nálezu.
V 3. mesiaci trvania ochorenia realizovaná prvá operácia – pravostranná lobektómia s použitím gama-kamery, maximum rádioizotopovej aktivity sa zobrazilo nad pravým lalokom štítnej žľazy. Peroperačná biopsia nepotvrdila paratyreoidálne tkanivo. Súčasne bola vykonaná revízia retrotracheálneho priestoru, horného mediastina a exstirpácia tkaniva makroskopicky pripomínajúceho paratyreoidálny adenóm. Definitívna histológia nepotvrdila prítomnosť paratyreoidálneho tkaniva. Pooperačne pretrváva elevácia parathormónu s hyperkalcémiou. V 4. mesiaci trvania ochorenia opätovne realizovaná scintigrafia potvrdila zvýšenú akumuláciu rádioizotopu v oblasti dolnej časti ľavého laloku štítnej žľazy. Následne realizovaná druhá operácia s exstirpáciou tkaniva mylne identifikovaného ako dolné ľavé prištítne teliesko, so súčasnou exstirpáciou uzla v oblasti ľavého laloku štítnej žľazy. Definitívna histológia opätovne vylúčila prítomnosť paratyreoidálneho tkaniva. Pooperačnou komplikáciou bola paréza n. reccurens sinister, laboratórne pretrvávala elevácia PTH a kalcia. Subjektívne ťažkosti u pacientky boli námahové dyspnoe a zachrípnutý hlas, pri objektívnom vyšetrení neboli prítomné známky hyperkalcémie. Bola započatá liečba kalcitonínom v dávke 200 IU denne. V 6. mesiaci trvania ochorenia pacientka prijatá na spádové interné oddelenie s ťažkou hyperkalcémiou. Hladina celkového kalcia bola 4,47 mmol/l (norma do 2,6 mmol/l), koncentrácia iPTH 600 pg/ml (norma do 68,3 pg/ml). Bola aplikovaná rehydratačná liečba s forsírovaním diurézy furosemidom, podávaný bol kalcitonín a i.v. bisfosfonáty, po úprave liečby došlo aj k úprave hyperkalcémie. V zapätí bola pacientka preložená na endokrinologické oddelenie Národného endokrinologického a diabetologického ústavu v Ľubochni (NEDU) za účelom ďalšej diagnostiky a liečby. Tu sa pokračovalo v intenzívnej liečbe hyperkalcémie. S navrhovanou reexploráciou krku pacientka nesúhlasila. V rámci diferenciálnej diagnostiky bol realizovaný selektívny odber krvi z krčného venózneho systému so stanovením hladiny PTH, výsledok neposkytol významnú informáciu k stanoveniu diagnózy. Doplnená magnetická rezonancia (MR) vizualizovala tumoróznu masu suprasternálne za fossa jugularis s lymfadenopatiou supraklavikulárnych, submandibulárnych a parakarotických lymfatických uzlín.
V 8. mesiaci trvania ochorenia bola realizovaná tretia operácia – parciálna sternotómia s identifikáciou tumoróznej masy veľkosti 13 × 10 × 10 mm, peroperačná histológia vysoko suspektná pre karcinóm prištítnych teliesok. Resekovaný bol týmus, tumorózna masa exstirpovaná len parciálne pre inváziu do okolitých štruktúr a nervov. Definitívna histológia potvrdila paratyreoidálny karcinóm s infiltráciou týmusu. Histomorfologicky alveolárna štruktúra s fibróznymi septami (obr. 1).
Image 1. Histomorfologický obraz: alveolárna štruktúra s fibróznymi septami 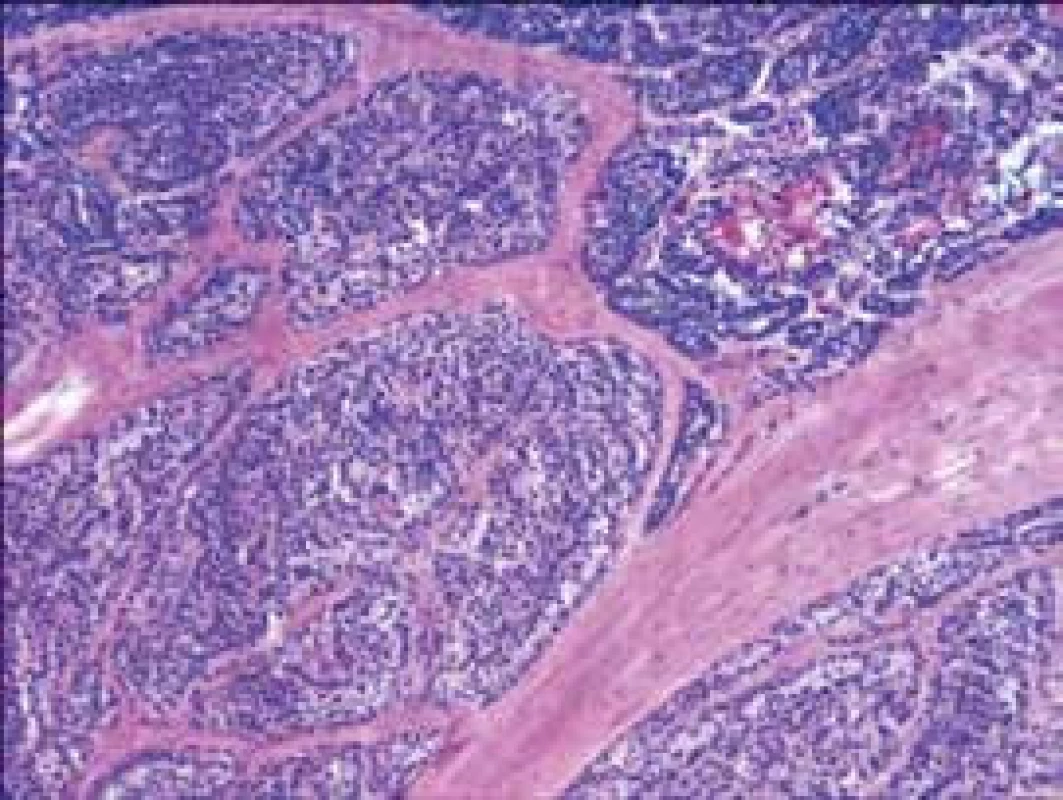
Imunohistochemicky sú nádorové bunky pozitívne pri dôkaze cytokeratínu CK 8/18. Proliferačná aktivita (index Ki – 67) presahuje 20 %. V 9. mesiaci trvania ochorenia bola realizovaná pozitrónová emisná tomografia (PET) s 18fluorodeoxyglukózou s nálezom reziduálnej hypermetabolickej tumoróznej masy s lokalizáciou v hornej hrudnej apertúre siahajúcej po dorzokraniálnu oblasť hrudnej kosti, dotýkajúcej sa trachey s veľkosťou v latero-laterálnom rozmere 31,3 mm, s mnohopočetnými bilaterálnymi pľúcnymi metastázami v celkovom počte 14 v pravom pľúcnom laloku a 12 v ľavom pľúcnom laloku, s najväčšou v priemere 13 mm (obr. 2).
Image 2. Pozitrónová emisná tomografia (PET) s <sup>18</sup>fluorodeoxyglukózou 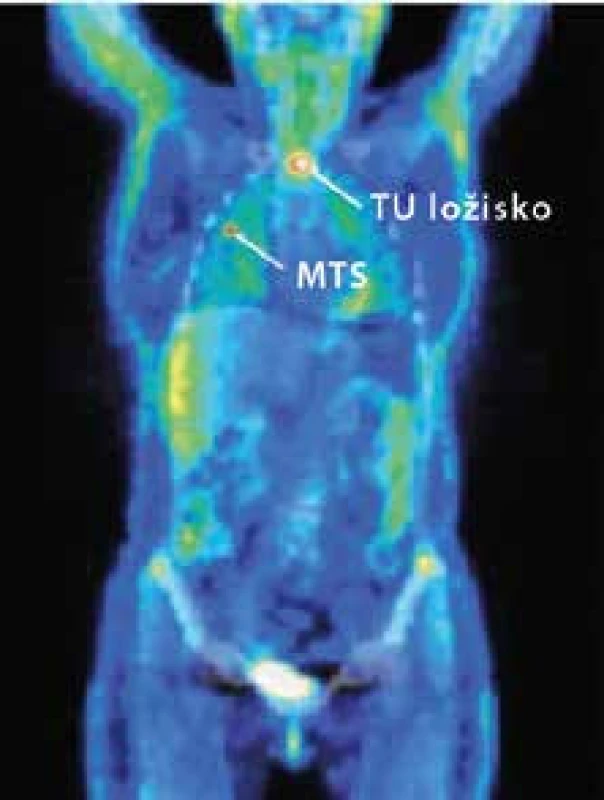
V 9. mesiaci trvania ochorenia pacientka opakovane hospitalizovaná na endokrinologickom oddelení NEDU v Ľubochni, kde sa pokračovalo v intenzívnej liečbe hyperkalcémie (rehydratácia, forsirovaná diuréza, pamidronát i.v., neskôr zolendronát i.v., bol navýšený cinakalcet na maximálnu, pacientkou ešte tolerovanú dávku 180 mg rozdelenú do 3 dávok). Subjektívne pretrvávalo námahové dyspnoe, občasný suchý kašeľ, bez prítomnosti iných ťažkostí. Objektívne bez významného patologického nálezu, bez poklesu hmotnosti. Prehľad hladín celkového kalcia, fosforu a PTH počas monitoringu v NEDU uvádzame v tab. 1.
Table 1. Hodnoty celkového kalcia, fosforu a PTH počas monitoringu v NEDU t.j. v druhom polroku trvania ochorenia 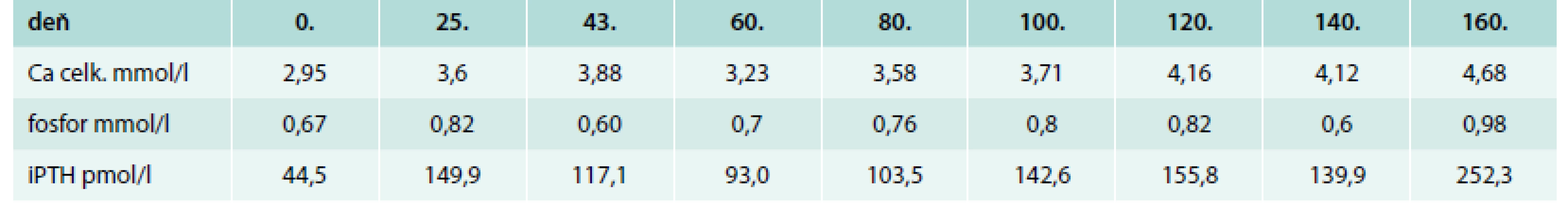
Ca celkové – norma 2,10–2,55 mmol/l fosfor – norma 0,74–1,52 mmol/l iPTH – norma 0,88–7,66 pmol/l Denzitometricky bol potvrdený nález počínajúcej osteopénie. USG abdomenu bez diseminácie základného ochorenia, bez prítomnosti kalcifikácií. EKG Holter bez záchytu poruchy rytmu, QT interval v norme. V snahe o zníženie metabolizmu nádorovej masy sa konzultoval onkológ, ktorý vzhľadom k rozsahu ochorenia kuratívnu chemoterapiu ani rádioterapiu neindikoval. Konzultované boli zahraničné pracoviská ohľadom možnosti aplikácie imunizačnej liečby, ktorá však nebola vzhľadom k rozsahu ochorenia schválená. V 11. mesiaci trvania ochorenia došlo k progresívnemu vzostupu kalcémie s nutnosťou zaradenia do dialyzačnej liečby cestou spádového interného oddelenia. Subjektívne dominujú dyspeptické ťažkosti horného GIT so zvracaním, nechutenstvom, slabosťou, tupou bolesťou za processus xiphoideus. Klinicky prítomná mierna redukcia hmotnosti, známky dehydratácie, palpačná bolestivosť v oblasti umbilika, na EKG prítomná sínusová tachykardia. Realizované kontrolne PET/CT, podľa ktorého v porovnaní s predošlým vyšetrením došlo k zvýšeniu metabolickej aktivity retrosternálneho tumoru, k progresii metastatického postihnutia pľúc a kostnej drene. Opakovane bol konzultovaný chirurg, ktorý vzhľadom k progresii základného ochorenia ako aj jeho vysokej metabolickej aktivite operačné riešenie neindikuje.
Po jednom roku od stanovania diagnózy primárnej hyperparatyreózy pacientka exitovala pod obrazom ťažkej hyperkalcémie.
Diskusia
Karcinóm prištítnych teliesok je zriedkavou príčinou primárnej hyperparatyreózy. Incidencia ochorenia u oboch pohlaví je približne rovnaká, avšak výskyt karcinómu sa v porovnaní s adenómom popisuje o 1 dekádu skôr s maximom medzi 40. až 50. rokom života [3]. Etiológia ochorenia zahŕňa podobne ako u iných malignít interakciu enviromentálnych a genetických faktorov. Vyššia incidencia paratyreoidálneho karcinómu je prezentovaná u pacientov s anamnézou rádioterapie v oblasti krku najmä v období detstva ako aj u pacientov s terminálnym štádiom obličkového zlyhania. Z genetických faktorov je to najmä mutácia HRPT2/CDC73 génu pri syndróme hyperparatyreózy – tumoru čeluste. Klinické prejavy karcinómu prištítnych teliesok uvádzame v tab. 2.
Table 2. Klinické prejavy karcinómu prištítnych teliesok [33–35] ![Klinické prejavy karcinómu prištítnych teliesok [33–35]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d5bedff705e65a362f35d4e4b1dace9a.png)
Paratyreoidálny karcinóm sa obvykle prezentuje závažnejšiou, rezistentnejšou hyperkalcémiou s vyššími hladinami PTH v porovnaní s adenómom asociovanou primárnou hyperparatyreózou. Kým symptómy ako malátnosť, nevoľnosť, vracanie, poruchy nálady a chudnutie sú z veľkej časti spoločné pre všetky príčiny hyperkalcémie, zvýšenú pozornosť v zmysle suspekcie na paratyreoidálny karcinóm by mali vzbudiť najmä pacienti s pridruženými kostnými prejavmi ako osteitis fibrosa cystica, subperiostálna osteoresorpcia, absencia lamina dura, difúzna osteopénia, osteoporóza, s bolesťami kostí prípadne patologickými zlomeninami [9,10]. Samotné renálne komplikácie v zmysle nefrolitiázy, nefrokalcinózy, zníženej glomerulárnej filtrácie a renálnej koliky nie sú špecifické pre karcinóm prištítneho telieska, avšak súčasné ochorenie kostí a obličiek sa vyskytuje v 50 % prípadov [11]. Hmatateľná tumorózna krčná masa je ďalším ukazovateľom malígneho ochorenia vyskytujúcim sa pri 15–76 % malígnych ochorení, len zriedkavo pri benígnej etiológii [9,10]. Na základe niekoľkých štúdií bol v 7–30 % prípadoch popisovaný bezpríznakový priebeh karcinómu prištítnych teliesok [11–13]. V prípade laboratórnych parametrov hladiny celkového vápnika ako aj PTH môžu byť nápomocné pri stanovení diagnózy karcinómu, hoci ich prahová hodnota nie je známa. Sérové hladiny celkového kalcia > 3,5 mmol/l sú popisované u > 60 % pacientov s paratyreoidálnym karcinómom, v porovnaní s < 10 % pri benígnom adenóme. Hladina PTH je v prípade karcinómu typicky 5–10-násobne vyššia ako horná hranica normy, zatiaľ čo benígna forma zvyčajne vykazuje jej miernejší nárast [14]. Spomedzi ostatných laboratórnych parametrov býva prítomná hypofosfatémia, hyperkalciúria a hyperfosfatúria. Boli preukázané významne vyššie hladiny alkalickej fosfatázy (ALP) u karcinómov prištítnych teliesok, pričom hladina < 300 IU/l je pre toto ochorenie nepravdepodobná [15]. Zvýšené hodnoty ALP odrážajú pôsobenie PTH na kosť. Mechanizmus pôsobenia PTH je v zmysle straty kortikálnej kosti pred špongióznou, čoho dôsledkom je elevácia ALP, ktorá môže predstavovať užitočný diagnostický kostný marker pred prejavmi ochorenia kostí, ako sú napr. zlomeniny [15]. Identifikácia nových laboratórnych markerov, ktoré môžu pomôcť odlíšiť malígnu a benígnu primárnu HPT, je v súčasnej dobe v oblasti výskumu. Zvýšené hladiny močového ľudského choriového gonadotropínu (hCG), ktoré boli zistené u pacientov s karcinómom prištítnych teliesok a korelujú s agresívnejším štádiom ochorenia súvisiacim s patologickou fraktúrou, prípadne smrťou. To viedlo k hypotéze, že močové hladiny hCG môžu mať potenciál v diferenciácií benígneho a malígneho ochorenia prištítnych teliesok [16]. Stock et al zachytili zvýšenie hladiny α a β podjednotky hCG po chirurgickej liečbe [17]. Ďalším vyšetrovaním je nutné vymedziť úlohu testovania hCG v diagnostike a prognóze paratyreoidálneho karcinómu [17]. Vzhľadom k náročnosti odlíšiť benígne a malígne nádory prištítnych teliesok na báze samotných morfologických kritérií, značné úsilie bolo zamerané na identifikáciu imunohistochemických nádorových markerov užitočných pre tento účel. Na základe dôkazov spájajúcich mutáciu HRPT2/CDC73 génu s malignitou prištítnych teliesok bol najsľubnejším markerom parafibromin, a to buď samostatne, alebo v spojení s inými markermi. Clark et al zistili, že kombinácia markerov zahrňujúca stratu parafibrominu, expresiu RB1 a galektínu 3 je najviac špecifická pre paratyreoidálny karcinóm. Žiadny z uvedených markerov nemá samostatne dostatočnú senzitivitu a špecificitu, preto ich výsledky treba interpretovať spoločne [18]. V prípade suspekcie paratyreoidálneho karcinómu zohráva kľúčovú úlohu lokalizácia malígnej lézie, určenie jej rozmerov a prípadnej invázie s cieľom efektívneho kompletného chirurgického odstránenia. Problém pri lokalizácií karcinómu prištítnych teliesok predstavuje skutočnosť, že v 6–16 % prípadov sa nachádza v netypickej lokalizácii – najčastejšie v štítnej žľaze (18 %), thymu (38 %), alebo za pažerákom (31 %) [19]. Jednou z najdostupnejších, najbezpečnejších zobrazovacích metód je ultrasonografia, ktorá sa vyznačuje nedostatočnou senzitivitou (50–60%) a jej využitie je v lokalitách krku a štítnej žľaze. Sonografické známky nehomogénnej štruktúry, hypoechogenicity, nerovných okrajov môžu byť suspektné pre malignitu, ale nie sú vždy prítomné. Testom voľby v lokalizácií zväčšených prištítnych teliesok je 99mTc-MIBI, ktoré je účinné aj pri lokalizácii ektopických lézií a vzdialených metastáz [20,21]. Citlivosť scintigrafie je 73–80 %, pri použití MIBI s USG stúpa na 95 % [20]. Ešte lepšie výsledky možno dosiahnuť využitím kombinácie MIBI a CT prípadne MR s kontrastom, ktoré umožňuje podrobné posúdenie patologického tkaniva – jeho vzťahov s ostatnými štruktúrami, inváziu do okolitých tkanív, zväčšenie lymfatických uzlín [22]. Na detekciu vzdialených metastáz používame PET s 18fluorodeoxyglukózou, ktoré môžu viesť k falošne pozitívnym výsledkom. V zložitých prípadoch môže pacient podstúpiť invazívnu metódu selektívny odber krvi z krčného venózneho systému so stanovením hladiny PTH [23].
Jedinou efektívnou liečebnou metódou je včasná a kompletná chirurgická resekcia primárneho tumoru [24]. Adekvátna chirurgická excízia vyžaduje odstránenie ipsilaterálneho laloku štítnej žľazy s istmom, skeletonizáciu priedušnice a odstránenie akéhokoľvek kostrového svalstva úzko súvisiaceho s nádorom. Efekt chirurgickej liečby môže byť zhodnotený na základe poklesu koncentrácie PTH za minútu, ktorá by mala klesnúť o 50 % v porovnaní s najvyššou vstupnou hladinou. Vzhľadom k zriedkavému výskytu ochorenia neexistujú žiadne dáta určujúce rozsah iniciálnej chirurgickej resekcie. Hoci je odporúčaná en bloc resekcia, v praxi sa tento chirurgický zákrok iniciálne vykonáva len u približne 12 % prípadov [25]. V prípade recidívy ochorenia je dôležité vylúčiť metastázy do pľúc a kostí pred reexploráciou krčnej oblasti. V nadväznosti na predoperačnú lokalizáciu nasleduje lokálna liečba recidívy ochorenia. Hoci sa neočakáva jej kuratívny efekt, je efektívna pri zmierňovaní symptómov a znížení hladiny vápnika v 68–86 % prípadov [26]. Následné, opätovné operácie majú zvyčajne nižšiu mieru účinnosti. Medzi komplikácie operačnej liečby patrí porušenie krčného n. reccurens, prechodná, prípadne trvalá hypotyreóza, poranenie pažeráka, priedušnice a lokálne hematómy [27]. Niektorí autori popisujú efekt paliatívnej resekcie vzdialených metastáz najmä v pľúcach a kostiach [28]. Tento efekt býva u lokalizovaných metastatických postihov nie pri ich diseminácii, kedy je nepravdepodobný vplyv reoperácie na zlepšenie symptómov a zníženie hladiny kalcia [29]. Chemoterapia a rádioterapia zvyčajne nie sú účinné, ale novšie metódy ako katetrizačná arteriálna embólia a rádiofrekvenčná ablácia predstavujú sľubnú paliatívnu liečbu u vybraných pacientov. Hlavnou príčinou úmrtia pacientov s paratyreoidálnym karcinómom je ťažká hyperkalcémia. V liečbe akútnej hyperkalcémie sa používa intravenózna hydratácia, forsírovaná diuréza pomocou kľučkových diuretík, liečba cinakalcetom, kalcitonínom, vnútrožilovými bisfosfonátmi (pamidronát, zoledronát). V prípade nezvládnutia hyperkalcémie konzervatívnym spôsobom je nutná dialyzačná liečba. Imunizácia so syntetickými ľudským, alebo hovädzím PTH viedla k produkcii protilátok anti-PTH a tým k zníženiu sérového kalcia o > 1 mmol/l u pacienta s karcinómom prištítnych teliesok s neresekovateľnými metastázami [30]. V prípade ďalšieho pacienta viedla imunizačná terapia k zníženiu sérovej hladiny kalcia a parathormónu [31]. Dá sa predpokladať, že denosumab (monoklonálna protilátka proti receptoru aktivátora nukleárneho faktora κ-B ligand) so silným antiresorpčným účinkom v kosti bude testovaný na účinnosť pri kontrole hyperkalcémie pri paratyreoidálnom karcinóme [32].
Nami prezentovaná pacientka vekovo spadala do obdobia maximálnej incidencie ochorenia, jej subjektívne ťažkosti ako aj klinické symptómy boli v priebehu ochorenia nevýrazné. K plnému rozvinutiu gastrointestinálnych a neuropsychických symptómov došlo až v konečnej fáze ochorenia. Napriek vysokým hladinám kalcémie a PTH (tab. 1) bolo denzitometrické vyšetrenie u pacientky na úrovni počínajúcej osteopénie, EKG Holter bez poruchy rytmu (QT interval v norme), sonograficky bez prítomnosti kalcifikátov v obličkách a močovodoch. Sonograficky ani scintigraficky sa nepodarilo potvrdiť karcinóm prištítnych teliesok. Diagnóza bola zrejmá po absolvovaní MR, ktoré však nezobrazilo početné MTS v pľúcnom parenchýme. Tie sa podarilo zachytiť prostredníctvom PET/CT s 18fluorodeoxyglukózou. Peroperačná diagnostika úvodne nebola úspešná v dôsledku ektopickej lokalizácie karcinómu. Po diagnostikovaní ochorenia kompletná resekcia tumoróznej masy nezrealizovaná pre pokročilosť ochorenia s jeho inváziou do okolitých štruktúr a nervov. Imunizačná liečba, terapeutická rádioterapia a chemoterapia vzhľadom k rozsahu ochorenia s mnohopočetným metastatickým postihom nebola zindikovaná. Konzultovaný špecialista v oblasti hrudnej chirurgie realizujúci predošlé operačné výkony u pacientky odmietol ďalšie operačné riešenie vzhľadom na komplikovaný priebeh posledného operačného výkonu ako aj PET/CT nález. Pacientka zomrela na závažnú hyperkalcémiu o 12 mesiacov po stanovení diagnózy primárnej hyperparatyreózy. V literatúre popisovaný indolentný priebeh ochorenia v prípade našej pacientky nemôžeme pre rýchly a progresívny priebeh potvrdzovať.
Záver
Karcinóm prištítnych teliesok predstavuje raritnú príčinu primárnej hyperparatyreózy, čo vedie k oneskoreniu diagnostikovania ochorenia. V čase stanovenia diagnózy je už zvyčajne tumor zreteľný. Prognóza ochorenia je ťažko predvídateľná vzhľadom k častej recidíve ochorenia v mnohých prípadoch. Efektívnou liečbou je skorá kompletná resekcia tumoru. Včasná diagnostika karcinómu prištítnych teliesok je jedinou možnosťou v ovplyvnení morbidity a mortality pacientov trpiacich týmto ochorením.
Práca podporená grantom APVV–14–0153.
MUDr. Ivana Ságová, PhD.
iva.sagova@gmail.com
I. interná klinika JLF UK a UN,
Martin,
Slovenská republika
www.unm.sk
Doručeno do redakce 1. 12. 2016
Přijato po recenzi 21. 1. 2017
Sources
1. Dudney WC, Bodenner D, Stack BC Jr. Parathyroid carcinoma. Otolaryngol Clin North Am 2010; 43(2): 441–53, xi. Dostupné z DOI: <http://dx.doi.org/10.1016/j.otc.2010.01.011>.
2. Wilkins BJ, Lewis JS Jr. Non-functional parathyroid carcinoma: a review of the literature and report of a case requiring extensive surgery. Head Neck Pathol 2009; 3(2): 140–149. Dostupné z DOI: <http://dx.doi.org/10.1007/s12105–009–0115–4>.
3. Ricci G, Assenza M, Barreca M et al. Parathyroid carcinoma: the importance of high clinical suspicion for a correct management. Int J Surg Oncol 2012; 2012 : 649148. Dostupné z DOI: <http://dx.doi.org/10.1155/2012/649148>.
4. Shi X, Chang M, Wolf AJ et al. Cdc73p and Paf1p are found in a novel RNA polymerase II-containing complex distinct from the Srbp-containing holoenzyme. Mol Cell Biol. 1997; 17(3): 1160–1169.
5. Newey PJ, Bowl MR, Thakker RV. Parafibromin – functional insights. J Intern Med 2009; 266(1): 84–98.
6. Jackson CE, Norum RA, Boyd SB et al. Hereditary hyperparathyroidism and multiple ossifying jaw fibromas: a clinically and genetically distinct syndrome. Surgery 1990; 108(6): 1006–1012.
7. Bradley KJ, Hobbs MR, Buley ID et al. Uterine tumours are a phenotypic manifestation of the hyperparathyroidism-jaw tumour syndrome. J Intern Med 2005; 257(1): 18–26.
8. Chen JD, Morrison C, Zhang C et al. Hyperparathyroidism-jaw tumour syndrome. J Intern Med. 2003; 253(6): 634–642.
9. Givi B, Shah JP. Parathyroid Carcinoma. Clin Oncol (R Coll Radiol) 2010; 22(6): 498–507. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clon.2010.04.007>.
10. Marcocci C, Cetani F, Rubin MR et al. Parathyroid carcinoma. J Bone Miner Res 2008; 23(12): 1869–1880. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.081018>.
11. Shane E. Clinical review 122: Parathyroid carcinoma. J Clin Endocrinol Metab 2001; 86(2): 485–493.
12. Sharretts JM, Kebebew E, Simonds WF. Parathyroid cancer. Semin Oncol 2010; 37(6): 580–590. Dostupné z DOI: <http://dx.doi.org/10.1053/j.seminoncol.2010.10.013>.
13. Kentoš P, Macháleková K, Szépe P et al. Metastazujúci karcinóm prištítneho telieska – zriedkavá príčina primárnej hyperparytyreózy. Onkológia 2008; 3(5): 341–344.
14. Fernandez-Ranvier GG, Khanafshar E, Jensen K et al. Parathyroid carcinoma, atypical parathyroid adenoma, or parathyromatosis? Cancer 2007; 110(2): 255–264.
15. Bae JH, Choi HJ, Lee Y et al. Preoperative predictive factors for parathyroid carcinoma in patients with primary hyperparathyroidism. J Korean Med Sci 2012; 27(8): 890–895. Dostupné z DOI: <http://dx.doi.org/10.3346/jkms.2012.27.8.890>.
16. Rubin MR, Bilezikian JP, Birken S et al. Human chorionic gonadotropin measurements in parathyroid carcinoma. Eur J Endocrinol 2008; 159(4): 469–474. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-08–0169>.
17. Stock JL, Weintraub BD, Rosen SW et al. Human chorionic gonadotropin subunit measurement in primary hyperparathyroidism. J Clin Endocrinol Metab 1982; 54(1): 57–63.
18. Juhlin CC, Villablanca A, Sandelin K et al. Parafibromin immunoreactivity: its use as an additional diagnostics marker for parathyroid tumor classification. Endocrine-Related Cancer 2007; 14(2): 501–512.
19. Rawat N, Khetan N, Williams DW et al. Parathyroid carcinoma. Br J Surg 2005; 92(11): 1345–1353.
20. Roy M, Mazeh H, Chen H et al. Incidence and localization of ectopic parathyroid adenomas in previously unexplored patients. World J Surg 2013; 37(1): 102–106. Dostupné z DOI: <http://dx.doi.org/10.1007/s00268–012–1773-z>.
21. De Feo ML, Colagrande S, Biagini C et al. Parathyroid glands: combination of (99m)Tc MIBI scintigraphy and US for demonstration of parathyroid glands and nodules. Radiology 2000; 214(2): 393–402.
22. Owen RP, Silver CE, Pellitteri PK et al. Parathyroid carcinoma: a review. Head Neck 2011; 33(3): 429–436. Dostupné z DOI: <http://dx.doi.org/10.1002/hed.21376>.
23. Pyzik JP, Matyjaszek-Matuszek B, Zwolak A et al. Parathyroid cancer – difficult diagnosis – a case report. Nucl Med Rev 2016; 19(1): 46–50. Dostupné z DOI: <http://dx.doi.org/10.5603/NMR.2016.0009>.
24. Halenka M, Klusová N, Fryšák Z et al. Karcinom příštítného tělíska, vzácná příčina hyperkalcémie u pacienta s B-NHL. Interní Med 2009; 11(1): 42–44.
25. Lee PK, Jarosek SL, Virnig BA et al. Trends in the incidence and treatment of parathyroid cancer in the United States. Cancer 2007; 109(9): 1736–1741.
26. Iihara M, Okamoto T, Suzuki R et al. Functional parathyroid carcinoma: Long-term treatment outcome and risk factor analysis. Surgery 2007; 142(6): 936–943. Erratum in Surgery 2008; 143(2): 302.
27. Kebebew E. Parathyroid carcinoma. Curr Treat Options Oncol 2001; 2(4): 347–354.
28. Koyano H, Shishiba Y, Shimizu T et al. Successful treatment by surgical removal of bone metastasis producing PTH: new approach to the management of metastatic parathyroid carcinoma. Intern Med 1994; 33(11): 697–702.
29. Flye MW, Brennan MF. Surgical resection of metastatic parathyroid carcinoma. Ann Surg 1981; 193(4): 425–435.
30. Bradwell AR, Harvey TC. Control of hypercalcaemia of parathyroid carcinoma by immunisation. Lancet 1999; 353(9150): 370–373.
31. Betea D, Bradwell AR, Harvey TC et al. Hormonal and biochemical normalization and tumor shrinkage induced by anti-parathyroid hormone immunotherapy in a patient with metastatic parathyroid carcinoma. J Clin Endocrinol Metab 2004; 89(7): 3413–3420.
32. Lumachi F, Brunello A, Roma A et al. Cancer-induced hypercalcemia. Anticancer Res 2009; 29(5): 1551–1555.
33. Fraker DL. Parathyroid tumors. In: De Vita VT Jr, Hellman S, Rosenberg SA (eds). Cancer: Principles and practice of oncology. Lippincott Williams and Wilkins: Philadelphia 2000 : 1763–1769.
34. Koea JB, Shaw HF. Parathyroid Cancer: Biology and management. Surg Oncol 1999; 8(3): 155–165.
35. Jakoubkova S, Vokurka J, Cap J et al. Parathyroid carcinoma: Clinical presentation and treatment. International Congress Series 2003; 1240 : 991–995.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 2-
All articles in this issue
- Dlouhodobě působící inzuliny v léčbě diabetu 2. typu a jejich postavení v rámci současného léčebného algoritmu
- Akútne obličkové poškodenie: aktuálny komplexný prehľad
- Autoprotilátky u systémových onemocnění pojiva a ANCA asociovaných vaskulitid, jejich vztah k intersticiálním plicním procesům a prognóze
- Vyhodnocení kinetiky VO2 v zotavovací fázi spiroergometrického vyšetření u kardiologicky nemocných – význam a klasifikace
- Funkční význam hERG: od fyziologické role po cíl protinádorové terapie
- Antitrombocytová tromboprofylaxia artériových vaskulárnych chorôb a orgánovaskulárnych ischemických chorôb
- Konzervativní terapie pozdní infekce aortální protézy
- Karcinóm prištítneho telieska
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autoprotilátky u systémových onemocnění pojiva a ANCA asociovaných vaskulitid, jejich vztah k intersticiálním plicním procesům a prognóze
- Karcinóm prištítneho telieska
- Dlouhodobě působící inzuliny v léčbě diabetu 2. typu a jejich postavení v rámci současného léčebného algoritmu
- Akútne obličkové poškodenie: aktuálny komplexný prehľad
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

