-
Medical journals
- Career
Metabolizmus cholesterolu u pacientů s diabetes mellitus 2. typu
Authors: Michal Vrablík; Eva Tůmová
Authors‘ workplace: Centrum preventivní kardiologie III. interní kliniky 1. LF UK a VFN Praha
Published in: Vnitř Lék 2016; 62(3): 189-194
Category: Reviews
Overview
Diabetická dyslipidemie je komplexní změnou metabolizmu lipidů, které musíme věnovat při péči o diabetika velkou pozornost. Samotný diabetes mellitus 2. typu je onemocnění spojené s mnoha makrovaskulárními a mikrovaskulárními komplikacemi a od počátku onemocnění je nutné s ohledem na možnost rozvoje těchto komplikací o pacienta pečovat komplexně. Prevence kardiovaskulárních komplikací je jedním z nejdůležitějších faktorů při péči o diabetika, protože kardiovaskulární příhody jsou mezi hlavními příčinami morbidity a mortality pacientů s diabetem. Riziko vzniku aterosklerotických komplikací je u diabetiků výrazně vyšší než u nediabetické populace, což více než z poloviny podmiňuje rozdílný metabolizmus plazmatických lipoproteinů a rozvoj typické diabetické dyslipidemie s vysoce aterogenním potenciálem. Léčba diabetické dyslipidemie je založená na dodržování režimových opatření, která mají pozitivní efekt i na diabetes obecně, prakticky vždy doplněných farmakoterapií vhodně zvolenou k dosažení cílových hodnot plazmatických lipoproteinů a ovlivnění jejich kvality.
Klíčová slova:
aterogenní dyslipidemie – diabetes mellitus – inzulinová rezistenceÚvod
Diabetes mellitus 2. typu (DM2T) je vysoce komplexní onemocnění ovlivňující celou řadu orgánových systémů, včetně kardiovaskulární (KV) soustavy. Při léčbě KV onemocnění (KVO) se snažíme stanovit individuální KV riziko každého pacienta, podle nějž určíme postup léčby. Diabetici patří mezi vysoce rizikové pacienty z hlediska rozvoje KVO – onemocnění DM2T není již hodnoceno jako rizikový faktor (RF) aterosklerózy, potažmo KVO, ale jako tzv. ekvivalent KV onemocnění. Pacienti s DM2T mají riziko rozvoje infarktu myokardu (IM) nebo náhlé srdeční smrti vyšší než 20 % v následujících 10 letech. Ekvivalenty KVO jsou symptomatická ateroskleróza karotid, onemocnění periferních tepen (ischemická choroba dolních končetin), aneuryzma abdominální aorty, DM2T a chronické renální onemocnění 4. a vyššího stupně [1]. Pacienti s diabetem bez známého KVO mají shodné 10leté riziko KV příhody jako nediabetici se známým KVO [2]. K diabetikům bychom proto měli přistupovat jako k vysoce nebo velmi vysoce rizikovým pacientům a léčit je stejně jako nemocné s již manifestním KVO.
Mnoho diabetiků ovšem současně trpí dalším RF aterosklerózy – 22 % pacientů s DM2T kouří, 45 % je obézních (BMI ≥ 30 kg/m2), 63 % trpí arteriální hypertenzí (krevní tlak ≥ 140/90 mm Hg či antihypertenzní terapie) a dokonce 67 % dyslipidemií (LDL-cholesterol ≥ 3,4 mmol/l či hypolipidemická léčba) [3].
Diabetici, coby vysoce rizikoví pacienti z hlediska potencionálního rozvoje KVO, by měli být dispenzarizováni v odborných ambulancích, důsledně léčeni a kontrolováni. Samozřejmostí by mělo být také pravidelné vyšetřování hladin sérových lipidů, protože onemocnění diabetem jde ruku v ruce se změnami metabolizmu sérových lipidů a lipoproteinů. Pacienti s diabetem jsou dle skórovacích systémů pro stratifikaci rizika KVO ve skupině vysokého či velmi vysokého KV rizika (dle současné přítomnosti dalších RF), proto adekvátně klesá cílová hladina LDL-cholesterolu. U pacientů s vysokým rizikem rozvoje KVO v příštích 10 letech se snažíme o snížení hladiny LDL-cholesterolu < 2,5 mmol/l, u pacientů s velmi vysokým rizikem by měla hladina LDL-cholesterolu klesnout < 1,8 mmol/l či alespoň o 50 % výchozí hodnoty [4].
Mechanizmus vzniku diabetické dyslipidemie
Komplexní změny metabolizmu diabetika jsou charakterizované odlišnou kvalitou i kvantitou sérových lipoproteinů a rozvíjejí se již od vzniku inzulinové rezistence, dále se prohlubují spolu se snižováním inzulinové senzitivity a nárůstem inzulinové deficience. Z hlediska metabolizmu lipoproteinových částic se jako nejvýznamnější jeví porucha správné funkce inzulinu na úrovni jaterní buňky a enterocytu, tedy v místech rozhodujících o vzniku a degradaci lipoproteinových částic. Také změny ve svalové a tukové tkáni se podílejí na negativním vývoji lipidového metabolizmu. Narušení metabolizmu lipoproteinů hraje velmi důležitou roli při vzniku a udržování inzulinové rezistence a představuje jeden z hlavních mechanizmů vzniku cévních komplikací u nemocných s diabetem 2. typu.
Inzulinová rezistence v místě intraabdominálního tuku ovlivňuje hydrolýzu triglyceridů (TG) a vede k uvolňování většího množství volných mastných kyselin do splanchnické cirkulace. V játrech způsobuje inzulinová rezistence spolu s vysokou dodávkou volných mastných kyselin zvýšenou produkci TG, což ústí v hypertriglyceridemii, a VLDL částic. Vysoké množství těchto částic může za přítomnosti CETP podněcovat přesun TG do LDL částic výměnou za LDL cholesterylestery. LDL částice bohaté na TG mohou podléhat hydrolýze činností jaterní lipázy, která vede ke vzniku malých denzních LDL částic chudých na cholesterol. Vysoká množství TG a VLDL také za stejných podmínek způsobují přesun TG do HDL částice výměnou za HDL cholesterylestery, což ústí ve formaci HDL částic bohatých na TG. Ty jsou také dobrým substrátem pro jaterní lipázu s výsledným poklesem hladin HDL-cholesterolu a zvýšeným uvolňování apolipoproteinu AI, který je rychle katabolizován játry. Výsledkem těchto metabolických pochodů u diabetiků je tedy větší zastoupení malých denzních LDL částic, které jsou vysoce aterogenní, při vyšetření lipidogramu můžeme zjistit vysokou hladinu apolipoproteinu B100, TG a VLDL. Současně dochází k poklesu ateroprotektivních HDL častic [5]. Tato aterogenní dyslipidemie je naprosto typická pro diabetiky a vysoce riziková z hlediska rozvoje KVO.
U diabetiků má naprosto zásadní význam postprandiální metabolizmus lipidů, který pravděpodobně určuje samotný vznik a vývoj aterosklerózy více než obdobné změny detekovatelné nalačno. Za normálních podmínek potlačuje po jídle inzulin lipolýzu v tukové tkáni a produkci VLDL v játrech. V případě nemocných s diabetem dochází postprandiálně k hyperinzulinemii, která spolu s působením inzulinové rezistence opět vede k vysoké hladině TG, nízké hladině HDL-cholesterolu a vzniku malých denzních LDL částic [6]. Hlavní změnou postprandiálního lipoproteinového metabolizmu je ale kumulace „na TG bohatých lipoproteinů“ (triglyceride rich lipoproteins – TRL), jejichž akumulace je asociovaná s porušenou vazodilatační schopností endotelu, produkcí zánětlivých cytokinů, aktivací monocytů a zvýšené náchylnosti aterosklerotického plátu k ruptuře [7,8]. Za aterogenicitu TRL nejsou ale zodpovědné samotné TG, ale spíše množství cholesterolu, které TRL transportují. Během postprandiální hypertriglyceridemie je poměrně velké množství cholesterolu neseno také remnantními lipoproteiny, které jsou dalšími nositeli aterogenního rizika [9].
Rozdíly v manifestaci diabetické dyslipidemie (pouze minimální zvýšení TG a hraniční hodnoty HDL-cholesterolu vs extrémní hodnoty u jiných pacientů) jsou vysvětlitelné genetickými faktory. Dnes je známo již více než 100 genů, které se podílejí na rozvoji inzulinové rezistence a metabolického syndromu [10].
Hodnocení diabetické dyslipidemie
Stejně tak jako u ostatních pacientů s dyslipidemií, i u diabetiků rutinně stanovujeme hladinu celkového cholesterolu (TC), TG, HDL-cholesterolu, LDL-cholesterolu výpočtem dle Friedwaldovy formule. Možnosti tohoto výpočtu limituje hladina TG – pokud je triglyceridemie > 4,5 mmol/l, nelze tuto rovnici použít. V roce 2011 byly evropskými odbornými společnostmi publikovány nové cílové hodnoty rozmezí plazmatických lipidů tab. 1 [4].
Table 1. Cílové a optimální hodnoty plazmatických lipidů a apoproteinů podle doporučení evropských společností z roku 2011 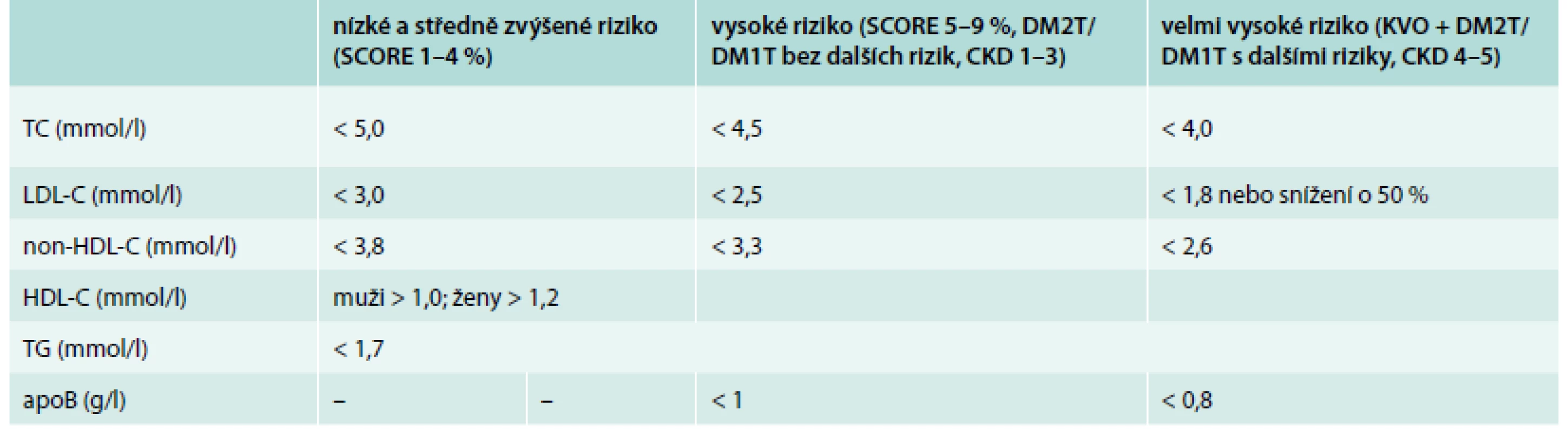
TC – celkový cholesterol LDL-C – low density lipoprotein cholesterol non-HDL-C – non-HDL-cholesterol apoB – apoprotein B HDL-C – high density lipoprotein cholesterol TG – triglyceridy DM2T – diabetes mellitus 2. typu DM1T – diabetes mellitus 1. typu KVO – přítomnost manifestního kardiovaskulárního onemocnění CKD – chronické onemocnění ledvin Nicméně v případě hodnocení diabetické dyslipidemie je prosté změření koncentrací základních subfrakcí cholesterolu (LDL-cholesterolu a HDL-cholesterolu) a TG nedostatečné. V klinické praxi můžeme dále využít tyto ukazatele:
- non-HDL-cholesterol = TC – HDL-cholesterol: jedná se o přesnější ukazatel rizika u osob se smíšenou dyslipidemií, reflektuje celkové množství cholesterolu v plazmě neseného aterogenními lipoproteinovými částicemi, výhodou je, že se jedná o prostý výpočet a není třeba další laboratorní stanovení s rostoucími náklady
- poměr TC/HDL-cholesterol: vystihuje rovnováhu aterogenních a neaterogenních částic v plazmě, které transportují cholesterol, zvláště výhodné je tento poměr stanovovat u stavů s nižší hladinou HDL-cholesterolu, což je pro diabetiky typické, také je tento ukazatel využíván u osob s prediabetem ke zhodnocení KV rizika dle tabulek SCORE; podobně jako výše zmíněný ukazatel se jedná o výpočet dále nezatěžující rozpočet
- apolipoprotein B (apoB): jedná se o nejnovější a nejpřesnější ukazatel rizika u smíšené diabetické dyslipidemie, jehož koncentrace odpovídá počtu aterogenních lipoproteinových částic a informuje nás o kvantitě, ale také kvalitě a velikosti lipoproteinů, zvýšení hladiny apoB při normální či lehce zvýšené hladině LDL-cholesterolu znamená vyšší zastoupení malých denzních LDL částic s aterogenním potenciálem
Možnosti ovlivnění rizika KV rizika u diabetika
Režimová opatření
Vzhledem k faktu, že valná většina pacientů s diabetem 2. typu je obézních, je jedním ze základních požadavků v rámci režimových opatření snížit hmotnost, a to o ideálně 7–10 % během 6–12 měsíců. Faktorem, který má na průběh nemoci zásadní vliv, je fyzická aktivita. Vhodné je zařadit 30–60 min pravidelné pohybové aktivity denně a omezit sedavý způsob života, pokud to zdravotní stav pacienta dovolí. Pravidelná fyzická aktivita má pozitivní vliv na inzulinovou rezistenci, proto se snažíme pacienta motivovat, aby ve snaze hýbat se nepolevoval, i přestože nepozoruje kýženou odezvu v podobě poklesu hmotnosti.
Pozornost je samozřejmě nutné věnovat jídelníčku diabetika. Pacienta edukujeme, aby omezil celkový příjem tuků na 25–35 % celkového kalorického příjmu, také je třeba snížit obsah jednoduchých cukrů a soli. Pozornost by měl nemocný věnovat obsahu transnenasycených a nasycených mastných kyselin v potravě, upřednostnit mononenasycené a polynenasycené mastné kyseliny a také potraviny s vysokým obsahem vlákniny.
Samozřejmostí je v rámci režimových opatření zdůraznit zcela zásadní význam zanechání kouření na celkové zdraví pacienta, s důrazem na benefit ve směru prevence KV komplikací.
Farmakoterapie
Řada nemocných s vysokým rizikem komplikací aterosklerózy dodržujících doporučené změny životního stylu (a tím spíše osoby, které režimová opatření nedodržují), musí být ovšem léčena medikamentózně. Předpokladem léčby diabetické dyslipidemie je dosažení optimální kontroly diabetu a normalizace glykemie. Hypolipidemika představují základ preventivní farmakoterapie. Metaanalýza 14 studií s 18 686 diabetiky léčených statiny prokázala pokles rizika velkých KV komplikací o 21 % při redukci hladiny LDL-cholesterolu o 1 mmol/l [11]. Je tedy zřejmé, že pacienti s diabetem 2. typu bezpochyby profitují z intenzivní hypolipidemické terapie a i v tomto případě platí tvrzení o LDL-cholesterolu „čím níže, tím lépe“. Pokud léčíme vysoce rizikového pacienta statinem a podaří se dosáhnout cílových hladin LDL-cholesterolu, je třeba věnovat pozornost dalším faktorům. U mnoha takových pacientů přetrvává hypertriglyceridemie a nízká hladina HDL-cholesterolu, což jsou charakteristické rysy aterogenní diabetické dyslipidemie. Pokud k ovlivnění tohoto reziduálního rizika nestačí zlepšení režimových opatření, je nutné zvážit kombinační hypolipidemickou farmakoterapii. V tomto případě se rozhodujeme mezi přidáním fibrátu, k optimalizaci koncentrací aterogenních TRL a remnantních částic, nebo ještě intenzivnějším snížením LDL-cholesterolu přidáním ezetimibu. Tyto úvahy se na pořad dne dostávají v případě, že lipidogram není úspěšně kontrolován ani správně titrovanou léčbou statinem.
Dle studie IMPROVE-IT publikované v roce 2015, ve které bylo sledováno 18 134 pacientů po akutním koronárním syndromu, dochází po přidání ezetimibu do hypolipidemické terapie statinem k dalšímu snížení KV příhod o 6,4 % [12], přičemž průměrná hladina LDL-cholesterolu pacientů léčených kombinací statin + ezetimib byla 1,4 mmol/l. Součástí výsledků byla i analýza některých podskupin pacientů, z níž bylo zřejmé, že z léčby kombinací profitovali především diabetici. Ve studii bylo sledováno celkem 4 933 pacientů s diabetem, diagnóza byla stanovena před vstupem pacientů do studie. Skupiny pacientů s diabetem a bez diabetu se od sebe lišily v základní charakteristice (věk, zastoupení mužů a žen, BMI, kouření) i v průběhu předchorobí (arteriální hypertenze, předchozí akutní infarkt myokardu, angioplastika, bypass) a terapií před vstupem do studie (acetylsalicylová kyselina – ASA, statiny, betablokátory, RAAS inhibitory). Lze ve zkratce shrnout, že mezi diabetiky bylo více žen, měli vyšší BMI, více diabetiků trpělo arteriální hypertenzí, ovšem méně diabetiků kouřilo. Pacienti s diabetem byli častěji léčeni ASA, statiny, betablokátory a RAAS inhibitory, více diabetiků před zahájením studie prodělalo akutní infarkt myokardu, angioplastiku, či podstoupilo bypass. Ve skupině diabetiků byla nižší výchozí hladina LDL-cholesterolu a HDL-cholesterolu, vyšší hladina TG, vyšší CRP. Ve studii IMPROVE-IT došlo u diabetiků ke statisticky významně většímu poklesu LDL-cholesterolu ve srovnání s nediabetiky. Ve snižování hladiny TG a zvyšování HDL-cholesterolu nebyl pozorován žádný rozdíl. Co více, u pacientů s diabetem došlo ke statisticky signifikantnímu poklesu KV příhod o 14 %, zatímco u pacientů bez diabetu nebyl pokles výskytu KV příhod statisticky významný (snížení pouze o 2 %). Pokles incidence KV příhod u diabetiků byl dán především menším výskytem akutního infarktu myokardu a ischemických CMP. Z této subanalýzy jednoznačně vyplývá, že nemocní s diabetem podstatně více profitují z přidání ezetimibu ke statinu. Tato léčebná kombinace diabetikům zajistí nižší hladinu LDL-cholesterolu a zejména efektivní kontrolu KV rizika.
Pokud se rozhodneme do hypolipidemické léčby statinem přidat fibrát, dojde kromě poklesu hladiny TG také ke změně zastoupení jednotlivých typů LDL částic a především k poklesu hladiny malých denzních LDL částic [13]. Tato kombinační léčba tedy ovlivňuje aterogenní diabetickou dyslipidemii, čímž zlepšuje prognózu diabetiků [14]. Překračuje-li triglyceridemie nalačno 4 mmol/l, jsou lékem první volby fibráty. Fibráty jsou agonisté nitrojaderných receptorů PPARα, a proto mají komplexní působení. Zvyšují lipolýzu prostřednictvím aktivace lipoproteinové lipázy, snižují produkci na triglyceridy bohatých částic v hepatocytu, indukují β oxidaci mastných kyselin a jejich zvýšenou utilizaci v jaterní buňce, zvýšení syntézy apoproteinů AI a AII. Těmito mechanizmy je vysvětlitelná fibráty navozená změna v kvantitě, ale i kvalitě lipoproteinových částic krevní plazmy.
Dnes je nejrozšířenějším fenofibrát. Jak dokumentovaly provedené studie, podávání fenofibrátu je spojeno s významným poklesem rizika o KVO u osob s typickou smíšenou DLP provázející diabetes (někdy označovanou aterogenní DLP). Tato zjištění potvrzují logický předpoklad – léčba fibrátem je efektivní pouze u osob, které mají hypertriglyceridemii a sníženou hladinu HDL-cholesterolu. Fenofibrát prošel i dosud jedinou klinickou studií hodnotící kombinaci statinu a fibrátu. Diabetici 2. typu v ní byli randomizováni ke kombinaci statin + placebo nebo statin + fenofibrát. Kombinační léčba snižovala riziko makrovaskulárních komplikací opět pouze u osob s typickou „diabetickou“ dyslipidemií (vysoké TG a nízká hladina HDL-cholesterolu). Byl potvrzen příznivý vliv fibrátu na vznik a rozvoj mikrovaskulárních komplikací. Studie ACCORD také prokázala, že bezpečnost kombinace statinu s fenofibrátem byla srovnatelná s monoterapií statinem a léčba byla provázena minimem nežádoucích účinků [14].
Fibráty jsou indikovány jako iniciální terapie u všech diabetiků s hypertriglyceridemií > 4 mmol/l nalačno. U ostatních se fibrát uplatní v kombinaci se statinem nebo ezetimibem při snaze o ovlivnění všech složek diabetické dyslipidemie. Jak bylo uvedeno v předchozím odstavci, přidání fibrátu ke statinu prohloubí LDL snižující účinek o 10–15 %, což je nesporně dalším významným „pro“ časné zahájení kombinační léčby. V souladu s výsledky klinických studií a na jejich základě formulovaných doporučení odborných společností přidáme k zavedené terapii statinem fibrát u těch diabetiků, u nichž přetrvává zvýšení hladin TG > 2,3 mmol/l nebo koncentrace HDL-cholesterolu < 1,0 mmol/l.
S ohledem na příznivé působení terapie fenofibrátem na mikrovaskulární komplikace diabetu (zpomalení progrese retinopatie i nefropatie, snížení nutnosti amputací pro syndrom diabetické nohy) byla v některých mimoevropských zemích tato samostatná indikace fenofibrátu schválena. Zajímavé je, že mechanizmy ovlivnění mikrovaskulárního postižení fenofibrátem nejsou zprostředkovány změnami lipopoproteinového metabolizmu, ale spíše pleiotropními účinky [15] (tab. 2).
Table 2. Možné mechanizmy příznivého ovlivnění mikrovaskulárních komplikací diabetu fenofibrátem 
Závěr
Intervence dyslipidemie u diabetika představuje jednu z hlavních možností ovlivnění jeho prognózy. Hlavními požadavky mohou být:
- pozornost věnovaná i malým změnám koncentrací plazmatických lipidů s využitím nových markerů rizika DLP (non-HDL-cholesterol, apoB, AIP)
- časné zahájení farmakologické léčby včetně kombinací (prokázaný benefit z kombinace statin + ezetimib, příznivé mikrovaskulární účinky fenofibrátu)
- důraz na dosahování cílových hodnot
- motivace nemocných k dlouhodobé dobré spolupráci v oblasti režimových opatření i farmakoterapie
Dodržováním pravidel správné diagnostiky a léčby dyslipidemie snížit riziko makrovaskulárních i mikrovaskulárních komplikací diabetu, což s ohledem na rostoucí počet všech diabetiků i těch s rozvinutými komplikacemi považujeme za velmi důležité
Podpořeno grantem AZV 15–28277A.
Doručeno do redakce 15. 3. 2016
Přijato po recenzi 18. 3. 2016
doc. MUDr. Michal Vrablík, Ph.D.
vrablikm@seznam.cz
Centrum preventivní kardiologie III. interní kliniky 1. LF UK a VFN Praha
www.vfn.cz
Sources
1. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Circulation 2002; 106(25): 3143–3421.
2. Juutilainen A, Lehto S, Rönnemaa T et al. Type 2 diabetes as a “coronary heart disease equivalent”: an 18-year prospective population-based study in Finnish subjects. Diabetes Care 2005; 28(12): 2901–2907.
3. Harris MI. Health care and health status and outcomes for patients with type 2 diabetes. Diabetes Care 2000; 23(6): 754–758.
4. Reiner Z, Catapano AL, De Backer G et al. (European Association for Cardiovascular Prevention & Rehabilitation). ESC/EAS Guidelines for the management of dyslipidaemias: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J 2011; 32(14):1769–1818.
5. Austin MA, Breslow JL, Hennekens CH et al. Low-density lipoprotein subclass patterns and risk of myocardial infarction. JAMA 1988; 260(13): 1917–1921.
6. Enkhmaa H, Ozturk Z, Anuurad E et al. Postprandial Lipoproteins and Cardiovascular Disease Risk in Diabetes Mellitus. Curr Diab Rep 2010; 10(1): 61–69.
7. Hsieh J, Hayashi AA, Webb J et al. Postprandial dyslipidemia in insulin resistance: Mechanisms and role of intestinal insulin sensitivity. Atheroscler Suppl 2008; 9(2): 7–13.
8. Rivellese AA, De Natale C, Di Marino L et al. Exogenous and endogenous postprandial lipid abnormalities in type 2 diabetic patients with optimal blood glucose control and optimal fasting triglyceride levels. J Clin Endocrinol Metab 2004; 89(5): 2153–2159.
9. McPherson R. Remnant cholesterol: “Non-(HDL-C + LDL-C)” as a coronary artery disease risk factor. J Am Coll Cardiol 2013; 61(4): 437–439.
10. Lusis AJ, Mar R, Pajukanta P. Genetics of atherosclerosis. Annu Rev Genomics Hum Genet 2004; 5 : 189–218.
11. Kearney PM, Blackwell L, Collins R et al. (Cholesterol Treatment Trialists’ (CTT) Collaborators). Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet 2008; 371(9607): 117–125.
12. Cannon CP, Blazing MA, Giugliano RP et al. (IMPROVE-IT Investigators). Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med 2015; 372(25): 2387–2397.
13. Grundy SM, Vega GL, Yuan Z et al. Effectiveness and tolerability of simvastatin plus fenofibrate for combined hyperlipidemia (the SAFARI trial). Am J Cardiol 2005; 95(4): 462. Erratum in Am J Cardiol 2006; 98(3): 427–428.
14. Ginsberg HN, Elam MB, Lovato LC et al. (ACCORD Study Group). Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362(17): 1563–1574. Erratum in N Engl J Med 2010; 362(18): 1748.
15. Wright AD, Dodson PM. Medical management of diabetic retinopathy: fenofibrate and ACCORD Eye studies. Eye (Lond) 2011; 25(7): 843–849.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 3-
All articles in this issue
- Paradoxy obezity
- Klinické aspekty farmakologické léčby diabetické neuropatie – spolupráce neurologa a diabetologa
- Farmakogenetika perorálnej antidiabetickej liečby
- Metabolizmus cholesterolu u pacientů s diabetes mellitus 2. typu
- Victoza mění diabetes a životy pacientů již 5 let
- XIGDUO – fixní kombinace dapagliflozinu a metforminu
- Diabetes mellitus a karcinom pankreatu
- Časná detekce ICHS u diabetiků a určení typu léčby
- Jaký význam má fenomén „maskované“ hypertenze u nemocných s diabetes mellitus 2. typu léčených pro setrvalou hypertenzi?
- Vedení terapie diabetes mellitus 2. typu ve zralém věku
- Řízení motorových vozidel a diabetes mellitus – lékařské aspekty
- Zdravotní způsobilost k řízení motorových vozidel a diabetes mellitus – vybrané aspekty z právní úpravy v České republice
- „Zdravé správanie“ a psychická odolnosť v prevencii mládeže proti cukrovke v projekte Diateens
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Victoza mění diabetes a životy pacientů již 5 let
- Řízení motorových vozidel a diabetes mellitus – lékařské aspekty
- Diabetes mellitus a karcinom pankreatu
- Paradoxy obezity
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

