-
Medical journals
- Career
Centrální diabetes insipidus u dospělých osob – první příznak histiocytózy z Langerhansových buněk a Erdheimovy‑Chesterovy choroby. Popis tří případů a přehled literatury
Authors: Z. Adam 1; K. Balšíková 2; M. Krejčí 1; L. Pour 1; S. Štěpánková 3; P. Svačina 2; M. Hermanová 4; J. Vaníček 5; P. Krupa 5; J. Staníček 6; R. Koukalová 6; J. Neubauer 7; A. Křivanová 1; J. Mayer 1; R. Hájek 1
Authors‘ workplace: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc. 2II. interní klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MU Dr. Miroslav Souček, CSc. 3Interní hepatogas 1
Published in: Vnitř Lék 2010; 56(2): 138-148
Category: Case Reports
Overview
V dospělosti vzniklý centrální diabetes insipidus je velmi vzácný. U dospělých (na rozdíl od dětí) jsou častější příčinou zánětlivé procesy a infiltrace neoplaziemi, které nevycházejí z nervové tkáně, než primární tumory vycházející z nervové tkáně. Vzácné histiocytární neoplazie (histiocytóza z Langerhansových buněk, xantogranulomatóza a Erdheimova‑Chesterova choroba) mají speciální afinitu právě k hypotalamu a ke stopce hypofýzy, a to nejen u dětských forem histiocytóz, ale také u histiocytóz vzniklých v dospělosti. Popisujeme tři případy centrálního diabetes insipidus vzniklého v dospělosti. U dvou pacientů byl diabetes insipidus prvním projevem histiocytózy z Langerhansových buněk. U jednoho pacienta byl diabetes insipidus prvním projevem Erdheimovy‑Chesterovy nemoci. MR zobrazení ve všech třech případech prokázalo patologický infiltrát a rozšíření stopky hypofýzy. V diferenciální diagnostice se osvědčilo PET‑CT vyšetření, které buď na základě akumulace značené glukózy, či na základě CT zobrazení prokázalo další extrakraniální patologické změny. U 1. pacienta se histiocytóza z Langerhansových buněk ještě projevila infiltrací perianální krajiny s intenzivní kumulací fluorodeoxyglukózy (FDG) – SUV 8,6 a zánětlivým procesem v oblasti dásní, který byl neodlišitelný od paradontitity. Histologie infiltrátu z perianální infiltrace prokázala histiocytózu z Langerhansových buněk. Po čtyřech cyklech 2‑chlordeoxyadenosinu (5 mg/ m2 5 dní po sobě) vymizela na MR zobrazení infiltrace stopky hypofýzy. U 2. pacienta PET‑CT zobrazení prokázalo jen hraniční kumulaci FDG v ORL oblasti, ale současně provedené CT zobrazení prokázalo cystickou přestavbu plicního parenchymu a nodularity, korelující s obrazem plicní formy histiocytózy z Langerhansových buněk (LCH). Bronchoalveolární laváž prokázala zvýšený počet CD1a a S100 pozitivních elementů odpovídajících plicní formě LCH, která postihovala také stopku hypofýzy a vnější zvukovod. Ve 3. případě PET‑CT prokázalo zvýšenou aktivitu v kostech dlouhých končetin a lopatě kosti kyčelní v blízkosti sakroiliakálního skloubení. Punkce ložiska v lopatě kosti pánevní prokázala infiltraci pěnitými histiocyty, imunohistochemicky odpovídající Erdheimově‑Chesterově nemoci. Další zobrazovací vyšetření potvrdila i další znaky této nemoci. U tohoto pacienta byla provedena i punkce infiltrátu v hypofýze, diagnózu neobjasnila, ale způsobila vznik kompletního panhypopituarizmu. Centrální diabetes insipidus v dospělosti může být prvním projevem zatím nepoznaného extrakraniálního onemocnění, v našem případě histiocytárních neoplazií a PET‑CT má excelentní potenciál detekovat extrakraniální projevy nemoci. Proto by rizikovou biopsii infiltrátu stopky hypofýzy mělo vždy předcházet kompletní vyšetření cílené na odhalení extrakraniálních projevů nemocí, které mohou postihovat hypofýzu.
Klíčová slova:
histiocytóza z Langerhansových buněk – Erdheimova‑Chesterova choroba – diabetes insipidus centralis – PET‑CT – 2‑chlordeoxyadenosin – cladribinÚvod
Centrální diabetes insipidus je vzácnou endokrinní poruchou, charakterizovanou polydipsií a polyurií s poruchou koncentrační schopnosti ledvin. Způsobuje dehydrataci, hypotenzi a někdy i synkopu [1,2].
Centrální diabetes insipidus je způsoben částečným nebo absolutním deficitem vazopresinu. Příčinou je destrukce neuronů v hypotalamicko hypofyzární oblasti, které za fyziologických podmínek produkují vazopresin [3,4].
Dle rozsahu postižení neurohypofyzárních buněk lze rozlišit kompletní a parciální formu centrálního diabetes insipidus. Rozlišení dle klinickýchpříznaků není příliš spolehlivé, velmi orientačně lze říct, že při kompletnímdiabetes insipidus je diuréza kolem 15 až 20 l/ den, při parciálním bývá diuréza menší, kolem 8 – 10 l/ den. K rozlišení kompletní a parciální formy centrálního diabetes insipidus pomáhá výsledek koncentračního testu.
Etiologie centrálního diabetes insipidus je velmi různorodá (tab. 3). Dělí se na primární (vrozené) formy diabetes insipidus, manifestované již od raného dětství, a sekundární (získané) formy, které vznikají na podkladě různých patologických procesů v mozku a hypofýze. Idiopatický centrální diabetes insipidus nemá organický podklad, diagnostikuje se po vyloučení všech ostatních organických příčin.
Primární mozkové tumory jsou zodpovědné asi za 50 % případů centrálního diabetes insipidus u dětí a za 30 % u dospělých [5,6]. U dětí se uvádí, že asi 15 % případů centrálního diabetes insipidus je způsobeno histiocytózou z Langerhansových buněk [6]. Pro dospělé jsme podobný údaj v literatuře nenašli.
Moderní zobrazovací metody (MR i CT) mají klíčovou roli při detekci těchto procesů. MR mozku může identifikovat zesílení stopky hypofýzy, a dokonce v ní detekovat patologický signál. MR nálezy jsou však nespecifické. Diagnózu může ověřit pouze histologický rozbor tohoto infiltrátu. Získat však reprezentativní histologický vzorek ze stopky hypofýzy není jednoduché a bez rizika, a tak se v praxi doporučuje provést celkové vyšetření s cílem odhalit nemoc, která by mohla souviset s postižením hypofýzy, jak dále rozvedeme v diskuzi.
Cílem následujícího popisu 3 případů je upozornit na málo známou skutečnost, že příčinou centrálního diabetes insipidus může být maligní histiocytární onemocnění a že PET CT může odhalit extrakraniální projevy nemoci, která způsobila centrální diabetes insipidus.
Popisy případů
Kazuistika 1 – muž, narozený roku 1973
Muž, narozen roku 1973, měl jako první příznak nemoci diabetes insipidus v roce 2005 ve věku 27 let. Později byl zjištěn i hypogonadizmus. Byl sledován na endokrinologickém oddělení FN u sv. Anny v Brně. Uvádíme pouze endokrinologické výsledky, ostatní laboratorní nálezy byly bez pozoruhodností. Osmolalita/ S 282 mmol/ kg, ionty/ S – norma (výsledky jsou po terapii adiuretinem, výsledky bez terapie nejsou k dispozici). Testosteron 6,28 nmol/ l (10,40 – 52,40), FSH 1,9 U/ l (1,4 – 18,1), LH 1,9 U/ l (1,5 – 9,3), ostatní hypofýzární hormony v normě. Kortizol/ S < 5,5 nmol/ l (118,6 – 618), ACTH < 10 pg/ ml (0,0 – 46).
V březnu roku 2007 byla provedena excise a histologické vyšetření verukózních útvarů v perianální krajině a byla potvrzena kožní forma LCH.
V rámci iniciálního stanovení rozsahu postižení bylo v dubnu roku 2007 provedeno PET - CT vyšetření, které však vyjma zvýšené aktivity v oblasti perianální (SUV 8,6) nepotvrdilo další patologická ložiska.
Provedená vyšetření potvrdila pouze infiltraci perianální oblasti s verukózními morfami kolem anu a postižení CNS. Vzhledem k mladému věku jsme měli podezření, že paradontitida bude souviset také s histiocytózou. Naše podezření na současné poškození gingivy touto nemocí nebylo potvrzeno, nebylo však provedeno histologické vyšetření dásní s cíleným barvením na CD1a pozitivní buňky. Bez tohoto cíleného vyšetření není tato forma postižení dásní diagnostikovatelná.
Vzhledem k tomu, že 2 chlordeoxyadenosin (2 - CDA) prochází i do CNS v účinných koncentracích, byly podány 4 cykly 2 - CDA a provedena radioterapie cílená na infiltraci perianální krajiny v dávce 20 Gy. Léčba byla ukončena v červenci roku 2007. Uvedené 4 cykly 2 - CDA vedly k vymizení infiltrátu v oblasti stopky hypofýzy, jak potvrdily MR kontroly (obr. 1 – 4), ale sekrece antidiuretického hormonu se neobnovila. Poškození této oblasti je zřejmě u pacienta nevratné. Při poslední kontrole v květnu roku 2009 je pacient 22 měsíců (rok a 10 měsíců) od ukončení léčby bez recidivy nemoci se zcela negativním PET - CT nálezem.
Image 1. Kulovité zbytnění, infiltrace stopky hypofýzy při Langerhansově histiocytóze, se sycením kontrastní látkou. Řez v koronární rovině, T1 vážený MR obraz po aplikaci k. l. 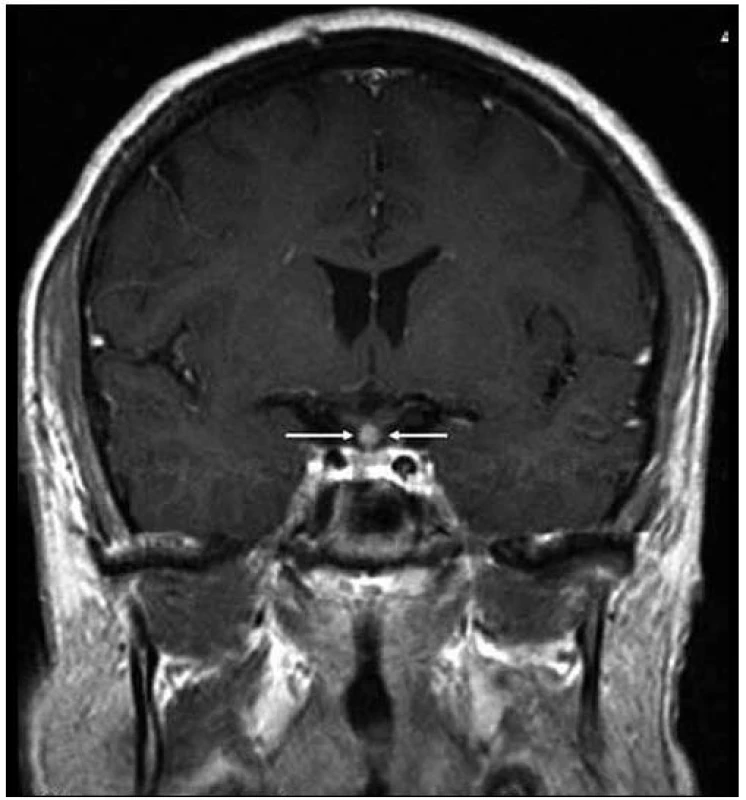
Image 2. Kulovité zbytnění, infiltrace stopky hypofýzy při Langerhansově histiocytóze, se sycením kontrastní látkou. Řez v sagitální rovině, T1 vážený MR obraz po aplikaci k. l. 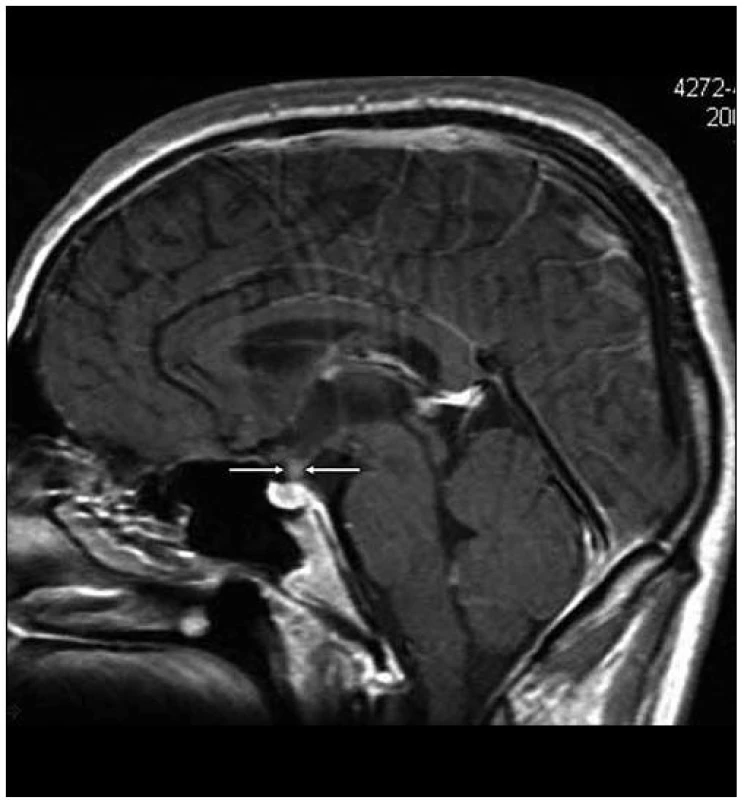
Image 3. Stejná rovina vyšetření jako na obr. 1, ústup zbytnění stopky hypofýzy po léčbě Langerhansovy histiocytózy, v MR obraze ad normam. 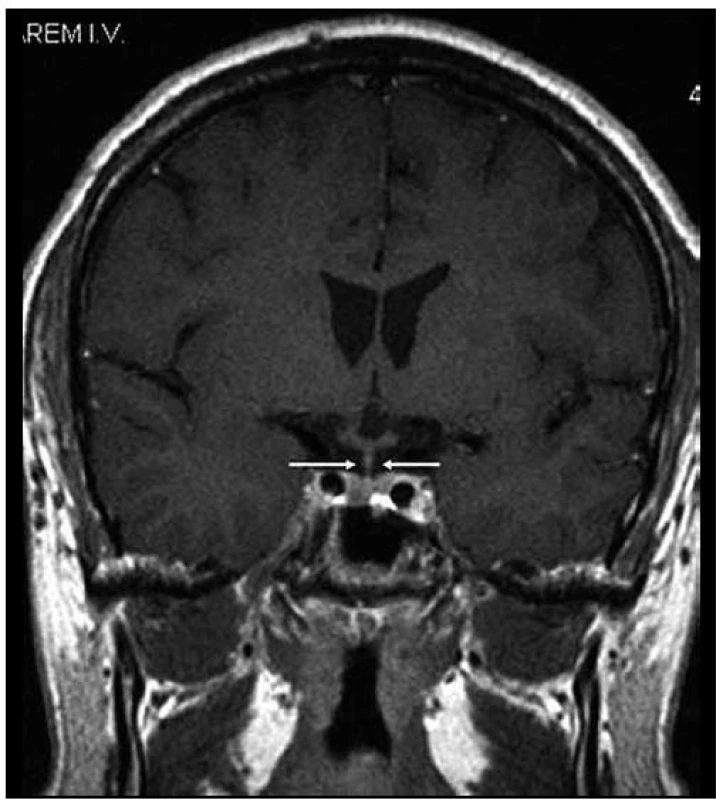
Image 4. Stejná rovina vyšetření jako na obr. 2, ústup zbytnění stopky hypofýzy po léčbě Langerhansovy histiocytózy, v MR obraze ad normam. 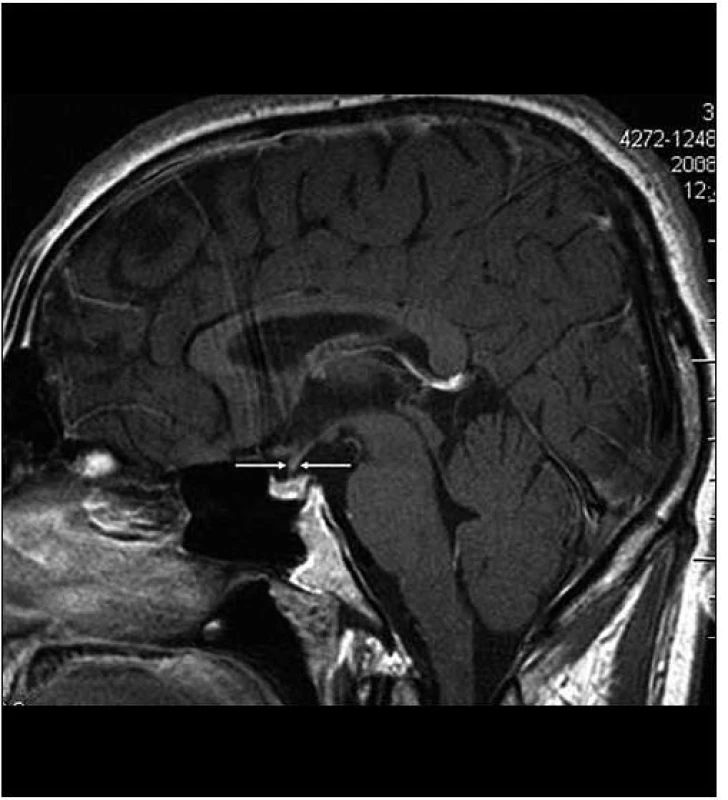
Kazuistika 2 – muž, narozený roku 1974
Muž, narozený roku 1974, byl až do roku 2007 zcela zdráv. Na podzim náhle začaly potíže – zvýšená žízeň a celková tělesná slabost, pro které byl vyšetřován v endokrinologické ambulanci FN u sv. Anny Brno a v prosinci roku 2007 byl diagnostikován parciální centrální diabetes insipidus a centrální hypogonadizmus.
Uvádíme pouze endokrinologické výsledky, ostatní laboratorní nálezy byly bez pozoruhodností. Osmolalita/ S 297 ... 296 mmol/ kg, Na/ S 142 … 147 … 145 … 146 mmol/ l (výsledky nejsou učebnicové, ale bude to asi tím, že se jednalo o parciální centrální diabetes insipidus). Testosteron 7,56 nmol/ l (9,90 – 27,80), FSH 6,2 U/ l (1,4 – 18,1), LH 5,6 U/ l (1,5 – 9,3). Ostatní hypofyzární hormony v normě.
Při prvním MR vyšetření nebyl prokázán jednoznačný infiltrát v oblasti infundibula hypofýzy (obr. 5 – 7). Teprve kontrolní MR zobrazení, provedené o sedm měsíců později, prokázalo patologickou infiltraci (obr. 8, 9).
Image 5. Při MR vyšetření v březnu roku 2008 byla patrná absence normálního hypersignálu v T1 váženém obraze, obvykle patrná v oblasti neurohypofýzy, a ložiskové zbytnění tkáně zde. Stopka hypofýzy byla v té době normální. T1 vážený MR obraz po aplikaci kontrastní látky ukazuje spíše normální vzhled stopky hypofýzy, snad jen nepatrné sporné zesílení v koronární rovině v březnu roku 2008. 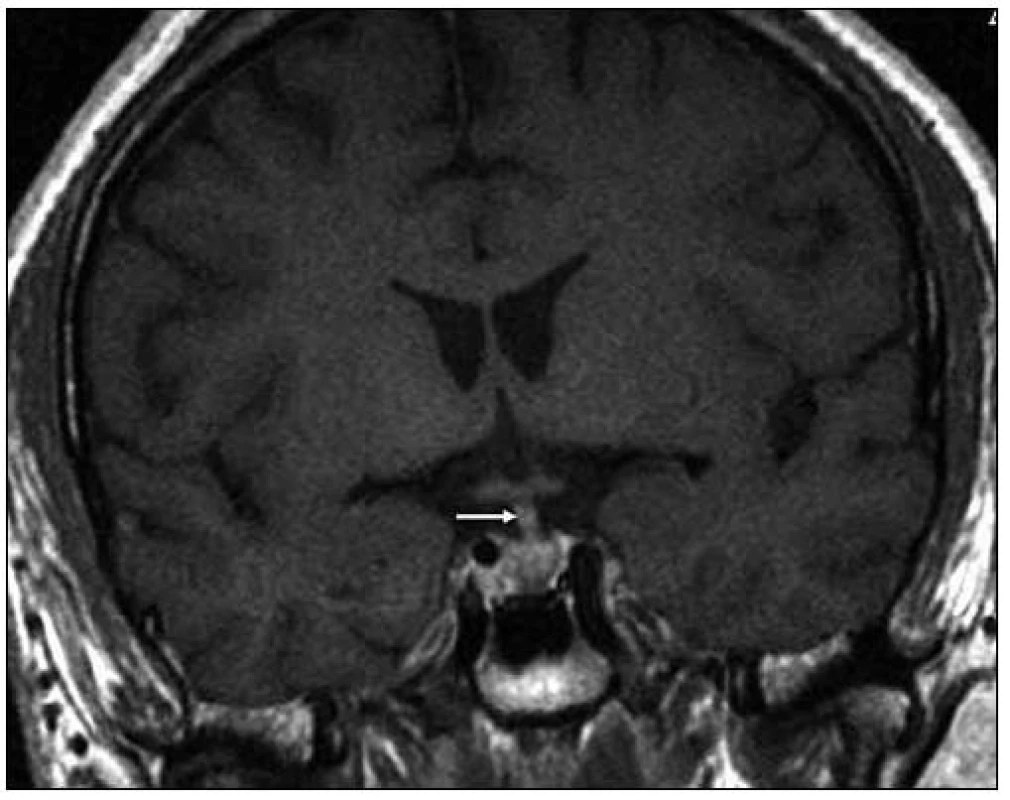
Image 6. MR vyšetření, T1 vážený obraz ukazuje sagitální rovinu téhož vyšetření. Je patrný rovněž normální vzhled stopky, chybí však normální hypersignální tkáň neurohypofýzy, na jejím místě je nejasný ložiskový infiltrát. 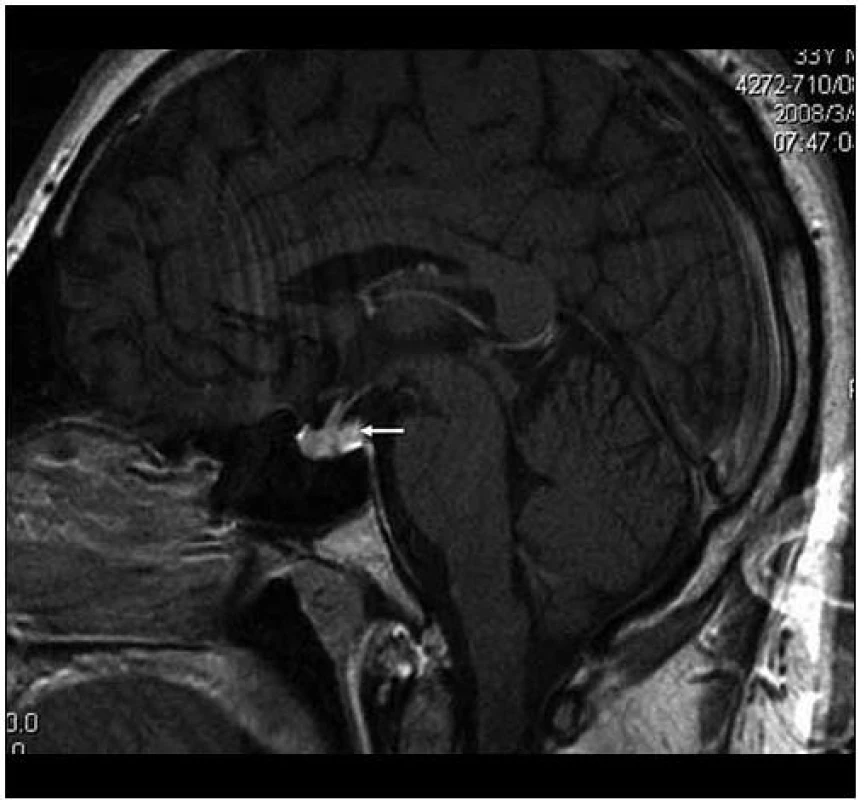
Image 7. Ukazuje tentýž pohled v T2 váženém MR obraze a sagitální rovině jako na obr. 6. 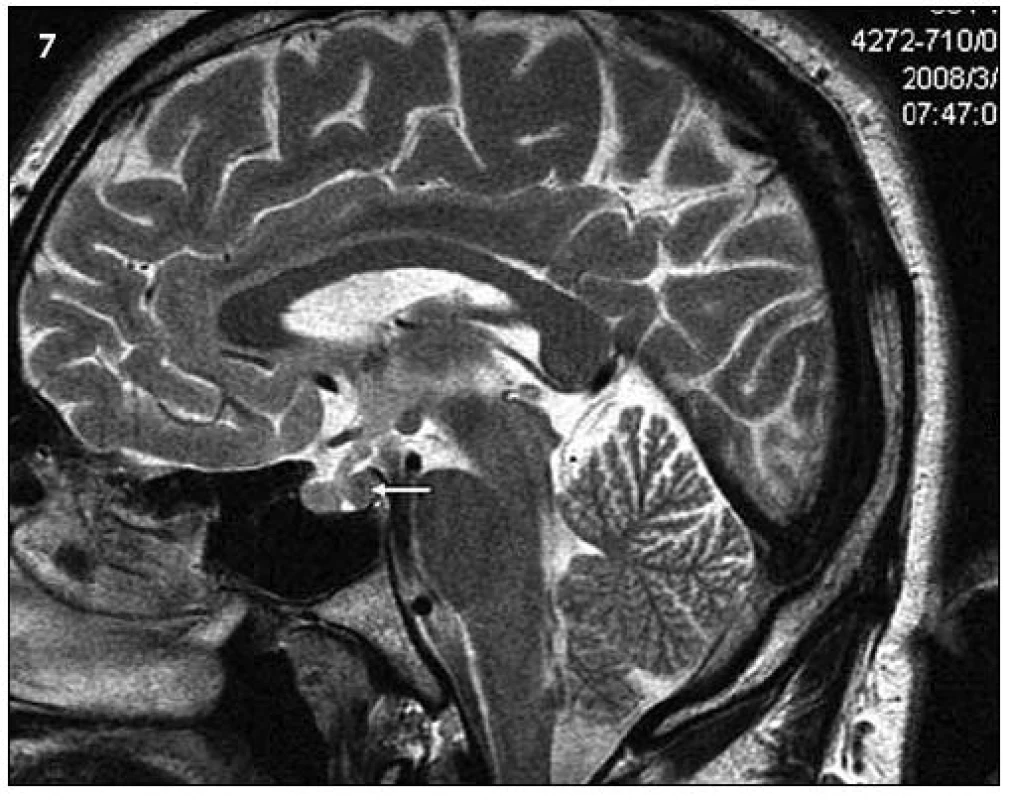
Image 8. Kontrolní MR vyšetření za 9 měsíců (T1 vážený MR obraz po aplikaci kontrastní látky – v koronární rovině), došlo prokazatelně k ložiskové infiltraci stopky hypofýzy a původní infiltrát v oblasti neurohypofýzy se mění, je jakoby lehce zmenšený. Čili ložisková infiltrace stopky se vytvořila v období mezi vyšetřeními. 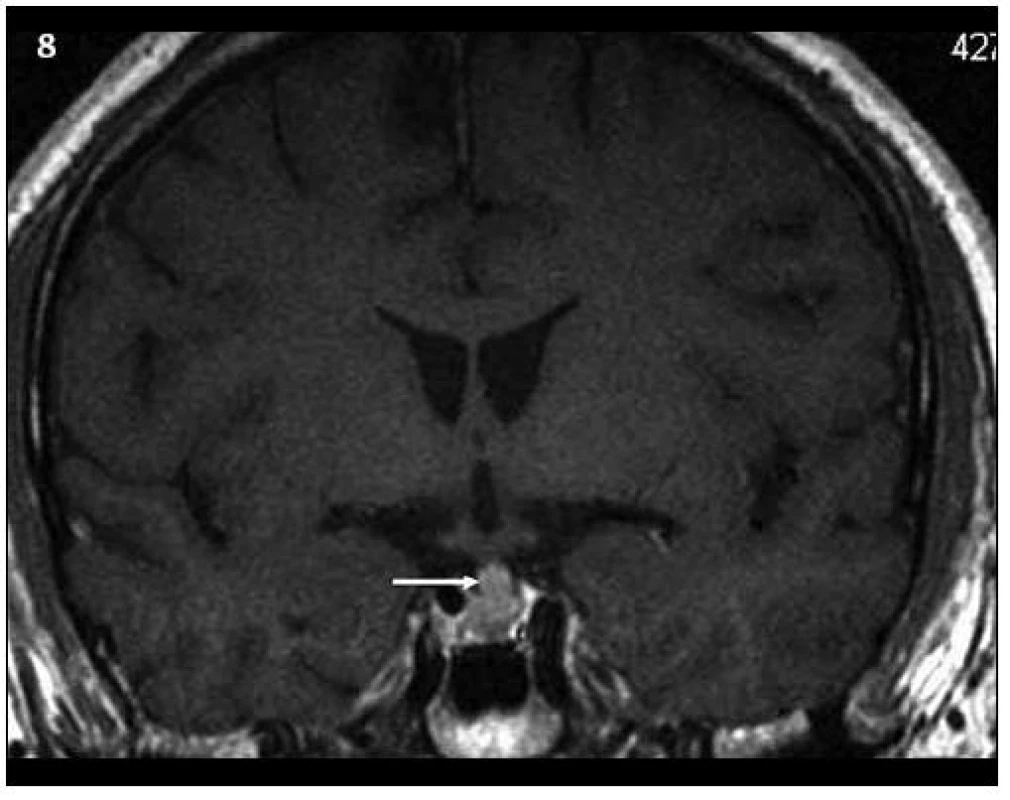
Image 9. Kontrolní MR vyšetření za 9 měsíců od prvního (T1 vážený MR obraz po aplikaci kontrastní látky – v sagitální rovině), kdy došlo prokazatelně k ložiskové infiltraci stopky hypofýzy a původní infiltrát v oblasti neurohypofýzy se mění, je jakoby lehce zmenšený. Čili ložisková infiltrace stopky se vytvořila v období mezi vyšetřeními. 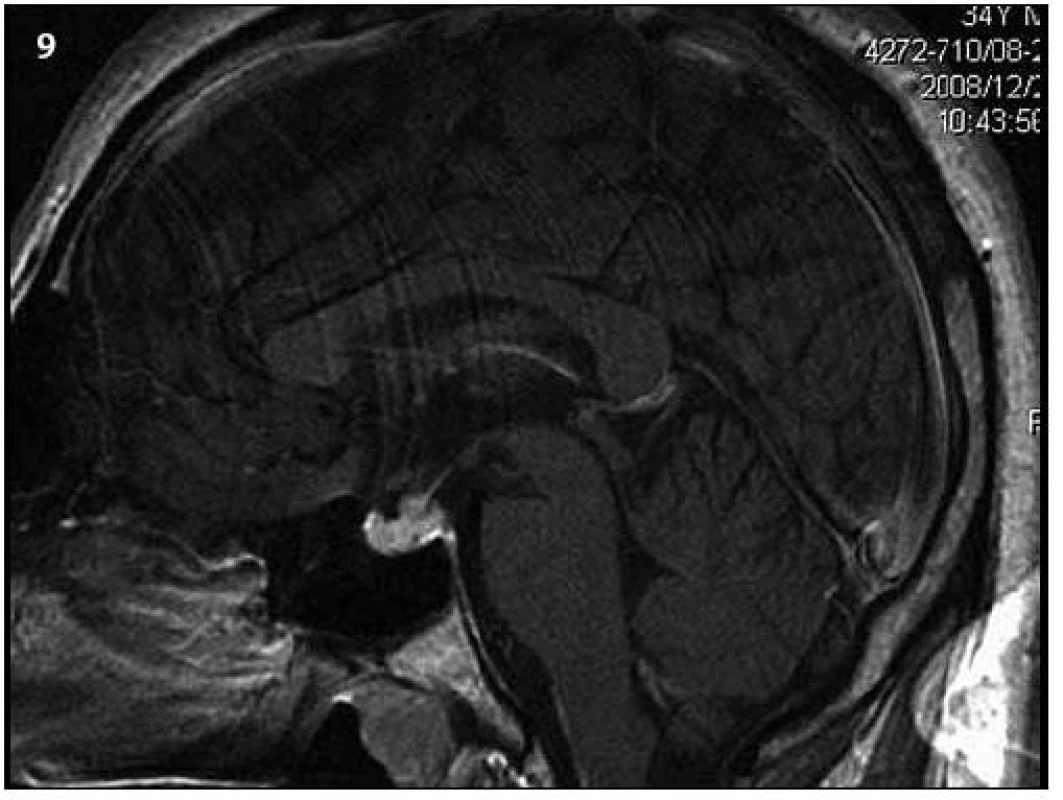
Dalším zdravotním problémem, který vznikl současně s diabetes insipidus, byl oboustranný výtok z uší. Byl ošetřován na ORL v místě bydliště s diagnózou otitis externa, zatím bez histologického vyšetření, přičemž chronický zánět zevního zvukovou je jedním z typických projevů histiocytózy z Langerhansových buněk.
V rámci diferenciálně diagnostickérozvahy byly hledány extrakraniální příznaky nemocí, které by mohly kauzálně souviset s diabetes insipidus, a proto bylo provedeno PET CT vyšetření. Vý-sledek PET CT nasměroval další dia-gnostický proces, a proto jej zde v celémrozsahu uvádíme.
CT zobrazení: V lokalitě infundibula náznak hypodenzního ložiska velikosti 1 cm. V maxilárních dutinách ohraničené hypodenzní struktury typu polypů do 2 cm. Na krku bez patologie. Oboustranně v plicním parenchymu převážně v horních lalocích a více na periferii jsou mnohočetné drobné cystické struktury různého tvaru, velikosti 0,5 – 0,9 mm, některé s poměrně dobře vyznačenou stěnou. Současně jsou patrné menší acinární opacity a okrsky zesíleného intersticia. Pleurální prostor bez výpotku, v mediastinu nejsou zvětšené uzliny, v pravém hilu uzliny do 1,1 cm. Hraniční šířka až lehce rozšířené pravé srdeční oddíly a truncus pulmonalis. Játra nezvětšená, jsou v nich 3 – 4 drobné útvary, které imponují jako cysty, orgány v pánvi a lymfatické uzliny bez patologie. Na skeletu žádné strukturální změny. PET bez patologického ložiska, lehce zvýšená aktivita v oblasti nosohltanu, což nelze jednoznačně hodnotit.
Pro podezření na plicní formu histio-cytózy z Langerhansových buněk odeslán na I. kliniku TRN 1. LF UK a VFN Praha, kde provedli bronchoalveolární laváž. V aspirované tekutině zjištěna zvýšená celková buněčnost a 10 % CD1aa také S100 pozitivních elementů. Tento nález potvrdil histiocytózu z Langerhansových buněk.
Vzhledem k tomu, že jde o kombinované postižení CNS a plic, plánujeme zahájit léčbu 2 chlordeoxyadenosinem (2 - CDA). Zatím však bylo zahájení léčby odloženo, protože mladý muž chce mít děti a stanovení diagnózy jej zastihlo právě v době procesu in vitro fertilizace.
Tč. se alespoň po domluvě s ORL lékaři pokusíme upřesnit původ ušních potíží, průběh by odpovídal postižení této oblasti histiocytózou, ale je třeba histologické verifikace.
Kazuistika 3 – muž narozený roku 1965
Muž narozený roku 1965 byl až do roku 2004 (do svých 39 let) zcela zdráv. V roce 2004 byl zjištěn centrální diabetes insipidus. První CT vyšetření sice údajně neprokázalo infiltraci hypofýzy, ale v roce 2005 se objevila typická infiltrace infundibula hypofýzy. Uvádíme pouze endokrinologické výsledky: osmolalita 322 mmol/ kg, Na 147 mmol/ l. Moč: osmolalita 72 mmol/ kg. Hypofyzární hormony při prvním vyšetření v normě. Následně byla provedena biopsie stopky hypofýzy, jejíž výsledek byl nespecifický, navíc po biopsii došlo k rozvoji kompletního panhypopituitarizmu s nutností substituční terapie.
Hormony: FSH 1,9 U/ l (1,4 – 18,1), LH 2,1 U/ l (1,5 – 9,3), testosteron2,34 nmol/ l (10,4 – 52,4), tyreotropin1,17 mU/ l (0,32 – 5,00), fT4 7,71 pmol/ l (9,14 – 23,81), kortizol ráno 110,3 nmol/ l(118,6 – 618), adrenokortikotropin< 10,0 pg/ ml (0,0 – 46), růstový hormon < 0,12 mU/ l (0,28 – 22,10).
Jinak v následujících čtyřech letech při substituční léčbě žil zcela spokojeně a bez dalších příznaků nemoci. Teprve v roce 2008 se objevily nové příznaky nemoci – neurologické potíže s lehkou pravostrannou hemiparézou.
Výsledek PET CT nasměroval další diagnostický proces, a proto jej zde v celém rozsahu uvádíme.
CT zobrazení: Zesílené měkkotkáňové struktury v levém maxilárním sinu, vzhledem ke sklerotickým změnám okolního skeletu suspektní infiltrace. Zřetelná sklerotizace mediální části levé jařmové kosti a suspektní přesah patologických změn na baze orbit. Plicní parenchym a mediastinum v normě, místy pleurální změny. V břiše zvýšení denzity perirenálního tuku, zneostření kontur ledvin, bez lymfadenopatie. Cirkulární zesílení stěny břišní aorty místy až na 8 mm, méně výrazný je nález na hrudní aortě a na společných ilických tepnách. Struktura skeletu je zřetelně nepravidelná, s nápadnými sklerotickými ložisky, místy v terénu prořídlé struktury (zřetelné zesílené skeletu levé maxilární dutiny a jařmové kosti vlevo, hlavic obou humerů a těla obratle Th4, obou lopat kyčelních, vlevo v blízkosti sakroiliakálního skloubení, levé kosti stydké, levé sedací kosti). Je výrazné postižení skeletu obou dolních končetin, výrazně nepravidelná, převážně sklerotická struktura diafýz dlouhých kostí dolních končetin. FDG PET sken prokázal difuzně zvýšenou aktivitou fluorodeoxyglukózy (FDG) v místech CT strukturálních změn skeletu (levá maxila – SUV 8,9; Th4 – SUV 2,6; strop acetabula – SUV 3,0; sakroiliakální spojení – SUV 2,4; trochanter vpravo – SUV 3,8. Zvýšená kumulace FDG také v zesílených stěnách hrudní a bederní aorty.
Zvýšená kumulace v dlouhých kostech a na pánvi byla zřetelná i při scintigrafii skeletu technecium pyrofosfátem. Trepanobiopsie ložiska v lopatě kosti pánevní prokázala přítomnost pěnitých histiocytů s expresí CD antigenů odpovídající Erdheimově Chesterově nemoci.
V tomto případě se však později objevily i další infiltrace v mozku. K nám byl poslán z endokrinologie pro suspektní LCH. Všech výsledky (zobrazení skeletu s typickou zvýšenou aktivitou techneciumpyrofosfátu v dlouhých kostech a zřetelným zesílením kortikalis na RTG snímcích, fibrotické změny v retroperitoneu, nález pěnitých histiocytů – foamy histiocytes – v kostní dřeni) odpovídaly Erdheimově Chesterově nemoci, o níž jsme již referovali.
Opět jsme zvolili vstupně sběr hemopoetických kmenových buněk z periferní krve po stimulačním režimu cyklofosfamid + etoposid a zahájili léčbu 2 chlordeoxyadenosin (2 – CDA), zpočátku v monoterapii 5 mg/ m2 s.c. 5 dní po sobě, po 3. cyklu bylo provedeno kontrolní MR zobrazení. Vzhledem k tomu, že pouze jedno ložisko v mozku regredovalo a ostatní zůstala beze změny, byla pro další tři cykly použita kombinace uvedené dávky CDA + 300 mg cyklofosfamidu a 24 mg dexamazonu i.v. po 5 dní. Efekt této modifikace zatím čeká na zhodnocení. Dle pacienta je menší slabost pravostranných končetin. Jedenkrát měsíčně je aplikován zoledronát.
Diskuze
Diferenciální diagnostika centrálního diabetes insipidus, nefrogenního diabetes insipidus a psychogenní polyurie
U člověka je antidiuretickým hormonem arginin vazopresin. V přítomnosti ADH jsou sběrné kanálky nefronu propustné pro vodu a může se uplatnit osmotický tlakový gradient mezi intersticiem dřeně ledviny se zvýšenou osmolalitou a hypoosmolární tekutinou ve sběrných kanálcích. Účinek vazopresinu je v ledvinách zprostředkován V2 receptorem. Komplex ADH s V2 receptorem aktivuje přeměnu ATP na cAMP, který vede ve finále k aktivaci vodního kanálu aquaporinu 2 (AQP 2), zajišťujícího rychlý průnik vody [7].
Nefrogenní diabetes insipidus se projevuje necitlivostí či sníženou citlivostí distálního úseku nefronu na ADH. Nemoc se tedy projevuje vodní polyurií, která nereaguje na ADH, resp. DDAVP. Vrozené formy se manifestují v raném dětském věku. Získaná forma vzniká na podkladě postižení tubulárních buněk. Možné příčiny jsou některá farmaka a dále patologické stavy elektrolytového metabolizmu (tab. 1). Většinou se ale nejedná o izolovanou poruchu citlivosti tubulárních buněk na ADH, nýbrž o součást širší tubulární dysfunkce typu např. Fanconiho syndromu.
Table 1. Zevní příčiny renálního diabetes insipidus. 
Lithium se hromadí v tubulárních buňkách sběrných kanálků a snižuje účinnost ADH patrně snížením exprese aquaporinu 2. Snížením exprese AQP2 se vysvětluje i vznik nefrogenního diabetes insipidus při hypokalemii. Při léčbě nefrogenního diabetes insipidus se zkouší thiazidová diuretika a omezený přísun soli. Principem je zmenšit objem ECT, a tím zvýšit tubulární resorpci sodíku a vody v proximálním tubulu. V této části tubulu není resorpce vody závislá na ADH.
U centrální formy diabetes insipidus je nutno odlišit psychogenní (primární) polydipsii, která je způsobena velkým příjmem vody a fyziologickým potlačením produkce ADH. Jedinci s psychogenní polydipsií nemívají známky dehydratace. Sérová osmolarita a koncentrace Na v séru bývá v normě nebo na dolní hranici normy a tito jedinci jsou schopni vytvářet moč, jejíž osmoralita převyšuje osmolaritu séra.
Funkční testy, které se používají v diferenciální diagnostice, jsou jednak noční odnětí tekutin na 12 hod a jednak test s exogenním podáním ADH. Obvykle používáme DDAVP v dávce 10 μg intranazálně (dvě kapky do každého nosního průduchu), ev. 4 μg intramuskulárně. V obou typech testů se měří a porovnává U - osm (tab. 2). Test s nočním odnětím tekutin provádíme jen u jedinců, jejichž 24hodinová diuréza nepřesahuje 5 litrů, abychom nezpůsobili iatrogenní dehydrataci [8,9].
Table 2. Diferenciální diagnostika polyurie. Podle [8]. ![Diferenciální diagnostika polyurie. Podle [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7abfe2852388f09eb786c1b79d84c871.jpg)
Histopatologické složení hypofýzy
Hypofýza je uložená v tureckém sedle a sestává z předního laloku – adenohypofýzy a zadního laloku – neurohypofýzy. Adenohypofýza je epiteliálního původu, vzniká vzestupem orgánového základu ze stropu hltanu (z Rathkeho výchlipky). Stopka hypofýzy vzniká z ventromediálního hypotalamu a je vlastně výběžkem hypotalamu. Adenohypofýza se vyznačuje acinárním uspořádáním, jednotlivé buněčné typy jsou definovány na základě hormonální produkce: buňky somatotropní, kortikotropní, tyreotropní, laktotropní a gonadotropní.
Neurohypofýza je neuroektodermál-ního původu, je tvořená specializovanou nervovou tkání sestávající z modifikovaných gliových buněk označovaných jako pituicyty a z axonálních zakončení hypotalamohypofyzárních drah z neuronů supraoptických a paraventrikulárních jader hypotalamu produkujících oxytocin a vazopresin, které jsou axonálním transportem neseny na místo sekrece, tj. do neurohypofýzy.
Nejčastějšími hypofyzárními tumory jsou adenomy hypofýzy představující benigní epitelové nádory adenohypofýzy. Karcinomy adenohypofýzy jsou velmi vzácné. V neurohypofýze se vzácně vyskytují gangliocytomy, low grade astrocytomy neurohypofýzy, tzv. pituicytomy a histogeneticky nejasné nádory z granulárních buněk.
Z extrakraniálních nádorových chorob mají histiocytární choroby speciální afinitu k hypotalamu a hypofýze. Nejčastější to bývá histiocytóza z Langerhansových buněk u dětí, méně často je tomu u dospělých a zcela výjimečně i další vzácné histiocytární choroby infiltrují hypotalamus a stopku hypofýzy – Erheimova Chesterova choroba a xantogranulom (tab. 3).
Table 3. Příčiny centrálního diabetu insipidus. Volně upraveno dle [93]. ![Příčiny centrálního diabetu insipidus. Volně upraveno dle [93].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2beb4eb1583abfd47d805ba6e30835bf.jpg)
Zobrazení normální stopky hypofýzy a patologické nálezy
Normální stopka hypofýzy se nálevkovitě zužuje, v úrovní chiasma opticum měří kolem 3 mm a při vyústění do hypofýzy jen 1 – 2 mm. Intenzita signálu z normální stopky hypofýzy v T1 váženém MR obraze je obvykle nižší než u chiasma opticum a nižší než u neurohypofýzy. Stopka nemá vyvinutou hematocefalickou bariéru a má relativně vysoký signál v T1 váženém obraze. Deviace infundibula může být fyziologická, nemusí tedy vždy znamenat patologii. Normálně je v T1 váženém MR obraze hyperintenzní signál zadního laloku hypofýzy – neurohypofýzy, předpokládá se, že je to způsobeno neurosekrečními granuly vazopresinu a lipoidními částicemi (lysozomy) v pituicytech, které jsou uloženy převážně v neurohypofýze.
Nejčastějším MR nálezem u nemocných s centrálním diabetes insipidus, nezávisle na histologickém typu infiltrátu, je ztráta fyziologického hyperintenzivního signálu z oblasti neurohypofýzy v T1 váženém obraze, zesílení a infiltrace stopky hypofýzy a případně hypotalamická patologická ložiska [10,11]. Tento nález však bývá popisován také u germinomů [12 – 18].
Možné příčiny centrálního diabetes insipidus
Primární CNS tumory a diseminace extracerebrálních neoplazií
Choroby, které mohou způsobit centrální diabetes insipidus a vést k zesílené stopky hypofýzy, uvádíme v tab. 3. U dětí tvoří primární mozkové tumory asi 50 % případů centrálního diabetes insipidus, u dospělých je tento počet podstatně nižší, maximálně 30 % [18 – 28]. U dětí mohou být příčinou také vrozené malformace CNS [29,30].
Oproti dětské populaci jsou však u dospělých častější případy, kdy primární extrakraniální maligní choroba metastazuje do CNS a způsobí centrální diabetes insipidus. Opakovaně tyto případy byly popsány u karcinomu prsu [31 – 35], karcinomu plic [36 – 38] a také u karcinomu ledviny [34,39] a u medulárního karcinomu štítné žlázy [40]. V CNS, a tedy i v oblasti hypofýzy jak u dětí, tak u dospělých se mohou vyskytnout germinální tumory [41].
Ale i maligní lymfomy a leukemie občas při diseminaci způsobí centrální diabetes insipidus [42 – 46] a zcela výjimečně i plazmocytom [47].
Afinita histiocytárních chorob k hypotalamu a stopce hypofýzy
Poměrný výskyt diabetes insipidus u pa-cientů s lymfomy a leukemiemi je však podstatně nižší než poměrný výskyt centrálního diabetes insipidus u pacientů s histiocytárními chorobami, které mají zatím nevysvětleně vysokou afinitu k hypotalamu a ke stopce hypofýzy. Centrální diabetes insipidus je dominujícím příznakem formy histiocytózy z Langerhansových buněk. Tuto formu starší literatura nazývala Handova - Schüllerova - Christianova nemoc (tab. 4). Učebnice tuto formu nemocipřiřazují dětskému věku, protože v tomtověku je mnohem častější než u dospělých [48 – 50]. Centrální diabetes insipidus se může objevit jako první příznak histiocytózy z Langerhansových buněk i u dospělých, jak je patrno z popisovaných případů i citované literatury [22,51 – 58]. Infiltrace stopky hypofýzyněkdy je na MR zobrazení zřetelná ihnedzpočátku nemoci, jindy se infiltrát stopkyhypofýzy odhalí až při kontrolním vyšetření po určitém čase od prvních příznaků centrálního diabetes insipidus [59 – 65].
Table 4. Klasické formy histiocytózy z Langerhansových buněk. 
Erdheimova Chesterova nemoc patřído skupiny xantogranulomatózních histiocytóz, pro které jsou typické pěnité histiocyty. I tato skupina histiocytárních chorob může postihnout CNS a opět je zde zřetelná afinita k hypothalamu a stopce hypofýzy [66 – 71].
Autoimunitní příčiny centrálního diabetes insipidus
Z oblasti autoimunitních chorob může stopku hypofýzy a hypofýzu poškodit lymfocytární hypofysitis, jejíž první projev může být diabetes insipidus [65,72 – 77] nebo diabetes insipidus následkem protilátek proti vazopresinu [12]. U autoimunitní etiologie je častá koincidence s jinými autoimunitními chorobami.
Granulomatózní choroby způsobující centrální diabetes insipidus
Výjimečným procesem, který může taképoškodit hypofýzu, je fibromatóza [78].
Také granulomatózní choroby se mo-hou projevit diabetes insipidus, v první řadě je nutno zmínit sarkoidózu, přičemž výjimečně může být diabetes insipidus prvním příznakem této nemoci [79 – 83]. Méně publikací je o diabetes insipidus ve spojení s Wegenerovou granulomatózou [84,85], a dokonce i s granulomatózní vaskulitidou Churgova - Straussova typu [86]. Z granulomatozních chorob je dále třeba zmínit i TBC.
Poškození mozku traumatem, zánětem a dalšími příčinami, které způsobí centrální diabetes insipidus
Z dalších příčin vedoucích k centrálnímu diabetes insipidus lze uvést záněty mozku (encefalitidy, meningitidy). Nezřídka vzniká centrální diabetes insipidus po úrazech a traumatech mozku. Při traumatickém původu jsou obvykle zřetelné tři fáze. Počáteční polyurie, která trvá několik hodin až dnů, je následována normalizací díky uvolnění ADH z poškozené tkáně a pak následuje trvalý diabetes insipidus, jehož úplnost závisí na rozsahu poškození tkáně.
Po chirurgickém odstranění suprasellárních tumorů nebo po transsfenoi-dálním hypofyzektomii vzniká poope-rační centrální diabetes insipidus až u 20 % nemocných (taktéž může mít třífázový průběh jako kraniotraumat). Nelze opomenout ani vaskulární etio-logii (aneuryzma, mozkový infarkt, krvácení do centrálního mozkového systému, Sheehanův syndrom) a syndrom prázdné selly [87,88].
Termín idiopatický diabetes insipidus se používá pro případy, kdy během pěti let sledování a vyšetřování není prokázána žádná z výše uvedených příčin centrálního diabetes insipidus.
Diferenciálně diagnostický postup
Příčiny diabetes insipidus mohou být tedy velmi pestré. Standardním postupem je v první linii MR zobrazení mozku se zaměřením na hypotalamus, infundibulum a stopku hypofýzy. Pokud se najde patologický infiltrát, je vždy zásadní zahájit pátrání, zda nejsou přítomny extrakraniální příznaky některého z výše uvedených onemocnění, které může způsobit postižení hypofýzy. Signifikantní zesílení stopky hypofýzy může být považováno za relativní indikaci k provedení biopsie a k histologickému ověření procesu. Provedení biopsie však není bez rizika, jak nakonec můžeme ilustrovat na 3. pacientovi, u něhož se po biopsii stopky hypofýzy rozvinul kompletní panhypopituarizmus, aniž by tento proces vedl ke stanovení diagnózy. Komplikace při tomto zákroku jsou popisovány jinými autory [89 – 92].
Proto považujeme za vhodnější pečlivé kompletní vyšetření s cílem detekovat extrakraniální projevy nemoci, které vedly k rozšíření stopky hypofýzy.
U našich nemocných chceme vyzvednout přínos PET CT vyšetření, které ve všech třech případech signalizovalo přítomnost patologického extrakraniálního procesu v těle, jehož histologické vyšetření pak vedlo ke stanovení diagnózy. V prvním případě byla aktivita fluorodeoxyglukózy vysoká v pouze v oblasti periánální (SUV 8,6), kde byl i makroskopicky zřetelný patologický infiltrát, jehož histologie prokázala histocytózu z Langerhansových buněk, jiné ložisko této nemoci nebylo v těle doposud odhaleno. Ve druhém případně PET CT metodou CT zobrazilo patologickou strukturu plic, typicky odpovídající plicní formě histiocytózy u Langerhansových buněk. Následná brochoalveolární laváž pak potvrdila diagnózu. Kumulace fluorodeoxyglukózy nedosahovala jednoznačně patologických hodnot, ale vyšší kumulace byla v oblasti nazofaryngu. Zda tato hraničně zvýšený kumulace FDG odpovídá zánětu nebo infiltraci ORL oblasti, ukážou další vyšetření. Připomínáme, že tento pacienta má diagnózu otitis externa s výtokem z obou uší a tyto potíže začaly ve stejnou dobu jako diabetes insipidus. Ve 3. případě PET CT zobrazilo četné patologické odchylky, mimo jiné i změny kostní struktury a zvýšené vychytávání glukózy v oblastech s patologickou změněnou kostní strukturou. Punkce lopaty kosti kyčelní trepanobioptickou jehlou a histologické vyšetření vzorku prokázalo patologickou infiltraci penitými histiocyty.
Závěr pro praxi
Považuje celotělové PET CT vyšetřeníoptimální postup při nálezu centrálního diabetes insipidus a infiltrace v oblastistopky hypofýzy, hypofýzy či hypotalamu. PET CT může prokázat extrakraniální manifestaci nemoci. Odběr vzorku z extrakraniálního patologického ložiska k histologickému vyšetření může stanovit diagnózu, a tedy i příčinu diabetes insipidus.
Tato práce vznikla a byla podporována v rámci projektu MŠMT: LC 06027 a VZ 0021622434.
prof. MU Dr. Zdeněk Adam, CSc.
www.fnbrno.cz
e mail: z.adam@fnbrno.czDoručeno do redakce: 23. 6. 2009
Přijato po recenzi: 17. 8. 2009
Sources
1. Dufka A, Šálek T. Recidivující synkopa jako vedoucí symptom u parciálního centrálního diabetu insipidu. Interní Med 2007;4 : 195 – 197.
2. Votava F. Diferenciální diagnostika polyurie a polydipsie. Čes Slov Pediat 2001; 56 : 655 – 659.
3. Loh JA, Verbalis JG. Disorders of water and salt metabolism associated with pituitary disease. Endocrinol Metab Clin North Am 2008; 37 : 213 – 234.
4. Müssig K, Beschorner R. Rare differential diagnosis of diabetes insipidus. Dtsch Med Wochenschr 2008; 133 : 2159 – 2160.
5. Saborio P, Tipton GA, Chan JC. Diabetes insipidus. Pediatr Rev 2000; 21 : 122 – 129.
6. Hamilton BE, Salzman KL, Osborn AG. Anatomic and pathologic spectrum of pituitary infundibulum lesions. AJR Am J Roentgenol 2007; 188: W223 – W232.
7. Reeves WB, Bichet DG, Andreoli TE. Posterior pituitary and water metabolism. In: Wilson JD (ed). Wiliam’s Textbook of Endocrinology. 9th ed. Philadelphia: W.B. Saunders 1998.
8. Tesař V, Schück O, Teplan V. Klinická nefrologie. Praha: Grada 2006.
9. Schück O. Poruchy metabolizmu vody a elektrolytů v klinické praxi. Praha: Grada 2000.
10. Prosch H, Grois N, Prayer D et al. Central diabetes insipidus as presenting symptom of Langerhans cell histiocytosis. Pediatr Blood Cancer 2004; 43 : 594 – 599.
11. Grois N, Prayer D, Prosch H et al. Course and clinical impact of magnetic resonance imaging findings in diabetes insipidus associated with Langerhans cell histiocytosis. Pediatr Blood Cancer 2004; 43 : 59 – 65.
12. Maghnie M, Ghirardello S, De Bellis A et al. Idiopathic central diabetes insipidus in children and young adults is commonly associated with vasopressin‑cell antibodies and markers of autoimmunity. Clin Endocrinol (Oxf) 2006; 65 : 470 – 478.
13. Czernichow P, Garel C, Léger J. Thickening of pituitary stalk on magnetic resonance imaging in children with diabetes insipidus. Horm Res 2000; 53 (Suppl 3): 61 – 64.
14. Roberts CC, Banks KP, Hesselink JR et al. Imaging of the pineal region and spine: self ‑ assessment module. AJR Am J Roentgenol 2006; 186 (Suppl 3): S224 – S226.
15. Samarasinghe S, Vokes T. Diabetes insipidus. Expert Rev Anticancer Ther 2006; 6 (Suppl 9): S63 – S74.
16. Sheen KC, Chang CC, Chang TC et al. Thickened pituitary stalk with central diabetes insipidus: report of 3 cases. J Formos Med Assoc 2001; 100 : 198 – 204.
17. Varan A, Cila A, Akyüz C et al. Radiological evaluation of patients with pituitary langerhans cell histiocytosis at diagnosis and at follow‑up. Pediatr Hematol Oncol 2008; 25 : 567 – 574.
18. Liška J. Klinické a hormonální nálezy u 27 dětí s centrálním diabetes insipidem. Vox Pediatriae 2007; 7 : 36 – 37.
19. Sinayová M, Kúseková M, Dorička A. Diabetes insipidus ako první příznaky panhypopituarismu. Čs Pediatr 2007; 62 : 341.
20. Gomboš V, Semanová Z, Rosenberger J et al. Mikroadenom hypofýzy s klinickým obrazem hypopituarismu a diabetes insipidus komplikovaný akutnou renálnou insuficiencí. Aktuality v nefrologii 2007; 13 : 164.
21. Prosch H, Grois N, Bökkerink J et al. Central diabetes insipidus: Is it Langerhans cell histiocytosis of the pituitary stalk? A diagnostic pitfall. Pediatr Blood Cancer 2006; 46 : 363 – 366.
22. Demaerel P, Van Gool S. Paediatric neuroradiological aspects of Langerhans cell histiocytosis. Neuroradiology 2008; 50 : 85 – 92.
23. Ghirardello S, Garrè ML, Rossi A et al. The diagnosis of children with central diabetes insipidus. J Pediatr Endocrinol Metab 2007; 20 : 359 – 375.
24. Ghirardello S, Malattia C, Scagnelli P et al. Current perspective on the pathogenesis of central diabetes insipidus. J Pediatr Endocrinol Metab 2005; 18 : 631 – 645.
25. Scheithauer BW, Kovacs K, Horvath E et al. Pituitary blastoma. Acta Neuropathol 2008; 116 : 657 – 666.
26. Yap L, Crooks D, Warnke P. Low grade astrocytoma of the pituitary stalk. Acta Neurochir (Wien) 2007; 149 : 307 – 311.
27. Zachariah S, Byrne P, Hyer S. Adult ‑ onset diabetes insipidus caused by congenital midline brain abnormalities. Br J Hosp Med (Lond.) 2008; 69 : 227.
28. Zhang HW, Sun W, Yang J et al. Diagnosis and treatment of pituitary microadenoma: report of 80 cases. Neurol Res 2008; 30 : 587 – 593.
29. Vosáhlo J, Kolská M, Lebl J. Diabetes insipidus u chlapce s vrozenou anomalií CNS. Diabet Metabol Endokrin Výž 2001; 4 : 47.
30. Mohn A, Fahlbusch R, Dörrr HG. Panhypopituarismus associated with diabetes insipidus in a girl with suprasellar arachnoid cyst. Horm Res 1999; 52 : 35 – 38.
31. Bobilev D, Shelef I, Lavrenkov K et al. Diabetes insipidus caused by isolated intracranial metatstases in patient with breast cancer. J Neurooncol 2005; 73 : 39 – 42.
32. Sturm I, Kirschke S, Krahl D et al. Panhypopituitarism in a patient with breast cancer. Onkologie 2004; 27 : 480 – 482.
33. Dogan M, Karakilic E, Zorlu F et al. Breast cancer with diabetes insipidus. Exp Oncol 2008; 30 : 324 – 326.
34. Gołkowski F, Trofimiuk M, Czepko R et al. Two rare cases of pituitary metastases from breast and kidney cancers. Exp Clin Endocrinol Diabetes 2007; 115 : 537 – 540.
35. Lin CS, Lin SH, Chiang YH et al. Diabetes insipidus revealing an isolated pituitary stalk metastasis of breast cancer. Eur J Neurol 2007; 14: e11 – e12.
36. Alacacioğlu A, Oztop I, Fidan F et al. Diabetes insipidus caused by pituitary gland metastasis accompanied by iris metastasis of small cell lung cancer: case presentation and review of the literature. Tumori 2008; 94 : 765 – 768.
37. Guillén Ponce C, Garrido López MP, Molina Garrido MJ et al. Panhypopituitarism as first manifestation of a lung cancer. Clin Transl Oncol 2007; 9 : 53 – 55.
38. Harzallah L, Migaw H, Harzallah F et al. Diabetes insipidus and panhypopituitarism revealing pituitary metastasis of small cell lung carcinoma: a case report. Ann Endocrinol (Paris) 2005; 66 : 117 – 120.
39. Gopan T, Toms SA, Prayson RA et al. Symptomatic pituitary metastases from renal cell carcinoma. Pituitary 2007; 10 : 251 – 259.
40. Williams MD, Asa SL, Fuller GN. Medullary thyroid carcinoma metastatic to the pituitary gland: an unusual site of metastasis. Ann Diagn Pathol 2008; 12 : 199 – 203.
41. Crawford JR, Santi MR, Vezina G et al. CNS germ cell tumor (CNSGCT) of childhood: presentation and delayed diagnosis. Neurology 2007; 68 : 1668 – 1673.
42. Megan Ogilvie C, Payne S, Evanson J et al. Lymphoma metastasizing to the pituitary: an unusual presentation of a treatable disease. Pituitary 2005; 8 : 139 – 146.
43. Kozáková D, Macháleková K, Brtko P et al. Primary B ‑ cell pituitary lymphoma of the Burkitt type: case report of the rare clinic entity with typical clinical presentation. Čas Lék Čes 2008; 147 : 569 – 573.
44. Chang ET, Ju SC, Lee KF et al. Central diabetes insipidus and monosomy 7 in myeloid crisis of chronic myeloid leukemia. Leuk Lymphoma 2006; 47 : 1407 – 1408.
45. Otrock ZK, Salti I, Merheb M et al. Diabetes insipidus and thrombocytosis as the presenting symptoms of acute myeloblastic leukemia with monosomy 7. Am J Hematol 2006; 81 : 152 – 153.
46. Piccin A, Raimondi R, Laspina S et al. Erythroleukaemia, diabetes insipidus and hypophyseal damage: Two case reports. Leuk Res 2007; 31 : 1135 – 1139.
47. Sinnott BP, Hatipoglu B, Sarne DH. Intrasellar plasmacytoma presenting asa non‑functional invasive pituitary macro‑-adenoma: case report & literature review. Pituitary 2006; 9 : 65 – 72.
48. Mottl H, Koutecký J, Ganevová M. Strategie léčby histiocytózy z Langerhansových buněk u dětí. Čes Slov Pediatr 1994; 49 : 81.
49. Mottl H, Mracek J, Kabelka Z et al. Histiocytóza z Langerhansových buněk u dětí. Čs Pediatr 1992; 47 : 530 – 533.
50. Mottl H, Starý J. Histiocytóza z Langerhansových buněk u dětí – klinická diagnostika a současná léčba. Čes Slov Pediatr 2007; 62 : 220 – 225.
51. D’Ambrosio N, Soohoo S, Warshall C et al. Craniofacial and intracranial manifestations of langerhans cell histiocytosis: report of findings in 100 patients. AJR Am J Roentgenol 2008; 191 : 589 – 597.
52. Grois N, Pötschger U, Prosch H et al. Risk factors for diabetes insipidus in langerhans cell histiocytosis. Pediatr Blood Cancer 2006; 46 : 228 – 233.
53. Horn EM, Coons SW, Spetzler RF et al. Isolated Langerhans cell histiocytosis of the infundibulum presenting with fulminant diabetes insipidus. Childs Nerv Syst 2006; 22 : 542 – 544.
54. Mahnel R, Tan KH, Fahlbusch R et al. Problems in differential diagnosis of non Langerhans cell histiocytosis with pituitary involvement: case report and review of literature. Endocr Pathol 2002; 13 : 361 – 368.
55. Amato MC, Elias LL, Elias J et al. Endocrine disorders in pediatric – onset Langerhans Cell Histiocytosis. Horm Metab Res 2006; 38 : 746 – 751.
56. Ouyang DL, Roberts BK, Gibbs IC et al. Isolated Langerhans cell histiocytosis in an adult with central diabetes insipidus: case report and review of literature. Endocr Pract 2006; 12 : 660 – 663.
57. Adam Z, Pour L, Krejčí M et al. Histiocytóza z Langerhansových buněk u osob dospělého věku nemoc s mnoha tvářemi. Zkušenosti jednoho pracoviště a přehled projevů nemocióza. Vnitř Lék 2008; 54 : 1063 – 1081.
58. Ščudla V, Roček V, Dušek B et al. Multifokální eozinofilní granulom v dospělosti. Vnitř Lék 1987; 33 : 1078 – 1086.
59. Halefoglu AM. Magnetic resonance imaging of thickned pituitary stalk proceeding to Langerhans cell histiocytosis in a child. Australas Radiol 2006; 50 : 175 – 178.
60. Makras P, Alexandraki KI, Chrousos GP et al. Endocrine manifestations in Langerhans cell histiocytosis. Trends Endocrinol Metab 2007; 18 : 252 – 257.
61. Makras P, Samara C, Antoniou M et al. Evolving radiological features of hypothalamo - pituitary lesions in adult patients with Langerhans cell histiocytosis (LCH). Neuroradiology 2006; 48 : 37 – 44.
62. Maghnies M. Diabetes insipidus. Horm Res 2003; 59 (Suppl 1): 42 – 54.
63. Pomahačová R, Klabochová J. Diabetes insipidus. Diferenciální diagnostika. Čes Slov Pediatrie 2002; 57 : 465 – 466.
64. Pomahačová R. Diabetes mellitus centralis. Vox Pediatrie 2004; 4 : 33 – 35.
65. Rivera JA. Lymphocytic hypophysitis: disease spectrum and approach to diagnosis and therapy. Pituitary 2006; 9 : 35 – 45.
66. Khamseh ME, Mollanai S, Hashemi F et al. Erdheim‑Chester syndrome, presenting as hypogonadotropic hypogonadism and diabetes insipidus. J Endocrinol Invest 2002; 25 : 727 – 729.
67. Kovacs K, Bilbao JM, Fornasier VL et al. Pituitary pathology in Erdheim‑Chester disease. Endocr Pathol 2004; 15 : 159 – 166.
68. Lachenal F, Cotton F, Desmurs - Clavel H et al. Neurological manifestations and neuroradiological presentation of Erdheim‑Chester disease: report of 6 cases and systematic review of the literature. J Neurol 2006; 253 : 1267 – 1277.
69. Sheu SY, Wenzel RR, Kersting R et al. Erheim‑Chester disease: A case report with multisystemic manifestation including testes, thyroid, and lymph nodes and review of literature. J Clin Pathol 2004; 57 : 1225 – 1228.
70. Shimada S, Ono K, Hashizume Y et al. Intracranial lesion of Erdheim‑Chester disease. Hum Pathol 2007; 38 : 950 – 951.
71. Tritos NA, Weinrib S, Kaye TB. Endocrine manifestations of Erdheim‑Chester disease (a distinct form of histiocytosis). J Intern Med 1998; 244 : 529 – 535.
72. Abe T. Lymphocytic infundibulo - neurohypophysitis and infundibulo - panhypophysitis regarded as lymphocytic hypophysitis variant. Brain Tumor Pathol 2008; 25 : 59 – 66.
73. Gellner V, Kurschel S, Scarpatetti M et al. Lymphocytic hypophysitis in the pediatric population. Childs Nerv Syst 2008; 24 : 785 – 792.
74. Ikema T, Takasu N. Serial T1 - weighted magnetic resonance imaging changes in a patient with central diabetes insipidus, possibly due to lymphocytic infundibuloneurohypophysitis. Eur J Endocrinol 2005; 153 : 989 – 990.
75. Folkerth RD, Price DL Jr, Schwartz M et al. Xanthomatous hypophysitis. Am J Surg Pathol 1998; 22 : 736 – 741.
76. Takao T, Asaba K, Tanaka H et al. A case of lymphocytic infundibuloneurohypophysitis schowing diabetes inspidus followed by anterior hypopituitarism associated with trombnasthenia. Endocr J 2000; 47 : 285 – 291.
77. Wang XL, Lu JM, Yang LJ et al. A case of relapsed autoimmune hypothalamitis successfully treated with methylprednisolone and azathioprine. Neuro Endocrinol Lett 2008; 29 : 874 – 876.
78. Gursoy A, Cesur M, Aktaş B et al. Intracranial aggressive fibromatosis presenting as panhypopituitarism and diabetes insipidus. Pituitary 2005; 8 : 123 – 126.
79. Bauer MP, Brouwer PA, Smit VT et al. The challenges of extrapulmonary presentations of sarcoidosis: A case report and review of diagnostic strategies. Eur J Intern Med 2007; 18 : 152 – 154.
80. Bihan H, Christozova V, Dumas JL et al. Sarcoidosis: clinical, hormonal, and magnetic resonance imaging (MRI) manifestations of hypothalamic - pituitary disease in 9 patients and review of the literature. Medicine (Baltimore) 2007; 86 : 259 – 268.
81. Bullmann C, Faust M, Hoffmann E et al. Five cases with central diabetes insipidus and hypogonadism as first presentation of neurosarcoidosis. Eur J Endocrinol 2000; 142 : 365 – 372.
82. Tsao CY, Lo WD, Rusin JA et al. Isolated neurosarcoidosis presenting as headache and multiple brain and spinal cord lesions mimicking central nervous system metastases. Brain Dev 2007; 29 : 514 – 518.
83. Tabuena RP, Nagai S, Handa T et al. Diabetes insipidus from neurosarcoidosis: long‑term follow‑up for more than eight years. Intern Med 2004; 43 : 960 – 966.
84. Dutta P, Hayatbhat M, Bhansali A et al. Wegener’s granulomatosis presenting as diabetes insipidus. Exp Clin Endocrinol Diabetes 2006; 114 : 533 – 536.
85. Düzgün N, Morris Y, Güllü S et al. Diabetes insipidus presentation before renal and pulmonary features in a patient with Wegener’s granulomatosis. Rheumatol Int 2005; 26 : 80 – 82.
86. Vomáčka Z, Ehrmann J, Škvařilová Met al. Granulomatous vasculitis of Churg- - Strauss type in patient with diabetes insipidus. Acta Univ Palack Olomouc Fac Med 1993; 135 : 17 – 19.
87. Agha A, Thornton E, O’Kelly P et al. Posterior pituitary dysfunction after traumatic brain injury. J Clin Endocrinol Metab 2004; 89 : 5987 – 5992.
88. Schaefer S, Boegershausen N, Meyer Set al. Hypothalamic - pituitary insufficiency following infectious diseases of the central nervous system. Eur J Endocrinol 2008; 158 : 3 – 9.
89. Charalampaki P, Reisch R, Ayad A et al. Endoscopic endonasal pituitary surgery: surgical and outcome analysis of 50 cases. J Clin Neurosci 2007; 14 : 410 – 415.
90. Sudhakar N, Ray A, Vafidis JA. Complications after trans‑sphenoidal surgery: our experience and a review of the literature. Br J Neurosurg 2004; 18 : 507 – 512.
91. Grois N, Pötschger U, Prosch H et al. Risk factors for diabetes insipidus in langerhans cell histiocytosis. Pediatr Blood Cancer 2006; 46 : 228 – 230.
92. Tashiro T, Sano T, Xu B et al. Spectrum of different types of hypophysitis. A clinicopahtological study hypophysitis in 31 cases. Endocr Pathol 2002; 13 : 183 – 195.
93. Lopes MB. Tumors of pituitary gland. In: Fletcher CD (ed). Diagnostic histopathology of tumors. London: Elsevier Limited 2007 : 971 – 997.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 2-
All articles in this issue
- Výskyt revmatických manifestací a orgánově nespecifické autoimunity u nemocných s autoimunitní tyreopatií – editorial
- Několik poznámek k problematice infikovaného myxomu – editorial
- Analýza a srovnání souborů nositelů implantabilního kardioverteru- defibrilátoru v primární a sekundární prevenci
- Výskyt reumatických manifestácií a orgánovo nešpecifickej autoimunity u chorých s autoimunitnou tyreopatiou
- Probiotika u akutní pankreatitidy – randomizovaná, placebem kontrolovaná, dvojitě slepá studie
- Rizika dlouhodobé antisekreční terapie
- Přímý inhibitor reninu aliskiren v léčbě kardiovaskulárních a renálních onemocnění
- Endokanabinoidní systém a ovlivnění trombogeneze
- Antitrombotická terapie v graviditě
- Centrální diabetes insipidus u dospělých osob – první příznak histiocytózy z Langerhansových buněk a Erdheimovy‑Chesterovy choroby. Popis tří případů a přehled literatury
- Kazuistika mladého pacienta s konstriktivní perikarditidou se subakutním průběhem
- Infikovaný myxom jako příčina akutní infekční endokarditidy
- Přehodnocení doporučení pro diagnostiku a léčbu hypertenze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Centrální diabetes insipidus u dospělých osob – první příznak histiocytózy z Langerhansových buněk a Erdheimovy‑Chesterovy choroby. Popis tří případů a přehled literatury
- Rizika dlouhodobé antisekreční terapie
- Kazuistika mladého pacienta s konstriktivní perikarditidou se subakutním průběhem
- Přímý inhibitor reninu aliskiren v léčbě kardiovaskulárních a renálních onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

