-
Medical journals
- Career
Difuzní idiopatická skeletální hyperostóza a souvislost s metabolickými parametry
Authors: A. Pavelková; K. Pavelka
Authors‘ workplace: Revmatologický ústav, Praha, ředitel prof. MUDr. Karel Pavelka, DrSc.
Published in: Vnitř Lék 2006; 52(5): 477-480
Category: Diabetes and other subjects (infection, dermatovenerology and rheumatology) Hradec Králové 3 to 4 June 2005
Overview
Difuzní idiopatická skeletální hyperostóza (DISH) je nezánětlivé onemocnění skeletu charakterizované hyperostózou v oblasti axiálního skeletu i na periferii. Již řadu let je známá jeho souvislost s diabetem 2. typu a ostatními metabolickými změnami (porucha metabolizmu lipidů), i když souvislost stále není zcela jasná. Zdá se, že důležitou roli v procesu choroby hraje hyperglykemie a inzulinorezistence, dále vlivy hormonální, související s růstovým hormonem (GH) a zprostředkování jeho působení prostřednictvím insulin-like growth faktoru (IGF) a jeho binding proteinů (IGFBP2, IGFBP3). Z hlediska symptomatické terapie tohoto onemocnění je třeba se vyhýbat lékům, zvyšujícím hyperinzulinemii.
Klíčová slova:
DISH - hyperostóza - diabetes mellitus - inzulinorezistence - IGFDifuzní idiopatická skeletální hyperostóza (DISH, Forestierova choroba) je chronické nezánětlivé systémové onemocnění skeletu nejasné etiologie, jehož znakem je kostní novotvorba v oblasti páteře a periferního skeletu. Hyperostóza je hyperplazie kostního vaziva vznikající na nejrůznějším podkladě. V případě difuzní idiopatické skeletální hyperostózy vzniká místní metaplastické zvápenatění základní hmoty ve vmezeřeném řídkém vazivu mezi ligamentum longitudinale anterius a tělem obratle přímo zvápenatění podélného ligamenta. Osifikace vycházejí z úponů šlach, vazů a kloubních pouzder [1]. Páteř je postižena heterotopní kostní tkání nejvíce, dochází ke vzniku splývajících přemostění mezi obratli (obr.1 a 2). První osifikace vznikají v Th-úseku páteře zejména vpravo, protože z levé strany brání vzniku osifikací tlak aorty. Postižení periferie se projevuje entezopatiemi, které se vyskytují zejména v oblasti pat, kolen, loktů, pánve [2]. Diagnóza je stanovena na základě splnění Resnickových kritérií [3] (tab. 1), která charakterizují typický rentgenový obraz na páteři, avšak nezahrnují klinické ani laboratorní znaky.
Image 1. DISH na Th páteři, hyperostózy charakteru býčích rohů. 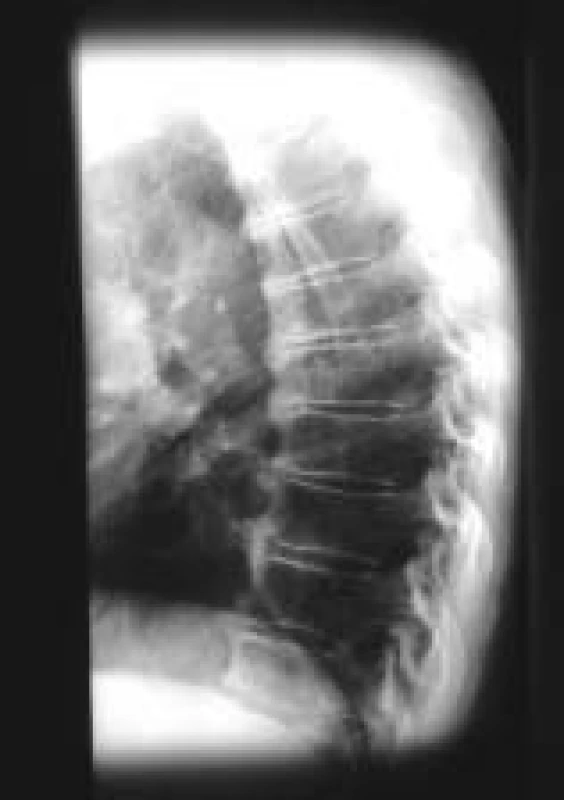
Image 2. Splývavé osifikace při DISH. 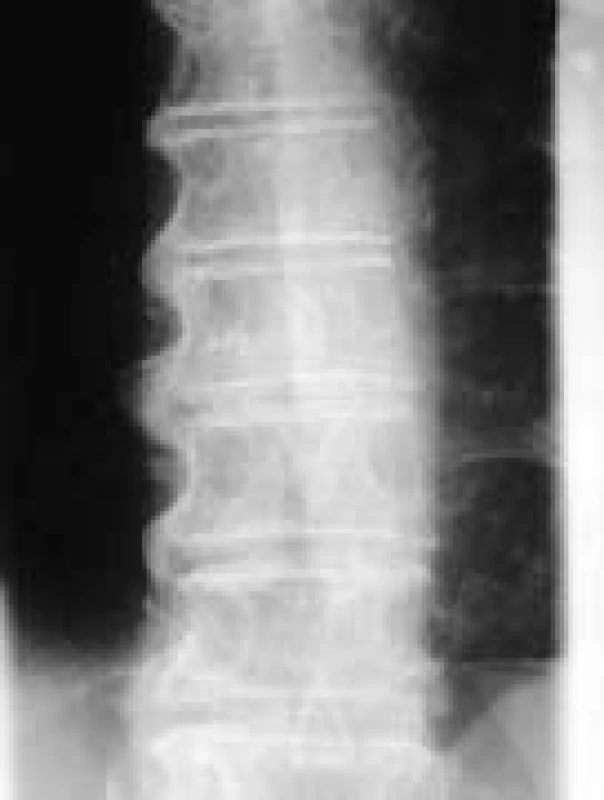
Table 1. Resnickova diagnostická kritéria DISH. 
Prevalence DISH podle pohlaví je 2 : 1 s převahou mužů [4], je to onemocnění středního věku, zřídka vzniká před 40. rokem. S věkem se prevalence tohoto onemocnění zvyšuje. Někdy je průběh choroby zcela asymptomatický a diagnóza stanovena náhodně např. při snímkování hrudníku či až při sekci, ale často je příčinou větších bolestí axiálního skeletu a ztuhlosti, zejména krční a LS/páteře, nebo entezopatických bolestí (kyčle, lokty, ramena, kolena, paty apod). V oblasti periferních kloubů dochází zprvu k nebolestivému omezení hybnost (ramena, kyčle) vlivem ztluštění a zkrácení ligament, tyto změny můžeme klinicky pozorovat ještě před typickým postižením páteře. Mezi další klinické projevy DISH může patřit i dysfagie, která vzniká kompresí jícnu cervikálními osifikačními formacemi [5]. Proces analogický DISH je osifikace zadního podélného ligamenta v oblasti krční páteře (OPLL). Tato jednotka se nejčastěji vyskytuje v Asii, v Japonsku je prevalence OPLL okolo 1,5 % [6]. V důsledku osifikace zadního podélného ligamenta může vzniknout cervikální myelopatie.
DISH je nezřídka klinicky i rentgenologicky zaměňována za ankylozující spondylitidu (AS), u které jsou naopak postiženy apofyzeální, kostovertebrální a sakroiliakální klouby. U AS dochází na rozdíl od DISH k sekundární metaplazii zánětlivé tkáně v oblasti předních a bočních okrajů obratlů a vazů, postupně tak vznikají osifikace periferní části vazivového prstence meziobratlové destičky a blízkých vazů. Na rozdíl od DISH se tedy jedná o zánětlivé onemocnění páteře.
Etiopatogeneze DISH a souvislost s metabolickými a hormonálními procesy
Etiologie DISH je neznámá. Na vzniku osifikací u DISH se podílejí multifaktoriální vlivy (metabolické, hormonální, genetické a další). Popisuje se souvislost zejména s diabetes mellitus 2. typu a hyperinzulinemií [7] či poruchou glukózové tolerance, dále s obezitou, častější jsou poruchy v metabolizmu lipidů (hypercholesterolemie, hypertriglyceridemie), ve větší míře se vyskytuje též hyperurikemie. Prevalence diabetu dospělých a porucha glukózové tolerance činí u pacientů s DISH 17 - 60 %, prevalence DISH u dospělých s diabetem 2. typu pak činí 13 - 50 % [8]. Současné poznatky ukazují, že v etiopatogeneze tohoto onemocnění se uplatňuje zejména hyperinzulinemie, resp. inzulinorezistence [9]. Nebyl nalezen vztah mezi stupněm hyperglykemie a kostními změnami na skeletu.
Dalším důležitým faktorem jsou i vlivy hormonální, a to zejména vliv růstového hormonu (GH). Podobná hyperostotická přemostění jako u DISH se vyskytují také u akromegalie, což jen potvrzuje úlohu GH v tomto procesu [10]. Hormonální změny spojené se stárnutím organizmu hrají také roli v regulaci GH. Předpokládá se, že následkem poklesu gonadotropinů, zejména androgenů, ve vyšším věku se zvyšuje produkce estrogenů jako přirozeného stimulátoru růstového hormonu. Při hyperinzulinemii dochází ke stimulaci sekrece IGF I, a tím i ke zvýšení osteosyntetického potenciálu. To by mohlo vysvětlovat spojitost osteoproduktivních změn s častějším výskytem diabetes mellitus a obezity.
Zdá se, že důležitou úlohu v etiopatogeneze hraje i genetika vzhledem k familiárnímu výskytu a popisovaným spojením s metabolickým syndromem. Dosud však nebyla prokázána souvislost v rámci HLA systému a typizaci HLA zatím nelze využít k rozlišení DISH a ankylozující spondylitidy. V rozsáhlých slovenských studiích byla vyslovena hypotéza o autozomálně dominantní dědičnosti DISH, což by vysvětlovalo i spojitost zmíněných metabolických poruch a DISH [11].
DISH a kostní metabolizmus
Vznik osifikací u DISH je v podstatě kostní novotvorba v atypických lokalizacích, a tudíž si samotná kost a její metabolizmus zaslouží v této problematice naši pozornost. Metabolizmus kosti závisí na aktivitě kostních buněk, jejichž činnost je ovlivňována množstvím faktorů jednak místních, jednak systémových.
Mezi systémové faktory patří hormony regulující homeostázu kalcia (kalcitonin, vitamin D a parathormon - PTH), které mají přímý vliv na kostní buňky. Důležitou roli v zachování kostní hmoty mají i ostatní hormony, estrogeny, růstový hormon (GH), jehož efekt na kost se uskutečňuje pomocí insulin-like growth faktoru (IGF), který stimuluje osteoblastickou diferenciaci [12].
Mezi lokální faktory ovlivňující aktivitu kostních buněk patří cytokiny, růstové faktory a ostatní peptidy [13] (tab. 2). Jedním z nejdůležitějších je interleukin I (IL-1), který stimuluje osteoblasty k sekreci proteináz (kolagenázy, stromelyzin), které mohou způsobit odbourávání matrix pojivové tkáně. Podobný účinek jako IL-1 má i tumor-nekritizující faktor (TNF). Další cytokin, interferon γ, působí opačně, inhibuje IL-1 a TNF indukovanou kostní resorpci stimulovanou PTH či hydroxyvitaminem D3. Také mnoho lokálních růstových faktorů přímo ovlivňuje aktivitu kostních buněk. Insulin-like growth factors (IGF I a IGF II) jsou peptidy s jedním řetězcem produkovány zejména játry, ale i např. kostními buňkami [14]. Hlavními regulátory syntézy IGF jsou: 1. růstový hormon (GH), 2. nutrice a 3. imunitní systém (obr. 3). Nedostatečná sekrece GH a malnutrice potlačují syntézu IGF I. Je-li aktivován imunitní systém (sepse, systémová zánětlivá onemocnění, malignity), je produkce IGF I suprimována [15]. V tomto procesu hrají nejspíše roli cytokiny. In vitro IGFs podporují syntézu kostního kolagenu a matrix a stimulují replikaci buněk osteoblastické linie. Zvyšují transkripci kolagenu I a potlačují transkripci kolagenázy 3 (metaloproteinázy 13). Snížením hladin kolagenáz inhibují tedy IGFs degradaci kostního kolagenu. Tyto děje hrají zásadní roli v zachování kostní hmoty [16]. Modulátory účinku IGF jsou IGFBP - specifické vazebné proteiny pro IGF, které jsou secernovány kostními buňkami a je jich celkem šest. IGF I a IGF II jsou s nimi vázány nekovalentní vazbou. Pro diagnostické účely je nejčastěji používána koncentrace IGFBP 3 v krvi. Jedná se o glykoprotein, který je v cirkulaci zastoupen v největší míře [17] a je dependentní na GH. Biologicky dostupný je jen volný (free) IGF, kterého je jen asi 1 % z celkového množství IGF [18]. Množství celkových koncentrací IGF I a IGF II vysoce koreluje s hladinou IGFBP 3. IGF vázaný do tříčlenného komplexu zůstává nejspíše jen intravaskulárně, zatímco IGF vázaný na ostatní BP je přenesen do tkání.
Table 2. Lokální faktory ovlivňující kostní resorpci či formaci (upraveno dle Stevensona aMarshe). 
Image 3. Regulátory sekrece IGF (upraveno dle Wernera et al). 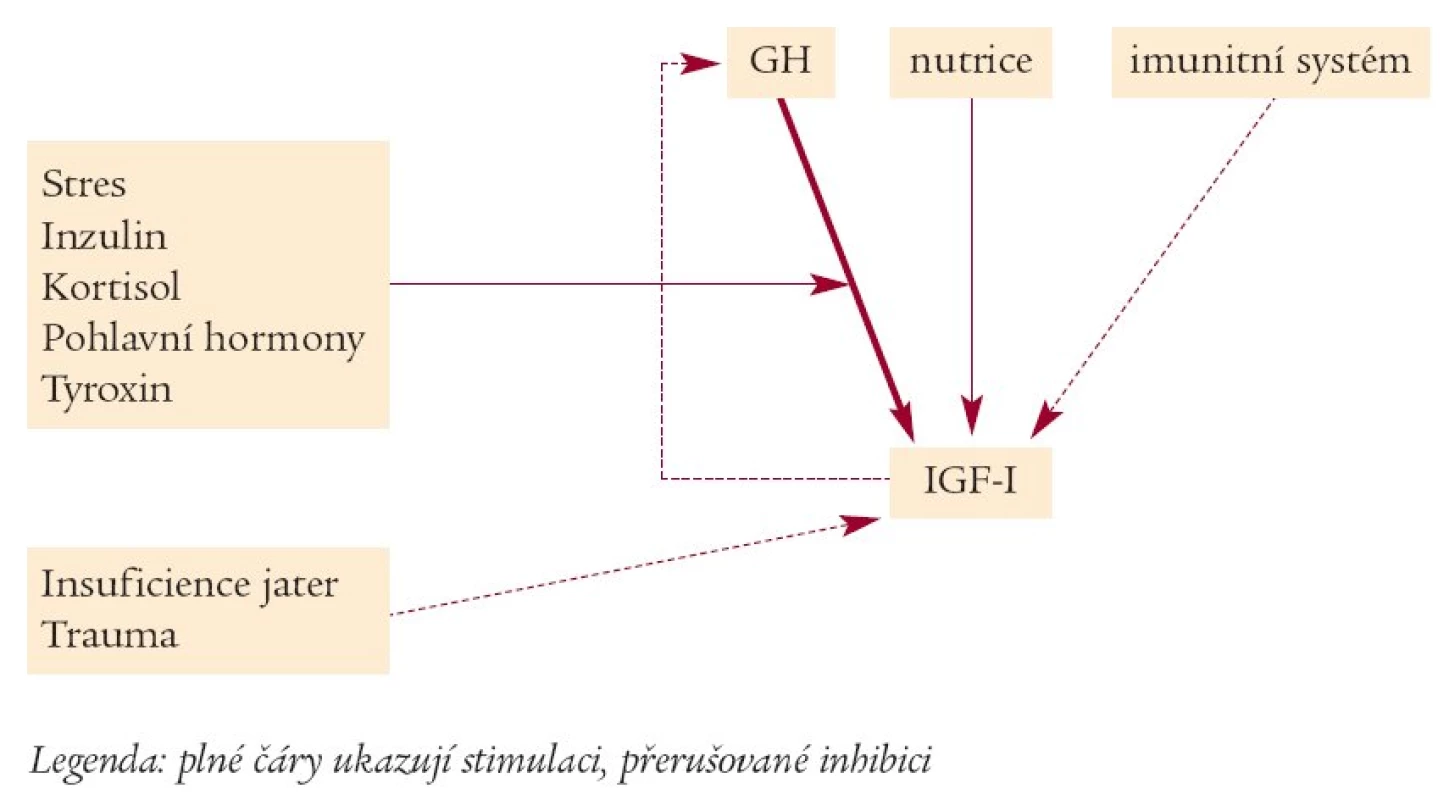
Alkalická fosfatáza (ALP) a zejména její kostní izoforma, je obrazem osteoformace, stejně tak jako osteokalcin. Osteokalcin je protein produkovaný kostními buňkami. Jeho fyziologická funkce je stále nejasná, zdá se, že reguluje aktivitu osteoklastů a jejich prekurzorů. Používá se jako marker kostního obratu při metabolických kostních změnách [19]. Při odbourávání kosti osteoklasty uvolňují produktů degradace kolagenu do oběhu, které pak jsou dále metabolizovány ledvinami a játry. V moči pak lze detekovat volný (40 %) a vázaný (60 %) pyridinolin (Pyr) a deoxypyridinolin (Dpyr). Tyto markery jsou tedy obrazem kostní resorpce (tab. 3).
Table 3. Markery kostního metabolizmu. 
Rozvaha, týkající se markerů kostního metabolizmu a jejich vlivu na osteoformaci a osteoresorpci, stejně tak jako již známé poznatky týkající se úlohy hyperglykemie a inzulinorezistence, spojované s DISH, nás vedly k vyšetření těchto parametrů u našich pacientů s DISH. Ve studii s 64 pacienty s DISH jsme hodnotili markery kostního metabolizmu (ALP, osteokalcin, vitamin D, pyridinolin, deoxypyridinolin) a lokální faktory ovlivňující aktivitu kostních buněk (IGF-I, volný IGF-I a jejich binding proteiny IGFBP2, IGFBP3). Zajímal nás obraz kostního metabolizmu u této skupiny nemocných a případné odchylky ať již ve prospěch osteoformace či osteoresorpce či posun v aktivitě faktorů lokálních. Z výsledků provedených vyšetření jsme však nezjistili žádnou závislost či trend v posunu hodnot markerů kostního metabolizmu či lokálních růstových faktorů na kost u našich pacientů s DISH [20]. Zdá se tedy, že proces neoformace heterotopní kosti u DISH nemá vliv na hodnoty markerů kostního metabolizmu, jedná se tudíž nejspíše o změny na úrovni lokální.
Terapie
Z hlediska terapie, která není doposud kauzální, ale jen symptomatická, hraje velkou roli zejména prevence. Monitorujeme glykemii, lipidové spektrum, je třeba redukce hmotnosti a správná životospráva. Je důležité vyhýbat se lékům, které zvyšují hyperinzulinemii. U nemocných s diabetem 2. typu je vhodné použít metformin. V případě hypertenze u nemocných s poruchou inzulinové rezistence je vhodné použití antihypertenziv, která nezhoršují inzulinovou rezistenci (ACEI, α-adrenolytika - prazosin). Je-li třeba léčit inzulinem, dáváme přednost podání preprandiálního krátkého inzulinu.
Závěr
Kost je metabolicky aktivní tkáň, která se během života neustále mění. V dospělosti jsou procesy osteoresorpce a osteoformace v rovnováze, ta se však mění s vyšším věkem. Na jedné straně můžeme vidět úbytek kostní hmoty, na druhé pak její novotvorbu v atypických lokalizacích, jak je tomu například u DISH. Zajímavé je tak časté spojení této jednotky s diabetes mellitus a možnosti působení hyperglykemie a hyperinzulinemie přímo na vznik heterotopních osifikací. K přesnému vysvětlení etiopatogeneze bude třeba dalších zkoumání zejména na lokální úrovni přímo v místech vzniku osifikací, v oblasti periostu a okolních tkání.
MUDr. Andrea Pavelková
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: pavelka@revma.cz
Doručeno do redakce: 13. 9. 2005
Přijato k otištění: 13. 9. 2005
Sources
1. Smythe H, Littlejohn G. Diffuse idiopathic skeletal Hyperostosis. In: Klippel JH, Dieppe PQ. Rheumatology. St Louis: Mosby 1994; 9 : 1-9.
2. Littlejohn GO, Urowitz MB. Peripheral enthesopathy in difuse idiopathic skeletal hyperostosis (DISH): a radiological study. J Rheumatol 1982; 9 : 568-572.
3. Resnick D, Saul SR, Robins JM. Difuse idiopathic skeletal hyperostosis (DISH): Forestier´s disease with extra spinal manifestations. Radiology 1975; 115 : 513-524.
4. Jalkunen H, Heinonen OP, Knekt P et al. The epidemiology of hyperostosis of the spine together with its symptoms and related mortality in general population. Scand J Rheumatol 1973; 40 : 581-591.
5. Fortin PR, Mata S, Joseph L et al. Is difuse idiopathic skeletal hyperostosis a distinct entity? A controlled study. Arthritis Rheum 1995, 38(Suppl): 657 (abstract).
6. Kamila M, Farada A, Mizuno M et al. Association between a polymorphism of the transforming factor-beta 1 gene susceptibility to ossification of the posterior longitudinal ligament in Japanese patients. Spine 2001; 26 : 1264-1266.
7. Littlejohn GO. Insulin and new bone formation in difuse idiopathic skeletal hyperostosis. Clin Rheumatol 1985; 4 : 294-300.
8. Littlejohn G. DISH. In: Hochburg et al. Rheumatology. St Louis: Mosby 2003; 1863
9. Littlejohn GO, Smythe HA Marked Hyperinsulinemia after Glucose Challenge in Patients with Diffuse Idiopathic Skeletal Hyperostosis. J Rheumatol 1981; 8 : 965-968.
10. Bluestone R, Bywaters EG, Hartoo M et al. Acromegalic arthropathy. Ann Rheum Dis 1971; 30 : 243-250.
11. Bošák V, Žlnay D, Navrátil J et al. Imunogenetické aspekty při ankylozujúcej hyperostóze. Rheumatologia 1988, 24 : 8-14.
12. Brixen K, Nielsen HK, Mosekilde L et al. A short course of rhGH stimulates osteoblasts and activates bone remodeling in normal human volunteers. J Bone Miner Res 1990 : 5: 609-618.
13. Russel RGG, Bunning RAD, Hughes DE et al. Humoral and local factors affecting bone formation and resorption. In: Stevenson JC (ed). New techniques in Metabolic Bone Disease. London: Wright 1990 : 1-20.
14. Oursler MJ, Osdoby P, Pyfferoen J et al. Avian osteoclasts as estrogen target cells. Proc Natl Acad Sci USA 1991; 88 : 6613-6617.
15. Canalis E. Growth factors and their potential clinical value. J Clin Endocrinol Metab 1992; 75 : 1-4.
16. Lian JB, Stein GS, Canalis E et al. Bone formation: osteoblast lineage cells, growth factors, matrix proteins, and mineralization process. In: Favus MJ (ed). Primer on the metabolic bone diseases and disorders of mineral metabolism. 4th ed. Philadelphia: Lippincott Williams and Wilkins, 1999 : 14-29.
17. Baxter RC, Martin JL Radioimmunoassay of growth hormone-dependent insulinelike growth factor binding protein in human in human plasma. Journal of Clinical Investigation 1986; 78, 1504-1512.
18. Frystyk J, Skjaerbaek C, Dinesen B et al. Free insulin-like growth factors (IGF I and IGF II) in human serum. FEBS letters 1994; 348 : 185-191.
19. Khosla S, Kleerekepper M Biochemical markers of bone turnover. In: Favus MJ (ed) Primer on the metabolic bone diseases and disorders of mineral metabolism. 4th ed. Philadelphia: Lippincott Williams and Wilkins, 1999 : 128-134.
20. Pavelková A, Havelka S, Veselá M et al. Metabolické kostní ukazatele u difuzní idiopatické skeletální hyperostózy. Rheumatologia 2001; 15 : 161-166.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 5-
All articles in this issue
- Nemocniční nákazy a diabetes
- Diabetes mellitus a imunizace
- Úloha diabetologa při infekčním onemocnění diabetika
- Patogeneze postižení pojivové tkáně při diabetes mellitus
- Metabolické jaderné receptory PPAR a kůže
- Kožní změny při diabetu z pohledu dermatologa
- Hojení kožních afekcí u syndromu diabetické nohy při hospitalizaci
- Infekce a syndrom diabetické nohy v terénní praxi
- Komplex hyaluronanu a jodu - Hyiodine® - nová metoda při terapii diabetických defektů
- Uroinfekce u diabetiků
- Respirační infekce a terapie inhalačním inzulinem
- Metabolizmus glukózy a účinky inzulinu v sepsi
- Kožní projevy hyperlipidemie u diabetiků z pohledu internisty
- Mykózy a diabetes
- Kožní komplikace terapie diabetes mellitus
- Difuzní idiopatická skeletální hyperostóza a souvislost s metabolickými parametry
- Revmatologické manifestace při diabetes mellitus
- Metabolické kostní choroby a diabetes
- Dna a diabetes
- Glukokortikoidy a diabetes mellitus
- Anagrelid v léčbě esenciální trombocytemie a dalších myeloproliferací s trombocytemií sledovaných v registru pacientů v ČR
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kožní změny při diabetu z pohledu dermatologa
- Glukokortikoidy a diabetes mellitus
- Difuzní idiopatická skeletální hyperostóza a souvislost s metabolickými parametry
- Kožní komplikace terapie diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

