-
Medical journals
- Career
Neobvyklá příčina zvětšování břicha
: K. Dvořák 1; J. Fulík 2
: Oddělení gastroenterologie a hepatologie, Krajská nemocnice Liberec, a. s., Nemocnice Liberec 1; Chirurgická klinika 1. LF UK a IPVZ Nemocnice Na Bulovce, Praha 2
: Gastroent Hepatol 2018; 72(2): 119-121
: Hepatology: Case Report
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2018119Prezentujeme případ pacienta vyšetřovaného pro zvětšování břicha a bolesti v epigastriu. Na základě zobrazovacích metod byl diagnostikován pseudomyxom peritonea, vzácný klinický syndrom charakterizovaný přítomností akumulovaných gelatinózních kolekcí v dutině břišní a pánvi s mucinózními implantáty na peritoneu. Příčinou byl cystadenom apendixu a jeho buňky implantované v dutině břišní. Průběh onemocnění je sice indolentní, ale progresivní a neléčený vede ke smrti. Optimální léčbu pseudomyxomu peritonea představuje maximálně agresivní cytoredukční chirurgická léčba v kombinaci s hypertermickou intraperitoneální chemoterapií, která může mít kurativní potenciál.
Klíčová slova:
pseudomyxom peritonea – cystadenom apendixu – cytoredukce – HIPECPopis případu
Poslední pracovní den před Vánoci přišel do naší ambulance pacient, který byl odeslán praktickým lékařem k diagnostické punkci ascitu. Muž, 44 let, atletické postavy se dosud s ničím neléčil, byl nekuřák a abstinent. Udával bolesti břicha v epigastriu a kolem pupku v posledních 3 měsících, bolesti byly zejména na pohmat, při zatnutí břišních svalů potíže neměl. Základní biochemické parametry a krevní obraz byly normální, hmotnost měl stabilní. Sonograficky byl popsán nehomogenní hypoechogenní obsah v dutině břišní s maximem v epigastriu, také mezi střevními kličkami a dále normální játra se třemi ložisky charakteru hemangiomů. Na následném CT byl nález popsán jako „…výrazný septovaný ascites vyplňující celou dutinu břišní. Postkontrastně dochází k sycení sept i rozšířeného parietálního peritonea. V diferenciální diagnostice karcinomatóza, zánětlivé změny, hemoperitoneum po ruptuře hemangiomu…“ (obr. 1). Sonografický nález (obr. 2) při vyšetření pacienta na našem pracovišti se nejevil jako nález vhodný k punkci. Bylo naplánováno kontrolní CT za měsíc, nález se za tu dobu nezměnil. Byla vyslovena suspekce na pseudomyxom paritonea (PMP) a pacient byl odeslán na specializované pracoviště – Chirurgickou kliniku Nemocnice Na Bulovce.
1. První CT vyšetření s nálezem galatinózních hmot vyplňujících dutinu břišní. Fig. 1. First abdominal CT scan showing the abdominal cavity filled with mucoid fluid. 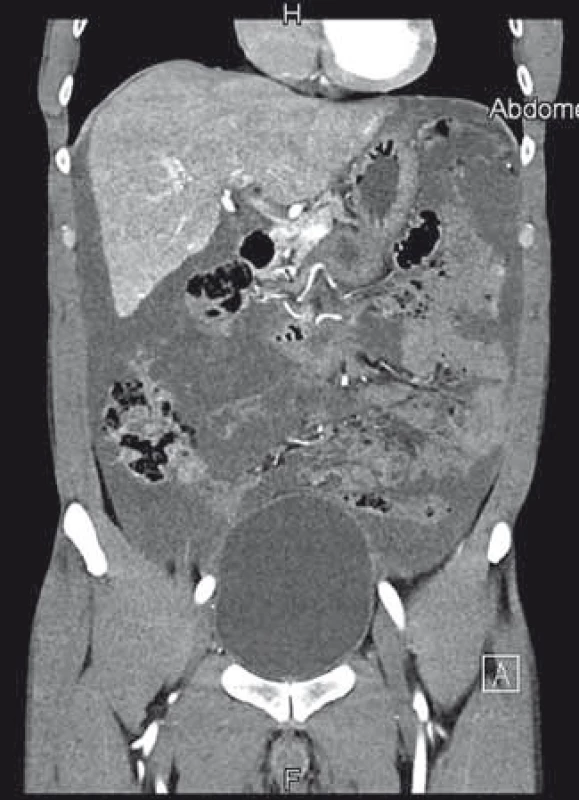
2. Sonografické vyšetření břicha v době diagnózy – A. příčný řez epigastriem; B. hmoty pseudomyxomu peritonea (PMP) mezi pravou ledvinou (RK) a pravým jaterním lalokem (RLL); C. RLL. PB – tělo pankreatu, HA – hemangiom, GB – žlučník Fig. 2. Abdominal ultrasound at the time of diagnosis – A. transverse section; B. mucinous material of pseudomyxoma peritonei (PMP) between the right kidney (RK) and the right liver lobe (RLL); C. RLL. PB – pancreas body, HA – hemangioma, GB – gallbladder 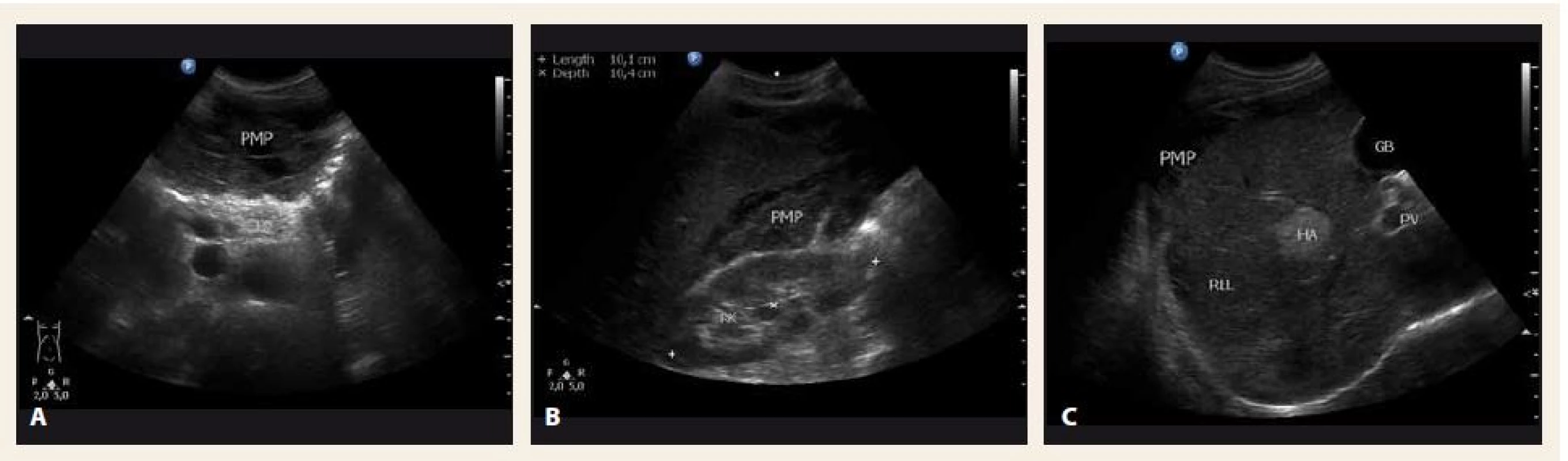
Diagnóza PMP byla potvrzena a pacient byl indikován k chirurgickému řešení. To spočívalo v přední a oboustranné laterální peritonektomii, omentektomii, apendektomii, splenektomii, debulkingu a hypertermické intraperitoneální chemoterapii (HIPEC), konkrétně HIPEC 90 min s použitím Mytomycine C 30 mg a EPIC (early postoperative intraperitoneal chemotherapy) 5 dní po operaci – aplikace 5-fluorouracylu. Chirurgický výkon trval 9 hod, pacient se po něm ale rychle zotavil. Na kontrolním CT za 6 měsíců byla popsána téměř úplná regrese patologického obsahu v dutině břišní (obr. 3), následná kontrola je za dalších 6 měsíců.
3. CT břicha 6 měsíců po léčbě, kde je patrná prakticky kompletní regrese. Fig. 3. Abdominal CT 6 months after treatment with almost complete regression. 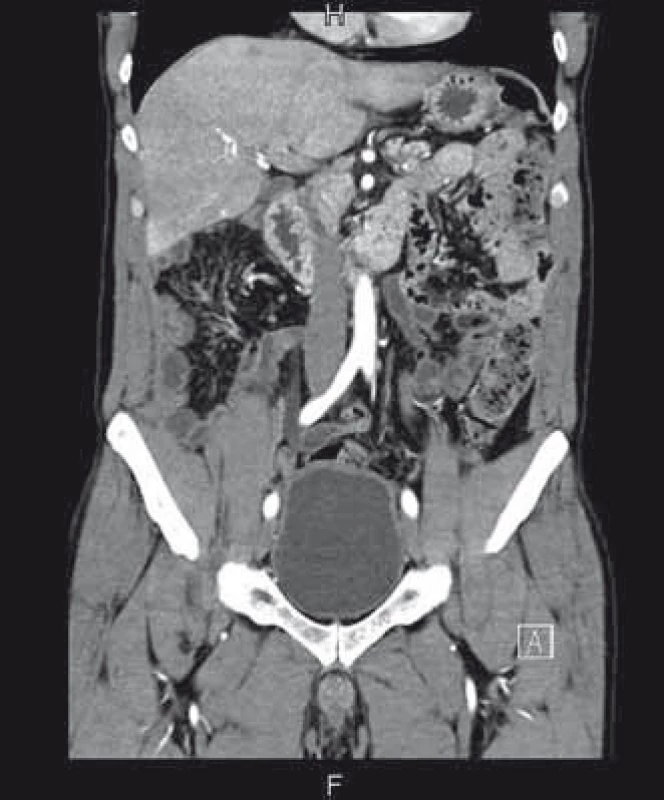
Pseudomyxom peritonea
PMP představuje vzácný klinický syndrom, kdy je dutina břišní vyplněna gelatinózními hmotami a přítomností mucinózních implantátů na peritoneu. Zdrojem je cystadenom apendixu, který svým růstem obturuje lumen. V apendixu se akumuluje mucin, což nakonec vede k jeho ruptuře. Na peritoneu se následně uchytí buňky produkující mucin, které proliferují a zaplňují dutinu břišní tímto gelatinózním obsahem [1]. Tento stav nakonec vede ke střevní obstrukci a neléčený končí smrtí. Označení PMP by mělo být omezeno na histologicky benigní peritoneální tumory, které jsou často asociovány s mucinózním adenomem apendixu – nyní bývají také označovány jako diseminovaná peritoneální adenomucinóza (DPAM) [2].
PMP je častější u žen, incidentálně bývá nacházen u 2 pacientek na 10 000 laparotomií [3]. Nejčastějším symptomem bývá u obou pohlaví zvětšování obvodu pasu, u mužů je druhým nejčastějším příznakem inguinální hernie přítomná u 25 % případů, u žen to je hmatná ovariální masa při rutinním vaginálním vyšetření [1].
CT je v literatuře uváděna jako metoda volby u pacientů s PMP [4]. Diagnostickým znakem PMP je lemování (scalloping) kontur jater a jiných abdominálních orgánů. Je patrná i dislokace střevních kliček centrálním směrem tlakem mucinózních hmot. Ložiska na CT dosahují nativně nízké denzity (5–20 HU), postkontrastně se minimálně sytí a mohou obsahovat kalcifikace [5]. Distribuce ložisek je v oblasti pravého subfrenického a retrohepatálního prostoru, velkého omenta, parakolicky a v malé pánvi [6]. Ultrazvuk zobrazí septovaný ascites a echogenní nepohyblivé peritoneální masy [7]. V diferenciální diagnostice PMP se uvádí peritonitida, karcinomatóza peritonea bez mucinózního ascitu a peritoneální sarkomatóza.
Optimální léčbou symptomatických pacientů s PMP/DPAM je agresivní chirurgická cytoredukce [2] s následným podáním HIPEC formou laváže (obr. 4). Cílem léčby je odstranit maximum postižených tkání, a omezit tak tvorbu mukózních hmot. Následné intraperitoneální podání chemoterapie (nejčastěji mitomycin C, cisplatina, oxaliplatina, gemcitabin, doxorubicin) umožňuje několikanásobný nárůst koncentrace cytostatika v dutině břišní ve srovnání se systémovým podáním. Význam hypertermie je dvojí. Jednak samotná vyšší teplota (41,5–43 °C) vede k destrukci nádorových buněk, dále také zlepšuje průnik cytostatik do nádorových buněk. I tak je penetrace do nádorové tkáně omezena do hloubky max. 2 mm, na větší rezidua tumoru HIPEC neúčinkuje [8,9]. Rekurence choroby vyžaduje opakované čím dál obtížnější chirurgické výkony kvůli adhezím a fibrotizaci tkání.
4. Peritoneální laváž systémem HIPEC. Fig. 4. Peritoneal lavage with HIPEC system. 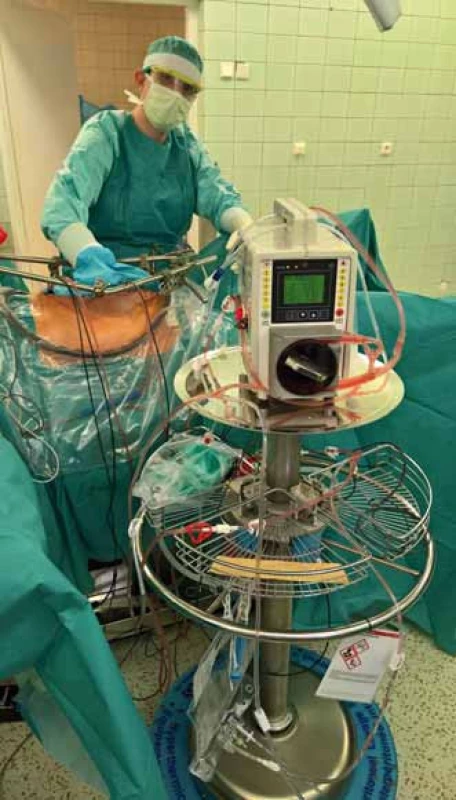
Tento postup má na specializovaných pracovištích dobré výsledky. Pětileté přežití pacientů s DPAM po cytoredukční chirurgické léčbě s intraperitoneální chemoterapií dosahovalo 81 %, u pacientů s peritoneální mucinózní karcinomatózou to bylo jen 59 % a 78 % u pacientů s přechodnými znaky [10]. Data z registru 2 298 pacientů, kteří podstoupili chirurgickou cytoredukci a HIPEC, zahrnující 1 419 pacientů s DPAM udávají 5-a 10leté přežití 81 a 70 % [10]. Tato metoda byla v ČR zavedena v 90. letech minulého století prof. Antošem v Nemocnici Na Bulovce, kde bylo tímto způsobem ošetřeno již více než 50 pacientů s PMP.
Diskuze
Popisujeme kazuistiku vzácného PMP, který byl zpočátku považován za ascites. Díky pro ascites netypickému sonografickému nálezu byl pacient ušetřen pokusu o punkci. Po přehodnocení nálezů zobrazovacích metod byl odeslán na pracoviště s odpovídající erudicí a vybavením. Podstoupil agresivní chirurgickou cytoredukční léčbu spolu s HIPEC, která může mít u těchto pacientů kurativní potenciál. V případě recidivy onemocnění by byla dalším krokem opět chirurgická cytoredukce spolu s HIPEC. Přežití pacientů s PMP je dle literárních údajů kolem 80 % po 5 letech a kolem 70 % po 10 letech. Neléčené onemocnění je fatální.
Tato práce byla podpořena grantem KNL VR170307.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 26. 3. 2018
Přijato: 28. 3. 2018
MUDr. Karel Dvořák, Ph.D.
Oddělení gastroenterologie a hepatologie
Krajská nemocnice Liberec, a. s.
Nemocnice Liberec
Husova 357/10
460 63 Liberec
Sources
1. Sugarbaker PH, Ronnett BM, Archer A et al. Pseudomyxoma peritonei syndrome. Adv Surg 1996; 30 : 233–280.
2. Ronnett BM, Zahn CM, Kurman RJ et al. Disseminated peritoneal adenomucinosis and peritoneal mucinous carcinomatosis. A clinicopathologic analysis of 109 cases with emphasis on distinguishing pathologic features, site of origin, prognosis, and relationship to „pseudomyxoma peritonei“. Am J Surg Pathol 1995; 19 (12): 1390–1408.
3. Hinson FL, Ambrose NS. Pseudomyxoma peritonei. Br J Surg 1998; 85 (10): 1332–1339.
4. Yalcin S, Ergül E, Korukluoglu B et al. Pseudomyxoma peritonei: what do we have? Int J Surg 2007; 15 (1): 1–9.
5. Psár R, Kala Z, Krátký J. Diferenciální diagnostika peritoneálních cystických lézí se zřetelem na pseudomyxom peritonea a echinokokovou cystu. Ces Radiol 2017; 71 (1): 74–78.
6. Levy D, Shaw J, Sobin L. Secondary tumors and tumorlike lesions of the peritoneal cavity: imaging features with pathologic correlation. Radiographics 2009; 29 : 347–373. doi: 10.1148/rg.292085189.
7. Hanbidge AE, Lynch D, Wilson SR. US of the peritoneum. Radiographics 2003; 23 (3): 663–684. doi: 10.1148/rg.233025712.
8. Los G, Verdegaal EM, Mutsaers PH et al. Penetration of carboplatin and cisplatin into rat peritoneal tumor nodules after intraperitoneal chemotherapy. Cancer Chemother Pharmacol 1991; 28 (3): 159–165.
9. Sugarbaker PH. Managing the peritoneal surface component of gastrointestinal cancer. Part 1. Patterns of dissemination and treatment options. Oncology (Williston Park) 2004; 18 (1): 51–59.
10. Chua TC, Moran BJ, Sugarbaker PH et al. Early-and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol 2012; 30 (20): 2449–2456. doi: 10.1200/JCO.2011.39. 7166.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2018 Issue 2-
All articles in this issue
- Acute kidney injury in patients with acute pancreatitis
- Treatment of an adenoma of the ascending colon with the non-lifting sign via a combination of endoscopic mucosal resection and full-thickness resection
- Sleeve gastrectomy – a popular bariatric method to treat severe obesity and type 2 diabetes
- Esomeprazole – S-isomer of omeprazole with more favorable pharmacological properties and stronger pharmacodynamic effect
- Gastrointestinal symptomatology of familial Mediterranean fever – is this a problem also in Central Europe?
- Anniversary of Professor Zdenek Marecek
- View of the XXIIIrd Gastroforum, Strbske Pleso, 2018
- 6th Conference of Central European Hepatologic Col laboration
- The selection from international journals
- Hepatology
- Guidelines of the Czech Society of Hepatology for diagnosis and treatment of primary biliary cholangitis
- A rare cause of increased abdominal size
- Terlipressin remains indispensable in two indications
- Treatment of complicated Crohn’s disease with vedolizumab
- Hepatic cyst infection as a source of sepsis in liver polycystosis
- Hepatocellular carcinoma in central Slovakia – tertiary referral centre experience with 207 patients
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Terlipressin remains indispensable in two indications
- Guidelines of the Czech Society of Hepatology for diagnosis and treatment of primary biliary cholangitis
- Hepatic cyst infection as a source of sepsis in liver polycystosis
- A rare cause of increased abdominal size
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

