-
Medical journals
- Career
Primární biliární cholangitida – doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu
Authors: T. Fejfar 1; T. Vaňásek 1; P. Hůlek 1,2; L. Vítek 3,4; S. Fraňková 5; R. Brůha 4
Authors‘ workplace: II. interní gastroenterologická klinika LF UK a FN Hradec Králové 1; Katedra interních oborů, LF OU a FNsP Ostrava 2; Ústav lékařské biochemie a laboratorní diagnostiky, 1. LF UK a VFN v Praze 3; IV. interní klinika – klinika gastroenterologie a hepatologie 1. LF UK a VFN v Praze 4; Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 5
Published in: Gastroent Hepatol 2018; 72(2): 109-118
Category: Hepatology: Best Practises
doi: https://doi.org/10.14735/amgh2018109Primární biliární cholangitida je chronické autoimunní cholestatické onemocnění. Diagnóza je založena na nálezu cholestázy, průkazu specifických antimitochondriálních protilátek nebo typickém histologickém nálezu. Velká část nemocných je v době diagnózy asymptomatická. Pokud jsou symptomy přítomny, nejčastěji se objevuje pruritus a únava. Základní léčbou 1. linie je ursodeoxycholová kyselina. U nemocných, kteří na léčbu ursodeoxycholovou kyselinou neodpoví adekvátním ústupem cholestázy, zůstává prognóza nepříznivá. Pro tyto nemocné lze zvážit podání léčby 2. linie. Léčbu vyžadují i často přidružené symptomy nebo komplikace, jako je pruritus a kostní choroba. V pokročilých stadiích vyžadují léčbu komplikace asociované portální hypertenze. Ve stadiu jaterní cirhózy je nutno zvážit transplantaci jater.
Overview
Primární biliární cholangitida je chronické autoimunní cholestatické onemocnění. Diagnóza je založena na nálezu cholestázy, průkazu specifických antimitochondriálních protilátek nebo typickém histologickém nálezu. Velká část nemocných je v době diagnózy asymptomatická. Pokud jsou symptomy přítomny, nejčastěji se objevuje pruritus a únava. Základní léčbou 1. linie je ursodeoxycholová kyselina. U nemocných, kteří na léčbu ursodeoxycholovou kyselinou neodpoví adekvátním ústupem cholestázy, zůstává prognóza nepříznivá. Pro tyto nemocné lze zvážit podání léčby 2. linie. Léčbu vyžadují i často přidružené symptomy nebo komplikace, jako je pruritus a kostní choroba. V pokročilých stadiích vyžadují léčbu komplikace asociované portální hypertenze. Ve stadiu jaterní cirhózy je nutno zvážit transplantaci jater.
Klíčová slova:
biliární cholangitida – primární – diagnostika – léčbaÚvod
Primární biliární cholangitida (PBC) je chronické autoimunitní jaterní onemocnění vyznačující se cholestázou přítomnou déle než 6 měsíců. Po desetiletí zažitý a používaný název, primární biliární cirhóza, je na základě dlouholeté diskuze odborných společností s organizacemi nemocných od roku 2014 v Evropě a 2015 ve Spojených státech zaměněn za název primární biliární cholangitida. Zkratka přitom zůstává stejná – PBC. Důvodem této změny byla potenciální stigmatizace nemocných použitím termínu cirhóza i u velké skupiny nemocných, kteří do stadia jaterní cirhózy dosud nedospěli [1]. Současně je i přesnějším označením, protože hlavním rysem onemocnění je nehnisavá chronická destruující cholangitida.
V současné době neexistují epidemiologická data pro incidenci a prevalenci PBC v ČR. V Evropě je incidence udávána 0,3–5,8 nemocných na 100 000 a rok, prevalence pak v širším rozmezí 1,9–40 na 100 000. V posledních letech má incidence i prevalence rostoucí tendenci [2]. Epidemiologické studie potvrzují jasnou dominanci žen, v posledních desetiletích ale s mírně větším nárůstem podílu choroby i u mužů [2].
Ženy jsou postiženy ve více než 90 % případů, a to převážně mladšího a středního věku. Začátek po 60. roce je spíše výjimečný. Zvýšený výskyt onemocnění je popsán v některých rodinách s postižením matky a dcery, avšak genetická podstata této choroby nebyla jednoznačně identifikována. U řady nemocných lze prokázat antigeny HLA-B8, HLA-DR3 či HLA-DR4, které jsou typické i pro jiná autoimunitní onemocnění. Je vysoce pravděpodobné, že v geneticky predisponovaném terénu se uplatňují i další faktory ze zevního prostředí.
Etiologie a patofyziologie není stále dostatečně objasněna. Klíčovou roli hraje zejména patologická imunitní reakce převážně T cytotoxických lymfocytů vedoucí k poškození nitrojaterních, převážně interlobulárních a septálních žlučovodů. Proč je zánětlivý děj primárně selektivně směřován do oblasti interlobulárního duktu, není zcela jasné, zřetelný je však autoimunitní charakter celého patologického procesu se zkříženou reaktivitou autoprotilátek k řadě mikrobiálních i environmentálních antigenů. Aktivované T buňky také produkují cytokiny, které poškozují biliární epitelie i hepatocyty. Velkou úlohu v této reakci hraje řada prozánětlivých cytokinů produkovaných i monocyto-makrofágovým systémem, jako je IL-23, -12, IFN-γ a TNF-α, které působí přímo nebo aktivují cytotoxické T buňky. Významnou roli v aktivaci zánětlivé kaskády hraje i JAK/Stat a NFκB signální dráha. Dnes je za jeden z důležitých patofyziologických mechanizmů považováno i poškození cholangiocytů s narušením sekrece ochranné vrstvy glykokalix a zejména narušení protektivního mechanizmu označovaného jako „bikarbonátový deštník“ chránící cholangiocyty udržováním zásaditého pH před toxickým efektem žlučových kyselin. Jednou z hlavních složek tohoto systému je na Na+ nezávislá Cl–/HCO3– pumpa (AE2 – anion exchanger 2). U nemocných s PBC je exprese této pumpy snížena. Důsledkem je pak vyšší toxický efekt hydrofobních žlučových kyselin s možným apoptotickým efektem, další down-regulací AE2 pumpy a indukcí tvorby reaktivních kyslíkových radikálů [2].
Dochází k aktivaci eozinofilů a žírných buněk. Výsledkem je progresivní granulomatózní zánět vedoucí k duktopenii a zvýšené aktivitě a transformaci hvězdicovitých buněk s následnou fibroprodukcí a rozvojem zvýšeného portálního tlaku. Onemocnění se tak svými rysy řadí mezi příčiny tzv. syndromu mizejících žlučovodů.
Přístup k nemocnému a diagnostika
Klinický obraz a základní vyšetření
Při vyšetření nemocného s cholestázou bychom měli postupovat dle určitého schématu (schéma 1).
Schéma 1. Vyšetřovací schéma. Upraveno dle EASL [2]. Scheme 2. Diagnostic algorithm. Adaptation according to EASL [2]. ![Schéma 1. Vyšetřovací schéma. Upraveno dle EASL [2].
Scheme 2. Diagnostic algorithm. Adaptation according to EASL [2].](https://pl-master.mdcdn.cz/media/image/be1373ab5f453e15da9be20d26bc63dc.jpg?version=1537796325)
EASL – Evropská asociace pro studium jater, ALP – alkalická fosfatáza, GGT – γ-glutamyl transferáza, Bil – bilirubin, UZ – ultrazvuk, AMA – antimitochondriální protilátky, ANA – antinukleární protilátky, MRCP – magnetická rezonanční cholangiopankreatografie, EUS – endosonografie, PBC – primární biliární cholangitida Jednou z nejčastějších příčin cholestázy bývá polékové postižení. Farmakologická anamnéza je v rámci diferenciální diagnostiky (tab. 1) zásadní součástí vyšetření. V rodinné a osobní anamnéze pátráme kromě metabolických poruch též po autoimunitních chorobách (Hashimotova thyreoiditida, idiopatické střevní záněty, celiakie, Sjögrenův syndrom, revmatoidní artritida, systémová skleróza).
Table 1. Diferenciální diagnostika PBC. Tab. 1. PBC differential diagnosis. 
Velká část nemocných s PBC je v době diagnózy asymptomatická. Pokud jsou klinické projevy přítomny, je onemocnění nejčastěji spojeno s pruritem a progredující, někdy velmi výraznou únavou. V menším procentu je provázeno bolestmi v pravém podžebří.
Při fyzikálním vyšetření cílíme na přítomnost xantalesmat, exkoriací při pruritu nebo známky již pokročilého jaterního onemocnění (hepatomegalie, splenomegalie, ikterus) a portální hypertenze (palmární erytém, pavoučkovité névy, hyperdynamická cirkulace, ascites). V časných stadiích onemocnění však bývá fyzikální nález zcela normální.
Laboratorní vyšetření
V základním laboratorním vyšetření nalézáme různý stupeň cholestázy. Hlavním znakem je zvýšení sérové aktivity alkalické fosfatázy (ALP). Při posuzování nálezu musíme mít ale na paměti možnost elevace hodnot ALP danou zvýšením střevní, kostní či placentární frakce. Hodnoty jsou tedy zcela fyziologicky zvýšené v těhotenství a bývají vyšší i u dětí v období růstu. Elevaci ALP obvykle doprovází zvýšení γ-glutamyl transferázy (GGT). U dětí je specifičtější. Hodnoty aktivit aminotransferáz (alaninamonotransferáza – ALT, aspartátaminotrasferáza – AST) nemusí být zvýšeny. Při jejich elevaci musíme vždy myslet i na možnost překryvného syndromu s autoimunitní hepatitidou (AIH). Zvýšení bilirubinu se přidává až v pokročilejších stadiích onemocnění, kdy často nalézáme i pokles hodnot albuminu, trombocytů a prodloužení protrombinového času. Chronický cholestatický obraz je zpravidla provázen hypercholesterolemií.
Zobrazovací vyšetření
V dalším kroku k vyloučení obstrukce žlučových cest a vaskulárních onemocnění jater vždy provádíme ultrazvuk (UZ) břicha s dopplerovským mapováním. Vlastní PBC nemá na UZ žádný specifický obraz. Pouze ve vyšším procentu nemocných bývá popisována hilová lymfadenopatie benigního charakteru. V případě nejasného nálezu k vyloučení obstrukční příčiny provádíme magnetickou rezonanční cholangiopankreatografii – MRCP a/nebo endosonografii – EUS.
Provedení jaterní elastografie dokáže přispět k určení stadia onemocnění, nikoli vlastní diagnóze. V případě nálezu hodnot nad 9,6 kPa (při tranzientní elastografii – TE) považujeme onemocnění v případě PBC za pokročilé [2].
Imunologické vyšetření
Základním a vysoce senzitivním a specifickým vyšetřením (senzitivita ≥ 90 %, specificita ≥ 95 %) při podezření na PBC je vyšetření antimitochondriálních protilátek (AMA – anti-mitochondrial antibody) [3]. Nepřímou imunofluorescencí lze rozlišit devět typů AMA, pro PBC je charakteristická pozitivita anti-M2 AMA. Tyto protilátky jsou namířeny proti E2 podjednotce pyruvát dehydrogenázového komplexu (PDC-E2) mitochondrií. Vyskytují se u více než 90 % nemocných s PBC [4]. Negativní nález bývá asi u 5 % nemocných s diagnózou PBC. Na druhou stranu izolované zvýšení AMA bez přítomné cholestázy neznamená diagnózu PBC a v určitém procentu jej můžeme nalézt i u zdravých jedinců. V běžné populaci je výskyt AMA uváděn 1 na 1 000 [2]. Existují ale i populace, jako např. indiánské kmeny ve Spojených státech, kde je výskyt AMA popisován až v 15 % [5]. V případě, že máme nemocného s AMA pozitivitou, bez vyjádřené cholestázy, měli bychom ho dále sledovat. Riziko rozvoje PBC je v tomto případě uváděno 14–15% v horizontu 5 let [6]. Evropská asociace pro studium jater (EASL – European Association for the Study of the Liver) v tomto případě doporučuje kontroly 1× ročně [2].
U části nemocných (30 %) s PBC můžeme prokázat přítomnost i antinukleárních protilátek (ANA). Senzitivita je nízká, ale specificita u podtypů anti-sp100 a anti-gp210 je vysoká (> 95 %) a lze je využít v případech AMA negativity [4,5,7]. Nespecifickým, ale poměrně častým nálezem je i polyklonální zvýšení IgM protilátek. Je třeba zmínit, že část nemocných, zejména s negativitou AMA protilátek, může vykazovat znaky překryvného syndromu s dalšími autoimunitními cholestatickými nemocemi.
Histologie
Pro PBC je v jaterní histologii charakteristický nález nehnisavé cholangitidy s destrukcí malých interlobulárních a septálních žlučovodů. Zánětlivá, převážně lymfocytární infiltrace je lokalizována kolem malých žlučovodů a je tvořena převážně T lymfocyty a menšinovou populací B lymfocytů, makrofágů a eozinofilů. Typický epiteloidní granulom se podaří prokázat v menším procentu případů. V závislosti na stadiu onemocnění je dále přítomna duktopenie, depozice kolagenu až do obrazu cholestatické jaterní cirhózy. V histologii by se měl hodnotit zejména stupeň fibrózy, duktopenie a množství orcein-pozitivních granul. Toto hodnocení lépe koreluje s prognózou než dříve používané hodnocení dle Ludwiga a Scheuera [8]. Ne vždy jsou ale všechny typické změny jasně vyjádřeny a diferenciální diagnostika je poměrně velmi široká (tab. 2).
Table 2. Diferenciální diagnostika PBC, histologická. Tab. 2. Histology – PBC differential diagnosis. 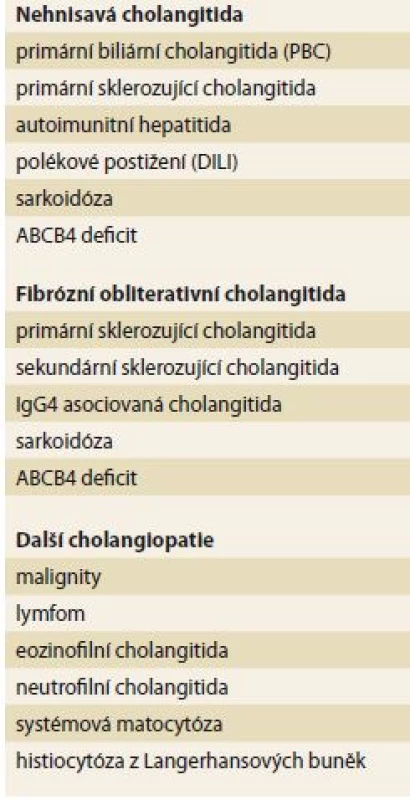
Vzhledem k vysoké specificitě AMA je pro diagnózu v současné době dostatečné splnění 2 ze 3 kritérií, mezi která patří cholestatický laboratorní obraz, pozitivita AMA a typický nález v jaterní biopsii. Z tohoto pohledu je jaterní biop-sie dnes indikována spíše jen v nejasných případech AMA a ANA negativní PBC nebo při podezření na překryvný syndrom s AIH.
Diagnostická kritéria pro PBC (EASL, AASLD), postačující je 1 a 2 nebo 1 a 3
- trvající (> 6 měsíců) zvýšení sérové aktivity ALP jaterního původu při UZ nebo EUS nebo MRCP normálním nálezu na biliárním stromu;
- pozitivita AMA (titr > 1 : 40) nebo pozitivita anti-sp100 a anti-gp210 subtypů ANA;
- histologický nález postižení interlobulárních žlučovodů nehnisavou (nonsupurativní) obstruktivní cholangitidou.
Indikace jaterní biopsie (histologické vyšetření)
- pacienti s trvající zvýšenou aktivitou ALP jaterního původu a negativitou AMA, anti-M2 nebo PBC-specifických ANA (sp100, gp210);
- podezření na overlap syndrom s AIH (sérové aminotrasferázy > 5× ULN, IgG > 2 ULN, ANA + (> 1 : 320), ASMA + (> 1 : 80)) nebo potřeba vyloučit jiné chronické jaterní onemocnění.
Samotná pozitivita AMA není dostatečná pro diagnózu PBC. U nemocných s AMA pozitivitou bez přítomné cholestázy se doporučuje klinická a laboratorní kontrola 1× ročně [2].
Prognostické ukazatele
PBC je progresivním onemocněním s vysokým rizikem rozvoje jaterní cirhózy, portální hypertenze a všech komplikací jako u ostatních nemocných s jaterní cirhózou.
Prognóza nemocných v době diagnózy je určována na základě demografických parametrů (věk, pohlaví), základních parametrů laboratorních (zejména hodnoty sérového bilirubinu a albuminu), pokročilosti jaterního onemocnění (histologické vyšetření a/nebo neinvazivní metody stanovení stupně jaterní fibrózy) [2,9]. Ke kalkulaci odhadu rizika je používáno Mayo risk skóre (MRS), které je dále spolu s MELD skóre používáno i v rozhodování o indikaci k transplantaci jater [2,10]. Pro výpočet obou skóre jsou standardně používány webové kalkulátory (www.mayoclinic.org).
Mayo risk skóre [10]
MRS = 0,871 × ln (bilirubin (mg/dl)) – 2,53 × ln (albumin (g/dl)) + 0,039 × věk (roky) + 2,38 (protrombinový čas (s)) + 0,859 edém (0 – žádné otoky, žádná diuretika; 0,5 – otoky, žádná diuretika nebo žádné otoky, diuretika; 1 – otoky + diuretika).
Dalším důležitým prognostickým ukazatelem v průběhu léčby je odpověď na terapii ursodeoxycholovou kyselinou (UDCA). Na základě vývoje základních laboratorních parametrů se u léčených nemocných provádí stanovení odpovědi na léčbu po 12 měsících terapie (tab. 3) (v závislosti na zvolených kritériích lze i po 6 nebo 24 měsících). Odpověď na léčbu je podle řady retrospektivních a prospektivních dat vysoce validním ukazatelem míry rizika další progrese onemocnění [11–22].
Table 3. Vyhodnocení odpovědi na léčbu UDCA u nemocných s PBC. Tab. 3. Assessing response to UDCA treatment in PBC. 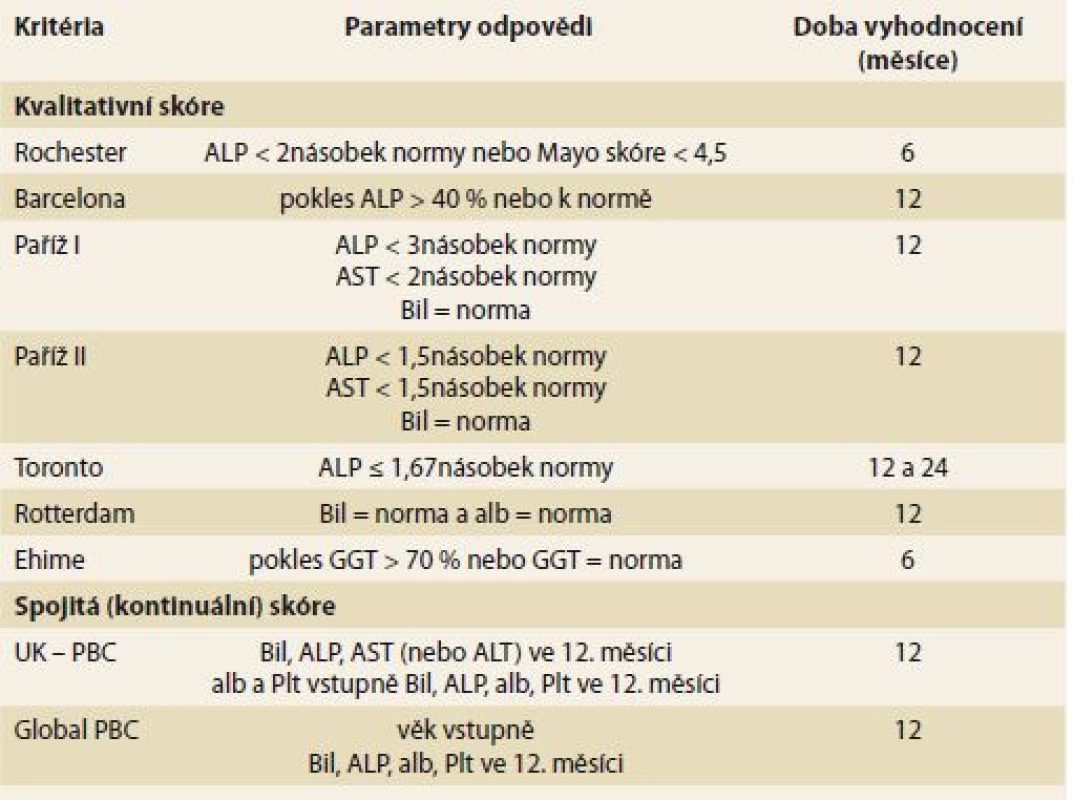
Bil – bilirubin, ALT – alaninaminotransferáza, ALP – alkalická fosfatáza, AST – aspartátaminotransferáza, alb – albumin, Plt – trombocyty, GGT – γ-glutamyltransferáza, UDCA – ursodeoxycholová kyselina, PBC – primární biliární cholangitida U nemocných ve stadiu jaterní cirhózy je indikováno standardní sledování jako u ostatních nemocných s jaterní cirhózou jiné etiologie, a to jak UZ screeningové kontroly k vyhledávání hepatocelulárního karcinomu, tak i pravidelné gastroskopické kontroly k zjištění klinicky významné portální hypertenze podle daných doporučení [2].
Nemocné bez jaterní cirhózy v závislosti na výše uvedených rizikových faktorech sledujeme obvykle v intervalech 6 měsíců. Vždy monitorujeme základní laboratorní hodnoty pokročilosti a aktivity choroby (sérový bilirubin, ALP, AST, albumin, trombocyty) [2]. Dle možností je vhodné k časné diagnostice progrese onemocnění v ročních intervalech provádět jaterní elastografii. Názory na provádění dispenzárních UZ kontrol u nemocných v pokročilejším stadiu bez cirhózy nejsou jednoznačné. U nemocných s pokročilejším onemocněním (tuhost jater vyšetřená pomocí TE ≥ 9,6 kPa nebo III. stadium dle jaterní histologie) a přítomností rizikových faktorů provádíme UZ sledování obvykle 1× za 6–12 měsíců.
Léčba
Z pohledu testování a hodnocení výsledků léčby v randomizovaných studiích je u PBC problematická jak pomalá progrese onemocnění, tak povětšinou velký rozdíl v pokročilosti choroby u jednotlivých nemocných v době diagnózy. Proto v řadě studií není adekvátně hodnocena doba přežívání nebo doba do potřeby transplantace jater. Převážně jsou hodnoceny již dříve verifikované a obecně přijímané jak laboratorní, neinvazivní, tak histologické ukazatele rizika progrese (ALP, bilirubin, albumin, výsledky hodnocení tuhosti jater pomocí jaterní elastografie, stupeň jaterní fibrózy) [11,13–20].
Léčba 1. linie
Ursodeoxycholová kyselina
UDCA dnes jednoznačně léčbou první volby u všech nemocných s PBC. UDCA je u člověka terciální žlučovou kyselinou a v lidské žluči je obsažena v 1–3 %. Jedná se o 7β-epimer chenodeoxycholové kyseliny (CDCA). Je hydrofilnější než její strukturní analog. Jak naznačuje její název, UDCA je primární žlučovou kyselinou medvědů (Ursidae). Z jejich žluči byla v minulosti také získávána. Obecně využití medvědí žluči v terapii jaterních onemocnění má velmi dlouhou tradici a první zmínky o jejím využití se objevují v Číně již v 7. st. n. l. [23]. V evropské medicíně se objevuje již jako chemicky částečně syntetizovaná molekula od 70. let minulého století. První prospektivní randomizovaná studie s UDCA u nemocných s PBC byla publikována v roce 1989 [24].
Efekt UDCA je velmi široký a všechny úrovně, na kterých UDCA působí, nejsou dosud rozpoznány. V experimentu byl prokázán efekt UDCA na snížení reabsorbce hydrofobních žlučových kyselin v terminálním ileu (kompetice), zvýšení pólu hydrofilních žlučových kyselin ve žluči, stabilizaci membrán i imunomodulační efekty. V hepatocytu zvyšuje expresi BSEP (bile satl export pump), snižuje permeabilitu mitochondriální membrány a má efekt antiapoptotický [25]. Na úrovni cholangiocytu zvyšuje expresi AE2, choleresu, a tím sekreci HCO3 a ochranu cholangiocytu s antiapoptotickým a protizánětlivým efektem. Při léčbě podíl UDCA ve žluči značně stoupá a v závislosti na dávce se stává nejvíce zastoupenou žlučovou kyselinou [25]. V klinické praxi byl efekt UDCA na průběh PBC pozitivně testován v různých dávkách (5–25 mg/kg/den) a jako optimální se jeví podávání 13–15 mg/kg/den. Tři velké prospektivní randomizované studie (548 pacientů) u nemocných se středně až více pokročilým onemocněním s touto dávkou UDCA ukázaly snížení potřeby transplantace jater a letality v porovnání s placebem o 1/3 (RR 1,9 CI (1,3–2,8)) [2,26,27]. Podobný efekt UDCA v porovnání s placebem na snížení progrese onemocnění do významné fibrózy nebo cirhózy (7 vs. 34 %) a udržení časného stadia (76 vs. 29 %) ukázala i studie francouzská [28]. Následná metaanalýza více než tisíce nemocných ze sedmi randomizovaných kontrolních studií. z roku 2006 tyto výsledky potvrdila. Ukázala signifikantní snížení potřeby jaterní transplantace (odds ratio 0,65), rizika úmrtí, a navíc ukázala větší profit u nemocných s nižším stadiem jaterní fibrózy (stadium I a II) [29].
Nejvýznamnější data pochází z retrospektivní analýzy Global PBC study group z roku 2014 (4 845 nemocných), kdy v horizontu 5, 10 a 15 let v porovnání s neléčenou skupinou opět ukázala signifikantní rozdíl (90 vs. 78 %, 66 vs. 79 % a 59 vs. 32 %) v prodloužení doby do transplantace i přežívání [22,30].
Obecně platí, že léčba UDCA je velmi bezpečná. V některých případech byl popsán vzestup hmotnosti, dyspeptické potíže a průjmy. Procento nemocných, u kterých je však nutno léčbu pro nežádoucí účinky přerušit, je malé (3–20 %) [31]. Dle posledních expertních názorů (EASL) je UDCA považována za bezpečný lék v těhotenství i v poporodním období, a v těhotenství je tak možné v léčbě pokračovat [2].
Za validní ukazatele adekvátní odpovědi na léčbu jsou dnes považovány základní laboratorní hodnoty, zejména aktivita ALP a koncentrace sérového bilirubinu. Podle některých kritérií i aktivita AST, koncentrace sérového albuminu a hodnoty trombocytů (tab. 3). Do budoucna se jako perspektivní jeví i neinvazivní metody vyšetřování jaterní fibrózy [32].
Ne všichni nemocní bohužel na terapii UDCA odpoví adekvátním poklesem nebo normalizací těchto laboratorních hodnot (viz dále). Hůře odpovídají nemocní mladší 45 let, muži a nemocní v pokročilejším stadiu jaterního onemocnění s vyšší hodnotou bilirubinu. V histologickém nálezu je negativním prediktivním ukazatelem pokročilejší stadium jaterní fibrózy a vyšší stupeň lymfocytárního periportálního infiltrátu a duktopenie. Některé práce ukazují i horší odpověď u nemocných s AMA negativitou a ANA pozitivitou (sp100, gp210).
Procento nemocných, kteří na léčbu neodpoví, je uváděno v poměrně širokém rozmezí (5–25 %). V posledních 10 letech vzniklo několik skórovacích prediktivních systémů založených především na laboratorních datech pro vyhodnocení odpovědi či neodpovědi na léčbu (tab. 3). Kromě Torontských kritérií [15,16], která byla vytvořena z prospektivních dat k hodnocení histologického stadia onemocnění, se u ostatních kritérií jedná o data z retrospektivních kohort [11–14,17–22]. Společné však zůstává, že u nemocných v časném stadiu jaterní choroby a s dobrou odpovědí hodnocenou dle poklesu základních laboratorních parametrů (ALP < 1,5násobek normy, normální sérový bilirubin) se přežívání blíží obecné srovnatelné populaci [2]. U nemocných s pokročilejším stadiem onemocnění v době diagnózy a dobrou odpovědí na léčbu UDCA tato léčba prodlužuje přežívání a snižuje potřebu transplantace jater [33]. Naopak ve skupině bez adekvátní odpovědi (pokles ALP a bilirubinu) je přežívání signifikantně kratší.
Pro tuto podskupinu nemocných se stále hledá adekvátní léčba. První data ukazují možnou efektivitu několika lékových skupin.
UDCA v dávce 13–15 mg/kg/den je lékem první volby u všech nemocných s PBC. Léčba je celoživotní [2].
Potenciální léčba 2. linie
Obeticholová kyselina
Obeticholová kyselina (OCA) je derivátem CDCA. Na rozdíl od UDCA má však afinitu k FXR receptoru, kde působí jako agonista. Tento receptor hraje zásadní roli v řízení metabolizmu žlučových kyselin i v celé řadě dalších metabolických procesů. Aktivace nukleárního FXR receptoru v enterocytech terminálního ilea vede k produkci FGF-19, který zpětnovazebně snížením aktivity cholesterol7α-hydroxylázy redukuje syntézu žlučových kyselin v játrech. Působí i jako růstový faktor cholangiocytů a hepatocytů. Naopak při snížené aktivitě FXR je popisována zvýšená exprese ASBT (apical sodium bile acid transporter), která vede ke zvýšené reabsorbci žlučových kyselin s možným vlivem na apoptózu hepatocytů. Aktivace FXR receptoru je spojena i s řadou metabolických účinků, jako jsou snížení jaterní glukoneogeneze, zvýšení β-oxidace mastných kyselin, zlepšení periferní inzulinové senzitivity a protizánětlivé účinky.
OCA je primárně vyvíjena a zkoušena u nonrespondentů na léčbu UDCA s PBC [34]. Ve studii fáze III byla prokázána biochemická účinnost OCA u nemocných, kteří neodpověděli adekvátně na terapii UDCA podle Torontských kritérií (ALP > 1,67 ULN a/nebo nadhraniční koncentrace sérového bilirubinu do dvojnásobku normy). V podskupinách léčených 5 a 10 mg OCA v kombinaci s UDCA byl zaznamenán signifikantní pokles ALP a bilirubinu pod cílovou hranici u 46 a 47 % nemocných [35]. Na základě těchto dat byla OCA v květnu 2016 Úřadem pro kontrolu léčiv FDA a prosinci 2016 Evropskou lékovou agenturou podmínečně v kombinační léčbě s UDCA schválena jako možná terapie u nemocných s nedostatečnou odpovědí na terapii UDCA. Pozitivní efekt na hlavní laboratorní ukazatele cholestázy byl potvrzen přitom i v monoterapii [36]. Na základě těchto dat EASL od roku 2017 navrhuje zvážit podání OCA jako léčbu 2. linie u nemocných s neadekvátní odpovědí na 12měsíční léčbu UDCA (ALP > 1,67× ULN a/nebo zvýšená sérová koncentrace celkového sérového bilirubinu do dvojnásobku normy) nebo u nemocných, kteří nemohou UDCA užívat pro intoleranci nebo hypersenzitivitu. Uvedená horní hranice bilirubinu přitom tvoří bezpečnostní bariéru. Dosud totiž nejsou dostupná data o efektu a bezpečnosti léčby u nemocných v pokročilejších stadiích jaterního onemocnění (jaterní cirhóza ve stadiu B nebo C dle Childa a Pugha). Při hodnocení sérových koncentrací bilirubinu je třeba též zvažovat, zda se nejedná o jedince se současným Gilbertovým syndromem (5–7 % populace).
Ze známých dat lze očekávat pozitivní odpověď na léčbu u 40–50 % nemocných [35,36]. Léčba dle doporučení EASL má být u kompenzovaných nemocných zahájena dávkou 5 mg/den s možností navýšení dle efektu po 6 měsících. V případě zahájení terapie je z dat studie POISE zřejmé, že k poklesu hodnot ALP dochází zejména v úvodu léčby, a pokud není ani částečný pokles patrný po 3 měsících, pak není další léčba s vysokou pravděpodobností již účinná [35]. V případě zvažování této terapie je třeba také zohlednit celkovou prognózu nemocného, pokročilost jaterního onemocnění hodnocenou pomocí jaterní histologie nebo jaterní elastografie, věk nemocného a další rizikové faktory progrese. V ČR i v Evropě zůstává stále otázkou nákladová efektivita této terapie. Nákladová studie byla zatím provedena pouze ve Spojených státech [37].
Pokud léčbu OCA zahájíme, je nemocného třeba bedlivě sledovat alespoň v 3měsíčních intervalech k hodnocení efektu léčby a hodnocení případných nežádoucích účinků, zejména možného zhoršení pruritu a dekompenzaci jaterního onemocnění. Pokud dojde k poklesu sérové aktivity ALP pod 1,67× ULN a sérové koncentrace celkového bilirubinu ≤ ULN, je dle současných dat indikace k dalšímu pokračování terapie [2].
Kritéria pro zvážení zahájení terapie OCA (postačuje naplnění kritéria 1 nebo 2)
- sérová aktivita ALP > 1,67× ULN a/nebo zvýšená sérová koncentrace celkového bilirubinu do < 2× ULN, a to při min. 12 měsíců trvající léčbě UDCA v terapeutických dávkách;
- v dokumentaci je doložena intolerance UDCA (tj. zejména jde-li o možné nežádoucí účinky).
Kritéria pro ukončení léčby (postačuje naplnění vždy jediného kritéria)
Ukončení ve 3. měsíci terapie OCA
- ve 3. měsíci léčby nedošlo k poklesu > 10 % výchozí sérové aktivity ALP.
Ukončení ve 12. měsíci terapie OCA
- ve 12. měsíci léčby OCA je sérová aktivita ALP > 1,67× ULN a/nebo sérová koncentrace celkového bilirubinu > ULN (za předpokladu nepřerušované léčby OCA).
Kdykoli v průběhu léčby
- jakékoli závažné nežádoucí účinky léčby, především ve smyslu dekompenzace chronického jaterního onemocnění, rozvoj farmakoterapií ne-kontrolovatelného pruritu nebo zá-važné dyslipidemie.
Pokud došlo k poklesu sérové aktivity ALP pod 1,67× ULN a sérová koncentrace celkového bilirubinu je ≤ ULN, je indikace k dalšímu pokračování terapie.
Budesonid
Budesonid je syntetický kortikosteroid s vysokým first-pass metabolizmem v játrech a nízkými systémovými nežádoucími účinky. Pozitivní efekt systémových kortikoidů kromě overlap syndromu PBC s AIH na průběh onemocnění nebyl dosud dokumentován. V případě budesonidu je však známo, kromě jeho protizánětlivých účinků, i jeho synergické působení s UDCA na expresi AE2 jako jednoho z protektivních faktorů cholangiocytu [38].
Z tohoto pohledu byl proto budesonid zkoumán v několika menších prospektivních studiích. V roce 1999 byla publikována práce dokumentující na 39 nemocných v horizontu 2 let pozitivní efekt užívání 9 mg budesonidu denně [39]. Podobně pozitivní výsledky přinesla i 3letá studie finských autorů, kteří ukázali zlepšení histologického nálezu u 25 % nemocných s kombinovanou léčbou [40]. Další práce ale tento pozitivní efekt již nepotvrdily. Pro definitivní doporučení se stále jedná o data z malých souborů. V současné době probíhá rozsáhlá mezinárodní multicentrická studie porovnávající UDCA v kombinaci s budesonidem proti UDCA s placebem na 144 nemocných (Eudra CT No 2007-004040-70). Její výsledky nebyly dosud publikovány.
Fibráty
Fibráty jsou léky užívané běžně v terapii dyslipidemií. Jejich účinek je dán agonistickým působením na PPARα receptorech, které se uplatňují nejen v metabolických pochodech, ale i na úrovni reakcí monocyto-makrofágového systému i metabolizmu samotného hepatocytu a cholangiocytu. Nepřímo ovlivňují i produkci žlučových kyselin [2]. Z tohoto důvodu je tato léková skupina v posledních letech testována jako možná terapie PBC. V menších studiích vedlo přidání bezafibrátu (400 mg/den) v kombinaci s UDCA v porovnání s placebem k normalizaci ALP (45 vs. 18 % pacientů) [41]. Ve studii probíhající 100–120 měsíců bylo spojeno i s trendem k lepšímu přežití [42]. U určitého procenta nemocných je popisováno i zlepšení pruritu [43]. V metaanalýze byla celková biochemická odpověď u předchozích nonrespondentů uváděna v 69 % [44].
Zatím největší prospektivní randomizovaná studie (BEZURSO) s dobou terapie v trvání 2 let byla ukončena v roce 2017. Studie BEZURSO (NCT01654731) sledovala efekt bezafibrátu v dávce 400 mg/den v kombinaci s UDCA u nemocných s neadekvátní odpovědí na monoterapii UDCA dle kritérií Paříž II. Na 100 zařazených pacientech dokumentovala normalizaci aktivity ALP u 67 % nemocných spolu se signifikantní redukcí únavy a pruritu (částečný pokles LS a ELF skóre). U léčených nemocných nebyl přitom zaznamenán zvýšený výskyt závažných nežádoucích účinků. Výsledky této studie je nutné zatím brát jen jako předběžné, byly prezentovány na konferenci EASL v dubnu 2017, nebyly ale dosud publikovány.
Z pohledu potenciální léčby fibráty je třeba velké pozornosti na současné podávání nesteroidních antiflogistik vedoucí k výrazně vyššímu riziku nežádoucích účinků, zejména jaterního a renálního poškození [2].
Všechna data o této potenciální léčebné možnosti v současné době pocházejí jen z menších studií a data z větších randomizovaných studií III. fáze klinického zkoušení s budesonidem (u necirhotiků) a bezafibrátem, obojí v kombinaci s UDCA, nejsou dosud kompletně publikována. V současnosti proto není možné vydat jednoznačné doporučení pro použití obou léků. Do budoucna se zdá být použití těchto léků 2. linie velmi nadějné.
U ostatních preparátů, které byly zkoušeny, se efekt na zpomalení progrese PBC neprokázal (azathioprin, metotrexát, D-penicilamin, kolchicin).
V současně době nejsou dostatečná data pro jednoznačné doporučení pro podání nebo nepodání budesonidu nebo fibrátů (bezafibrátu) jako léků 2. linie u nemocných s PBC.
Další významné klinické projevy
Pruritus
Pruritus patří mezi nejčastější příznaky provázející PBC. Značně ovlivňuje kvalitu života a v případech rezistentních ke standardní terapii může být i indikací k transplantaci jater. Může se objevit v kterémkoli stadiu jaterní choroby i o řadu let předcházet laboratorním projevům onemocnění. Efekt UDCA na pruritus není jasně prokázán, i když některá data pozitivní efekt dokumentují [45]. OCA pruritus dokonce u 30–35 % léčených významně zhoršuje.
V 1. linii nemocnému nabízíme lokálně chladicí emolentia. K lékům první volby patří hlavně sekvestranty žlučových kyselin. Nejčastěji je s dobrým efektem používán cholestyramin. Požití cholestyraminu musí být odděleno od ostatní medikace, zejména UDCA, o 2–4 hod. Problémem může být horší snášenlivost. V případě neúčinnosti této léčby by další volbou mohlo být podání rifampicinu, jehož efektivita je dokumentována v několika studiích [46] i metaanalýzách [47,48]. Vzhledem k celkové strategii indikace antibiotik není ale jeho podání u nás v současné době v léčbě pruritu možné. Jako 3. linii lze použít léky ze skupiny perorálních opoidních antagonistů (naltrexon, nalmefen). Problematická může být jejich dlouhodobá snášenlivost. Mohou se objevit projevy syndromu odnětí nebo snížení tolerance bolesti.
Spolu s psychoterapií lze empiricky použít i inhibitory zpětného vychytávání serotoninu nebo gabapentin. Některé práce jako účinnou, ale technicky ne vždy proveditelnou a nemocným tolerovanou, shledaly možnost derivace žluči pomocí nazobiliární drenáže.
V případě refrakterního pruritu je třeba zvážit i možnost transplantace jater, která může být indikována i bez významné jaterní dysfunkce.
Únava
Zvýšená únava je s PBC asociována ve vysokém procentu (nad 50 %) a ve vysoké míře může vést až k signifikantnímu snížení kvality života nemocných (20 %) [2]. V případě výskytu výrazné únavy je nutné se zaměřit zejména na cílené vyhledávání únavu zhoršujících faktorů, převážně anémii, hypotyreózu a poruchy spánku. V některých případech je třeba nemocnému poskytnout i psychologickou nebo psychiatrickou léčbu.
Metabolická kostní choroba
U nemocných s PBC je osteoporóza velmi častou komplikací a je nutné na ni vždy myslet. Vysoké riziko je zvláště u nemocných s pokročilou jaterní chorobou a výraznou cholestázou. U méně pokročilých nemocných jsou rizikovými faktory kouření, malá fyzická aktivita, nižší tělesná hmotnost, pozitivní rodinná anamnéza, ženské pohlaví a vyšší věk. U každého nemocného je doporučeno vyšetření duální rentgenovou absorpciometrií v době diagnózy a dále dle vstupního nálezu a individuálních rizikových faktorů v 1–5letých intervalech.
Léčba může být velmi problematická, ale včasné zahájení je naprosto zásadní. V 1. linii suplementujeme vápník v dávce 1 500 mg a vitamin D (1 000 IU denně). Doporučujeme úpravu pohybového režimu a u postmenopauzálních žen ve spolupráci s gynekologem hormonální substituční léčbu. Hormonální substituce androgeny u mužů není vhodná pro riziko hepatocelulárního karcinomu. S ohledem na mechanizmus účinku lze u nich preferovat denosumab ovlivňující receptor RANKL (receptor activator for nuclear factor kappa B ligand), který se nemetabolizuje v játrech. U závažnějších stavů je indikována léčba bisfosfonáty (zejména alendronát), které jsou i u nemocných s PBC bezpečné [2,49,50]. U nemocných po transplantaci jater je případně variantou zoledronát [51,52]. Zvýšené opatrnosti a zvážení benefitu perorální léčby je ale třeba u nemocných s jícnovými varixy.
Hypovitaminózy
Dle aktuálního stavu řešíme i deficit dalších v tucích rozpustných vitaminů.
Další symptomy
Projevy sicca-syndromu, pokud jsou přítomny, léčíme symptomaticky. Lokálně se u xeroftalmie aplikují umělé slzy. U xerostomie umělé sliny s pečlivou ústní hygienou a zvlhčováním dutiny ústní. V zahraničí je používán a registrován muskarinový agonista cevimelin [2]. Vaginální projevy nutno řešit ve spolupráci s gynekologem.
Projevy Raynaudova fenoménu jsou v různých sériích popisovány kolem 8 %. Základním doporučením je přestat kou?it a chr?nit kon?etiny p?ed vlivem chladu. Ve farmakoterapii je mo?n? přit a chránit končetiny před vlivem chladu. Ve farmakoterapii je možné použít blokátory kalciového kanálu.
Těhotenství
Těhotenství může být komplikováno zhoršením pruritu. Choroba není ale kontraindikací těhotenství. Diagnostika PBC v době těhotenství zahrnuje zejména diferenciální diagnostiku s intrahepatální cholestázou těhotných, se kterou má společný laboratorní obraz i častý výskyt pruritu. Léčba UDCA je považována za bezpečnou během početí, těhotenství i šestinedělí [2,53]. Cholestyramin i rifampicin jsou v léčbě pruritu od 3. trimestru považovány za léčbu bezpečnou, i když data nejsou příliš bohatá [2,54,55]. Velmi pečlivé sledování vyžaduje skupina s pokročilým jaterním onemocněním ve stadiu jaterní cirhózy s portální hypertenzí.
Překryvný (overlap) syndrom s AIH
PBC je autoimunitní chorobou. U některých nemocných můžeme nalézt laboratorní znaky PBC i AIH současně. Stejně tak se můžeme setkat s nemocnými s typickým obrazem PBC a současně PSC. Tyto případy se nazývají překryvným syndromem. Prevalence těchto syndromů činí asi 10 % ze všech případů autoimunitních jaterních chorob. Nomenklatura ale není zcela jednotná.
Z pohledu terapie je důležité odlišit zejména překryvný syndrom PBC s AIH. V tomto případě se ale neobejdeme bez jaterní biopsie a histologického vyšetření.
I PBC je provázena v histologickém nálezu různým stupněm lymfocytární infiltrace. Klasicky je ale lokalizována periduktálně a pouze minimálně nalézáme obraz lobulárního zánětu nebo interface hepatitidy. U 8–10 % nemocných se však mohou zánětlivé změny v histologickém obraze blížit nálezu AIH s obrazem lobulární a interface hepatitidy. Důležité je, že tento nález může být jak v době diagnózy, tak se může rozvinout i v průběhu dalších let. Podezření na překryvný syndrom s AIH musíme mít u nemocných, u kterých v laboratorním obraze nalézáme krom cholestatických rysů i výraznější elevaci aminotransferáz a IgG. Dle pařížských kritérií [2] mají být pro diagnózu naplněna diagnostická kritéria jak pro PBC (ALP > 2násobek normy nebo GGT > 5násobek normy, AMA 1 : 40, duktální léze v histologii), tak alespoň dva znaky z následujících: ALT > 5násobek normálních hodnot, IgG > 2násobek normálních laboratorních hodnot nebo pozitivita ASMA, těžká nebo středně těžká interface hepatitida v histologickém nálezu. U těchto nemocných je současně s UDCA indikována i kortikoterapie nebo další imunosupresivní léčba jako u AIH [2]. U nemocných s překryvným syndromem také můžeme nalézt pozitivitu SLA a anti-dsDNA, které diagnózu podporují.
Závěr
PBC je chronické cholestatické autoimunitní jaterní onemocnění, u neléčených nemocných s vysokým rizikem progrese do jaterní cirhózy. Diagnóza je založena na přítomnosti cholestatického laboratorního obrazu, průkazu AMA nebo typickém histologickém nálezu. Léčebně je indikováno podávání UDCA, léčba symptomů, zejména pruritu, a prevence nebo léčba kostní choroby. V případě adekvátní odpovědi na léčbu UDCA je prognóza nemocných dále dobrá. U pacientů, kteří na léčbu neodpoví, lze zvážit možnost podání léčby 2. linie. U nemocných s pokročilou jaterní chorobou vždy musíme zvážit možnosti transplantační léčby a nemocné sledovat dle standardů pro nemocné s jaterní cirhózou, zejména s ohledem k asociované portální hypertenzi.
Použité zkratky
AASLD – Americká asociace pro studium jaterních chorob
AIH – autoimunitní hepatitida
ALP – alkalická fosfatáza
AST – aspatrátaminotrasferáza
ALT – alaninamonotransferáza
AMA – antimitochondriální protilátky
ANA – antinukleární protilátky
ASMA – protilátky proti hladkému svalu
CDCA – chenodeoxycholová kyselina
CI – interval spolehlivosti
EASL – Evropská asociace pro studium jater
EUS – endosonografie
GGT – γ-glutamyltransferáza
IgG – imunoglobulin G
MRCP – magnetická rezonanční cholangiopankreatografie
MRS – Mayo risk skóre
OCA – obeticholová kyselina
PBC – primární biliární cholangitida
RR – relativní riziko
TE – tranzientní elastografie
UDCA – ursodeoxycholová kyselina
ULN – horní hranice normy
UZ – ultrazvuk
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Výborem ČHS ČLS JEP schváleno 20. 3. 2018.
MUDr. Tomáš Fejfar, Ph.D.
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
Sources
1. AASLD. A name change for PBC: cholangitis replacing cirrhosis. [online]. Dostupné z: http: // www.aasld.org/name-change-pbc-cholangitis-replacing-cirrhosis#sthash.hrd6kN6F.dpuf.
2. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: the diag-nosis and management of patients with primary biliary cholangitis. J Hepatol 2017; 67 (1): 145–172. doi: 10.1016/j.jhep.2017.03.022.
3. Invernizzi P, Lleo A, Podda M. Interpreting serological tests in diagnosing autoimmune liver diseases. Semin Liver Dis 2007; 27 (2): 161–172.
4. Vergani D, Alvarez F, Bianchi FB et al. Liver autoimmune serology: a consensus statement from the committee for autoimmune serology of the International Autoimmune Hepatitis Group. J Hepatol 2004; 41 (4): 677–683.
5. Ong J, Erdei E, Rubin RL et al. Mercury, autoimmunity, and environmental factors on cheyenne river sioux tribal lands. Autoimmune Dis 2014; 2014 : 325461. doi: 10.1155/2014/325461.
6. Dahlqvist G, Gaouar F, Carrat F et al. Large-scale characterization study of patients with antimitochondrial antibodies but nonestablished primary biliary cholangitis. Hepatology 2017; 65 (1): 152–163. doi: 10.1002/hep.28859.
7. Hirschfield GM, Heathcote EJ. Antimitochondrial antibody-negative primary biliary cirrhosis. Clin Liver Dis 2008; 12 (2): 323–331. doi: 10.1016/j.cld.2008.02.003.
8. Kakuda Y, Harada K, Sawada-Kitamura S et al. Evaluation of a new histologic staging and grading system for primary biliary cirrhosis in comparison with classical systems. Hum Pathol 2013; 44 (6): 1107–1117. doi: 10.1016/j.humpath.2012.09.017.
9. Carbone M, Mells GF, Pells G et al. Sex and age are determinants of the clinical phenotype of primary biliary cirrhosis and response to ursodeoxycholic acid. Gastroenterology 2013; 144 : 560–569. doi: 10.1053/j.gastro.2012.12.005.
10. Mayo clinic. Mayo PBC model. [online]. Dostupné z: https: //www.mayoclinic.org/medical-professionals/model-end-stage-liver-disease/updated-natural-history-model-for-primary-biliary-cirrhosis.
11. Angulo P, Lindor KD, Therneau TM et al. Utilization of the Mayo risk score in patients with primary biliary cirrhosis receiving ursodeoxycholic acid. Liver 1999; 19 (2): 115–121.
12. Parés A, Caballería L, Rodés J. Excellent long-term survival in patients with primary biliary cirrhosis and biochemical response to ursodeoxycholic acid. Gastroenterology 2006; 130 (3): 715–720.
13. Corpechot C, Abenavoli L, Rabahi N et al. Biochemical response to ursodeoxycholic acid and long-term prognosis in primary biliary cirrhosis. Hepatology 2008; 48 (3): 871–877. doi: 10.1002/hep.22428.
14. Kuiper EM, Hansen BE, de Vries RA et al. Improved prognosis of patients with primary biliary cirrhosis that have a biochemical response to ursodeoxycholic acid. Gastroenterology 2009; 136 (4): 1281–1287. doi: 10.1053/j.gastro.2009.01.003.
15. Kumagi T, Guindi M, Fischer SE et al. Baseline ductopenia and treatment response predict long-term histological progression in primary biliary cirrhosis. Am J Gastroenterol 2010; 105 (10): 2186–2194. doi: 10.1038/ajg.2010.216.
16. Lammert C, Juran BD, Schlicht E et al. Biochemical response to ursodeoxycholic acid predicts survival in a North American cohort of primary biliary cirrhosis patients. J Gastroenterol 2014; 49 (10): 1414–1420. doi: 10.1007/s00535-013-0903-1.
17. Corpechot C, Chazouillères O, Poupon R. Early primary biliary cirrhosis: biochemical response to treatment and prediction of long-term outcome. J Hepatol 2011; 55 (6): 1361–1367. doi: 10.1016/j.jhep.2011.02.031.
18. Azemoto N, Abe M, Murata Y et al. Early biochemical response to ursodeoxycholic acid predicts symptom development in patients with asymptomatic primary biliary cirrhosis. J Gastroenterol 2009; 44 (6): 630–634. doi: 10.1007/s00535-009-0051-9.
19. Azemoto N, Kumagi T, Abe M et al. Biochemical response to ursodeoxycholic acid predicts long-term outcome in Japanese patients with primary biliary cirrhosis. Hepatol Res 2011; 41 (4): 310–317. doi: 10.1111/j.1872-034X.2011.00782.x.
20. Momah N, Silveira MG, Jorgensen R et al. Optimizing biochemical markers as endpoints for clinical trials in primary biliary cirrhosis. Liver Int 2012; 32 (5): 790–795. doi: 10.1111/j.1478-3231.2011.02678.x.
21. Carbone M, Sharp SJ, Flack S et al. The UK-PBC risk scores: derivation and validation of a scoring system for long-term prediction of end-stage liver disease in primary biliary cirrhosis. Hepatology 2016; 63 (3): 930–950. doi: 10.1002/hep.28017.
22. Lammers WJ, Hirschfield GM, Corpechot C et al. Development and validation of a scoring system to predict outcomes of patients with primary biliary cirrhosis receiving ursodeoxycholic acid therapy. Gastroenterology 2015; 149 (7): 1804–1812. doi: 10.1053/j.gastro.2015.07.061.
23. Beuers U, Trauner M, Jansen P et al. New paradigms in the treatment of hepatic cholestasis: from UDCA to FXR, PXR and beyond. J Hepatol 2015; 62 (1 Suppl): S25–S37. doi: 10.1016/j.jhep.2015.02.023.
24. Leuschner U, Fischer H, Kurtz W et al. Ursodeoxycholic acid in primary biliary cirrhosis: results of a controlled double-blind trial. Gastroenterology 1989; 97 (5): 1268–1274.
25. Juřica J. Ursodeoxycholová kyselina. Remedia 2016; 26 (6): 529–535.
26. Poupon RE, Lindor KD, Cauch-Dudek K et al. Combined analysis of randomized controlled trials of ursodeoxycholic acid in primary biliary cirrhosis. Gastroenterology 1997; 113 (3): 884–890.
27. Lindor KD, Dickson ER, Baldus WP et al. Ursodeoxycholic acid in the treatment of primary biliary cirrhosis. Gastroenterology 1994; 106 (5): 1284–1290.
28. Corpechot C, Carrat F, Bonnand AM et al. The effect of ursodeoxycholic acid therapy on liver fibrosis progression in primary biliary cirrhosis. Hepatology 2000; 32 (6): 1196–1199.
29. Shi J, Wu C, Lin Y et al. Long-term effects of mid-dose ursodeoxycholic acid in primary biliary cirrhosis: a meta-analysis of randomized controlled trials. Am J Gastroenterol 2006; 101 (7): 1529–1538.
30. Lammers WJ, van Buuren HR, Hirschfield GM et al. Levels of alkaline phosphate and bilirubin are surrogate end points of outcomes of patients with primary biliary cirrhosis: an international follow up study. Gastroenterology 2014; 147 (6): 1338–1349. doi: 10.1053/j.gastro.2014.08.029.
31. Hempfling W, Dilger K, Beuers U. Systematic review: ursodeoxycholic acid-adverse effects and drug interactions. Aliment Pharmacol Ther 2003; 18 (10): 963–972.
32. European Association for Study of Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol 2015; 63 (1): 237–264. doi: 10.1016/j.jhep.2015.04.006.
33. Poupon RE, Lindor KD, Cauch-Dudek K et al. Combined analysis of randomized controlled trials of ursodeoxycholic acid in primary biliary cirrhosis. Gastroenterology 1997; 113 (3): 884–890.
34. Hirschfield GM, Mason A, Luketic V et al. Efficacy of obeticholic acid in patients with primary biliary cirrhosis and inadequate response to ursodeoxycholic acid. Gastroenterology 2015; 148 (4): 751–761. doi: 10.1053/j.gastro.2014.12.005.
35. Nevens F, Andreone P, Mazzella G et al. POISE Study Group. A placebo-controlled trial of obeticholic acid in primary biliary cholangitis. N Engl J Med 2016; 375 (7): 631–643. doi: 10.1056/NEJMoa1509840.
36. Kowdley KV, Luketic V, Chapman R et al. A randomized trial of obeticholic acid monotherapy in patients with primary biliary cholangitis. Hepatology 2017. In press.
37. Samur S, Klebanoff M, Banken R et al. Long-term clinical impact and cost-effectiveness of obeticholic acid for the treatment of primary biliary cholangitis. Hepatology 2017; 65 (3): 920–928. doi: 10.1002/hep.28932.
38. Arenas F, Hervias I, Uriz M et al. Combination of ursodeoxycholic acid and glucocorticoids upregulates the AE2 alternate promoter in human liver cells. J Clin Invest 2008; 118 (2): 695–709. doi: 10.1172/JCI33156.
39. Leuschner M, Maier KP, Schlichting J et al. Oral budesonide and ursodeoxycholic acid for treatment of primary biliary cirrhosis: results of a prospective double-blind trial. Gastroenterology 1999; 117 (4): 918–925.
40. Rautiainen H, Kärkkäinen P, Karvonen AL et al. Budesonide combined with UDCA to improve liver histology in primary biliary cirrhosis: a three-year randomized trial. Hepatology 2005; 41 (4): 747–752.
41. Kanda T, Yokosuka O, Imazeki F et al. Bezafibrate treatment: a new medical approach for PBC patients? J Gastroenterol 2003; 38 (6): 573–578.
42. Hosonuma K, Sato K, Yamazaki Y et al. A prospective randomized controlled study of long-term combination therapy using ursodeoxycholic acid and bezafibrate in patients with primary biliary cirrhosis and dyslipidemia. Am J Gastroenterol 2015; 110 (3): 423–431. doi: 10.1038/ajg.2015.20.
43. Lens S, Leoz M, Nazal L et al. Bezafibrate normalizes alkaline phosphatase in primary biliary cirrhosis patients with incomplete response to ursodeoxycholic acid. Liver Int 2014; 34 (2): 197–203. doi: 10.1111/liv.12290.
44. Grigorian AY, Mardini HE, Corpechot C et al. Fenofibrate is effective adjunctive therapy in the treatment of primary biliary cirrhosis: a meta-analysis. Clin Res Hepatol Gastroenterol 2015; 39 (3): 296–306. doi: 10.1016/j.clinre.2015.02.011.
45. Matsuzaki Y, Tanaka N, Osuga T et al. Improvement of biliary enzyme levels and itching as a result of long-term administration of ursodeoxycholic acid in primary biliary cirrhosis. Am J Gastroenterol 1990; 85 (1): 15–23.
46. Bachs LP, Parés A, Elena M et al. Effects of long-term rifampicinadministration in primary biliary cirrhosis. Gastroenterology1992; 102 (6): 2077–2080.
47. Tandon P, Rowe BH, Vandermeer B et al. The efficacy and safety ofbile acid binding agents, opioid antagonists or rifampin in the treatment of cholestasis-associated pruritus. Am J Gastroenterol 2007; 102 (7): 1528–1536.
48. Khurana S, Singh P. Rifampin is safe for treatment of pruritus due to chronic cholestasis: a meta-analysis of prospective randomized-controlled trials. Liver Int 2006; 26 (8): 943–948.
49. Wolfhagen FH, van Buuren HR, den Ouden JW et al. Cyclical etidronate in the prevention of bone loss in corticosteroid-treated primary biliary cirrhosis. A prospective, controlled pilot study. J Hepatol 1997; 26 (2): 325–330.
50. Zein CO, Jorgensen RA, Clarke B et al. Alendronate improves bone mineral density in primary biliary cirrhosis: a randomized placebo-controlled trial. Hepatology 2005; 42 (4): 762–771.
51. Bodingbauer M, Wekerle T, Pakrah B et al. Prophylactic bisphosphonates treatment prevents bone fractures after liver transplantation. Am J Transplant 2007; 7 (7): 1763–1769.
52. Misof BM, Bodingbauer M, Roschger P et al. Short-term effects of highdose zoledronic acid treatment on bone minera-lization density distribution after orthotopic liver transplantation. Calcif Tissue Int 2008; 83 (3): 167–175. doi: 10.1007/s00223-008-9161-2.
53. Trivedi PJ, Kumagi T, Al-Harthy N et al. Good maternal and fetal outcomes for pregnant women with primary biliary cirrhosis. Clin Gastroenterol Hepatol 2014; 12 (7): 1179–1185. doi: 10.1016/j.cgh.2013.11.030.
54. Kondrackiene J, Beuers U, Kupcinskas L. Efficacy and safety of ursodeoxycholicacid versus cholestyramine in intrahepatic cholestasis of pregnancy. Gastroenterology 2005; 129 (3): 894–901.
55. Geenes V, Chambers J, Khurana R et al. Rifampicin in the treatment of severe intrahepatic cholestasis of pregnancy. Eur J Obstet Gynecol Reprod Biol 2015; 189 : 59–63. doi: 10.1016/j.ejogrb.2015.03.020.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2018 Issue 2-
All articles in this issue
- Akutní poškození ledvin u pacientů s akutní pankreatitidou
- Kombinace endoskopické slizniční resekce a „full-thickness“ resekce v léčbě adenomu ascendens s příznakem „non-liftingu“
- Populární sleeve gastrectomy – tubulizace žaludku v chirurgické léčbě těžké obezity a cukrovky 2. typu
- Esomeprazol – S-izomer omeprazolu s výhodnějšími farmakologickými vlastnostmi a silnějším farmakodynamickým účinkem
- Gastrointestinálne prejavy familiárnej stredomorskej horúčky – problém aj v strednej Európe?
- Životní jubileum prof. Zdeňka Marečka
- Pohľad na XXIII. Gastrofórum, Štrbské Pleso, 2018
- 6th Conference of Central European Hepatologic Col laboration
- Výběr z mezinárodních časopisů
- Hepatologie
- Primární biliární cholangitida – doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu
- Neobvyklá příčina zvětšování břicha
- Terlipresin – stále nepostradatelný ve dvou indikacích
- Léčba komplikované Crohnovy choroby vedolizumabem
- Infekce jaterní cysty při polycystóze jater jako zdroj sepse
- Hepatocelulárny karcinóm na strednom Slovensku – analýza kohorty 207 pacientov v nemocnici 3. stupňa
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Terlipresin – stále nepostradatelný ve dvou indikacích
- Primární biliární cholangitida – doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu
- Infekce jaterní cysty při polycystóze jater jako zdroj sepse
- Neobvyklá příčina zvětšování břicha
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

