-
Medical journals
- Career
Prediktivní diagnostika HER2 v adenokarcinomu žaludku
Authors: Daum O.ihash2ihash4ihash6 1 2 3 3
Authors‘ workplace: Šiklův ústav patologie LF UK v Plzni a FN Plzeň, Bioptická laboratoř, s. r. o., Plzeň, Fingerlandův ústav patologie LF UK a FN, Hradec Králové 1
Published in: Čes.-slov. Patol., 47, 2011, No. 4, p. 160-163
Category: Reviews Article
Overview
Trastuzumab je monoklonální protilátka proti receptoru HER2, jehož zvýšená exprese je prokazatelná asi u 20 % adenokarcinomů žaludku charakterizovaných horší prognózou. Zároveň však bylo prokázáno signifikantní prodloužení celkové doby přežití pacientů s HER2-pozitivními metastazujícími karcinomy při kombinované terapii s trastuzumabem. Indikace této cílené léčby je založena na stanovení HER2-pozitivity tumoru. Tato HER2 pozitivita se primárně stanovuje imunohistochemickým průkazem overexprese proteinu, a to podle skórovacího systému specifického pro žaludeční lokalizaci, který rozlišuje, zda jde o materiál z resekátu či z endoskopické biopsie. V případě sporné pozitivity imunohistochemického vyšetření (skóre 2+) se provádí analýza amplifikace genu HER2. Za znak HER2-pozitivity je stanoveno imunohistochemické skóre 3+ a dále skóre 2+ s prokázanou amplifikací genu HER2. O případném dalším rozšíření spektra biologické terapie žaludečního adenokarcinomu rozhodnou výsledky probíhajících klinických studií s dalšími monoklonálními protilátkami a inhibitory receptorových tyrosinkináz.
Klíčová slova:
biologická terapie – HER2 – karcinom – trastuzumab – žaludekPřestože je adenokarcinom žaludku jedním z nejčastějších maligních nádorů (1) a ve světovém měřítku druhým nejčastějším nádorem vedoucím ke smrti pacienta (2), zavedení cílené (biologické) terapie do jeho léčby mělo téměř deset let zpoždění za počátky použití monoklonální protilátky proti receptoru pro lidský epidermální růstový faktor 2 (HER2) trastuzumabu jako součásti léčebného schématu HER2-pozitivního pokročilého karcinomu prsu (3). Současné poznatky o možnostech užití trastuzumabu a prediktivního významu exprese proteinu HER2 a amplifikace jeho genu jsou založeny především na výsledcích studie ToGA (4). V této studii bylo celkové přežití skupiny léčené kombinací konvenční chemoterapie s trastuzumabem signifikantně vyšší než u skupiny léčené pouze konvenční chemoterapií. Vzhledem k tomu, že byla prokázána závislost terapeutické odpovědi na stupni exprese proteinu HER2 a amplifikace jeho genu, je role patologa v řízení terapie nezbytná.
GEN A PROTEIN HER2
HER2 (HER-2/neu, c-erbB2) je protoonkogen lokalizovaný na dlouhém raménku 17. chromozomu (5). Patří spolu s HER1 (EGFR, c-erbB1), HER3 (c-erbB3) a HER4 (c-erbB4) do molekulární rodiny receptoru pro lidský epidermální růstový faktor (EGFR). Gen HER2 kóduje stejnojmennou transmembránovou receptorovou tyrozinkinázu, jejíž přirozený ligand není znám, a předpokládá se, že je aktivována především tvorbou homodimerů a heterodimerů s ostatními členy této receptorové rodiny (6). Za nejvýznamnější kombinaci se pokládá heterodimer s HER3, jehož ligandem je Heregulin; tvorba homodimerů však může být vyvolána i samotnou overexpresí proteinu HER2 bez nutnosti aktivace ligandem (7,8). Charakter odpovědi postreceptorových intracelulárních signálních kaskád se liší v závislosti na typu aktivace a kombinaci vytvořeného dimeru, obecně však vede k ovlivnění buněčné proliferace, diferenciace a regulace apoptózy (9,10).
HER2 A ADENOKARCINOM ŽALUDKU
Kvůli nedůslednosti v rozlišování adenokarcinomu žaludku a adenokarcinomu distálního jícnu, heterogenitě studovaných souborů a počáteční nedostatečné standardizaci definice „HER2-pozitivity“ se údaje o četnosti HER2-pozitivních adenokarcinomů žaludku pohybují v širokém intervalu 7–43 %; většina relevantních studií však udává zastoupení okolo 20 %, přičemž adenokarcinomy intestinálního typu jsou výrazně častěji pozitivní než difúzní adenokarcinomy (11–14). HER2-pozitivita je pravděpodobně asociována s horší prognózou (15–17).
Inhibiční účinek trastuzumabu (monoklonální protilátky proti HER2) na progresi HER2-pozitivního adenokarcinomu žaludku byl prokázán jak na tkáňových kulturách, tak v klinické studii ToGA (4,18,19). V této studii léčba trastuzumabem prodloužila střední celkovou dobu přežití o 3 měsíce, přičemž výrazně vyšší účinnost vykazovala léčba touto monoklonální protilátkou u pacientů s HER2-pozitivními nádory.
HODNOCENÍ POZITIVITY HER2 V ADENOKARCINOMU ŽALUDKU
HER2-pozitivní adenokarcinom žaludku indikovaný k terapii trastuzumabem je definovaný pozitivním imunohistochemickým vyšetřením overexprese HER2 (skóre 3+) anebo průkazem amplifikace genu HER2 (v našich podmínkách metodou fluorescenční in situ hybridizace (FISH) či in situ hybridizace se stříbrem (SISH)) při sporném výsledku imunohistochemického vyšetření (skóre 2+). Vyšetření exprese HER2 i stanovení amplifikace jeho genu je nutno provádět v invazivní komponentě nádoru, aby se zajistila co nejvyšší shoda mezi vyšetřeným genetickým a expresním profilem na jedné straně a vlastnostmi případné systémové nádorové nemoci na straně druhé.
Imunohistochemie
Pro zajištění validity výsledků imunohistochemického vyšetření je vyžadováno použití certifikovaných protilátek HercepTestTM firmy Dako nebo PATHWAY® HER2/neu (4B5) firmy Ventana/Roche. Hodnotí se pouze membránová imunopozitivita, jakékoli zbarvení cytoplazmy je nutno považovat za arteficiální. Skórovací systém pro adenokarcinom žaludku se liší od původního skorovacího systému pro karcinom prsu (tab. 1). Změny spočívají zejména v tom, že do kategorie 3+ spadají i tumory s inkompletní (bazolaterální a/nebo laterální) silnou expresí, a v zohlednění výrazné heterogenity barvení při hodnocení endoskopických biopsií (4). Na rozdíl od skórovacího systému prsu je třeba odlišovat hodnocení resekátu tumoru od hodnocení endoskopické biopsie z nádoru. Zatímco dolní hranicí pro hodnocení imunoreaktivity je v resekátu 10 % nádorových buněk, v endoskopických biopsiích je tímto prahem 5 buněk tvořících kohezivní buněčný shluk (klastr). Dalším kritériem je zvětšení objektivu, při kterém je již imunopozitivita patrná. Pro diagnózu overexprese HER2 (3+) by tedy mělo být zbarvení membrány patrné již při použití objektivu s malým zvětšením (2,5–5x). Přestože není požadováno kompletní zbarvení buněčné membrány, granulární nebo luminální membránová pozitivita (tedy zbarvení pouze části membrány tvořící lumen nádorové žlázky) by měla být hodnocena jako arteficiální a tudíž negativní (20) (obr. 1).
Table 1. Kritéria pro skórování exprese HER2 v adenokarcinomu žaludku. 
Image 1. Stanovení skóre exprese HER2 v adenokarcinomu žaludku. 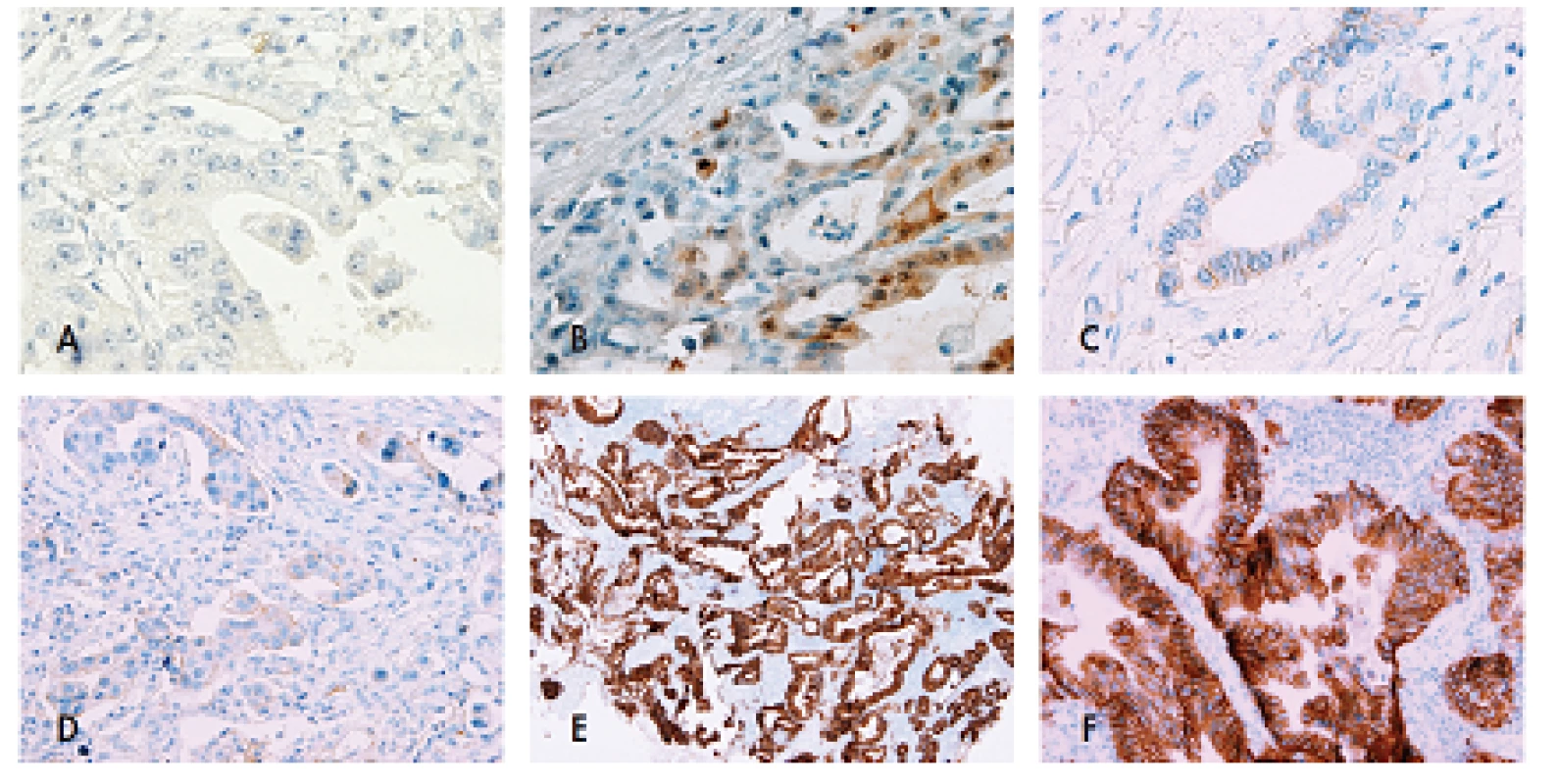
Skóre 0 se většinou jeví jako kompletní absence zbarvení protilátkou proti HER2, a to i při použití objektivu 40x, zde pouze s minimalnim zbarvením luminální membrány ojedinělých buněk (A). Jindy může na prvni pohled být přítomno intenzivní zbarvení nádoru, ale použití velkého zvětšení (objektiv 40x) odhalí, že jde o pozitivitu cytoplazmatickou a/nebo jadernou, což také odpovídá skore 0 (B). Skóre 1+ je charakterizováno nálezem alespoň slabé pozitivity na bazolaterální membránu alespoň 10 % buněk při použití objektivu 40x (C). Zde je zbarvení membrány patrné již při použití objektivu 20x, jde tedy o skore 2+ (D). Pro stanoveni skore 3+ je vyžadována pozitivita pozorovatelná již při malém zvětšeni (zde objektiv 4x) v alespoň 10% buněk (E), přičemž větší zvětšení (zde objektiv 20x) musí prokázat, že jde o pozitivitu membránovou (F). Problémem je stanovení HER2 pozitivity v difúzních adenokarcinomech, u nichž samozřejmě nelze identifikovat bazolaterální membránu, protože buňky netvoří mezibuněčné spoje. Oficiální doporučení pro tento typ adenokarcinomu nejsou jasně definovaná, za pozitivitu v resekátu je však možné považovat lineární cirkumferenciální zbarvení buněčné membrány. Z endoskopické biopsie by neměla být pozitivita nikdy stanovena, protože buňky difúzního adenokarcinomu netvoří kohezivní shluky.
In situ hybridizace
K vyšetření amplifikace genu HER2 metodou FISH jsou doporučovány především eseje HER2 FISH pharmDXTM firmy Dako a PathVysion® firmy Abbott. Použít lze rovněž esej HER2 Dual Colour ISH firmy Ventana/Roche. Původně byla japonskými autory pro adenokarcinom žaludku navržena definice amplifikace genu jako průměrný počet kopií genu ≥7 a/nebo poměr signálů HER2/CEP17 (centromeric probe 17) ≥2 (21). Roku 2007 však byla přijata vyšší hranice poměru HER2/CEP17 ≥2,2 pro diagnózu amplifikace HER2. Poměr v rozmezí 1,8–2,2 je pak hodnocen jako nejistý z hlediska amplifikace HER2, poměr HER2/CEP17 ≥1,8 jako negativní výsledek (22).
Na rozdíl od karcinomu prsu je shoda mezi výsledky imunohistochemického vyšetření overexprese HER2 a vyšetření amplifikace jeho genu pouze 87,5 % a významně častěji je amplifikace přítomná i u nádorů hodnocených imunohistochemickým skóre 0 a 1+ (23 %) (4). Nicméně, prediktivní hodnota této amplifikace bez overexprese není dostatečná a podání trastuzumabu v těchto případech není asociováno se signifikantním prodloužením celkové doby přežití (4). Proto zůstává diagnostickou metodou první linie imunohistochemie, která je v případě sporně pozitivního výsledku imunohistochemického vyšetření (skóre 2+) následována vyšetřením amplifikace genu HER2 některou z in situ hybridizačních metod.
DALŠÍ POTENCIÁLNÍ MOŽNOSTI PROTINÁDOROVÉ LÉČBY
Vzhledem ke komplexnosti řízení nádorového růstu je nezbytné zasáhnout intracelulární signalizaci v nádorových buňkách na více kritických místech. Proto je snahou nalézt další molekuly umožňující komplexní protinádorovou léčbu zasahující na více úrovních. V současné době probíhá 3. fáze klinických studií použití monoklonálních protilátek bevacizumabu (anti-VEGF, studie AVAGAST a MAGIC-2), panitumumabu (anti-EGFR, studie REAL-3) a cetuximabu (anti-EGFR, studie EXPAND) jako součásti kombinované terapie adenokarcinomu žaludku (23). Slibné předběžné výsledky také poskytuje 3. fáze klinické studie LOGIC s duálním inhibitorem receptorových tyrosinkináz HER1 a HER2 lapatinibem. Dalšími látkami, jejichž možnosti u žaludečního karcinomu jsou v současné době studovány, jsou multipotentní tyrosinkinázové inhibitory sunitinib a sorafenib, inhibitor mTOR everolimus, a inhibitor dimerizace receptorových molekul pertuzumab (23,24).
SOUČASNÝ STAV LÉČBY ADENOKARCINOMU ŽALUDKU TRASTUZUMABEM V ČESKÉ REPUBLICE (ČR)
Vzhledem k tomu, že v ČR v současné době není cílená terapie karcinomu žaludku trastuzumabem hrazena zdravotními pojišťovnami, neprovádí se vyšetřování HER2 v těchto nádorech rutinně, ale pouze ve vybraných případech (většinou zařazených do klinické studie), a to na žádost ošetřujícího onkologa. Toto vyšetření by mělo být prováděno některou z laboratoří zahrnutých do „Aktuálního seznamu pracovišť pro vyšetřování HER-2/neu“ (viz http://www.patologie.info/standardy.php?zobrazit=12), nicméně oficiální doporučený postup zatím nebyl vypracován. Vzhledem k probíhajícím jednáním o úhradách této cílené terapie se tento stav může v budoucnosti změnit.
ZÁVĚR
Stanovení HER2 pozitivity žaludečního adenokarcinomu začíná imunohistochemickým průkazem overexprese proteinu HER2. Skóre imunoexprese se stanovuje na základě zvětšení objektivu, při kterém je již patrno lineární zbarvení alespoň laterálních částí membrány v místě mezibuněčných kontaktů, a to alespoň v 10 % buněk ve vzorku z resekátu nebo ve skupině alespoň pěti buněk v materiálu z endoskopické biopsie. V případě sporné pozitivity imunohistochemického vyšetření (skóre 2+) se následně provádí vyšetření amplifikace genu HER2 pomocí in situ hybridizace. Adenokarcinomy žaludku IHC3+ a/nebo IHC2+/ISH+ jsou indikovány k terapii monoklonálními protilátkami proti receptoru HER2 (trastuzumab).
Adresa pro korespondenci:
MUDr. Ondřej Daum, Ph.D.
Šiklův patologicko-anatomický ústav FN a LF UK Plzeň
Edvarda Beneše 13, 305 99 Plzeň
tel: +420377402523; fax: +420377402634
e-mail: Daum@fnplzen.cz
Sources
1. Ferlay J, Autier P, Boniol M, et al. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol 2007; 18(3): 581–592.
2. Kamangar F, Dores GM, Anderson WF. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world. J Clin Oncol 2006; 24(14): 2137–2150.
3. Slamon DJ, Leyland-Jones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001; 344(11): 783–792.
4. Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376(9742): 687–697.
5. Schechter AL, Hung MC, Vaidyanathan L, et al. The neu gene: an erbB-homologous gene distinct from and unlinked to the gene encoding the EGF receptor. Science 1985; 229(4717): 976–978.
6. Coussens L, Yang-Feng TL, Liao YC, et al. Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene. Science 1985; 230(4730): 1132–1139.
7. Carraway KL, 3rd, Sliwkowski MX, Akita R, et al. The erbB3 gene product is a receptor for heregulin. J Biol Chem 1994; 269(19): 14303–14306.
8. Worthylake R, Opresko LK, Wiley HS. ErbB-2 amplification inhibits down-regulation and induces constitutive activation of both ErbB-2 and epidermal growth factor receptors. J Biol Chem 1999; 274(13): 8865–8874.
9. Olayioye MA, Graus-Porta D, Beerli RR, et al. ErbB-1 and ErbB-2 acquire distinct signaling properties dependent upon their dimerization partner. Mol Cell Biol 1998; 18(9): 5042–5051.
10. Sepp-Lorenzino L, Eberhard I, Ma Z, et al. Signal transduction pathways induced by heregulin in MDA-MB-453 breast cancer cells. Oncogene 1996; 12(8): 1679–1687.
11. Hofmann M, Stoss O, Shi D, et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopathology 2008; 52(7): 797–805.
12. Park DI, Yun JW, Park JH, et al. HER-2/neu amplification is an independent prognostic factor in gastric cancer. Dig Dis Sci 2006; 51(8): 1371–1379.
13. Yano T, Doi T, Ohtsu A, et al. Comparison of HER2 gene amplification assessed by fluorescence in situ hybridization and HER2 protein expression assessed by immunohistochemistry in gastric cancer. Oncol Rep 2006; 15(1): 65–71.
14. Zhang XL, Yang YS, Xu DP, et al. Comparative study on overexpression of HER2/neu and HER3 in gastric cancer. World J Surg 2009; 33(10): 2112–2118.
15. Uchino S, Tsuda H, Maruyama K, et al. Overexpression of c-erbB-2 protein in gastric cancer. Its correlation with long-term survival of patients. Cancer 1993; 72(11): 3179–3184.
16. Nakajima M, Sawada H, Yamada Y, et al. The prognostic significance of amplification and overexpression of c-met and c-erb B-2 in human gastric carcinomas. Cancer 1999; 85(9): 1894–1902.
17. Allgayer H, Babic R, Gruetzner KU, et al. c-erbB-2 is of independent prognostic relevance in gastric cancer and is associated with the expression of tumor-associated protease systems. J Clin Oncol 2000; 18(11): 2201–2209.
18. Matsui Y, Inomata M, Tojigamori M, et al. Suppression of tumor growth in human gastric cancer with HER2 overexpression by an anti-HER2 antibody in a murine model. Int J Oncol 2005; 27(3): 681–685.
19. Tanner M, Hollmen M, Junttila TT, et al. Amplification of HER-2 in gastric carcinoma: association with Topoisomerase IIalpha gene amplification, intestinal type, poor prognosis and sensitivity to trastuzumab. Ann Oncol 2005; 16(2): 273–278.
20. Ruschoff J, Dietel M, Baretton G, et al. HER2 diagnostics in gastric cancer-guideline validation and development of standardized immunohistochemical testing. Virchows Arch 2010; 457(3): 299–307.
21. Kimura M, Tsuda H, Morita D, et al. A proposal for diagnostically meaningful criteria to classify increased epidermal growth factor receptor and c-erbB-2 gene copy numbers in gastric carcinoma, based on correlation of fluorescence in situ hybridization and immunohistochemical measurements. Virchows Arch 2004; 445(3): 255–262.
22. Wolff AC, Hammond ME, Schwartz JN, et al. American Society of Clinical Oncology/ College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med 2007; 131(1): 18–43.
23. Kim JG, Chung HY, Yu W. Recent advances in chemotherapy for advanced gastric cancer. World J Gastrointest Oncol 2010; 2(7): 287–294.
24. Okines AF, Cunningham D. Trastuzumab in gastric cancer. Eur J Cancer 2010; 46(11): 1949–1959.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2011 Issue 4-
All articles in this issue
- Molekulární diagnostika gastrointestinálních stromálních tumorů ve vztahu k predikci terapeutické odpovědi na cílenou biologickou léčbu
- Molekulární prediktory cílené anti-EGFR terapie u metastatického kolorektálního karcinomu
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- Cielená liečba melanómu: fakt alebo fikcia?
- Novinky v klasifikaci adenokarcinomů plic a potenciální prognostické a prediktivní faktory u nemalobuněčných plicních karcinomů
- Klinické registry jako nezbytná podpora personalizované medicíny
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
- Akantolytický variant skvamózneho karcinómu prsnej žľazy. Kazuistika a prehľad literatúry
- Carneyho komplex
- Intraperikardiální teratom jako příčina intrauterinního odumření – kazuistika
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Carneyho komplex
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
- Akantolytický variant skvamózneho karcinómu prsnej žľazy. Kazuistika a prehľad literatúry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

