-
Medical journals
- Career
LYNCHŮV SYNDROM V RUKÁCH UROLOGA
Authors: Tomáš Pitra 1; Kristýna Pivovarčíková 2; Hana Sedláčková 1; Ondřej Hes 2; Milan Hora 1; Ondřej Daum 2
Authors‘ workplace: Urologická klinika LF UK a FN Plzeň 1; Šiklův ústav patologie LF UK a FN Plzeň 2
Published in: Ces Urol 2017; 21(4): 272-279
Category: Review article
Overview
Hlavní stanovisko práce:
Přehledový článek zabývající se problematikou Lynchova syndromu, jeho manifestací, diagnostikou, léčbou a dispenzarizací v urotraktu.
Lynchův syndrom (LS) je autosomálně dominantně dědičné nádorové onemocnění, manifestující se většinou již v mladém/středním věku vznikem mnohočetných maligních tumorů v různých orgánech (nejčastěji se jedná o nádory vznikající v oblasti kolorektální a v endometriu). V rámci urologických malignit je LS dáván do souvislosti zejména s uroteliálním karcinomem horních cest močových (UUTUC), kdy UUTUC je považován za třetí nejčastější typ nádoru vznikající u pacientů s tímto hereditárním syndromem. Recentně v anglické literatuře vychází řada článků volajících po zlepšení screeningu, diagnostiky, dispenzarizace a managementu LS u urologických pacientů. I přes všechny tyto snahy a navzdory dlouhodobě známé asociaci mezi UUTUC a LS nejsou prozatím vymezeny jednotlivé algoritmy, které by byly široce respektovány a rutinně aplikovány do urologické praxe.Klíčová slova:
Lynchův syndrom, hereditární onemocnění, uroteliální karcinom, horní cesty močové.ÚVOD
Lynchův syndrom (LS) je dědičným nádorovým onemocněním s autosomálně dominantním vzorcem dědičnosti, projevující se u postižených jedinců většinou již v mladém/středním věku vznikem mnohočetných maligních tumorů v různých orgánech. Nejčastějším nádorem asociovaným s LS je kolorektální karcinom (CRC), avšak LS se může manifestovat vznikem širokého spektra nádorů extrakolonické lokalizace (karcinom endometria, ovárií, urotraktu, žaludku, tenkého střeva, jater, žlučových cest, nádory centrálního nervového systému a kůže) (1).
Molekulárně genetickým podkladem onemocnění je většinou zárodečná mutace některého z DNA mismatch repair (MMR) genů, které jsou zodpovědné za opravy chyb ve struktuře DNA vznikajících při její replikaci (2). Mutací způsobená dysfunkce MMR genů způsobí ztrátu funkce či nedostatečnou funkci MMR proteinů, což vede ke kumulaci chyb v DNA, jejichž výsledkem je maligní zvrat buňky. U LS jsou nejčastěji mutovanými MMR geny MLH1 a MSH2 (vyskytující se ve více jak 80 % případů) (3). Další u LS popsané mutace MMR genů (charakteru substituce, delece či inzerce) byly objeveny na genech MSH6, PMS1, MSH3, MLH3 (4). Mikrosatelitní nestabilita (MSI) je charakteristickým znakem přítomným v průměru u 85 % nádorů spojených s LS (5).
V rámci urologických malignit je LS dáván do souvislosti zejména s uroteliálním karcinomem horních cest močových (UUTUC), tedy postižením ledvinné pánvičky a močovodu (6, 7). V literatuře je popisována i asociace LS s uroteliálním karcinomem močového měchýře (UCB) (8, 9) a v rámci spektra malignit jsou v některých pracích zabývajících se LS zmiňovány i nádory varlat a adenokarcinom prostaty (10). UUTUC je pak považován za třetí nejčastější typ nádoru vznikající u pacientů s LS (po CRC a endometriálním karcinomu), riziko rozvoje UUTUC u pacientů s LS je v literatuře udáváno v širokém rozmezí 2,9–28 % (1). U UUTUC nejčastěji prokazovaná mutace postihuje gen MSH2 (9).
SPEKTRUM UROLOGICKÝCH MALIGNIT SPOJENÝCH S LS
LS je typicky asociován se vznikem nádorů ledvinné pánvičky a močovodu, karcinomy těchto lokalizací jsou řazeny do tzv. klasického spektra LS (6).
Obecně UUTUC představuje do 5 % ze všech uroteliálních karcinomů, přičemž nádorové postižení ledvinné pánvičky je ve sporadických případech udáváno s 3–4x větší frekvencí výskytu než u uroteliálních karcinomů vznikajících v močovodu. Celkově UUTUC vykazuje predominanci v postižení mužů (muži postiženi 2x častěji než ženy) (11).
Jedinci s LS mají průměrně 22x vyšší riziko rozvoje UUTUC ve srovnání s běžnou populací (12). Crockett a kol. ve své retrospektivní studii porovnávali rozdíly mezi UUTUC vznikajícím u pacientů s LS a sporadickými UUTUC. V této práci prokázali, že nádory pacientů s LS vznikaly průměrně o osm let dříve než v obvyklé populaci (62 let věku versus 70 let u sporadických případů), tumory byly lokalizovány v oblasti ureteru (51 % případů) a postižení obou pohlaví bylo téměř ve stejném poměru (poměr muži/ženy 0,95) (13).
Názory na asociaci mezi LS a uroteliálním karcinomem postihujícím močový měchýř nejsou zcela jednotné. Nesporný je fakt, že u uroteliálních karcinomů vznikajících v močovém měchýři pacientů s LS, lze v nádorových buňkách prokázat mutaci některého z MMR genů.
Ve zcela obecné rovině pak lze vztah mezi UUTUC a UCB (sporadickým i hereditárně asociovaným) vysvětlit dvěma teoriemi. Podle jedné může UCB vznikat jako následek sekundárního šíření nádorových buněk z vyšších oddílů močového traktu (tedy z UUTUC) s jejich následnou inokulací v oblasti močového měchýře a rozvojem karcinomu (14). Další z možností je tzv. efekt pole (field‑effect), tedy teorie založená na předpokladu, že urotel v celém svém rozsahu je (jako pole) postižen preneoplastickými změnami, nádory tak vznikají souběžně (synchronně) či sukcesivně (metachronně) v různých oblastech celého dutého vývodného systému. Obě tyto teorie jsou uznávány, nelze spolehlivě rozhodnout, která z těchto je pravdivější. Proto je i určení jasného vztahu mezi LS a UCB velmi obtížné a asociace mezi syndromem a zvýšeným rizikem UCB zůstává relativně kontroverzním tématem. To je dáno i tím, že dostupná data o výskytu nádorů močového měchýře ve spojitosti s LS jsou relativně omezená (15, 16).
Jednu z větších studií provedli Skeldon a kol., kteří se zaměřili na riziko vzniku UCB u pacientů s detekovanou MMR mutací. V jejich kohortě 177 pacientů s potvrzenou MSH2 mutací, byl u 11 pacientů (6,2 %) diagnostikován UCB (u 7/11 těchto případů (63,6 %) byl dále diagnostikován i UUTUC, přičemž u 3/7 případů UUTUC souběžně s UCB – synchronně, 1/7 případů UCB dříve než UUTUC, u 1/7 pacientů byl UCB diagnostikován až s odstupem po UUTUC – sukcesivně, u 2/7 případů nejsou bližší informace dostupné). U 3/129 pacientů (2,3 %) s prokázanou mutací genu MLH1 byl diagnostikován UCB (u 1/3 pacientů současně s anamnézou synchronního UUTUC). Na podkladě výsledků autoři udávají možnost asociace mezi zvýšeným rizikem rozvoje UCB a zejména mutací MSH2, samozřejmě ale nevylučují ani možnost rozvoje UCB jako následek první z výše popsaných teorií – tedy intraluminálního šíření nádorových buněk z UUTUC se sekundárním postižením močového měchýře (14).
Nádory močového měchýře u pacientů s LS často vznikají právě u jedinců s již dříve či současně diagnostikovaným UC horních močových cest. Nelze tedy spolehlivě a objektivně rozhodnout, zda je LS asociován se zvýšeným rizikem rozvoje UCB, či se jedná o sekundární následek nádorových změn vznikajících ve vyšších etážích urotraktu. Důležitý je však fakt, že pacienti s diagnostikovaným UUTUC by měli být dispenzarizováni s ohledem na zvýšené riziko rozvoje uroteliálního karcinomu jak horních, tak i dolních močových cest.
Raritně jsou v literatuře popsány i další urologické malignity jako případy karcinomu prostaty či tumorů varlat vznikající u rodinných příslušníků pacientů s diagnostikovaným LS (17–19). Vzhledem k velmi malému počtu případů se tyto jednotky řadí do tzv. atypického spektra nádorů LS (10).
DIAGNOSTICKÝ ALGORITMUS
Lynchův syndrom lze prokázat genetickým vyšetřením z krve, jedná se však o nákladnou metodu a toto vyšetření se provádí jen u pečlivě vytipovaných jedinců s vysokou suspekcí. Diagnostika se tak opírá o klinická kritéria, hodnocení nádorové tkáně a molekulárně genetické testování.
V průběhu let byla vypracována různá diagnostická kritéria. Zcela o klinická data se v diagnostice LS opírají tzv. Amsterdamská kritéria (zveřejněná v roce 1991) založená na osobní a rodinné anamnéze, zaměřená striktně na kolorektální karcinom (20). Revidovaná Amsterdamská kritéria (verze II) z roku 1999 již myslela i na extrakolonické spektrum neoplazií LS, diagnostika stále spočívala pouze na dobré znalosti osobní a rodinné anamnézy (tabulka 1) (21). To odráží i skutečnost, že Amsterdamská kritéria II vykazují v diagnostice LS pouze 22% senzitivitu při 98% specificitě (22). Za účelem vytipování pacientů suspektních z diagnózy LS, vhodných pro další molekulárně genetické testování byla dále vypracována tzv. Bethesda guidelines, poprvé formulovaná v roce 1996, tato verze byla v roce 2003 taktéž revidována (5). Revidovaná Bethesda kritéria (tabulka 2) mají v záchytu pacientů s LS senzitivitu 82 %, specificitu 77 % (23).
Table 1. Amsterdamská kritéria II (21) Tab. 1. Amsterdam criteria II (21) 
Table 2. Revidovaná Bethesda guidelines (14) Tab. 2. Revised Bethesda guidelines (14) 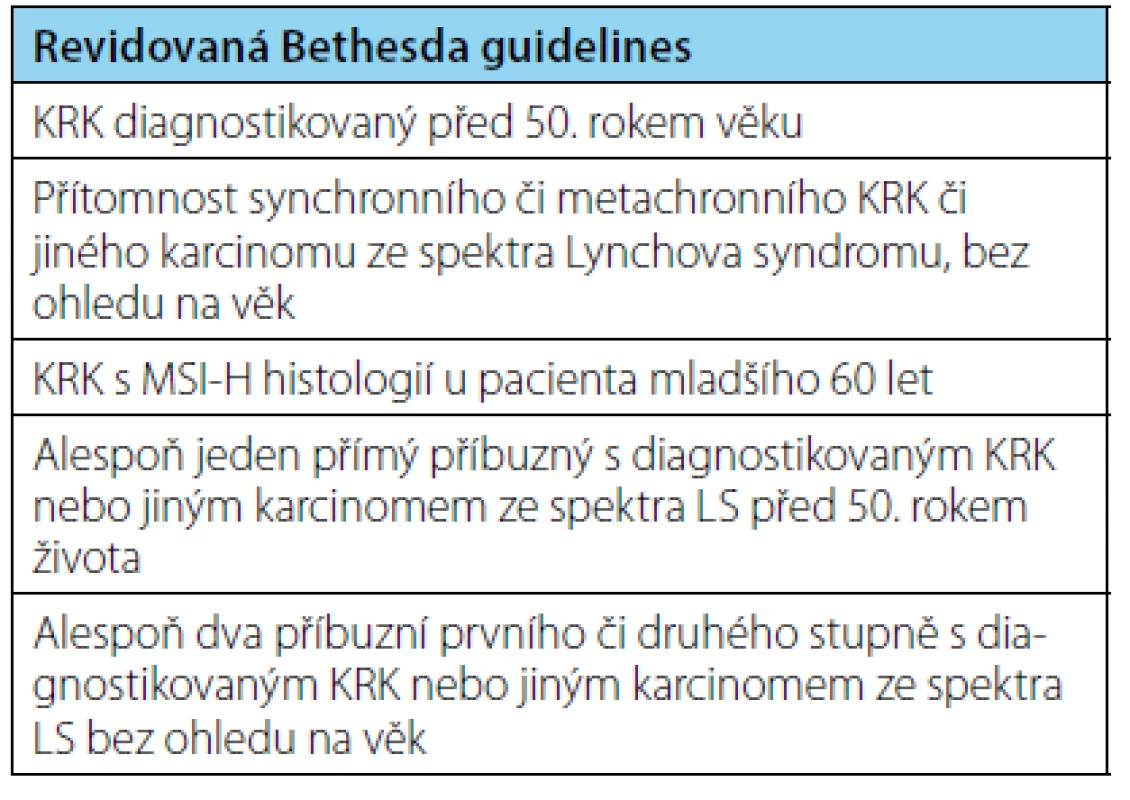
Dalším diagnostickým krokem je hodnocení a testování vlastní resekované nádorové tkáně histopatologickými metodami, včetně použití imunohistochemických barvení, případně prostřednictvím vyšetření mikrosatelitní instability (MSI) Bethesda panelem mikrosatelitních markerů. Při imunohistochemickém vyšetření je hodnocena exprese hlavních MMR proteinů (MLH1, PMS2, MSH2, MSH6). Senzitivita imunohistochemického vyšetření a stanovení MSI je srovnatelná (24). Obě metody jsou pak vnímány jako komplementární, v kombinaci mající vyšší senzitivitu než při samostatném užití (25, 26).
Genetické testování je konečným krokem v diagnostickém algoritmu LS, kdy je u jedinců na základě výše uvedených indicií vytipovaných, provedeno genetické vyšetření z periferní krve za účelem stanovení zárodečné mutace některého z MMR genů a tím konečné potvrzení diagnózy. Při pozitivním výsledku by mělo následovat vyšetření rodinných příslušníků.
SCREENING A DISPENZARIZACE PACIENTŮ S DIAGNOSTIKOVANÝM LS
Pacienty lze z hlediska urologické dispenzarizace rozdělit do dvou skupin. Jednak jsou to pacienti s LS bez diagnózy karcinomu močového traktu v osobní anamnéze. Druhou skupinou jsou pak pacienti s již prodělaným a léčeným UUTUC asociovaným s LS. Dispenzarizace u těchto dvou skupin by logicky, s ohledem na různé riziko, měla pobíhat u každé ze skupin lehce modifikovaně.
Pacienti se stanovenou diagnózou LS bez uroteliální neoplazie v osobní anamnéze by měli vyhledat urologickou péči v rámci dispenzarizace, ve snaze o časnou detekci eventuálního UC (sekundární prevence). V literatuře se udává vyšší riziko rozvoje UC u pacientů s detekovanou mutací postihující gen MSH2 (9). Jednoznačný preventivně‑dispenzarizační postup v rámci urologických malignit v této skupině pacientů není jasně definován, Evropská urologická asociace ve svých doporučených postupech tuto skupinu pacientů zcela opomíjí, všeobecně aplikovaný a uznávaný postup v současné době bohužel neexistuje.
Pacienti s již dříve diagnostikovaným a léčeným UC vyhledávají urologickou péči v rámci časné detekce možné recidivy. Obecně je u těchto pacientů postupováno dle doporučení Evropské urologické asociace (EAU Guidelines), v současnosti bez výraznějších odlišností od populace sporadických karcinomů (obrázek 2) (27).
Image 1. Souhrn doporučených postupů EAU pro follow-up uroteliálního karcinomu horních cest močových po iniciální léčbě (27) Fig. 2. EAU guidelines on follow-up UUTUC after initial treatment (27) 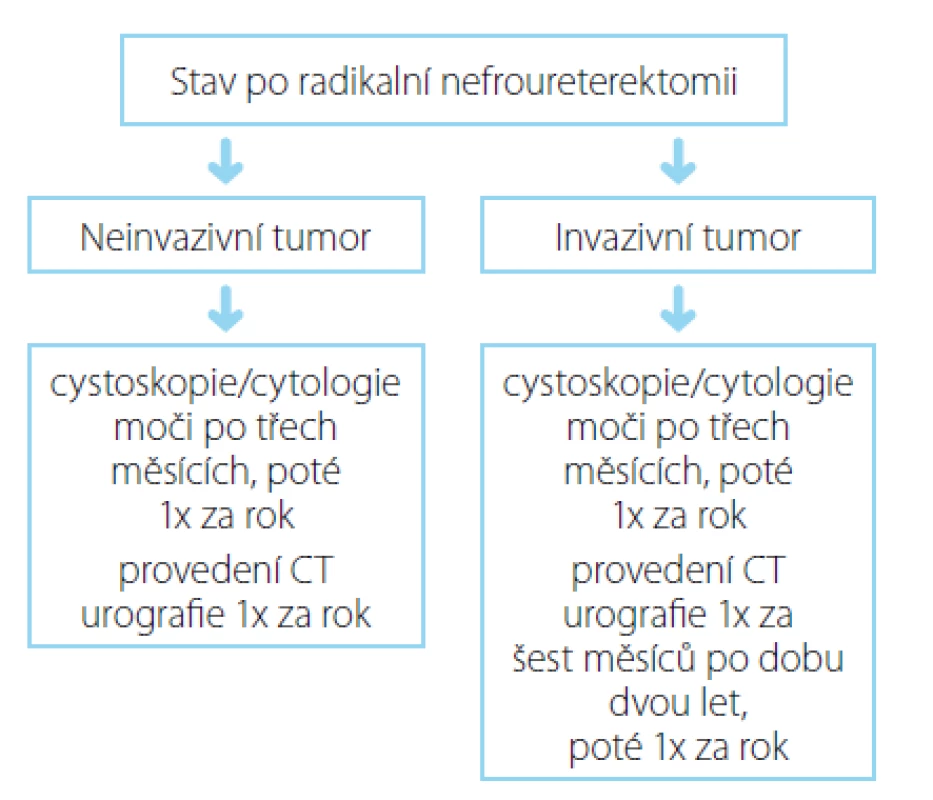
Ve snaze najít levnou a neinvazivní metodu dispenzarizace je některými autory u obou skupin pacientů doporučována močová cytologie (28). Při jejích dobře známých úskalích (v literatuře udávaná senzitivita okolo 79 % a specificita téměř 100 % u high grade uroteliálních lézí, naopak u low‑grade lézí senzitivita 25–45 % při specificitě až 98 % (29–31)) pak není překvapením, že v publikovaných studiích zaměřených přímo na pacienty s LS byla prokázána pouze 29% senzitivita močové cytologie při záchytu uroteliálního karcinomu (32). Úloha cytologie moči v dispenzarizaci LS je tedy sporná. Vzhledem k jejím nesporným výhodám (cena, neinvazivita) ji však lze dobře užívat jako doplňkovou metodu k jiným dispenzárním opatřením.
Dalším nenákladným vyšetřením je některými autory preferovaná detekce hematurie pomocí dipstick testů (9, 32, 33).
Zajímavý přístup ve své práci představili autoři Acher a kol. Ti v rámci dispenzarizace rozdělují pacienty s diagnózou LS do tří rizikových skupin – pacienti s nízkým/středním/vysokým rizikem. Pro jednotlivé skupiny pak navrhli postup v další dispenzarizaci. Za pacienty s nízkým rizikem jsou považováni pacienti s diagnostikovaným LS (prokázaná mutace nepostihuje gen MSH2), bez osobní či rodinné anamnézy UUTUC. Tito pacienti by měli být sledováni za pomoci močové cytologie a vyšetřením moči metodou dipstick, v případě pozitivních výsledků by měla být promptně provedena též diagnostika pomocí zobrazovacích metod. Skupina pacientů se středním rizikem jsou pacienti s LS, s rodinou anamnézou UUTUC, či prokázanou mutací MSH2 genu, u kterých je doporučována dispenzarizace stejným způsobem jako u výše popsané nízce rizikové skupiny, navíc by však mělo být prováděno i ultrasonografické vyšetření urotraktu. Skupina s vysokým rizikem, jsou pacienti s LS a UUTUC v osobní anamnéze, tito by kromě močové cytologie a dipstick testu měli mít i pravidelné CT vyšetření a cystoskopie (34).
DISKUZE
Spojitost mezi CRC a LS se již dostává do povědomí i neodborné veřejnosti. To však neplatí o vztahu mezi UUTUC a LS. Heterogenita v literatuře udávané incidence rozvoje UUTUC u LS (2,9–28 %) je pak odrazem variability ve screeningu a nedostatečné detekci vysoce rizikových pacientů (35). To je z části zapříčiněno i nedostatečnou edukací, kdy v běžné urologické praxi není příliš často pomýšleno na asociaci mezi UUTUC s LS. UUTUC vznikající v rámci LS jsou tak často mylně považovány za nádory sporadické. To vede k dlouhodobému podhodnocování celkové incidence dědičných syndromů (36).
Nádory horních cest močových mohou být první manifestací LS. U všech pacientů s nově diagnostikovaným UUTUC by proto měla vždy být zvážena možnost hereditárního syndromu a to především u pacientů mladších 60 let, s osobní či rodinnou anamnézou tumoru spadajícího do spektra LS (obrázek 1) (37).
Image 2. Diagnostický algoritmus při podezření na LS Fig. 1. Diagnostic algorithm in case of LS suspicion 
Recentně v anglické literatuře vychází řada článků volajících po zlepšení screeningu, diagnostiky, dispenzarizace a managementu LS u urologických pacientů. I přes všechny tyto snahy a navzdory dlouhodobě známé spojitosti mezi UUTUC a LS nejsou prozatím v rámci těchto modalit vymezeny jednotlivé algoritmy, které by byly rutinně aplikovány do urologické praxe.
Po pečlivé revizi dostupné literatury je na našem pracovišti (za kooperace s patology) v rámci screeningu a detekce uplatňován diagnostický postup, kdy v nádorové tkáni všech pacientů s UUTUC je rutinně imunohistochemicky vyšetřena exprese MMR proteinů (MLH1, PMS2, MSH2, MSH6) – tzv. univerzální imunohistochemický screening LS, který se velmi dobře osvědčil v záchytu LS v případech CRC a endometriálního karcinomu. V případě ztráty exprese některého z MMR proteinů jsou dále provedena molekulárně genetická vyšetření, jejichž cílem je potvrdit přítomnost MSI, vyloučit možnost sporadického MSI karcinomu a určit pravděpodobně postižený gen k další detekci germinální mutace (38).
Dispenzarizace pacientů s již diagnostikovaným LS je na poli urologie (na rozdíl např. od kolorektální lokalizace) bez jednoznačně vymezených doporučených postupů. I nadále tak tyto zůstávají na uvážení jednotlivých ošetřujících urologů a na zvyklostech daného pracoviště, celkově by však měly být respektovány obecné doporučené postupy Evropské urologické asociace pro UUTUC (obrázek 2) (27). To samé pak platí i pro terapeutický management.
ZÁVĚR
Kýžený algoritmus diagnostiky LS je již otázkou s definovanou odpovědí. Diagnostika LS probíhá ve třech po sobě následujících krocích – splnění klinických kritérií, vyšetření nádorové tkáně a genetické testování z periferní krve. Co však i nadále zůstává otevřené, je další urologický management a dispenzarizační protokol pacientů s diagnostikovaným LS.
Brzká detekce hereditárního podkladu nádorového onemocnění znamená pro pacienta a jeho rodinu benefit ve smyslu multidisciplinární dispenzarizace se snahou o co nejčasnější záchyt nádoru (sekundární a terciální prevence), stále relativně malý je však terapeutický benefit.
Střet zájmů: žádný
Prohlášení o podpoře: Programem rozvoje vědních oborů Karlovy univerzity (projekt P36) a MZ ČR RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Došlo: 1. 11. 2017
Přijato: 27. 11. 2017
Kontaktní adresa:
MUDr. Tomáš Pitra
Urologická klinika LF UK a FN Plzeň Edvarda Beneše 13, 305 99 Plzeň
e‑mail: pitrat@fnplzen.cz
Sources
1. Barrow P, Khan M, Lalloo F, Evans DG, Hill J. Systematic review of the impact of registration and screening on colorectal cancer incidence and mortality in familial adenomatous polyposis and Lynch syndrome. Br J Surg. 2013; 100(13): 1719–1731.
2. Fishel R, Lescoe MK, Rao MR, et al. The human mutator gene homolog MSH2 and its association with hereditary nonpolyposis colon cancer. Cell. 1993; 75(5): 1027–1038.
3. Nyström‑Lahti M, Wu Y, Moisio AL, et al. DNA mismatch repair gene mutations in 55 kindreds with verified or putative hereditary non‑polyposis colorectal cancer. Hum Mol Genet. 1996; 5(6): 763–769.
4. Wijnen J, van der Klift H, Vasen H, et al. MSH2 genomic deletions are a frequent cause of HNPCC. Nat Genet. 1998; 20(4): 326–328.
5. Umar A, Boland CR, Terdiman JP, et al. Revised Bethesda Guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst. 2004; 96(4): 261–268.
6. Lynch HT, Ens JA, Lynch JF. The Lynch syndrome II and urological malignancies. J Urol. 1990; 143(1): 24–28.
7. Sijmons RH, Kiemeney LA, Witjes JA, Vasen HF. Urinary tract cancer and hereditary nonpolyposis colorectal cancer: risks and screening options. The Journal of urology. 1998; 160(2): 466–470.
8. Mueller CM, Caporaso N, Greene MH. Familial and genetic risk of transitional cell carcinoma of the urinary tract. Urol Oncol. 2008; 26(5): 451–464.
9. Joost P, Therkildsen C, Dominguez‑Valentin M, Jönsson M, Nilbert M. Urinary tract cancer in lynch syndrome; increased risk in carriers of MSH2 mutations. Urology 2015; 86(6): 1212–1217.
10. Rouprêt M, Yates DR, Comperat E, Cussenot O. Upper urinary tract urothelial cell carcinomas and other urological malignancies involved in the hereditary nonpolyposis colorectal cancer (lynch syndrome) tumor spectrum. Eur Urol. 2008; 54(6): 1226–1236.
11. Visser O, Adolfsson J, Rossi S, et al. Incidence and survival of rare urogenital cancers in Europe. Eur J Cancer. 2012; 48(4): 456–464.
12. Watson P, Lynch HT. The tumor spectrum in HNPCC. Anticancer Res. 1994; 14(4 B): 1635–1639.
13. Crockett DG, Wagner DG, Holmäng S, Johansson SL, Lynch HT. Upper urinary tract carcinoma in Lynch syndrome cases. J Urol. 2011; 185(5): 1627–1630.
14. Sidransky D, Frost P, Vohttps://www.centrum.cz/?redirected=1503167932n Eschenbach A, et al. Clonal origin of bladder cancer. N Engl J Med. 1992; 326(11): 737–740.
15. van der Post RS, Kiemeney LA, Ligtenberg MJ, et al. Risk of urothelial bladder cancer in Lynch syndrome is increased, in particular among MSH2 mutation carriers. Journal of medical genetics. 2010; 47(7): 464–470.
16. Skeldon SC, Semotiuk K, Aronson M, et al. Patients with Lynch syndrome mismatch repair gene mutations are at higher risk for not only upper tract urothelial cancer but also bladder cancer. Eur Urol. 2013; 63(2): 379–385.
17. Maul JS, Warner NR, Kuwada SK, Burt RW, Cannon‑Albright
LA. Extracolonic cancers associated with hereditary nonpolyposis colorectal cancer in the Utah Population Database. Am J Gastroenterol. 2006; 101(7): 1591–1596.
18. Burger M, Denzinger S, Hammerschmied CG, et al. Elevated microsatellite alterations at selected tetranucleotides (EMAST) and mismatch repair gene expression in prostate cancer. J Mol Med (Berl). 2006; 84(10): 833–841.
19. Velasco A, Riquelme E, Schultz M, et al. Mismatch repair gene expression and genetic instability in testicular germ cell tumor. Cancer Biol Ther. 2004; 3(10): 977–982.
20. Vasen HF, Mecklin JP, Khan PM, Lynch HT. The International Collaborative Group on Hereditary Non‑Polyposis Colorectal Cancer (ICG‑HNPCC). Dis Colon Rectum. 1991; 34(5): 424–425.
21. Vasen HF, Watson P, Mecklin JP, Lynch HT. New clinical criteria for hereditary nonpolyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative group on HNPCC. Gastroenterology. 1999; 116(6): 1453–1456.
22. Green RC, Parfrey PS, Woods MO, Younghusband HB. Prediction of Lynch syndrome in consecutive patients with colorectal cancer. J Natl Cancer Inst. 2009; 101(5): 331–340.
23. Piñol V, Castells A, Andreu M, et al. Accuracy of revised Bethesda guidelines, microsatellite instability, and immunohistochemistry for the identification of patients with hereditary nonpolyposis colorectal cancer. JAMA 2005; 293(16): 1986–1994.
24. Shia J, Tang LH, Vakiani E, et al. Immunohistochemistry as first‑line screening for detecting colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome: a 2-antibody panel maybe as predictive as a 4-antibody panel. Am J Surg Pathol. 2009; 33(11): 1639–1645.
25. Funkhouser WK, Lubin IM, Monzon FA, et al. Relevance, pathogenesis, and testing algorithm for mismatch repair‑defective colorectal carcinomas: a report of the association for molecular pathology. J Mol Diagn. 2012; 14(2): 91–103.
26. Halvarsson B, Lindblom A, Rambech E, Lagerstedt K, Nilbert M. Microsatellite instability analysis and/or immunostaining for the diagnosis of hereditary nonpolyposis colorectal cancer? Virchows Arch. 2004; 444(2): 135–141.
27. Rouprêt M, Babjuk M, Compérat E, et al. European Association of Urology Guidelines on Upper Urinary Tract Urothelial Carcinoma: 2017 Update. Eur Urol. 2017; doi: 10.1016/j.eururo.2017. 07. 036. [Epub ahead of print].
28. Lindor NM, Petersen GM, Hadley DW, et al. Recommendations for the care of individuals with an inherited predisposition to Lynch syndrome: a systematic review. JAMA 2006; 296(12): 1507–1517.
29. Bastacky S, Ibrahim S, Wilczynski SP, Murphy WM. The accuracy of urinary cytology in daily practice. Cancer 1999; 87(3): 118–128.
30. Koss LG, Deitch D, Ramanathan R, Sherman AB. Diagnostic value of cytology of voided urine. Acta Cytol. 1985; 29(5): 810–816.
31. Raab SS, Lenel JC, Cohen MB. Low grade transitional cell carcinoma of the bladder. Cytologic diagnosis by key features as identified by logistic regression analysis. Cancer 1994; 74(5): 1621–1626.
32. Myrhøj T, Andersen MB, Bernstein I. Screening for urinary tract cancer with urine cytology in Lynch syndrome and familial colorectal cancer. Fam Cancer 2008; 7(4): 303–307.
33. Koornstra JJ, Mourits MJ, Sijmons RH, et al. Management of extracolonic tumours in patients with Lynch syndrome. Lancet Oncol. 2009; 10(4): 400–408.
34. Acher P, Kiela G, Thomas K, O‘Brien T. Towards a rational strategy for the surveillance of patients with Lynch syndrome (hereditary non‑polyposis colon cancer) for upper tract transitional cell carcinoma. BJU Int. 2010; 106(3): 300–302.
35. Pradere B, Lotan Y, Roupret M. Lynch syndrome in upper tract urothelial carcinoma: significance, screening, and surveillance. Curr Opin Urol. 2017; 27(1): 48–55.
36. Audenet F, Colin P, Yates DR, et al. A proportion of hereditary upper urinary tract urothelial carcinomas are misclassified as sporadic according to a multi‑institutional database analysis: proposal of patient‑specific risk identification tool. BJU Int. 2012; 110 (11 Pt B): E583–9.
37. Rouprêt M, Zigeuner R, Palou J, et al. European guidelines for the diagnosis and management of upper urinary tract urothelial cell carcinomas: 2011 update. Eur Urol. 2011; 59(4): 584–594.
38. Daum O, Beneš Z, Ladislav H, et al. Lynchův syndrom v rukách patologa. Česko‑Slovenská patologie 2014; 50(1): 18–24.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2017 Issue 4-
All articles in this issue
- LAPAROSKOPICKÁ EXTRAPERITONEÁLNÍ RADIKÁLNÍ PROSTATEKTOMIE NERVY ŠETŘÍCÍ – VIDEO
- DOMÁCÍ VYŠETŘENÍ SPERMIOGRAMU POMOCÍ CHYTRÉHO MOBILNÍHO TELEFONU? VÍTEJTE V ÉŘE TELESPERMATOLOGIE
- ZKUŠENOSTI S POUŽITÍM INDEXU ZDRAVÍ PROSTATY V KLINICKÉ PRAXI
- VYUŽITÍ PRŮTOKOVÉ CYTOMETRIE PRO STANOVENÍ KVALITY EJAKULÁTU U MUŽŮ S PORUCHOU REPRODUKCE
- SOLITÁRNÍ KOSTNÍ METASTÁZA V PALCI RUKY JAKO PRIMOMANIFESTACE BILATERÁLNÍHO SVĚTLOBUNĚČNÉHO RENÁLNÍHO KARCINOMU pT1a U PACIENTA SE SPORADICKOU TRIPLICITOU UROLOGICKÝCH MALIGNIT
- PARATESTIKULÁRNÍ MALIGNÍ MEZOTELIOM
- AGRANULOCYTÓZA PO ANALGETICKÉ LÉČBĚ RENÁLNÍ KOLIKY
- ATYPICKÁ SEKUNDÁRNÍ MALIGNITA PO RADIOTERAPII PROSTATY
- K POZORUHODNÉMU ŽIVOTNÍMU JUBILEU doc. MUDr. Radko Petříka, CSc.
- CO SE UDÁLO NA VÝROČNÍ KONFERENCI ČUS SPOJENÉ S CEM V ŘÍJNU 2017 V PLZNI?
- VÝSLEDKY SOUTĚŽE ČUS O NEJLEPŠÍ VĚDECKOU PUBLIKACI ZA ROK 2016
- LYNCHŮV SYNDROM V RUKÁCH UROLOGA
- LAUDATIO K ŽIVOTNÍMU VÝROČÍ doc. MUDr. Jana Krhuta, Ph.D.
- doc. MUDr. Miloš Broďák, Ph.D., SLAVÍ ŽIVOTNÍ JUBILEUM
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ZKUŠENOSTI S POUŽITÍM INDEXU ZDRAVÍ PROSTATY V KLINICKÉ PRAXI
- AGRANULOCYTÓZA PO ANALGETICKÉ LÉČBĚ RENÁLNÍ KOLIKY
- DOMÁCÍ VYŠETŘENÍ SPERMIOGRAMU POMOCÍ CHYTRÉHO MOBILNÍHO TELEFONU? VÍTEJTE V ÉŘE TELESPERMATOLOGIE
- doc. MUDr. Miloš Broďák, Ph.D., SLAVÍ ŽIVOTNÍ JUBILEUM
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

