-
Medical journals
- Career
SOLITÁRNÍ KOSTNÍ METASTÁZA V PALCI RUKY JAKO PRIMOMANIFESTACE BILATERÁLNÍHO SVĚTLOBUNĚČNÉHO RENÁLNÍHO KARCINOMU pT1a U PACIENTA SE SPORADICKOU TRIPLICITOU UROLOGICKÝCH MALIGNIT
Authors: Jan Novák 1; Lukáš Fišer 1; Robert Jůzek 2; Jan Lesenský 2; Jan Pertlíček 3; Zuzana Špůrková 4; Petra Beroušková 5; Lubomír Hyršl 1
Authors‘ workplace: Urologické oddělení, Oblastní nemocnice Kladno, a. s., Kladno 1; Ortopedická klinika, 1. LF UK a Nemocnice Na Bulovce, Praha 2; Chirurgické oddělení, Oblastní nemocnice Kladno, a. s., Kladno 3; Patologicko‑anatomické oddělení, Nemocnice Na Bulovce, Praha 4; Patologicko‑anatomické oddělení, Oblastní nemocnice Kladno, a. s., Kladno 5
Published in: Ces Urol 2017; 21(4): 299-304
Category: Case report
Overview
V následující kazuistice prezentujeme dvaasedmdesátiletého pacienta s bohatou urologickou anamnézou (adenokarcinom prostaty po RAPE s aktuálně stoupající hladinou PSA a uroteliální karcinom měchýře pTa low grade s jednou recidivou), jemuž byla při rekonstrukčním výkonu zjištěna kostní metastáza světlobuněčného renálního karcinomu v palci levé ruky. Opakovaná CT vyšetření prokázala celkem dvě drobná ložiska v obou ledvinách bez progrese velikosti v čase. Resekce dolního pólu pravé ledviny a nefroureterektomie vlevo ve dvou dobách prokázaly bilaterální světlobuněčný renální karcinom pT1a. Vyšetření cíleným sekvenačním panelem CZECANCA obsahujícím 219 genů neprokázalo žádnou signifikantní mutaci svědčící pro hereditární příčinu vzniku triplicity urologických malignit.
Klíčová slova:
Solitární kostní metastáza, bilaterální karcinom ledviny, světlobuněčný renální karcinom pT1a, triplicita urologických malignit.ÚVOD
Klasická triáda ‘hmatná rezistence – hematurie – bolest v bedru’ dříve často udávaná jako charakteristická při klinické diagnóze pokročilého tumoru ledviny se v dnešní době díky rozšířenosti zobrazovacích metod z nejrůznějších indikací stává méně častou, čímž se záchyt těchto nádorů posouvá do časných stádií. Stále však až 28 % světlobuněčných renálních karcinomů ledvin je diagnostikováno v době pokročilého onemocnění (T3-4, N+, M+) (1).
KAZUISTIKA
Dvaasedmdesátiletý pacient byl odeslán z pracoviště onkologické ortopedie, kde mu byla provedena operace kostního nádoru záprstní kosti palce levé ruky – histologicky se překvapivě jednalo o metastázu světlobuněčného renálního karcinomu. Z pacientovy bohaté urologické anamnézy zmiňme:
- transuretrální resekci prostaty pro benigní hyperplázii prostaty (PSA není k dispozici, histologicky adenomyomatózní hyperplázie prostaty) před patnácti lety,
- radikální prostatektomii s pánevní lymfadenektomií před sedmi lety pro adenokarcinom prostaty pT2X pN0 cM0, GS 3+4, iPSA 20,1 nmol/ml (až čtvrtá biopsie prostaty při progredující elevaci PSA byla pozitivní) s následnou nutností dvou transuretrálních discizí striktury anastomózy (obě histologicky bez průkazu recidivy adenokarcinomu prostaty) – pro aktuální elevaci hladiny PSA 0,41 nmol/ml je v plánu iradiace prostatického lůžka,
- transuretrální resekci uroteliálního karcinomu močového měchýře pTa low grade před třemi lety s jednou recidivou identické histologie po dvou letech dispenzarizace a
- recidivu renální koliky vlevo na podkladě nekontrastní ureterolitiázy (100% kyselina močová) s nutností zavedení JJ stentu vlevo (do té doby vždy spontánní odchod konkrementů) a s následnou ureterorenoskopickou trypsí konkrementu před jedním rokem.
Z osobní anamnézy stojí za pozornost arteriální hypertenze, diabetes mellitus 2. typu na terapii perorálními antidiabetiky, cholecystektomie před více než třiceti lety a excize bazocelulárního karcinomu zad pT1 před dvěma roky. Sám pacient pracoval jako elektrikář, je nekuřák a jeho bratr (též nekuřák) zemřel na karcinom plic.
Zmíněný kostní nádor se projevoval zvětšením a ztvrdnutím palcového valu (pacient pozoroval cca jeden rok) a náhlou výraznou bolestivostí po minimálním úderu, pro kterou pacient vyhledal lékařské ošetření. Na rentgenovém snímku byla zjištěna prakticky úplná destrukce palcového metakarpu levé ruky kostním nádorem, což bylo potvrzeno i magnetickou rezonancí (obrázek 1). Na pracovišti onkologické ortopedie byla nejdříve provedena probatorní excize nádoru s histologickým průkazem zmíněné metastázy světlobuněčného renálního karcinomu. Pacient podstoupil radikální exstirpaci tumoru vel. 60×65×50 mm s náhradou cementovým spacerem, po třech měsících však musela být provedena reoperace pro chronický infekt rány a její intermitentní fistulaci, histologicky již bez průkazu malignity (obrázek 2). Původně zvažovaná iradiace operačního pole nebyla pro možné zhoršení již tak komplikovaného hojení provedena.
Image 1. Rtg (vlevo) a MRI (vpravo): metastáza světlobuněčného renálního karcinomu v záprstní kosti palce levé ruky Fig. 1. X-ray (left) and MRI (right): the metastasis of a clear cell renal cell carcinoma in the left thumb 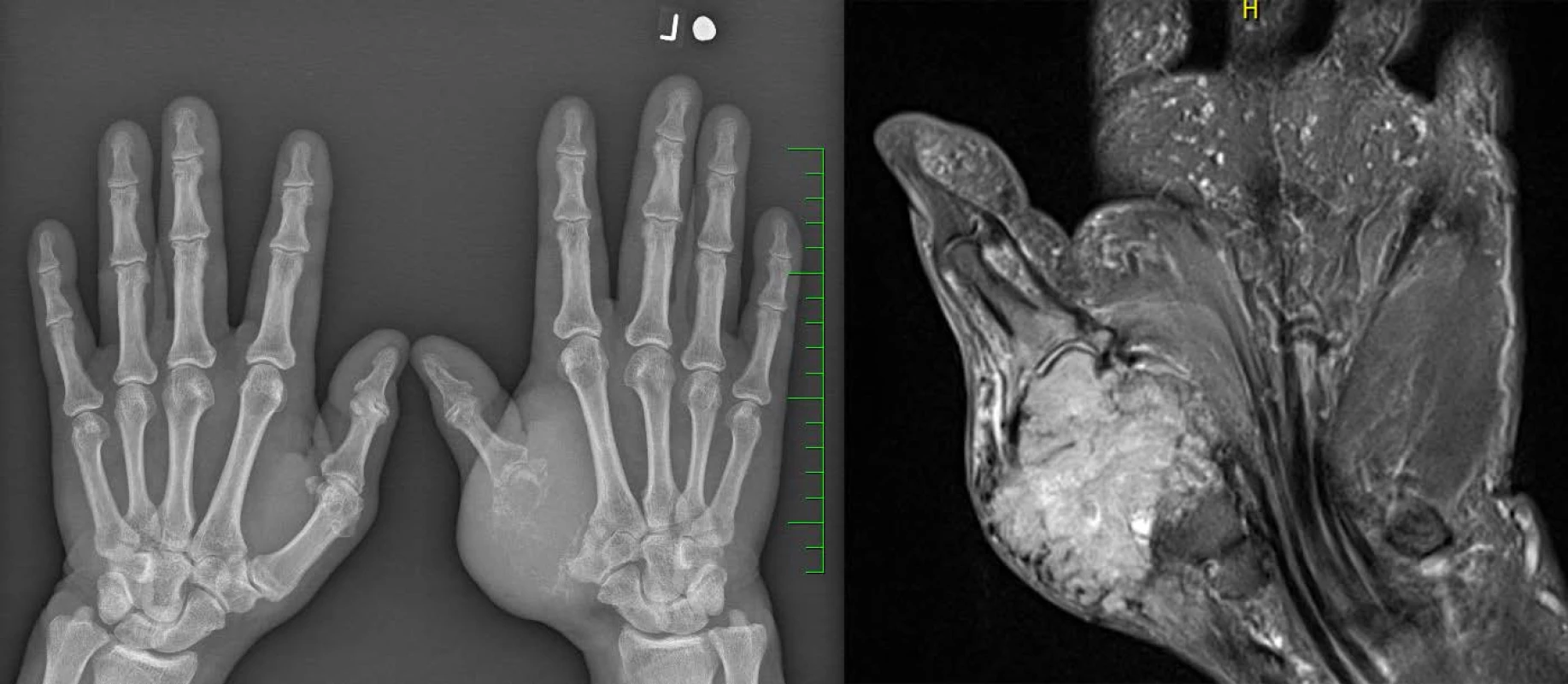
Image 2. Rtg: rekonstrukce záprstní kosti palce levé ruky cementovým spacerem s třemi Kirschnerovými dráty (jeden rok po reoperaci) Fig. 2. X-ray of the reconstructed metacarpal bone of the left thumb with a cement spacer and three Kirschner wires (one year after reoperation) 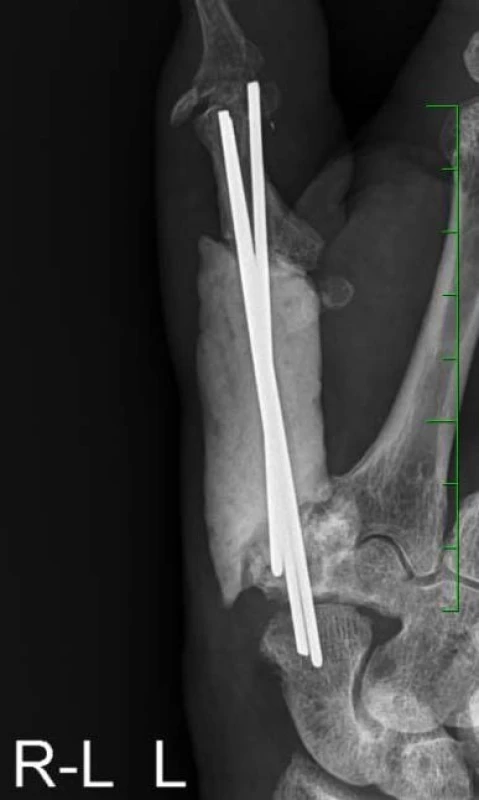
Pacientovi byla doplněna scintigrafie skeletu bez průkazu dalších metastatických kostních ložisek a také kontrastní CT hrudníku, břicha a malé pánve, kde bylo zjištěno v oblasti dolního pólu pravé ledviny suspektní ložisko vel. 17×15×15 mm (nativní denzity 30 HU, postkontrastně se sytící na 100 HU) a dále v zadním labiu levé ledviny suspektní ložisko vel. 25×22×18 mm (nativní denzity 40 HU, postkontrastně se sytící na 90 HU) vtlačující se do centrálního sinu při známých bilaterálních intrasinusálních cystách, vlevo byla také popsána sytící se zesílená stěna pánvičky a nerovné kontury močovodu (obrázek 3). V plicních křídlech bylo popsáno několik drobných subpleurálních lézí vel. do 6 mm benigního vzhledu. Přítomnost mediastinální ani retroperitoneální lymfadenopatie nebyla zjištěna.
Image 3. CT, transverzální řez, arteriální fáze: bilaterální světlobuněčný renální karcinom pT1a (červené šipky) Fig. 3. CT scan, axial section, arterial phase: bilateral clear cell renal cell carcinoma pT1a (red arrows) 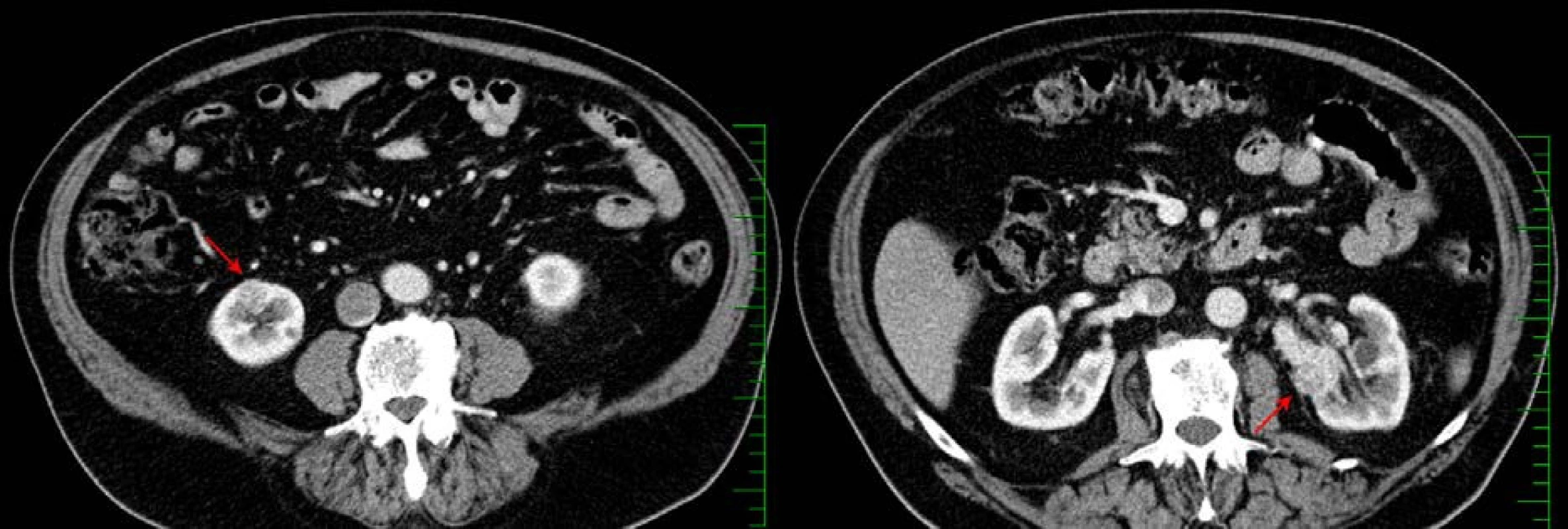
Vzhledem k nejednoznačnosti nálezu na ledvinách bylo provedeno časné kontrolní CT s odstupem tří měsíců, avšak bez průkazu progrese velikosti obou zmíněných suspektních ložisek. PET/CT neprokázalo výskyt ložiska s hypermetabolizmem glukózy.
Pacientovi byla provedena cystoskopie s vyloučením recidivy tumoru močového měchýře a ureterorenoskopie vlevo bez jasně patrného tumoru v pánvičce s výplachovou cytologií, která byla posléze zhodnocena jako PAP III.
Kontrolní CT s šestiměsíčním odstupem od posledního CT vyšetření (pacient preferoval vyčkat s operací) opět neprokázalo progresi velikosti zmíněných ložisek, scintigrafie skeletu byla opět bez průkazu metastáz. Na základě dosavadních vyšetření byla provedena otevřená radikální resekce suspektního ložiska dolního pólu pravé ledviny, histologicky byl zjištěn dobře diferencovaný světlobuněčný renální karcinom pT1a. Scintigraficky byl i po resekci pravé ledviny vyrovnaný poměr funkcí pravé a levé ledviny (55 : 45). Vzhledem k dobré funkci pravé ledviny, centrálnímu uložení suspektního ložiska v oblasti hilu znemožňujícímu záchovný výkon, anamnéze uroteliálního karcinomu močového měchýře a suspektnímu CT nálezu v dutém systému levé ledviny, kdy nebylo možné jednoznačně vyloučit uroteliální karcinom pánvičky, byla s pětiměsíčním odstupem po prvním výkonu provedena levostranná otevřená nefroureterektomie, histologicky se však jednalo o středně diferencovaný světlobuněčný renální karcinom pT1a.
Pro výskyt onkologické triplicity, respektive kvadruplicity bereme‑li v potaz i bazocelulární karcinom, byl pacient vyšetřen cíleným sekvenačním panelem CZECANCA obsahujícím 219 genů (2), přičemž nebyla prokázána žádná signifikantní mutace svědčící pro hereditární příčinu vzniku maligních onemocnění.
Na kontrolním CT hrudníku, břicha a malé pánve s šestiměsíčním odstupem po levostranné nefroureterektomii byla nově popsána progrese počtu a velikosti do té doby benigně vypadajících pleurálních uzlíků, čímž byla vyslovena suspekce na jejich metastatický původ. Byla provedena časná videotorakoskopická biopsie ložisek s průkazem metastázy světlobuněčného renálního karcinomu, na základě čehož byl pacient odeslán do komplexního onkologického centra k zahájení cílené léčby metastatického karcinomu ledviny.
DISKUZE
Jak bylo zmíněno v úvodu, i přes rozšířenost zobrazovacích metod a s ní související stoupající tendenci záchytu tumorů ledvin v časných stádiích je 28 % světlobuněčných (17,6 % papilárních a 16,9 % chromofóbních) renálních karcinomů diagnostikováno ve stadiu III a IV (T3-4, N+, M+) – vzhledem k 80-90 % zastoupení světlobuněčného renálního karcinomu v rámci karcinomů ledvin se většina publikovaných dat a doporučených postupů týká právě této nozologické entity (1).
Světlobuněčný renální karcinom metastazuje, a to nezřídka i více než deset let po radikální léčbě primárního tumoru, nejčastěji do lymfatických uzlin, plic, jater, nadledvin, mozku (nádory ledvin jsou po nádorech plic a prsu třetím nejčastějším zdrojem mozkových metastáz) (3) a kostí, ale postižen může být prakticky kterýkoli orgán – z vzácných lokalit uveďme např. slinivku břišní (4), močový měchýř (5), dáseň (6) či štítnou žlázu (7).
Je‑li histopatologicky prokázána extrarenální přítomnost světlobuněčného karcinomu, je nutné pátrat po možném primárním tumoru v ledvinách, kde je také nejčastěji prokázán. Světlobuněčný karcinom může však vzácně vzniknout primárně extrarenálně – v literatuře je popsáno více takových případů, např. primární světlobuněčný renální karcinom mezenchymálního embryonálního zbytku imitující tumor nadledviny (8), primární světlobuněčný karcinom jazyka u pacientky sedm let po nefrektomii pro imunohistochemicky odlišný světlobuněčný renální karcinom (9), dále primární světlobuněčný adenokarcinom štítné žlázy vzniklý transformací původně folikulárního karcinomu (10) a konečně primární světlobuněčný karcinom plic s kostními metastázami (11) – v tomto případě je však nutné odlišovat od většinou benigního světlobuněčného „sugar“ tumoru pocházejícího z perivaskulárních epiteloidních buněk, jenž je blízce příbuzný např. s angiomyolipomem (12). Pro úplnost uveďme, že je možné se setkat i se světlobuněčným sarkomem měkkých tkání (dříve známý jako maligní melanom měkkých tkání) (13) a světlobuněčným sarkomem ledvin vyskytujícím se především u pediatrické populace (14).
Vzhledem k tomu, že v každé ledvině byl prokázán karcinom s rozdílným gradingem, považujeme námi popisovaný případ za pluricentrický výskyt a nikoli za synchronní metastázu v kontralaterální ledvině.
Riziko rozvoje synchronního i metachronního metastatického postižení u renálního karcinomu T1a je nízké, různými autory udáváno v rozmezí 1,1 % (15) až 8 % (16), přičemž je patrný růst rizika s velikostí tumoru (OR 1,25 na každý cm velikosti) (16), jako negativní prognostický faktor byl v jedné studii označen diabetes mellitus (15). Přítomnost von Hippelova‑Lindauova syndromu není asociována se zvýšeným rizikem oproti běžné populaci (16).
Od prvního CT po levostrannou nefroureterektomii v pořadí druhého světlobuněčného renálního karcinomu s paradoxně méně příznivým gradingem uplynul více než jeden rok, přesto na žádném z vyšetření nebyla prokázána progrese velikosti ložisek ani rozvoj lymfadenopatie či dalších metastáz.
Malá ložiska (SRM – small renal masses) je možné u vybraných pacientů (vysoký věk, závažné komorbidity) dle Doporučených postupů Evropské urologické společnosti sledovat (active surveillance) a aktivní léčba bude zahájena až s progresí jejich velikosti. Jelikož je však v rámci stagingu renálních karcinomů scintigrafie skeletu indikována pouze v případě klinické suspekce na přítomnost kostních metastáz (CT mozku také není v rutinním diagnostickém postupu) (1), může dojít k poddiagnostikování zmíněných lézí, neboť jsou mylně považovány za lokalizovaná onemocnění.
Urology a onkology často diskutovaná cytoredukční nefrektomie metastatického karcinomu ledviny je u většiny pacientů paliativním zákrokem pomáhajícím ulevit od lokálních příznaků (např. konzervativně neřešitelná makrohematurie). Byl však prokázán benefit v celkovém přežití u pacientů podstoupivších cytoredukční nefrektomii následovanou imunoterapií ve srovnání se samostatně aplikovanou imunoterapií (LE: 1a). Pro biologickou léčbu cílenými preparáty jsou k dispozici pouze retrospektivní studie, ale i v tomto případě je u pacientů s dobrým performance status pozorován benefit v celkovém přežití a možnost odložení zahájení systémové terapie po provedení cytoredukční nefrektomie s resekcí solitárních metastáz (LE: 3) (1).
Ačkoli je renální karcinom radiorezistentní, je prokázán benefit paliativní radioterapie kostních či mozkových metastáz, a to i po jejich chirurgickém odstranění (17).
ZÁVĚR
I přes jasný posun v diagnostice k časnějším stádiím díky rozšířenosti zobrazovacích metod má stále až čtvrtina renálních karcinomů v době diagnózy přítomné vzdálené metastázy, přičemž s rostoucí velikostí primární léze riziko roste – v případě drobných tumorů T1a je riziko udáváno v rozmezí 1 až 8 %. Jedná‑li se o kostní a mozkové metastázy, mohou tyto zůstat mnohdy nerozpoznány, neboť scintigrafie skeletu a CT mozku jsou dle platných Doporučených postupů Evropské urologické společnosti indikované pouze při klinické suspekci na jejich přítomnost. Zmíněný metastatický potenciál vnáší otázku do protokolů active surveillance, která je možným postupem u vybraných pacientů.
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Došlo: 11. 9. 2017
Přijato: 13. 11. 2017
Kontaktní adresa:
MUDr. Jan Novák
Urologické oddělení, Oblastní nemocnice Kladno, a. s. Vančurova 1 548, 272 59 Kladno
email: honza.novak11@gmail.com
Sources
1. Ljungberg B, Albiges L, Bensalah K, et al. EAU guidelines on renal cell carcinoma. Arnhem: European Association of Urology; 2017.
2. Soukupová J, Zemánková P, Kleiblová P, Janatová M, Kleibl Z. CZECANCA: CZEch CAncer paNel for Clinical Application – Design and Optimization of the Targeted Sequencing Panel for the Identification of Cancer Susceptibility in High‑risk Individuals from the Czech Republic. Klin Onkol. 2016; 29(Suppl 1): S46–54.
3. Povýšil C, Šteiner I. Speciální patologie. 2., dopl. a přeprac. vyd. Praha: Galén; 2007. 430 s.
4. Boussios S, Zerdes I, Batsi O, et al. Pancreatic resection for renal cell carcinoma metastasis: an exceptionally rare coexistence. Int J Surg Case Rep. 2016; 27 : 198–201.
5. Matsumoto K, Hayakawa N, Nakamura S, Oya M. Bladder metastasis from renal cell carcinoma: retrospective analysis of 65 reported cases. Clin Exp Metastasis. 2015; 32(2): 135–141.
6. Pastremoli A. Gingival metastasis, the first clinical sign of a silent kidney carcinoma. A case report. Minerva Stomatol. 1991; 40(12): 825–828.
7. Astl J, Bahannan AA, Dušková J, Novák Z, Vlcek P, Betka J. Solitary metastasis of clear renal cell carcinoma to thyroid gland: three reported cases with review of the literature. Gulf J Oncolog. 2017; 1(23): 67–71.
8. Hasan R, Kumar S, Monappa V, Ayachit A. Primary extra‑renal clear cell renal cell carcinoma masquerading as an adrenal mass: A diagnostic challenge. Urol Ann. 2015; 7(4): 513–515.
9. Novák P, Németh I, Hamar S, et al. Clear cell adenocarcinoma of the tongue. Coincidence or distant metastasis? Fogorv Sz. 2009; 102(5): 183–186.
10. Zeman V, Trnka V. Clear‑cell carcinoma of the thyroid gland. Cesk Patol. 1979; 15(2): 91–95.
11. Nissenbaum M, Kutz JE, Lister GD. Clear‑cell carcinoma of the lung metastatic to the hamate: a case report. Clin Orthop Relat Res. 1978; (134): 293–296.
12. Kim WJ, Kim SR, Choe YH, et al. Clear cell „sugar“ tumor of the lung: a well‑enhanced mass with an early washout pattern on dynamic contrast‑enhanced computed tomography. J Korean Med Sci. 2008;
23(6): 1121–1124.
13. Ozuguz P, Kocak M, Atasoy P, Vargel I, Cavusoglu T. Clear cell sarcoma. Indian Dermatol Online J. 2014; 5(4): 488–490. 14. Lal N, Singhai A. Clear cell sarcoma of kidney: a rare entity. Indian J Med Paediatr Oncol. 2011; 32(3): 157–159.
15. Lee H, Lee JK, Kim K, et al. Risk of metastasis for T1a renal cell carcinoma. World J Urol. 2016; 34(4): 553–559.
16. Thompson RH, Hill JR, Babayev Y, et al. Metastatic renal cell carcinoma risk according to tumor size. J Urol. 2009; 182(1): 41–45.
17. Damber J‑E, Peeker R. Urologi. Studentlitteratur; 2012. 549.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2017 Issue 4-
All articles in this issue
- LAPAROSKOPICKÁ EXTRAPERITONEÁLNÍ RADIKÁLNÍ PROSTATEKTOMIE NERVY ŠETŘÍCÍ – VIDEO
- DOMÁCÍ VYŠETŘENÍ SPERMIOGRAMU POMOCÍ CHYTRÉHO MOBILNÍHO TELEFONU? VÍTEJTE V ÉŘE TELESPERMATOLOGIE
- ZKUŠENOSTI S POUŽITÍM INDEXU ZDRAVÍ PROSTATY V KLINICKÉ PRAXI
- VYUŽITÍ PRŮTOKOVÉ CYTOMETRIE PRO STANOVENÍ KVALITY EJAKULÁTU U MUŽŮ S PORUCHOU REPRODUKCE
- SOLITÁRNÍ KOSTNÍ METASTÁZA V PALCI RUKY JAKO PRIMOMANIFESTACE BILATERÁLNÍHO SVĚTLOBUNĚČNÉHO RENÁLNÍHO KARCINOMU pT1a U PACIENTA SE SPORADICKOU TRIPLICITOU UROLOGICKÝCH MALIGNIT
- PARATESTIKULÁRNÍ MALIGNÍ MEZOTELIOM
- AGRANULOCYTÓZA PO ANALGETICKÉ LÉČBĚ RENÁLNÍ KOLIKY
- ATYPICKÁ SEKUNDÁRNÍ MALIGNITA PO RADIOTERAPII PROSTATY
- K POZORUHODNÉMU ŽIVOTNÍMU JUBILEU doc. MUDr. Radko Petříka, CSc.
- CO SE UDÁLO NA VÝROČNÍ KONFERENCI ČUS SPOJENÉ S CEM V ŘÍJNU 2017 V PLZNI?
- VÝSLEDKY SOUTĚŽE ČUS O NEJLEPŠÍ VĚDECKOU PUBLIKACI ZA ROK 2016
- LYNCHŮV SYNDROM V RUKÁCH UROLOGA
- LAUDATIO K ŽIVOTNÍMU VÝROČÍ doc. MUDr. Jana Krhuta, Ph.D.
- doc. MUDr. Miloš Broďák, Ph.D., SLAVÍ ŽIVOTNÍ JUBILEUM
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ZKUŠENOSTI S POUŽITÍM INDEXU ZDRAVÍ PROSTATY V KLINICKÉ PRAXI
- AGRANULOCYTÓZA PO ANALGETICKÉ LÉČBĚ RENÁLNÍ KOLIKY
- DOMÁCÍ VYŠETŘENÍ SPERMIOGRAMU POMOCÍ CHYTRÉHO MOBILNÍHO TELEFONU? VÍTEJTE V ÉŘE TELESPERMATOLOGIE
- doc. MUDr. Miloš Broďák, Ph.D., SLAVÍ ŽIVOTNÍ JUBILEUM
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

