-
Medical journals
- Career
Prediktivní parametry metastatického renálního karcinomu
Authors: Roman Sobotka; Otakar Čapoun; Viktor Soukup; Tomáš Hanuš
Authors‘ workplace: Urologická klinika 1. LF UK a VFN, Praha
Published in: Ces Urol 2014; 18(2): 101-111
Category: Original article
Overview
Definice klinických a laboratorních parametrů ve vztahu k metastatickému renálnímu karcinomu (RCC) u pacientů indikovaných k chirurgickému výkonu.
V období od května 2008 do února 2012 podstoupilo celkem 218 pacientů chirurgický výkon pro nádorovou expanzi ledviny. U všech pacientů byl zaznamenán věk, pohlaví, abúzus nikotinu, body mass index, klinické příznaky, vybrané laboratorní a perioperační parametry, typ a délka výkonu, krevní ztráty a délka hospitalizace. Z preparátu byl stanoven typ a velikost nádoru, grading a další histologické nálezy. Význam jednotlivých parametrů ve vztahu k lokalizovanému nebo metastatickému onemocnění byl hodnocen pomocí metody neparametrické analýzy rozptylu (Wilcoxon test). Metodou regresního modelu bylo zjištěno relativní riziko pro generalizaci tumoru. Multivariační analýza byla zpracována užitím Coxova regresního modelu metodou stepwise regrese.
Průměrný věk pacientů byl 64 let (22–84), mužů bylo celkem 143 (66 %), kuřáků 62 (28 %). Průměrný BMI byl 30,0 (19,1–45,2). Incidentální asymptomatický nález RCC byl popsán ve 155 (71%) případech. Primárně metastatický RCC byl zjištěn u 36 (17 %) pacientů. Celkem 65 (30 %) pacientů podstoupilo resekci ledviny, z toho 21 (32 %) laparoskopicky. Nefrektomii pro tumor postoupilo celkem 130 pacientů (otevřeně 93 výkonů, laparoskopicky 37 výkonů). Benigní tumor byl diagnostikován u 20 (9 %) pacientů, nejčastějším karcinomem byl světlobuněčný RCC (72 %). Statisticky signifikantními parametry pro přítomnost metastáz RCC byly úbytek na hmotnosti, CRP, trombocytóza, velikost tumoru a přítomnost symptomů (vše p < 0,0001), hladina hemogloginu (p = 0,0003), grading tumoru (p = 0,0004), pT klasifikace (p = 0,0006) a neutrofilie (p = 0,0239). Příznivým parametrem pro lokalizovaný tumor byl incidentální nález (p < 0,0001). Benigní nádor byl častěji diagnostikován u žen (p = 0,0204). Krevní ztráty, délka výkonu a doba hospitalizace byly signifikatně odlišné mezi otevřeným a laparoskopickým přístupem.
Řada klinických, laboratorních a histologických parametrů je statisticky signifikantní pro predikci generalizovaného RCC. Pacienti s CRP > 15 ng/ml měli 22krát vyšší riziko pro metastatický RCC, s hemoglobinem < 120 g/l 4,5krát vyšší riziko, s trombocyty nad 350 × 109 9krát a při velikosti tumoru nad 9 cm 7,6krát vyšší riziko metastatického RCC.Klíčová slova:
karcinom ledviny, metastáza, nádorový marker, prognostické faktory, CRP.ÚVOD
Nádory ledvin představují 2–3 % všech zhoubných nádorů v dospělosti a jsou třetí nejčastější urologickou malignitou po karcinomu prostaty a uroteliálním karcinomu. Mortalita i přes moderní diagnostiku a léčbu dosahuje 30 % incidence karcinomu ledviny (RCC) (1). V přepočtu na světový standard je v České republice (počet obyvatel 10,5 mil.) výskyt RCC nejvyšší na světě. Ročně je diagnostikováno přibližně 2800 nových případů, muži mají výskyt karcinomu ledviny cca 1,5krát častější než ženy (v roce 2010 byla incidence 20,88 mužů na 100 000 obyvatel přepočtených na světový standard, což znamená 1817 mužů v rámci České republiky) (1). I přes nárůst detekce malých náhodně zjištěných nádorů je v současné době stále patrný poměrně vysoký záchyt objemných nádorů. Ročně je přibližně 500–550 pacientů diagnostikováno již ve stadiu metastatického onemocnění, což odpovídá 18 % všech nově zjištěných nádorů ledvin. Právě tyto objemné a pokročilé nádory udržují téměř stabilní úroveň mortality na RCC za poslední desetiletí.
Karcinom ledviny je dlouhou dobu svého růstu u většiny postižených bezpříznakový. Dokonce i pokročilé a metastatické tumory bývají často bez symptomů, jen vzácně je vyjádřena klasická trias (hematurie, bolestí a hmatné rezistence). Většina pokročilých tumorů se manifestuje spíše celkovými příznaky, mezi které patří trombocytóza, hyperkalcémie a hypertenze nebo elevace jaterních enzymů (Staufferův syndrom). Určení rizika recidivy onemocnění je zásadní pro volbu chirurgického přístupu a následné sledování pacientů včetně frekvence zobrazovacích metod nebo účasti pacientů v klinických studiích s adjuvantní léčbou. Prognostické modely recidivy RCC zahrnují TNM klasifikaci, grading a velikost tumoru a přítomnost intratumorální nekrózy. Vliv histologického podtypu RCC na dobu do vzniku metastáz nebo nádorově specifické přežití byl také potvrzen. Pacienti se světlobuněčným RCC mají horší prognózu ve srovnání s pacienty s papilárním nebo chromofobním RCC stejného stadia a gradingu. Přesnost prognostických modelů zvyšuje využití dalších klinických, patologických nebo laboratorních parametrů, mezi něž patří např. snížená hladina hemoglobinu a elevace hladiny CRP nebo trombocytů.
Anémie je vysvětlována jako výsledek interakce mezi imunitním systémem s metabolismem železa a erytropoézou. Některé cytokiny jako interleukin-1 (IL-1) a tumor necrosis factor alfa (TNF-α) přirozeně vedou k supresi erytropoézy. Jiné jako IL-6 a hepcidin alterují metabolismus železa a vedou k retenci železa v retikuloendotelovém systému. Výsledkem je snížená hladina feritinu (6). Zvýšená hodnota CRP je v souvislosti s objemem nádorové masy a přítomností metastáz. Až u 20 % pacientů s RCC je zánětlivá reakce zahrnující subfebrilie, ztrátu hmotnosti a zvýšenou sedimentaci (FW) a současně elevace CRP s mírnou trombocytózou. Klinické a experimentální údaje naznačují, že patogeneze této reakce je v souvislosti s nádorem indukovanou produkcí cytokinů, zejména IL-6. Tento cytokin má také hlavní úlohu v odpovědi akutní fáze a stimuluje hepatocyty k produkci proteinů akutní fáze, tj. CRP a fibrinogenu a inhibuje produkci albuminu. Trombocytóza také souvisí s aktivitou IL-6 a zvýšenou produkcí růstového faktoru thrombopoietinu (TPO) v hepatocytech, čímž dochází ke stimulaci produkce a diferenciace megakaryocytů v kostní dřeni. Na zvýšené tvorbě destiček se také může podílet vyšší exprese faktoru stimulujícího granulocytární kolonie (G-CSF) v nádorové tkáni.
V současné době je vyléčitelný pouze pacient s kompletně odstraněným tumorem ledviny. Prognóza pacientů s generalizovaným RCC je stále neuspokojivá i přes prodloužení doby do progrese a celkového přežití pacientů léčených biologickou léčbou. V současnosti neexistují žádné markery využitelné v klinické praxi pro detekci nebo stanovení prognózy RCC, především z důvodu vysokých nákladů a limitovaných výsledků. Je snaha o začlenění některých nových biomarkerů do stávajících prognostických modelů s cílem zlepšit jejich prediktivní schopnost (9). U těchto nových biomarkerů bude také snaha o jejich zařazení do screeningových programů pro vyhledávání časných stadií. Předmětem prospektivní studie bylo porovnat rozdíly v běžně dostupných klinických a laboratorních parametrů u lokalizovaného a metastatického RCC.
METODIKA
Do studie bylo zařazeno od května 2008 do února 2012 celkem 217 pacientů, kteří podstoupili chirurgický výkon pro nádor ledviny. Pacienti s benigním tumorem byli z analýzy vyřazeni (n = 20). U vybraných klinických a laboratorních parametrů jsme stanovili statistickou významnost a hodnotu relativního rizika pro přítomnost metastatického karcinomu. U všech pacientů byl zaznamenán věk a pohlaví, hodnota body mass indexu (BMI) byla vypočítána na základě výšky a váhy pa-cienta v den příjmu k výkonu. Abúzus nikotinu byl hodnocen ve formě skupin nekuřáků, bývalých a současných kuřáků, absolutní hodnota byla stanovena jako balíčkorok (balíčkorok je definován jako vykouření 20 kusů cigaret denně po dobu 1 roku). Většina pacientů byla v době diagnózy asymptomatických, jednotlivé symptomy nebyly kategorizovány, ale jednotlivě popsány. Zvlášť byl sledován výskyt mikroskopické a makroskopické hematurie, lumbalgie a nespecifických celkových klinických příznaků, jako je únava, nechutenství, dušnost, noční pocení a subfebrilie. Všichni pacienti byli dotázáni na případný úbytek hmotnosti v posledních 3 měsících před výkonem, úbytek hmotnosti byl definován absolutním číslem v kilogramech. Z laboratorních parametrů byly monitorovány hodnoty hemoglobinu, počet leukocytů a diferenciál krevního obrazu, počet trombocytů, hladina CRP, urea, kreatinin, sérové kalcium a laktátdehydrogenáza, alkalická fosfatáza. Všechny laboratorní odběry byly prováděny mezi 7. a 8. hodinou ranní nalačno v den výkonu. V rámci předoperačního stagingu onemocnění bylo u všech pacientů provedeno CT břicha a malé pánve s kontrastní látkou a prostý snímek hrudníku nebo CT plic. V případě kostních bolestí a u objemných nádorů byla indikována scintigrafie skeletu. Vyhodnocování CT vyšetření a RTG snímků hrudníku bylo prováděno či supervidováno dvěma radiology s úzkou specializací na urologii. Dále jsme popsali lokalizaci případných metastatických ložisek a počet postižených orgánů. Velikost tumoru byla zaznamenána v milimetrech na základě zprávy patologa u fixovaného preparátu, byl určen patologický staging a jaderný grading dle Fuhrmanové. Mezi další histopatologické charakteristiky patřily infiltrace perirenálního, perihilózního tuku nebo ledvinné pánvičky, přítomnost nekróz nebo zánětlivé infiltrace tumoru neutrofily. Dále byl popsán rozsah případného nádorového trombu a postižení nadledviny v případě provedení adrenalektomie. Histologické hodnocení preparátu bylo provedeno týmem Ústavu patologie 1. LF UK a VFN v Praze.
Statistická analýza
Jednotlivé proměnné byly popsány metodami deskriptivní statistiky, u kontinuálních proměnných s normální distribucí byla stanovena průměrná hodnota a směrodatná odchylka, kontinuální proměnné s abnormální distribucí byly hodnoceny pomocí mediánu a kvartilů, zatímco kategorické proměnné byly definovány pomocí frekvence případů. Vztahy mezi jednotlivými vstupními parametry byly hodnoceny pomocí Spearmanova koeficientu pořadové korelace. Pozitivní vztah byl prokázán testem o nenulovém koeficientu korelace. U každého vstupního parametru byla metodou kontingenční tabulky a χ2-testu zhodnocena relativní četnost výskytu lokalizovaného nebo metastatického onemocnění. Význam jednotlivých spojitých veličin pro přítomnost generalizovaného karcinomu byl hodnocen pomocí metody neparametrické analýzy rozptylu (Wilcoxonův test). Multivariační analýzou pomocí Coxova regresního modelu byly definovány nezávislé prognostické parametry a bylo stanoveno relativní riziko generalizace tumoru v době diagnózy. Hladina významnosti statistických testů byla stanovena na hranici p = 0,05 (5 %). Analýza byla provedena pomocí statistického software Statistica 9.0.
VÝSLEDKY
Charakteristiky souboru jsou shrnuty v tabulce 1. Z celkového počtu 217 zařazených pacientů bylo 160 (73,7 %) nemocných s lokalizovaným karcinomem ledviny a 36 (16,6 %) nemocných s generalizací karcinomu ledviny. Průměrný věk pacientů byl 64 let (22–84). Průměrný počet „balíčkoroků“ dosahoval u skupiny exkuřáků 24,0; ve skupině současných kuřáků 30,8. U pacientů s generalizovaným karcinomem ledviny byl průměrný počet balíčkoroků 13,5, zatímco u případů s lokalizovaným karcinomem ledviny 15,8. Celkem 13 pacientů (37,1 %) s primárně generalizovaným karcinomem ledviny byli nekuřáci, zatímco ve skupině s lokalizovaným karcinomem byl nekuřáků 77 (47,8 %).
Table 1. Prediktivní parametry metastatického karcinomu ledviny – univariantní a multivariantní analýza Table 1. Predictive parameters of metastatic renal cell carcinoma – univariate and multivariate analysis 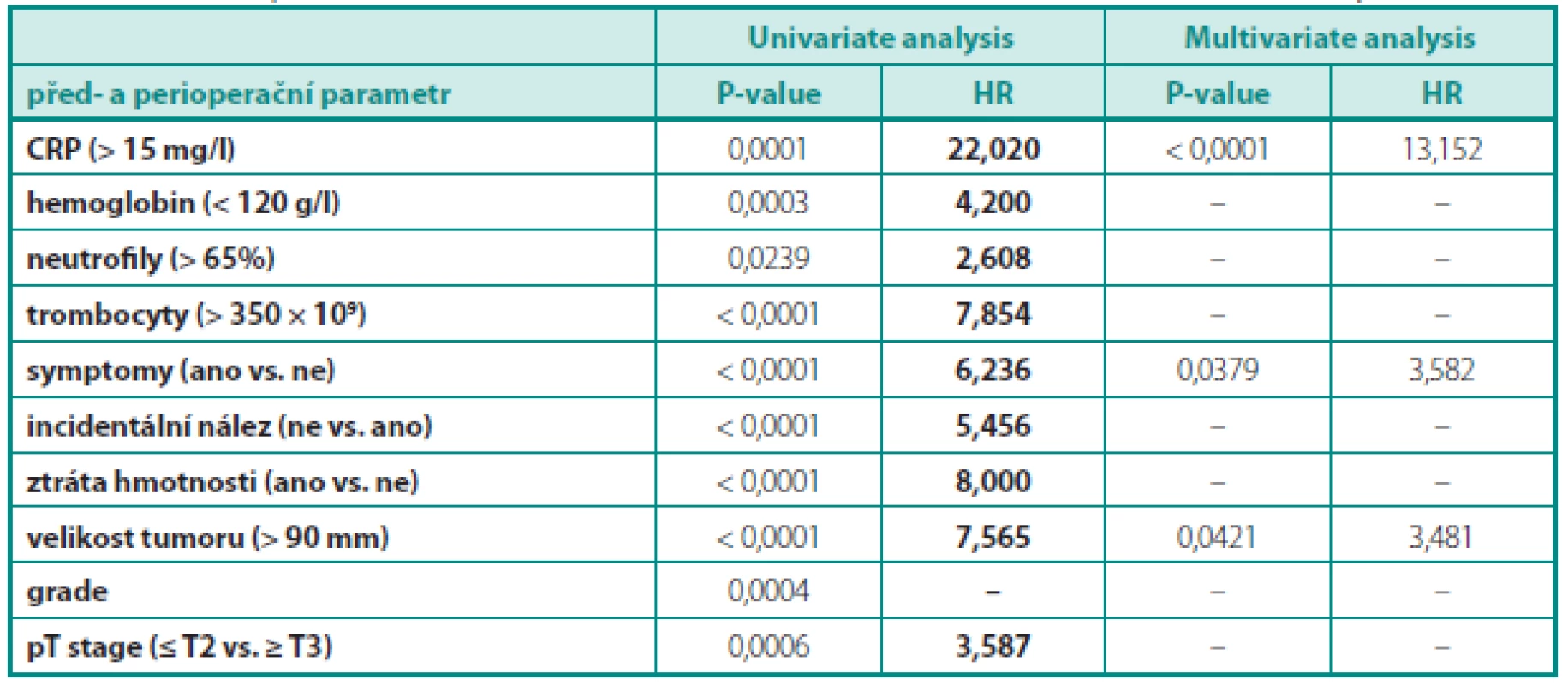
Průměrný BMI byl 30,0 (19,1–45,2). Mezi jednotlivými skupinami benigního tumoru a lokalizovaného nebo metastatického karcinomu se hodnoty BMI významně nelišily.
Incidentální nález RCC byl popsán ve 155 (71 %) případech, v obou skupinách (lokalizovaný a generalizovaný RCC) byl asymptomatický průběh onemocnění nejčastější. Nicméně u primárně generalizovaného onemocnění byla přítomnost symptomů častější než u lokalizovaného tumoru (61,1 vs. 22,4 %). Ze symptomů u pacientů s generalizovaným karcinomem ledviny převažovala hematurie (59,0 %), dále celkové příznaky (27,2 %), lumbalgie (13,6 %) a patologická fraktura (4,5 %). Ve skupině pacientů s lokalizovaným karcinomem byl také nejčastější symptom hematurie (55 %).
Celkem 65 (30 %) pacientů podstoupilo resekci ledviny, z toho 21 (32 %) laparoskopicky. Průměrná velikost tumoru při resekci ledviny byla 36 mm oproti 63 mm u pacientů, kteří podstoupili nefrektomii, a 97 mm u pacientů po provedené trombektomií (19 pacientů). Laparoskopicky byla průměrná velikost odstraněného tumoru 41 mm (14–90 mm), při laparoskopciké nefrektomii průměrně 49 mm, zatímco při laparoskopické resekci ledviny pro tumor 29 mm. Nefrektomii pro tumor postoupilo celkem 130 pacientů (otevřeně 93 výkonů, laparoskopicky 37 výkonů).
U resekcí ledviny byla nejčastější pT klasifikace pT1a (55,4 %), následovaná pT1b (16,9 %). Resekcí ledviny byli též řešeni dva pacienti s pT3a nálezem (první pacient s velikostí tumoru 34 mm, druhý 49 mm – u obou byl nález pT3a až histologickým zjištěním, oba s negativním resekčním okrajem) a jeden pacient s nálezem pT2a. U 15 pacientů (23,1 %) se jednalo o nezhoubný nález. Ve skupině pacientů po nefrektomii byla nejčastější klasifikace pT3a v 39 případech (29,8 %), následovaná klasifikací pT1b s lokalizací tumoru nevhodnou k resekci (21,4 %).
Benigní tumor byl diagnostikován z celého souboru pacientů u 20 (9 %) pacientů, nejčastějším karcinomem byl světlobuněčný karcinom (72 %), následovaný papilárním renálním karcinomem (typ I + typ II) (12,4 %), chromofobní karcinom byl zjištěn jen u čtyř pacientů z celé skupiny nemocných. Multilokulární cystický karcinom byl diagnostikován u dvou pacientů. Dva pacienti měli v rámci jedné ledviny dva tumory s odlišným histologickým typem (papilární renální karcinom typu II v jednom případě kombinovaný se světlobuněčným renálním karcinomem, ve druhém případě s chromofobním karcinomem). U jedné pacientky byl odstraněn iuxtaglomerulární tumor produkující renin a u jedné pacientky karcinom ze sběrných tubulů. Z 36 pacientů s primárně generalizovaným karcinomem tvořil primární nádor ledviny světlobuněčný karcinom (86,1 %), u tří pacientů byl primárním nádorem papilární renální karcinom typ I, jeden pacient měl papilární renální karcinom typ II a jeden pacient chromofobní karcinom. Benigní nádor byl častěji diagnostikován u žen (p = 0,0204), dominujícím typem byl onkocytom.
Krevní ztráty, délka výkonu a doba hospitalizace byly signifikatně odlišné mezi otevřeným a laparoskopickým přístupem. V případě otevřených výkonů (resekce ledviny, nefrektomie a kavotomie s trombektomií) byla průměrná krevní ztráta 489 ml při průměrné délce výkonu 113 minut. U pacientů, kteří měli pT4 nádor nebo nádorový trombus a byla prováděna trombektomie, dosahovala průměrná krevní ztráta 2326 ml. V případě laparoskopických výkonů byla průměrná krevní ztráta 272 ml při průměrné délce výkonu 147 minut. Po laparoskopických výkonech pacienti strávili pooperačně na lůžku průměrně 7,7 dne, po otevřených výkonech pak průměrně 9,8 dne.
V rámci vyhledávání a hodnocení prediktivních faktorů pro metastatický karcinom ledviny byly zařazeny následující hodnoty: BMI, kouření, úbytek tělesné hmotnosti, přítomnost symptomů, hladina hemoglobinu, množství trombocytů a neutrofilů, hladina CRP, Ca, LDH, ALP, velikost tumoru, grading tumoru a pT klasifikace.
Statisticky signifikantními parametry pro přítomnost metastáz RCC byly: váhový úbytek, CRP, trombocytóza, velikost tumoru a přítomnost symptomů (vše p < 0,0001), hladina hemogloginu (p = 0,0003), grading tumoru (p = 0,0004), pT klasifikace (p = 0,0006) a neutrofilie (p = 0,0239). Příznivým parametrem pro lokalizovaný tumor byl incidentální nález (p < 0,0001). Při univariantní analýze dosahovala hladina CRP nad 15 mg/l relativního rizika pro přítomnost metastatického karcinomu ledviny 22krát vyšší hodnoty než u pacientů s CRP pod 15 mg/l. Hladina krevních destiček nad 350 × 109, velikost tumoru nad 90 mm, přítomnost symptomů a váhový úbytek za poslední 3 měsíce zvyšovaly relativní riziko pro přítomnost metastatického karcinomu ledviny 5,5–8krát. V případě CRP dosahovala oblast pod křivkou (AUC) 79 %, pro velikost tumoru 78 %. Při provedení multivariantní analýzy zůstaly jako statisticky signifikantní faktory hladina CRP, přítomnost symptomů a velikost tumoru.
Mikroangioinvaze, lymfangioinvaze a způsob infiltrace tuku (perirenálně vs. perihilózně) byl z celého souboru pacientů hodnocen jen u 80 pacientů (36,9 %), proto výsledky nebyly zařazeny do celkového vyhodnocení.
DISKUSE
V současné době neexistuje pro karcinom ledviny žádný marker, který by byl spolehlivě schopen diagnostikovat přítomnost lokalizovaného ani pokročilého či metastatického onemocnění. Ve většině případů je karcinom ledviny bezpříznakové onemocnění, které je diagnostikováno náhodně na základě ultrasonografického či CT vyšetření. Je tedy snaha hledat nové sérové či močové markery, které by napomohly k časnější diagnostice karcinomu ledviny, vedly k odhalení mikrometastatického onemocnění a s jistotou byly schopny predikovat riziko vzniku metastáz u pacienta po radikální operaci pro lokalizovaný karcinom ledviny.
Již v současné době je dostupná řada prognostických modelů, které jsou s jistou přesností schopné predikovat pravděpodobnost nádorově specifického přežití (CSS) a celkového přežití (OS) pacientů s lokalizovaným karcinomem ledviny (např. MSKCC – Memorial Sloan-Kettering Cancer Center – nomogram) (41) nebo spočítat pravděpodobnost metastáz v době diagnózy na základě velikosti nádoru a přítomnosti či absence symptomů, popřípadě určit riziko postižení lymfatických uzlin v době diagnózy (Karakiewicz) (42). Většina těchto i dalších modelů (Patard, Zisman, Frank a Leibovich, SSIGN – stage, size, grade and necrosis, UISS – University of California-Los Angeles Integrated Staging System) vychází z následujících prognostických faktorů: TNM klasifikace, performance status, Fuhrmanové grade, většina i velikost nádoru, symptomy pacienta, SSIGN počítá i s nekrózou tumoru jako prognostickým parametrem.
Tyto prognostické modely byly v minulosti jednotlivě i konfrontačně validovány. Martella v roce 2011 retrospektivně porovnal SSIGN a UISS model na skupině 100 pacientů a nezjistil významnou odlišnost predikce CSS. Oblast pod křivkou (ROC) byla pro SSIGN model 0,815, pro UISS 0,843 (10).
Souvislost velikosti tumoru, stagingu, gradingu a pokročilosti karcinomu ledviny je známým údajem. Práce čínských autorů hodnotí vztah velikosti nádoru, stagingu, gradingu a histologického subtypu. Průměr nádoru se stoupajícím gradem rostl. Procento extrakapsulárních invazí u nádorů do 2 cm dosahovalo 0,5 % oproti nádorům nad 10 cm, kde bylo až 91,9 %. Pravděpodobnost papilárního a chromofobního karcinomu klesá s nárůstem velikosti nádoru oproti světlobuněčné variantě. V případě průkazu nekróz a ostatních regresivních změn, jako je krvácení, je větší pravděpodobnost chromofobního karcinomu (11).
V našem souboru dosahovala průměrná velikost světlobuněčného karcinomu 61 mm (12–180 mm), zatímco průměrná velikost papilárního renálního karcinomu byla 48 mm (14–90 mm). Snažili jsme se také ověřit některé další klinické parametry v rámci predikce pokročilého stadia karcinomu ledviny. Prokázali jsme, že pacienti s metastatickým renálním karcinomem mají signifikantně větší velikost tumoru (p < 0,0001), vyšší stage (p < 0,0006) a vyšší grade (p < 0,0004). Sledované symptomy pacienta (mikrohematurie a makrohematurie, lumbalgie, varikokéla) dosahovaly hazard ratio (HR) 5,456 mezi lokalizovaným a metastatickým karcinomem ledviny, ztráta hmotnosti za poslední 3 měsíce dokonce HR 8,000.
Je známo, že přítomnost paraneoplastických příznaků zhoršuje přežití pacientů s lokalizovaným karcinomem. V retrospektivní studii mělo 1512 pacientů celkem 68 % pacientů nejméně jeden paraneoplastický symptom, z nichž zvýšená sedimentace (FW), kachexie, varikokéla a pyrexie byly v souvislosti s pokročilejším stadiem RCC (12). V našem souboru bylo celkem 62 pacientů (28,4 %) v době diagnózy hodnoceno jako symptomatických. Problémem hodnocení paraneoplastických symptomů je jejich variabilita a rozdílné určení jednotlivých symptomů u jednotlivých autorů. V našem souboru jsme jednotlivé laboratorní hodnoty nehodnotili jako paraneoplastické symptomy, za symptomatické byli prezentováni pacienti, kteří se v době diagnózy projevili hematurií, lumbalgií a celkovými příznaky, které nebyly jednotlivě hodnoceny. Toto může být limitací této práce.
Paralelně se v literatuře v posledních letech objevuje snaha identifikovat další marker, který by zlepšil prognostickou schopnost těchto modelů. Ze současně dostupných běžných laboratorních parametrů, které mají prediktivní vztah ke karcinomu ledviny, se ověřují proteiny akutní fáze, zejména CRP, SAA a další. Práce Michigena hodnotí na skupině 257 pacientů význam předoperačního CRP jako prediktivního markeru CSS u pacientů s lokalizovaným karcinomem ledviny. Mezi další prognosticky významné faktory autor hodnotí stage, grade, velikost tumoru, Charlson Comorbidity Index score a kouření (13). Zvýšená hodnota předoperačního i pooperačního CRP je v souvislosti s objemem nádorové masy a přítomností metastáz. Až u 20 % pacientů s karcinomem ledviny je zánětlivá reakce zahrnující subfebrilie, ztrátu hmotnosti a zvýšenou sedimentaci (FW) a elevace CRP s mírnou trombocytózou. Klinické a experimentální údaje naznačují, že patogeneze této reakce je v souvislosti s tumor odvozenou produkcí cytokinů, zejména interleukinu-6 (6).
Stanovením cut-off hodnoty CRP pro predikci CSS se zabývala německá práce Bedkeho. Multivariantní analýza prokázala, že optimální hodnota CRP pro stratifikaci CSS je při hodnotě 2,5 mg/l (HR 6,47, p < 0,001). Přidání CRP ke stávajícím prognostickým modelům však již nedošlo k zlepšení prediktivní schopnost těchto modelů (14). Obdobnou snahou o stratifikaci hodnot CRP ve vztahu k CSS se zabývala práce Stephense. Hodnoty CRP u pacientů s karcinomem ledviny stratifikoval na tři podskupiny (CRP ≤ 4, 4–10, a > 10 mg /l), elevace CRP významně korelovala se sta-diem nádoru, rizikem postižení uzlin a přítomností vzdálených metastáz (2,9, 8,6, a 30,0 %, p < 0,001). Pětileté přežití bylo v jednotlivých skupinách dosahováno 89,4, 77,9, a 49,5 %. Pacienti s CRP 4–10 mg/l a > 10 mg/l měli 1,67 a 2,48krát vyšší riziko úmrtí v důsledku jejich RCC ve srovnání s pacienty s předoperační hodnotou CRP ≤ 4 mg/l (15). Podobně jako naše práce hodnotila i argentinská studie z Buenos Aires odds-ratio pro cut-off hodnotu CRP při lokálně pokročilém karcinomu ledviny. Hodnota CRP ≥ 10 mg/l v publikované studii dosahuje HR 4,0 pro přítomnost lokálně pokročilého nemetastatického onemocnění (16). V našem souboru předoperační hodnota CRP nad 15 mg/l dosahovala HR až 22 v predikci metastatického stadia (p < 0,0001) a hodnota CRP byla v multivariantní analýze také nejsilnějším prediktorem pokročilého onemocnění (HR = 13,152).
Významnou změnou pohledu na prediktivní schopnost CRP byla práce z Atlanty, ve které autoři v roce 2010 prokázali, že nikoliv předoperační hodnota CRP, ale pooperační hodnota CRP je lépe prediktivní ve smyslu vzniku metastáz a CSS po nefrektomii pro vstupně lokalizovaný RCC (17). Jinou prací byla hodnocena kinetika CRP u karcinomu ledviny. Bylo zařazeno 108 pacientů s metastatickým karcinomem ledviny. Pacienti byli rozděleni do tří skupin: se vstupním CRP < 5,0 mg/l, s CRP > 5,0 mg/l, které se v průběhu multimodální léčby normalizovalo, a s CRP > 5,0 mg/l, které v průběhu léčby se dále navyšovalo. Porovnáním prvních dvou skupin se skupinou pacientů bez normalizace hodnoty CRP v průběhu léčby byla určena prediktivní schopnost CRP jako nezávislého prognostického faktoru ve vztahu k OS v rámci léčby metastatického karcinomu ledviny (18).
Jako ještě citlivější marker pro CSS je v některých pracích hodnocen serum amyloid A (SAA) patřící do skupiny proteinů akutní fáze. Pokročilé nádory ledvin byly identifikovány se senzitivitou 78 % pro SAA, 69 % pro CRP a 44 % pro IL-6. Specificita dosahovala 82 %, 82 % a 94 % pro SAA, CRP a IL-6 (19). Rozdíl hladin SAA je také signifikantně odlišný mezi lokalizovaným a metastatickým sta-diem karcinomu ledviny (20).
Práci hodnotící vliv předoperační trombocytózy na CSS u pacientů operovaných pro lokalizovaný a metastatický karcinom publikovali autoři z Mnichova. Bylo hodnoceno celkem 3139 pacientů ze čtyř center. Předoperační trombocytóza má vliv na CSS u pacientů s lokalizovaným, nikoliv však s metastatickým karcinomem ledviny. Cut-off hodnota byla u trombocytózy stanovena na 400 × 109 buněk/l, pro tuto hodnotu byl HR 1,337 (21). Obdobně byl prokázán vliv trombocytózy na OS a CSS i jinými autory (22). Španělská práce Seda též potvrzuje prognostický vliv trombocytózy na přežití. Pacienti s hladinou trombocytů vyšší než 350 × 109 buněk/l měli zkrácené přežití. V našem souboru jsme hodnotili hodnotu trombocytózy jako prediktora metastatického onemocnění a prokázali, že u hodnoty trombocytů nad 350 × 109 buněk/l je dosaženo HR 7,854 pro riziko přítomnosti metastatického onemocnění (p < 0,0001).
Naopak jako favorizující faktor přežití byl v literatuře identifikován hematokrit. Jeho zvýšená hodnota nad normu v době stanovení diagnózy představuje nižší riziko úmrtí (23). Výsledky své práce publikoval také v roce 2007 Karakiewicz na skupině 1828 pacientů s karcinomem ledviny. Prokázal vliv předoperační trombocytózy a anémie na zhoršení CSS, tyto prognostické faktory již však dále nezlepšili prediktivní schopnost Karakiewiczova nomogramu v porovnání se stávajícími prognostickými faktory (stage, grade, histologický subtyp a Eastern Cooperative Oncology Group-Performance Status) (24). Naopak Ito poukazuje na malý prognostický vliv trombocytózy. Pacienti s trombocytózou a pacienti se zvýšenou hladinou CRP vykazují signifikantně vyšší patologický stage, klinické stadium, velikost nádoru, histologický grade a procento mikrovaskulární invaze než pacienti bez trombocytózy a s hladinou CRP < 10 mg/l. Multivariantní analýza prokázala, že vzdálené metastázy, velikost nádoru, grading stupně 3 a CRP byly nezávislými prediktory prognózy, nikoliv však trombocytóza (25). Pacienti s předoperační anémií měli postoperačně až 6,20krát větší riziko úmrtí na jiné onemocnění než RCC ve srovnání s pacienty bez anémie. Tento vliv anémie byl výraznější u pacientů s indexem tělesné hmotnosti (BMI) < 25 (26).
Jako další možný prognostický faktor je v literatuře hodnocen poměr neutrofilů a lymfocytů. V práci Pichlera z Grazu identifikovala multivariantní analýza zvýšený poměr neutrofily/lymfocyty jako nezávislý prognostický faktor pro OS (HR = 1,59), ale ne pro CSS, ani pro přežití bez metastáz (27). Studie z Tokya uvádí, že pacienti s hodnotou poměru neutrofilů/lymfocytů nad 2,7 měli výrazně zhoršené přežití bez recidivy oproti skupině pacientů s poměrem pod 2,7. Zároveň zhoršené CSS bylo výraznější u pacientů, kteří měli pooperačně snížený poměr neutrofilů/lymfocytů pod 2,7 oproti skupině pacientů s trvající elevací. Tato kombinace změny předoperačního a pooperačního poměru neutrofilů/lymfocytů byla multivariantní analýzou prokázána jako nezávislý prognostický parametr (28). Jinou analýzou bylo zjištěno, že hodnota poměru neutrofilů/lymfocytů souvisí s dobou do progrese, resp. vzniku mestatáz. Poměr neutrofilů/leukocytů byl nejvyšší u pacientů s přítomností metastáz v době diagnózy, následuje skupina pacientů s časným vznikem metastáz (do 5 let od operace), nejnižší byl u pacientů s pozdním vznikem metastáz. Tito pacienti měli nejlepší prognózu (29). Ohno v roce 2010 určil prognostické skupiny na základě T stagingu a hodnoty předoperačního poměru neutrofilů/lymfocytů. Stanovil 10leté přežití u pacientů s nízkým rizikem (T2 a méně a poměr neutrofilů/lymfocytů menší než 2,7), střední riziko (T2 a méně a poměr 2,7 nebo vyšší nebo T3 a vyšší a poměr menší než 2,7) a vysoké riziko (T3 a větší a poměr 2,7 nebo vyšší), které dosahuje 82,0 %, 63,6 % a 33,0 % (30). Limitací našeho souboru bylo hodnocení pouhého relativního zastoupení počtu neutrofilů v krevním diferenciálu bez stanovení poměru počtu neutrofilů a lymfocytů. I tak neutrofilie nad 65 %, zastoupená v krevním diferenciálu, znamená 2,6krát vyšší riziko přítomnosti metastatického onemocnění (p = 0,0239).
Jako jeden z nových a jen ojediněle publikovaných prognostických parametrů přežití je také fibrinogen. Takovouto retrospektivní práci na 286 pacientech uveřejnila čínská skupina autorů z Tianjinu. Prokázali vyšší předoperační hladinu fibrinogenu jako nezávislý prediktivní faktor OS i CSS (31).
Jednou z limitací práce je pravděpodobně chybné zařazení hodnot kalcémie do sledovaných parametrů. Ve většině prací je hodnota kalcia korigována k hodnotě albuminu. Pravděpodobně z tohoto důvodu nebyla hodnota kalcémie v našem souboru signifikantní pro predikci mRCC.
S rozvojem proteomiky se v posledních letech objevují další nové potenciální bílkoviny, které mají větší či menší vztah k prognostice u karcinomu ledviny. Jednou z prací hodnotící společně prediktivní schopnost CRP s osteopontinem a karboanhydrázou IX (CA IX) je studie Sima z roku 2012. Všechny tyto faktory byly v univariantní analýze prognostické ve vztahu k OS i CSS. Přiřazením těchto hodnot do Karakiewiczova nomogramu se zlepšila prognostická úroveň nomogramu. Osteopontin, CRP a CA IX dokázaly navýšit c-index pro staging na 76 % ve srovnání s 70 % u stávajícího nomogramu SSIGN. Elevace osteopontinu nebo CA IX tak identifikovala pacienty se špatnou prognózu ve stadiu T1, kteří by mohli mít prospěch z adjuvantní léčby nebo zpřísněného režimu sledování (32).
Již v roce 2002 byl publikován význam proteinu NMP-2 z moči, který by mohl být nezávislým prognostickým faktorem OS, práce však byla postavena na malém počtu pacientů (33). Dalšími proteiny identifikovanými v moči u karcinomu ledviny se vztahem k proximálnímu tubulu byly identifikovány aquaporin-1a adipophilin. Mohly by mít jistý význam v rámci primární diagnostiky, chybí však validizační studie (34).
Ze sérových nových potenciálních biomarkerů se objevují zmínky o N-BNP (N-terminal precursor of brain natriuretic peptide), který by mohl mít funkci v monitorování efektu biologické léčby u metastatického karcinomu ledviny. Pyruvát kináza typ M2 (TuM2-PK) a thymidin kináza 1 nebo Decoy receptor 3 jsou potencionálními prognostickými faktory recidivy, uvažuje se i o možnosti určení skupiny pacientů, kteří by benefitovali z adjuvantní léčby. Mezi další patří např. B7x či TPS, které by mohly korelovat s pokročilejším onemocněním (35–39).
Ani jeden z výše uvedených prediktivních faktorů není zcela diagnostický pouze pro karcinom ledviny, není použitelný pro diagnostiku a vyhledávání asymptomatických pacientů s karcinomem ledviny v populaci a nezlepšuje prediktivní schopnost stávajících nomogramů pro karcinom ledviny. Proto je snaha identifikovat nové prognostické faktory ze séra a z moči, které by měly vyšší prognostickou sílu. V literatuře se objevuje řada sdělení hodnotících izolovaně některý z těchto nových prediktivních molekul, eventuálně v kombinaci několika málo molekul. Výsledky ale zatím nenasvědčují pro široce využitelný marker se silnou prognostickou nebo diagnostickou silou. Probíhají však další studie a výzkumné projekty hodnotící další takové potenciální markery na základě rozvoje proteomiky, nebo se snaží vytvořit prognostický marker na základě stanovení celého panelu takovýchto bílkovin. Z námi testovaných bílkovin v rámci řešení projektu MPO TIP FR-TI3/666 jsme určili leptin jako možný potenciální marker zejména pro určení pokročilého onemocnění. Hladina leptinu byla statisticky odlišná mezi jednotlivými histologickými typy nádorů ledvin (p = 0,0419) a mezi lokalizovaným a metastatickým RCC (p = 0,0324). Dále odlišila jednotlivé stupně gradingu (p = 0,0270) a klinická stadia RCC (p = 0,0323) (40).
ZÁVĚR
Na základě sledování skupiny 217 nemocných s nádorem ledviny, odoperovaných na našem pracovišti, vychází, že řada klinických, laboratorních a histologických parametrů je statisticky signifikantní pro predikci metastatického RCC. Pacienti s CRP > 15 ng/ml měli 22krát vyšší riziko pro metastatický RCC, s hemoglobinem < 120 g/l 4,5krát vyšší riziko, s trombocyty nad 350 × 109 9krát a při velikosti tumoru nad 9 cm 7,6krát vyšší riziko metastatického RCC. Z námi testovaných potenciálních nových biomarkerů představuje leptin potenciální prognostický faktor pokročilého a dediferencovaného RCC. Je třeba dalších studií identifikujících nové sérové bílkoviny, ověření jejich prediktivních schopností u RCC a eventuálně jejich přiřazení do stávajících prognostických modelů za účelem zlepšení jejich prediktivních schopností a identifikace pacientů ve vysokém riziku relapsu onemocnění.
Došlo: 28. 11. 2013.
Přijato: 20. 1. 2014.
Kontaktní adresa
MUDr. Roman Sobotka
Urologická klinika 1. LF UK a VFN
Ke Karlovu 6, 128 00 Praha 2
e-mail: romansobotka@atlas.cz
Práce byla podpořena granty MPO TIP FR-TI3/666 a VZ MSM 0021620808.
Střet zájmů: žádný.
Sources
1. SVOD: www.svod.cz
2. Leibovich BC, Blute ML, Cheville JC, Lohse CM, Frank I, Kwon ED, Weaver AL, Parker AS, Zincke H. Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials. Cancer 2003; 97(7): 1663–1671.
3. Lau WK, Cheville JC, Blute ML, Weaver AL, Zincke H. Prognostic features of pathologic stage T1 renal cell carcinoma after radical nephrectomy. Urology 2002; 59(4): 532–537.
4. Cho DS, Kim SJ, Lee SH, Ahn HS, Kim YS, Kim SI. Prognostic significance of preoperative C-reactive protein elevation and thrombocytosis in patients with non-metastatic renal cell carcinoma. Korean J Urol 2011; 52(2): 104–109. doi: 10.4111/kju.2011.52.2.104. Epub 2011 Feb 21.
5. Citterio G, Bertuzzi A, Tresoldi M, Galli L, Di Lucca G, Scaglietti U, Rugarli C. Prognostic factors for survival in metastatic renal cell carcinoma: retrospective analysis from 109 consecutive patients. Eur Urol 1997; 31(3): 286–291.
6. van Rossum AP, Vlasveld LT, Vlasveld IN, Jansen PM, Dik WA, Hooijkaas H, Castel A. Granulocytosis and thrombocytosis in renal cell carcinoma: a pro-inflammatory cytokine response originating in the tumour. Neth J Med 2009; 67(5): 191–194.
7. Whiteside T. The role of immune cells in the tumor microenvironment the link between infl ammation and cancer. In Dalgleish AG, Haefner B eds, The Link Between Infl ammation and Cancer Wounds That Do Not Heal, Vol. 130. New York: Springer 2006; 103–124.
8. Suzuki A, Takahashi T, Nakamura K, Tsuyuoka R, Okuno Y, Enomoto T, Fukumoto M, Imura H. Thrombocytosis in patients with tumors producing colony-stimulating factor. Blood 1992; 80(8): 2052–2059.
9. Kruck S, Bedke J, Kuczyk MA, Merseburger AS. Second line systemic therapy for the treatment of metastaticrenal cell cancer. Expert Rev Anticancer Ther 2012; 12 : 777–785.
10. Martella O, Galatioto GP, Necozione S, Pomante R, Vicentini C. Integrated staging systems for conventional renal cell carcinoma: a comparison of two prognostic models. Arch Ital Urol Androl 2011; 83(3): 121–127.
11. Zhang C, Li X, Hao H, Yu W, He Z, Zhou L. The correlation between size of renal cell carcinoma and its histopathological characteristics: a single center study of 1867 renal cell carcinoma cases. BJU Int 2012; 110(11): 481–485.
12. Ding GX, Song NH, Feng CC, Xia GW, Jiang HW, Hua LX, Ding Q. Is there an association between advanced stage of renal cell carcinoma and paraneoplastic syndrome? Med Princ Pract 2012; 21(4): 370–374.
13. Michigan A, Johnson TV, Master VA. Preoperative C-reactive protein level adjusted for comorbidities and lifestyle factors predicts overall mortality in localized renal cell carcinoma. Mol Diagn Ther 2011; 15(4): 229–234.
14. Bedke J, Chun FK, Merseburger A, Scharpf M, Kasprzyk K, Schilling D, Sievert KD, Stenzl A, Kruck S. Inflammatory prognostic markers in clear cell renal cell carcinoma – preoperative C-reactive protein does not improve predictive accuracy. BJU Int 2012; 110(11): 771–777.
15. Steffens S, Köhler A, Rudolph R, Eggers H, Seidel C, Janssen M, Wegener G, Schrader M, Kuczyk MA, Schrader AJ. Validation of CRP as prognostic marker for renal cell carcinoma in a large series of patients. BMC Cancer 2012; 12 : 399.
16. García-Marchiñena P, Billordo-Perés N, Tobía-González I, Jurado A, Damia O, Gueglio G. High-sensitivity C-reactive protein as a predictor of locally advanced renal cell carcinoma. Arch Esp Urol 2012; 65(6): 601–607.
17. Johnson TV, Abbasi A, Owen-Smith A, Young AN, Kucuk O, Harris WB, Osunkoya AO, Ogan K, Pattaras J, Nieh PT, Marshall FF, Master VA. Postoperative better than preoperative C-reactive protein at predicting outcome after potentially curative nephrectomy for renal cell carcinoma. Urology 2010; 76(3): 766.e1–5.
18. Saito K, Tatokoro M, Fujii Y, Iimura Y, Koga F, Kawakami S, Kihara K. Impact of C-reactive protein kinetics on survival of patients with metastatic renal cell carcinoma. Eur Urol 2009; 55(5): 1145–1153.
19. Fischer K, Theil G, Hoda R, Fornara P. Serum amyloid A: a biomarker for renal cancer. Anticancer Res 2012; 32(5): 1801–1804.
20. Mittal A, Poudel B, Pandeya DR, Gupta SP, Sathian B, Yadav SK. Serum amyloid a as an independent prognostic factor for renal cell carcinoma – a hospital based study from the Western region of Nepal. Asian Pac J Cancer Prev 2012; 13(5): 2253–2255.
21. Brookman-May S, May M, Ficarra V, Kainz MC, Kampel-Kettner K, Kohlschreiber S, Wenzl V, Schneider M, Burger M, Wieland WF, Otto W,Tilki D, Gilfrich C, Hohenfellner M, Pahernik S, Chromecki TF, Stief C, Zigeuner R. Does preoperative platelet count and thrombocytosis play a prognostic role in patients undergoing nephrectomy for renal cell carcinoma? Results of a comprehensive retrospective series. World J Urol 2013; 31(5): 1309–1316.
22. Wosnitzer M, Polland A, Hai Q, Hruby G, McKiernan J. Role of preoperative platelet level in clinical and pathological outcomes after surgery for renal cortical malignancies. BJU Int 2011; 108(1): 73–79.
23. Seda CJ, Salas AS, Sánchez CG, Blasco JM, García IO, Sánchez JM, Ruíz CB, Navarro SM, López RA. Thrombocytosis and hematocrit as prognostic factors in renal carcinoma. Arch Esp Urol 2011; 64(9): 883–890.
24. Karakiewicz PI, Trinh QD, Lam JS, Tostain J, Pantuck AJ, Belldegrun AS, Patard JJ. Platelet count and preoperative haemoglobin do not significantly increase the performance of established predictors of renal cell carcinoma–specific mortality. Eur Urol 2007; 52(5): 1428–1436.
25. Ito K, Asano T, Yoshii H, Satoh A, Sumitomo M, Hayakawa M. Impact of thrombocytosis and C-reactive protein elevation on the prognosis for patients with renal cell carcinoma. Int J Urol 2006; 13(11): 1365–1370.
26. Choi Y, Park B, Kim K, Jeong BC, Seo SI, Jeon SS, Choi HY, Lee JE, Lee HM. Erythrocyte sedimentation rate and anaemia are independent predictors of survival in patients with clear cell renal cell carcinoma. Br J Cancer 2013; 108(2): 387–394.
27. Pichler M, Hutterer GC, Stoeckigt C, Chromecki TF, Stojakovic T, Golbeck S, Eberhard K, Gerger A, Mannweiler S, Pummer K, Zigeuner R. Validation of the pre-treatment neutrophil-lymphocyte ratio as a prognostic factor in a large European cohort of renal cell carcinoma patients. Br J Cancer 2013; 108(4): 901–907.
28. Ohno Y, Nakashima J, Ohori M, Gondo T, Hatano T, Tachibana M. Followup of neutrophil-to-lymphocyte ratio and recurrence of clear cell renal cell carcinoma. J Urol 2012; 187(2): 411–417.
29. Sejima T, Iwamoto H, Morizane S, Hinata N, Yao A, Isoyama T, Saito M, Takenaka A. The significant immunological characteristics of peripheral blood neutrophil-to-lymphocyte ratio and Fas ligand expression incidence in nephrectomized tumor in late recurrence from renal cell carcinoma. Urol Oncol 2013; 31(7): 1343–1349.
30. Ohno Y, Nakashima J, Ohori M, Hatano T, Tachibana M. Pretreatment neutrophil-to-lymphocyte ratio as an independent predictor of recurrence in patients with nonmetastatic renal cell carcinoma. J Urol 2010; 184(3): 873–878.
31. Du J, Zheng JH, Chen XS, Yang Q, Zhang YH, Zhou L, Yao X. High preoperative plasma fibrinogen is an independent predictor of distant metastasis and poor prognosis in renal cell carcinoma. Int J Clin Oncol 2013; 18(3): 517–523.
32. Sim SH, Messenger MP, Gregory WM, Wind TC, Vasudev NS, Cartledge J, Thompson D, Selby PJ, Banks RE. Prognostic utility of pre-operative circulating osteopontin, carbonic anhydrase IX and CRP in renal cell carcinoma. Br J Cancer 2012; 107(7): 1131–1137.
33. Ozer G, Altinel M, Kocak B, Yazicioglu A, Gonenc F. Value of urinary NMP-22 in patients with renal cell carcinoma. Urology 2002; 60(4): 593–597.
34. Morrissey JJ, London AN, Luo J, Kharasch ED. Urinary biomarkers for the early diagnosis of kidney cancer. Mayo Clin Proc 2010; 85(5): 413–421.
35. Papazisis KT, Kontovinis LF, Papandreou CN, Kouvatseas G, Lafaras C, Antonakis E, Christopoulou M, Andreadis C, Mouratidou D, Kortsaris AH. Brain natriuretic peptide precursor (NT-pro-BNP) levels predict for clinical benefit to sunitinib treatment in patients with metastatic renal cell carcinoma. BMC Cancer 2010; 10 : 489.
36. Nisman B, Yutkin V, Nechushtan H, Gofrit ON, Peretz T, Gronowitz S, Pode D. Circulating tumor M2 pyruvate kinase and thymidine kinase 1 are potential predictors for disease recurrence in renal cell carcinoma after nephrectomy. Urology 2010; 76(2): 513.e1–6.
37. Macher-Goeppinger S, Aulmann S, Wagener N, Funke B, Tagscherer KE, Haferkamp A, Hohenfellner M, Kim S, Autschbach F, Schirmacher P, Roth W. Decoy receptor 3 is a prognostic factor in renal cell cancer. Neoplasia 2008; 10(10): 1049–1056.
38. Thompson RH, Zang X, Lohse CM, Leibovich BC, Slovin SF, Reuter VE, Cheville JC, Blute ML, Russo P, Kwon ED, Allison JP. Serum-soluble B7x is elevated in renal cell carcinoma patients and is associated with advanced stage. Cancer Res 2008; 68(15): 6054–6058.
39. Chang CH, Wu HC, Yen RF, Kao A, Lin CC, Lee CC. Tissue polypeptide specific antigen (TPS) as a tumor marker in renal cell carcinoma. Anticancer Res 2002; 22(5): 2949–2950.
40. Sobotka R, Čapoun O, Hanuš T. Leptin as a biomarker in renal cell carcinoma. Poster presentation on Central European Meeting, Prague 2013.
41. http: //nomograms.mskcc.org/Renal/PostSurgery.aspx.
42. http: //www.nomogram.org/Kidney/rcc_launch.php
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2014 Issue 2-
All articles in this issue
- Intravezikální léčba nádorů močového měchýře
- Klasifikace intraepiteliálních neoplazií předcházejících dlaždicovému karcinomu penisu a jejich analogie s prekancerózami dlaždicových karcinomů vulvy
- Prediktivní parametry metastatického renálního karcinomu
- Role plicní metastazektomie v léčbě diseminovaného světlobuněčného renálního karcinomu
- Endoskopická extraperitoneální radikální prostatektomie a její komplikace – vlastní zkušenosti z prvních 300 operací
- Perkutánní operace nefrolitiázy v Galdakao-modifikované supinační poloze
- Aneuryzmatická cysta nadledviny
- „Burned-out“ tumor semenníka s metastázou do retroperitoneálnej lymfatickej uzliny
- Případ monstrózní benigní hyperplazie prostaty
- Asynchronní solitární metastáza světlobuněčného renálního karcinomu 7 let po nefrektomii projevující se Hornerovým syndromem
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intravezikální léčba nádorů močového měchýře
- Aneuryzmatická cysta nadledviny
- Klasifikace intraepiteliálních neoplazií předcházejících dlaždicovému karcinomu penisu a jejich analogie s prekancerózami dlaždicových karcinomů vulvy
- „Burned-out“ tumor semenníka s metastázou do retroperitoneálnej lymfatickej uzliny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

