-
Medical journals
- Career
Vplyv gastroezofágového refluxu na riasinky horných dýchacích ciest u pediatrických pacientov
Authors: Júlia Kvaššayová 1,2; P. Ďurdík 1,2; V. Kučeravá 1; Dáša Oppová 1,2; D. Šutvajová 1
Authors‘ workplace: Klinika detí a dorastu, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Univerzitná nemocnica Martin, Slovensko 1; Centrum experimentálnej a klinickej respirológie, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Univerzitná nemocnica Martin, Slovensko 2
Published in: Čes-slov Pediat 2021; 76 (6): 296-303.
Category: Original Papers
Overview
Úvod: Riasinky (cílie) sú komplexné bunkové organely nachádzajúce sa na povrchu väčšiny buniek v tele. V respiračnom systéme sú dôležitou zložkou mukociliárneho transportu, ktorý zabezpečuje očisťovanie dýchacích ciest. Gastroezofágový reflux (GER) je v detskom veku veľmi často spojený so vznikom typickej extraezofágovej symptomatológie (rinitídy, sinusitídy, kašeľ, zahlienenie a iné), ktorá je často prejavom porušenej očisťovacej schopnosti dýchacích ciest.
Cieľ práce: Hodnotenie kinematiky cílií respiračného epitelu horných dýchacích ciest u detských pacientov s gastroezofágovým refluxom.
Metodika: Prospektívna štúdia bola realizovaná na Klinike detí a dorastu JLF UK a UNM od roku 2017 do roku 2019. Zaradení boli pediatrickí pacienti vo veku od 4 do 18 rokov s pozitívnym gastroezofágovým refluxom a s extraezofágovou symptomatológiou. U všetkých pacientov bola zrealizovaná 24-hodinová multikanálová intraluminálna impedancia s pH-metriou. Vzorka sliznice respiračného epitelu horných dýchacích ciest bola odobratá z dolnej lastúry nosa pred zahájením liečby a po 6 mesiacoch farmakologickej liečby. Vzorka bola spracovaná a vyhodnotená vysokorýchlostnou videomikroskopiou. 24-hodinová multikanálová intraluminálna impedancia s pH-metriou bola vyhodnotená manuálne. Kontrolnú skupinu na porovnanie frekvencie ciliárnej kinematiky tvorili zdraví jedinci.
Výsledky: Zaradených bolo 40 pacientov s gastroezofágovou refluxnou chorobou (GERD). Prevalencia mužského pohlavia bola vyššia (55 %). Kinematika riasiniek u pacientov s GERD bola signifikantne nižšia než v kontrolnej skupine (4,43 Hz ± 2,2 Hz v.s. 6,86 Hz ± 0,96 Hz, p < 0,001). Po 6 mesiacoch medikamentóznej liečby refluxu došlo k signifikantnému vzostupu ciliárnej kinematiky (4,08 Hz ±1,7 Hz v.s. 5,39 Hz ± 0,69 Hz, n = 13).
Záver: Na základe našich doterajších výsledkov možno konštatovať, že u pacientov s GERD dochádza k zníženiu kinematiky cílií respiračného epitelu v porovnaní s kontrolnou skupinou. Naše výsledky ukazujú, že adekvátnou terapiou GERD môžno zlepšiť kinematiku riasiniek v oblasti horných dýchacích ciest.
Klíčová slova:
gastroezofágový reflux – sekundárne cíliopatie – kinematika riasiniek – multikanálová intraluminálna impedancia – pediatria – GERD – EER
ÚVOD
Cílie (riasinky) sú komplexné bunkové organely s vysoko organizovanou ultraštruktúrou a špecializovanou funkciou nachádzajúce sa na povrchu väčšiny buniek v tele. V dýchacom systéme tvoria dôležitú zložku mukociliárneho systému, ktorá zabezpečuje očisťovanie dýchacích ciest [1–4]. Poškodením ciliárnej kinematiky vznikajú optimálne podmienky na rast a rozmnožovanie mikroorganizmov a ich prenikanie k bunkám respiračného epitelu. Výsledkom sú recidívne infekcie horných i dolných dýchacích ciest, kašeľ, zahlienenie, zachrípnutie alebo opakované otitídy [5–8].
Etiológia klinických ťažkostí je rôznorodá. Jednou z príčin môže byť gastroezofágový reflux (GER) [8, 9, 10]. Vzťah medzi ochoreniami gastrointestinálneho a respiračného traktu bol opakovane popisovaný v mnohých publikáciách. Napriek tomu je v tejto problematike množstvo nejasností [8, 10–12, 15]. GER predstavuje spätný návrat žalúdočného obsahu do pažeráka. GER je považovaný za fyziologický jav, pokiaľ nespôsobuje klinické ťažkosti. V prípade vzniku klinickej symptomatológie hovoríme o refluxnej chorobe žalúdka a pažeráka (GERD), ktorá vyžaduje cielenú liečbu. Patologicky sa GERD prejavuje nielen typickými gastrointestinálnymi symptómami (zvracanie, pyróza, neprospievanie, bolesti brucha), ale aj mimopažerákovou symptomatológiou. Na jej vzniku sa podieľa najmä extraezofágový reflux (EER). EER predstavuje stav, kedy dochádza k prieniku refluxátu nad proximálny ezofágový zvierač, do laryngofaryngu a do otorinolaryngickej oblasti [12–15]. Sliznica dýchacích ciest na rozdiel od sliznice pažeráka nemá obranné mechanizmy pred poškodením žalúdočným obsahom. Pôsobením kyslého pH alebo pepsínu dochádza k jej poškodeniu, narušeniu obranných a ochranných reflexných, prípadne nereflexných mechanizmov dýchacích ciest. Najčastejšie sa tieto zmeny prejavujú kašľom, zahlienením, zatekaním hlienov do orofaryngu (post-nasal drip), typické sú i rekurentné rinitídy, sinusitídy, otitídy, stridor, zachrípnutie a iné [11, 13–16]. Pri EER sú typicky prítomné denné refluxy a refluxy vo vzpriamenej polohe [4, 12, 17].
Aj keď je problematika GERD a respiračného systému dostatočne známa a popísaná v mnohých publikáciách, ich diagnostika je obtiažna. V diagnostike gastroezofágového refluxu „zlatý štandard“ neexistuje, používa sa 24-hodinová pH-metria, multikanálová intraluminálna impedancia s pH-metriou (MII pH-metria), prípadne terapeutický test s inhibítormi protónovej pumpy. Za skríningové vyšetrenie sa považuje meranie koncentrácie pepsínu v tekutých vzorkách (sliny, spútum, ušný sekrét) [13, 18, 32]. V diagnostike cíliopatií sa využívajú skórovacie systémy, nazálne meranie oxidu dusnatého, vysokorýchlostná videomikroskopia, elektrónová mikroskopia, imunoflourescenčná mikroskopia a genetické vyšetrenie [4, 8, 9, 18, 37]. Našou hypotézou je, že pri GERD dochádza vplyvom látok v žalúdočnom obsahu k štrukturálnym a funkčným zmenám riasiniek so zmenou kinematiky riasiniek, pričom pri vhodne zvolenej terapii GERD by tieto zmeny mali byť reverzibilné.
MATERIÁL A METODIKA
Táto prospektívna štúdia bola realizovaná od marca 2017 do júna 2019 na Klinike detí a dorastu Jesseniovej lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice v Martine.
Pre zaradenie do štúdie museli pacienti spĺňať zaraďovacie kritériá (tab. 1). Pacienti podstúpili odber sliznice z horných dýchacích ciest brushingovou metódou. Následne im bola zavedená sonda na vyšetrenie 24-hodinovej multikanálovej intraluminálnej impedancie (MII) s jednokanálovou pH-metriou. V prípade, že sa u jedinca vyšetreniami nepotvrdil GERD/ /EER, pacient bol zo štúdie vyradený. Pacienti v štúdii boli rozdelení na dve skupiny: prvú skupinu tvorili deti s potvrdeným GERD (n = 34). Druhou skupinou boli pacienti, ktorí splnili kritériá pre EER (n = 27).
Table 1. Kritériá pre zaradenie pacienta do štúdie. 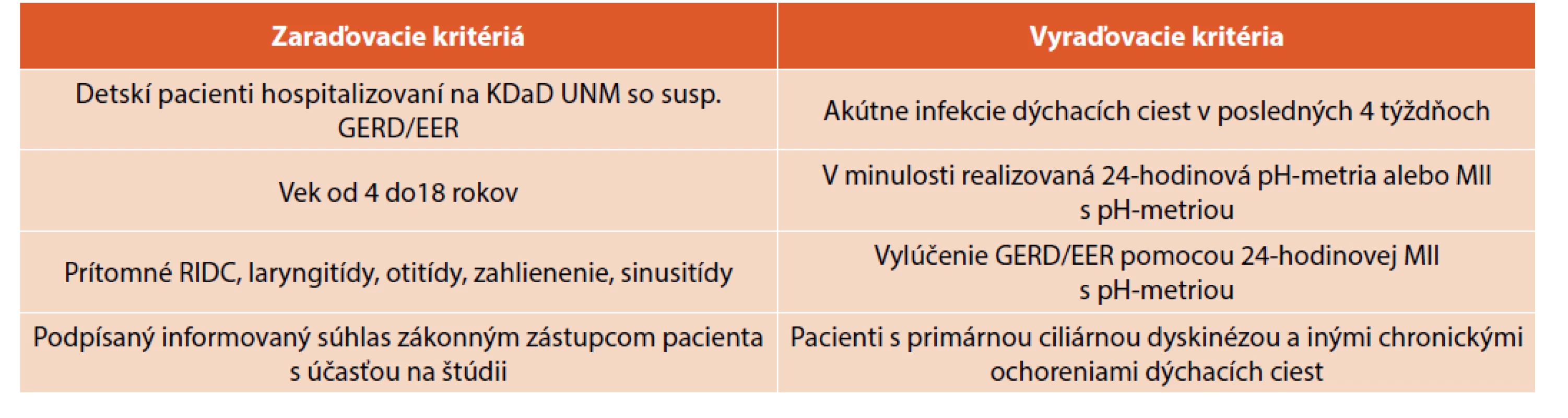
Pacienti v kontrolnej skupine rovnakej vekovej kategórie boli bez potvrdenej alergickej anamnézy, bez známok akútnej respiračnej infekcie v posledných 4 týždňoch, bez známeho chronického respiračného ochorenia, bez zvýšenej chorobnosti, nevykazovali klinické známky GERD/EER a zákonní zástupcovia podpísali informovaný súhlas. MII s pH-metriou nebola realizovaná v kontrolnej skupine z etických dôvodov.
Klinická štúdia bola schválená Etickou komisiou Jesseniovej lekárskej fakulty Univerzity Komenského.
Vyšetrenie kinematiky cílií respiračného epitelu
Vyskorýchlostná videomikroskopia (High Speed Video Microscopy – HSVM) predstavuje moderné diagnostické vyšetrenie ciliárneho pohybu. Rutinne je používaná vo viacerých diagnostických centrách pre cíliopatie v Európe [9, 18]. Základom vyšetrenia je správny odber sliznice dýchacích ciest. V našej štúdii bola každému vyšetrovanému jedincovi vzorka ciliárneho epitelu odoberaná z horných dýchacích ciest, konkrétne z dolnej lastúry nosa (concha nasalis inferior). Odber riasiniek bol realizovaný na Klinike detí a dorastu v Univerzitnej nemocnici v Martine. Cílie sme odoberali cytologickou kefkou, jednorázovou, sterilnou, ktorá bola pred sterom namočená do izotonického roztoku. Vyšetrenie prebiehalo za štandardnej teploty, bez nutnosti celkovej alebo lokálnej anestézy. Odber riasiniek bol vykonávaný minimálne 4 týždne od akútneho infektu [4, 19]. Vzorka sliznice respiračného epitelu bola následne vložená do skúmavky s 3 ml transportného média (RPMI 1 640). Z každej vzorky boli vytvorené tri samostatné preparáty. Cílie boli pozorované bezprostredne po odbere pomocou svetelného mikroskopu Zeis Axio Scope.A.1. (Zeiss Microscopy, Carl Zeiss, Nemecko), pričom bol vysokofrekvenčnou kamerou xiQ MQ003CG - CM (Ximea, Nemecko) zaznamenávaný ciliárny pohyb a nahrávané krátke videosekvencie (3 až 4 sekundy). Z každého preparátu bolo nahratých 10 videí s dostatočným množstvom buniek respiračného epitelu. Vysokorýchlostná videokamera bola napojená na počítač vybavený špeciálnym softvérom (Ciliary analysis, Slovensko) na hodnotenie ciliárneho pohybu a frekvencie kmitania riasiniek [36]. Manuálne sme v každom preparáte označovali všetky pohyblivé cílie a následne softvér vyhodnocoval frekvencie pohybu riasiniek. Výsledky boli interpretované ako priemerná frekvencia kinematiky cílií.
24-hodinová multikanálová intraluminálna impedancia s pH-metriou
Na vyšetrenie prítomnosti gastroezofágového a extraezofágového refluxu sme použili 24-hodinovú MII s jednokanálovou pH-metriou.
Jednotliví pacienti prichádzali na vyšetrenie minimálne po 8-hodinovom lačnení. Pacientovi bola určená vhodná veľkosť sondy (VersaFlex ZNIS+7R2.0, VersaFlex ZNIS+7R+1.5, VersaFlex ZNIS+8R) podľa jeho hmotnosti a výšky. Pred samotným zavedením boli sondy kalibrované v kalibračných roztokoch podľa odporúčania výrobcu. Takto pripravené sondy boli následne zavádzané pacientovi cez nosový otvor do pažeráka. Každá sonda obsahovala 6 impedančných kanálov a jeden pH-metrický senzor, ktorý bol umiestňovaný 3–5 cm nad dolným ezofágovým zvieračom. Poloha sondy bola pravidelne overovaná hodnotami pH na displeji pH-metra. Prítomnosť refluxov sme zaznamenali pomocou pH-metra Digitrapper® pH-Z (Medtronic, USA).
Každý záznam z pH-metra bol hodnotený manuálne pomocou AccuViewTM 5 Analysis Software. Hodnotili sme samostatne pH-metriu a multikanálovú intraluminálnu impedanciu (MII). Zaznamenávali sme:
1. počet refluxov celkovo, v stoji, v leže, refluxy vyskytujúce sa počas dňa a noci,
2. pH refluxov (kyslé pH < 4, slabokyslé pH 4–7, zásadité pH > 7),
3. charakter refluxov (tekuté, zmiešané, plynné),
4. reflux index (RI),
5. De Meester skóre,
6. počet refluxov zasahujúcich až do proximálnych pažerákových etáží.
Pre detský vek neexistujú normálne hodnoty pre MII a pH-metriu [20]. Pri spracovaní našich výsledkov MII s pH-metriou sme sa riadili normami a doporučenými postupmi z iných štúdii realizovaných u nás i v zahraničí [10, 21–23]. Za patologickú hodnotu pre GERD z pH-metrického kanála sme považovali viac ako 46 všetkých kyslých refluxov a reflux index viac ako 3, De Meester skóre > 14,72. Na MII sme považovali výsledok za GERD pozitívny v prípade, keď u pacienta bolo prítomných viac než 50 kyslých refluxov, 25 slabo kyslých a jeden zásaditý reflux. O pozitívnom EER sme hovorili v prípade, keď bolo proximálnym impedančným kanálom zachytených viac ako 10 refluxov, viac ako 50 % z celkového počtu refluxov boli refluxy plynné, prípadne viac než 50 % zo všetkých zachytených refluxov dosahovalo až do hornej oblasti ezofágu.
Štatistické vyhodnotenie výsledkov
Výsledky našej práce boli spracované pomocou programu Microsoft Office Excel 2019 a SYSTAT verzia 11. Kvantitatívne hodnoty sú prezentované ako priemer a smerodajná odchýlka. Na porovnanie štatistickej významnosti kvantitatívnych znakov sme použili Studentov t-test. Hodnoty p < 0,005 ukazujú štatisticky významný rozdiel medzi porovnávanými znakmi.
VÝSLEDKY
Do našej štúdie bolo zaradených 79 pacientov vo veku 4–18 rokov, z toho vstupné kritériá splnilo 40 jedincov (18 dievčat – 45 %, 22 chlapcov – 55 %), medián veku pacientov bol 7 rokov, priemerný vek 8,67 roka. Kontrolnú skupinu tvorilo 30 detí vo veku od 4–18 rokov (18 chlapcov – 60 %, 12 dievčat – 40 %), medián veku 9 rokov, priemer 9,3 roka. U detí s GERD bola priemerná frekvencia kmitania riasiniek (CBF) respiračného epitelu signfikantne nižšia než u detských pacientov v kontrolnej skupine (4,43 Hz ± 2,2 Hz, v.s. 6,86 Hz ± 0,96 Hz, p < 0,001) (graf 1). Nezaznamenali sme signifikantné rozdiely kinematiky riasiniek medzi chlapcami a dievčatami v skupine GERD (4, 58 Hz ± 2, 34 Hz, v.s. 4,22 Hz ± 1,86 Hz, p > 0,05).
Graph 1. Porovnanie frekvencie kinematiky riasiniek (CBF) u pacientov s GERD a kontrolnej skupiny. 
Pacienti boli podľa výsledku MIIs pH-metriou rozdelení na GERD pozitívnych a EER pozitívnych. V skupine s GERD (n = 34) bola CBF 4,65 ± 2,05 Hz a v skupine tvorenej jedincami s EER bola CBF 3,85 ± 1,95 Hz. Medzi skupinami nebol zaznamenaný signifikantný rozdiel v ciliárnej kinematike (p > 0,05) (graf 2).
Graph 2. Porovnávanie CBF u pacientov s GER a EER. V prípade GER refluxát zasahuje len do pažerákových etáží. U EER dosahuje refluxát až nad horný ezofágový zvierač. 
V práci bol sledovaný aj vplyv cielenej terapie GERD na ciliárnu kinematiku. U pacientov bolo indikované prísne dodržiavanie režimových a diétnych opatrení a farmakoterapia refluxu inhibítormi protónovej pumpy alebo alginátom. Trinásť pacientov podstúpilo vyšetrenie kinematiky riasiniek po 6 mesiacoch na liečbe. Na liečbe a režimových opatreniach došlo u detí k signifikantnému zlepšeniu kinematiky riasiniek v porovnaní s výsledkami pred terapiou (4,08 Hz ± 1,7 Hz v.s. 5,39 Hz ± 0,69 Hz, p < 0,001) (graf 3).
Graph 3. Vplyv terapie GERD na CBF. CBF pred podávaním terapie bola signifikantne nižšia než CBF po 6 mesiacoch liečby GERD. 
DISKUSIA
Cíliopatie predstavujú heterogénnu skupinu ochorení, ktoré vznikajú vrodenou alebo získanou poruchou riasiniek [1, 2, 4, 24]. V klinickej praxi sa stretávame častejšie so sekundárnymi (získanými) cíliopatiami, ktoré sú pri adekvátnej liečbe ich etiológie reverzibilné [2, 4, 17].
V našej štúdii sme sa na Klinike detí a dorastu UNM zaoberali zmenou kinematiky riasiniek respiračného epitelu u detských pacientov s refluxom. V prípade, že sa refluxát dostáva nad horný ezofágový zvierač až do nasofaryngeálnej a laryngeálnej oblasti, prichádza do kontaktu so sliznicou dýchacích ciest. Agresívny refluxát môže spôsobiť poškodenie cílií respiračného epitelu, ktoré predstavujú významnú zložku MCT [28].
V našej práci sme preukázali, že pôsobenie refluxátu na sliznicu dýchacích ciest vedie k signifikantnému zníženiu frekvencie kinematiky cílií respiračného epitelu oproti jedincom z kontrolej skupiny a tým k zníženiu mukociliárneho transportu. Issing s kolektívom autorov popisujú vo svojej štúdii 250 pacientov s GERD, u ktorých sa ako prvý príznak v 75 % prípadov preukázal post-nasal drip, ktorý pravdepodobne vzniká deštrukciou buniek respiračného epitelu a spôsobí poruchu MCT [29]. Poruchy MCT spôsobené refluxátom sú dlhodobo známe, ale len málo preskúmané.
Delhaye uverejnil prácu, kde sa u 50 pacientov s GERD a chronickou rinosinusitídou zaoberali ich mukociliárnym transportom. Účastníci štúdie absolvovali sacharínový test s nasledovnými výsledkami. U pacientov s preukázaným GERD došlo k významnému predĺženiu sacharínového testu v porovnaní s kontrolnou skupinou, u ktorej boli výsledky v norme (23,8 ± 5,6 v.s. 8,15 ± 2). Táto štúdia podporila predpoklad možnej korelácie medzi porušením mukociliárneho transportu a GERD [30].
Rovnako i štúdia od Pooja, ktorá bola publikovaná v roku 2020, popisuje vplyv EER na MCT. Na vzorke 45 pacientov s EER bol realizovaný sacharínový test. Trvanie viac ako 20 minút bolo považované za predĺžený čas MCT. V tejto práci popisujú prolongáciu MCT nad 20 minút u 28 jedincov, t.j. 62 % [28]. V týchto štúdiách potvrdili, že vplyvom GERD/EER dochádza k zníženiu mukociliárneho transportu v porovnaní s jedincami z kontrolnej skupiny. Výsledky týchto štúdii korelujú s výsledkami našej práce. Je nutné podotknúť, že vo vyššie uvedených štúdiách sa autori nezaoberali meraním frekvencie kinematiky cílií respiračného epitelu. Štúdiu, kde by autori porovnávali CBF u pacientov s GERD/EER a kontrolnou skupinou sme zatiaľ z dostupných zdrojov nenašli, naše výsledky CBF u pacientov s GERD/EER nemáme s čím porovnať.
V pediatrickej populácii sa môže GERD prejavovať typickými (gastroezofágovými) symptómami, ako je napríklad pyróza, bolesti brucha, zvracanie. Pri EER sa vyskytujú takzvané atypické (extraezofágové) symptómy ako chrapot, kašeľ, zahlienenie, rekurentné infekcie dýchacích ciest, laryngitídy, sinusitídy, otitídy a iné [10, 13, 14, 17] (tab. 2). V experimentálnych štúdiách je preukázané, že poškodenie sliznice laryngu dokážu spôsobiť už tri refluxné epizódy, zatiaľ čo 50 refluxných epizód v pažerákovej sliznici je považovaných ešte za normu [26].
Table 2. Rozdelenie klinických prejavov GERD na typické (gastroezofágové) a atypické (extraezofágové) [13, 14, 21]. ![Rozdelenie klinických prejavov GERD na typické (gastroezofágové) a atypické (extraezofágové) [13, 14, 21].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/76b709a369764e3093d2b6e2226a36bf.png)
Sliznica dýchacích ciest je náchylnejšia na poškodenie refluxátom než sliznica v oblasti pažeráku. Klinická symptomatológia závisí aj od individuálnej citlivosti jedinca. Dľa viacerých štúdií je typická symptomatológia GERD spôsobená kyslými refluxami, ktorých pH je nižšie než 4. Extraezofágovú symptomatológiu spôsobujú slabo kyslé, zásadité a plynné refluxy, ktoré sa vyskytujú prevažne počas dňa a vo vzpriamenej polohe. Vzhľadom k tejto skutočnosti je vhodnejšie u pacientov s atypickou symptomatológiou k diagnostike GERD/EER použiť MII s pH-metriou [10, 22, 23, 27, 28]. Pacienti v našej štúdii, ktorí nespĺňali hodnotiace kritéria pre EER, ale mali pozitívny GERD, mali CBF signifikantne nižšiu v porovnaní so zdravou kontrolnou skupinou. Medzi skupinami pacientov s GERD a EER sme signifikantný rozdiel v znížení CBF nepreukázali. Tento záver prispieva k predpokladu, že existuje individuálna citlivosť jedincov na množstvo refluxátu zasahujúceho do proximálnych oblastí pažeráku, ktorý poškodzuje sliznicu respiračného systému.
Brndiarová s kolektívom autorov popisuje, že u detských pacientov s recidivujúcimi otorinolaryngologickými ochoreniami je vysoká prevalencia výskytu EER a GERD. Prítomný bol i vyšší podiel refluxov vo vzpriamenej polohe a počas dňa. Podľa ich výsledkov sa mužské pohlavie ukazuje ako rizikový faktor [10].
Podstatnú úlohu pri vzniku EER symptomatológie má enzým pepsín, ktorý je v refluxáte prítomný. Je považovaný za dôležitý patologický faktor spôsobujúci poškodenie sliznice horných dýchacích ciest i stredoušia. Pepsín vykazuje najvyššiu aktivitu v kyslom prostredí, ale aktivitu si zachováva i v prostredí slabokyslých refluxov [26, 32]. Formánek spolu s autormi určili hraničnú hodnotu 6 epizód EER pri prítomnosti pepsínu v laryngeálnej sliznici [33]. Li s kolektívom autorov vo svojej štúdii potvrdili vyššiu koncentráciu pepsínu v slinách u pacientov s GERD (n = 45) než u pacientov bez GERD a zdravých jedincov, výška koncentrácie korelovala so závažnosťou slizničného poškodenia [34]. Štúdia českých autorov sledovala prítomnosť pepsínu v oblasti stredoušia u pediatrických pacientov s chronickou sekretorickou otitídou, kde potvrdili prítomnosť pepsínu v stredouší (nepriamy znak EER) u 1/3 pacientov [35].
Pri vzniku extraezofágovej symptomatológie je popisovaný vplyv aerosolových refluxov [26]. Galos spoločne s kolegami opisuje vo svojej práci prípad 3-ročného dieťaťa s epizódami dyspnoe, periorálnou cyanózou, agitáciou a prítomnou hypotoniou. Výsledok vyšetrenia MII s pH-metriou preukázal enormné množstvo plynných refluxov (100 refluxov za 24 hodín), zatiaľ čo zvyšné parametre boli v rámci normy. Autori svojou prácou poukazujú na skutočnosť, že typ refluxu, hlavne prítomnosť plynných refluxov, môže zohrávať dôležitú úlohu v patogenéze symptómov [25]. Koncentrácia pepsínu v plynných refluxoch je nižšia než v refluxoch tekutých, plynné refluxy sa ale jednoduchšie šíria a dosahujú do vzdialenejších oblastí. Aj toto je jedna z teórií, akým spôsobom sa dostáva pepsín do oblastí stredoušia, paranasálnych dutín alebo do pľúc [38]. Domnievame sa, že pepsín svojou proteolytickou aktivitou môže poškodiť cílie v oblasti horných dýchacích ciest. Sliznica v extraezofágovej oblasti je oveľa citlivejšia k pôsobeniu agresívneho refluxátu v porovnaní s pažerákovou sliznicou. Pre absenciu obranných mechanizmov stačí ku vzniku slizničného poškodenia len niekoľko epizód EER. Javí sa, že aj tento mechanizmus môže viesť ku vzniku extraezofágovej symptomatológie. V našej štúdii sme nevyšetrovali pôsobenie pepsínu na cílie buniek respiračného epitelu, ani sme podobnú štúdiu nenašli.
Bothwell spolu s kolektívom autorov zverejnili štúdiu, kde reprezentujú súbor 28 detí s chronickou rinosinusitídou, ktorých potreba chirurgickej intervencie výrazne klesla po adekvátnej antirefluxnej liečbe [31]. Výsledky našej práce korelujú i s predchádzajúcou štúdiou. Na malej vzorke pacientov, ktorí boli na medikamentóznej terapii, dodržiavali diétne a režimové opatrenia, došlo po 6 mesiacoch užívania liečby k signifikantnému zlepšeniu ciliárnej kinematiky. Adekvátna a cielená terapia GERD a striktné dodržiavanie režimových opatrení vedie k signifikantnému zlepšeniu ciliárnej kinematiky a obnove mukociliárneho transportu. V našej práci sme jedincov nerozdeľovali do skupín podľa charakteru medikamentóznej terapie, nakoľko by sa jednalo o veľmi malý súbor pacientov.
Etiológia sekundárnych cíliopatií je rozmanitá a v našej štúdii nebolo možné vylúčiť všetky príčiny. Pred samotným odberom riasiniek sme u pacientov nerealizovali výter z nosa (mohlo by dochádzať k poškodeniu cílií odberovým tampónom), a tak nedokážeme vylúčiť možnosť bakteriálnej kontaminácie, ktorá by mohla znížiť CBF. Rovnako pacientom neboli vylúčené adenoidné vegetácie, ktoré podľa práce Marušiakovej a kol. [5] môžu spôsobovať signifikantné zníženie ciliárnej kinematiky a tým porušenie MCT. Za ďalšiu limitáciu štúdie považujeme menší súbor pacientov.
ZÁVER
Z našej štúdie vyplýva, že u pacientov s potvrdeným GERD alebo EER dochádza k zníženiu pohyblivosti riasiniek v porovnaní so zdravými jedincami. Výsledky našej práce preukazujú, že sliznica respiračného epitelu je citlivá na agresívny refluxát dosahujúci až do horných etáží pažeráka a dýchacích ciest. Refluxát môže spôsobovať ciliárnu deštrukciu a tým viesť k porušeniu mukociliárneho transportu a vzniku respiračných ťažkostí. Klinická symptomatológia závisí na individuálnej citlivosti sliznice respiračného systému a miere poškodenia mukociliárneho transportu. Pacienti, u ktorých sa nepotvrdil EER podľa hodnotiacich kritérií, ale mali pozitívny GERD, mali CBF signifikantne nižšiu v porovnaní so zdravou kontrolnou skupinou. Z výsledku možno prepodkladať, že existuje individuálna citlivosť jedincov na množstvo refluxátu zasahujúceho do proximálnych oblastí pažeráku a následné poškodenie sliznice respiračného systému. Gastroezofágový reflux je v pediatrickej populácii častou príčinou aerodigestívnej dysfunkcie. Najdôležitejšie je na toto ochorenie myslieť, zvoliť správne diagnostické možnosti a v závislosti od výsledkov vyšetrení i vhodnú liečbu. Adekvátna a cielená terapia GERD a striktné dodržiavanie režimových opatrení vedie k signifikantnému zlepšeniu ciliárnej kinematiky a obnove mukociliárneho transportu.
V danej problematike je ale ešte mnoho nejasností a do budúcna je potrebné zrealizovať štúdie s väčším množstvom pacientov. V budúcnosti by sa mohlo vyšetrenie ciliárnej kinematiky používať ako skríningový nástroj v diagnostike EER, ktorá je veľmi obtiažna.
Došlo: 9. 2. 2021
Přijato: 23. 3. 2021
Korespondující autorka:
Ing. Dominika Šutvajová
Klinika detí a dorastu JLF UK
a Univerzitnej nemocnice Martin
Kollárova 2
036 01 Martin Slovenská republika
e-mail: dsutvajova@gmail.com
Sources
1. Bergmann C. Educational paper: ciliopathies. Eur J Pediatr 2012; 171 (9): 1285–1300.
2. Waters AM, Beales PL. Ciliopathies: an expanding disease spectrum. Pediatr Nephrol 2011; 26 (7): 386–402.
3. Marušiaková L, Ďurdík P, Jošková M, et al. Cíliopatie v detskom veku, Pediatria (Bratisl) 2015; 10 (4): 199–205.
4. Ďurdík P, Bánovčin P. Primary ciliary dyskinesia – current therapeutic approach. In: Jeseňák M. Advances in Respiratory Therapy Research. New York: Nova Science Publishers Ic 2015; 157–176. ISBN: 978-1-63463-004-7.
5. Marusiakova L, Durdik P, Jesenak M, et al. Ciliary beat frequency in children with adenoid hypertrophy. Pediatr Pulmonol 2020; 55 : 666–673. https://doi.org/10.1002/ppul.24622.
6. Behan L, Dimitrov BD, Kuehni CE, et al. PICADAR: a diagnostic predictive tool for primary ciliary dyskinesia. Eur Respir J 2016; 47 : 1103–1112. https://doi.org/10.1183/13993003.01551 - 2015.
7. Marušiaková L, Ďurdík P, Bacmaňáková I, et al. Čo sa môže skrývať za diagnózou atypickej cystickej fibrózy? Čes-slov Pediat 2016; 71 (2): 80–86.
8. Kasajová J, Ďurdík P, Kapustová L, et al. Gastroezofágový reflux u detských pacientov ako príčina sekundárnych cíliopatií. Pediatria (Bratisl) 2017; 12 (5): 248–250.
9. Ďurdík P, Marušiaková L, Šujanská A, et al. Diagnostika primárnej ciliárnej dyskinézy na Slovensku. Pediatria (Bratisl) 2015; 10 (6): 293–297.
10. Brndiarová M, Mikler J, Bánovčin P, et al. Extraezofágový reflux – otolaryngologické komplikácie gastroezofágového refluxu. Čes-slov Pediat 2011; 66 (2): 85–91.
11. Fraser-Kirk K. Laryngopharyngeal reflux: A confounding cause of aerodigestive dysfunction. Aust Fam Physician 2017; 1–2 : 34–39.
12. Galván AP, Hart SP, Morice AH. Relationship between gastro-oesophageal reflux and airway diseases: The airway reflux paradigm. Arch Bronchopneumol 2011; 47 (4): 195–203.
13. Oleárová A. Gagastroezofageálny reflux u detí. Prakt Lékárn 2015; 5 (1): 6–10.
14. Zelník K, Komínek P, Chlumský J. Extraezofageální reflux. Príručka pro praxi. 1. vyd. Praha: Merck spol s.r.o., 2013 : 2–7.
15. Ďuríček M, Bánovčin P Jr, Haličková T, et al. Acidic pharyngeal reflux does not correlate with symptoms and laryngeal injury attributed to laryngopharyngeal reflux. Dig Dis Sci 2019; 64 : 1270–1280. https://doi.org/10.1007/s10620-018-5372-1.
16. Ďuríček M, Nosaková L, Zaťko T, et al. Cough reflex sensitivity does not correlate with the esophageal sensitivity to acid in patients with gastroesophageal reflux disease. Respir Physiol Neurobiol 2018; 257 : 25–29. https://doi.org/10.1016/j. resp.2018.03.011.
17. Bertrand B, Collet S, Eloy P, et al. Secodary ciliary dyskinesia in upper respiratory tract. Acta Otorhinolaryngol Belg 2000; 53 (3): 309–316.
18. Hassel E. Decisions in diagnosing and managing chronic gastroesophrageal reflux disease in children. J Pediatr 2005; 146 : 3–12.
19. Barbato A, Fischer T, Kuehni CE, et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. Eur Respir J 2009; 34 (6): 1264–1276.
20. Amirav I, Mussaffi H, Roth Y, et al. A reach-out system for video microscopy analysis of ciliary motions aiding PCD diagnosis. BMC Res Notes 2015; 71 (8).
21. Mousa H, Machado R, Orsi M, et al. Combined multichannel intraluminal impedance - pH(MII-pH): multicenter report of normal values from 117 children. Curr Gastroenterol Rep 2014; 16 (8): 400.
22. Gunasagaran HL, Varjavandi V, Lemberg DA, et al. The utility of multichannel intraluminal impedance-pH testing in tailoring the managment of paediatric gastrooesophageal reflux disease. Acta Paediatr 2020; 109 (12): 2799–2807.
23. Safe M, Cho J, Krishnan U. Combined multichannel intraluminal impedance and pH measurement in detecting gastroesophageal reflux disease in children. JPGN 2016; 63 (5): 98–106.
24. Brndiarová M, Antonyová M, Dedinská I, et al. Nephronophthisis type I, left ventricular non-compaction cardiomyopathy and reduced cilia motility – atypical manifestations of one disease. J Nephrol 2020; 33 (1): 183–186.
25. Galos F, Boboc C, Balgradean M, et al. Gas reflux in children with normal acid exposure of the oesophagus. Maedica (Bucur) 2016; 11 (4): 345–348.
26. Brandtl P, Lukáš K, Turzíková J, et al. Extraezofageální refluxní choroba – mezioborový konsenzus. Čas Lék čes 2011; 150 : 513–518.
27. Mattioli G, Pini-Prato A, Gentilino V, et al. Esophageal impedance/ pH monitoring in pediatric patients: preliminary experience with 50 cases. Dig Dis Sci 2006; 51 : 2341–2347.
28. Vasu PK, Gopalankutty NV, Somayaji G. Does laryngopharyngeal reflux disease impair nasal mucociliary transport? A case control prospective study. Int J Otorhinolaryngol Head Neck Surg 2020; 6 (4): 1–5.
29. Issing WJ, Karkos PD. Atypical manifestation of gastro-oesophageal reflux. J R Soc Med 2003; 96 : 477–480.
30. Delhay E, Dore MP, Bozzo C, et al. Correlation between nasal mucociliary clearance time and gastroesophageal reflux disease: our experience on 50 patients. Auris Nasus Larynx 2009; 33 (2): 157–161.
31. Bothwell MR, Parsons DS, Talbot A, et al. Outcome of reflux therapy on pediatric chronic sinusitis. Otolaryngol Head Neck Surg 1999; 121 : 255–262.
32. Hayat JO, Gabieta-Somnez S, Yazaki E, et al. Pepsin in saliva for the diagnosis of gastro-oesophageal reflux disease. Gut 2015; 64 : 373-380. doi: 10.1136/gutjnl-2014-307049373.
33. Formánek M, Jančatová D, Komínek P, et al. Comparison of impedance an pepsin detection in the laryngeal mucosa to determine impedance values that indicate pathological laryngopharyngeal reflux. Clin Transl Gastroenterol 2017; 8 (123). doi: 10.1038/ctg2017.49.
34. Li Y, Sifrim D, Xie Ch, et al. Relationship between salivary pepsín concentration and esophageal mucosal integrity in patients with gastroesophageal reflux disease. J Neurogastroenterol Motil 2017; 23 (4): 517–525.
35. Syrovátka J, Komínek P, Matoušek P, et al. Diagnostika extraezofageálního refluxu u detí se sekretorickou otitídou. Otorinolaryngol Foniatr 2014; 63 (4): 68–74.
36. Koniar D, Hargaš L, Štofan S. Segmentation of motion regions for biomechanical systems. Procedia Engineering 2012; 48 : 304–311.
37. Lucas JS, Barbato A, Collins SA, et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. Eur Respir J 2017; 49 : 1–25. 1601090 [https://doi.org/10.1183/ 13993003.01090-2016].
38. Zeleník K, Schwarz P, Urban O, et al. Extraezofageální reflux up to-date. Čes a Slov Gastroent a Hepatol 2010; 64 (6): 10–14.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics
2021 Issue 6-
All articles in this issue
- Vplyv gastroezofágového refluxu na riasinky horných dýchacích ciest u pediatrických pacientov
- Systémový lupus erythematodes s hematologickými projevy – nemoc mnoha tváří: kazuistiky a shrnutí pro praxi
- BRDLÍKOVA CENA
- Narkolepsia v detskom veku – naše skúsenosti
- Nie každý hemangióm je hemangióm...
- Sideropenická anémie u dětských pacientů s vrozenými srdečními vadami
- Edwardsův syndrom – fenotyp, prognóza, etické postoje, odborná a paliativní péče
- Jak komunikovat s pacienty a jejich rodiči na dálku a mít vše efektivně hrazeno?
- Specifika péče o tracheostomované dětské pacienty – stále živé téma
- List redakcii
- Mavena B12 přináší nové možnosti v léčbě chronických zánětů kůže
- Německá pediatrie v Praze – profesor Dr. med. Berthold EPSTEIN (1890–1962) (přednosta německé univerzitní kliniky v Praze na Karlově v letech 1932–1939 a po válce primář Dětského oddělení Nemocnice Bulovka v Praze)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Edwardsův syndrom – fenotyp, prognóza, etické postoje, odborná a paliativní péče
- Nie každý hemangióm je hemangióm...
- Systémový lupus erythematodes s hematologickými projevy – nemoc mnoha tváří: kazuistiky a shrnutí pro praxi
- Specifika péče o tracheostomované dětské pacienty – stále živé téma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

