-
Medical journals
- Career
Nie každý hemangióm je hemangióm...
Authors: T. Kráľová 1; M. Murgašová 1,2; M. Pršo 1; M. Igaz 1; F. Olekšák 1; Peter Bánovčin 1
Authors‘ workplace: Klinika detí a dorastu, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Univerzitná nemocnica Martin, Slovensko 1; Ambulancia pediatrickej hematológie a onkológie, Univerzitná nemocnica Martin, Slovensko 2
Published in: Čes-slov Pediat 2021; 76 (6): 320-329.
Category: Case Report
Overview
Hemangiómy sú benígne vaskulárne tumory a patria k najčastejším nádorovým ochoreniam u detí. V klinickej praxi sa pomerne často hemangiómy zamieňajú s inými kožnými léziami (napr. mongolská škvrna) či vaskulárnymi malformáciami (napr. naevus flammeus, naevus teleangiectaticus). V niektorých prípadoch sa však môže pod nepatrným kožným nálezom pripomínajúcim hemangióm skrývať vážne ochorenie, ktoré si vyžaduje úplne inú liečbu. Preto je dôležité poznať základné morfologické črty a špecifické biologické správanie hemangiómov, aby sme ich vedeli odlíšiť od iných lézií na koži a následne zvoliť vhodnú liečbu pre pacienta.
Prinášame kazuistiky troch pacientov, ktorí boli odoslaní na naše pracovisko s diagnózou hemangióm, no po dôkladnom vyšetrení a multiodborovej spolupráci sme diagnostikovali tri rôzne závažné ochorenia (multisystémovú histiocytózu z Langerhansových buniek, extranodálny non-Hodgkinov lymfóm z B buniek a rozsiahlu arteriovenóznu malformáciu).
Klíčová slova:
liečba – hemangiom – detský vek – cievne malformácie – diferenciálna diagnostika
ÚVOD
Hemangiómy sú nezhubné nádory vaskulárneho pôvodu. Predstavujú najčastejšiu skupinu nádorových ochorení v detskom veku. Postihujú častejšie dievčatá ako chlapcov. Vo väčšine prípadov predstavujú pre pacientov len kozmetický problém, avšak v niektorých prípadoch najmä pri nepriaznivej lokalizácii či veľkosti môžu viesť k závažným zdravotným komplikáciám, pokiaľ nezahájime adekvátnu liečbu (obr. 1). Niekedy si liečba hemangiómov vyžaduje multidisciplinárny prístup [1–3].
Image 1. Segmentálny hemangióm postihujúci takmer celú dolnú končatinu (zdroj: archív autorov).
Fig. 1. Segmental hemangioma affecting almost the entire lower limb (source: authors’ archive).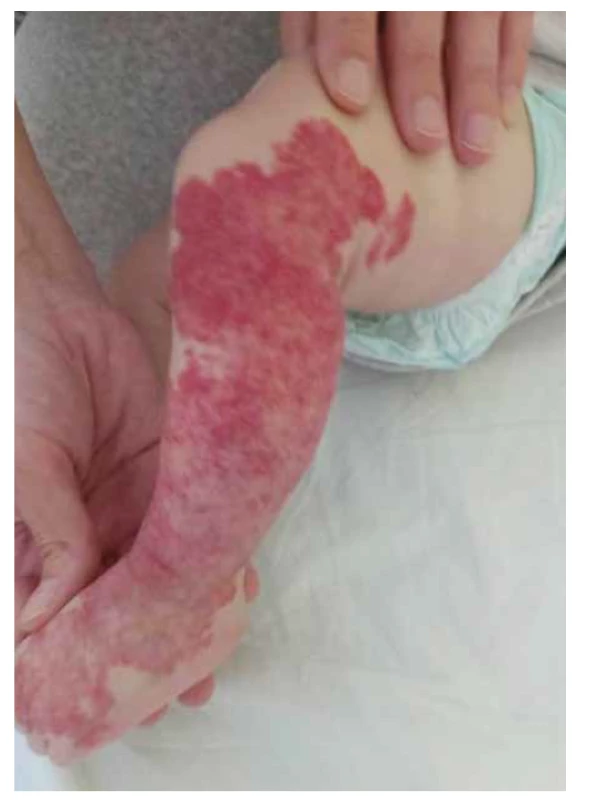
Veľakrát sa názvom hemangióm označujú aj iné cievne lézie, ktoré na pohľad vyzerajú ako hemangióm, ale v skutočnosti majú úplne iné biologické správanie. Nesprávne diagnostikovanie môže viesť k nesprávnemu manažmentu a nevhodne zvolenej liečbe pre pacienta [3, 4].
Mulliken a Glowacki ako prví v roku 1982 vytvorili klasifikačnú schému pre vaskulárne lézie na základe ich bunkových charakteristík (zmeny na endoteliálnych bunkách) a klinických prejavov. Cievne lézie rozdelili do dvoch skupín na skupinu cievnych tumorov (hemangiómy) a skupinu cievnych malformácií [5]. Na základe tejto klasifikácie neskôr vznikla oficiálna klasifikačná schéma, ktorú vypracovala Medzinárodná spoločnosť pre štúdium vaskulárnych anomálií (International Society for the study of Vascular Anomalies, ISSVA). Súčasná klasifikácia z roku 2018 rozdeľuje cievne anomálie na základe ich biologickej povahy a získaných genetických poznatkov o cievnych tumoroch a malformáciách (tab. 1). Hemangiómy aj cievne malformácie sa môžu vyskytovať solitárne, ale v zriedkavých prípadoch aj ako súčasť rôznych syndrómov (napr. LUMBAR syndróm, PHACE syndróm, Rendu-Osler-Weberov syndróm a mnohé ďalšie) [2, 6].
Table 1. ISSVA klasifikácia vaskulárnych anomálií z roku 2018 [6]. ![ISSVA klasifikácia vaskulárnych anomálií z roku 2018 [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/8c510af95c254cff7dc1405569b5e79c.png)
Vysvetlivky skratiek:
AV malformácia – arteriovénozna malformácia, CLOVES syndróm – kongenitálny syndróm spojený s nadmerným rastom lipomatóznych más, anomálií stavcov, epidermálnym névom (Congenital lipomatous overgrowth vertebrae epidermal nevi syndrome), ISSVA – Medzinárodná spoločnosť pre štúdium vaskulárnych anomálií (International Society for the study of Vascular anomalies), KAVM – kapilárno-arterio-venózne malformácie, KLAVM – kapilárno-lymfaticko-arterio-venózne malformácie, KLM – kapilárno-lymfatické malformácie, KLVM – kapilárno-lymfaticko-venózne malformácie, KVM – kapilárno-venózne malformácieU detí sa najčastejšie stretávame s infantilným hemangiómom (IH). Je charakteristický fázou rastu v 1. roku života dieťaťa s následnou fázou regresie a involúcie, ktorá trvá približne do predškolského veku dieťaťa. Takto bohato vaskularizovaný cievny tumor postupne regreduje a dochádza k jeho prestavbe na tukovo-väzivové tkanivo. K rizikovým faktorom IH patrí ženské pohlavie, predčasný pôrod, nízka pôrodná hmotnosť, viacplodová gravidita, či rôzne komplikácie počas gravidity (napr. preeklampsia, placenta praevia). Podľa hĺbky postihnutia kože IH delíme na povrchové (kapilárne), hlboké (kavernózne), alebo zmiešané (kapilárno-kavernózne) [7, 8] (obr. 2). Osobitú podskupinu IH tvora viscerálne hemangiómy, ktoré najčastejšie postihujú pečeň.
Image 2. Rozdelenie infantilných hemangiómov (IH) na základe hĺbky postihnutia kože (zdroj: archív autorov).
a) Povrchové (kapilárne) IH
b) Hlboké (kavernózne) IH
c) Zmiešané (kapilárno – kavernózne) IH
Fig. 2. Classification of infantile hemangiomas (IH) based on the depth of the lesion from the skin surface (source: authors’ archive).
a) Superficial (capillary) IH
b) Deep (cavernous) IH
c) Mixed (capillary-cavernous) IH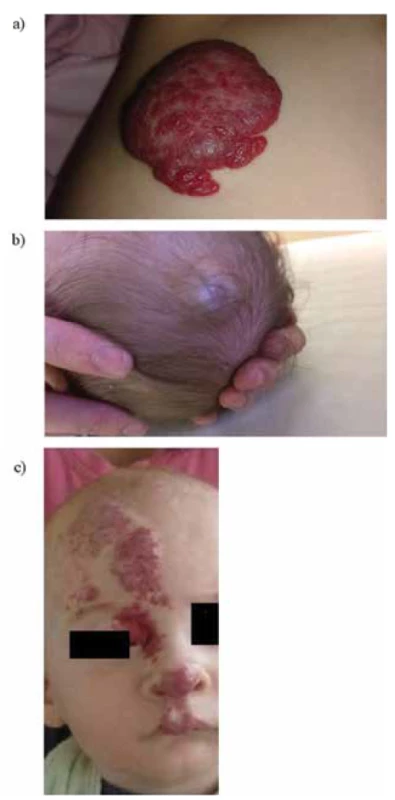
Liečba hemangiómov je rôznorodá, v posledných rokoch si prešla mnohými zmenami a závisí od biologického správania a konkrétneho typu hemangiómu. Napr. u infantilných hemangiómov sú liekmi prvej voľby betablokátory, buď aplikované lokálne alebo systémovo v závislosti od veku, veľkosti a lokalizácie IH. U pyogénneho granulómu (inak nazývaného lobulárny kapilárny hemangióm) je naopak prvou voľbou chirurgická liečba, liečba laserom alebo elektrokauterizácia [8–10].
Cievne malformácie sa rozdeľujú na kapilárne, lymfatické, venózne, arteriovenózne (AV) malformácie a AV fistuly a následne ich kombinácie (napr. kapilárno-venózna, kapilárno-lymfatická) (tab. 1). Ďalej sa delia na nízkoprietokové a vysokoprietokové. Liečba cievnych malformácií zahŕňa viacero modalít od konzervatívnej liečby (elastická bandáž), cez laseroterapiu, sklerotizáciu, embolizáciu či chirurgické odstránenie v závislosti od typu, rozsahu, lokalizácie či biologického správania [11, 12].
Prinášame prípady troch pacientov odoslaných na naše pracovisko s diagnózou hemangióm, no v skutočnosti po doplnení anamnestických údajov a ďalších vyšetrení sme diagnostikovali tri úplne rozdielne závažné diagnózy.
KAZUISTIKA Č. 1
Do našej ambulancie bol odoslaný na odporúčanie dermatológa 13-mesačný pacient pre suspektné mnohopočetné „miznúce“ hemangiómy. Uvedené ložiská sa u pacienta objavovali na trupe cca od 3. mesiaca života. Mali vzhľad živočervených škvŕn veľkosti špendlíkovej hlavičky a hojili sa hnedasto sfarbenými makulami, ktoré následne postupne spontánne vymizli.
Pri vyšetrení u nás neboli na tele nájdené žiadne hemangiómy. Lézie na trupe a v plienkovej oblasti mali charakter vaskulitických zmien, najmä v mieste tlaku plienky. Preto bolo realizované reumatologické, dermatologické a imuno-alergologické vyšetrenie vrátane laboratórneho odberu autoprotilátok a vyšetrenia imunoprofilu. USG brušných orgánov bolo bez patologického nálezu. Cca 2 mesiace pred prvým vyšetrením u nás (vo veku 11 mesiacov) sa chlapcovi vytvorila na hornej gingíve vľavo v oblasti molárov bolestivá škvrna, z ktorej po lokálnom ošetrení vytiekol sérosangvinolentný obsah. Následne bol hospitalizovaný v spádovej nemocnici pre bolestivú aftóznu stomatitídu s febrilným priebehom. Pre protrahované hojenie lézie v oblasti gingívy bolo v spáde realizované CT vyšetrenie tváre popísané s negatívnym nálezom. Následne doplnili biopsiu z defektu v dutine ústnej so záverom, že lézia obsahuje granulomatózne tkanivo a baktérie. Pacient bol preliečený intravenóznou kombinovanou antibiotickou a antimykotickou liečbou a ložiská v dutine ústnej boli lokálne ošetrované. Došlo k ich postupnej nekompletnej regresii. Pre anémiu ľahkého stupňa bol chlapec liečený feropreparátmi.
Vo veku 14 mesiacov došlo k recidíve nekrotického defektu v oblasti gingívy maxily vľavo a rozvoju gingivostomatitídy a pacient bol následne hospitalizovaný u nás. Vo vstupných laboratórnych vyšetreniach bol krvný obraz bez leukocytózy a anémie, mikroskopicky krvný obraz bez nálezu blastov s prítomným posunom doľava pri predpokladanej superinfekcii. Nešpecifická zápalová aktivita bola ľahko zvýšená, osmolalita séra a moča boli v norme, diuréza primeraná. Bola zahájená intravenózna antibiotická a antimykotická liečba s dobrou účinnosťou na patogén vykultivovaný z ložísk v dutine ústnej (Klebsiella pneumoniae). Doplnili sme kontrolné CT vyšetrenie tváre s nálezom početných osteolytických ložísk v kalve, v maxile a mandibule (obr. 3, 4).
Image 3. Osteolytický defekt nad alveolárnym výbežkom vľavo v maxile u pacienta s multisystémovou histiocytózou z Langerhansových buniek (zdroj: archív autorov).
Fig. 3. Osteolytic defect above the alveolar ridge on the left side of the maxilla in the patient with multisystem Langerhans cell histiocytosis (source: authors’ archive).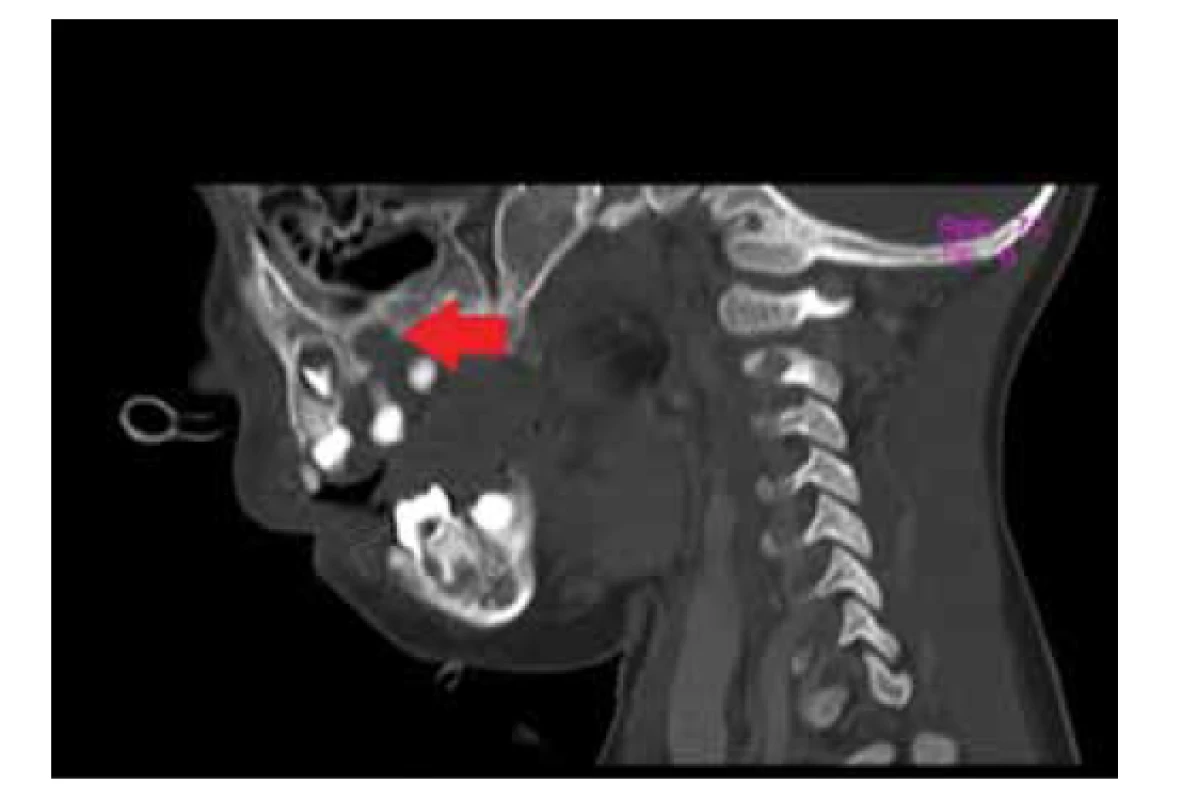
Image 4. 3D rekonštrukcia CT maxily s vyznačeným osteolytickým defektom nad ľavým alveolárnym výbežkom (zdroj: archív autorov).
Fig. 4. 3D CT scan of maxilla with marked osteolytic defect above the left alveolar ridge (source: authors’ archive).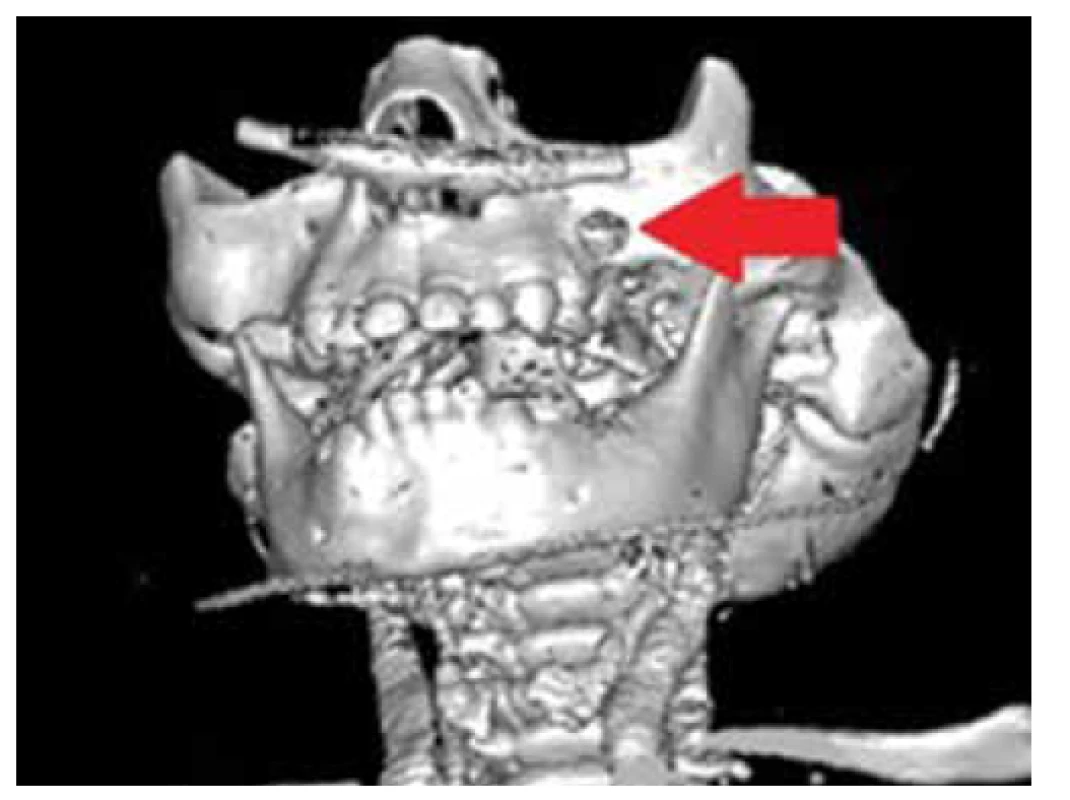
CT vyšetrenie hrudníka odhalilo viaceré osteolytické ložiská v rebrách (obr. 5). Následne na celotelovej scintigrafii skeletu sa zobrazili osteolytické ložiská v kalve, rebrách, klavikule vpravo, v pravom humere a suspektné ložiská aj v stavcoch torakálnej a lumbálnej chrbtice (obr. 6). Kontrolné ultrasonografické vyšetrenie bolo bez hepatosplenomegálie a pečeň a slezina boli bez postihnutia. Zväčšené okcipitálne lymfatické uzliny zobrazené na CT vyšetrení mali v USG obraze reaktívny charakter, týmus sa nepodarilo sonograficky zobraziť. Mediastínum na RTG hrudníka nebolo rozšírené. V spolupráci so stomatochirurgami sme realizovali histologizáciu dvoch ložísk v ústach so súčasnou bikristálnou trepanobiopsiou. Vzhľadom na minimálny nález na koži v čase výkonu sme od plánovanej biopsie z kože upustili (obr. 7 [13]). Rany sa po výkone hojili primerane. Doplnili sme stagingové CT pľúc s nálezom difúzneho pľúcneho postihnutia charakteru ground glass opacít v pľúcnom parenchýme a bilaterálnych emfyzematóznych búl. CT brucha bolo bez patologického nálezu.
Image 5. CT nález osteolytických ložísk v rebrách (zdroj: archív autorov).
Fig. 5. Osteolytic lesions in the ribs on CT scan (source: authors’ archive).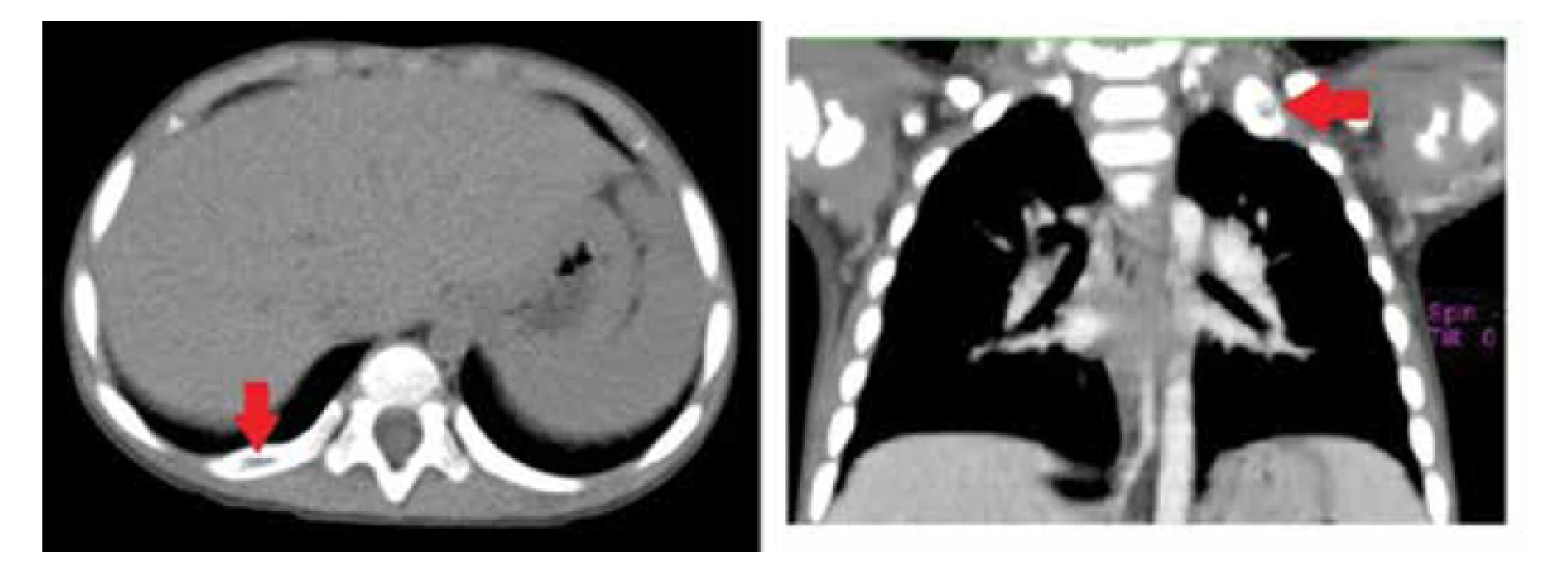
Image 6. Celotelová scintigrafia skeletu s akumuláciou osteotropného rádiofarmaka vo viacerých ložiskách (kalva, mandibula, humerus vpravo, klavikula vpravo) (zdroj: archív autorov).
Fig. 6. An accumulation of osteotropic radiopharmaceutical in several deposits (calva, mandible, right humerus, right clavicle) on whole-body bone scintigraphy (source: authors’ archive).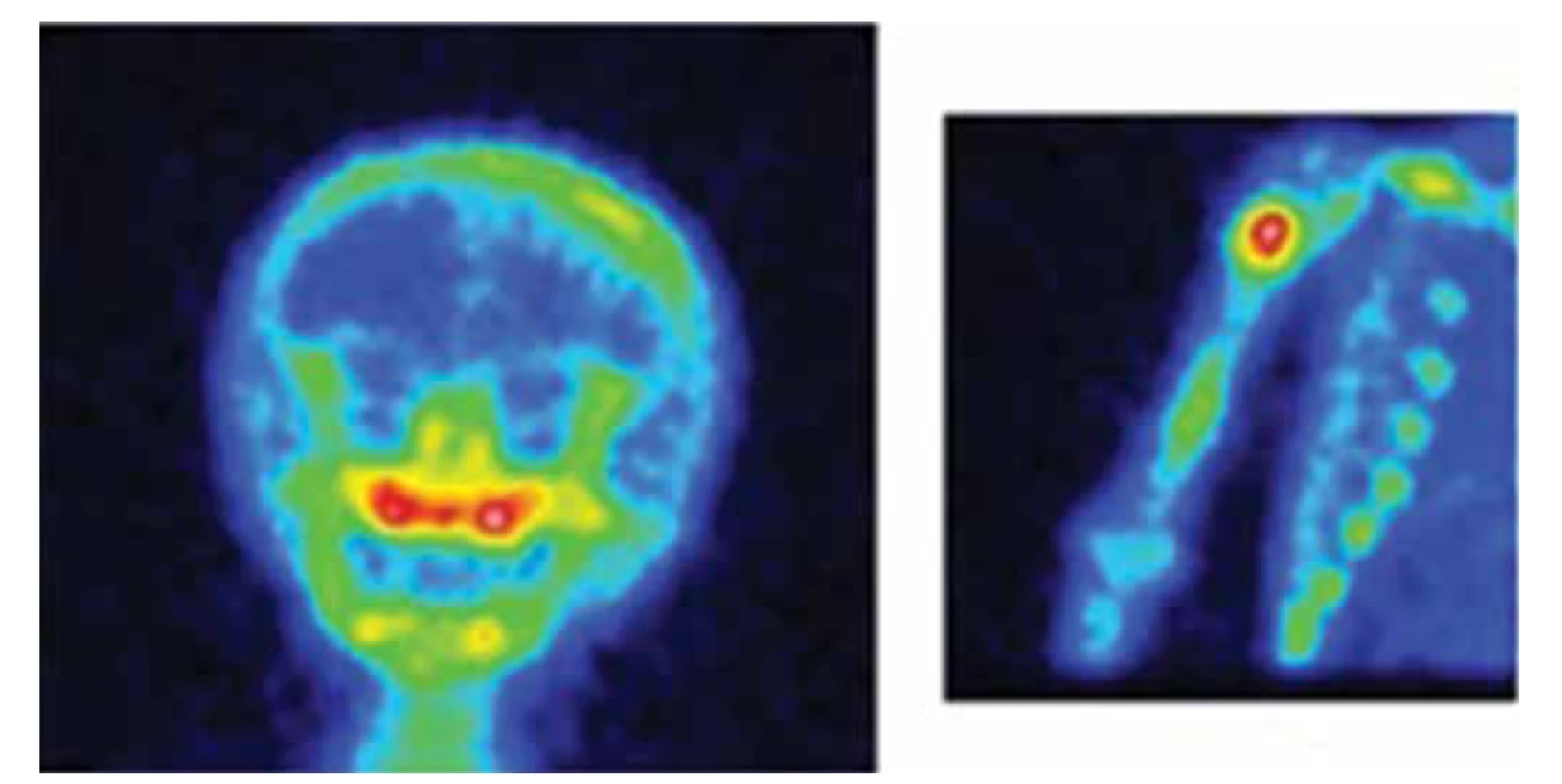
Image 7. Rozvinutý kožný nález u pacienta s multisystémovou histiocytózou z Langerhansových buniek zachytený počas hospitalizácie na pracovisku pediatrickej hematológie a onkológie [13]. Počas hospitalizácie na našej klinike mal pacient minimálny kožný nález, preto sme aj od plánovanej biopsie z kože upustili.
Fig. 7. Developed skin manifestation of multisystem Langerhans cell histiocytosis in our patient captured during the stay in the pediatric hematology and oncology department [13]. The patient had a minimal skin manifestation during hospitalization in our department, because of this we abandoned the planned skin biopsy.![Rozvinutý kožný nález u pacienta s multisystémovou
histiocytózou z Langerhansových buniek zachytený počas
hospitalizácie na pracovisku pediatrickej hematológie a onkológie
[13]. Počas hospitalizácie na našej klinike mal pacient
minimálny kožný nález, preto sme aj od plánovanej biopsie
z kože upustili.<br>
Fig. 7. Developed skin manifestation of multisystem Langerhans
cell histiocytosis in our patient captured during the stay
in the pediatric hematology and oncology department [13].
The patient had a minimal skin manifestation during hospitalization
in our department, because of this we abandoned
the planned skin biopsy.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/22cc47ddd73133ee3d69db0471e73587.png)
Definitívny výsledok histológie potvrdil predpokladanú diagnózu – histiocytózu z Langerhansových buniek s infiltráciou kostnej drene do 10 %. Pacient bol následne preložený na pracovisko pediatrickej hematológie a onkológie za účelom liečby.
KAZUISTIKA Č. 2
V našej ambulancii bolo vyšetrené 3-ročné dievčatko bez pozoruhodnej perinatálnej anamnézy pre suspektný hemangióm na hlavičke parietálne vľavo. Rezistenciu na hlave pozorovali rodičia doma približne pol roka, avšak v priebehu tohto obdobia sa zväčšila len minimálne. V objektívnom náleze pri prvom vyšetrení u nás mal útvar veľkosť približne 2 cm x 1,5 cm, prominoval nad niveau kože do 5 mm, bol mäkký, dobre ohraničený, palpačne nebolestivý, modrasto presvital. Ultrasonograficky bol útvar bohato vaskularizovaný, kalva pod ním bola neporušená, vykazoval klinické aj sonografické známky hemangiómu. Vzhľadom na vek dieťaťa a lokalizáciu lézie bola zahájená lokálna liečba betablokátorom. Lézia nereagovala na lokálnu liečbu a došlo k jej rastovej progresii. Aj napriek poučeniu rodičia prišli na nasledujúcu kontrolu až o 8 týždňov.
Pri vyšetrení bol útvar v podkoží tmavoružovo sfarbený, miestami modrasto presvitajúci, tuhej konzistencie a nepohyblivý voči spodine. USG vyšetrenie pečene zobrazilo hypoechogénne ľahko nehomogénne ložisko priemeru cca 20 mm v blízkosti hepatálnej vény, USG obličiek bolo v norme. V čase kontrolného ambulantného vyšetrenia malo dieťa 2 dni trvajúcu febrilnú akútnu respiračnú infekciu liečenú antibiotikami a rodičia vraveli, že dievčatko začalo krívať a sťažovalo sa na bolesti pravej päty. RTG pravej päty a USG jej mäkkých štruktúr bolo bez patologického nálezu. V laboratórnych parametroch bola v krvnom obraze relatívna monocytóza (pri prebiehajúcej infekcii), hranične elevované AST a ALT a ľahko zvýšená nešpecifická zápalová aktivita. Ostatné parametre boli v norme. Pri kontrastnom CT vyšetrení hlavy, hrudníka a brucha sa v oblasti hlavy zobrazovala postkontrastne sa sýtiaca tumorózna lézia mäkkých tkanív hlavy nad parietálnou kosťou vľavo (obr. 8). V oblasti pečene sa na rozhraní pravého a ľavého laloka kraniálne subkapsulárne zobrazovali postkontrastne sa sýtiace ložiská viditeľné aj na natívnom obraze (obr. 9). Prekvapivý bol nález mnohopočetných tumoróznych lézií v oboch obličkách pri postkontrastnom CT vyšetrení, ktoré sa ale pri natívnom vyšetrení nezobrazovali (obr. 9).
Image 8. CT obraz oválnej mäkkotkanivovej tumoróznej lézie naliehajúcej na ľavú parietálnu kosť (vľavo natívny obraz, vpravo po podaní kontrastnej látky). Lézia je dobre ohraničená, nedeštruuje priľahlý skelet ani ho neuzuruje, nepropaguje sa do intrakránia (zdroj: archív autorov).
Fig. 8. CT image of an oval soft tissue tumor lying on the left parietal bone (native image on the left side, on the right side after an administration of contrast agent). The lesion is well demarcated, does not destroy the adjacent skull and does not spread to the intracranial space (source: authors’ archive).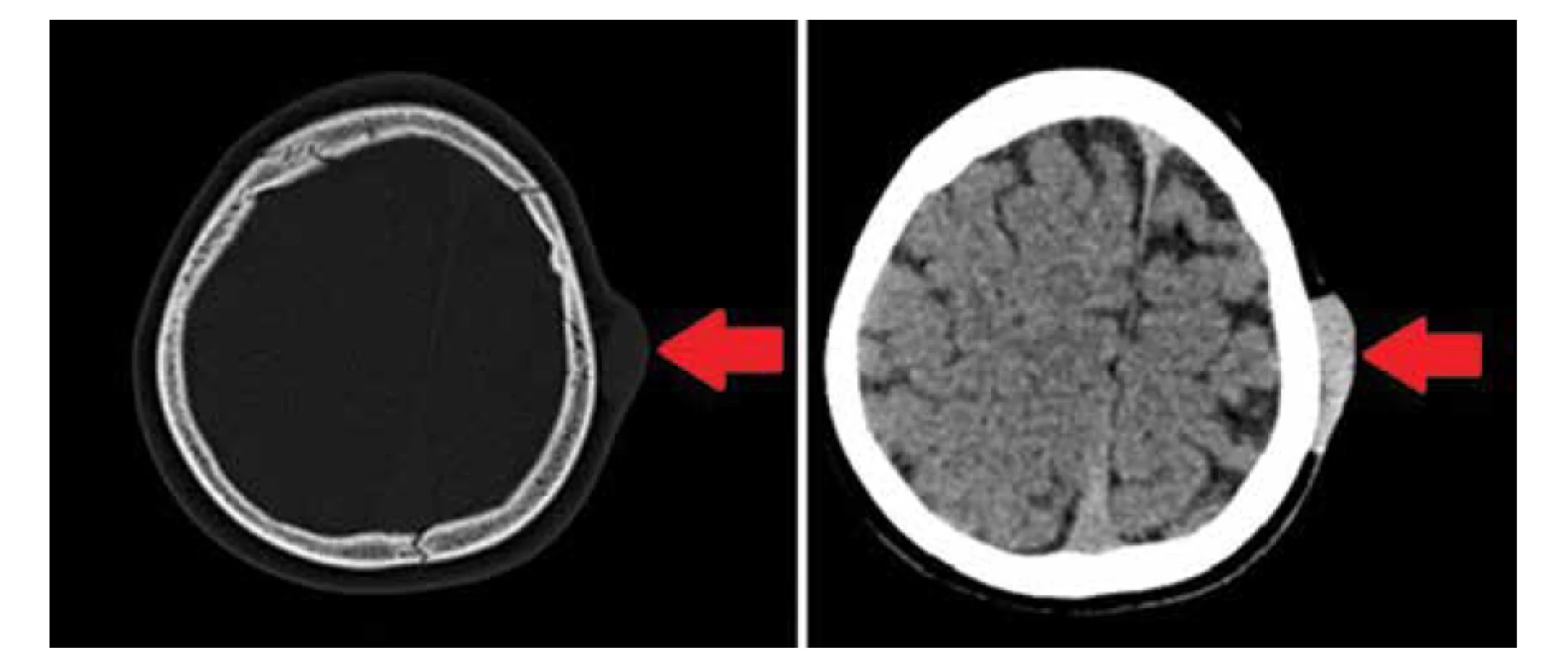
Image 9. Postkontrastne sa sýtiace viacpočetné ložiskové lézie v oboch obličkách (a, b) a homogénne ložisko na rozhraní pravého a ľavého laloka pečene (c) u pacientky s extranodálnym B-NHL (zdroj: archív autorov).
Fig. 9. Multiple focal lesions in both kidneys were enhanced after the contrast administration (a, b) and also a homogeneous lesion on the interface of the right and left lobes of the liver (c) in a patient with extranodal B-NHL (source: authors’ archive).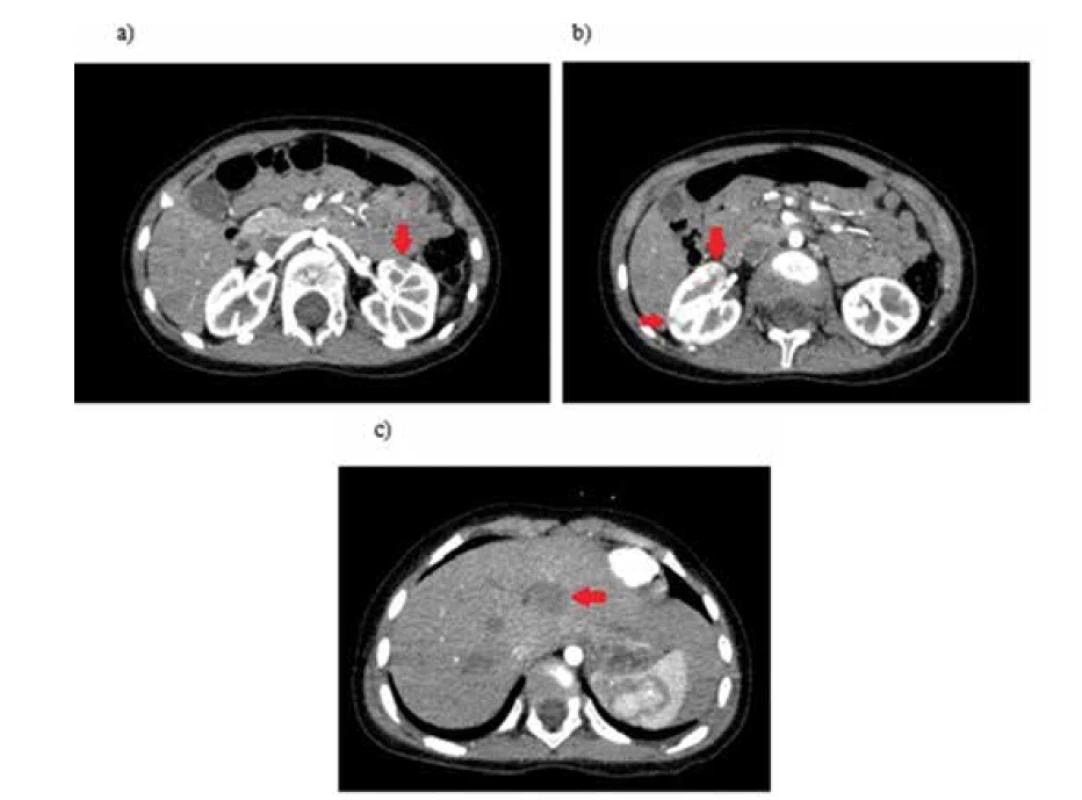
Vzhľadom na distribúciu a vzhľad lézií sme pri diferenciálnej diagnostike zvažovali aj možnú fakomatózu, preto bolo doplnené aj genetické vyšetrenie. Pre nepriaznivú lokalizáciu ložísk v pečeni a obličkách sme od perkutánnej bioptizácie pod USG či CT kontrolou v spolupráci s urológom a intervenčným rádiológom upustili a následne bolo exstirpované a histologizované iba ložisko v podkoží parietálne vľavo.
Imunofenotypové vyšetrenie periférnej krvi vylúčilo akútnu leukémiu. Na základe histologického vyšetrenia išlo o infiltráciu mäkkých tkanív ložiskami blastickej nádorovej lymfoproliferácie – išlo o ťažko klasifikovateľný blastický B non-Hodgkinov lymfóm (B-NHL) v extranodálnej lokalizácii. Následne bola pacientka hospitalizovaná na pracovisku pediatrickej hematológie a onkológie za účelom liečby.
KAZUISTIKA Č. 3
Takmer 13-ročný chlapec rok liečený na diabetes mellitus 1. typu bol odoslaný do našej ambulancie s rozsiahlym hemangiómom v oblasti ľavého líca. Išlo o veľké, progresívne rastúce ložisko, ktoré mal na líci od narodenia. Približne od 7. roku života bol 2 roky ošetrovaný v spáde laserom bez podstatnejšieho efektu. Do vyšetrenia u nás chlapec nikdy neabsolvoval žiadne zobrazovacie vyšetrenie zamerané na oblasť ľavého líca. Pri vyšetrení u nás bol v objektívnom náleze prítomný opuch ľavého líca s livídnou makulou, ktorá siahala až do zygomatickej oblasti a na ľavé dolné viečko, ľavá očná štrbina bola užšia, ľavé líce bolo bez jednoznačnej hmatnej rezistencie a výrazne teplejšie oproti ostatnej koži (obr. 10). Korešpondujúca bukálna sliznica bola mierne vyklenutá a modrasto sfarbená. Slizničné zmeny zasahovali až na alveolárny výbežok, vitálne zuby v hornom zuboradí sa kývali a priľahlá gingíva minimálna krvácala. Pacient mal v oblasti mandibuly a hornej časti krku viditeľnú výraznejšiu cievnu kresbu (obr. 10).
Image 10. Pacient s rozsiahlou AV malformáciou v oblasti ľavej maxilárnej dutiny a ľavého líca (stav pred embolizáciou) (zdroj: archív autorov).
Fig. 10. The patient with extensive AV malformation of the left maxillary sinus and in the area of the left cheek (the condition before embolization) (source: authors’ archive).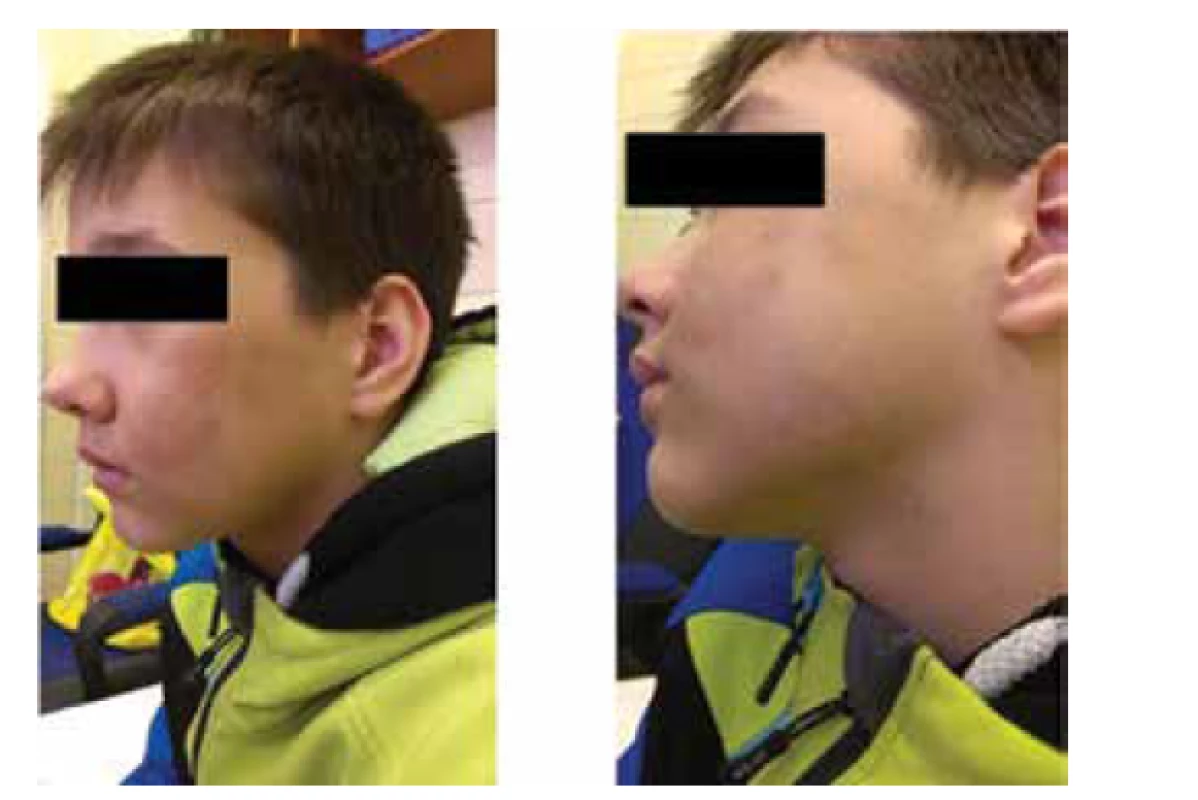
Všetky laboratórne parametre okrem hyperglykémie a glykozúrie boli v norme. Sonograficky sa v oblasti ľavého líca zobrazovala bohato vaskularizovaná lézia s reaktívnou krčnou lymfadenopatiou. Na OPG snímke bola prítomná deštrukcia maxily. Kontrastné CT a kontrastné MR vyšetrenie a scintigrafia skeletu zobrazili vaskularizovaný útvar s vysokými prietokmi a arteriovenóznymi spojkami, prerastajúci a deštruujúci celú maxilu vľavo až do zygomatickej oblasti s reaktívnymi krčnými lymfatickými uzlinami. Útvar vypĺňal maxilárnu dutinu vľavo, infiltroval alveolárny výbežok a dosahoval ku čiastočne rezorbovaným koreňom viacerých zubov v ľavom hornom zuboradí.
Na multidisciplinárnom konzíliu (pediatri, stomatochirurgovia, intervenčný rádiológ, pediatrický onkológ a otorinolaryngológ) po prehodnotení všetkých dostupných vyšetrení a po vyšetrení pacienta sme vzhľadom na charakter lézie a veľmi vysoké riziko život ohrozujúceho krvácania perioperačne upustili od zvažovanej biopsie na verifikovanie pôvodu lézie. Tumor bol veľmi málo pravdepodobný. Predpokladali sme, že ide najskôr o rozsiahlu AV malformáciu. Po adekvátnej príprave bola realizovaná selektívna angiografia v celkovej anestézii s nálezom rozsiahlej AV malformácie v oblasti ľavej maxilárnej dutiny a ľavého líca, sýtiacej sa dominantne z vetiev ľavej a. maxillaris. Sýtenie bolo prítomné aj z drobných vetiev pravej a. maxillaris a a. facialis bilaterálne s obojstrannými vetvičkami zasahujúcimi do oboch orbít (obr. 11). Na základe tohto nálezu bola jediným terapeutickým riešením selektívna endovaskulárna embolizácia.
Image 11. Angiografický nález rozsiahlej atypickej AV malformácie v oblasti ľavej maxilárnej dutiny a ľavého líca sýtiacej sa dominantne z vetiev ľavej a. maxillaris. Sýtenie je prítomné aj z drobných vetiev pravej a. maxillaris a a. facialis bilatelárne (stav pred embolizáciou) (zdroj: archív autorov).
Fig. 11. The extensive atypical AV malformation of the left maxillary sinus and in the area of the left cheek is fed predominantly from the branches of the left maxillary artery on the angiography. It is also supplied from small branches of the right maxillary artery and both facial arteries (the condition before embolization) (source: authors’ archive).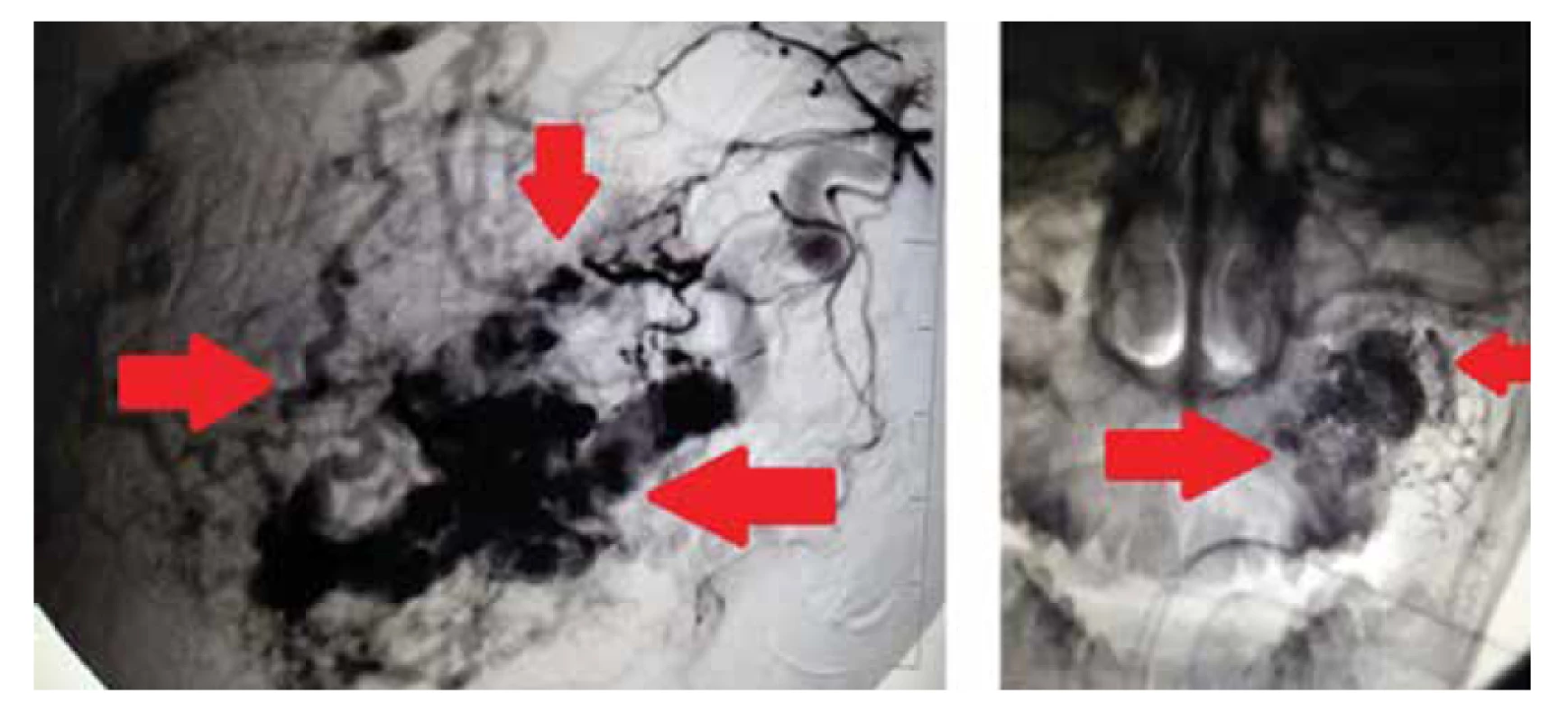
Aj napriek riziku obojstranného poškodenia zraku bola následne vykonaná subtotálna embolizácia AV malformácie špeciálnou embolizačnou látkou nespôsobujúcou vznik postembolizačnej tetováže. Postupne došlo k ústupu opuchu a zvýšeného prekrvenia ľavého líca, vymizla kývavosť zubov a gingiválne krvácanie. U pacienta sme následne v pravidelných intervaloch realizovali kontrastné MR a angiografické kontroly, došlo k podstatnej regresii vaskularizácie AV malformácie, vyvinuli sa fibrotické zmeny a reziduálna AV fistula sa nezobrazila (obr. 12).
Image 12. Stav po subtotálnej embolizácii rozsiahlej AV malformácie v oblasti ľavej maxilárnej dutiny a ľavého líca. Na kontrolnej angiografii vaskularizácia AV malformácie je vo výraznej regresii a bez nálezu reziduálnej AV fistuly (zdroj: archív autorov).
Fig. 12. The condition after subtotal embolization of the extensive AV malformation of the left maxillary sinus and in the area of the left cheek. Vascularization of AV malformation is in significant regression on control angiography and without finding any residual AV fistula (source: authors’ archive).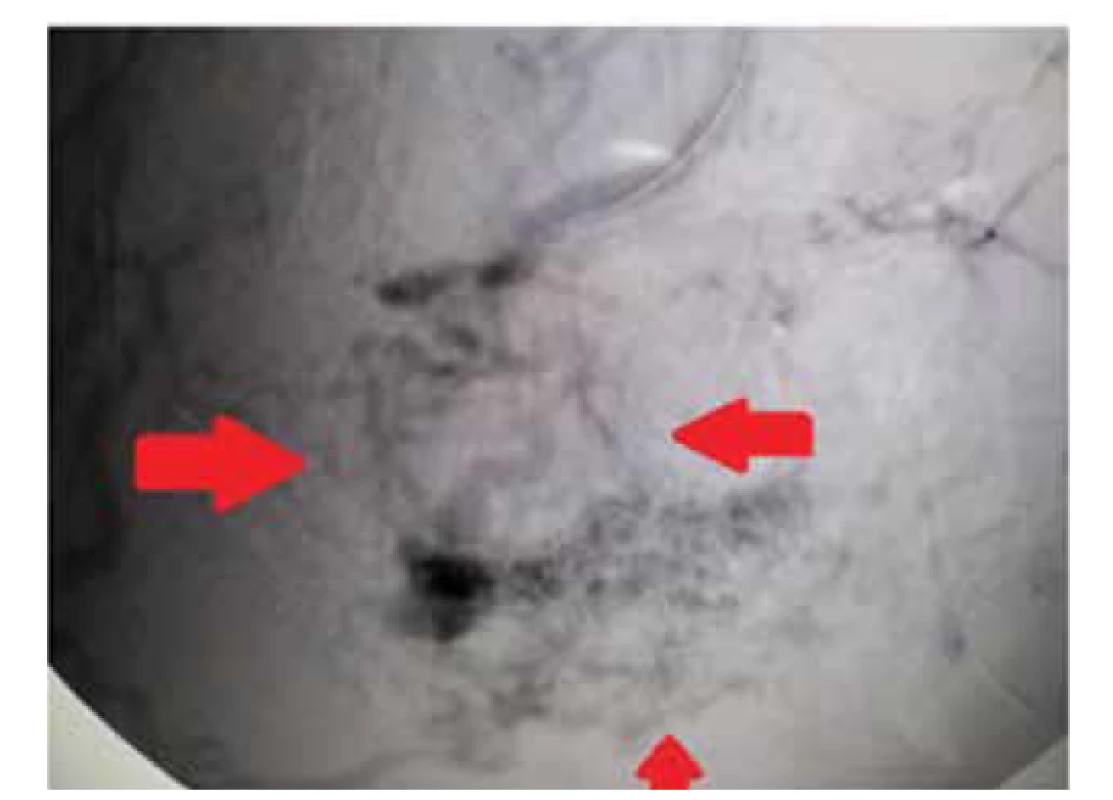
DISKUSIA
Predstavili sme tri kazuistiky pacientov, u ktorých sa primárne predpokladalo, že majú hemangióm. Po dôkladnom odobratí anamnézy a klinickom vyšetrení bolo zjavné, že termín hemangióm bol nesprávne použitý na lézie, ktoré sa na hemangiómy iba podobali. Za pomoci neinvazívnych aj invazívnych zobrazovacích vyšetrení, histopatologických vyšetrení a vďaka multidisciplinárnej spolupráci sme diagnostikovali rôzne závažné ochorenia (multisystémovú histiocytózu z Langerhansových buniek, extranodálny B-NHL a rozsiahlu AV malformáciu maxily), z ktorých si každé vyžadovalo odlišný ďalší manažment a špecifický liečebný postup [11, 14–18]. Nesprávne liečené by mali fatálny priebeh.
Z našej praxe vieme, že asi v 90 % prípadov stačí správne odobrať anamnézu a klinicky vyšetriť pacienta na to, aby sme vedeli správne diagnostikovať hemangióm a odlíšiť ho od iného tumoru alebo inej vaskulárnej anomálie. Najčastejšími hemangiómami sú infantilné a kongenitálne hemangiómy. V dojčenskom veku sa zamieňajú s teleangiektatickými névami, ktoré patria medzi benígne vaskulárne malformácie a v mnohých prípadov pre pacienta nepredstavujú zdravotné riziko. Väčšina zvykne časom spontánne zregredovať a nevyžaduje špecifickú liečbu ani sledovanie. Teleangiektatické névy sa vyskytujú už pri narodení u vyše polovice novorodencov. Charakteristické je pre nich bledoružové až tmavoružové sfarbenie, majú charakter makuly nepravidelného tvaru a bývajú lokalizované v záhlaví, na čele, na očných viečkach, koreni nosa, v okolí pier, niekedy v oblasti kolien [2, 4].
K ďalším často zamieňaným kožným nálezom s hemangiómom patrí naevus flammeus, nazývaný aj „oheň“ alebo „škvrna farby portského vína“. Najčastejšie býva lokalizovaný v oblasti hlavy a krku, najmä v senzorických oblastiach V. hlavového nervu. Má tmavočervenú alebo vínovočervenú farbu a patrí medzi vaskulárne malformácie. Vzniká v dôsledku čiastočnej alebo úplnej absencie inervácie krvných ciev. Postihuje malé percento novorodencov a detí, ale predstavuje veľkú psychickú záťaž pre jedinca a jeho rodičov. Spontánne nemizne a lieči sa laserom. Niekedy môže byť súčasťou niektorých syndrómov, napr. Sturgeho-Weberovho syndrómu (zahŕňa postihnutie tváre, očí a CNS vaskulárnymi malformáciami) či Klippelovho-Trenaunayovho syndrómu (ten charakterizuje triáda – cievna malformácia, varikozity, hypertrofia končatiny) [2, 19, 20].
Veľké a hlboko uložené hemangiómy sa môžu v niektorých prípadoch zamieňať s vysokoprietokovými arteriovenóznymi malformáciami na základe bohato vyznačenej vaskularizácie v ultrasonografickom obraze. Pre výber vhodnej liečby je dôležité ďalej dodiferencovať charakter lézie pomocou iných zobrazovacích vyšetrení, či už kontrastnou ultrasonografiou, CT či MR angiografiou, ale často musíme siahnuť pri diagnostike aj k invazívnym metódam, akou je digitálna substrakčná angiografia [11, 14, 21–23].
Takisto niektoré iné mäkkotkanivové nádory – zhubné aj nezhubné – môžu svojim vzhľadom pripomínať hemangióm. Pri sporných anamnestických údajoch, klinických nálezoch na koži a pri podozrení z malignity pre správnu diagnostiku je nutné okrem zobrazovacích vyšetrení doplniť aj bioptické vyšetrenie ložiska s histologizáciou, eventuálne podľa uloženia a veľkosti léziu čiastočne alebo úplne chirurgicky odstrániť. Od výsledku histologického vyšetrenia sa následne odvíjajú ďalšie stagingové vyšetrenia a onkologická liečba [23–27].
Pri diferenciálnej diagnostike vaskulárnych lézií u detí je dôležité myslieť aj na rôzne kožné prejavy systémových ochorení, napr. vaskulitíd (petéchie, purpura, livedo reticularis), SLE a mnohých ďalších. Taktiež kožná manifestácia vrodených (hemofília) alebo získaných koagulopatií (DIC), trombocytopénie a trombocytopatie môže imitovať hemangióm [28].
ZÁVER
Vzhľadom na veľké množstvo lézií na koži, ktoré môžu byť podobné hemangiómom, je potrebné pre správne stanovenie diagnózy poznať základné rizikové faktory, klinické charakteristiky a typické biologické správanie hemangiómov. Vo väčšine prípadov nám na určenie toho, či sa jedná alebo nejedná o hemangióm, stačí správne a dôkladne odobrať anamnézu a klinicky vyšetriť pacienta. V prípade nejasností o biologickej povahe lézie je potrebné doplniť ďalšie vyšetrenia a včas odoslať pacienta na špecializované pracovisko.
Skratky:
ALT – alanínaminotransferáza
AST – aspartátaminotransferáza
AV malformácia – arteriovénozna malformácia
B-NHL – non-Hodgkinov lymfóm z B buniek
CLOVES syndróm – kongenitálny syndróm spojený s nadmerným rastom lipomatóznych más, anomálií stavcov, epidermálnym névom (Congenital lipomatous overgrowth vertebrae epidermal nevi syndrome)
CT – vyšetrenie počítačovou tomografiou
CNS – centrálny nervový systém 3 D – trojrozmerný
DIC – diseminovaná intravaskulárna koagulácia
IH – infantilný hemangióm
ISSVA – Medzinárodná spoločnosť pre štúdium vaskulárnych anomálií (International Society for the study of Vascular anomalies)
KAVM – kapilárno-arterio-venózne malformácie
KLAVM – kapilárno-lymfaticko-arterio-venózne malformácie
KLM – kapilárno-lymfatické malformácie
KLVM – kapilárno-lymfaticko-venózne malformácie
KVM – kapilárno-venózne malformácie
LUMBAR syndróm – syndróm zahŕňajúci hemangiómy na dolných končatinách, abnormality urogenitálneho traktu, myelopatiu, deformity kostí a anorektálne anomálie (Lower body hemangioma, Urogenital abnormalities or ulceration, Myelopathy, Bony deformities, Anorectal malformations or arterial anomalies, Rectal anomalies)
MR – vyšetrenie magnetickou rezonanciou
OPG – ortopantomogram
PHACE syndróm – syndróm spojený s malformáciami zadnej jamy, hemangiómami, arteriálnymi anomáliami, srdcovými a očnými alebo endokrinnými abnormalitami (Posterior fossa malformations, Hemangioma, Arterial lesions, Cardiac abnormalities or Coarctation of the aorta, Eye or Endocrine abnormalities)
RTG – röntgen
SLE – systémový lupus erythematodes
USG – ultrasonografia
Došlo: 20. 2. 2021
Přijato: 19. 5. 2021
Korespondující autorka:
MUDr. Michaela Murgašová
Klinika detí a dorastu JLF UK
a Univerzitnej nemocnice Martin
Kollárova 2
036 01 Martin Slovenská republika
e-mail: murgasovam@zoznam.sk
Sources
1. Faberová R, Arenberger P, Čapková Š, et al. Infantilní hemangiomy z pohledu dermatologa. Čes-slov Derm 2017; 92 (5): 206–218.
2. Murgašová M. Novorodenecké znamienka. In: Zibolen M, et al. Zdravo rásť. Banská Bystrica: Klub priateľov Detskej nemocnice v Banskej Bystrici, 2019 : 188–194.
3. Prusíková D. Zajímavé kazuistiky léčby hemangiomů z klinické praxe. Dermatol praxi 2020; 14 (4): 202–206.
4. Piccolo V, Russo T, Moscarella E, et al. Dermatoscopy of vascular lesions. Dermatol Clin 2018; 36 (4): 389–395.
5. Mulliken JB, Glowacki J. Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg 1982; 69 (3): 412–422.
6. ISSVA Classification of Vascular Anomalies 2018. International Society for the Study of Vascular Anomalies. Available at: „issva.org/classification“ (Accessed 23th January 2021).
7. Mališ J, Mišove A. Mýty a úskalí v přístupu k pacientovi s infantilním hemangiomem. Pediatr praxi 2020; 21 (4): 232–235.
8. Mališ J, Stará V, Bláhová K, et al. Infantilní hemangiomy. Současné léčebné postupy. Čes-slov Pediat 2017; 72 (4): 245–254.
9. Grešíková M, Sejnová D, Babala J. Aktuálny manažment infantilných hemangiómov. Pediatria 2020; 15 (1): 25–29.
10. Lee J, Sinno H, Tahiri Y, et al. Treatment options for cutaneous pyogenic granulomas: A review. J Plast Reconstr Aesthet Surg 2011; 64 (9): 1216–1220.
11. Carqueja IM, Sousa J, Mansilha A. Vascular malformations: classification, diagnosis and treatment. Int Angiol 2018; 37 (2): 127–142.
12. Mulligan PR, Prajapati HJ, Martin LG, et al. Vascular anomalies: classification, imaging characteristics and implications for interventional radiology treatment approaches. Br J Radiol 2014; 87 (1035): 20130392.
13. Kolenová A, Bubanská E, Špotová A, et al. Cielená liečba závažnej multisystémovej histiocytózy z Langerhansových buniek. Pediatr prax 2018; 19 (1): 27–23.
14. Fernández-Alvarez V, Suárez C, de Bree R, et al. Management of extracranial arteriovenous malformations of the head and neck. Auris Nasus Larynx 2020; 47 (2): 181–190.
15. Guo MM, Chen CC, Chen FS, et al. A case of congenital Langerhans cell histiocytosis with disseminated skin and pulmonary involvement masquerading as multiple infantile hemangiomas. Pediatr Neonatol 2017; 58 (6): 552–554.
16. Jezierska M, Stefanowicz J, Romanowicz G, et al. Langerhans cell histiocytosis in children - a disease with many faces. Recent advances in pathogenesis, diagnostic examinations and treatment. Postepy Dermatol Alergol 2018; 35 (1): 6–17.
17. Vannata B, Zucca E. Primary extranodal B-cell lymphoma: current concepts and treatment strategies. Chin Clin Oncol 2015; 4 (1): 10.
18. Weber AL, Rahemtullah A, Ferry JA. Hodgkin and non-Hodgkin lymphoma of the head and neck: clinical, pathologic, and imaging evaluation. Neuroimaging Clin N Am 2003 Aug; 13 (3): 371–392.
19. Deka JB, Deka NK, Shah MV, et al. Intraneural hemangioma in Klippel–Trenaunay syndrome: role of musculo-skeletal ultrasound in diagnosis – case report and review of the literature. J Ultrasound 2020; 23, 435–442.
20. Sudarsanam A, Ardern-Holmes SL. Sturge-Weber syndrome: from the past to the present. Eur J Paediatr Neurol 2014; 18 (3): 257–266.
21. Tomblinson CM, Fletcher GP, Lidner TK, et al. Parapharyngeal space venous malformation: An imaging mimic of pleomorphic adenoma. AJNR Am J Neuroradiol 2019; 40 (1): 150–153.
22. Wiegand S, Dietz A. Vaskuläre malformationen im Hals-Nasen-Ohren-Bereich [Vascular malformations of the head and neck]. Laryngorhinootologie 2021; 100 (1): 65–76.
23. Zaltsberg GS, Spring S, Malic C, et al. Soft tissue lesions with highvascular density on sonography in pediatric patients: Beyond hemangiomas. Can Assoc Radiol J 2020; 71 (4): 505–513.
24. Evans MS, Burkhart CN, Bowers EV, et al. Solitary plaque on the leg of a child: A report of two cases and a brief review of acral pseudolymphomatous angiokeratoma of children and unilesional mycosis fungoides. Pediatr Dermatol 2019; 36 (1): e1–e5.
25. Hassanein AH, Alomari AI, Schmidt BA, et al. Pilomatrixoma imitating infantile hemangioma. J Craniofac Surg 2011; 22 (2): 734–736.
26. Karkoska K, Ricci K, Vanden Heuvel K, et al. Metastatic neuroblastoma masquerading as infantile hemangioma in a 4-month-old child. Pediatr Blood Cancer 2021; 68 (5): e28920.
27. Makino T, Ishida W, Hamashima T, et al. An intermediate vascular tumour between kaposiform hemangio endothelioma and tufted angioma with regression of the skin lesion. Eur J Dermatol 2017 Apr 1; 27 (2):175–176.
28. Craig SK. Purpura and other hematovascular disorders. In: Consultative Hemostasis and Thrombosis. 4th ed. Elsevier, 2019 : 167–189.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics
2021 Issue 6-
All articles in this issue
- Effect of gastroesophageal reflux on cilia in upper respiratory tract in children
- Systemic lupus erythematosus with hematological symptoms – a multifaceted disease: case reports and summary for clinical practice
- BRDLÍKOVA CENA
- Narcolepsy in childhood – our experiences
- Not every hemangioma is a hemangioma...
- Iron deficiency in pediatric patients with congenital heart defects
- Edwards syndrome – phenotype, prognosis, ethical attitudes, professional and palliative care
- Jak komunikovat s pacienty a jejich rodiči na dálku a mít vše efektivně hrazeno?
- Specifics of care for tracheostomized pediatric patients – relevant topic
- List redakcii
- Mavena B12 přináší nové možnosti v léčbě chronických zánětů kůže
- Německá pediatrie v Praze – profesor Dr. med. Berthold EPSTEIN (1890–1962) (přednosta německé univerzitní kliniky v Praze na Karlově v letech 1932–1939 a po válce primář Dětského oddělení Nemocnice Bulovka v Praze)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Edwards syndrome – phenotype, prognosis, ethical attitudes, professional and palliative care
- Not every hemangioma is a hemangioma...
- Systemic lupus erythematosus with hematological symptoms – a multifaceted disease: case reports and summary for clinical practice
- Specifics of care for tracheostomized pediatric patients – relevant topic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

