-
Medical journals
- Career
Využití multiplexového systému ImmunoCAP ISAC k určení senzibilizace na molekulární komponenty související se závažností atopické dermatitidy
Authors: R. Vaňková 1; J. Čelakovská 2; J. Bukač 3; I. Krčmová 1; J. Krejsek 1; C. Andrýs 1
Authors‘ workplace: Ústav klinické imunologie a alergologie, Univerzita Karlova, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové, přednosta prof. RNDr. Jan Krejsek, CSc. 1; Klinika nemocí kožních a pohlavních, Univerzita Karlova, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové, přednosta doc. MUDr. Miloslav Salavec, CSc. 2; Ústav lékařské biofyziky, Univerzita Karlova, Lékařská fakulta v Hradci Králové, přednosta prof. Ing. Jan Kremláček, Ph. D. 3
Published in: Čes-slov Derm, 95, 2020, No. 5, p. 166-179
Category: Pharmacologyand Therapy, Clinical Trials
Overview
Cílem práce bylo zhodnocení přínosu vyšetřování specifických IgE protilátek proti molekulárně definovaným alergenům u pacientů s atopickou dermatitidou (AD) pomocí multiplexové metody ISAC a posouzení, zda se senzibilizační profily liší u mírné, středně těžké a těžké formy AD. Do studie bylo zahrnuto celkem 81 pacientů (41 mužů a 40 žen), u kterých bylo provedeno kompletní dermatologické a alergologické vyšetření včetně určení profilu senzibilizace na molekulární komponenty metodou ImmunoCAP ISAC. Výsledky vyšetření byly statisticky zpracovány. Významně vyšší počet pozitivních reakcí s vysokou hladinou specifického IgE (≥ 15 ISU–E) byl prokázán u pacientů se středně těžkou a těžkou formou AD. U většiny molekulárních komponent byla zaznamenána zvyšující se relativní frekvence pozitivních reakcí od mírné po těžkou formu AD. U pacientů s těžkou formou se významně častěji vyskytovala senzibilizace na molekulární komponenty roztoče domácího prachu, zvířat (kočky, psa, koně), vaječného bílku, krevety a plísní (Aspergillus, Alternaria). V tomto směru doporučujeme zaměřit vyšetření, léčbu a režimová opatření.
Klíčová slova:
atopická dermatitida – molekulární komponentová diagnostika – ISAC test – SCORAD index
ÚVOD
U pacientů s atopickou dermatitidou (AD) při určení diagnózy vycházíme z důkladné rodinné a osobní anamnézy, z dermatologického vyšetření podle Hanifinových-Rajkových kritérií [17] a z alergologického vyšetření, které úzce souvisí se stanovením senzibilizace. Na exacerbaci ekzémových projevů se mohou podílet různé alergeny. V současnosti můžeme alergeny definovat jako proteiny, glykoproteiny, lipoproteiny nebo protein-konjugované hapteny, které mají jedinečné molekulární a strukturní vlastnosti [12]. U dospělých pacientů je popisována alergen-specifická IgE mediovaná reakce na široké spektrum potravinových a inhalačních alergenů, zejména alergenů roztočů domácího prachu, pylu a potravin rostlinného původu [35]. Hlavními zdroji alergenů jsou potraviny, trávy, plevele, stromy, plísně, roztoči a zvířata [18].
Mezi běžně prováděná laboratorní vyšetření atopické dermatitidy patří stanovení specifického IgE proti inhalačním a potravinovým alergenům, která se již řadu let provádí pomocí alergenových extraktů z přírodních zdrojů [12].
Během posledního desetiletí bylo do oblasti klinické alergologie zavedeno vyšetření komponentové diagnostiky (CRD – Component Resolved Diagnostics), které se zaměřuje na stanovení specifických IgE protilátek v séru proti rekombinantním a nativním (purifikovaným) komponentám alergenů. Tyto molekuly představují alergenní proteiny, na které je zaměřena specifická IgE imunitní odpověď [16]. Alergenové komponenty by mohly přispět k přesnější diagnostice alergických onemocnění. S jejich pomocí lze s přihlédnutím k dalším okolnostem (anamnestické údaje, další faktory podílející se na zhoršení AD) odlišit reaktivitu proti zkříženě reagujícím alergenům od reaktivity na převážně druhově specifické alergenní komponenty, které by mohly odhalit primární zdroj senzibilizace. U řady molekulárně definovaných alergenů je známo, že navozují závažné projevy alergických chorob. Nález zvýšené hladiny specifických IgE protilátek proti těmto alergenům umožňuje predikovat riziko závažných klinických projevů včetně anafylaxe. Ve skupině potravinových alergenů je možno odlišit reaktivitu na termostabilní molekulární komponenty s obecně vyšším rizikem od termolabilních, odstranitelných tepelnou úpravou potravin. Dále může vyšetření specifických IgE protilátek lékaři usnadnit identifikaci příčinného alergenu k indikaci specifické alergenové imunoterapie.
Molekulární komponenty jsou využívány jak v jednoparametrových, tak multiplexních analýzách. V oboru klinické imunologie je v současné době jedním z nejčastěji používaných multiplexních systémů ImmunoCAP ISAC (ISAC, Immuno Solid-Phase Allergen Chip), který kombinuje technologii biočipu s možnostmi komponentní diagnostiky alergií. V jediném kroku lze z velmi malého množství séra vyšetřit 112 různých alergenních komponent z celkem 51 zdrojů alergenů [12, 27]. Indikace provedení testu ISAC zahrnuje široké spektrum alergických onemocnění, jako je bronchiální astma, alergická rinokonjunktivitida, atopická dermatitida, potravinová alergie a anafylaxe [34].
Vědeckých prací zabývajících se průběhem AD v souvislosti s potravinovou alergií nebo senzibilizací na potravinové a inhalační alergenové komponenty není příliš mnoho [30, 35]. Pouze několik studií prokázalo komorbiditu alergie na potravinové a inhalační alergeny se závažností AD hodnocené pomocí indexu SCORAD (SCORing Atopic Dermatitis) [36].
Cílem našeho sdělení je popsat senzibilizační profil na molekulární komponenty stanovené multiplexovou metodou ISAC u pacientů s atopickou dermatitidou, zhodnotit přínos vyšetření specifických IgE protilátek proti molekulárně definovaným alergenům a posoudit, zda se senzibilizační profil liší u mírné, středně těžké a těžké formy AD. Je třeba zdůraznit, že v tomto příspěvku se zaměřujeme pouze na míru senzibilizace proti molekulárním komponentám a nikoli na jejich klinický význam s využitím specifických provokačních testů. Určení senzitivity metody ISAC na vybrané potravinové alergeny bude cílem našeho dalšího sdělení. V dřívějších publikacích jsme se zabývali vzájemnými vztahy mezi senzibilizací na arašídy, vlašské a lískové ořechy a senzibilizací na plísně Alternaria a Cladosporium u pacientů s atopickou dermatitidou [8, 9, 10].
METODIKA
V období let 2018 a 2019 bylo na Klinice nemocí kožních a pohlavních, Fakultní nemocnice Hradec Králové, vyšetřeno 81 pacientů s atopickou dermatitidou. Diagnóza atopické dermatitidy byla stanovena podle Hanifin-Rajkových kritérií [17]. Vylučovacími kritérii pro zařazení do studie byla dlouhodobá terapie cyklosporinem a systémovými kortikoidy, těhotenství a kojení. Rovněž nemohli být zahrnuti pacienti s atopickou dermatitidou mající jiná systémová onemocnění. U všech pacientů zařazených do studie bylo provedeno kompletní dermatologické a alergologické vyšetření a zároveň in vitro stanovení hladiny IgE protilátek specifických pro molekulárně definované alergeny (sIgE). Hladiny specifického IgE byly sledovány ve vztahu k závažnosti atopické dermatitidy. Studie byla schválena Etickou komisí Fakultní nemocnice a LF UK v Hradci Králové.
Závažnost atopické dermatitidy
Závažnost atopické dermatitidy byla hodnocena podle indexu SCORAD [36]. Byl zhodnocen rozsah postižení, intenzita onemocnění a subjektivní parametry. Závažnost byla hodnocena do 25 bodů jako mírná forma AD, nad 25 bodů do 50 bodů jako středně těžká forma AD a nad 50 bodů jako těžká forma AD. Vyšetření bylo provedeno každé dva měsíce v průběhu jednoho roku a byla vypočítána průměrná hodnota SCORAD [29].
Určení senzibilizace na molekulární komponenty – vyšetření sérových sIgE protilátek metodou ISAC
Vzorky periferní krve byly odebrány z kubitální žíly a následně zpracovány centrifugací. Krevní sérum bylo zamrazeno na -70 °C bez opakovaného rozmrazování a zamrazování až do provedení analýzy. Všichni pacienti byli vyšetřeni multiplexním systémem ImmunoCAP ISAC (Phadia AB, Uppsala, Švédsko).
Systém ISAC je semikvantitativní multiplexní metoda. Reakce probíhá na skleněné destičce (biočipu), na které je ukotveno celkem 112 molekulárně definovaných alergenů v triplikátech (70 rekombinantních, 42 nativních) – obrázek 1 [21, 23]. Výsledky jsou vyjádřeny v arbitrárních jednotkách zvaných standardizované jednotky ISAC pro specifické IgE (ISU-E). Měřící rozsah metody je udáván od 0 do 100 ISU-E. Výsledky větší než 0,3 ISU-E jsou považovány za pozitivní. Naměřené hladiny sIgE lze vyjádřit 4 semikvantitativními třídami: < 0,3 ISU-E negativní, 0,3 > 0,9 ISU-E nízká pozitivita, 0,9 > 15 ISU-E střední pozitivita, ≥ 15 ISU-E vysoká pozitivita. Analýza byla provedena podle doporučení výrobce.
Image 1. Systém ImmunoCAP ISAC – příklad výsledku našeho pacienta s nálezem zvýšené hladiny sIgE protilátek proti několika molekulárně definovaným alergenům
Molekulární komponenty jsou na biočipu seřazeny vertikálně v tripletech, v rozích jsou umístěny kontrolní alergeny. Intenzita fluorescence je vizualizovaná ve formě barevných spotů, které jsou kvantifikovány výpočtem z kalibrační křivky kontrolního vzorku. Barevné spoty na obrázku znázorňují pozitivní nález sIgE na danou molekulární komponentu.
Statistické zhodnocení
Ke zpracování počtu negativních a pozitivních reakcí (nízká, střední a vysoká pozitivita hladiny specifického IgE proti molekulárním komponentám) u mírné, středně těžké a těžké formy atopické dermatitidy byly použity kontingenční tabulky. Dále bylo ve sledovaném souboru pacientů statisticky hodnoceno, zda výskyt senzibilizace u zkoumaných molekulárních komponent souvisí se závažností atopické dermatitidy. Ve skupinách byly podle závažnosti atopické dermatitidy stanoveny relativní četnosti výskytu senzibilizace na vyšetřované molekulární komponenty. Byly posouzeny především alergeny s nejvyšší pravděpodobností pozitivního výsledku a vyhodnoceny unikátní statistickou analýzou podle Worsleyho [40]. Sledované parametry byly vloženy do kontingenčních tabulek a zhodnoceny testem nezávislosti chí-kvadrát s hladinou významnosti 5 % (chí kvadrát test).
VÝSLEDKY
Pacienti
Vyšetření hladin specifického IgE bylo provedeno celkem u 81 pacientů s diagnózou AD – 40 mužů a 41 žen s průměrným věkem 41,7 roku (11–76 roků) a s průměrným indexem SCORAD 39,0 bodů (s. d. 13,1). Mírná forma AD byla zjištěna u 13,6 % pacientů, středně těžká forma u 55,6 % pacientů a těžká forma u 30,9 % pacientů. Alergická rýma byla diagnostikována u 80,2 % pacientů a bronchiální astma u 56,8 % pacientů. Senzibilizace na vyšetřované alergeny stanovením sIgE byla prokázána u 92,6 % pacientů. U 7,4 % pacientů nebyla detekována pozitivní reakce proti vyšetřovaným molekulárním komponentám (tab. 1).
Table 1. Charakteristika souboru pacientů s atopickou dermatitidou 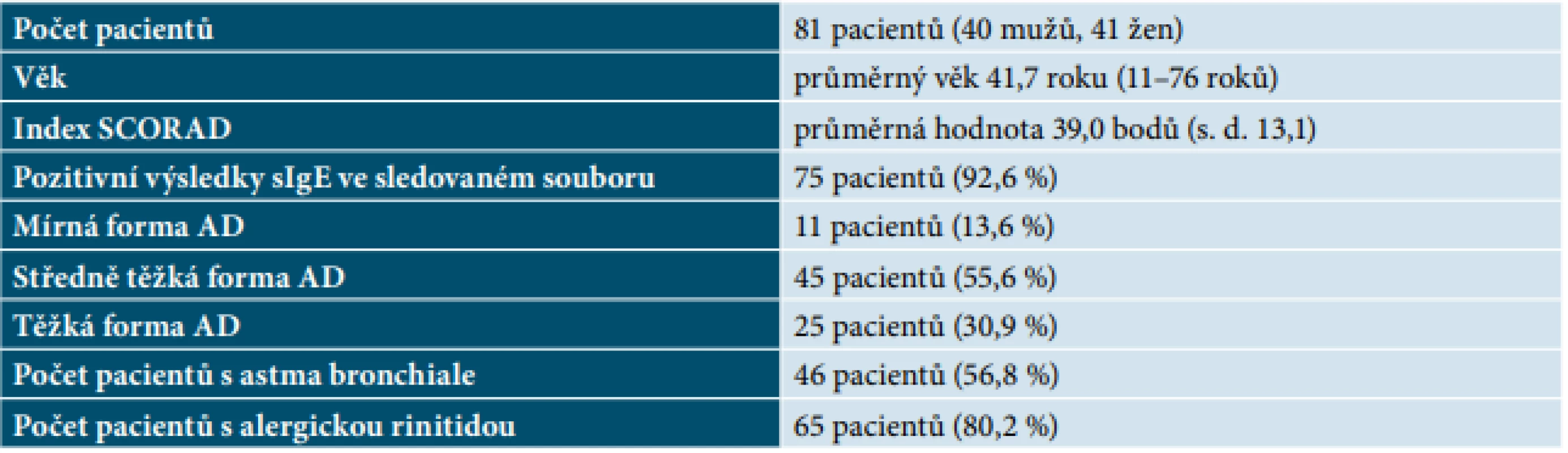
Zhodnocení senzibilizace na molekulární komponenty podle závažnosti atopické dermatitidy
Pro zhodnocení senzibilizace podle tíže atopické dermatitidy byli pacienti rozděleni do tří skupin podle indexu SCORAD. Ve skupinách byl v porovnání mírné až těžké formy AD viditelný trend k vyšší četnosti senzibilizace. Počet negativních a pozitivních reakcí specifického IgE (nízká, střední a vysoká pozitivita) u mírné, středně těžké a těžké formy atopické dermatitidy je uveden v tabulce 2. U pacientů trpících mírnou formou AD bylo 92,9 % reakcí negativních, 1,3 % s nízkou pozitivitou, 4,7 % se střední pozitivitou a 1,0 % s vysokou pozitivitou. Ve střední formě AD bylo 86,5 % reakcí negativních, 2,5 % s nízkou pozitivitou, 7,0 % se střední pozitivitou a 4,1 % s vysokou pozitivitou. V těžké formě AD bylo 80,4 % reakcí negativních, 2,6 % s nízkou pozitivitou, 8,8 % se střední pozitivitou a 8,2 % s vysokou pozitivitou. Byl potvrzen významný vztah mezi závažností AD a hladinou specifických IgE protilátek proti molekulárním komponentám (p-hodnota = 0,0001). Významně vyšší počet pozitivních reakcí s vysokou hladinou sIgE protilátek (≥ 15 ISU-E) byl prokázán u pacientů se středně těžkou a těžkou formou AD.
Table 2. Počet negativních a pozitivních reakcí sIgE (semikvantitativních tříd) stanovených metodou ISAC hodnocených podle závažnosti AD u všech pacientů 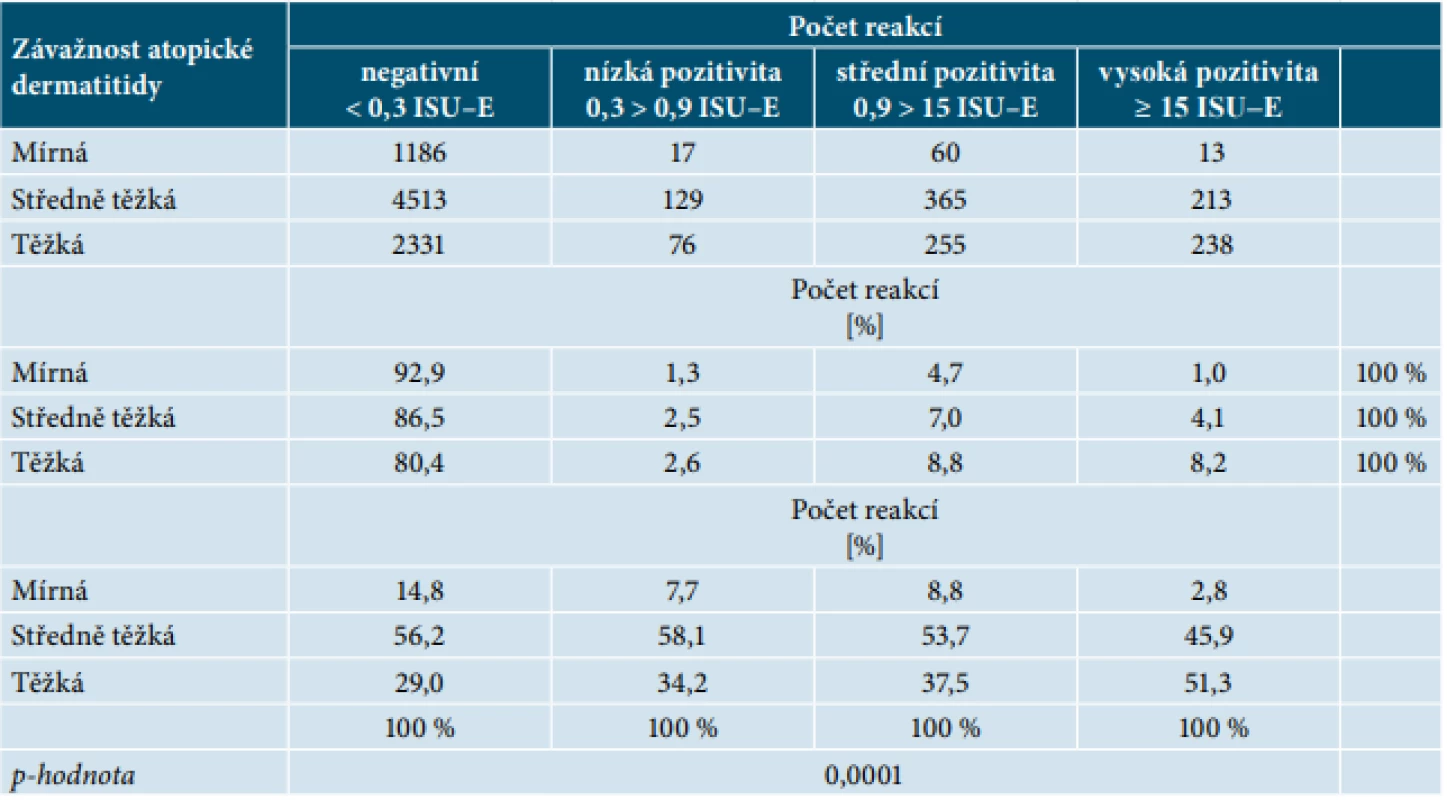
Vysvětlivky:
Celkový počet reakcí sIgE činil 9 072 (81 pacientů, u každého pacienta bylo vyšetřeno 112 molekulárních komponent). U středně těžké a těžké formy AD byl prokázán statisticky významně častější výskyt pozitivních reakcí s vysokou hladinou sIgE protilátek (≥ 15 ISU-E).Vzhledem k velkému množství naměřených dat nejsou v přehledných tabulkách senzibilizačního profilu podle závažnosti AD zmíněny všechny komponenty, ale pouze přehled 30 nejčastěji se vyskytujících (tab. 3, 4, 5). Celkový počet senzibilizací byl u mírné formy na 40 komponent, u středně těžké formy na 93 komponent a u těžké formy na 98 komponent. V každé skupině dle závažnosti AD bylo zhodnoceno pořadí relativních četností výskytu molekulárních komponent. Statistické rozdíly v pořadí zastoupení molekulárních komponent prokázány nebyly.
Table 3. Přehled 30 nejčastěji zastoupených molekulárních komponent u mírné formy atopické dermatitidy** 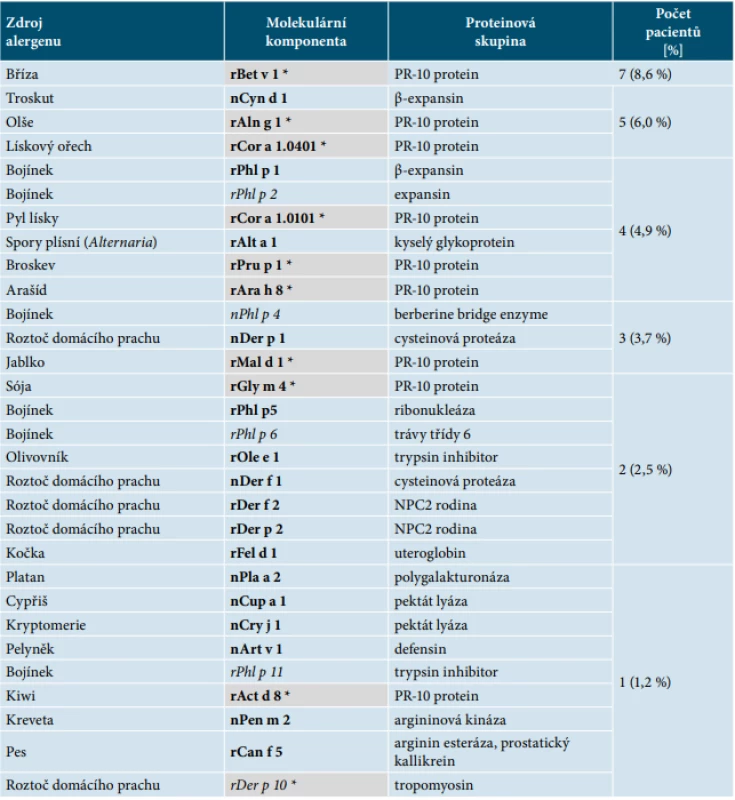
**11 pacientů = 13,6 %, celkový počet 81 pacientů. Celkový počet senzibilizací byl u mírné formy na 40 komponent.
Vysvětlivky:
Šedá políčka se symbolem * – znázorňují převážně zkříženě reagující komponenty (např. rBet v 1).
Ostatní políčka – znázorňují převážně druhově specifické komponenty (např. rPhl p 1).
Tučně – jsou zvýrazněny hlavní alergeny (např. rPhl p 1).
Kurzivou – jsou zobrazeny vedlejší alergeny (např. rPhl p 11).Table 4. Přehled 30 nejčastěji zastoupených molekulárních komponent u středně těžké formy atopické derpatitidy** 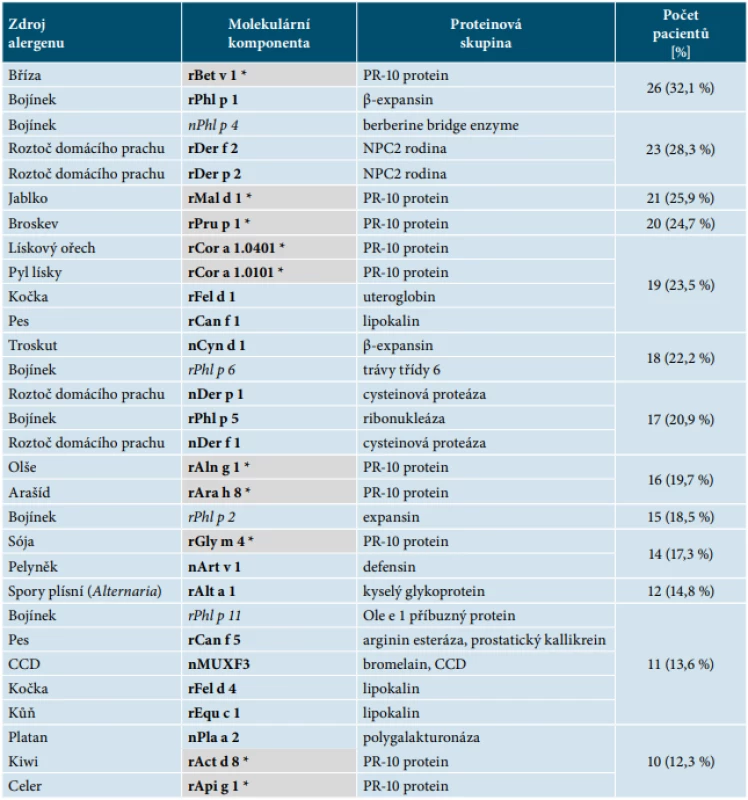
**45 pacientů = 55,6 %, celkový počet 81 pacientů. Celkový počet senzibilizací byl u středně těžké formy na 93 komponent.
Vysvětlivky:
Šedá políčka se symbolem * – znázorňují převážně zkříženě reagující komponenty (např. rBet v 1)
Bílá políčka – znázorňují převážně druhově specifické komponenty (např. rPhl p 1)
Tučně – jsou zvýrazněny hlavní alergeny (např. rPhl p 1)
Kurzivou – jsou zobrazeny vedlejší alergeny (např. rPhl p 11)Table 5. Přehled 30 nejčastěji zastoupených molekulárních komponent u těžké formy atopické dermatitidy** 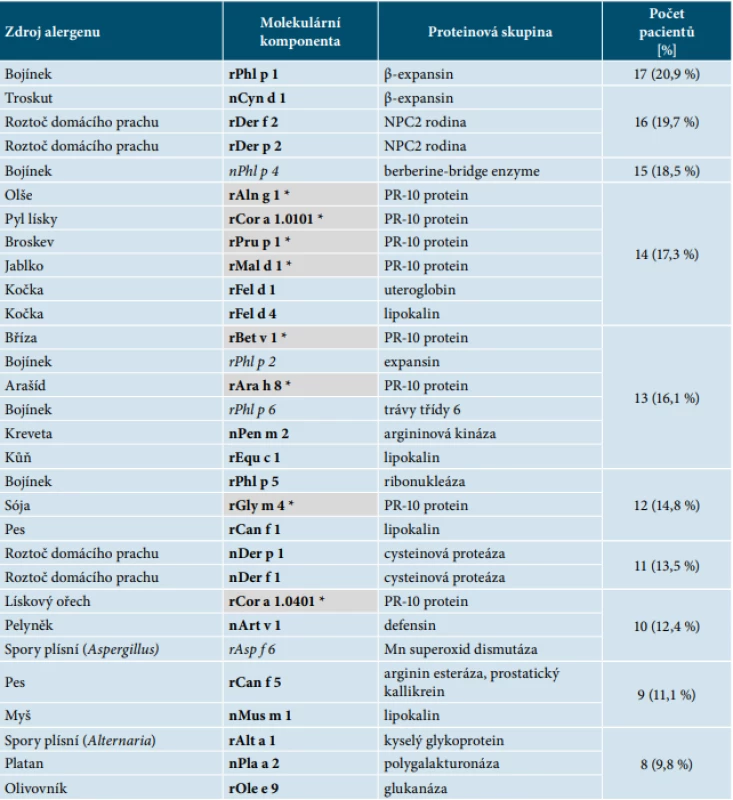
** 25 pacientů = 30,9 %, celkový počet 81 pacientů. Celkový počet senzibilizací byl u těžké formy na 98 komponent.
Vysvětlivky:
Šedá políčka se symbolem * – znázorňují převážně zkříženě reagující komponenty (např. rBet v 1).
Ostatní políčka – znázorňují převážně druhově specifické komponenty (např. rPhl p 1).
Tučně – jsou zvýrazněny hlavní alergeny (např. rPhl p 1).
Kurzivou – jsou zobrazeny vedlejší alergeny (např. rAsp f 6).U mírné formy AD (11 pacientů, 13,6 %) převažovala senzibilizace na pylové alergeny, především na hlavní alergen břízy rBet v 1, která patří do skupiny zkříženě reagujících Bet v 1 homologních proteinů (PR-10 protein). Stupeň zkřížené reaktivity s ostatními alergeny ze skupiny PR-10 proteinů pylu stromů (rAln g 1, rCor a 1.0101) a potravin rostlinného původu (rCor a 1.0401, rPru p 1, rMal d 1, rGly m 4, rAra h 8) je vysoký, čemuž nasvědčuje jejich častý výskyt ve skupině. Vysoký stupeň zkřížené reaktivity s β-expansiny z jiných trav (rPhl p 1) by mohl být vysvětlením časté senzibilizace na pyl trávy troskut (nCyn d 1). Početně méně často byla pozorována senzibilizace na hlavní alergeny pylu bojínku (rPhl p 1) v porovnání s těžšími formami AD, viz tab. 3.
Ve skupině se středně těžkou formou AD (45 pacientů, 55,6 %) byla detekována nejvyšší četnost pozitivních reakcí na hlavní alergen bojínku (rPhl p 1) a zároveň na hlavní alergen břízy (rBet v 1). Vyšší byla také četnost senzibilizace na roztoče domácího prachu rDer f 2 a rDer p 2 z NPC2 rodiny (Niemann-Pick disease type C2), kteří dominují především u těžké formy AD. Podobně jako u mírné formy byla častá senzibilizace na Bet v 1 homologní proteiny pylu stromů a potravin rostlinného původu. Často zastoupenými byly také hlavní alergeny kočky (rFel d 1, uteroglobin) a psa (rCan f 1, lipokalin) – viz tabulka 4.
Ve skupině s těžkou formou AD (25 pacientů, 30,9 %) byly s vysokou četností zastoupeny pozitivní sIgE reakce na komponenty bojínku, konkrétně na hlavní alergeny rPhl p 1, rPhl p 5 a na vedlejší alergeny rPhl p 2, nPhl p 4, rPhl p 6. Dále dominovala již zmíněná senzibilizace na hlavní alergeny roztočů domácího prachu rDer f 2 a rDer p 2, méně pak na hlavní alergeny nDer f 1 a nDer p 1 (cysteinové proteázy). Výrazná senzibilizace na komponentu trávy troskut nCyn d 1 (součástí vyšetření ISAC metody), je nejspíše i v tomto případě důsledkem vysoké zkřížené reaktivity s jinými β-expansiny pylu trav. Troskut v Čechách prakticky vůbec neroste, pouze ojediněle na jižní Moravě, jde především o trávu subtropických oblastí. Četné byly také senzibilizace na pyly stromů a potraviny rostlinného původu obsahující zkříženě reagující PR-10 proteiny. Značná byla také senzibilizace proti hlavním zvířecím alergenům kočky rFel d 1 (uteroglobin) a rFel d 4 (lipokalin), koně rEqu c 1 (lipokalin) a psa rCan f 1 (lipokalin). Z potravinových alergenů byla často detekována sIgE odpověď na vedlejší potravinový alergen krevet nPen m 2 (argininová kináza) – viz tabulka 5.
Hodnotili jsme relativní četnost výskytu pozitivních reakcí na molekulární komponenty u pacientů s mírnou, středně těžkou a těžkou formou atopické dermatitidy. U většiny molekulárních komponent byla zaznamenána zvyšující se relativní četnost pozitivních reakcí od mírné po středně těžkou až těžkou formu AD (tab. 6 a 7). Významný rozdíl ve výskytu byl však potvrzen pouze u těchto molekulárních komponent: rDer f 2 a rDer p 2 (roztoči domácího prachu), nPen m 2 (kreveta), rFel d 4 (kočka), rCan f 1 (pes), rEqu c 1 (kůň), nMus m 1 (myš), rBet v 2 (bříza), rAlt v 6 (Alternaria), rAsp f 6 (Aspergillus), nTri a aA_TI (pšenice), nGal d 2 (vaječný bílek), rAra h 1 (arašíd) a rVes v 5 (jed vosy). Uvedené molekulární komponenty se vyskytují významně častěji u pacientů s těžkou formou AD (tab. 6 a s ní související graf na obrázku 2, p-hodnota < 0,05). Relativní četnost nejčastěji zastoupených molekulárních komponent bez statisticky prokázaného významného rozdílu u pacientů s mírnou, středně těžkou a těžkou formou AD je ukázána v tabulce 7 a schematicky znázorněna v souvisejícím grafu na obrázku 3.
Image 2. Znázornění zastoupení molekulárních komponent u mírné, středně těžké a těžké formy AD – statisticky významný rozdíl (p-hodnota < 0,05). 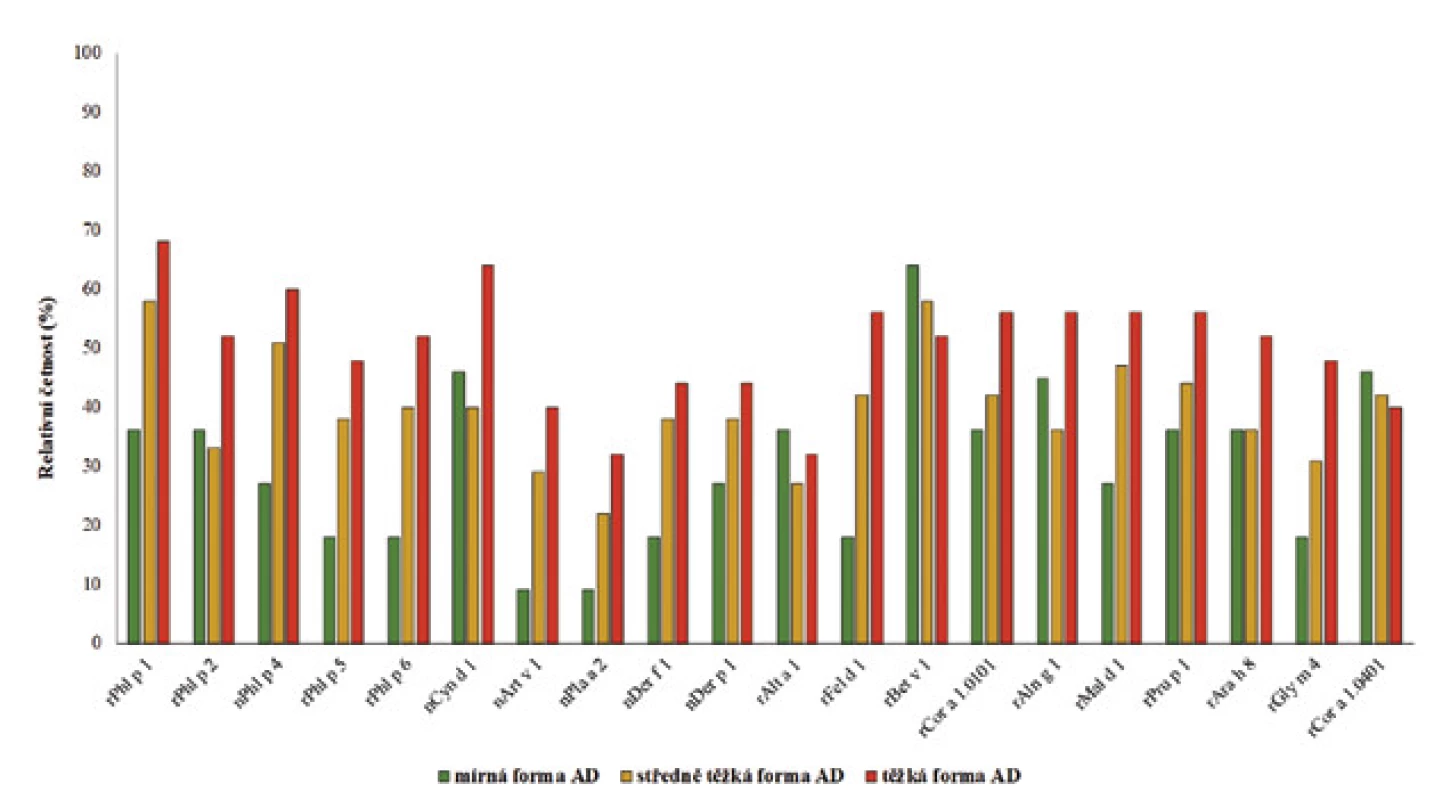
Image 3. Znázornění nejčastěji zastoupených molekulárních komponent u mírné, středně těžké a těžké formy AD – statisticky významný rozdíl neprokázán (p-hodnota > 0,05). 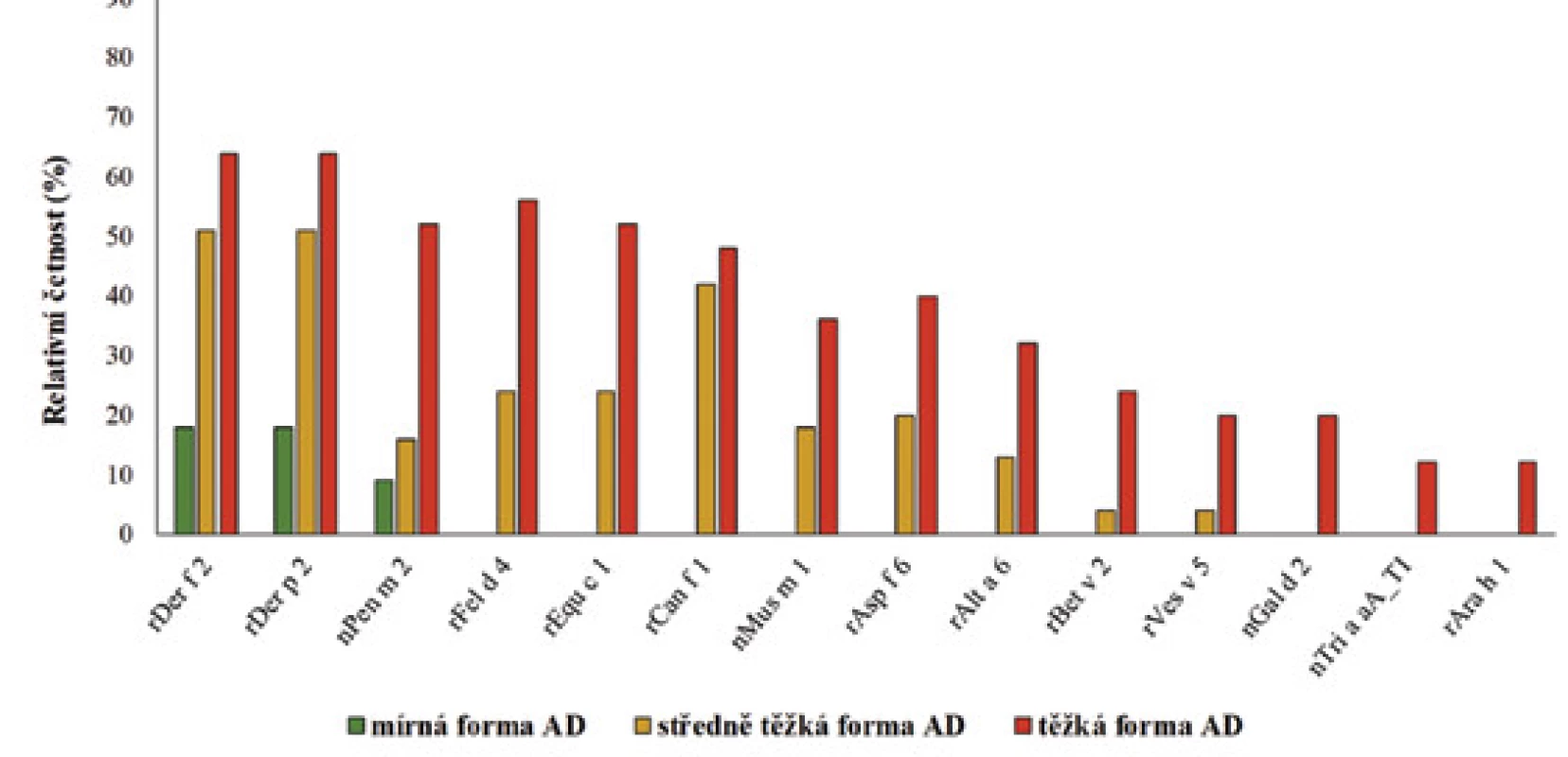
Table 6. Relativní četnost molekulárních komponent se statisticky významným rozdílem ve výskytu u mírné, středně těžké a těžké formy AD (p-hodnota < 0,05) 
Vysvětlivky:
Šedá políčka se symbolem * – znázorňují převážně zkříženě reagující komponenty (např. rBet v 2).
Ostatní políčka – znázorňují převážně druhově specifické komponenty (např. rCan f 1).
Tučně – jsou zvýrazněny hlavní alergeny (např. rFel d 4).
Kurzivou – jsou zobrazeny vedlejší alergeny (např. rAsp f 6).Table 7. Relativní četnost nejčastěji zastoupených molekulárních komponent u mírné, středně těžké a těžké formy AD** 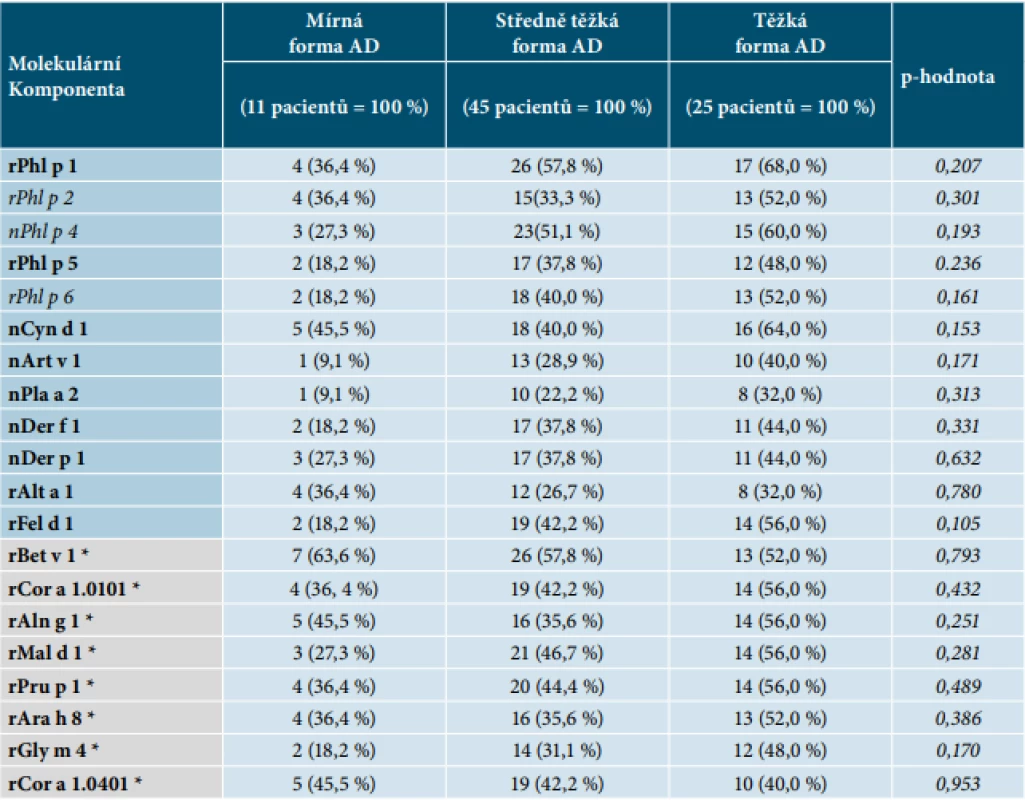
**Neprokázán statisticky významný rozdíl (p-hodnota >0,05).
Vysvětlivky:
Šedá políčka se symbolem * – znázorňují převážně zkříženě reagující komponenty (např. rBet v 1).
Ostatní políčka – znázorňují převážně druhově specifické komponenty (např. rPhl p 1).
Tučně – jsou zvýrazněny hlavní alergeny (např. rPhl p 1).
Kurzivou – jsou zobrazeny vedlejší alergeny (např. rPhl p 2).DISKUSE
Atopická dermatitida je chronické zánětlivé kožní onemocnění s charakteristickými klinickými projevy a významným zapojením imunitních mechanismů. V počátečním stadiu je u geneticky disponovaných jedinců pravděpodobnou příčinou narušení kožní obranné bariéry vnějšími i vnitřními faktory, které vede k abnormální imunitní odpovědi. Je prolomena imunitní tolerance vůči přirozeným agens z vnějšího světa, alergenům. Imunitní odpověď je polarizována směrem k mechanismům zapojujícím buňky vrozené imunity, jako jsou dendritické buňky, ILC (Innate Lymphoid Cells) typu 2, žírné buňky, bazofilní granulocyty a posléze i eozinofilní granulocyty. Aktivují se i mechanismy adaptivní imunitní odpovědi, při které dochází především k aktivaci a klonální expanzi T lymfocytů specifických pro dané alergeny s následnou funkční polarizací do subsetu Th2. T lymfocyty subsetu Th2 regulují izotypový přesmyk v B lymfocytech rozpoznávajících alergenové epitopy. Výsledkem je tvorba IgE protilátek namířených proti vyvolávajícím alergenům. To je typickým projevem rozvíjejícího se alergického zánětu. Celková koncentrace IgE a zejména hladiny IgE protilátek specifických pro alergeny jsou významným diagnostickým nástrojem. Klíčové je nicméně zhodnocení klinického stavu a podrobná cílená anamnéza doplněná kožními, popř. expozičními testy. Rutinní je stanovení specifických IgE protilátek proti směsným, extraktovým alergenům, které u většiny pacientů dostačuje k potvrzení diagnózy.
Multiplexové metody mohou být významným obohacením laboratorní diagnostiky alergických stavů, jsou doporučovány u nejasných a komplikovaných pacientů, u neshod mezi výsledky získanými základními přístupy, pro možné zachycení neočekávaných alergenních specificit, a také pro zhodnocení senzibilizačního profilu pacienta. Použitím této metody lze získat v jednom kroku podrobný profil pacienta vyjádřený pomocí molekulárně definovaných cílů, což při hodnocení vyžaduje na straně lékaře nemalou míru erudice a detailních znalostí o jednotlivých alergenech. Zároveň může odhalit i nečekané reaktivity a v optimálním případě upřesnit cílové alergeny u pacientů zařazených do idiopatických forem alergického onemocnění. Biočipové metody postupně nacházejí uplatnění u respiračních forem alergického zánětu a také u podezření na potravinové alergie. Je pravděpodobné, že se multiplexové metody ukáží jako užitečné i u kožních projevů alergického zánětu. Na druhé straně limitací tohoto přístupu je fixně daný profil alergenů a semikvantitativní výsledky hladin specifického IgE. Nemalé náklady, které se u biočipu pohybují kolem 2 000–3 000 Kč na vyšetření jednoho pacienta, mohou být kompenzovány výhodou vyššího počtu výsledků, které tvoří komplexní obraz senzibilizace pacienta, byť s rizikem nižší senzitivity. V případě, že je třeba vyšetřit cílené spektrum sIgE proti molekulárním komponentám vycházející z anamnézy či jiných vyšetření, lze za podobné náklady získat šest až sedm jednotlivých výsledků sIgE protilátek s výhodou vyšší senzitivity [14].
V naší práci byly využity multiplexní technologie, které umožňují zhodnocení senzibilizačního profilu pacientů s AD pomocí analýzy sIgE protilátek proti 112 molekulárně definovaným alergenům z 51 různých alergenních zdrojů s využitím biočipu ISAC od firmy Phadia. Tato metoda pracuje s velmi malým množstvím vzorku, což je významným benefitem. Cílem naší studie bylo zhodnotit přínos vyšetření specifických IgE protilátek proti molekulárním komponentám metodou ISAC a zároveň porovnat senzibilizační profily u pacientů s mírnou, středně těžkou a těžkou formou atopické dermatitidy. Podle literárních údajů však systém ISAC vykazuje nízkou senzitivitu při pátrání po senzibilizaci na kravské mléko a pšeničnou mouku, naopak může přinášet falešně pozitivní výsledky senzibilizací na zkříženě reagující alergeny ze skupiny PR-10 proteinů [5, 6, 13, 26, 37].
Dosavadní publikované studie zabývající se hodnocením senzibilizace multiplexními metodami jsou zaměřeny především na pacienty s respiračními projevy alergického zánětu. Prací týkajících se atopické dermatitidy je poskrovnu. Tematicky nejblíže byla publikace polských autorů, kteří hodnotili senzibilizační profily 19 pacientů s AD. Hladinu sIgE stanovili rovněž metodou ISAC a tíži onemocnění hodnotili taktéž indexem SCORAD. V této studii dominovaly alergeny zvířat (58 %), pylů stromů (47 %) a trav (42 %). Téměř polovina pacientů (47 %) odpovídala na zkříženě reagující komponenty a 10 % pacientů vykazovalo pozitivitu na druhově specifické alergeny [39].
V naší studii provedené na výrazně větším souboru (81 pacientů) byl potvrzen významný vztah mezi závažností AD a hladinou specifických IgE protilátek na molekulární komponenty. Významně vyšší počet pozitivních reakcí s vysokou hladinou specifického IgE (≥ 15 ISU–E) byl prokázán u pacientů se středně těžkou a těžkou formou AD. Pro zhodnocení, zda se významně liší pořadí pozitivních výsledků sIgE proti molekulárním komponentám u sledovaného souboru pacientů, jsme použili unikátní statistickou analýzu podle Worsleyho [40]. Testovali jsme, které molekulární komponenty patří do množiny alergenů s nejvyšší pravděpodobností pozitivního výsledku, tzn. se zvýšenou hladinou specifického IgE. Z analýzy vyplývá, že pořadí pozitivních výsledků molekulárních komponent v mírné, středně těžké a těžké formě AD vzhledem k velikosti sledovaného souboru nebylo statisticky významné. Ve skupině pacientů trpících mírnou formou AD byly zaznamenány četné reakce proti inhalačním alergenům pylů trav, stromů a s nimi zkříženě reagujících alergenů ze skupiny PR-10 proteinů. Mezi hlavní alergeny pylu stromů z rodiny Bet v 1 homologních proteinů, vyšetřovaných testem ISAC, patří bříza (rBet v 1), olše (rAln g 1) a líska (rCor a 1.0101). Zajímavé je, že v případě hlavního alergenu břízy jsme rozdíly v zastoupení rBet v 1 u mírné, středně těžké a těžké formy AD neprokázali. Podle očekávání byly spolu s alergenem břízy často detekovány také zkříženě reagující potravinové alergeny rostlinného původu z rodiny PR-10 proteinů (jablko, broskev, lískový ořech, arašíd, sója), které způsobují především lokální projevy alergické reakce a mohou vyvolat řadu tzv. „pollen-food“ syndromů [15]. Výsledky senzibilizačního profilu pacientů trpících mírnou formou AD naznačují, že k senzibilizaci proti inhalačním alergenům dochází prostřednictvím dýchacích cest, případně po požití potravy rostlinného původu ze skupiny PR-10 proteinů uvedených výše. Pacienti se středně těžkou a těžkou formou AD byli hojně senzibilizováni hlavními alergeny pylů trav, zároveň se zvyšovala četnost výskytu pozitivních reakcí proti alergenům roztočů domácího prachu a zvířecím alergenům. Bojínek luční je na biočipu zastoupený v osmi molekulárních komponentách, z kterých byla nejčastěji naměřena pozitivní reakce na hlavní alergeny rPhl p 1 (β-expansin), rPhl p 5 (ribonukleáza) a vedlejší alergeny rPhl p 2 (expansin), nPhl p 4 (berberine-bridge enzym) a rPhl p 6 (trávy třídy 6). Pozitivní reakce na vedlejší alergeny rPhl p 7 (polkalcin), rPhl p 11 (Ole e 1 příbuzný protein) a rPhl p 12 (profilin) byly méně časté. Molekulární komponenta rPhl p 1 je považována za iniciátor senzibilizačního procesu a za diagnostický marker identifikace pacientů se skutečnou senzibilizací na pyl bojínku lučního. Hlavním alergenem troskutu prstnatého je nCyn d 1 z rodiny β-expansinů, jež se běžně vyskytuje v subtropických oblastech, naopak pro náš region je vzácný [33]. Důvodem časté senzibilizace na nCyn d 1 může být vysoká zkřížená reaktivita s β-expansiny z jiných trav, především s hlavním alergenem bojínku rPhl p 1, který se nejčastěji vyskytoval u pa-cientů s těžkou formou AD.
Pouze u pacientů trpících těžkou formou AD jsme prokázali statisticky významný rozdíl ve výskytu molekulárních komponent. Vysoká četnost pozitivních reakcí byla zaznamenána proti hlavním inhalačním alergenům roztočů rDer f 2 a rDer p 2 (NPC2 rodina), psa rCan f 1 (lipokalin), kočky rFel d 4 (lipokalin), koně rEqu c 1 (lipokalin), myši nMus m 1 (lipokalin) a také proti vedlejším alergenům břízy rBet v 2 (profilin), plísní Alternaria rAlt v 6 (enoláza), Aspergillus rAsp f 6 (Mn superoxid dismutáza) a potravinovému alergenu krevet nPen m 2 (argininová kináza). Dále byly potvrzeny významné rozdíly, avšak s nižší četností pozitivních případů, proti hlavním potravinovým alergenům pšenice nTri a aA_TI (trypsin/α-amylázový inhibitor), arašídu rAra h 1 (7S globulin), vaječného bílku nGal d 2 (ovalbumin) a hlavnímu alergenu vosy rVes v 5 (antigen 5). Výsledek analýzy mohl být ovlivněn skutečností, že u některých alergenů byly zaznamenány nulové četnosti pozitivních hodnot, což se projevilo zejména při srovnání mírné, středně těžké a těžké formy AD. Předpokládáme, že tyto problémy vyřeší plánované rozšíření kohorty pacientů. Komponenta nTri a aA_TI je součástí vyšetření ISAC testu a patří mezi trypsin/α-amylázové inhibitory pšenice. Její název nevychází z nomenklatury WHO/IUIS, ale z označení od firmy Phadia [38].
Výsledky porovnání výskytu molekulárních komponent u mírné, středně těžké a těžké formy AD naznačují, že senzibilizace na roztoče by mohla být klíčová pro rozvoj polysenzibilizace u těžkých forem AD. Roztoči mají schopnost narušovat slizniční bariéru, což může vést k senzibilizaci inhalačními alergeny (např. pyly, zvířata, plísně) jinou cestou než respirační. Jsou zároveň nosiči mikrobiálních a plísňových antigenů, respektive patogenních molekulárních vzorů (PAMPs, Pathogen-Associated Molecular Patterns), čímž vstupují i do mechanismů přirozené imunity [4, 20]. Alergeny roztočů z rodu Dermatophagoides (D.) pocházejí z výkalů a tělesných struktur roztočů. V testu ISAC jsou vyšetřovány druhy D. farinae a D. pteronyssinus. Jejich molekulární antigeny můžeme rozdělit do skupin podle proteinových rodin. Do skupiny 1 (cysteinové proteázy) se řadí hlavní molekulární komponenty nDer f 1 a nDer p 1, které vykazují 85% homologii. Do skupiny 2 řadíme komponenty rDer f 2 a rDer p 2 (NPC2 rodina), které vykazují až 90% homologii v rámci skupiny [32]. Mnohé enzymy roztočů mají destrukční účinek na epitel dýchacích cest (rozrušují mezibuněčné spoje), čímž alergenům usnadňují hlubší průnik do organismu [7, 19]. Molekulární komponenty nDer p 1 a rDer p 2 jsou přítomny ve výkalech roztočů a jsou silně asociovány s vazbou na astma bronchiale. U pacientů s AD a alergií na roztoče má zásadní roli porucha kožní bariérové funkce. Předpokládá se, že na rozdíl od rinitidy či astma bronchiale se u atopické dermatitidy uplatňují především molekulární komponenty obsažené v tělech roztočů nikoli ve výkalech (Der p 11, Der p 14, Der p 18), ačkoli jejich přesná úloha v patogenezi dermatitidy zatím není zcela objasněna. Tyto zmíněné komponenty nejsou obsaženy v testu ISAC, proto je s našimi výsledky nelze porovnat [4, 20]. Vysoká míra homologie tropomyozinů mezi roztoči, korýši a měkkýši může vyvolat projevy zkřížené inhalačně-potravinové alergie, kdy například u jedince senzibilizovaného alergenem rDer p 10 může po konzumaci různých „plodů moře“ nastat alergická reakce [3]. Pacienti s těžkou formou AD byli zároveň výrazně senzibilizováni hlavními zvířecími alergeny, které patří do proteinových rodin uteroglobinů, lipokalinů a kallikreinů. Zejména molekulární komponenty z rodiny lipokalinů jsou častými hlavními alergeny řady živočichů a homologie v rámci skupiny může být důvodem zkřížené senzibilizace mezi různými savčími druhy. Do této skupiny řadíme například alergeny rEqu c 1 (kůň), rCan f 1 a rCan f 6 (pes), rFel d 4 (kočka) a nMus m 1 (myš), které se tvoří ve slinných žlázách. Molekula rFel d 1 (uteroglobin) je hlavní alergen kočky, který je produkován kůží i slinnými žlázami. rCan f 5 (arginin esteráza/prostatický kallikrein) je považován za hlavní alergen psa (samců), jenž je secernován do moči [25].
Metodu ISAC použili i korejští autoři ve studii provedené na 25 pacientech s AD. Hladinu sIgE protilátek měřili metodami ISAC a MAST-EIA (Multiple Allergen Simultaneous Test-Enzyme Immunoassay). Získali senzibilizační profily pacientů, kde dominovaly alergeny roztočů, pyly trav a spory plísní [11]. Multiplexním vyšetřením molekulárních komponent se zabývala také skupina německých autorů, kteří dosáhli podobných výsledků, jako jsou v naší studii. V souboru 20 pacientů s AD měřili hladinu sIgE singleplexní metodu ImmunoCAP (UniCAP) a multiplexním systémem ISAC. Závažnost onemocnění hodnotili rovněž indexem SCORAD. U pacientů dominovaly sIgE protilátky především proti inhalačním alergenům rostlinného původu (troskut, bojínek, pyl lísky, olše, bříza) a alergenům roztočů, plísní, kočky a psa [31]. Nizozemští autoři se zaměřili na zhodnocení senzibilizace na potravinové alergeny u 211 pacientů s AD ve vztahu k její závažnosti. Specifické IgE protilátky stanovili metodou ISAC, závažnost AD určili podle skórovacího systému SASSAD (Six Area, Six Sign AD). Senzibilizace na potraviny byla prokázána u 74,4 % pacientů. Dominovaly především alergeny rostlinného původu ze skupiny PR-10 proteinů (63,5 %) a alergeny živočišného původu (35,5 %). Při porovnání výskytu alergenů podle závažnosti AD bylo u těžké formy AD prokázáno významně vyšší zastoupení senzibilizace na arašídy (rAra h 1) a kravské mléko (nBos d) (35). V naší studii jsme podobné výsledky neprokázali.
Můžeme si položit otázku, jak zařadit vyšetření pomocí molekulární komponentové diagnostiky do běžné praxe. V současnosti převládá diagnostický postup při podezření na alergická onemocnění tzv. od „symptomů k molekulám“, který zahrnuje:
- klinické vyšetření pacienta,
- kožní testy (SPT, Skin Prick Test) a vyšetření IgE protilátek,
- stanovení sIgE protilátek proti molekulárním komponentám.
Skupina rakouských autorů se zabývala posouzením nového alternativního diagnostického přístupu tzv. od „molekul k symptomům“, který byl navržen EAACI (European Academy of Allergy and Clinical Immunology) v příručce pro molekulární diagnostiku alergií [25]. Z výsledků studie vyplývá, že postup od „molekul k symptomům“ by mohl najít uplatnění především při ověření klinické suspekce na alergické onemocnění u dětí, seniorů a zvláště u pacientů s atopickou dermatitidou [28].
Vyšetření molekulárních komponent se zdá být slibným nástrojem pro diagnostiku potravinových alergií, která umožňuje identifikovat senzibilizační profil a zároveň odhadnout riziko imunologické odpovědi na daný alergen. Diagnostická přesnost těchto laboratorních testů se v různých studiích liší, a tudíž jejich klinická užitečnost není zcela jasná. V přehledovém článku se skupina britských autorů zaměřila na diagnostickou přesnost komponentové diagnostiky potravinových alergií [14]. Práce shrnuje výsledky jedenácti studií zabývajících se laboratorním vyšetřením senzibilizace na kravské mléko, vejce, ořechy, arašídy a korýše. Hladiny specifických IgE protilátek proti molekulárním komponentám byly analyzovány různými metodami ImmunoCAP (Phadia) a ISAC (Phadia). Potravinová alergie byla u většiny respondentů (> 80 %) potvrzena dvojitě slepým placebem kontrolovaným potravinovým testem (DBPCFC). Z přehledové studie vyplývá, že některé komponenty mají potenciál diagnostikovat alergie na vaječný bílek nGal d 1 [2], arašídy nAra h 6 [22], lískové ořechy rCor a 14 [24], kravské mléko nBos d 4 [1] – v metodě ISAC s vysokou specificitou, ale velmi nízkou senzitivitou. V současné době však není dostatek metodologicky spolehlivých důkazů, aby bylo možné vyvodit konečné závěry. Je třeba zdůraznit, že v tomto příspěvku jsme se zaměřili pouze na míru senzibilizace a nikoli na její klinický význam. Otázkou diagnostické přesnosti multiplexního stanovení specifických IgE protilátek proti molekulárně definovaným komponentám potravin se budeme zabývat v následujících publikacích. Zvláště se budeme věnovat hodnocení výsledků expozičních testů na sledované potraviny (arašídy, vlašské ořechy, lískové ořechy, jablko, sója, celer a další) v porovnání s výsledky ISAC testu.
ZÁVĚR
Vyhodnotili jsme výsledky vyšetření pomocí molekulární komponentové diagnostiky u pacientů s AD. Významně vyšší počet pozitivních reakcí v metodě ISAC s vysokou hladinou specifického IgE (≥ 15 ISU-E) byl prokázán u pacientů se středně těžkou a těžkou formou AD. U pacientů s těžkou formou AD byla prokázána statisticky významně častější senzibilizace na molekulární komponenty: rDer f 2 a rDer p 2 (roztoči), nPen m 2 (kreveta), rFel d 4 (kočka), rCan f 1 (pes), rEqu c 1 (kůň), nMus m 1 (myš), rBet v 2 (bříza), rAlt v 6 (Alternaria), rAsp f 6 (Aspergillus), rVes v 5 (jed vosy), nTri a aA_TI (pšenice), nGal d 2 (vaječný bílek) a rAra h 1 (arašíd). U mírné formy AD dominovaly spíše inhalační alergeny pylů trav (bojínek Phl p 1, rPhl p 1 a s nimi zkříženě reagující trávy) a stromů (bříza Bet v 1, rBet v 1, a s nimi zkříženě reagující stromy olše Aln g 1, rAnl g 1, rCor a 1.0101). Vyšetření specifických IgE protilátek multiplexní metodou ISAC doporučujeme vyšetřovat u dospělých trpících těžkou formou atopické dermatitidy, kdy zásadní roli v senzibilizaci mohou hrát především hlavní alergeny pylů trav, stromů, roztočů, kočky, psa, koně a spor plísní. Naopak u mírné formy se zdá přínosné se v klinické praxi spíše zaměřit na to, zda ekzémové projevy nesouvisí s alergií na hlavní alergeny pylu trav (bojínek) a stromů (bříza s bohatou zkříženou reaktivitou s potravinami rostlinného původu v rámci Bet v 1 homologie).
Poděkování
Práce byla podpořena programem PROGRES Q40/10.
Prohlášení o střetu zájmů
Autoři v souvislosti s tématem práce v posledních 12 měsících nespolupracovali s žádnou farmaceutickou firmou.
Do redakce došlo dne 30. 4. 2020.
Adresa pro korespondenci:
doc. MUDr. Jarmila Čelakovská, Ph.D.
Klinika nemocí kožních a pohlavních
Univerzita Karlova, LF v Hradci Králové
FN Hradec Králové
Sokolovská 581
500 05 Hradec Králové
e-mail:jarmila.celakovska@seznam.cz
Sources
1. ALESSANDRI, C., SFORZA, S., PALAZZO, P. et al. Tolerability of a fully maturated cheese in cow’ s milk allergic children: biochemical, immunochemical, and clinical aspects. PLOS ONE, 2012, 7(7), p. 1–14.
2. ALESSANDRI, C., ZENNARO, D., SCALA, E. et al. Ovomucoid (Gal d 1) specific IgE detected by microarray system predict tolerability to boiled hen’s egg and an increased risk to progress to multiple environmental allergen sensitisation. Clinical & Experimental Allergy, 2012, 42, p. 441–450.
3. AYUSO, R., REESE, G., LEONG-KEE, S., PLANTE, M., LEHRER, S. B. Molecular basis of arthropod cross-reactivity: IgE-binding cross-reactive epitopes of shrimp, house dust mite and cockroach tropomyosins. International Archives of Allergy and Immunology, 2002, 129, p. 38–48.
4. BANERJEE, S., RESCH, Y., CHEN, K. W. et al. Der p 11 is a major allergen for house dust mite-allergic patients suffering from atopic dermatitis. Journal of Investigative Dermatology, 2015, 135(1), p. 102–109.
5. BERNEDER, M., BUBLIN, M., HOFFMANN-SOMMERGRUBER, K., HAWRANEK, T., LANG, R. Allergen chip diagnosis for soy-allergic patients: Gly m 4 as a marker for severe food-allergic reactions to soy. International Archives of Allergy and Immunology, 2013, 161, p. 229–233.
6. Blankestijn, M. A., Knulst, A. C., Knol, E. F. et al. Sensitization to PR‑10 proteins is indicative of distinctive sensitization patterns in adults with a suspected food allergy. Clinical and Translational Allergy, 2017, 7(42), p. 1–8.
7. Calderón, M. A., Linneberg, A., Kleine-Tebbe, J. et al. Respiratory allergy caused by house dust mites: What do we really know? Journal of Allergy and Clinical Immunology, 2015, 136(1), p. 38–48.
8. CELAKOVSKA, J., BUKAC, J., ETTLER, K., VANECKOVA, J., ETTLEROVA, K., KREJSEK, J. Sensitisation to outdoor and indoor fungi in atopic dermatitis patients and the relation to the occurrence of food allergy to peanuts and walnuts. Mycoses, 2018, 61(9), p. 698–703.
9. CELAKOVSKA, J., BUKAC, J., ETTLER, K., VANECKOVA, J., KRCMOVA, I., ETTLEROVA, K. Sensitisation to fungi in atopic dermatitis patients over 14 years of age and the relation to the occurrence of food hypersensitivity reactions. Mycoses, 2018, 61(2), p. 88–95.
10. ČELAKOVSKÁ, J., BUKAČ, J., VAŇKOVÁ, R., KRČMOVÁ, I., KREJSEK, J., ANDRÝS, C. Sensitisation to molecular allergens of Alternaria alternata, Cladosporium herbarum, Aspergillus fumigatus in atopic dermatitis patients. Food and Agricultural Immunology, 2019, 30(1), p. 1097–1111.
11. CHOI, J., ROH, J., LEE, J. Clinical availability of component-resolved diagnosis using microarray technology in atopic dermatitis. Annals of Dermatology, 2014, 26(4), p. 437–446.
12. DODIG, S., ČEPELAK, I. The potential of component-resolved diagnosis in laboratory diagnostics of allergy. Biochemia Medica, 2018, 28(2), p. 1–9.
13. ERWIN, E. A, TRIPATHI, A., OGBOGU, P. U. et al. IgE antibody detection and component analysis in patients with eosinophilic esophagitis. Journal of Allergy and Clinical Immunology: In Practice, 2016, 3(6), p. 896–904.
14. FLORES, K. J., MCCLEARY, N., NWARU, B., STODDART, A., SHEIKH, A. Diagnostic accuracy, risk assessment, and cost-effectiveness of component-resolved diagnostics for food allergy: A systematic review. Allergy, 2018, 73(8), p. 1609–1621.
15. FUCHS, M. Potravinová alergie a intolerance. Praha: Mladá fronta, 2016. Edice postgraduální medicíny. ISBN 978-80-204-3757-0.
16. HAGE, M., HAMSTEN, C., VALENTA, R. ImmunoCAP assays: Pros and cons in allergology. Journal of Allergy and Clinical Immunology, 2017, 140(4), p. 974–977.
17. HANIFIN, J., RAJKA, G. Diagnostic features of atopic dermatitis. Acta Dermato-Venereologica, 1980, 92, p. 44–47.
18. HE, Y., LIU, X., HUANG, Y., ZOU, Z., CHEN, H., LAI, H., ZHANG, L., WU, Q., ZHANG, J., WANG, S., ZHANG, J., TAO, A., SUN, B. Reduction of the number of major representative allergens: From clinical testing to 3-dimensional structures. Mediators of Inflammation, 2014, p. 1–11.
19. HEWITT, C. R., BROWN, A. P., HART, B. J., PRITCHARD, D. I. A major house dust mite allergen disrupts the immunoglobulin E network by selectively cleaving CD23: innate protection by antiproteases. Journal of Experimental Medicine, 1995, 182(2), p. 1537–1544.
20. JACQUET, A. Innate Immune Responses in House Dust Mite Allergy. IRSN Allergy, 2013, p. 1–18.
21. JAKOB, T., FORSTENLECHNER, P., MATRICARDI, P., KLEINE-TEBBE, J. Molecular allergy diagnostics using multiplex assays: methodological and practical considerations for use in research and clinical routine. Allergo Journal International, 2015, 24, p. 320–332.
22. KUKKONEN, A. K., PELKONEN, A. S., KILJUNEN, S. M., VOUTILAINEN, H., MÄKELÄ, M. J. Ara h 2 and Ara 6 are the best predictors of severe peanut allergy: a double-blind placebo-controlled study. Allergy, 2015, 2(7), p. 1239–1245.
23. MARTÍNEZ-ARANGUREN, R., LIZASO, M., GOIKOETXEA, M., GARCÍA, B., CABRERA-FREITAG, P., TRELLEZ, O., SANZ, M. Is the determination of specific IgE against components using ISAC 112 a reproducible technique? PLOS ONE, 2014, 9(2), p. 1–7.
24. MASTHOFF, L. J. N., MATTSSON, L., ZUIDMEER-JONGEJAN, L. et al. Sensitization to Cor a 9 and Cor a 14 is highly specific for a hazelnut allergy with objective symptoms in Dutch children and adults. Journal of Allergy and Clinical Immunology, 2013, 132(2), p. 393-399.
25. MATRICARDI, P. M., KLEINE-TEBBE, J., HOFFMANN, H. J., VALENTA, R., HILGER, C., HOFMAIER, S. et al. EAACI Molecular Allergology User‘s Guide. Pediatric Allergy and Immunology, 2016, 27(23), p. 1–250.
26. MATSUO, H., TANAKA, A., KOHNO, K. et al. Sensitivity and specificity of recombinant ω-5 gliadin-specific IgE measurement for the diagnosis of wheat-dependent exercise-induced anaphylaxis. Allergy, 2008, 63, p. 233–236.
27. MELIOLI, G., BONIFAZI, F., BONINI, S., MAGGI, E., MUSSAP, M., PASSALACQUA, G., ROSSI, E., VACCA, A., CANONICA, G. The ImmunoCAP ISAC molecular allergology approach in adult multi-sensitized Italian patients with respiratory symptoms. Clinical Biochemistry, 2011, 44, p. 1005–1011.
28. MOTHES-LUKSCH, N., JORDAKIEVA, G., HINTERHÖLZL, L., JENSEN, A., HALLMANN, P., KUNDI, M., JENSEN-JAROLIM, E. Allergy diagnosis from symptoms to molecules, or from molecules to symptoms: a comparative clinical study. World Allergy Organization Journal, 2018, 11(22), p. 1–11.
29. ORANJE, A. P., GLAZENBURG, E. J., WOLKERSTORFER, A., WAARD-VAN DER SPEK, F. B. Practical issues on interpretation of scoring atopic dermatitis: The SCORAD index, objective SCORAD and the three-item severity score. British Journal of Dermatology, 2007, 157(4), p. 645–648.
30. OTT, H., BARON, J. M., HEISE, R., OCKLENBURG, C., STANZEL, S. et al. Clinical usefulness of microarray-based IgE detection in children with suspected food allergy. Allergy, 2008, 63(11), p. 1521–1528.
31. OTT, H., FÖLSTER-HOLST, R., MERK, H., BARON, J. Allergen microarrays: a novel tool for high-resolution IgE profiling in adults with atopic dermatitis. European Journal of Dermatology, 2010, 20(1), p. 54–61.
32. PANZNER, P., VACHOVÁ, M., VLAS, T., VÍTOVCOVÁ, P., BRODSKÁ, P., MALÝ, M. Cross-sectional study on sensitization to mite and cockroach allergen components in allergy patients in the Central European region. Clinical and Translational Allergy, 2018, 8(19), p. 1–9.
33. PANZNER, P., VACHOVÁ, M., VÍTOVCOVÁ, P., BRODSKÁ, P., VLAS, T. A comprehensive analysis of middle-European molecular sensitization profiles to pollen allergens. International Archives of Allergy and Immunology, 2014, 164(1), p. 74–78.
34. PATELIS, A., BORRES, M. P., KOBER, A., BERTHOLD, M. Multiplex component-based allergen microarray in recent clinical studies. Clinical and Experimental Allergy, 2016, 46(8), p. 1022–1032.
35. RÖCKMANN, H., GEEL, M. J., KNULST, A. C., HUISKES, J., BRUIJNZEEL-KOOMEN, C., BRUIN-WELLER, M. S. Food allergen sensitization pattern in adults in relation to severity of atopic dermatitis. Clinical and Translational Allergy, 2014, 4(1), p. 1–9.
36. Severity scoring of atopic dermatitis: the SCORAD Index (Consensus report of the European Task Force on Atopic Dermatitis). Dermatology, 1993, 186, p. 23–31.
37. WESTWOOD, M., RAMAEKERS, B., LANG, S. et al. ImmunoCAP® ISAC and Microtest for multiplex allergen testing in people with difficult to manage allergic disease: a systematic review and cost analysis. Health Technology Assessment, 2016, 20(67), p. 1–177.
38. WHO/IUIS Allergen Nomenclature Sub-Committee. Allergen Nomenclature. Allergen.org [online]. [cit. 2020-2-12]. Dostupné na www: http://www.allergen.org/
39. WOJCIECHOWSKA, M., ŻBIKOWSKA-GOTZ, M., MAREK-JÓZEFOWICZ, L., PRZYBYSZEWSKI, M., GOCKI, J., BARTUZI, Z. Allergic phenotypes in adult patients with atopic dermatitis, determined with the ISAC test (ImmunoCAP ISAC). Advances in Dermatology and Allergology, 2018, 35(4), p. 351–359.
40. WORSLEY, J. K. The power of likelihood ratio and cumulative sum tests for a change in a binomial probability. Biometrika, 1983, 70(2), p. 455–464.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2020 Issue 5-
All articles in this issue
- Collodion baby a jeho další vývoj
- Využití multiplexového systému ImmunoCAP ISAC k určení senzibilizace na molekulární komponenty související se závažností atopické dermatitidy
- Acrodermatitis chronica atrophicans s fibrózními uzly. Popis případu
- Klinický případ: Solitární ložisko na skrotu. Stručný přehled
- Ohlédnuti za workshopem ONYGENALES 2020: Pokroky v základním a klinickém výzkumu dermatofytů a dimorfních hub
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Acrodermatitis chronica atrophicans s fibrózními uzly. Popis případu
- Využití multiplexového systému ImmunoCAP ISAC k určení senzibilizace na molekulární komponenty související se závažností atopické dermatitidy
- Collodion baby a jeho další vývoj
- Klinický případ: Solitární ložisko na skrotu. Stručný přehled
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

