-
Medical journals
- Career
Epidemiologická a klinicko-patologická charakteristika pacientů s renálním karcinomem: analýza 544 případů z jednoho centra
Authors: A. Poprach 1; R. Lakomý 1; I. Selingerová 2; B. Dolečková 1; O. Bílek 1; O. Slabý 1; R. Héžová 1; P. Fabian 3; M. Staník 4; T. Pavlík 5; Z. Bortlíček 5; H. Mlčochová 1; D. Tkáč 6; R. Vyzula 1; I. Kiss 1; I. Kocák 1; I. Kocáková 1; M. Svoboda 1
Authors‘ workplace: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Ústav matematiky a statistiky, PřF MU Brno 2; Oddělení onkologické a experimentální patologie, Masarykův onkologický ústav, Brno 3; Uroonkologické oddělení, Masarykův onkologický ústav, Brno 4; Institut biostatistiky a analýz, MU Brno 5; Farmaceutická fakulta UK v Praze, Hradec Králové 6
Published in: Klin Onkol 2013; 26(2): 114-123
Category: Original Articles
Overview
Východiska:
Incidence renálního karcinomu je v České republice jedna z nejvyšších ve světě. Kurativní léčba je stále možná pouze chirurgicky, v paliativní léčbě bylo dosaženo dílčích úspěchů s cílenou terapií. Zatímco prognostické faktory a modely jsou běžně používané v klinické praxi, prediktivní biomarkery nebyly bohužel dosud nalezeny. Cílem naší práce bylo ověřit platnost vybraných prognostických faktorů na konsekutivním souboru pacientů české populace.Soubor pacientů a metody:
Do souboru bylo zařazeno 544 pacientů s RCC diagnostikovaných a/nebo léčených v našem ústavu v letech 2003 až 2010. Validovány byly jednotlivé klinické a histologické prognostické faktory a Hengův prognostický model.Výsledky:
Medián času sledování našeho souboru byl 42 měsíců (rozpětí 0,3–326 měsíců), medián věku diagnózy pacientů byl 62 let a téměř v 64 % se jednalo o muže. Zastoupení klinických stadií bylo následující:aI 46,5 %, II 10,7 %, III 13,1 %, IV 20 %. U 26,4 % pacientů stadia I–III nastal relaps onemocnění. Diagnostikován byl zejména světlobuněčný (84,6 %) a papilární karcinom (9,2 %). Chirurgickou léčbu iniciálně podstoupilo 95,8 % pacientů, systémová adjuvantní a paliativní léčba byla aplikována u 3,7, resp. 37,7 % pacientů. Paliativní cílenou terapii obdrželo celkem 163 pacientů (30 %). V první linii cílené léčby jsme dosáhli následujících mediánů TTP v měsících: sunitinib 10,8, sorafenib 6,3 a imunoterapie 5,2 měsíce. K nejvýznamnějším (p < 0,00001) prognostickým faktorům patřily: stadium onemocnění (HR = 9,61), velikost primárního tumoru (HR = 5,83), postižení lymfatických uzlin (HR = 8,26), přítomnost sarkomatoidních úseků v nádoru (HR = 7,29) a grading tumoru (HR = 4,0). Kromě nich jsme potvrdili i prognostický význam přítomnosti eozinofilních granulací v nádoru (HR = 1,91; p = 0,02). Při aplikaci Hengova prognostického modelu jsme u pacientů léčených cílenou terapií dosáhli podobných výsledků.Závěr:
Získaná epidemiologická a klinicko-patologická data jsou v souladu s dosud publikovanými pracemi. Uvedené prognostické faktory lze využít k diferencovanému přístupu k pacientům s RCC, a to jak pro stanovení plánu sledování pacienta po chirurgické léčbě, tak i k indikaci cílené léčby.Klíčová slova:
renální karcinom – imunoterapie – cílená léčba – sunitinib –sorafenib – prognózaÚvod
Incidence a mortalita renálního karcinomu (renal cell carcinoma – RCC), který představuje prakticky všechny zhoubné novotvary ledvin mimo pánvičku, jsou v České republice jedny z nejvyšších ve světě. V roce 2009 byla jejich incidence v České republice 26,99 na 100 000 obyvatel (celkem 2 309 případů) a mortalita 10,9 na 100 000 obyvatel (celkem 1 166 případů). Výskyt těchto onemocnění významně narůstá po 50. roce života, nejčastěji je diagnostikováno ve věkové skupině 60 až 70 let. Většinu případů tvoří muži (63 %). Přibližně 35 % těchto nádorů je zachyceno v inoperabilním nebo metastatickém stadiu [1].
Mezi histologickými podtypy RCC jednoznačně převažuje světlobuněčný karcinom (70–75 %) následovaný papilárním karcinomem (10 %), chromofobním karcinomem (5 %) a dalšími histologickými podtypy (karcinom ze sběracích kanálků, mucinózní karcinom atd.) [2]. Odhaduje se, že přibližně 2–3 % RCC jsou dědičně podmíněné [3].
Kurativní metodou léčby RCC je pouze radikální chirurgický výkon, žádná adjuvantní či neoadjuvantní terapie dosud neprokázala signifikantní vliv na přežívání pacientů či oddálení návratu onemocnění. Systémová paliativní léčba je určena pro pacienty s inoperabilním nebo metastatickým RCC (mRCC), stejně tak i paliativní radioterapie. Významným přínosem v paliativní systémové léčbě RCC je možnost podání cílené terapie, která jako jediná má signifikantní vliv na parametry přežití těchto pacientů. Do roku 2012 bylo v České republice k dispozici 6 preparátů z této skupiny léčiv (řazeno abecedně): bevacizumab (pozn.: podáván s interferonem), everolimus, pazopanib, sorafenib, sunitinib a temsirolimus. Dříve rozšířená imunoterapie v podobě interferonu α (IFN) a interleukinu-2 (IL-2) má proto dnes již druhořadý význam a klasická chemoterapie představuje u mRCC vysoce paliativní léčbu, doporučována je v podstatě jen u sarkomatoidních tumorů ledviny [4,5]. V současné době známe řadu prognostických faktorů či modelů, které nám dovolují odhad celkového přežívání (overall survival – OS), a to jak pro lokalizované (the stage size grade and necrosis score – SSIGN, the UCLA Integrated Staging System – UISS), tak pro metastatické onemocnění (Hengův prognostický model, the Memorial Sloan-Kettering Cancer Center score – MSKCC prognostické skóre) [6–12].
Ve vztahu k cílené terapii je prognóza pacientů nejčastěji určována pomocí Hengova prognostického modelu, který na základě přítomnosti jednotlivých rizikových faktorů stratifikuje pacienty do 3 prognostických skupin: s dobrou prognózou (žádný rizikový faktor, 2letý OS – 75 %, medián OS nebyl dosažen), se střední prognózou (1–2 rizikové faktory, 2letý OS – 53 %, medián OS 27 měsíců) a se špatnou prognózou (3 až 6 rizikových faktorů, 2letý OS 7 %, medián OS 8,8 měsíce). Mezi rizikové faktory, které Hengův model zahrnuje, patří: hladina hemoglobinu pod normu, hladina korigovaného vápníku nad normu, Karnofsky performance status (KPS) méně než 80 %, 1 rok a méně od diagnózy do léčby mRCC, hladina neutrofilů a trombocytů nad normu [12].
Zatímco prognostické faktory a modely jsou v klinické praxi běžně používané, do dnešní doby nebyl bohužel nalezen jediný spolehlivý klinický nebo molekulární prediktivní biomarker.
Cílem naší práce bylo zpracovat základní epidemiologickou charakteristiku pacientů s RCC léčených v Masarykově onkologickém ústavu (MOÚ) a na tomto souboru validovat existující prognostické faktory a případně identifikovat nové. Podrobněji jsme se přitom zaměřili na skupinu pacientů s inoperabilním, lokálně pokročilým a metastatickým RCC, kteří byli léčení cílenou terapií.
Soubor pacientů a metody
Soubor pacientů
Zpracovali jsme soubor 544 pacientů diagnostikovaných a/nebo léčených v MOÚ od roku 2003–2010. Z údajů ze zdravotnické dokumentace pacientů, které byly standardně pořizovány v průběhu diagnostiky, léčby a následného sledování pacientů, jsme shromažďovali a v anonymizované podobě evidovali následující informace: datum diagnózy a rozsah primární operace, velikost primárního tumoru, TNM klasifikaci a klinické stadium onemocnění, histologický podtyp nádoru, grade tumoru, přítomnost eozinofilních granulací v cytoplazmě nádoru, lymfocytární infiltrace a sarkomatoidní úseky v primárním tumoru, datum a místo relapsu a následné diseminace, údaje o přítomnosti a charakteru nádorové multiplicity, informace o zahájení a charakteru adjuvantní a paliativní léčby RCC, údaje o efektivitě léčby, rizikové faktory Hengova prognostického modelu a hladinu laktátdehydrogenázy (LDH). Dále byly shromažďovány údaje o poslední absolvované kontrole v MOÚ a v případě, že pacient zemřel, tak i příčina úmrtí. Pro účely statistických analýz jsme rozdělili systémovou léčbu RCC na následující skupiny: a) imunoterapie (interferon α, interleukin-2, jejich kombinace; režim dle Atzpodiena), b) cílená terapie (sunitinib, sorafenib, inhibitory mTOR, pazopanib, bevacizumab, axitinib), v případě účasti v zaslepené klinické studii bylo podmínkou odslepení preparátu, c) chemoterapie (monoterapie 5-flourouracilem, gemcitabin, vinblastin, cisplatina + jejich kombinace) a d) skupina s best supportive care (BSC).
Statistické hodnocení
Pro účely analýz přežití byly definovány následující parametry: celkové přežití ve vztahu k základnímu onemocnění (overall survival-disease specific – OS(ds)), časový interval mezi datem diagnózy a datem úmrtí pacienta v důsledku RCC, časový interval mezi datem zjištění metastáz a datem úmrtí pacienta v důsledku RCC – OS(ds-m), časový interval mezi datem zahájení systémové léčby a datem úmrtí pacienta v důsledku RCC – OS(ds-st).
Přežití bez známek onemocnění (disease free survival – DFS) – časový interval mezi datem diagnózy a datem relapsu onemocnění nebo úmrtí z důvodu progrese maligního onemocnění, pokud nebyl popsán relaps onemocnění. Doba do progrese (time to progression – TTP) – časový interval mezi datem zahájení systémové léčby a datem progrese onemocnění na tuto léčbu. Žijící pacienti byli cenzorováni k datu poslední kontroly. Pacienti, kteří zemřeli z jiné příčiny než na základní onemocnění, byli taktéž cenzorováni k datu poslední kontroly. Léčebné odpovědi byly hodnoceny dle kritérií RECIST, verze 1.1. [13]. K určení rozsahu onemocnění jsme použili TNM klasifikaci, 6. vydání z roku 2002 [14].
Pro základní charakteristiku dat byly použity běžné popisné statistiky (medián, procentuální zastoupení). V analýze přežití byly vytvořeny Kaplan-Meierovy křivky přežití. K porovnání křivek přežití v jednotlivých skupinách pacientů byl použit log-rank test či Gehan-Wilcoxonův test. Multivariační analýza byla provedena Coxovým regresním modelem proporcionálních rizik. Za statisticky signifikantní byly považovány hodnoty p < 0,05. Zpracování bylo provedeno ve statistickém softwaru Statistica, verze 10 a programem Matlab, verze 2009b.
Výsledky
Základní epidemiologická charakteristika
Do souboru jsme zařadili 544 pacientů s RCC diagnostikovaným a/nebo léčeným v MOÚ v letech 2003 až 2010 (tab. 1). Převažovali muži (347 pacientů, 63,8 %). Medián věku pacientů v době diagnózy byl 62 let (rozmezí 22–93 let), medián sledování byl 42 měsíců. V prvním klinickém stadiu bylo onemocnění diagnostikováno u 253 pacientů (46,5 %), ve druhém, třetím a čtvrtém stadiu pak u 58 (10,7 %), 71 (13,1 %) a 109 (20 %) pacientů. Diseminace choroby do regionálních uzlin byla zjištěna u 55 (10,1 %) pacientů (4 % N1 a 6,1 % N2) a vzdálené metastázy u 97 (17,8 %) pacientů. Klinické stadium onemocnění nebylo možné zjistit u 53 pacientů (9,7 %).
Table 1. Epidemiologická, histologická a klinická charakteristika souboru. 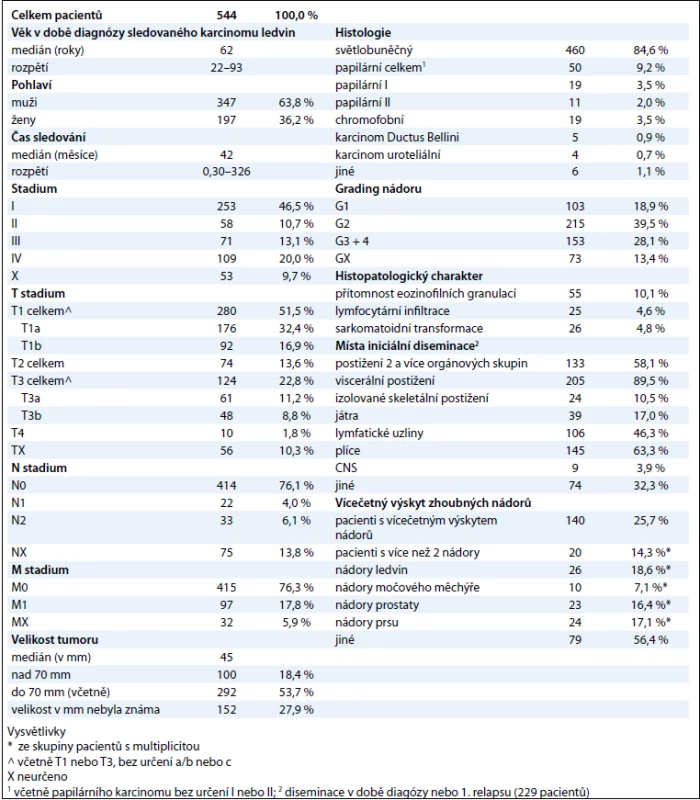
Nejčastěji byl diagnostikován světlobuněčný renální karcinom (clear cell renal cell carcinoma – CCRCC), a to u 460 pacientů (84,6 %), dále papilární karcinom (50 pacientů, 9,2 %), chromofobní karcinom (19 pacientů, 3,5 %), ostatní histologické podtypy RCC byly velmi vzácné. Většinu nádorů (215 pacientů, 39,5 %) tvořily středně diferencované karcinomy (grade 2). Přítomnost eozinofilních granulací, lymfocytární infiltrace a sarkomatoidních úseků byla prokázána u 10,1 %, resp. 4,6 % a 4,8 % RCC. Vícečetný výskyt nádorů jsme zaznamenali u 140 pacientů, přičemž 20 pacientů mělo 3 a více různých nádorů. Mezi nejčastější multiplicity patřily: metachronní či synchronní karcinom ledviny (26 pacientů), karcinom prsu (24 pacientek) a karcinom prostaty (23 pacientů). U pacientů v prvním klinickém stadiu nastal relaps u 30 pacientů (11,9 %), ve druhém a třetím stadiu u 29 (50 %) a 42 pacientů (59,2 %). Metastázy byly nejčastěji zjištěny v plicích (63,3 % pacientů), uzlinách (46,3 %), játrech (17 %) a ve skeletu (10,5 %).
Strategie léčby
Podrobný přehled léčby – s důrazem na první linii systémové paliativní léčby – obsahuje tab. 2. Nejčastějším chirurgickým výkonem byla nefrektomie (v nejrůznějších modifikacích) – 367 pacientů (67,5 %), některou z nefron šetřících operací podstoupilo celkem 154 pacientů (28,3 %), pouze bioptický výkon byl proveden u 23 pacientů (4,2 %). Metastazektomii před podáním první linie systémové léčby podstoupilo 75 pacientů (13,8 %), u 53 pacientů se jednalo o výkon typu R0 resekce. Jakoukoli formu adjuvantní léčby dostalo 20 pacientů (3,7 %). Paliativní systémová léčba první linie byla podána celkem 205 pacientům (37,7 %). Z imunoterapie se jednalo především o interferon α (IFN) (96 pacientů, 46,8 %), režim dle Atzpodiena absolvovalo 6,8 % pacientů. U 57 pacientů (27,8 %) byl v rámci první linie léčby podán sunitinib, v 6 % případů bylo aplikováno některé jiné cílené léčivo, sorafenib dostaly v první linii jen 3,4 % pacientů. Chemoterapie byla použita přibližně u 5 % pacientů.
Table 2. Přehled léčby a rozdělení pacientů do rizikových skupin. 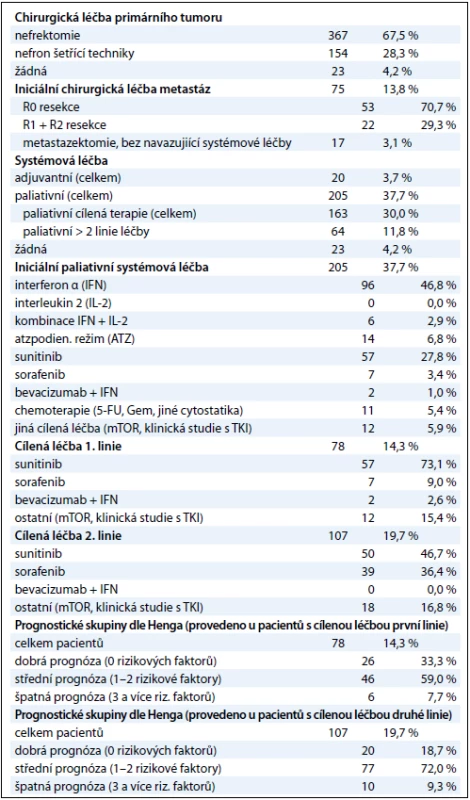
Analýzy přežití a prognostické faktory
Medián OS(ds) byl pro celý náš soubor pacientů 135,8 měsíce a medián DFS 97,3 měsíce (graf 1A + B). Medián OS(ds) pacientů primárně IV. stadia bez ohledu na to, zda podstoupili či nepodstoupili léčbu, byl 15,6 měsíce. Kolik procent pacientů v jednotlivých stadiích našeho souboru přežívalo v 1., 3., 5. a 8., případně 10. roce, resp. kolik procent pacientů bylo bez známek onemocnění, ukazuje názorně tab. 3. V jednorozměrné analýze jsme prokázali statisticky významný vztah k OS(ds) u následujících faktorů: klinické stadium onemocnění (porovnání IV. vs ostatních stadií; ve prospěch nižších stadií; p < 0,00001), velikost primárního tumoru (cut-off hranice 70 mm; ve prospěch menších nádorů; p < 0,00001), postižení uzlin (N1 + N2 vs N0; ve prospěch bez postižení uzlin; p < 0,00001), přítomnost metastáz primárně zjištěných při diagnóze v porovnání s relapsem (ve prospěch přítomnosti metastáz při relapsu; p < 0,00001), přítomnost eozinofilních granulací (ve prospěch jejich nepřítomnosti; p = 0,02047) a sarkomatoidních úseků (ve prospěch jejich neprokázání; p < 0,00001) a grade tumorů (porovnání grade 1 + 2 vs 3 + 4; ve prospěch 1 + 2; p < 0,00001, graf 2A). U typu operačního výkonu (nefrektomie vs nefron šetřící techniky) jsme prokázali statisticky významný vztah k OS(ds), a to jak v celém souboru pacientů, tak i u podskupiny pacientů I. stadia. Tyto výsledky jsou jistě podmíněny skutečností, že nefrektomie se provádí u pokročilejších primárních tumorů, tedy nádorů s horší prognózou! V mnohorozměrné analýze byla prokázána statisticky významná prognostická hodnota těchto parametrů: velikost primárního tumoru (cut-off 70 mm), postižení uzlin, přítomnost metastáz a přítomnost sarkomatoidních úseků.
Graph 1. A, B. Křivky přežití (A – celkové přežití ve vztahu k onemocnění OS(ds), B – přežití bez známek onemocnění (DFS) u pacientů s RCC v závislosti na klinickém stadiu). 
Table 3. Pravděpodobnost přežívání pacientů s renálním karcinomem dle klinického stadia. 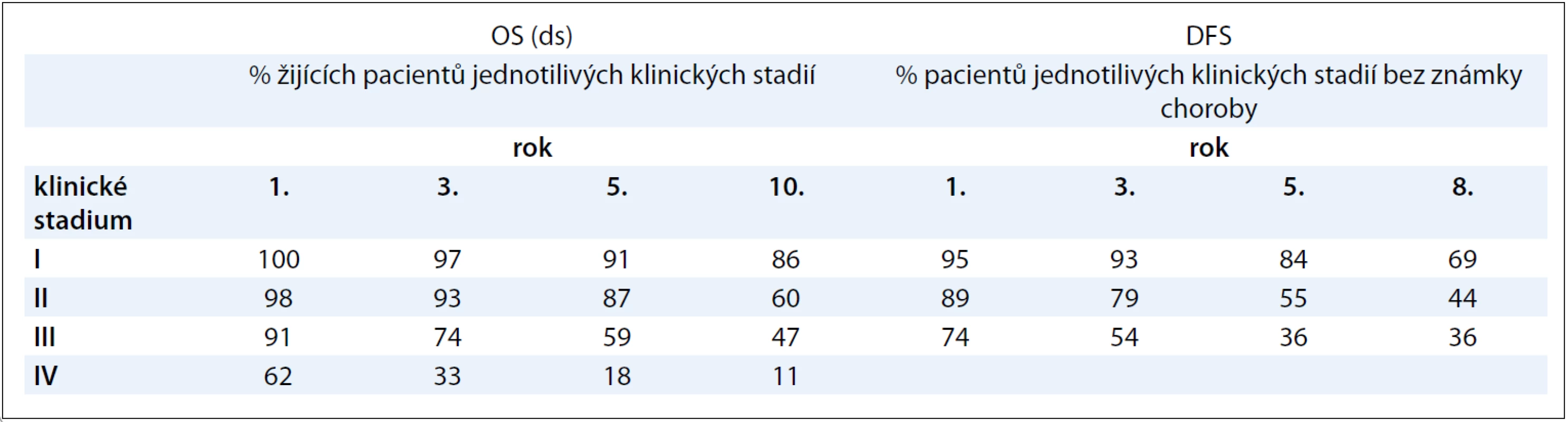
Graph 2. A, B. Křivky přežití (A – celkové přežití ve vztahu k onemocnění OS(ds), B – přežití bez známek onemocnění (DFS) u pacientů s RCC v závislosti na gradu tumorů). 
Pokud jsme hodnotili vztah výše uvedených parametrů k DFS, prokázali jsme v jednorozměrné analýze statisticky významnou závislost následujících parametrů: klinické stadium onemocnění (porovnání I., II. a III. klin. stadia; ve prospěch nižších stadií; p < 0,00001), velikost primárního tumoru (cut-off hranice 70 mm; ve prospěch menších nádorů; p < 0,00001), postižení uzlin (N1 + N2 vs N0; ve prospěch bez postižení uzlin; p = 0,00005), přítomnost eozinofilních granulací (ve prospěch jejich nepřítomnosti; p = 0,02006), lymfocytární infiltrace (ve prospěch jejich nepřítomnosti; p = 0,03024) a sarkomatoidních úseků (ve prospěch jejich neprokázání, p < 0,00001) a grade tumorů (porovnání grade 1 + 2 vs 3 + 4; ve prospěch 1 + 2, p < 0,00001, graf 2B) a pohlaví (ve prospěch ženského pohlaví; p = 0,00695). Způsob operačního výkonu – nefrektomie vs nefron šetřící techniky – opět dosáhl statistické významnosti jak v celém souboru, tak i pro pacienty I. stadia, ale výsledky jsou nejspíše opět podmíněny skutečností, že nefrektomie se provádí u pokročilejších primárních tumorů, které mají horší prognózu. V mnohorozměrné analýze jsme prokázali statistickou závislost mezi DFS a přítomností sarkomatoidních úseků, mezi ostatními sledovanými parametry a DFS jsme neprokázali statisticky významný vztah.
Pohlaví pacientů a lymfocytární infiltrace tumoru neměly statisticky významný vliv na OS(ds), a to jak v jednorozměrné, tak v mnohorozměrné analýze. Výsledky vztahu sledovaných parametrů na OS(ds) a DFS jsou v tab. 4.
Table 4. Vztah mezi sledovanými faktory a OS(ds), resp. DFS u pacientů s renálním karcinomem. 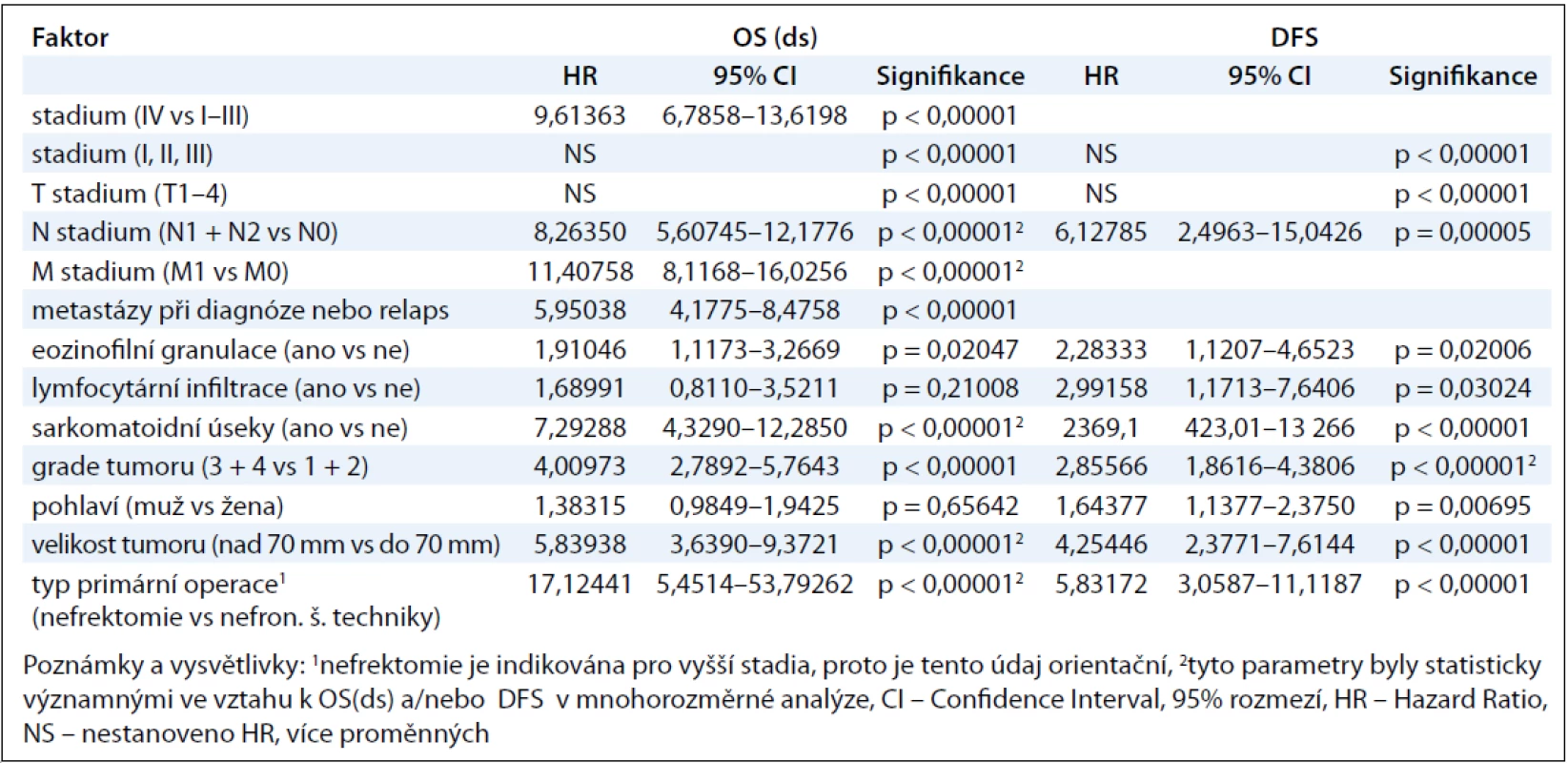
Systémová léčba první a druhé linie ve vztahu k času do progrese onemocnění a celkovému přežití
První linii systémové léčby dostalo v našem souboru celkem 205 pacientů, počty pacientů s konkrétními léčebnými preparáty jsou uvedené v tab. 2. Tuto léčbu absolvovali pacienti s inoperabilním či metastatickým RCC. Tab. 5 ukazuje mediány jednotlivých OS: OS(ds), OS(ds-m) a OS(ds-st). Mediány OS(ds-m) – tedy časový interval mezi datem zjištěných metastáz a datem úmrtí pacienta v důsledku renálního karcinomu – byly ve skupině pacientů léčených pouze cílenou terapií nebo imunoterapií 37,3 měsíce, resp. 20,4 měsíce, neléčení pacienti (pacienti s BSC) měli medián OS(ds-m) 17,8 měsíce. Mediány OS(ds-st) – interval mezi datem zahájení systémové léčby a datem úmrtí pacienta na základní onemocnění – byly ve skupině jen s cílenou terapií a jen imunoterapií 27,4 měsíce, resp. 19,8 měsíce. Následně jsme ještě provedli subanalýzu skupiny léčených pacientů s mRCC, spočítali jsme mediány TTP a OS (ds, ds-m, ds-st) pro podskupiny pacientů léčených v první linii sunitinibem, sorafenibem a imunoterapií, ve druhé linii pak sunitinibem a sorafenibem. Vzhledem k tomu, že sorafenib byl aplikován jen 7 pacientům v rámci první linie, nebyly mediány OS u těchto pacientů počítány. Z podobného důvodu jsme neanalyzovali mediány OS u imunoterapie ve druhé linii, tuto léčbu dostalo jen 9 pacientů. Výsledky ukazuje tab. 6. Mediány TTP v rámci první linie léčby pro sunitinib, sorafenib a imunoterapii byly 10,8 měsíce, 6,3 měsíce a 5,2 měsíce, mediány OS(ds-st) pro sunitinib a imunoterapii pak 27,4 měsíce a 27 měsíců.
Table 5. Výsledky celkového přežití (OS) u pacientů s inoperabilním či metastatickým RCC . 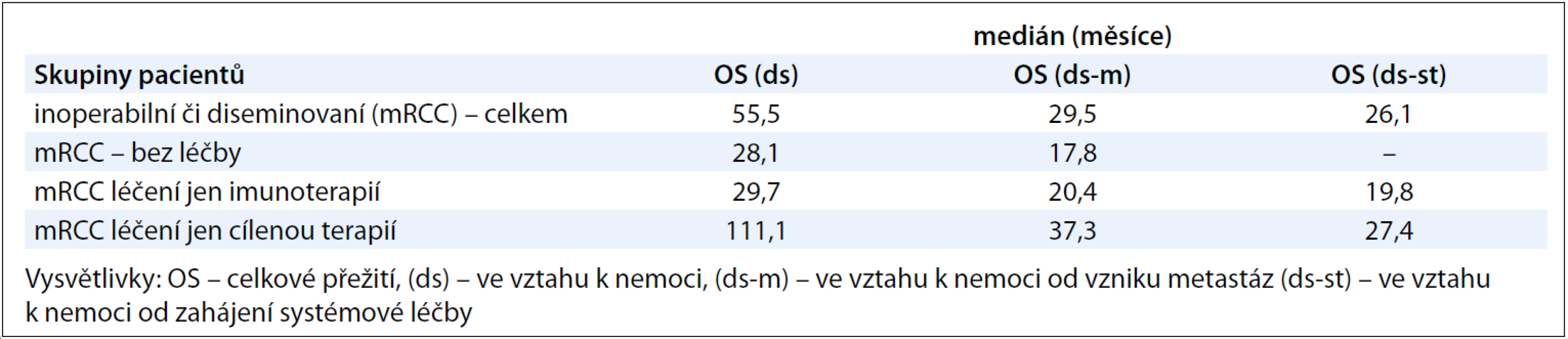
Table 6. Výsledky TT P a OS u vybraných podskupin pacientů. 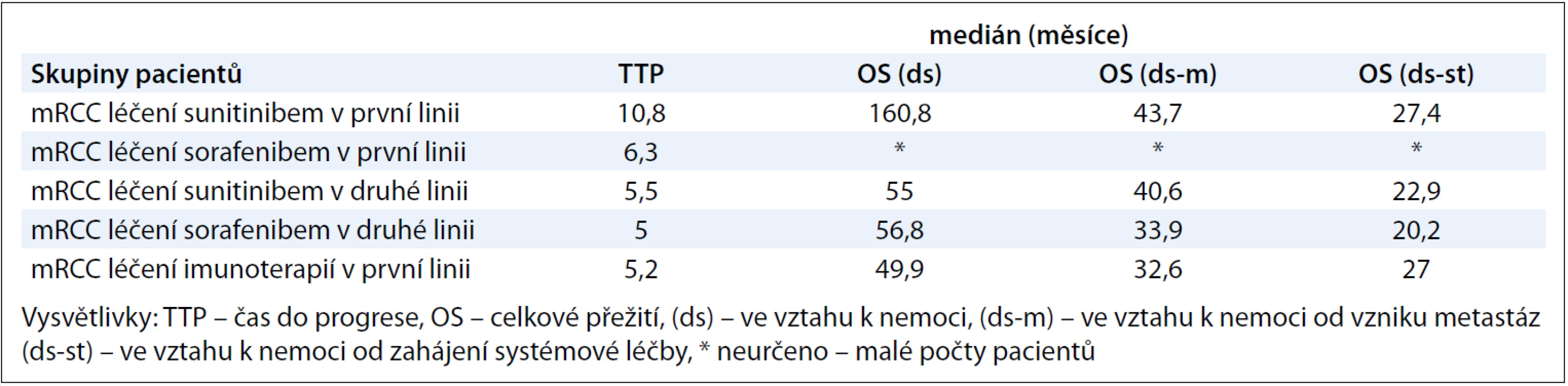
Aplikace prognostického modelu dle Henga, analýzy přežití
Při aplikaci Hengova prognostického modelu jsme pacienty s cílenou terapií rozdělili do 3 skupin dle přítomnosti rizikových faktorů. V rámci první linie cílené terapie (celkem 78 pacientů) bylo ve skupině s dobrou, střední a špatnou prognózou 26, resp. 46 a 6 pacientů, v rámci druhé linie cílené terapie (celkem 107 pacientů) pak 20, 77 a 10 pacientů. Tři a více linií paliativní systémové léčby mělo celkem 64 pacientů. Podrobně v tab. 2. Protože ve skupinách se špatnou prognózou byly nízké počty pacientů (první linie – 6 pacientů, druhá linie – 10 pacientů), sloučili jsme pro další analýzy skupiny se špatnou a střední prognózou do jedné skupiny. Poté jsme analyzovali křivky přežití pro jednotlivé linie léčby a pravděpodobnosti 2letého přežití – 2letý OS(ds-st). Skupina pacientů s dobrou prognózou měla pravděpodobnost 2letého OS(ds-st) v rámci první linie léčby 76,1 %, skupina se střední a špatnou prognózou 41,4 % (p = 0,00277, graf 3A). Pokud zhodnotíme všechny pacienty s cílenou léčbou bez ohledu na to, zda se jedná o první nebo druhou linii, je odhad 2letého OS(ds-st) 73,3 % ve skupině s dobrou prognózou, ve skupině střední a špatné prognózy dosahuje pravděpodobnost 2letého OS(ds-st) 39 % (p = 0,0020, graf 3B).
Graph 3. A, B. Křivky přežití (celkové přežití ve vztahu k onemocnění od započetí cílené léčby v závislosti na prognóze dle Henga, A – od počátku první linie cílené léčby, B – bez ohledu na to, zda cílená terapie nastala v první nebo druhé linii). 
Diskuze
Přestože ČR patří k zemím s nejvyšším výskytem renálního karcinomu ve světě, v českém odborném písemnictví chybí publikace, které by analyzovaly situaci u pacientů s RCC v takovém rozsahu jako naše práce. Retrospektivní kohortní analýza může přitom poskytnout celou řadu údajů užitečných pro klinickou praxi. V naší práci jsme se zaměřili na provedení základní epidemiologické a klinicko-patologické charakterizace konsekutivního souboru čítajícího 544 pacientů. Získané údaje jsme využili k validaci jednotlivých již známých i potenciálních prediktorů a vybraných mutlifaktoriálních prognostických systémů, které byly původně vytvořeny na jiných populacích, a to jak pro lokalizované (SSIGN, UISS), tak pro metastatické onemocnění (Hengův prognostický model, MSKCC prognostické skóre) [6–12].
Prognóza pacientů s RCC je obtížně predikovatelná. Z klasických prediktorů určují prognózu pacientů nejlépe staging onemocnění (dle TNM) a nukleární grading nádorů, nicméně uvnitř jednotlivých skupin existuje stále výrazná heterogenita v přežívání [15]. O určení hranice (cut-off) rozměru primárního nádoru spojeného s lepší, resp. horší prognózou pacientů, se stále vedou diskuze, což se odráží i ve změnách TNM klasifikace. Antonelli et al provedli analýzu 642 pacientů, pacienti s tumorem ≥ 4 cm měli významně kratší DFS [16]. Na druhou stranu Bedke et al doporučují hranici 7 cm jako cut-off pro zvýšené riziko pozdějšího návratu onemocnění [17]. V našem souboru jsme testovali prognostický význam pro hranici 7 cm, který jsme potvrdili, a to jak pro riziko relapsu onemocnění, tak pro celkové přežití. Postižení uzlin a vyšší nukleární grade (3 + 4) nádorů byly v našem souboru asociovány s kratším OS i DFS. Dělení rozsahu onemocnění na N1 nebo N2 nemá ani dle našich poznatků význam, vliv na přežití je podobný. Tuto skutečnost potvrdili i jiní autoři a byla zohledněna i v revizi 7. vydání TNM klasifikace v roce 2011 [4,14,18,19].
Pro pacienty s metastatickým RCC existuje větší počet prognostických modelů predikující přežívání s touto chorobou, nicméně jednoznačné silné prediktivní faktory ve vztahu k cílené léčbě popsány dosud nebyly. Prognostické modely se u mRCC navíc stále vyvíjejí, a to jak v závislosti na narůstajících poznatcích o RCC, tak na možnostech léčby dostupné v dané době. Nejznámějším prognostickým systémem je MSKCC prognostické skóre (kritéria dle Motzera), které bylo prvně publikováno v roce 1999, přičemž jeho poslední aktualizace z roku 2008 zahrnovala 10 rizikových faktorů: elevace LDH, alkalické fosfatázy, korigovaného vápníku, trombocytů, snížený hemoglobin, snížený KPS, přítomnost nefrektomie, počet metastatických míst, přítomnost jaterních a plicních metastáz a dobu od diagnózy do léčby pacienta [8–11]. V naší práci jsme validovali Hengův prognostický model, který je v současnosti v klinické praxi nejužívanější (podrobně viz výše) [12]. Naše výsledky dosaženého celkového přežití a pravděpodobnost 2letého celkového přežití jsou srovnatelné s daty publikovanými Hengem et al (viz úvod). Bohužel slabinou naší analýzy je příliš heterogenní populace a z toho vyplývající nízké počty pacientů ve srovnávaných kategoriích. Abychom mohli analýzy přežití provést, museli jsme sloučit pacienty ve středním a vysokém riziku, což mohlo dále zkreslit naše výsledky.
V rámci validace jednotlivých prognostických markerů jsme se zaměřili zejména na dosud známé histopatologické prediktory: přítomnost eozinofilních granulací v cytoplazmě, lymfocytární infiltrace v nádorech a projevy sarkomatoidní transformace. Přítomnost eozinofilních granulací v cytoplazmě maligních buněk v našem souboru skutečně korelovala jak s kratším OS, tak i DFS, což je v souladu s dosud publikovanými pracemi. V minulosti byl dokonce jedním z histologických podtypů RCC i granulární renální karcinom. Vymezení uvedené podjednotky z části zřejmě reflektovalo i její odlišné klinické chování. Výskyt eozinofilních granulací však není typický jen pro jednu entitu RCC, nacházíme je jak u světlobuněčného, tak i u papilárního nebo chromofobního RCC; jejich přítomnost byla potvrzena i u onkocytomů a obecně u karcinomů s vyšším gradem [20–22]. Transformace je známkou dediferenciace nádoru. V našem souboru byla přítomna u 4,8 % pacientů a statisticky významně korelovala s horší prognózou pacientů. Data jsou ve shodě s prací Kima et al, v níž autoři popisují výskyt sarkomatoidních změn u 4,6 % pacientů s CCRCC (u papilárního podtypu pak u přibližně 6 % pacientů), jejich přítomnost taktéž souvisela s horším přežíváním pacientů [23]. Na druhou stranu jsme nepotvrdili vliv přítomnosti lymfocytární infiltrace v nádoru na OS. Existují přitom práce, které prokazují její negativní význam pro uvedený parametr přežití, svou metodikou se však vzájemně liší [24]. Například Bromwich et al zkoumali přítomnost T lymfocytů, naše práce hodnotila lymfocytární populaci jako celek.
Při hodnocení výsledků léčby (OS a TTP) pacientů léčených imunoterapií, sunitinibem a sorafenibem jsme dosáhli podobných výsledků jako v randomizovaných studiích fáze III – Motzer et al, Escudier et al [25,26]. Srovnáváme-li naše výsledky se zahraničními studiemi, je nutné mít vždy na zřeteli, že cílená terapie RCC byla v ČR do roku 2011 podávána zejména u pacientů předléčených imunoterapií (61,5 % v ČR) [2]. Bohužel náš soubor neumožňoval zhodnocení sledovaných prognostických markerů pro prediktivní účely. Z tohoto pohledu byl příliš heterogenní, a jednotlivé podskupiny proto nedosahovaly potřebného počtu pacientů. Data z retrospektivních studií však ukazují, že možnými potenciálními prediktivními faktory mohou být nežádoucí účinky cílené terapie: arteriální hypertenze, hand-foot syndrom a hypothyreóza [27–30].
Závěr
Analyzovali jsme soubor pacientů s renálním karcinomem diagnostikovaným a/nebo léčeným v jednom zdravotnickém zařízení. Získaná epidemiologická a klinicko-patologická data jsou v souladu s dosud publikovanými pracemi. U pacientů s mRCC byl jednoznačně patrný přínos cílené terapie ve srovnání s imunoterapií a BSC. Prokázali jsme prognostický význam následujících faktorů: velikost primárního nádoru, postižení uzlin, klinické stadium, přítomnost eozinofilních granulací a sarkomatoidních úseků v histopatologickém preparátu. V případě prognostických modelů lze v našich podmínkách u pacientů s mRCC úspěšně aplikovat Hengův prognostický model. Uvedené prognostické markery pak lze využít k diferencovanému přístupu k pacientům s RCC, a to jak pro stanovení plánu sledování pacienta po chirurgické léčbě, tak i k indikaci cílené léčby [3]. Náš soubor pacientů však toto zhodnocení neumožňoval.
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Marek Svoboda, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: msvoboda@mou.cz
Obdrženo: 21. 3. 2013
Přijato: 28. 3. 2013
Sources
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita 2005. [cit. 2013-3-25]. http://www.svod.cz.
2. Poprach A, Bortlíček Z, Büchler T et al. Patients with advanced and metastatic renal cell carcinoma treated with targeted therapy in the Czech Republic: twenty cancer centres, six agents, one database. Med Oncol 2012; 29(5): 3314–3320.
3. Escudier B, Eisen T, Porta C et al. ESMO Guidelines Working Group. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (Suppl 7): vii65–vii71.
4. NCCN Clinical practice guidelines in oncology. Kidney cancer V.2.2012 [online]. J Natl Compr Cancer Netw 2012. [cit. 2012-10-16]. www.nccn.org.
5. Nanus DM, Garino A, Milowsky MI et al. Active chemotherapy for sarcomatoid and rapidly progressing renal cell carcinoma. Cancer 2004; 101(7): 1545–1551.
6. Leibovich BC, Blute ML, Cheville JC et al. Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials. Cancer 2003; 97(7): 1663–1671.
7. Patard JJ, Kim HL, Lam JS et al. Use of the University of California Los Angeles integrated staging system to predict survival in renal cell carcinoma: an international multicenter study. J Clin Oncol 2004; 22(16): 3316–3322.
8. Motzer RJ, Mazumdar M, Bacik J et al. Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol 1999; 17(8): 2530–2540.
9. Motzer RJ, Bacik J, Murphy BA et al. Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 2002; 20(1): 289–296.
10. Motzer RJ, Bacik J, Schwartz LH et al. Prognostic factors for survival in previously treated patients with metastatic renal cell carcinoma. J Clin Oncol 2004; 22(3): 454–463.
11. Motzer RJ, Bukowski RM, Figlin RA et al. Prognostic nomogram for sunitinib in patients with metastatic renal cell carcinoma. Cancer 2008; 113(7): 1552–1558.
12. Heng DY, Xie W, Regan MM et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol 2009; 27(34): 5794–5799.
13. Eisenhauer EA, Therasse P, Bogaerts J et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45(2): 228–247.
14. Sobin LH, Wittekind C. TNM Classification of Malignant Tumours. UICC International Union Against Cancer 6th Ed. Wiley-Blackwell 2002, česká verze 2004 : 161–166.
15. Fuhrman SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 1982; 6(7): 655–663.
16. Antonelli A, Zani D, Cozzoli A et al. Nephron-sparing surgery versus radical nephrectomy in the treatment of renal cell carcinoma up to 7 cm. Urologia 2007; 74(3): 173–179.
17. Bedke J, Pritsch M, Buse S et al. Prognostic stratification of localized renal cell carcinoma by tumor size. J Urol 2008; 180(1): 62–67.
18. Moch H, Artibani W, Delahunt B et al. Reassessing the current UICC/AJCC TNM staging for renal cell carcinoma. Eur Urol 2009; 56(4): 636–643.
19. Karakiewicz PI, Trinh QD, Bhojani N et al. Renal cell carcinoma with nodal metastases in the absence of distant metastatic disease: prognostic indicators of disease-specific survival. Eur Urol 2007; 51(6): 1616–1624. Epub 2006 Dec 14.
20. Yang XJ, Takahashi M, Schafernak KT et al. Does ‚granular cell‘ renal cell carcinoma exist? Molecular and histological reclassification. Histopathology 2007; 50(5): 678–680.
21. Kanamaru H, Mori H, Sasaki M et al. Histologic characteristics of renal cell carcinomas with lymph node metastasis. Int J Urol 1997; 4(5): 451–455.
22. Podhola M. Karcinom ledvin dospělých. Onkologie 2009; 3(2): 80–82.
23. Kim H, Cho NH, Kim DS et al. Genitourinary Pathology Study Group of the Korean Society of Pathologists. Renal cell carcinoma in South Korea: a multicenter study. Hum Pathol 2004; 35(12): 1556–1563.
24. Bromwich EJ, McArdle PA, Canna K et al. The relationship between T-lymphocyte infiltration, stage, tumour grade and survival in patients undergoing curative surgery for renal cell cancer. Br J Cancer 2003; 89(10): 1906–1908.
25. Motzer RJ, Hutson TE, Tomczak P et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol 2009; 27(22): 3584–3590. Epub 2009 Jun 1.
26. Escudier B, Eisen T, Stadler WM et al. Sorafenib for treatment of renal cell carcinoma: Final efficacy and safety results of the phase III treatment approaches in renal cancer global evaluation trial. J Clin Oncol 2009; 27(20): 3312–3318.
27. Bono P, Rautiola J, Utriainen T et al. Hypertension as predictor of sunitinib treatment outcome in metastatic renal cell carcinoma. Acta Oncol 2011; 50(4): 569–573. Epub 2011 Jan 5.
28. Puzanov I, Michaelson MD, Cohen DP et al. Evaluation of hand-foot syndrome (HFS) as a potential biomarker of sunitinib (SU) efficacy in patients (pts) with metastatic renal cell carcinoma (mRCC) and gastrointestinal stromal tumor (GIST). J Clin Oncol 2011; 29 (Suppl 7); abstr e21113.
29. Schmidinger M, Vogl UM, Bojic M et al. Hypothyroidism in patients with renal cell carcinoma: blessing or curse? Cancer 2011; 117(3): 534–544. doi: 10.1002//cncr.25422. Epub 2010 Sep 15.
30. Poprach A, Pavlik T, Melichar B et al. Czech Renal Cancer Cooperative Group. Skin toxicity and efficacy of sunitinib and sorafenib in metastatic renal cell carcinoma: a national registry-based study. Ann Oncol 2012; 23(12): 3137–3143. Epub 2012 Jun 13.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2013 Issue 2-
All articles in this issue
- Prognostické faktory karcinomu děložního hrdla
- Antiangiogenní bioterapie a chemoterapie v terapii karcinomu prsu: přehled literatury a kazuistika
- Postavení radioterapie v léčbě maligních lymfomů – doporučení Kooperativní lymfomové skupiny
- Epidemiologická a klinicko-patologická charakteristika pacientů s renálním karcinomem: analýza 544 případů z jednoho centra
- Castlemanova choroba: retrospektivní studie léčebných výsledků u 10 pacientů z jednoho centra
- Kazuistika: Výskyt grade IV neutropenie a febrilní neutropenie u pacientky s generalizovaným karcinomem prsu léčené paliativní chemoterapií cyklofosfamid/Myocet
- Spontánní remise akutní myeloidní leukemie – klinické případy jednoho centra
- Adjuvatní radioterapie karcinomu prsu s využitím Active breathing control – moderate inspiration breath-hold – kazuistika
- Adjuvant! Online: Pozor na rozdíly!
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostické faktory karcinomu děložního hrdla
- Spontánní remise akutní myeloidní leukemie – klinické případy jednoho centra
- Kazuistika: Výskyt grade IV neutropenie a febrilní neutropenie u pacientky s generalizovaným karcinomem prsu léčené paliativní chemoterapií cyklofosfamid/Myocet
- Postavení radioterapie v léčbě maligních lymfomů – doporučení Kooperativní lymfomové skupiny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

