-
Medical journals
- Career
Role polymorfismu rs17817449 FTO genu ve vztahu k obezitě a kompenzaci u diabetiků 1. typu
Authors: I. Jakubíková 1,2; T. Pelikánová 1
Authors‘ workplace: Centrum diabetologie, Institut klinické a experimentální medicíny, Praha 1; Lékařská fakulta v Hradci Králové, Univerzita Karlova v Praze 2
Published in: Klin. Biochem. Metab., 27, 2019, No. 2, p. 61-65
Overview
Cíl studie: Na české populaci diabetiků 1. typu jsme zkoumali vliv rizikové alely G polymorfismu rs17817449 FTO genu ve vztahu k obezitě a kompenzaci diabetu.
Typ studie: Retrospektivní.
Název a sídlo pracoviště: Centrum diabetologie, Institut klinické a experimentální medicíny, Vídeňská 1958/9, 140 21 Praha 4.
Materiál a metody: Po splnění striktních inkluzních kritérií bylo vybráno celkem 171 mužů a 115 premenopauzálních žen s diabetem mellitem 1. typu (hladina C peptidu pod 0,2 nmol/L), kteří byli dále rozděleni na dvě skupiny dle genotypu: na homozygoty TT a GG ve sledovaném polymorfismu rs17817449 FTO genu. Ve stabilním stádiu choroby byla zaznamenána jejich váha, výška, body mass index (BMI), nároky na inzulinoterapii (IU/kg) a průměrná roční hodnota glykovaného hemoglobinu (HbA1c). Statistická analýza byla provedena pomocí programu GraphPad Prism 5.0. California.
Výsledky: Riziková alela G jak u mužů, tak u premenopauzálních žen s diabetem mellitem 1. typu, není asociována s obezitou a nevysvětluje rozdíly v BMI a HbA1c (GG/TT muži: BMI 26,8/25,8 kg/m2, HbA1c 62,8/62,7 mmol/mol; ženy: BMI 24,1/24,6 kg/m2, HbA1c 64,3/63,1 mmol/mol). Pohlavně specificky byla skupina mužských GG homozygotů léčena statisticky významně vyšší dávkou inzulinu oproti TT homozygotům (0,63 vs. 0,57 IU/kg).
Závěr: U diabetiků 1. typu jsme sice nepotvrdili významný vztah polymorfismu FTO genu a rizikem obezity či horší kompenzací diabetu. Nicméně vyšší dávky inzulinu u mužských GG homozygotů mohou svědčit pro roli FTO genu v indukci inzulinové rezistence.
Klíčová slova:
FTO – SNP – BMI
Úvod
Obezita jako komplexní metabolické onemocnění vzniká v důsledku nerovnováhy mezi energetickým příjmem a výdejem, je spojena s řadou zdravotních rizik i komplikací, a stává se tak „strašákem“ 21. století. Pro rok 2030 se odhaduje, že obézních bude 20 % světové dospělé populace -1,12 miliardy lidí [1]. Na základě provedení celogenomových studií (GWAs) bylo nalezeno 10 kandidátních lokusů spojených s obezitou (P<5x10-8), z nichž nejpotentnější byla oblast genu FTO (fat mass and obesity associated gene) [2,3]. Přítomnost každé rizikové alely je spojena s přibližně 1,5-2 kg přírůstkem tělesné hmotnosti. Funkčně nejrozšířenější polymorfismy genu FTO se dominantně nacházejí v 1. intronu na chromozomu 16q12.2, pro českou populaci se jedná o hojně studované polymorfismy: rs99939609(T/A) a rs17817449 (G/T). Prevalence rizikového homozygotního polymorfismu je 16 % u Evropanů [4,5]. Míra exprese FTO genu u diabetiků 2. typu je obrazem centrální a periferní inzulinorezistence, která může být dále umocněna rizikovou alelou daného polymorfismu. Návazné studie poukázaly na vztah rizikových polymorfismů FTO genu nezávisle na BMI k vyšší kardiovaskulární mortalitě, riziku renálního selhání či Alzheimerově chorobě. Nového rozměru nabývá též na úrovni onkologie, kde zvýšená exprese FTO genu v nádoru je spojena se špatnou prognózou [6-9].
Na molekulární úrovni FTO protein je exprimován v jádře buněk a patří do AlkB rodiny Fe-nehemových 2-oxoglutarát-dependentních dioxygenáz. Oxygenázy mají za úkol opravit alkylovanou DNA a RNA pomocí oxidativní demethylace. Hlavní afinitu má tento enzym k jednořetězcové 3-methyluracil a 3-methylthymin RNA/DNA, specifickým substrátem FTO enzymu je N-methyladenosine RNA (m6A), jejíž stav methylace epigeneticky modifikuje roli mRNA. Celkově FTO zasahuje do metabolismu různých druhů RNA včetně miRNA, rRNA, mRNA [10,11]. Předpokládá se, že jako translačně - transkripční koaktivátor FTO enzym může regulovat ostatní geny, které jsou zapojené do řady metabolických dějů apod. Rizikové alely A rs99939609 (T/A) a G rs17817449 (G/T) polymorfismů vedou ke zvýšené expresi FTO genu [12].
Z myších modelů FTO overexprimující myš ve studii Church et al. 2010, vedla k dávce-dependentnímu nárůstu hmotnosti a tukové masy, nezávisle na podávané dietě, ale na vyšším energetickém příjmu. Nároky na úrovni energetického výdeje, fyzické aktivity, cirkadiálních rytmech se nijak nelišily od WT-myší [13].
Současné poznatky o roli FTO genu vycházejí dominantně z pozorování na běžné populaci spolu s diabetiky 2. typu, tj. na organizmech se zachovalou zpětnovazebnou regulací glukózového metabolismu se zachovalou sekrecí inzulinu s možností navození reaktivní hyperinzulinémie při zachovalé funkci β-buněk v pankreatu. Cílem naší studie bylo prozkoumat mezeru současného písemnictví a blíže prozkoumat existenci vlivu FTO polymorfismu na vznik obezity a kompenzaci diabetu na specifické populaci diabetiků 1. typu. Budou se lišit: body mass index (BMI), kompenzace diabetu (HbA1c) a nároky na inzulinoterapii (IU/kg) u diabetiků 1. typu v závislosti na polymorfismu rs17817449 FTO genu?
Design studie a metodologie
Na základě naší dřívější studie Hubáček et al. 2017, byl na našem pracovišti osekvenován soubor 814 pacientů s diabetem mellitem 1. typu na polymorfismus rs17817449 FTO genu [14]. Ve světle nových poznatků jsme se rozhodli doplnit retrospektivní studii, která je v souladu s vyjádřením institucionální etické komise a již dříve získaného informovaného souhlasu účastníků předchozí studie. Za účelem docílení statisticky významných nálezů na poli metabolismu FTO genu na populaci diabetiků 1. typu, kde frekvence alelického zastoupení se významně neliší od zdravé populace, byli vybráni pouze „zdraví“ TT homozygoti a rizikoví GG homozygoti. Tento soubor s ohledem na sledované parametry BMI (kg/m2), HbA1c (mmol/mol), nároky na inzulin (IU/kg) byl dále podroben přísným výběrovým kritériím. Byli vyloučeni: kuřáci nad 10 cigaret za den nebo kuřáci pod 10 cigaret za den s BMI pod 25, pacienti na off-label přídatné medikaci metforminem k inzulinoterapii, postmenopauzální ženy, ženy nad 50 let, těhotné ženy. Všichni zařazení jedinci měli normální funkci štítné žlázy (TSH, fT4 v normě), normální jaterní testy a renální funkce, lačný C peptid pod 0,2 nmol/L. Většina sledovaných parametrů byla vyhodnocena k roku 2018 nebo k nejzazšímu roku do alterace renálních funkcí retrospektivně na základě údajů zanesených v informačním systému naší instituce během ambulantních návštěv, včetně stažených výpisů z inzulinových pump. Hodnota HbA1c byla vypočítána jako průměr ze čtyř hodnot naměřených v daném roce. V případě starého číselného vyjádření v % byla hodnota konvertována na mmol/mol pomocí online dostupné aplikace na https://www.hba1cnet.com/hba1c-calculator/. Ve studii byl zohledněn způsob podávání inzulinu - podskupina na intenzifikovaném inzulinovém režimu (IIT) nebo aplikace pomocí inzulinové pumpy.
Genetická analýza polymorfismu rs17817449 FTO genu pomocí PCR a restrikční analýzy byla již zevrubně popsána ve studii Hubáček et al. 2015 [15]. Ve zkratce: oligonukleotid 5´ GGT GAA GAG GAG GAG ATT GTG TAA CTG G a 5´ GAA GCC CTG AGA AGT TTA GAG TAA ATT GGG pomocí restrikčního enzymu AlwN1 byly použity k detekci cílového polymorfismu. PCR produkt o délce 198 bp odpovídal alele G, fragment o 99 bp odpovídal alele T.
Po otestování dat na jejich normalitu pomocí D´Agostinova a Pearsonova testu byl pro statistické analýzy při nepravidelném rozložení dat použit neparametrický nepárový t-test event. ke konfirmaci Mann-Whitney test. Většina dat je uváděna jako průměr (µ) se směrodatnou odchylkou (SD). Hladina statistické významnosti byla určena jako P<0,05. Základní charakteristiky pro soubor diabetiků 1. typu bez ohledu na FTO genotyp jsou pro přehlednost uvedeny pomocí mediánu. Ke statistickým analýzám byl použit program GraphPad Prism 5.0. California.
Výsledky
Finální analýze po splnění přísných kritérií bylo podrobeno celkem 171 mužů a 115 žen s diabetem mellitem 1. typu. Nezávisle na sledovaném polymorfismu FTO genu uvádíme základní charakteristiky diabetiků 1. typu, kteří t. č. žijí ve 21. století. V mužské kategorii při mediánu věku 46 let, byl medián BMI 26 a medián HbA1c 62 mmol/mol při mediánu trvání diabetu 23 let. V ženské kategorii při mediánu věku 38 let, byl medián BMI 24 a medián HbA1c 63 mmol/mol při mediánu trvání diabetu 21 let. V námi sledované populaci diabetiků 1. typu odpovídaly frekvence alelického zastoupení v genotypu GG 19 %, GT 48 % a TT 33 % (stanoveno dle Hardy Weinbergova principu). V závislosti na pohlaví byly srovnány sledované parametry mezi homozygoty GG a TT polymorfismu rs17817449 FTO genu, které shrnuje Tabulka č.1. Sledovaný rizikový polymorfismus FTO genu nebyl provázen signifikantním rozdílem v dosažených hodnotách BMI a kompenzaci diabetu (GG/TT muži: BMI 26,8/25,8 kg/m2, HbA1c 62,8/62,7 mmol/mol; ženy: BMI 24,1/24,6 kg/m2, HbA1c 64,3/63,1 mmol/mol). Pouze v mužské kategorii byl nalezen statisticky významný rozdíl v nárocích na inzulinoterapii. Nemocní ve skupině GG byli léčeni vyšší dávkou inzulinu oproti TT skupině při shodně dosažené míře kompenzace diabetu (parametr HbA1c). Dále byl náznak na vyšší BMI ve skupině GG než u TT mužských homozygotů, což se jistě nedá odůvodnit statisticky významně mladším věkem skupiny GG oproti TT. Jak u žen, tak ani u mužů nebyly ve sledovaných parametrech nalezeny statisticky významné rozdíly mezi pacienty, kteří aplikovali inzulin pomocí inzulinové pumpy nebo pery v IIT režimu.
Table 1. Impact of the rs17817449 FTO gene polymorphism on selected parametres in type 1 diabetics. 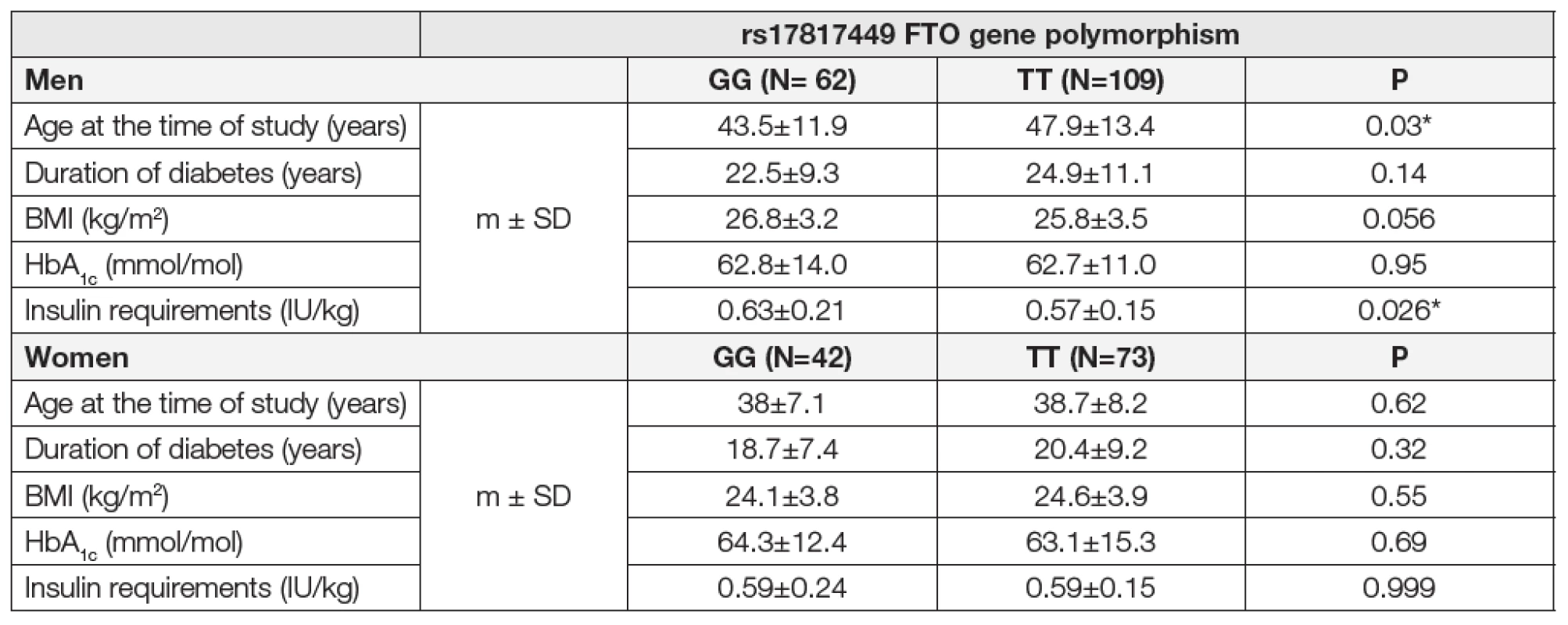
Diskuse
V současné literatuře chybí dostatek údajů o vlivu rizikových polymorfismů FTO genu na specifickou populaci diabetiků 1. typu. S ohledem na početně statisticky chudý soubor pacientů v této studii se jedná o pilotní data a naše závěry budou vyžadovat další ověření. Dále jsme si vědomi koncepčního nedostatku studie stran hodnocení tělesné konstituce pomocí BMI a inzulinorezistence pomocí dávky inzulinu na hmotnost. Vhodnější parametry ke sledování bohužel nebyly retrospektivně k dispozici. S ohledem na budoucí studie by bylo vhodné sledovat obvod pasů a boků, jako základní korelát viscerálního tuku a inzulinorezistence. Se znalostí obvodu pasu, glykovaného hemoglobinu a přítomností arteriální hypertenze se dá stanovit parametr vyvinutý pro sledování inzulinové senzitivity pro diabetiky 1. typu, a to estimated Glucose Disposal Rate (eGDR). Pro přesnější stanovení tělesného složení jsou v současnosti k dispozici zobrazovací vyšetření (např. DEXA nebo CT ke kvantifikaci tukové tkáně) či analýza bioelektrickou impedancí.
V naší studii jsme zkoumali metabolický dopad polymorfismu rs17817449 FTO genu v jeho homozygotních variantách GG vs. TT na průřezovém souboru českých diabetiků 1. typu. Ti byli v produktivním věku s průměrnou dobou trvání diabetu cca 20 let, což považujeme za již metabolicky ustálený stav při průměrné kompenzaci diabetu s HbA1c 63 mmol/mol. Oproti ostatním studiím na zdravých lidech či diabeticích 2. typu, jsme analyzovali soubor relativně dobře kompenzovaných diabetiků 1. typu bez nefropatie a dalších vážnějších komorbidit. Zde je vhodné poukázat ještě na rozdíly v inzulinorezistenci mezi pohlavími, neboť v řadě studií vyjdou sledované jevy ve vazbě k FTO genu významné u mužů nebo postmenopauzálních žen. Animální studie, poukazují na vliv estrogenů v regulaci příjmu potravy, kde estrogenní receptory v hypotalamu zlepšují senzitivitu k leptinu. To se dá aplikovat na premenopauzální ženy a ochrannou funkci estrogenů před přejídáním se. Možná proto nebyla nalezena vazba mezi obezitou a FTO SNP u premenopauzálních žen ani ve studii Hubáček et al. 2009 [16,17]. V naší studii jsme zaznamenali rozdíl v denní dávce inzulinu (vztaženo k hmotnosti, index IU/kg), která odráží míru inzulinové citlivosti (rezistence) pouze u mužské populace. Ačkoli BMI, HbA1c, doba trvání diabetu se mezi GG a TT homozygoty nelišila, přesto GG homozygoti vyžadovali vyšší dávky inzulinu k dosažení obdobné kompenzace diabetu. Lze si tento fakt nějak vysvětlit na základě znalostí z metabolických drah, v nichž je FTO enzym zapojen?
FTO gen jako demethylázová oxygenáza může svojí regulační schopností na úrovni RNA ovlivňovat řadu genů v tkáňově specifické lokalizaci, geny, které se dominantně zapojují do metabolických či kognitivních drah organismu. Některé studie poukazují na možný vliv rizikové alely ve vztahu ke zvýšenému energetickému příjmu a alterovanému pocitu sytosti postprandiálně, díky overexpresi genu FTO v hypotalamu a v regulačních okruzích zodpovídajících za příjem potravy např. ve vztahu k acyl-ghrelinu či dopaminergním centrálním signalizačním okruhům (CNS) [18]. Mimo jiné FTO exprimující dopaminergní neurony zapojené do CNS signalizace jsou důležitým regulátorem celotělové inzulinosenzitivity. Na základě současných znalostí stran role inzulinu v centrální nervové soustavě, kde centrální inzulinorezistence vede k patologickému jídelnímu chování, kognitivním dysfunkcím, predispozici ke vzniku závislostí, neurodegenerativním onemocněním, se tyto sledované okruhy nápadně prolínají s FTO signalizací. V nižších koncentracích, jak v hypotalamu, je FTO enzym přítomen ubikvitérně. V poslední době začal být studován vliv exprese FTO genu specificky v játrech. Overexprese FTO v játrech u myší vedla k zvýšeným lačným hladinám glykémie a hladinám inzulinu pravděpodobně přes FTO-leptin-STAT3 signální dráhu [19]. Podobné výsledky byly nalezeny ve studii Grunett et al. 2009 na kohortě 24letých neobézních zdravých mužů, kde v rámci klampové studie studovaný FTO rs9939609 a riziková alela A byla spojena se zvýšenou lačnou glykémií, inzulinémií, jaterní inzulinorezistencí bez ohledu na korekci k tukové hmotě, dále celkově nebyla narušena periferní inzulinová senzitivita a sekrece inzulinu [20]. K obdobným závěrům došla i studie na saudsko-arabské populaci [21]. Zdá se, že FTO gen na úrovni jater transkriptomicky může ovlivnit řadu genů zapojených do metabolických pochodů. Zvýšená exprese FTO vede v játrech např. k zvýšené expresi enzymů zodpovědných za glukoneogenezi. Nebo na úrovni lipidů vede de novo k lipogenezi a k jejich ukládání v játrech, což může přispět ke vzniku steatohepatopatie jater (NAFLD) [22].
Závěr
Vliv rizikové alely G polymorfismu rs17817449 FTO genu nevedl u diabetiků 1. typu ke vzniku obezity, či zhoršení kompenzace diabetu (hodnoceno dle BMI, HbA1c). Nároky na inzulinoterapii byly shodné mezi T a G alelou u premenopauzálních netěhotných diabetiček 1. typu. V mužské kategorii GG homozygoti vyžadovali statisticky významně vyšší dávky inzulinu než TT homozygoti. Tento jev na skupině diabetiků 1. typu svědčí pro vztah rizikových polymorfismů FTO genu a navození inzulinorezistence.
Poděkování
Za podporu na vzniku tohoto článku bych ráda poděkovala Ing. Jaroslavu A. Hubáčkovi, CSc., DSc. (Centrum experimentální medicíny, Institut klinické a experimentální medicíny, Praha).
Tato studie byla podpořena výzkumným záměrem MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“).
Autoři nejsou ve střetu zájmů.
Do redakce došlo 28. 12. 2018
Adresa pro korespondenci:
MUDr. Iva Jakubíková
Centrum diabetologie, Institut klinické a experimentální medicíny
Vídeňská 1958/9, 140 21 Praha 4
e-mail: ivajakub@gmail.com
Sources
1. Kelly, T., Yang, W., Chen, C. S., Reynolds, K., He, J. Global burden of obesity in 2005 and projections to 2030. Int J Obes., 2008, 32(9), p. 1431-1437.
2. Speliotes, E. K., Willer, C. J., Berndt, S. I. et al. Association analyses of 249,796 individuals reveal 18 new loci associated with body mass index. Nat Genet., 2010, 42(11), p. 937-948.
3. Frayling, T. M., Timpson, N. J., Weedon, M. N. et al. A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity. Science, 2007, 316, p. 889–894.
4. Dlouhá, D., Hubáček, J. A. Gen pro FTO a jeho role v genetické determinaci obezity. Vnitr Lek., 2012, 58(3), p. 208-215.
5. Hubacek, J. A., Bohuslavova, R., Kuthanova, L. et al. The FTO gene and obesity in a large Eastern Euro-pean population sample: the HAPIEE study. Obesity (Silver Spring)., 2008,16(12), p. 2764-2766.
6. Hubacek, J. A., Viklicky, O., Dlouha, D. et al. The FTO gene polymorphism is associated with end-stage renal disease: two large independent case-control stu-dies in a general population. Nephrol. Dial. Transplant., 2012, 27(3), p. 1030-1035.
7. Hubacek, J. A., Stanek, V., Gebauerova, M. et al. A FTO variant and risk of acute coronary syndrome. Clin. Chim. Acta, 2010, 411(15-16), p. 1069-1072.
8. Kullmann, S., Heni, M., Hallschmid, M., Fritsche, A., Preissl, H., Häring, H. U. Brain Insulin Resistance at the Crossroads of Metabolic and Cognitive Disorders in Humans. Physiol. Rev., 2016, 96(4), p. 1169-1209.
9. Deng, X., Su, R., Stanford, S., Chen, J. Critical Enzymatic Functions of FTO in Obesity and Cancer. Front. Endocrinol., 2018, 9, p. 396.
10. Berulava, T., Ziehe, M., Klein-Hitpass, L. et al. FTO levels affect RNA modification and the transcriptome. Eur J Hum. Genet., 2013, 21(3), p. 317-323.
11. Jia, G., Fu, Y., Zhao, X. et al. N6-methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO. Nat. Chem. Biol., 2011, 7(12), p. 885-887.
12. Berulava, T., Horsthemke, B. The obesity-associated SNPs in intron 1 of the FTO gene affect primary transcript levels. Eur J Hum. Genet., 2010, 18(9), p. 1054-1056.
13. Church, C., Moir, L., McMurray, F. et al. Overexpression of Fto leads to increased food intake and results in obesity. Nat. Genet., 2010, 42(12), p. 1086-1092.
14. Hubacek, J. A., Dlouha, D., Klementova, M., Lanska, V., Neskudla, T., Pelikanova, T. The FTO variant is associated with chronic complications of diabetes mellitus in Czech population. Gene, 2018, 642, p. 220-224.
15. Hubáček, J. A., Pikhart, H., Peasey, A., Kubínová, R., Bobák, M. Nobody Is Perfect: Comparison of the Accuracy of PCR-RFLP and KASP™ Method for Genotyping. ADH1B and FTO Polymorphisms as Examples. Folia Biol., 2015, 61(4), p. 156-160.
16. Clegg, D. J., Brown, L. M., Woods, S. C., Benoit, S. C. Gonadal hormones determine sensitivity to central leptin and insulin. Diabetes, 2006, 55(4), p. 978-987.
17. Hubacek, J. A., Pitha, J., Adamkova, V., Lanska, V., Poledne, R. A common variant in the FTO gene is associated with body mass index in males and postmenopausal females but not in premenopausal females. Czech post-MONICA and 3PMFs studies. Clin. Chem. Lab. Med., 2009, 47(4), p. 387-390.
18. Karra, E., O’Daly, O. G., Choudhury, A. I. et al. A link between FTO, ghrelin, and impaired brain food-cue responsivity. J Clin. Invest., 2013, 123(8), p. 3539-3551.
19. Bravard, A., Vial, G., Chauvin, M. A. et al. FTO contributes to hepatic metabolism regulation through regulation of leptin action and STAT3 signalling in liver. Cell Commun. Signal., 2014,12, p. 4.
20. Grunnet, L. G., Brøns, C., Jacobsen, S. et al. Increased recovery rates of phosphocreatine and inorganic phosphate after isometric contraction in oxidative muscle fibers and elevated hepatic insulin resistance in homozygous carriers of the A-allele of FTO rs9939609. J Clin. Endocrinol. Metab., 2009.
21. Saber-Ayad, M., Manzoor, S., El Serafi, A., Mahmoud, I., Hammoudeh, S., Rani, A., Abusnana, S., Sulaiman, N. The FTO rs9939609 “A” allele is associated with impaired fasting glucose and insulin resistance in Emirati population. Gene, 2019, 681, p. 93-98.
22. Mizuno, T. M. Fat Mass and Obesity Associated (FTO) Gene and Hepatic Glucose and Lipid Metabolism. Nutrients, 2018, 10(11).
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2019 Issue 2-
All articles in this issue
- Vysoce citlivé (hs) kardiální troponiny. Pomníček velkému úsilí, které tak hned neustane.
- Porovnání výsledků vysoce senzitivních stanovení troponinů I (Abbott, Beckman Coulter, Siemens) a troponinu T (Roche)
- Role polymorfismu rs17817449 FTO genu ve vztahu k obezitě a kompenzaci u diabetiků 1. typu
- Elongázy mastných kyselin a jejich účast v patogeneze chorobných stavů
- POCT systém detekce hladin fekálního kalprotektinu při telemonitoringu pacientů s idiopatickými střevními záněty
- Změny močových a sérových markerů poškození ledvin u dospělých pacientů po podání kontrastní látky při angiografii
- Vzácný pyrofosfátový močový konkrement u pětiletého chlapce s kongenitální hypofosfatázií
- Pleurální exsudát pozitivní na paraprotein a volné lehké řetězce jako první příznak mnohočetného myelomu
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Porovnání výsledků vysoce senzitivních stanovení troponinů I (Abbott, Beckman Coulter, Siemens) a troponinu T (Roche)
- POCT systém detekce hladin fekálního kalprotektinu při telemonitoringu pacientů s idiopatickými střevními záněty
- Změny močových a sérových markerů poškození ledvin u dospělých pacientů po podání kontrastní látky při angiografii
- Elongázy mastných kyselin a jejich účast v patogeneze chorobných stavů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

