-
Medical journals
- Career
Klinická štúdia ODYSSEY OUTCOMES
Authors: J. Murín 1; J. Špinar 2
Authors‘ workplace: I. interná klinika LF UK a UN Bratislava 2 Interní kardiologická klinika LF MU a FN Brno 1
Published in: Kardiol Rev Int Med 2018, 20(2): 131-136
Overview
Pacienti s akútnym koronárnym syndrómom (AKS) i po optimálnej liečbe akútneho ochorenia a i pri optimálnej liečbe v rámci sekundárnej následnej prevencie majú naďalej vysoké kardiovaskulárne (KV) riziko morbidity a mortality. Intenzívnejšia liečba dyslipidémie, ďalšia redukcia sérového LDL-cholesterolu (LDL-c), by mala zlepšiť prognózu týchto pacientov, čo bola hypotéza tejto štúdie s liečbou alirokumabom (PCSK9 inhibítorom) vs. placebom pri ostatnej štandardnej liečbe. V štúdii bolo zaradených 18 924 pacientov randomizovaných k tejto liečbe v období 1– 12 mesiacov po AKS. V ramene aktívnej liečby došlo k ďalšej redukcii sérového LDL-c (z úrovne 2,62 na úroveň 1,37 mmol/ l, redukcia 54,7 %). Tento pokles LDL-c viedol k redukcii primárneho endpointu (koronárne úmrtie/ nefatálny infarkt a cievna mozgová príhoda/ hospitalizácia pre nestabilnú anginu pektoris) o 15 % (štatisticky významne – S), aj jeho komponenty boli významne priaznivo ovplyvnené a celková mortalita bola redukovaná tiež o 15 % (S). Benefit bol najvyšší v podskupine pacientov, ktorí do štúdie vstupovali s najvyššou sérovou hladinou LDL-c, t.j. ≥ 2,6 mmol/ l – primárny endpoint bol tu redukovaný o 24 % (S) a KV mortalita o 31 % (S). Liečba bola bezpečná. Odkazom štúdie je významná redukcia výskytu KV príhod (mortality, nefatálnych infarktov myokardu i mozgových príhod, nestabilnej anginy pectoris) u chorých s AKS pomocou alirokumabu – pričom všetci pacienti mali výbornú štandardnú liečbu ochorenia, včítane použitia silných statínov vo vysokých dávkach. Najviac z liečby profitovali pacienti s najvyššou vstupnou sérovou hladinou LDL-c (≥ 2,6 mmol/ l).
Kľúčové slová:
akútny koronárny syndróm – hypercholesterolemia – alirokumab – kardiovaskulárne príhody
Prečo sa naplánovala
Napriek akútnej i následnej modernej liečbe chorých s akútnym koronárnym syndrómom (AKS), t.j. promptná koronárna revaskularizácia a následne dlhodobá duálna antitrombotická liečba, liečba v rámci sekundárnej kardiovaskulárnej (KV) prevencie podľa odporúčaní, vč. intenzívnej liečby silným statínom, sú títo pacienti ďalej vo vysokom riziku výskytu vážnych KV príhod, hlavne v období po prepustení [1 – 3]. Údaje z registrov preukázali, že KV mortalita v období 5 rokov po prekonaní AKS je v úrovni až 13 %, a asi štyri z piatich úmrtí sa udeje v prvých mesiacoch po prepustení [4].
Intenzívna statínová liečba (atorvastatín či rosuvastatín vo vysokých dávkach tolerovaných pacientom) je schopná redukovať sérové hladiny LDL-cholestrolu (LDL-c) okolo 50 %, ale asociácia „redukcie LDL-c s redukciou KV (príhod)“ nemá jasnú prahovú hodnotu, t.j. ak pôjdeme s redukciou LDL-c v sére ďalej, tak dosiahneme aj ďalšiu redukciu KV príhod [5]. Treba tiež dodať, že u chorých po prekonanom AKS či u chorých s chronickou ischemickou chorobou srdca (ICHS) býva následné KV riziko vývoja ďalších (rekurentných) KV príhod veľmi vysoké a je vo vzťahu k sérovej hladine LDL-c [1,6,7]. Okrem toho máme i chorých, ktorí statínovú liečbu netolerujú, a máme i chorých, u ktorých napriek intenzívnej statínovej liečbe sú sérové koncentrácie LDL-c stále vysoké [8,9].
Nuž a potom nie je prekvapením túžba (otázka) či k liečbe statínmi (hoci i silným a vo vysokej dávke) nemožno pridať ďalšiu liečbu, ktorá výrazne zredukuje sérovú koncentráciu LDL-c (oveľa viac ako pridanie ezetimibu) a možno i koncentrácie iných aterogénnych lipoproteínov – všetko s túžbou a cieľom významne a ešte viac redukovať KV riziko týchto chorých.
Proproteín konvertáza subtilizin/ kexin typ 9(PCSK9) je bielkovina – a je to regulátor expresie LDL-receptorov na hepatocytoch. Preto hrá potom významnú úlohu pri riadení (určovaní) sérových koncentrácií LDL-c [10]. Isté pozorovania u osôb s genetickým polymorfizmom PCSK9 podporujú významnú úlohu tohto proteinu v náchylnosti/ podpore k ateroskleróze. Sú dva vyhranené typy mutácie proteínu PCSK9:
- tzv. loss-of-function mutácia (inaktivita či neprítomnosť funkcie PCSK9) znamená u osoby, že má celoživotne nízke sérové koncentrácie LDL-c a súčasne nízku incidenciu príhod v rámci ICHS, a
- tzv. gain-of-function mutácia (kde je aktivita a pôsobenie proteinu PCSK9 výrazné) znamená opak predošlého, t.j. vysokú sérovú hladinu LDL-c celoživotne (tieto osoby majú málo alebo „žiadne“ LDL-receptory na hepatocytoch v dôsledku pôsobenia proteinu PCSK9 pri deštrukcii LDL-receptorov intracelulárne v hepatocytoch) a následne vysokú a predčasnú incidenciu ICHS-príhod [11,12]. Okrem toho aj statíny vedia upregulovať (t.j. zvýšiť) expresiu PCSK9, čím obmedzujú svoju účinnosť v redukcii sérového LDL-c [13].
Alirokumab je plnohodnotnou humánnou monoklonálnou protilátkou voči proteinu PCSK9. V štúdiách alirokumab preukázal redukciu LDL-c podobne ako intenzívna statínová liečba (t.j. ako silné statíny a vo vysokej dávke) [14]. V kombinovanej liečbe, t.j. alirokumab a intenzívna statínová liečba, dochádza potom navyše k významnej redukcii sérovej hladiny LDL-c [15,16]. Roth et al preukázali u pacientov s LDL-c ≥ 2,6 mmol/ l pri liečbe atorvastatínom 10 mg denne následné skutočnosti:
- a) zvýšenie dávky atorvastatínu na 80 mg denne viedlo k ďalšiemu 17% zníženiu sérového LDL-c, ale
- b) pridanie alirokumabu 150 mg s.c. 2× mesačne k liečbe pacientov liečených atorvastatínom v dávke 80 mg denne viedlo k ďalšej redukcii sérového LDL-c o 73 % [17].
Liečba alirokumabom je dobre tolerovaná a len ojedinele sa vyskytujú mierne lokálne reakcie kožné po vpichoch alirokumabu.
Cieľ štúdie ODYSSEY OUTCOMES
Táto štúdia testovala platnosť hypotézy, že „alirokumab v porovnaní s placebom“ bude redukovať KV mortalitu i morbiditu u pacientov s nedávno prekonaným AKS, ktorí súčasne napriek intenzívnej statínovej liečbe (atorvastatín, rosuvastatín) majú sérové hladiny lipoproteínov vyššie, ako to požadujú dnešné odporúčania pre liečbu týchto chorých.
Dizajn štúdie ODYSSEY OUTCOMES
Štúdia bola medzinárodná, multicentrická, randomizovaná, dvojito-slepá a placebom kontrolovaná, zahrňovala 18 924 pacientov s nedávnym AKS – hospitalizovaní pre koronárnu obštrukciu v období 4 – 52 týždňov pred randomizáciou pričom zaradenie pacienta vyžadovalo k tomu ešte aspoň prítomnosť elevácie biomarkerov nekrózy v sére alebo ischemické či infarktové EKG zmeny s regionálnou poruchou kinetiky steny ľavej komory či s perfúznym defektom, alebo s ≥ 70% epikardiálnou koronárnou stenózou pri angiografii či s potrebou koronárnej revaskularizácie. Pacienti mali ≥ 40 rokov a súčasne nedostatočne kontrolované sérové lipidy (LDL-c ≥ 1,81 mmol/ l, non-HDL-c≥ 2,59 mmol/ l alebo apoB ≥ 0,8 mmol/ l) napriek liečbe silnými statínmi (atorvastatín 40 – 80 mg, rosuvastatín 20 – 40 mg), obvykle na najvyššej tolerovanej dávke. Hlavnými dôvodmi nezaradenia pacienta boli: nestabilná hypolipidemická liečba (≥ 2 týždne pred randomizáciou), nekontrolovaná hypertenzia (≥ 180/ 110 mm Hg), srdcové zlyhávanie (NYHA III – IV napriek liečbe, ejekčná frakcia < 25 %), prekonaná hemoragická cievna mozgová príhoda, triacylglyceroly > 4,52 mmol/ l pri randomizácii, AKS či koronárna revaskularizácia do 2 týždňov pred randomizáciou či plánovaný zákrok po randomizácii, AST a ALT aj kreatin-kináza > 3násobok hornej normy, glomerulárna filtrácia < 30 ml/ min, aktívna hepatitída B či C, pozitívny gravidárny test a liečba fibrátmi (s výnimkou fenofibrátu).
Primárnym endpointom bolo zhodnotiť, či liečba alirokumabom (75 mg alebo 150 mg s.c. každý druhý týždeň), započatá 1 – 12 mesiacov po AKS, vie redukovať incidenciu „koronárneho úmrtia – nefatálneho myokardiálneho infarktu a nefatálnej mozgovej ischemickej cievnej príhody a tiež hospitalizácie pre nestabilnú anginu pektoris“ (zložený endpoint).
Dizajn štúdie je na obr. 1. Úvodná (run-in), 2 – 16týždňová, fáza, kde sa pacient učil podávať s.c. testované liečivo (placebo), nastolil sa vtedy metabolický „steady state“ po AKS včítane dobrej kontroly sérových lipidov (pri liečbe silnými statínmi). Pacienti vyhovujúci vstupným aj vylučovacím kritériám boli potom v druhej fáze štúdie (dvojito-slepej) randomizovaní k liečbe alirokumabom 75 mg s.c. každé 2 týždne vs. k liečbe placebom. Vizity sa naplánovali na 1., 2., 4., 8., 12., 16., 20. a 24. mesiac po randomizácii a potom 2× ročne. Zabezpečené bolo laboratórne testovanie krvi (lipoproteiny, hematologické bežné testy, obvyklé bežné biochemické testy funkcie obličiek, pečene, svalstva, HbA1c, hsCRP, protilátky voči alirokumabu, gravidárne testy) a moču. LDL-c v sére sa kalkuloval Friedewaldowou formulou (s výnimkou ak boli hodnoty veľmi nízke: < 0,38 mmol/ l (15 mg/ dl), alebo ak mal pacient sérové triacylglyceroly > 4,52 mmol/ l – vtedy sa LDL-c stanovoval priamo) [18].
Image 1. ODYSSEY Outcomes – dizajn štúdie. Upravené podľa [20]. ![ODYSSEY Outcomes – dizajn štúdie. Upravené podľa [20].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b0626a9f58a3bec5f55a343abaafe1d4.jpeg)
* po schválení zmeny a doplnenia; 4–6 týždňov pred schválením zmeny AKS – akútna ischemická choroba, ICHS – ischemická choroba srdca, IM – infarkt myokardu, CMP – cievna mozgová príhoda, LDL-c – LDL cholesterol, HDL-c – HDL cholesterol Ešte sa vyšetrovali hladiny PCSK9, lipoproteinové subfrakcie, mediátory zápalu a KV rizika. Pacienti boli v oboch ramenách liečby na dobrej hypolipidemickej liečbe, a preto v štúdii neboli lekári-investigátori a ani pacienti informovaní o hodnotách sérových lipidov. V štúdii sa kontrolovali sérové lipoproteiny u zaradených pacientov:
- v ramene liečby alirokumabom, ak bola hladina LDL-c po mesiaci liečby (od randomizácie) stále ≥ 1,29 mmol/ l (50 mg/ dl), tak sa dávka liečiva zvýšila na 150 mg s.c. každé 2 týždne;
- ak po mesiaci liečby bola hodnota LDL-c v sére < 1,29 mmol/ l (50 mg/ dl), tak sa i ďalej podával alirokumab v dávke 75 mg/ dl;
- ak sérová hladina LDL-c bola po mesiaci liečby < 0,64 mmol/ l (25 mg/ dl) (potrebné však boli 2 takéto merania) pri liečebnej dávke 150 mg, tak sa táto dávka redukovala na 75 mg (každé 2 týždne);
- ak bola sérová hladina LDL-c < 0,64 mmol/ l (25 mg/ dl) ale ≥ 0,38 mmol/ l (15 mg/ dl) (opäť dve merania po sebe), tak sa pokračovalo v dávke 75 mg s.c. alirokumabom (súčasne bol pacient podrobne monitorovaný pre nežiaduce účinky);
- ak sa sérová hladina LDL-c 2× po sebe nachádzala na hladine < 0,38 mmol/ l (15 mg/ l) pri liečbe alirokumabom 75g (každé 2 týždne), tak sa liečba alirokumabom zastavila (pacient dostal placebo až do konca štúdie).
Monitorovanie benefitu liečby alirokumabom
V štúdii sa analyzovali KV príhody (primárny endpoint – doba do koronárneho úmrtia, do výskytu nefatálneho infarktu myokardu/ nefatálnej ischemickej cievnej mozgovej príhody, do hospitalizácie pre nestabilnú angínu pektoris), ale aj nežiaduce príhody. Sekundárne endpointy boli nasledovné: potreba koronárnej revaskularizácie, hospitalizácia pre srdcové zlyhávanie, celková mortalita, tiež jednotlivé „súčasti“ primárneho endpointu. Ďalej sa analyzovali zmeny už spomínaných sérových lipidov, HbA1c, hs CRP. Používal sa aj osvedčený dotazník kvality života (EUROQOL-5) [19].
Nežiadúce účinky sa zbierali hlavne o alergickej príhode a o lokálnej kožnej reakcii v mieste podania alirokumabu. Hodnotili sa i prípady hemolytickej anémie a abnormality neurokognície (osobitne u pacientov, ktorí pri liečbe mali veľmi nízke sérové hladiny LDL-c). Protilátky voči alirokumabu sa merali pri randomizácii, v mesiacoch 2, 4, 12 a potom 1× ročne a pri odstúpení chorého zo štúdie.
Výskyt primárneho endpointu sa analyzoval podľa princípu „intention-to-treat“. Štatistiku zabezpečoval zdatný team Univerzity v New Yorku (SUNY) a vopred naplánoval hodnotenie [20].
Výsledky štúdie ODYSSEY OUTCOMES
Výsledky boli zverejnené na Americkom kardiologickom kongrese 10. marca 2018 [21]:
- Do štúdie zahrnuli 18 924 pacientov, ktorí boli rovnomerne randomizovaní na liečbu alirokumabom či placebom (po 9 462 pacientoch). Medián sledovania chorých v štúdii bol 2,8 rokov. Nazbieralo sa 1 955 primárnych endpointov: 726 úmrtí, prerušenie liečby bolo v úrovni 14 – 15 % pacientov, niekoľko „stratených pacientov“ (14 v ramene alirokumabovom vs. 9 v placebovom ramene).
- Vstupné charakteristiky pacientov boli nasledovné: 58 rokov priemerný vek, 25 % pacientov boli ženy, hypertenziou trpelo 65 % zaradených, diabetom 28 %, fajčiarov bolo 24 % a u 19 % zaradených bol už predtým prekonaný infarkt. V priemere boli pacienti zaradení do štúdiovej liečby 2,6 mesiacov po vzniku AKS. Rozdelenie chorých podľa jednotlivých typov AKS bolo nasledovné: s eleváciami ST úsekov (STEMI prípady – 35 % pacientov), bez elevácie ST úsekov (NSTEMI prípady – 48 %), pacienti s nestabilnou angínou pektoris (16,6 % chorých). Revaskularizáciu pri AKS podstúpilo 71,8 % chorých. Vstupné sérové lipidy: LDL-c (87 mg/ dl, 2,24 mmol/ l), HDL-c (43 mg/ dl, 1,11 mmol/ l), triacylglyceroly (129 mg/ dl, 1,45 mmol/ l), Lp(a) (21 mg/ dl), ApoB (79 mg/ dl). Liečba hypolipidemická bola výborná, nakoľko 89 % pacientov užívalo silný statín a vo vysokej dávke, ezetimib užívalo 2,8 % pacientov, nízku dávku statínov užívalo 8,8 % chorých a bez tejto liečby bolo len 0,9 % chorých. Aj ostatná liečba bola veľmi dobrá – kyselinu acetylsalicylovú užívalo 95,6 % zaradených, klopidogrel 87 % chorých, ACE inhibítor či sartan užívalo 77,7 % chorých, betablokátory 84,5 % pacientov a aj ostatná liečba bola výborná v oboch podskupinách pacientov.
- Výsledky sérových lipidov pri liečbe – alirokumab redukoval po 4 rokoch sledovania sérový LDL-c z úrovne 101,4 mg/ dl (2,62 mmol/ l) na úroveň 53,3 mg/ dl (1,37 mmol/ l), t.j. o 54,7 % (graf 1).
- Výsledky klinické:
- a) V placebovom ramene liečby bol 11,1% výskyt KV príhod a tento výskyt primárneho endpointu alirokumab redukoval o 15 % (RR 0,85, štatisticky významne) (graf 2). Efekt sa dal poznať na konci 1. roku liečby. Absolútne riziko výskytu príhod bolo redukované o 1,6 %.
- b) Aj komponenty primárneho endpointu boli dobre ovplyvnené: mortalita na ischemickú chorobu srdca (0,92; NS), výskyt nefatálneho infarktu (RR 0,86; S), výskyt nefatálnej mozgovej príhody (0,73; S) a aj výskyt nestabilnej angíny pektoris (0,61; S) (tab. 1). Druhotné endpointy boli tiež dobre ovplyvnené (RR 0,85 – 0,92, väčšinou štatisticky významne), aj celková mortalita (RR 0,85; S) (graf 3) a tiež potreba revaskularizácie pre ischémiu myokardu (RR 0,88; S).
- c) Benefit liečby alirokumabom závisel od vstupnej sérovej hladiny LDL-c a bol najvyšší v podskupine chorých so sérovým LDL-c > 100 mg/ dl (2,58 mmol/ l): tu bola redukcia primárneho endpointu 24 % (RR 0,76; S) (obr. 2), podobne celková mortalita (0,71; S, tab. 2), aj KV mortalita (RR 0,69; S).
- d) Benefit liečby alirokumabom bol prítomný vo všetkých podskupinách pacientov, rozdelených do podskupín podľa veku, pohlavia, rizikových faktorov a ochorení.
- Bezpečnosť liečby bola vynikajúca – išlo viacmenej len o lokálne reakcie po vpichoch (alirokumab vs. placebo (3,8 vs. 2.1 %)), ostatné nežiaduce účinky boli podobne časté ako v placebovom ramene liečby.
Graph 1. LDL-cholesterol – na liečbe. 
LDL- c – LDL cholesterol Graph 2. ODYSSEY Outcomes – primárny cieľ. 
Primárný cieľ – ischemická choroba srdca, nefatálny infarkt myokardu, ischemická cievna mozgová príhoda, nestabilná angina pectoris vyžadujúca hospitalizáciu Table 1. Účinnosť při LDL-c ≥ 2,6 mmol/l. 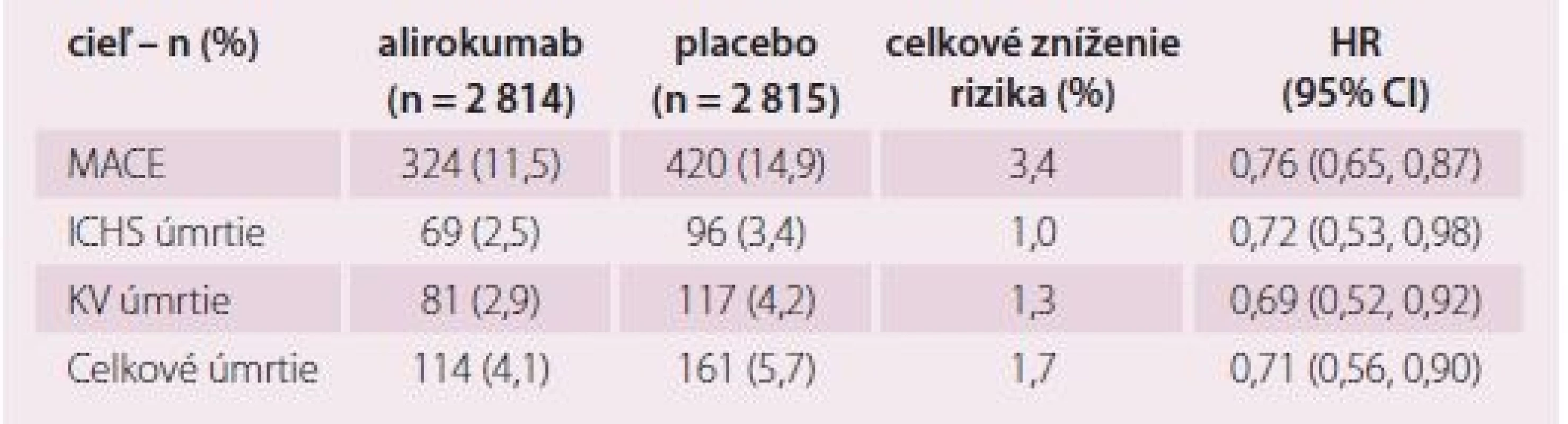
MACE – závažné srdcové komplikácie, LDL-c – LDL cholesterol, KV – kardiovaskulárne, ICHS – ischemická choroba srdca Image 2. Primárny cieľ v preddefi novaných skupinách. 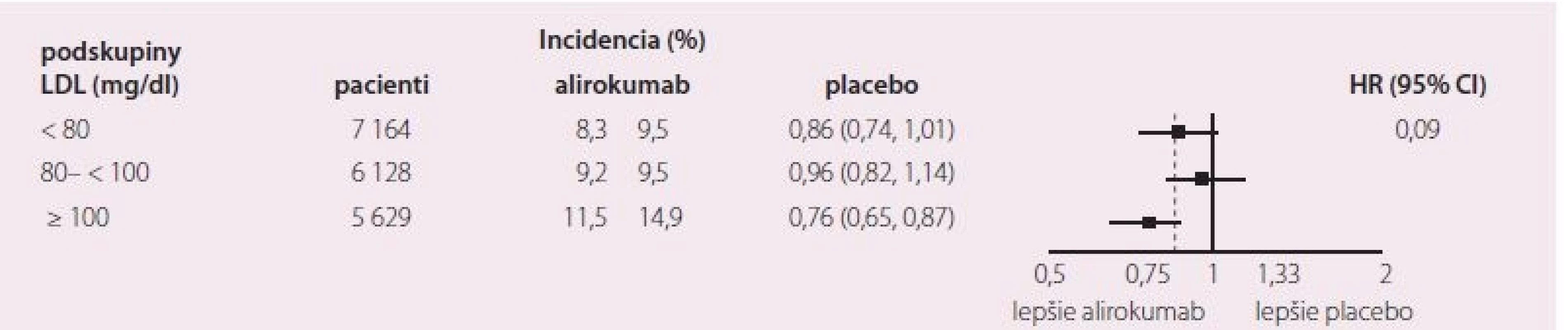
Odkaz štúdie – záver
Dá sa konštatovať, že alirokumab významne redukoval výskyt KV príhod (mortality, nefatálnych infarktov myokardu i mozgových príhod, tiež nestabilnej anginy pektoris) u chorých s AKS, ktorí dostávajú výbornú liečbu AKS a tiež silnú/ intenzívnu statínovú liečbu. Aj celková mortalita chorých bola významne redukovaná. Najviac z liečby profitovala podskupina chorých s najvyššou vstupnou hladinou LDL-c v sére (> 100 mg/ dl; 2,58 mmol/ l), kde bola redukcia príhod primárneho endpointu až 24 % a celkovej mortality až 29 %. Liečba bola veľmi bezpečná. Iste tí najrizikovejší chorí po AKS sú vhodnými pacientami pre túto liečbu.
Doručeno do redakce: 31. 3. 2018
Přijato o recenzi: 10. 4. 2018
prof. MU Dr. Ján Murín, CSc.
Sources
1. Schwartz GG, Olsson AG, Abt M et al. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N Engl J Med 2012; 367(22): 2089 – 2099. doi: 10.1056/ NEJMoa1206797.
2. Schwartz GG, Olsson AG, Ezekowitz MD et al. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial. JAMA 2001; 285(13): 1711 – 1718.
3. Cannon CP, Braunwald E, McCabe CH et al. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med 2004; 350(15): 1495 – 1504. doi: 10.1056/ NEJMoa040583.
4. Fox KA, Carruthers KF, Dunbar DR et al. Underestimated and underrecognized: the late concequences of acute coronary syndrome (GRACE UK-Belgian Study). Eur Heart J 2010; 31(22): 2755 – 2764. doi: 10.1093/ eurheartj/ ehq326.
5. Stamler J, Wentworth D, Neaton JD. Is relationship between serum cholesterol and risk of premature death from coronary heart disease continuous and graded? Finding in 356,222 primary screenees of the Multiple Risk Factor Intervention. Trial (MRFIT). JAMA 1986; 256(20): 2823 – 2828.
6. Baigent C, Blackwell L, Emberson J et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376(9753): 1670 – 1681. doi: 10.1016/ S0140-6736(10)61350-5.
7. Wiviott SD, Cannon CP, Morrow DA et al. Can low-density lipoprotein be too low? The safety and efficacy of achieving very low low-density lipoprotein with intensive statin therapy: a PROVE IT-TIMI 22 substudy. J Am Coll Cardiol 2005; 46(8): 1411 – 1416. 10.1016/ j.jacc.2005.04.064.
8. Karalis DG, Victor B, Ahedor I et al. Use of lipid--lowering medications and the likelihood of ochieving optimal LDL-cholesterol goals in coronary artery disease patients. Cholesterol 2012; 2012 : 861924. doi: 10.1155/ 2012/ 861924.
9. Kotseva K, Wood D, De Backer G et al. EUROASPIRE III: a survey on the lifestyle, risk factors and use of cardioprotective drug therapies in coronary patients from 22 European countries. Eur J Cardiovasc Prev Rehabil 2009; 16(2): 121 – 137. doi: 10.1097/ HJR.0b013e3283294b1d.
10. Do RQ, Vogel RA, Schwartz GG. PCSK9 inhibitors: potential in cardiovascular therapeutics. Curr Cardiol Rep 2013; 15(3): 345. doi: 10.1007/ s11886-012-0345-z.
11. Cohen JC, Boerwinkle E, Mosley TH Jr et al. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med 2006; 354(12): 1264 – 1272.
12. Naoumova RP, Tosi I, Patel D et al. Severe hypercholesterolemia in four British families with the D374Y mutation in the PCSK9 gene: long-term follow-up and treatment response. Arterioscler Thromb Vasc Biol 2005; 25(12): 2654 – 2660. doi: 10.1161/ 01.ATV.0000190668.94752.ab.
13. Welder G, Zineh I, Pacanowski MA et al. High-dose atorvastatin causes a rapid sustained increase in human serum PCSK9 and disrupts its correlation with LDL cholesterol. J Lipid Res 2010; 51(9): 2714 – 2721. doi: 10.1194/ jlr.M008144.
14. Stein EA, Mellis S, Yancopoulos GD et al. Effect of a monodonal antibody to PCSK9 on LDL cholesterol. N Engl J Med 2012; 366(12): 1108 – 1118. doi: 10.1056/ NEJMoa1105803.
15. McKenney JM, Koren MU, Kereiakes DJ et al. Safety and efficacy of a monoclonal antibody to proprotein convertase subtilisin/ kexin type 9 serine protease, SAR236553/ REGN727, in patients with primary hypercholesterolemia receiving ongoing stable atorvastatin therapy. J Am Coll Cardiol 2012; 59(25): 2344 – 2353. doi: 10.1016/ j.jacc.2012.03.007.
16. Stein EA, Gipe D, Bergeron J et al. Effect of a monoclonal antibody to PCSK9, REGN727/ SAR236553, to reduce low-density lipoprotein cholesterol in patients with heterozygous familial hypercholesterolaemia on stable statin dose with or without ezetimibe therapy: a phase 2 randomised controlled trial. Lancet 2012; 380(9836): 29 – 36. doi: 10.1016/ S0140-6736(12)60771-5.
17. Roth EM, McKenney JM, Hanotin C et al. Atorvastatin with or without an antibody to PCSK9 in primary hypercholesterolemia. N Engl J Med 2012; 367(20): 1891 – 1900. doi: 10.1056/ NEJMoa1201832.
18. Martin SS, Blaha MJ, Elshazly MB et al. Friedewald-estimated versus directly measured low-density lipoprotein cholesterol and treatment implications. J Am Coll Cardiol 2013; 62(8): 732 – 739. doi: 10.1016/ j.jacc.2013.01.079.
19. Dolan P. Modeling valuations for EuroQol health states. Med Care 1997; 35(11): 1095 – 1108.
20. Schwartz GG, Bessac L, Berdan LG et al. Effect of alirocumab, a monoclonal antibody to PCSK9, on long-term cardiovascular outcomes following acute coronary syndromes: rationale and design of the ODDYSSEY OUTCOMES trial. Am Heart J 2014; 168(5): 682 – 689.e1. doi: 10.1016/ j.ahj.2014.07.028.
21. Steg PG, Schwartz GG, Szarek M et al. The ODYSSEY OUTCOMES Trial: Topline results. Alirocumab in patients after acute coronary syndrome. American College of Cardiology – 67th Scientific Sessions, 2018, Orlando USA. Available at: https:/ / accscientificsession.acc.org/ .
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2018 Issue 2-
All articles in this issue
- Arytmie u mladých dospělých
- Prevence náhlé srdeční smrti u pacientů do 40 let věku
- Juvenilní hypertenze
- Chronická žilní insuficience a varixy dolních končetin u mladých osob
- Význam a léčba dyslipidemie u mladých dospělých
- Diabetes mellitus a kardiovaskulární onemocnění
- Možnosti ovlivnění inzulinové rezistence u jedinců s diabetem 1. typu
- Klinická štúdia ODYSSEY OUTCOMES
- Kyslíková terapie při podezření na akutní infarkt myokardu – studie DETO2X-AMI
- Fixní kombinace rosuvastatinu s ezetimibem – lékový profil
- Manažment hypertenzikov s končatinovocievnou artériovou chorobou
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Arytmie u mladých dospělých
- Juvenilní hypertenze
- Fixní kombinace rosuvastatinu s ezetimibem – lékový profil
- Chronická žilní insuficience a varixy dolních končetin u mladých osob
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


