-
Medical journals
- Career
Atherosclerosis of the intracranial arteries – current view, 2nd part
Authors: J. Žižka
Authors‘ workplace: I. interní klinika, FTNsP/IPVZ, Praha 44
Published in: Kardiol Rev Int Med 2012, 14(1): 40-45
Overview
Ateroskleróza intrakraniálních tepen je relativně časté onemocnění a pacienti se symptomatickým postižením intrakraniálního tepenného řečiště mají závažnou prognózu. Ta je nepříznivá zejména u nemocných s těžkými, tj. více než 70% stenózami. V současné době došlo s rozvojem neinvazivních a minimálně invazivních diagnostických metod k významnému nárůstu informací o tomto onemocnění. Nicméně léčebné možnosti zůstávají omezené a nepřinášejí uspokojivé výsledky. Naprostá většina nemocných je léčena konzervativně se zaměřením na antitrombotickou léčbu a agresivní snahu o ovlivnění rizikových faktorů aterosklerózy a na základě recentně publikovaných dat by tomu mělo být i nadále. Sdělení je rozděleno na dvě části – tato druhá část je věnována diagnostice a léčbě.
Klíčová slova:
ateroskleróza – intrakraniální stenózy – diagnóza – transkraniální duplexní sonografie – antitrombotická léčba – endovaskulární intervenceDiagnostika
K výraznému zvýšení našich znalostí o ateroskleróze IC tepen přispěl rozvoj a dostupnost nových, neinvazivních či minimálně invazivních diagnostických metod. V současnosti je za „zlatý standard“ stále považována digitální subtrakční angiografie (DSA) [1]. Tato metoda má svá známá omezení: je invazivní s nezanedbatelným rizikem komplikací, je drahá, časově náročná a jako screeningová metoda je nevhodná. Z novějších diagnostických metod se v současnosti uplatňuje zejména CT angiografie (CTA), MR angiografie (MRA) a ultrazvukové metody – transkraniální dopplerometrie (TCD) a transkraniální barevná duplexní sonografie (TCCS). CTA je metoda, která je v současnosti relativně dostupná, je v porovnání s DSA minimálně invazivní s menším rizikem komplikací a její senzitivita a specificita v diagnostice okluzí a stenóz IC tepen je srovnatelná s DSA. V relativně recentní studii, ve které byly obě tyto metody srovnávány (DSA jako standard), byla specificita a senzitivita CTA v diagnostice okluzí 100 % a v diagnostice stenóz ≥ 50 % byly senzitivita 97,1 %, specificita 99,5 a negativní prediktivní hodnota 99,8 % [1]. V jiných studiích byla CTA dokonce nadřazená DSA [2,3]. MRA je v současnosti méně dostupná a může významnost stenóz nadhodnocovat [4,5]. Ze všech výše uvedených metod jsou nejméně invazivní, resp. zcela neinvazivní metody ultrazvukové. V diagnostice IC stenóz i okluzí lze využít TCD i TCCS, přičemž obě metody jsou schopny přes intaktní lebku změřit průtok IC tepnami. TCCS však umožňuje na rozdíl od TCD i přímé zobrazení tepen (obr. 1) a obě metody jsou rovněž vhodné k zhodnocení hemodynamických následků postižení extra - i intrakraniálních úseků mozkových tepen. Nevýhodou UZ vyšetřovacích metod je ovšem značná závislost na zkušenosti vyšetřujícího a až u 20 % vyšetřovaných (zejména starších žen) nedostatečná kvalita akustického okna neumožňující dostatečně kvalitní vyšetření. Nicméně vzhledem ke své relativně vysoké senzitivitě i specificitě [6], neinvazivnosti, relativně nízké ceně a možnosti opakovaných vyšetření je TCCS velmi vhodná metoda v diagnostice postižení IC tepen a ve sledování jejich vývoje v čase [7].
Image 1. Vertebrální tepny zobrazené v CFM módu pomocí TCCS. 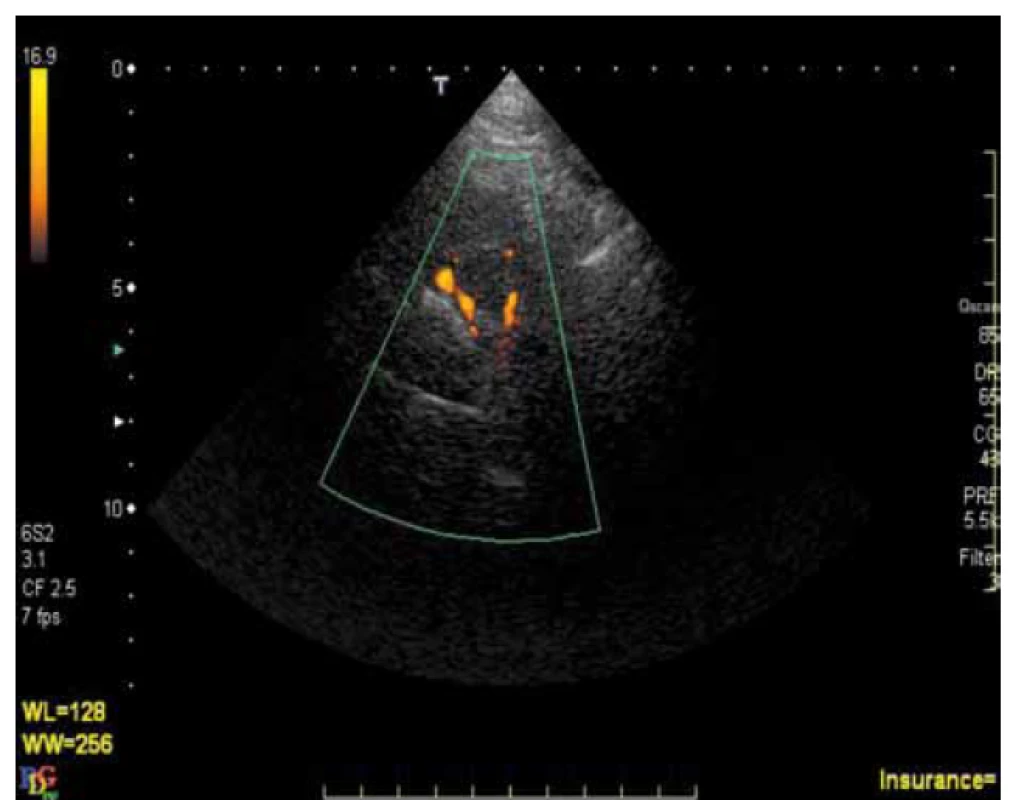
Výše uvedené metody dovolují diagnostiku postižení IC tepen opírající se o detekci až pokročilých stadií jejich postižení. Jejich nevýhodou je nemožnost s dostatečnou citlivostí odhalit méně pokročilá stadia onemocnění, nedovolují diferencovat etiologii stenóz a v případě aterosklerotického původu stenóz neodhalují histopatologické složení, resp. aktivitu plátu [8]. Naproti tomu nejnovější diagnostické metody jako hr-MR nebo intravaskulární UZ umožňují přímé zhodnocení aterosklerotických plátů vč. zhodnocení jejich aktivity. Tyto metody nejsou v současnosti běžně dostupné a jejich klinický význam musí být teprve stanoven. Srovnání tradičních a nových diagnostických metod a jejich možností ukazuje tab. 1.
Table 1. Srovnání tradičních a nových diagnostických metod. Převzato z [8]. ![Srovnání tradičních a nových diagnostických metod. Převzato z [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b8ee14a7af9e1988c5bc665241460359.png)
Léčba
Naprostá většina nemocných se stenózami IC tepen je v současné době léčena konzervativně, i když k dispozici jsou rovněž metody endovaskulární intervenční terapie – soudilo se, že představují alternativu zejména pro vysoce rizikové nemocné. Výsledky studie SAMMPRIS však tento předpoklad nepotvrdily – podrobnosti viz další text.
Farmakologická léčba se opírá o dva základní pilíře, léčbu antitrombotickou a farmakologickou (vedle obvyklých režimových opatření) kontrolu RF aterosklerózy.
Antitrombotická léčba
Nejvíce údajů máme o léčbě antitrombotické a to díky již opakovaně citované studii WASID, jejíž výsledky jsou podrobněji probrány v předchozím textu. I po zveřejnění výsledků, které prokázaly, že léčba aspirinem je stejně účinná, ale významně bezpečnější než léčba warfarinem, panoval názor, že u některých vybraných skupin pacientů může být prospěšnější léčba warfarinem. Jednalo se konkrétně o nemocné s postižením vertebrobazilárního řečiště, těžkými, ≥ 70% stenózami, a o nemocné, u nichž došlo k tzv. selhání antitrombotické léčby, čili v době výskytu CMP//TIA již byli z různých důvodů chronicky léčeni aspirinem. Ve snaze zodpovědět otázku, zda je v těchto případech warfarin skutečně účinnější, byly provedeny příslušné post-hoc analýzy. Výsledky rěchto analýz však prokázaly, že nebyl významný rozdíl v účinnosti mezi aspirinem a warfarinem u nemocných s těžkými stenózami ani u těch nemocných, kteří v době vstupu do studie byli již na antitrombotické léčbě. Byl však zjištěn významný rozdíl ve prospěch warfarinu u nemocných, kteří měli symptomatické postižení bazilární tepny, neboť primárního cíle sledování (iCMP/mozková hemoragie/cévní smrt z ostatních příčin) bylo dosaženo u 18 nemocných z 55 (33 %) ve skupině léčené aspirinem a u 9 z 57 nemocných léčených warfarinem (16 %, HR 2,28, 95% CI 1,02–5,08, p = 0,044). Nebyl ale významný rozdíl ve výskytu CMP v teritoriu postižené tepny. Učinit definitivní závěr z tohoto pozorování je obtížné, neboť jeho významnost je oslabena jak malými počty a širokým intervalem spolehlivosti, tak faktem, že pokud byli hodnoceni nemocní s postižením vertebrálních tepen, numericky (ale nikoli statisticky významně) byl nižší výskyt příhod ve skupině léčené aspirinem. Při hodnocení vertebrobazilárního řečiště jako celku pak mezi skupinami rozdíl nebyl. V současnosti tedy převládá názor, že i u pacientů s postižením AB je lékem volby aspirin.
Dalším zajímavým výsledkem je pozorování, že nemocní zařazení do studie časně po proběhlé příhodě, tj. ≤ 17 dní, měli větší prospěch z léčby warfarinem, zatímco nemocní zařazení více než 17 dní po příhodě profitovali více z léčby aspirinem. Rozdíly v obou případech nedosáhly statistické významnosti, statisticky významný byl pouze trend. Nicméně je možné, že v časných stadiích po proběhlé mozkové příhodě je intenzivnější antitrombotická léčba po omezenou dobu přínosná [9].
Další post-hoc analýza potvrdila pozorování z výše uvedené analýzy, tedy že není rozdíl mezi aspirinem a warfarinem u nemocných se „selháním antitrombotické léčby“, neboť neprokázala významný rozdíl ve výskytu CMP a mortality z cévních příčin ani ve výskytu CMP v teritoriu postižené tepny mezi oběma skupinami. Velmi zajímavé je, že také nebyl prokázán rozdíl ve výskytu uvedených příhod mezi nemocnými, kteří již na léčbě antitrombotiky byli, a těmi, u kterých byla tato léčba zahájena až po randomizaci (HR 0,86, 95% CI 0,55–1,34, p = 0,51 pro výskyt CMP/vaskulární smrti; HR 1,01, 95% CI 0,58–1,77, p = 0,97 pro výskyt CMP v teritoriu postižené tepny). Nepotvrdil se tak předpoklad, že nemocní s tzv. klinickým selháním antitrombotické léčby mají horší prognózu než nemocní, u kterých je antitrombotická léčba zahájena nově [10].
Již bylo uvedeno, že je možné, že intenzivnější antitrombotická léčba po omezenou dobu v časných stadiích po proběhlé CMP/TIA může být prospěšná ve srovnání s monoterapií aspirinem. Recentně byla publikována studie CLAIR, jejíž výsledky tento názor potvrzují. Tato studie se zaměřila na posouzení účinnosti a bezpečnosti duální antiagregace aspirinem a klopidogrelem ve srovnání s aspirinem samotným u nemocných s CMP/TIA na podkladě postižení intrakraniálních tepen. Jednalo se o prospektivní randomizovanou studii, nemocní byli zařazeni během sedmi dní po proběhlé příhodě, clopidogrel byl podáván první den v dávce 300 mg/den, poté v obvyklé dávce 75 mg/den, aspirin v obou skupinách v dávce 75–160 mg/den. Léčba trvala sedm dní. Primárním cílem sledování byla proporce pacientů s alespoň jedním mikroembolizačním signálem registrovaným při TCD dva dny po randomizaci. Výskyt těchto signálů u nemocných se symptomatickými stenózami mozkových tepen je významným prediktorem následných mozkových příhod, a je tedy vhodným cílem sledování ve studiích, do kterých není možné zařadit dostatek nemocných nutných k hodnocení klinických příhod. Zařazeno bylo 100 nemocných, po dvou dnech sledování mělo alespoň jeden TCD signál 14 ze 45 nemocných ve skupině léčené duální antiagregací ve srovnání s 27 nemocnými z 50 ve skupině léčené aspirinem samotným (RRR 42,4 %, 95% CI 4,6–65,2, p = 0,025). Rozdíl byl ještě výraznější po dalších pěti dnech. Došlo rovněž k významnému snížení celkového množství mikroembolizačních signálů [11]. Tyto výsledky jsou ve shodě s výsledky podobně uspořádané studie CARESS, ve které kombinace aspirin plus klopidogrel v krátkodobé léčbě vedla k významné redukci mikroembolizačních signálů ve srovnání s aspirinem samotným, ovšem u nemocných se symptomatickými stenózami extrakraniálních úseků vnitřních karotických tepen [12]. Obr. 2 ukazuje hlavní výsledky metaanalýzy obou studií.
Image 2. Metaanalýza studií CARESS a CLAIR. Podle [11]. ![Metaanalýza studií CARESS a CLAIR. Podle [11].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7a83db829d1bf4c7ed5f8e4338befb65.png)
Zda se duální antiagregační léčba kombinací aspirin plus klopidogrel stane součástí běžného postupu v léčbě nemocných se symptomatickými stenózami mozkových tepen je ovšem zatím nejasné, je třeba vyčkat na výsledky větších, na klinické endpointy zaměřených randomizovaných studií, zejména s ohledem na výsledky velké studie MATCH, ve které dlouhodobá duální antiagregační léčba (klopidogrel plus aspirin) nebyla účinnější než klopidogrel samotný, vedla však k významně vyššímu riziku krvácení. Tato studie však byla odlišného uspořádání a zaměřená na heterogenní skupinu pacientů po prodělané iCMP různého původu [13].
Kombinace aspirin plus dipyridamol je účinná v dlouhodobé sekundární léčbě nemocných po prodělané iCMP, nemáme však žádná data o jejím významu specificky u nemocných s IC stenózami. Jedinou další antiagregační látkou, která byla studována u skupiny nemocných se symptomatickými IC stenózami, je cilostazol. Ten byl srovnáván v kombinaci s aspirinem oproti aspirinu samotnému v randomizované, dvojitě slepé studii u nemocných se symptomatickými IC stenózami. V průběhu šestiměsíčního sledování však překvapivě nedošlo k výskytu CMP v žádné skupině, ale progrese stenóz byla signifikantně snížena ve skupině s duální antiagregací (6,7 % vs 28,8 %, p = 0,008) [14]. Tento výsledek vedl k zahájení studie TOSS-II, ve které je u nemocných se symptomatickými stenózami IC tepen srovnávána kombinace aspirin plus cilostazol oproti kombinaci aspirin plus klopidogrel (ClinicalTrials.gov identifier: NCT00130039). V této studii kombinace cilostazol plus ASA nevedla ke zpomalení progrese postižení ACM či bazilární tepny (primární cíl studie) ani k redukci klinických příhod ve srovnání s kombinací klopidogrel plus ASA.
Na základě výše uvedených faktů je tak v současnosti základním postupem v rámci antitrombotické léčby u nemocných se symptomatickými stenózami IC tepen dlouhodobé podávání aspirinu.
Léčba arteriální hypertenze
Arteriální hypertenze je zásadním rizikovým faktorem vzniku CMP/TIA stejně jako rozvoje AS intrakraniálních tepen a její léčba vede k významnému snížení incidence cerebrovaskulárních příhod v primární i sekundární prevenci. V současné době ale není zcela jasné, k jakým cílovým hodnotám snižovat TK v rámci sekundární prevence cévních mozkových příhod, a rovněž tak není jasná přesná cílová hodnota TK ani u nemocných s aterosklerózou extrakraniálních úseků mozkových tepen [15,16]. Široce přetrvává obava, že přílišné snižování TK u nemocných s chronickým cerebrovaskulárním onemocněním může mít negativní dopad na prognózu nemocných vzhledem k možnému snížení cerebrálního perfuzního tlaku. Tyto obavy jsou u nemocných se stenózami intrakraniálních tepen ještě akcentované.
Ve studii WASID mělo arteriální hypertenzi 84 % nemocných, naprostá většina z nich (96 %) byla léčena antihypertenzivy, většinou dvoj - či více kombinací. Výsledky post-hoc analýzy ukázaly, že sTK ≥ 140 mmHg byl spojen s významně vyšším rizikem CMP/IM//cévní smrti (HR 1,79, 95% CI 1,27–2,52, p = 0,0009) i iCMP samotné (HR 1,58, 95% CI 1,07–2,32, p = 0,02). Výskyt kombinovaného cíle sledování během 1,8 roku sledování byl u nemocných s sTK ≥ 140 mmHg 30,7 %, zatímco u nemocných s sTK ≤ 140 mmHg byl pouze 18,3 % (p < 0,0005) [17].
V další post-hoc analýze této studie bylo hodnoceno riziko výskytu iCMP a iCMP v teritoriu postižené tepny v závislosti na hodnotách systolického i diastolického TK, podle jejichž hodnot byli nemocní rozřazeni do několika skupin (sTK: ≤ 119 mmHg, 120–139 mmHg, 140–159 mmHg, ≥ 160 mmHg; dTK: ≤ 79 mmHg, 80–89 mmHg, ≥ 90 mmHg). Jak vyšší hodnoty sTK, tak vyšší hodnoty dTK byly spojeny s významně vyšším rizikem iCMP i iCMP v teritoriu postižené tepny (p = 0,0008 pro sTK, p < 0,0001 pro dTK). Významný je rovněž nález, že riziko uvedených příhod nebylo zvýšeno ve skupinách s nejnižšími hodnotami systolického ani diastolického TK. Riziko iCMP a iCMP v teritoriu postižené tepny ve skupinách s nejnižšími hodnotami sTK a dTK nebylo zvýšené ani u nemocných, kde jsou obavy z přílišného snižování TK obzvlášť patrné, tedy u nemocných s těžkými (≥ 70%) stenózami a u nemocných s postižením zadní mozkové cirkulace [18].
Uvedená pozorování tedy nepotvrzují obavy z přílišného snižování TK (v rozsahu uvedených hodnot TK), naopak svědčí ve prospěch intenzivní kontroly TK. Nemocní se symptomatickým postižením IC tepen nemají být vyloučeni z obecných doporučení pro léčbu arteriální hypertenze a lze u nich obecně doporučit snižování TK jistě pod 140/90 mmHg [19,20].
Léčba dyslipidemie
Vliv poruchy lipidového metabolizmu na riziko CMP je méně silný než v případě jiných KV příhod. Léčba statiny snižuje riziko CMP u nemocných s aterosklerózou a u nemocných po TIA/CMP aterotrombotického původu, ale podobně jako v případě léčby hypertenze, u nemocných s postižením intrakraniálních tepen máme k dispozici pouze data z post-hoc analýzy WASID. Zde mělo poruchu lipidového metabolizmu 71 % nemocných, z nich 91 % bylo léčeno hypolipidemiky (99 % statiny). Během studie došlo k významnému zlepšení některých lipidových parametrů – celkového cholesterolu, LDL cholesterolu, HDL cholesterolu. Hladina celkového cholesterolu ≥ 5,2 mmol/l byla spojena s významně zvýšeným rizikem výskytu CMP/IM/cévní smrti (HR 1,44, 95% CI 1,0–2,07, p = 0,048) i ischemické CMP (HR 1,95, 95% CI 1,29–2,97, p = 0,005). Nemocní s LDL cholesterolem ≥ 2,99 mmol/l měli výskyt uvedeného kombinovaného cíle sledování 25 % oproti 18,5 % těch, kteří měli hodnotu LDL cholesterolu pod 2,99 mmol/l (p = 0,029). Riziko iCMP bylo dále významně zvýšené u nemocných s LDL cholesterolem ≥ 2,6 mmol/l (HR 1,72, p = 0,032), non-HDL cholesterolem ≥ 3,38 mmol/l (HR 1,94, p = 0,01) a poměru celkového cholesterolu/HDL cholesterolu ≥ 4,4 (HR 1,89, p = 0,0043) [46]. Vzhledem k uvedeným nálezům lze soudit, že nemocní s poruchou lipidového metabolizmu a symptomatickými stenózami IC tepen jsou indikováni k agresivní kontrole lipidových parametrů, zejména LDL cholesterolu [21].
Endovaskulární intervence
Balónková angioplastika (PTA) jako metoda léčby IC stenóz byla použita již před několika dekádami, pro vysoké riziko komplikací však byla na mnoho let opuštěna. V posledních letech ale technologický pokrok, vynikající výsledky katetrizační léčby v oblasti koronárních tepen stejně jako poznatek o závažné prognóze nemocných se symptomatickými IC stenózami vedly k znovuzavedení metod endovaskulárních intervencí. Jsou prováděny jak primární PTA, tak intervence s implantací stentu, přičemž v současnosti není zcela jasné, která z metod je účinnější či bezpečnější, ačkoli některá data naznačují, že primární angioplastika je ve srovnání se stentingem zatížena vyšším rizikem vzniku restenóz a horší dvouletou prognózou. Jedná se však o údaje z retrospektivních studií a s nedostatečným množstvím zařazených pacientů, nelze tedy činit definitivní závěry [22–24].
Zpočátku bylo používáno instrumentárium pro koronární intervence, později byly vyvinuty speciální systémy pro neurointervence. První FDA schválený speciální stent pro intrakraniální použití byl NeuroLink System, který ale není komerčně dostupný. V roce 2005 byl schválen systém Wing-Span (Wing-Span Stent System a Gateway PTA Balloon Catether), s kterým je v současnosti nejvíce zkušeností. Jedná se o samoexpandibilní nitinolový mikrostent, který se rozvíjí velmi pozvolna, po dobu několika týdnů, což minimalizuje riziko disekce a ruptury tepny – to je u tepen mozkové cirkulace s jejich odlišnou anatomií oproti tepnám koronárním významné. Jsou nadále vyvíjeny další systémy a rovněž jsou první, zatím velmi omezené zkušenosti s použitím lékových stentů.
Do současnosti byla publikována řada prací, týkající se problematiky endovaskulárních intervencí, většinou se však jedná o retrospektivní data, často s malým množstvím zařazených pacientů a celkově je údajů z prospektivních multicentrických studií nedostatek; podrobnější rozbor uvedených prací přesahuje rámec tohoto článku. Souhrnně je však možno konstatovat, že dosud publikované výsledky ukazovaly, že při endovaskulárních intervencích je dosahováno vysokého stupně technického úspěch s akceptovatelným rizikem periproceduálních komplikací. Na druhou stranu je relativně vysoké riziko restenóz a dlouhodobý klinický prospěch není jasný.
Panovalo přesvědčení, že z endovaskulárních intervencí by mohli nejvíce profitovat nemocní, u kterých je mechanizmem vzniku klinických příhod porucha perfuze následkem významné stenózy a nedostatečného kolaterálního zásobení [26] a rovněž nemocní se symptomatickými těžkými (70–99 %) stenózami, jejichž prognóza je obzvláště nepříznivá.
Proto bylo dosud povážováno na základě současných doporučení příslušných amerických odborných společností za akceptovatelné zvážit indikaci k endovaskulární revaskularizaci pomocí balónkové angioplastiky a/nebo stentingu u těch nemocných, u kterých dochází k recidivujícím příhodám na podkladě těžkých (70 %) stenóz intrakraniálních tepen navzdory optimální medikamentózní léčbě (třída IIb, úroveň důkazů C) [25].
Do nedávné doby především chyběla data z prospektivních randomizovaných studií, srovnávajících katetrizační léčbu s léčbou konzervativní. Odpověď na otázku, který postup přináší lepší výsledky, přinesla studie fáze III SAMMPRIS (ClinicalTrials.gov identifier: NCT00576693). Jedná se o multicentrickou prospektivní randomizovanou studii srovnávající účinnost a bezpečnost stentingu (metodou perkutánní transluminální angioplastiky a stentingem – PTAS) za použití Wing--Span systému a agresivní medikamentózní léčby oproti medikamentózní léčbě samotné u nemocných se symptomatickými těžkými (70–99 %), angiograficky potvrzenými, stenózami intrakraniálních tepen. Výsledky této významné studie byly publikovány v září 2011 v New England Journal of Medicine poté, co byla studie předčasně ukončena [27].
Zařazeni byli do této studie nemocní po proběhlé TIA nebo neinvalidizující CMP během 30 dní po příhodě. Zařazování pacientů bylo zahájeno v listopadu 2008. Je zajímavé se podívat, jak vypadala „agresivní“ medikamentózní terapie v podmínkách této studie: antiagregační léčba spočívala v duální antiagregaci ASA a klopidogrelem po dobu 90 dní, poté bylo pokračováno v podávání aspirinu samotného. Kontrola rizikových faktorů spočívala v antihypertenzní léčbě s cílem dosáhnout sTK < 140 mmHg (resp. 130 mmHg u diabetiků), cílovou hodnotou LDL byla hladina < 1,8 mmol/l. Primárním cílem sledování byl výskyt CMP a/nebo úmrtí během 30 dnů po randomizaci, resp. revaskularizaci ve skupině PTAS a výskyt CMP v teritoriu postižené tepny v období po prvních 30 dnech dále po dobu sledování. Předtím, než byla studie předčasně ukončena, bylo zařazeno 451 nemocných (224 ve skupině PTAS, 227 ve skupině léčené konzervativně), průměrná doba sledování byla 11,9 měsíců (k této době se vztahují i níže uvedené výsledky, sledování zařazených nemocných nadále pokračuje). Medián doby od kvalifikující příhody do randomizace byl 7 dní (4–19 dní). Zhruba třetina nemocných byla zařazena po proběhlé TIA, asi čtvrtina měla v anamnéze již proběhlou cévní mozkovou příhodu v minulosti, rovněž asi čtvrtina nemocných měla anamnézu ICHS. Většina zařazených pacientů (přes 60 %) byla v době kvalifikující příhody již léčena antitrombotiky. Nejčastější postiženou tepnou (41 %, resp. 46 %) byla ACM, následována ACI a AB (v obou případech nad 20 %).
Primárního cíle sledování v prvních 30 dnech dosáhlo 14,7 % nemocných ve skupině stentované (PTAS) a 5,8 % nemocných ve skupině léčené konzervativně (p = 0,002). K úmrtí došlo ve skupině PTAS u 5 nemocných (2,2 %) – ve všech případech v souvislosti s rekurencí CMP. Jediné úmrtí v konzervativně léčené skupině (0,4 %) s CMP spojeno nebylo. Třetina (30,3 %) CMP ve skupině PTAS byla hemoragického původu, zatímco intrakraniální hemoragie nebyla zaznamenána v žádném případě ve skupině léčené konzervativně (p = 0,04). Ve velké většině případů došlo ve skupině stentované k výskytu sledovaných příhod v průběhu prvních 24 hod od proběhlé intervence, maximálně pak do 6 dnů.
V období po prvních 30 dnech mezi sledovanými skupinami rozdíl nebyl, v obou případech došlo k rekurenci CMP v povodí postižené tepny u 13 nemocných.
Pokud se podíváme na výskyt sledovaných příhod za celou dobu sledování, přetrval významný rozdíl ve prospěch konzervativně léčené skupiny (12,2 % vs 20,0 %, p = 0,009). Výsledek se nelišil ani při analýze „on treatment“ (p = 0,009).
Hlavní příčina uvedených výsledků spočívá ve dvou skutečnostech: jednak byl podstatně vyšší výskyt periproceduálních CMP po PTAS (přičemž to není vysvětlováno nezkušeností zúčastněných center), než předpokládali autoři na základě dříve reportovaných dat z registrů a jedné studie fáze I s použitím Wingspan systému. Na druhé straně byl oproti očekávání mnohem nižší výskyt CMP a úmrtí ve skupině léčené konzervativně. Předpokládaný výskyt vycházel přitom z údajů ze studie WASID, kde byla 30denní incidence CMP či úmrtí 10,7 % a 1 roční 25 % v populaci odpovídající populaci nemocných ve studii SAMMPRIS [28].
Vysvětlení v tuto chvíli není úplně jasné, spekuluje se o velkém významu užití duální antiagregace – to by bylo v souladu s výsledky menších studií, jež byly diskutovány v předchozím textu.
Diskuse jistě budou pokračovat (i se zaměřením na možnost užití jiného instrumentária, než jaké bylo ve studii), stejně tak jsou očekávány další analýzy a výsledky pokračujícího sledování dosud zařazených pacientů.
Nicméně lze v tuto chvíli uzavřít, že v současnosti nebyly naděje vkládané do PTAS, která je zatížena vysokým rizikem závažných komplikací, naplněny a nemocní s významnými symptomatickými intrakraniálními stenózami mají být obecně léčeni konzervativně.
Závěr
Ateroskleróza intrakraniálních tepen je závažné a časté onemocnění a je zodpovědné nejméně za 8–10 % ischemických CMP u bělochů, toto číslo je však možná podhodnocené. U Asiatů představuje postižení intrakraniálních tepen mnohem častější příčinu mozkových příhod, a je tak pravděpodobně nejčastější příčinou CMP na světě. Tento poznatek spolu s rozvojem a dostupností neinvazivních či minimálně invazivních diagnostických metod vedl v posledních letech ke zvýšenému a stále se zvyšujícímu zájmu o tuto problematiku. Prognóza nemocných se symptomatickými IC stenózami je vážná a v současnosti dostupná léčba přináší neuspokojivé výsledky. Naprostá většina nemocných je léčena konzervativně, základem jsou léčba antiagregační, převážně aspirinem, a důsledná kontrola rizikových faktorů aterosklerózy. Naděje vkládané do endovaskulární terapie nebyly zatím naplněny a v současné době zůstává základním léčebným přístupem postup konzervativní. Nové studie k získání dalších poznatků v této nesmírně zajímavé, významné a zatím nedostatečně prozkoumané oblasti jsou vysoce potřebné.
Doručeno do redakce 16. 8. 2011
Přijato po recenzi 29. 1. 2012
MUDr. Jiří Žižka
I. interní klinika, FTNsP/IPVZ, Praha 44
jiri.zizka@ftn.cz
Sources
1. Nguyen-Huynh MN, Wintermark M, English J et al. How Accurate is CT Angiogramy in Evaluating Intracranial Atherosclerotic Disease? Stroke 2008; 39 : 1184–1188.
2. Bash S, Villablanca JP, Jahan R et al. Intracranial vascular stenosis and occlusive disease. Evaluation with CT angiogramy, MR angiogramy, and digital subtraction angiogramy. AJNR Am J Neuroradiol 2005; 26 : 1012–1021.
3. Wong KS, Liang EY, Lam WW et al. Spiral computed tomography angiogramy in the assessment of middle cerebral artery occlusive dinase. J Neurol Nerosurg Psychiatry 1995; 59 : 537–539.
4. Feldmann E, Wilterdink JL, Kosinski A et al. Stroke Outcomes and Neuroimaging of Intracranial Atherosclerosis (SONIA) Trial Investigators. The Stroke outcomes and Neuroimaging of Intracranial Atherosclerosis (SONIA) trial. Neurology 2007; 68 : 2099–2106.
5. Bash S, Villablanca JP, Jahan R et al. Intracranial vascular stenosis and occlusive disease. Evaluation with CT angiogramy, MR angiogramy, and digital subtraction angiogramy. AJNR Am J Neuroradiol 2005; 26 : 1012–1021.
6. Školoudík D, Majvald Č, Chudoba V et al. Možnosti neinvazivní diagnostiky intrakraniálních stenóz pomocí transkraniální duplexní sonografie a MR angiografie. Čes Radiol 1999; 53 (Suppl 1): 42–46.
7. Žižka J. Transkraniální barevná duplexní sonografie v hodnocení intrakraniálních tepen při cerebrovaskulárním stenookluzivním onemocnění – přehled. Kardiol Rev 2010; 12 : 88–93.
8. Arenillas JF. Intracranial Atherosclerosis. Current Concepts. Stroke 2011; 42 (Suppl 1): S20–S23.
9. Kasner SE, Lynn MJ, Chimowitz MI et al. Warfarin Aspirin Symptomatic Intracranial Disease (WASID) Trial Investigators. Warfarin vs aspirin for symptomatic intracranial stenosis: Subgroup analyses from WASID. Neurology 2006; 67 : 1275–1278.
10. Turan TN, Maidan L, Cotsonis G et al. Warfarin-Aspirin Symptomatic Intracranial Disease Investigators. Failure of Antithrombotic Therapy and Risk of Stroke in Patiens With Symptomatic Intracranial Stenosis. Stroke 2009; 40 : 505–509.
11. Wong KSL, Chen C, Fu J et al. CLAIR study investigators. Clopidogrel plus aspirin alone for reducing embolisation in patiens with acute symptomatic cerebral or carotid artery stenosis (CLAIR study): a randomised, open-label, blinded-endpoint trial. Lancet Neurol 2010; 9 : 489–497.
12. Markus HS, Droste DW, Kaps M et al. Dual antiplatelet therapy with clopidogrel and aspirin in symptomatic carotid stenosis evaluated using doppler embolic signal detection: the clopidogrel and aspirin for reduction of emboli in symptomatic carotid stenosis (CARESS) trial. Circulation 2005; 111 : 2233–2240.
13. Diener HC, Bogousslavsky J, Brass LM et al. MATCH investigators. Aspirin and clopidogrel compared with clopidogrela alone after recent ischaemic stroke or transient ischaemic attack in high-risk patiens (MATCH): randomised, double-blind, placebo-controlled trial. Lancet 2004; 364 : 331–337.
14. Kwon S, Cho YJ, Koo JS et al. Cilostazol prevents the progression of the symptomatic intracranial arterial stenosis: the multicenter double-blind placebo-controlled trial of cilostazol in symptomatic intracranial stenosis. Stroke 2005; 36 : 782–786.
15. Kalita Z, Keller O, Bar M a spol. Doporučený postup sekundární prevence recidivy po akutní cévní mozkové příhodě [(iCMP) – mozkovém infarktu/tranzitorní ischemické atace (TIA) a hemoragické CMP] http://www.cmp.cz/jnp/cz/doporucene_postupy_pro_lecbu_cmp/cv_sekce_cns-sekundarni_prevence_po_cmp.html, 11.8.2011.
16. Brott TG, Halperin JL, Abbara S et al. 2011 ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SVS Guideline on the Management of Patients With Extracranial Carotid and Vertebral Artery Disease A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, and the American Stroke Association, American Association of Neuroscience Nurses, American Association of Neurological Surgeons, American College of Radiology, American Society of Neuroradiology, Congress of Neurological Surgeons, Society of Atherosclerosis Imaging and Prevention, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of NeuroInterventional Surgery, Society for Vascular Medicine, and Society for Vascular Surgery Developed in Collaboration With the American Academy of Neurology and Society of Cardiovascular Computed Tomography. J Am Coll Cardiol 2011; 57: e16–94.
17. Chaturvedi S, Turan TN, Lynn MJ et al. WASID Study Group. Risk factor status and vascular events in patiens with symptomatic intracranial stenosis. Neurology 2007; 69 : 2063–2068.
18. Turan TN, Cotsonis G, Lynn MJ et al. Warfarin-Aspirin Symptomatic Intracranial Disease (WASID) Trial Investigators. Relationship between blood pressure and stroke recurrence in patiens with intracranial arterial stenosis. Circulation 2007; 115 : 2969–2975.
19. Turan TN, Derdeyn CP, Fiorella D et al. Treatment of atherosclerotic intracranial arterial stenosis. Stroke 2009; 40 : 2257–2261.
20. Mancia G, Laurent S, Agabiti-Rosei E et al. European Society of Hypertension. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document. J Hypertens 2009; 27 : 2121–2158.
21. Turan TN, Derdeyn CP, Fiorella D et al. Treatment of atherosclerotic intracranial arterial stenosis. Stroke 2009; 40 : 2257–2261.
22. Quershi AI, Hussein HM, El-Gengaihy A et al. Concurrent comparison of outcomes of primary angioplasty and of stent placement in high-risk patiens with symptomatic intracranial stenosis. Neurosurgery 2008; 62 : 1053–1062.
23. Mazighi M, Yadav JS, Abou-Chebl A. Durability of endovascular therapy for symptomatic intracranial atherosclerosis. Stroke 2008; 39 : 1766–1769.
24. Siddiq F, Vazquez G, Momon MZ et al. Comparison of primary angioplasty with stent placement for treating symptomatic intracranial atherosclerotic disease: a multicenter study. Stroke 2008; 39 : 2505–2510.
25. Meyers PM, Schumacher HC, Higashida RT et al. American Heart Association. Indications for the performance of intracranial endovascular neurointerventional procedures: a scientific statement from the American Heart Association Council on Cardiovascular Radiology and Intervention, Stroke Council, Council on Cardiovascular Surgery and Anesthesia, Interdisciplinary Council on Peripheral Vascular Disease, and Interdisciplinary Council on Quality of Care and Outcomes Research. Circulation 2009; 119 : 2235–2249.
26. Schumacher HC, Meyers MP, Higashida RT et al. Reporting Standards for Angioplasty and Stent-Assisted Angioplasty for Intracranial Atherosclerosis. Stroke 2009; 40: e348–e365.
27. Chimowitz MI, Lynn MJ, Derdeyn CP et al. Stenting versus Medical Therapy for Intracranial Arterial Stenosisi. N Engl J Med 2011; 365 : 993–1003.
28. Zaidat OO, Klucznik R, Alexander MJ et al. The NIH registry on use of the Wingspan stent for symptomatic 7%–90% intracranial arterial stenosis. Neurology 2008; 70 : 1518–1524.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2012 Issue 1-
All articles in this issue
- Vitamin D a kardiovaskulární choroby
- Subklinické poškození mozku u starších pacientů s hypertenzí a demence
- Hluboká žilní trombóza a plicní embolie v geriatrické medicíně – dvě strany jedné mince
- Nové postupy v antikoagulační léčbě u seniorů s fibrilací síní
- Komplikace kardiostimulace u starších nemocných
- Komplikácie infrainguinálnych revaskularizačných výkonov u pacientov v geriatrickom veku
- Dyslipidemie v roce 2012
- Atherosclerosis of the intracranial arteries – current view, 2nd part
- Nezvyklá diagnostika perforace pravé komory defibrilační elektrodou
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Komplikace kardiostimulace u starších nemocných
- Vitamin D a kardiovaskulární choroby
- Hluboká žilní trombóza a plicní embolie v geriatrické medicíně – dvě strany jedné mince
- Nové postupy v antikoagulační léčbě u seniorů s fibrilací síní
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

