-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba k cíli u dnavé artritidy
Treat to target in gouty arthritis
Gout is a crystal-induced, metabolically determined inflammatory rheumatic disease with increasing prevalence. In clinical practice, gout causes frequent diagnostic as well as therapeutic problems. The golden diagnostic standard is crystalographic analysis and evidence of monosodium urate crystals in the polarization microscope; if this is not available, the diagnosis can be established through a combination of clinical, laboratory and imaging techniques. The acute gouty attack must be treated by quick administration of anti-inflammatory medicines, with available alternatives being nonsteroidal antirheumatic drugs (NSA), colchicine and glucocorticoids. When the attack subsides, hypouricemic therapy is initiated which should combine the regimen and diet measures and pharmacological treatment. Recommendations for the treatment of gout were published by the EULAR and the Czech Society for Rheumatology. Recently a new strategy appeared known as Treat to target – T2T. This principle has been successfully used in the treatment of rheumatiod arthritis and spondyloarthritis. The publication is structured as four overarching principles and nine Recommendations. The recommendations emphasize long-term maintenance of serum levels of uric acid below 360 μmol/l as the basic gout-related target in all patients, and below 300 μmol/l for patients with tophies. It is recommended to administer prophylactic small doses of colchicine for at least 3–6 months on the commencement of hypouricemic therapy. The Recommendations further emphasize the need for regular monitoring of comorbidities and the kidney function. A separate recommendation is concerned with necessary education of patients and their motivation toward compliance with regimen measures and increased physical activity.
Key words:
colchicine – gouty arthritis – treat to target principle
Autoři: Karel Pavelka
Působiště autorů: Revmatologický ústav, Praha
Vyšlo v časopise: Vnitř Lék 2018; 64(2): 185-190
Kategorie: Přehledné referáty
Souhrn
Dna je krystaly indukované, metabolicky podmíněné, zánětlivé, revmatické onemocnění se zvyšující se prevalencí. V klinické praxi dělá dna časté diagnostické i terapeutické problémy. Zlatým standardem diagnostiky je krystalografická analýza a průkaz krystalů natrium urátu v polarizačním mikroskopu, pokud toto není dostupné, je možné diagnózu stanovit kombinací klinických, laboratorních a zobrazovacích metodik. Akutní dnavý záchvat musí být léčen rychlým podáním protizánětlivých léků, přičemž jako alternativy jsou k dispozici nesteroidní antirevmatika (NSA), kolchicin a glukokortikoidy. Po odeznění záchvatu se aplikuje hypourikemická léčba, která by měla být kombinací režimových a dietních opatření a farmakologické léčby. Pro léčbu dny byla publikována Doporučení EULAR a České revmatologické společnosti. Aktuálně byla publikována nová strategie nazývaná „léčba k cíli“ (Treat to target – T2T). Tento princip byl úspěšně použit v léčbě revmatoidní artritidy a spondylartritid. Publikace je rozložena do 4 nadřazených principů a 9 doporučení. Doporučení zdůrazňují, že základním cílem u dny je dlouhodobé udržování sérové hladiny kyseliny močové < 360 μmol/l u všech pacientů a u pacientů s tofy < 300 μmol/l. Při zahájení hypourikemické léčby je doporučeno profylaktické podávání malých dávek kolchicinu nejméně 3–6 měsíců. Dále je v Doporučeních zdůrazněna nutnost pravidelného monitorování komorbidit a funkce ledvin. Samostatné Doporučení se týká také nutnosti edukace pacientů a jejich motivací k režimovým opatřením a zvýšené fyzické aktivitě.
Klíčová slova:
dnavá artritida – kolchicin – princip „léčba k cíli“Úvod
Dna je způsobena ukládáním krystalů natrium urátu do kloubů, které nastává následkem chronické hyperurikemie. Výskyt dny se udával u 1–2 % populace, ale výskyt se pravděpodobně zvyšuje: jedna novější studie v USA pomocí pacientských dotazníků nalezla prevalenci dokonce 4 % [1]. Příčinou hyperurikemie může být zvýšená novotvorba kyseliny močové (KM), snížené vylučování KM nebo kombinace obou. Podle přítomnosti vyvolávajícího onemocnění lze hyperurikemii a dnu dále dělit na primární a sekundární (tab. 1). Nejčastějšími příčinami primární dny jsou jednak nutriční faktory a dále genetické faktory ve formě polymorfizmu urátových transportérů v ledvinách [2]. Nejčastějšími příčinami sekundární dny jsou na straně novotvorby maligní onemocnění a na straně vylučování renální insuficience různé etiologie a užívání léků jako např. diuretik a malých dávek kyseliny acetylsalicylové.
Dna a hyperurikemie jsou asociovány s hypertenzí, diabetes mellitus, metabolickým syndromem, alkoholizmem, renálním onemocněním a zvýšeným kardiovaskulárním rizikem [3]. Dna proto představuje onemocnění s výraznou morbiditou i mortalitou a logicky i ekonomickou zátěží pro společnost [4].
Přestože diagnóza dny vypadá snadno, v praxi způsobuje často problémy, a to jak ve smyslu nedostatečné diagnostiky, tak falešně pozitivní diagnózy. Zlatým standardem diagnózy je stanovení krystalů natrium urátu v polarizačním mikroskopu, ale krystalografická analýza je v Česku prováděna nedostatečně. Pokud není k dispozici průkaz krystalů natrium urátu, je stále nejvhodnější použití klasifikačních kritérií American College of Rheumatology (ACR), která umožňují diagnózu i kombinací klinických kritérií s přijatelnou senzitivitou i specificitou (tab. 2). Problémem je také fakt, že část zánětlivých epizod (až 50 %) neprobíhá typicky, ale atypicky, především pak u dny se začátkem ve vyšším věku. Zde je již obraz klasické podagry s velkou převahou mužů často nahrazen formou polyartritidy připomínající revmatoidní artritidu. Vyrovnává se poměr mužů a žen. Jako příčiny hyperurikemie také ubývá alkoholizmu a přibývá užívání diuretik.
Tab. 2. Klinická kritéria pro akutní dnu 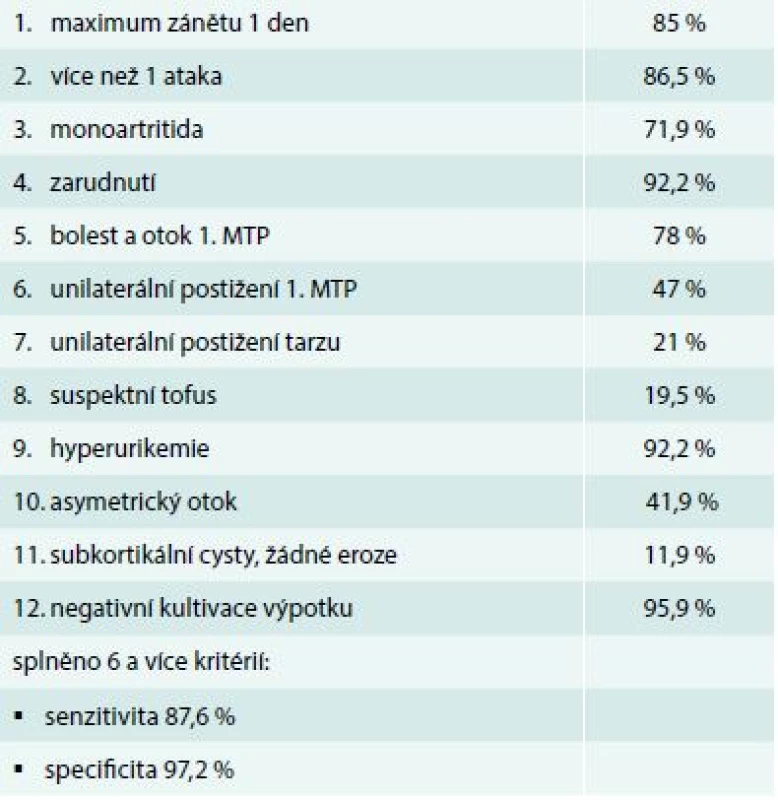
V posledních letech byla publikována řada Doporučení pro léčbu dny, a to jak na evropské úrovni pracovní skupinou EULAR (European League Against Rheumatism/Evropská liga proti revmatismu) [5], tak na úrovni národní České revmatologické společnosti (ČRS) [6]. Nově pak byla publikována strategie „léčba k cíli u dny“. Terapii dny lze rozdělit do několika stadií, což odpovídá epizodickému charakteru onemocnění.
Terapie dnavého záchvatu
Terapie dnavého záchvatu musí být zahájena ihned po diagnostice onemocnění. Bolest bývá největší hned první den záchvatu. V určitém smyslu je rychlost nasazení důležitější než volba preparátu. Patologickým substrátem dnavého záchvatu je zánět vyvolaný fagocytózou krystalů natrium urátu polymorfonukleárními buňkami a následným uvolněním prozánětlivých cytokinů. Proto je nutná aplikace léků s výrazným protizánětlivým účinkem. Konkrétně u dny se jedná o nesteroidní antirevmatika (NSA), kolchicin nebo glukokortikoidy aplikované systémově nebo lokálně. V praxi nejčastěji používaným postupem je aplikace NSA. Je možné použít jakékoliv NSA, ale vždy v dostatečné protizánětlivé dávce, která bývá na horní hranici doporučovaného dávkovacího schématu. Pro svoje výrazné protizánětlivé účinky je stále v této indikaci používán indometacin, z dalších NSA pak diklofenak či etorikoxib. Maximální dávky NSA se používají zpravidla 1–5 dní, pak je možné většinou již dávky redukovat. Nevýhodou NSA je, že jejich účinek není specifický pro dnu a příznivá odpověď na jejich podání v případě diagnostické nejistoty nepomůže. Dalším problémem NSA je jejich toxicita především gastrointestinální, ale i kardiovaskulární a renální. Proto je nutné po podání NSA u každého pacienta individuálně vyhodnotit riziko.
Druhou alternativou léčby dnavého záchvatu je podání kolchicinu. Kolchicin je mitotický jed blokující fagocytózu polymorfonukleárními buňkami a jeho účinek je pro dnu vysoce specifický. Je proto vhodný pro pacienty s nejasnou diagnózou dny a příznivá odpověď na jeho podání může sloužit jako podpora diagnózy. Jeho aplikace je však spojena s výskytem nežádoucích účinků, a to především průjmů a dalších GIT nežádoucích projevů, které může mít v době dosažení terapeutického účinku i nadpoloviční většina pacientů. Proto se nyní doporučuje nižší dávkování. Starší schéma uvádělo začít bolusovou dávkou 1 mg a pokračovat v dávkách 0,5 mg každé 2 hod do maxima 5–6 mg první den. V současné době se spíše doporučuje zkrácené schéma, tzn. 1 mg na začátek léčby a 0,5 mg za 2 hod a pak ukončit léčbu. Ve 2 studiích byl tento zkrácený režim stejně účinný jako klasické dávkování při výrazně nižším výskytu nežádoucích účinků [7].
Třetí alternativou je aplikace glukokortikoidů (GK), které je možné aplikovat lokálně nebo systémově. Lokální aplikace GK do zaníceného kloubu se běžně používá především při monoartritidě a nejčastějším místem aplikace je kolenní kloub, ale GK lze aplikovat i do jiných kloubů. Dávkování je podle velikosti postižených kloubů. Lokální aplikaci GK lze kombinovat s jinými protizánětlivými postupy. Před lokální aplikací GK je vždy nutné vyloučit septickou artritidu. Systémové podání GK se doporučuje pouze při závažné oligoartritidě nebo polyartritidě. Iniciální doporučovaná dávka GK je 0,5 mg/kg váhy prednisonu nebo jeho ekvivalentu podávaná 5–10 dní s postupnou detrakcí a vysazením.
Novým lékem pro léčbu dny je kanakinumab, což je plně humánní, monoklonální protilátka, která blokuje interleukin IL1β, který byl identifikován jako klíčový mediátor při vzniku dnavého záchvatu. Kanakinumab se používá v dávce 150 mg s.c. a léčba musí být zahájena v průběhu prvních 5 dní po vzniku záchvatu [8]. Je indikován u pacientů s velmi závažnou formou onemocnění, kteří jsou refrakterní na léčbu první linie, a to včetně kombinací.
Základní principy léčby dnavého záchvatu uvádí tab. 3.
Tab. 3. Základní principy léčby dnavého záchvatu 
Hypourikemická léčba
Hypourikemická léčba by měla být komplexní a skládat se z dietních opatření, omezení alkoholu a redukce váhy o obézních. Na začátku léčby je nutná edukace pacienta. Tato edukace může být slovní v ordinaci ev. doplněná o písemné materiály, včetně vhodných dietních doporučení a kuchařek, nebo formou elektronickou. Velmi důležitou součástí edukace je činnost specializované sestry. Dietní opatření a režimové změny jsou důležité pro všechny pacienty s dnou. Nejen že snižují hladinu kyseliny močové, a tím riziko vzniku artritidy a nefrolitiázy, ale zlepšují celkové zdraví pacientů a ovlivňují komorbidity.
Farmakologické prostředky ke snížení urikemie lze rozdělit na 2 skupiny: urikostatika a urikosurika.
Urikostatika
Nejčastěji užívaným urikostatikem je alopurinol. Mechanizmem účinku alopurinolu je inhibice xantinoxidázy, a tím syntézy purinů. Efekt alopurinolu je závislý na dávce a používané dávkové rozmezí je relativně široké od 100–900 mg denně. U každého pacienta je nutné vytitrovat individuálně potřebnou dávku. Zpravidla se začíná s nižšími dávkami 100–200 mg denně. Ze studií, ve kterých sloužil alopurinol jako referenční lék v dávce 300 mg denně, však vyplynulo, že žádané cílové hladiny kyseliny močové (viz dále) bylo dosaženo v méně než polovině případů a léčba u těchto pacientů byla hodnocena jako suboptimální. Alopurinol je nutné používat ve snížených dávkách při poruše funkce ledvin.
Novějším selektivním inhibitorem xantinoxidázy je febuxostat. V klinických studiích byl v dávce 80 mg denně účinnější než 300 mg alopurinolu [9]. Febuxostat je v současné indikován jako lék druhé volby léčby hyperurikemie při kontraindikaci, nesnášenlivosti nebo nedostatečném účinku alopurinolu. Další indikací jsou pacienti se středním stupněm renální insuficience, u kterých není nutné snižovat dávku léku. Dlouhodobé snížení urikemie febuxostatem také zachovává funkci ledvinného parenchymu.
Urikosurika
Urikosurika inhibují postsekreční, renální reabsorpci kyseliny močové a zvyšují renální eliminaci kyseliny močové. Zvýšená urikosurie může vzácně vést k depozicím urátů v ledvinách. Proto se urikosurika nedoporučují u dnavců s ledvinným postižením. Prevencí postižení ledvin je zajištění vysoké diurézy a v případě kyselé moči její alkalizací. V klinickém použití jsou celosvětově probenecid, sulfinpyrazon a benzbromaron. V současné době není žádné urikosurikum u nás na trhu.
První selektivní inhibitor urátového transportéru
Jako zcela nový lék léčby hypourikemie byl schválen první selektivní inhibitor urátového transportéru lesinurad.
Které pacienty s hyperurikemií a dnou léčit?
Cílovou hodnotou urikemie je 360 μmol/l u všech nemocných, u pacientů s tofy pak 300 μmol/l (viz dále „léčba k cíli“).
Které pacienty s hyperurikemií a dnou léčit? Jasně jsou indikováni pacienti s chronickou tofózní dnou, dále pacienti s progredujícími destrukcemi na RTG a pacienti s častými záchvaty (2 a více za rok). Relativně jsou indikováni k léčbě pacienti s řídkými záchvaty (1 a méně ročně), u nichž je nutné postupovat individuálně. Někteří klinici však u nemocných, kteří již prodělali záchvat, doporučují podávat hypourikemickou léčbu doživotně. Naopak panuje shoda v tom, že se nedoporučuje léčit asymptomatickou hyperurikemii, pokud nejsou hodnoty urikemie opakovaně > 540 μmol.
Léčba chronické tofózní dny
V současné době progreduje pouze 5–10 % pacientů do stadia chronické tofózní dny, při níž je kontinuálně přítomna artritida. Základem léčby těchto pacientů je kromě účinného snížení hladiny kyseliny močové i trvalé podávání protizánětlivé léčby ve formě glukokortikoidů, NSA nebo jejich kombinace.
Strategii dlouhodobého přístupu k léčbě dny ukazuje schéma. Při zahajování hypourikemické léčby se doporučuje 3–6měsíční podávání malých dávek kolchicinu, který snižuje riziko vzniku nových záchvatů a zlepšuje komplianci pacientů. Doporučováno je i pravidelné monitorování urikemie v intervalu 3–6 měsíců, nezávisle na přítomnosti záchvatů, dále adjustace léčby, pokud není dosaženo cílové hodnoty urikemie.
Schéma. Přístup k terapii dny 
* hladiny kyseliny mocové by mely být trvale < 360 μmol/l Léčba k cíli u dnavé artritidy (T2T)
V mnoha oblastech medicíny jako je např. kardiologie nebo diabetologie, byly stanoveny jasné terapeutické cíle, které byly uvedeny do klinické praxe a prokazatelně snížily morbiditu i mortalitu nemocných. Jako příklad lze uvést stanovení cílů v léčbě hypertenze, diabetu nebo dyslipidemie. Později byly tyto principy navrženy pro revmatologii, a to nejdříve pro léčbu revmatoidní artritidy [10], později i pro léčbu axiálních spondylartritid, psoriatické artritidy a systémového lupus erythematodes. Celý koncept byl nazván „léčba k cíli“ (Treat to target) a vžil se pod akronymem T2T. Tato doporučení byla vytvořena na základě systematického přehledu literatury z randomizovaných klinických studií, a především u revmatoidní artritidy a psoriatické artritidy byla prokázána jejich oprávněnost v klinické praxi [11]. Dostatek poznatků z randomizovaných studií u dny pak umožnil pracovní skupině EULAR definovat T2T u dnavé artritidy [12].
Metodologie
Na začátku procesu se sešla tzv. steering committee, skládající se z 5 revmatologů z Evropy a USA se zkušenostmi z výzkumu dnavé artritidy a dospěla k závěru, že je vhodné principy T2T pro dnavou artritidu vypracovat. Byla provedena literární rešerše randomizovaných kontrolovaných studií u dny, přičemž byla uplatněna metodologie dle PICO (P – patient, problem or population; I – intervention; C – comparison, control or comparator; O – outcome). Byly vyhodnoceny anglicky publikované práce a evidence byla vyhodnocena podle známé oxfordské metodologie na škále 1–5. Závěry byly prezentovány na setkání kompletní komise v Herne v Německu, mítinku se zúčastnili experti na dnu z Evropy, jižní a severní Ameriky a Oceánie, dále pak kardiolog, nefrolog, praktický lékař a pacient. Vlastní Doporučení byla vypracována na základě tzv. Delfské metodiky: každé doporučení muselo mít alespoň 75% souhlas expertů.
Výsledky
Celkem bylo identifikováno 761 publikací, z nichž 55 bylo zařazeno pro kompletní rozbor. Nebyla identifikována žádná studie, která by přímo testovala princip T2T u dny ve srovnání se standardním režimem. Nicméně byla získávána nepřímá evidence o tom, že optimální terapeutické postupy zlepšují kontrolu průběhu nemoci.
Vlastní text je formálně rozčleněn na 4 tzv. nadřazené principy (overarching principles) a 9 doporučení (tab. 4).
Tab. 4. Léčba k cíli u dnavé artritidy. Upraveno podle [11] ![Léčba k cíli u dnavé artritidy. Upraveno podle [11]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/94543a9bf7b13b1c0e11df238fb9e8fc.jpg)
Nadřazené principy
A. Dna je závažné a chronické onemocnění, které zhoršuje kvalitu života a zkracuje střední délku života a mělo by být efektivně léčeno.
Pacient by měl být o závažnosti dny informován, protože základní metabolický problém dny – hyperurikemie – je korigovatelný. Kvalitu života ovlivňují především epizody zánětu a bolesti, na zvýšené mortalitě se podílejí především renální komplikace, asociovaná onemocnění a možné nežádoucí účinky léků.
B. Snížení hladiny kyseliny močové a její dlouhodobé udržování pod stanoveným cílem je nutné pro eliminaci krystalů urátů z organizmu, což zlepšuje celkovou prognózu.
Krystaly natrium uráty jsou trvale deponovány v kloubních tkáních, a to i v nepostižených kloubech, a za určitých okolností se uvolňují a vyvolávají akutní či chronickou artritidu. Principem dlouhodobé úspěšné léčby je tedy eliminace těchto krystalů z organizmu. Toho může být docíleno jen dlouhodobým snížením hladiny kyseliny močové v séru. Studie také prokázaly, že dochází ke zmenšení tofů při dlouhodobém docílení adekvátního snížení urikemie.
C. Úspěšná léčba dny vyžaduje poučení pacienta o všech aspektech dny a plné zapojení pacienta do rozhodovacího procesu o léčbě.
Výše uvedený princip platí v obecné rovině u většiny onemocnění. Je však o to důležitější, že příčina dny je známá a existuje řada režimových a dietologických opatření, která zásadně dnu i asociovaná onemocnění ovlivňují. Jde především o dietní opatření a konkrétně nízkopurinovou dietu, v případě přítomnosti diabetu či dyslipidemie pak doporučujeme vhodnou dietu, redukci hmotnosti u obézních, abstinenci a dostatek pohybových aktivit. Je také znám fakt, že kompliance pacientů s dnou není často optimální. Některé studie ukazují výskyt alkoholizmu u dnavých až ve 30–40 % případů.
D. Dlouhodobá adherence k léčbě léky snižujícími hladinu kyseliny močové je základní podmínkou úspěšného výsledku léčby.
Opět je v obecné rovině známo, že dlouhodobá adherence k léčbě léky, které neovlivňují symptomy, ale určitý chronický stav, není optimální (osteoporóza, hypercholesterolemie, hypertenze). Ve zvýšené míře to platí i o dně.
Doporučení
Číslo 1. Hladina kyseliny močové by měla být měřena pravidelně a hypourikemická léčba by měla být adjustována k docílení optimální hodnoty.
Na začátku léčby se doporučuje provést měření 2krát a jako bazální hodnotu považovat průměr. Pacient přichází na lačno, bez zvláštní úpravy diety předcházející odběru. Monitorování hladiny kyseliny močové by mělo být častější na začátku léčby v případě zavádění hypourikemické léčby, v případě její změny nebo v případě klinických projevů. U pacientů stabilizovaných je adekvátní hodnocení urikemie v 6měsíčních intervalech.
Číslo 2. Sérová hladina kyseliny močové by měla být < 360 μmol/l (< 6 mg/l) u všech pacientů.
Byl podán jasný důkaz, že pouze dlouhodobé snížení urikemie < 360 μmol/l snižuje výskyt záchvatů a zmenšuje tofy.
Číslo 3. U pacientů s těžkou dnou, kteří mají výrazné tofy a časté záchvaty, by cíl měl být < 300 μmol (5 mg/l), dokud není dosaženo remise.
Navazuje na doporučení č. 2 a stanovuje cílovou hladinu pro tyto nejzávažnější pacienty ještě níže, na základě stejných poznatků [13].
Číslo 4. Akutní ataka má být léčena okamžitě protizánětlivými léky, přičemž mají být ale zvažována bezpečnostní rizika.
Bolest při dnavém záchvatu je zpravidla největší 1. den, takže dikce tohoto doporučení je logická. Před podáním NSA či GK je nutné se pacienta zeptat na přítomnost komorbidit a možných rizik léků (žaludečních vředů, astmatu, ICHS, diabetu, používání dalších léků).
Číslo 5. Profylaktická léčba proti dnavým atakám by měla být zahájena ihned a pokračováno by v ní mělo být nejméně 6 měsíců.
Doporučení používat profylakticky malé dávky kolchicinu (1–2 tbl denně) či malých dávek NSA je relativně nové. Vychází z faktu ze studií s hypourikemickými léky, které ukazují možný zvýšený výskyt záchvatů po zahájení hypourikemické léčby. Tento fakt může zhoršovat adherenci pacienta k léčbě. Malé dávky protizánětlivých léků riziko vzniku nových záchvatů snižují.
Číslo 6. U pacientů s dnou má být vyšetřena funkce ledvin v době diagnózy a dále pravidelně monitorována.
Postižení ledvin a dnavá artritida mají určitý vztah, který je obousměrný. U pacientů s onemocněním ledvin může při vývoji renální insuficience vznikat hyperurikemie a sekundární dna, naopak u primární dny mohou vznikat ledvinné komplikace (nefrolitiáza, intersticiální dnavá artritida). Funkci ledvin je nutné monitorovat i kvůli podávané medikaci, pokud je např. nutné redukovat dávky alopurinolu.
Číslo 7. Komorbidity asociované se dnou mohou ovlivňovat léčbu a výsledky a měly by být monitorovány a léčeny pravidelně.
Tzv. onemocnění asociovaná se dnou jsou vyjmenována výše. Přispívají ke zvýšené morbiditě, ale i mortalitě u nemocných s dnou. Především je zvýšené riziko kardiovaskulárních onemocnění. EULAR vydala speciální Doporučení pro hodnocení rizika a prevenci kardiovaskulárních onemocnění u zánětlivých revmatických onemocnění [14]. Např. při použití systému SCORE se doporučuje násobit výsledek 1,5krát.
Číslo 8. Modifikovatelné rizikové faktory by měly být pacientovi doporučeny ve formě edukace, měl by být získán rozvrh jejich plnění.
Jedná se především redukci váhy, dietní opatření, abstinenci a zvýšenou fyzickou aktivitu.
Číslo 9. Informace o dně a její léčbě by měly být pacientům poskytnuty v písemném materiálu, který pacientovi předají zdravotničtí pracovníci.
Nejčastěji jsou používané drobné knížky, bulletiny či letáky, ale tato písemná forma je dnes často doplňována elektronickými formami vzdělávání.
Závěr
Koncept léčby k cíli u dnavé artritidy byl na základě evidence navržen. Bylo by vhodné provést studii, jakým způsobem ovlivňuje jeho uplatňování osud nemocných s dnavou artritidou.
Práce je věnována životnímu výročí vynikajícího odborníka na metabolizmus prof. MUDr. Štěpána Svačiny, DrSc., MBA.
Doručeno do redakce 5. 5. 2017
Přijato po recenzi 19. 11. 2017
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav, Praha
Zdroje
1. Richette P, Bardin T. Gout. Lancet 2010; 375(9711): 318–328. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(09)60883–7>.
2. Kostalova E, Pavelka K, Vlaskova H et al. Hyperuricemia and gout due to deficiency of hypoxanthine-guanine phosphoribosyltransferase in female carriers: New insight to differential diagnosis. Clin Chim Acta 2015; 440 : 214–217. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cca.2014.11.026>.
3. Kuo CF, Grainge MJ, Mallen C et al. Comorbidities in patients with gout prior to and following diagnosis: case – control study. Ann Rheum Dis 2016; 75(1): 210–217. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2014–206410>.
4. Shields GE, Beard SM. A systematic review of the economic and humanistic burden of gout. Pharmacoeconomics 2015; 33(10): 1029–1047. Dostupné z DOI: <http://dx.doi.org/10.1007/s40273–015–0288–5>.
5. Khanna PP, Fitzgerald J. Evolution of management of gout: a comparison of recent guidelines. Curr Opin Rheumatol 2015; 27(2): 139–146. Dostupné z DOI: <http://doi.10.1097/BOR.0000000000000154>.
6. Pavelka K. Doporučení České revmatologické společnosti pro léčbu dnavé artritidy. Čes Revmatol 2012; 20(2): 82–92.
7. Terkeltaub RA, Furst DE, Bennet K et al. High versus low dosing of oral colchicine for early acute gout flare: Twenty-four-hour outcome of the first multicenter, randomized, double-blind, placebo-controlled, parallel-group, dose-comparison colchicine study. Arthritis Rheum 2010; 62(4): 1060–1068. Dostupné z DOI: <http://dx.doi.org/10.1002/art.27327>.
8. Schlesinger N, Alten RE, Bardin T et al. Canakinumab for acute gouty arthritis in patients with limited treatment options: results from two randomised, multicentre, active controlled, double blind trials and their initial extensions. Ann Rheum Dis 2012; 71(11): 1839–1848. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2011–200908>.
9. Becker MA, Schumacher HR, Wortman RL et al. Effects of febuxostat versus allopurinol and placebo reducing serum urate in subjects with hyperuricemia and gout: a 298, phase III. Randomised trial. Arthritis Care Res 2008; 59(11): 1540–1548. Dostupné z DOI: <http://dx.doi.org/10.1002/art.24209>.
10. Smolen J, Aletaha D, Bijlsma JW et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 2010; 69(4): 631–637. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2009.123919>. Erratum in Ann Rheum Dis 2011; 70(7): 1349. [van der Heijde D]. Ann Rheum Dis. 2011; 70(8): 1519.
11. Coates LC, Moverly AR, McParland L et al. Effect of tight control of inflammation in early psoriatic arthritis (TICOPA): a UK multicentre, open label, randomised controlled trial. Lancet 2015; 386(10012): 2489–2498. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(15)00347–5>.
12. Kiltz U, Smolen J, Bardin T et al. Treat to target (T2T) recommendations for gout. Ann Rheum Dis 2017; 76(4): 632–638. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2016–209467>.
13. Perez Ruiz F, Calabozo M, Pijoan JI et al. Effect of urate lowering therapy on the velocity of size reduction of tophi in chronic gout. Arthritis Rheum 2002; 47(4): 356–360. Dostupné z DOI: <http://dx.doi.org/10.1002/art.10511>.
14. Peters MJ, Symmons DP, McCarey D et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis 2010; 69(2): 325–331. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2009.113696>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2018 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Biologická léčba psoriatické artritidy
- Život ohrožující projevy systémového lupusu a antifosfolipidového syndromu ve vnitřním lékařství
- Systémová sklerodermie v roce 2017
- Idiopatické zánětlivé myopatie
- Nové trendy v monitorování a léčbě ANCA asociovaných vaskulitid
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
- Polymyalgia rheumatica
- Léčba k cíli u dnavé artritidy
- Nutraceutika v terapii gonartrózy: pohled ortopeda
- Osteoporóza a kvalita kostní hmoty
- Léčba chronické bolesti u zánětlivých revmatických onemocnění
- Revmatologie a vnitřní lékařství
- Revmatoidní artritida
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Idiopatické zánětlivé myopatie
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




