-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba Waldenströmovy makroglobulinemie a léčba nemocí způsobených monoklonálním IgM gamaglobulinem
The treatment of Waldenström macroglobulinemia and the therapy of diseases caused by monoclonal IgM gammaglobulin
Waldenström macroglobulinemia is defined by the presence of IgM type monoclonal immunoglobulin and histological prove of lymphoplasmocytary lymphoma in the bone marrow. Alkylating cytostatic drugs, chlorambucil or cyclofosfamide in monotherapy have been typically used for its treatment. Similarly to other lymphoproliferative diseases with a low degree of aggressiveness, purine analogues (fludarabine and 2-chlordeoxyadenosine) have a faster treatment response and a higher number of treatment responses, especially if administered in combination with alkylating drugs. The monoclonal antibody rituximab (R) also brings considerable improvement to patients suffering from the disease. It is good for cytopenic patients on monotherapy, and for non-cytopenic patients, in combination with other drugs, both with R-CHOP and with a purine analogue and an alkylating cytostatic drug. In recent years, new drugs for the treatment of this disease have been tested (bortezomib, thalidomid, revlimid and others). High-dose chemotherapy with autologous transplantation has a higher treatment response rate than classical chemotherapy. It is recommended in case of insufficient effect of conventional treatment or early relaps. Young patients with suitable profile and insufficient response to conventional treatment can also qualify for allogenic transplantation; graft response against the disease has been observed in almost all patients who underwent allogenic transplantation. However, treatment is often necessary also in diseases caused by IgM monoclonal immunoglobulin, irrespective of it being formed by a malignant or a benign clone, because the characteristics of IgM monoclonal immunoglobulin may endanger the patient’s integrity. The article provides an overview of treatment options for Waldenström macroglobulinemia and diseases caused by monoclonal IgM.
Keywords:
Waldenström macroglobulinemia – diseases caused by monoclonal immunoglobulin – disease of cold agglutinins – cryoglobulinemia – hyperviscosity
Autoři: Z. Adam 1; V. Ščudla 2; Z. Kořístek 1
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 1; III. interní klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Vlastimil Ščudla, CSc. 2
Vyšlo v časopise: Vnitř Lék 2008; 54(1): 68-83
Kategorie: Přehledný referát
Souhrn
Waldenströmova makroglobulinemie je definována přítomností monoklonálního imunoglobulinu typu IgM a histologickým průkazem lymfoplazmocytárního lymfomu v kostní dřeni. Klasickými léky byla alkylační cytostatika, chlorambucil, případně cyklofosfamid v monoterapii. Podobně jako u jiných nízce agresivních lymfoproliferativních chorob dosahují purinová analoga (fludarabin a 2-chlordeoxyadenozin) léčebnou odezvu rychleji a četnost léčebné odezvy je vyšší, obzvláště, pokud jsou podána v kombinaci s alkylačními léky. Značným přínosem pro tyto nemocné je také monoklonální protilátka rituximab. V monoterapii je vhodná pro cytopenické nemocné, u nemocných bez cytopenie je preferována v kombinacích, a to jak R-CHOP, tak v kombinaci purinovým analogem a alkylačním cytostatikem. V posledních letech jsou pro léčbu této nemoci úspěšně testovány další nové léky (bortezomib, thalidomid, revlimid a další). Vysokodávkovaná chemoterapie s autologní transplantací dosahuje vyšší četnost léčebné odezvy než klasická chemoterapie. Její použití je doporučováno při nedostatečném efektu konvenční léčby nebo při časném relapsu. U vhodných mladých nemocných, nedostatečně reagujících na konvenční léčbu, lze také uvažovat o alogenní transplantaci, reakce štěpu proti nemoci byla pozorována téměř u všech alogenně transplantovaných. Léčebná intervence je však často nutná i takzvaných nemocí způsobených monoklonálním imunoglobulinem typu IgM, ať je tvořen maligním či benigním klonem, protože monoklonální imunoglobulin IgM může svými vlastnostmi ohrožovat integritu nemocného. Cílem článku je podat přehled o léčebných možnostech Waldenströmovy makroglobulinemie a monoklonálním IgM způsobených nemocí.
Klíčová slova:
Waldenströmova makroglobulinemie - nemoci způsobené monoklonálním imunoglobulinem - nemoc chladových aglutininů - kryoglobulinemie - hyperviskozitaÚvod
Je tomu více než 60 let, co Jan Gosta Waldenström poprvé popsal případ 2 pacientů, trpících opakovaným krvácením z nosu a z úst, kteří měli lymfadenopatii, trombocytopenii, zvýšenou sedimentací erytrocytů, zvýšenou viskozitu séra, zvýšený počtem lymfoidních buněk v kostní dřeni a normální nález na snímcích kostí [1]. Definice této nemoci byla od té doby postupně upřesňována, v současnosti platí WHO klasifikace lymfoproliferativních chorob, která Waldenströmovu makroglobulinemii definuje přítomností monoklonálního imunoglobulinu typu IgM při histologicky prokázané infiltraci kostní dřeně lymfoplazmocytární lymfomem.
Biologie nemoci a její příznaky jsou uvedeny jinde [2,3]. V tomto článku se nastavíme pouze zrcadlo současným pohledům na léčebné možnosti a budeme informovat o doporučeních pro léčbu této nemoci.
Indikace k léčbě
Současné léčebné možnosti (chemoterapie i cílené léčba) mají potenciál dosáhnout léčebné odezvy (remise nemoci) u velkého počtu nemocných, ne však zcela eliminovat maligní klon a vést u většiny nemocných k úplnému uzdravení. Nemoc obvykle po remisi, trvající řádově měsíce či roky, opět recidivuje a vyžaduje další léčbu.
Proto se u Waldenströmovy makroglobulinemie doporučuje, podobně jako u jiných krevních nemocí, u nichž současné léčebné možnosti dosahují léčebné odezvy, ale přitom nemají potenciál zcela nemoc eliminovat, asymptomatické nemocné jen sledovat a se zahájením léčby vyčkávat do prvních klinických příznaků nemoci [4].
Vzácné případy lymfoplazmocytárního lymfomu klinického stadia I či II (s limitovanou formou nemoci) se léčí ihned při stanovení diagnózy kurativní radioterapií, podobně jako je tomu u folikulárního lymfomu klinického stadia I anebo II A.
Indikací k zahájení léčby Waldenströmovy makroglobulinemie jsou:
- klinické příznaky a projevy hyperviskozity (neurologické nebo oční projevy)
- symptomatická periferní neuropatie
- AL-amyloidóza
- symptomatická kryoglobulinemie
- cytopenie (hemoglobin pod 100 g/l a/nebo trombocyty pod 100 × 109/1)
- velká (bulky) lymfadenopatie nebo organomegalie nebo známky transformace ve velkobuněčný lymfom
- nebo jiné problémy, způsobené nemocí, které jsou natolik závažné, že vyžadují zahájení léčby (horečky, noční pocení, úbytek hmotnosti, fatigue, nefropatie)
Koncentrace monoklonálního imunoglobulinu IgM sama o sobě není indikací k zahájení léčby, nicméně pokud by koncentrace dosáhla 50 g/l, doporučuje se velmi intenzivně pátrat po projevech hyperviskozity dotazováním na krvácení z nosu a dásní, zhoršení vidění, bolesti hlavy, závratě, ataxii a změnu psychiky. Je vhodné sledovat viskozitu, ale s vědomím, že korelace mezi viskozitou a nástupem projevů hyperviskozity je interindividuálně odlišná, obvykle nastupuje až při vzestupu viskozity nad 4 cp (normální hodnota je 1,8) [4,5].
Optimální léčba pro první linii není definována, existuje více léčebných alternativ s doloženou účinností bez srovnávacích studií
Klasickým lékem pro Waldenströmovu makroglobulinemii byl a je chlorambucil. Pro iniciální léčbu lze použít i jiné léčebné postupy podobně jako u chronické lymfatické leukemie. V současnosti musí ošetřující lékař rozhodnout, zda iniciální léčbu založí na alkylačních cytostaticích (chlorambucil, cyklofosfamid) nebo purinových analozích anebo na monoklonální protilátce antiCD20 či zda použije všechny tyto 3 základní prvky v rámci kombinované léčby.
Zásadní je ihned před zahájením léčby zvážit, zda pacient bude či nebude kandidátem vysokodávkované chemoterapie s autologní transplantací. Pokud tento postup zvažujeme, pak je nutno omezit podávání alkylačních cytostatik a také purinových analog. Dále se doporučuje přihlédnout při volbě léčebného postupu k nutnosti rychlého nástupu léčebné odezvy.
V případě závažné cytopenie při stanovení diagnózy, kterou by chemoterapie mohla dále zhoršit, se doporučuje volit preparáty, které nemají závažný myelosupresivní účinek. Definice léčebné odezvy jsou uvedeny v tab. 1.
Tab. 1. Kritéria léčebné odezvy [6,7]. ![Kritéria léčebné odezvy [6,7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4562b5be7582bd2ccb6a118e5e3ebfaa.png)
Skutečnost, že Waldenströmova makroglobulinemie je vzácnou nemocí s relativně dlouhým přežitím nemocných, limituje organizování velkých klinických studií. Proto informace o účinnosti léčby máme z menších studií, které obvykle hodnotí četnost léčebné odezvy a délku remise, zatímco studie fáze III, které by srovnávaly vliv léčebných postupů na délku celkového přežití, jsou ojedinělé. Hodnocení léčby na základně četnosti léčebné odezvy a délky remisí není tak jasným argumentem, jako hodnocení léčba na základě délky celkového přežití.
Nedostatek srovnávacích studií však neumožňuje definovat jednu léčbu jako zlatý standard, podobně jako je tomu třeba u mnohočetného myelomu. Proto léčebná doporučení International Myeloma Working Group, uvedená v závěru článku, definují více účinných léčebných postupů, aniž by vyzdvihovala jeden z nich jako ten nejlepší.
Alkylační cytostatika
Léčebná odezva při léčbě chlorambucilem nastupuje velmi pomalu, interval do dosažení maximální léčebné odezvy byl 9 až dokonce 18 měsíců. Četnost léčebné odezvy po chlorambucilu kolísá kolem 50-60 %, kompletní remise je touto léčbou dosažena výjimečně. Nebylo zjištěno rozdílu mezi výsledkem kontinuální (0,1 mg/kg/den) a intermitentní aplikace (0,3 mg/kg/den 7 dní v 6týdenních intervalech), medián přežití byl v obou skupinách 5,4 roku, medián intervalu od randomizace do dosažení objektivní léčebné odezvy byl 18 měsíců a medián trvání remise 26 měsíců [8,9]. Optimální délka podávání chlorambucilu není známa, v některých studiích byl podáván do dosažení maximálního efektu, v jiných studiích byl podáván fixně po dobu 1-2 let. Není prokázáno, že by podávání chlorambucilu v rámci udržovací léčby bylo jakýmkoliv přínosem [10,11]. Režimy, obsahující více alkylačních cytostatik, byly testovány podobně jako u mnohočetného myelomu, pro menší četnost choroby však pouze v nerandomizované formě. Tyto vícelékové režimy dosahovaly vyšší četnost léčebné odezvy, než bylo dosaženo ve studiích testujících chlorambucil v monoterapii. Předpokládá se, že zde však nebude rozdílu v délce celkového přežití [12-17].
Glukokortikoidy
Přidání běžných dávek prednisonu zřejmě nezvyšuje četnost léčebné odezvy ani neprodlužuje délku přežití. Běžné dávky prednisonu jsou však účinné u pacientů s autoimunitní hemolytickou anémií, případně kryoglobulinemií II. typu či s nemocí chladových aglutininů [16,18].
Vysoké dávky glukokortikoidů, konkrétně dexametazonu, však potlačily chorobu a navodily léčebnou odezvu u pacientů, u nichž pro cytopenii nepřipadala v úvahu léčba alkylačními cytostatiky [19,20].
Purinová analoga
Do skupiny purinových analog patří fludarabin, 2-chlordeoxyadenosin a pentostatin. V klinických studiích byl použit dominantně fludarabin a 2-chlordeoxyadenosin, pentostatin má také prokázánu účinnost, ale by použit jen výjimečně [21].
Fludarabin
Fludarabin v monoterapii
Největší studie testující fludarabin v monoterapii jak u relabujících, tak u dříve neléčených nemocných s Waldenströmovou makroglobulinemií je studie South West Oncology Group - SWOG, zahrnující 182 nemocných. Celková četnost léčebné odezvy dosáhla 38 %, z toho u nově diagnostikovaných (118 pacientů) to bylo 40 %, u pacientů dříve léčených (64 nemocných) 33 %. Kompletní remise byly dosaženou výjimečně, pouze ve 3 % případů. Medián bezpříznakového a celkového přežití byl 43 a 84 měsíců [22,23].
Výsledky léčby fludarabinem v dalších menších skupinách pacientů jsou shrnuty v tab. 2 a 3. Opět je zde viditelná klasická nepřímá úměrnost mezi počtem hodnocených pacientů a četností léčebné odezvy.
Tab. 2. Výsledky monoterapie purinovými analogy u dříve neléčených nemocných s Waldenströmovou makroglobulinemií. 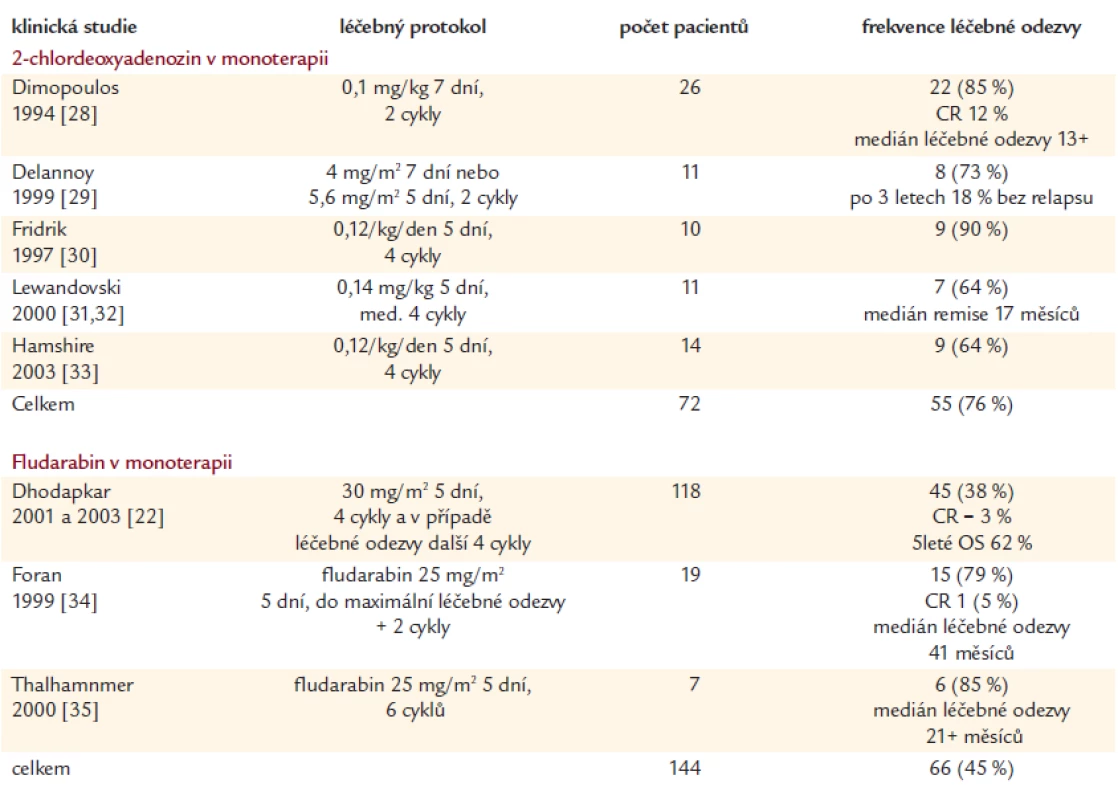
Tab. 3. Výsledky monoterapie purinovými analogy při relapsu nemoci či rezistenci na alkylační cytostatika. 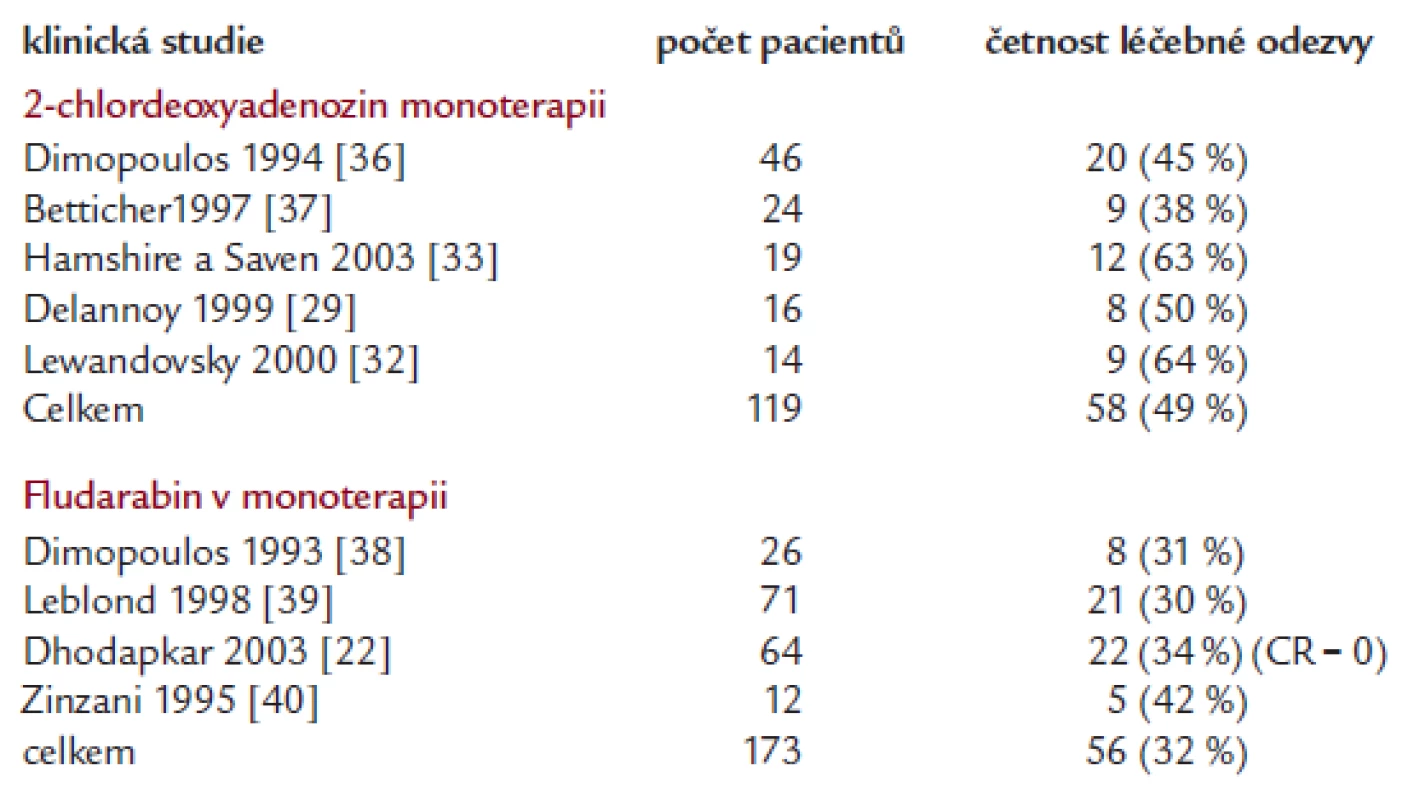
Randomizované srovnání léčby prvního relapsu nemoci fludarabinem anebo režimem CAP (cyklofosfamid, adriamycin a prednison) u 92 nemocných prokázalo lepší léčebnou odezvu po fludarabinu - 30 vs 11% (p = 0,019). Medián trvání léčebné odezvy byl 19 vs 3 měsíce, (p < 0,01), mezi mediány celkového přežití nebyl signifikantní rozdíl: 41 vs 45 měsíců. Nepřítomnost rozdílu délce přežití může být ovlivněna tím, že pacienti nereagující na léčbu CAP byli následovně také léčeni fludarabinem [24].
V běhu je randomizovaná studie srovnávající chlorambucil s fludarabinem v monoterapii u nově diagnostikových nemocných [25].
Poměrně vysoká četnost léčebné odezvy na fludarabinové režimy byla také popsána u dalších IgM tvořících lymfoproliferativních chorob (splenický lymfom s vilózními lymfocyty, cold aglutinin disease) [26].
Na otázku, zda může být fludarabin v monoterapii přínosem i pro pacienty, jejichž nemoc relabuje po 2-chlordeoxyadenosinu, lze v literatuře nalézt jak pozitivní odpověď, tak i opačný názor, popisující zkříženou rezistenci na tyto dvě purinová analoga.
Důležité je poznání, že léčba fludarabinem v monoterapii či v kombinaci může způsobit velmi pozvolna se rozvíjející léčebnou odezvu, maximální léčebná odezva (pokles koncentrace monoklonálního IgM) se může dostavit až několik měsíců od posledního cyklu léčby [27].
Fludarabin v kombinaci s alkylačním cytostatikem
Kombinace fludarabinu s cyklofosfamidem přináší vyšší četnost léčebné odezvy než fludarabin v monoterapii. První zpráva o vysoké efektivitě této kombinace u Waldenströmovy makroglobulinemie je z roku 1998. Studie z posledních let popisují u dříve neléčených osob až 85% léčebnou odezvu, u relabujících nemocných a nemocných refrakterních na alkylační cytostatika je četnost dosahované léčebné odezvy o něco nižší 55-89 %, jak je shrnuto v tab. 4.
Z větších studií zmíníme pouze skupinu 49 nemocných (37 z nich bylo dříve léčeno). V této skupině bylo dosaženo celkem 78% léčebné odezvy, u osob s relabující nemocí to bylo 76 %. Medián trvání remise byl 27 měsíců. Z dalších zajímavostí této studie je nutno uvést, že v průběhu sledování po léčbě se u 2 nemocných se vyvinula akutní leukemie, histologická transformace do agresivního lymfou byla pozorována u 1 nemocného a u 2 pacientů byla po ukončení léčby diagnostikována jiná maligní choroba (karcinom prostaty a maligní melanom). Výčtem těchto druhotných malignit chceme pouze dokumentovat nutnost komplexních kontrol po ukončení léčby s cílem diagnostikovat nejen časně relaps nemoci, ale také jiné případné maligní onemocnění, neboť pravděpodobnost jeho vzniku je vyšší než v průměrné populaci
2-chlordeoxyadenosin
2-chlordeoxyadenosin v monoterapii
2-chlordeoxyadenosin byl použit v malých studií v dávce 0,1/kg po 7 dní nebo 0,12/kg i.v. po 5 dní, případně 0,14 mg s.c. po 5 dní, tedy ve stejných dávkách, jako jsou používány pro vlasatobuněčnou leukemii. Četnost léčebné odezvy se pohybovala v rozmezí 40-85 %, ale kompletní remise byly dosaženy výjimečně. Výsledky větších studií, testujících purinová analoga, jsou v tab. 2 a 3. Počet cyklů 2-chlordeoxyadenosinu se pohyboval mezi 2-4.
Účinnost 2-chlordeoxyadenosinu nebyla u této diagnózy srovnána s fludarabinem formou randomizované studie.
2-chlordeoxyadenosin v kombinaci s alkylačními cytostatiky
Kombinace 2-chlordexyadenosinu s alkylačním cytostatikem dosahuje vyšší četnosti léčebné odezvy než 2-chlordeoxyadenosin v monoterapii, podobně jako kombinace fludarabinu a cyklofosfamidu, léčebné odezvy může být dosaženo při menším počtu léčebných cyklů. Největší skupina nemocných, léčená touto kombinací (37 nemocných), dostala v rámci iniciální léčby dva cykly 2-chlordeoxyadenosinu s cyklofosfamidem. Výsledek bylo 84% léčebná odezva, medián délky léčebné odezvy byl 36 měsíců [139-141]. Ale i tento excelentní výsledek léčby byl později zlepšen přidáním rituximabu. Výsledky shrnuje tab. 4.
Tab. 4. Výsledky léčebné kombinace purinového analoga a cyklofosfamidu. 
Zhodnocení přínosu purinových analog
Purinová analoga dosahují obzvláště v kombinaci vyšší četnosti léčebné odezvy, než dosahovala monoterapii cyklofosfamidem či chlorambucilem. Maximální léčebné odezvy je obvykle dosaženo po 3-6 měsících, ale v 17 % případů byla maximální odezva popsána opožděně, po 6 a v 5 % po 12 měsících. Celkové 5leté přežití a bezpříznakové přežití dosahuje při této léčbě 62 % a 49 %.
Hlavním nežádoucím účinkem této léčby je myelodeprese. Jejich podání zhoršuje případný sběr kmenových buněk krvetvorby pro následnou vysokodávkovanou chemoterapii. Purinová analoga dále způsobují dlouhodobý pokles T-lymfocytů (jak CD4+, tak i CD8+), neboli snižují efektivitu buněčné imunity a zvyšující riziko vzniku oportunních infekcí.
Purinová analoga, zvláště pokud jsou podávána s alkylačními cytostatiky, poškozují DNA a zároveň inhibují její opravy. To vysvětluje, proč Leblond [46] popisuje za několik let od ukončení léčby vyšší počet myelodysplazií, 3,5-8 % [44]. Bawcock [44] popsal dokonce incidenci sekundárního myelodysplastického syndromu až u 20 % starších nemocných, Tam [42] diagnostikoval MDS celkem u 10 v kolektivu 137 osob, léčených kombinací fludarabinu s dalšími cytostatiky. V případě, že se jednalo o léčbu první linie, to postihlo 2,5 % léčených, v případě léčby druhé linie tyto změny byly prokázány u 9,3 %. Kombinovaná léčba je tedy účinnější, ale indukuje ve vyšším počtu MDS, případně sekundární AML.
Francouzští autoři provedli analýzu 173 nemocných, léčených režimem s purinovým analogem a 153 nemocných, léčených režimem bez purinového analoga. Autoři uvádějí, že charakteristika nemocných v obou skupinách nebyla zásadně odlišná. Z nemocných, kteří měli purinové analogum, mělo 10 (5,7 %) transformaci v lymfom vyšší malignity, 3 (4 %) mělo sekundární MDS/AML. Transformace v lymfom vyšší malignity nebo MDS/AML se objevila po mediánu sledování 48 (38-52) měsíců od ukončení léčby. Naproti tomu ve skupině nemocných léčených režimem bez purinového analoga se progrese v lymfom vyšší malignity objevila pouze u jednoho nemocného a žádný nemocný neměl sekundární MDS/AML [45,46,142].
Purinová analoga, obzvláště jejich kombinace s alkylačními cytostatiky, jsou díky vysoké četnosti léčebné odezvy a hlavně díky rychlé redukci patologického klonu jistě léčbou volby pro pacienty se závažnými komplikacemi této nemoci, nicméně mají i svoje nežádoucí účinky.
Rituximab
Rituximab v monoterapii
Rituximab v mototerapii je účinný nejenom u difuzního velkobuněčného lymfomu či folikulárního lymfomu, ale také u nemocných s Waldenströmovou makroglobulinemií. Rituximab v monoterapii (podání 1krát týdně po dobu 4 týdnů) dosahuje 30-60% léčebné odezvy. V některých studiích vychází stejná účinnost rituximabu u dříve neléčených i u pacientů s relabující nemocí, v jiných studiích měl u první skupiny lepší efekt. Léčebná odezvy nastupuje relativně pomalu, časový interval do maximální léčebné odezvy od zahájení léčby přesahuje obvykle výrazně 3 měsíce. Kompletní remise jsou při monoterapii vzácné a mediány délky léčebné odezvy se pohybují mezi 7-9 měsíci u osob již dříve léčených a dosahují až mediánu 27 měsíců u osob dříve neléčených. Ale i pacienti, kteří nesplňují kritéria parciální remise, mají často z této léčby prospěch, neboť vlivem léčby se zlepší hodnoty krevního obrazu [47,48,50-59]. Efekt 4 aplikací rituximabu v týdenních intervalech dokládá největší studie (69 osob). Léčebné odezvy (nejméně PR) bylo dosaženo u 52 %, přičemž podskupiny dříve neléčených a léčených se nelišily četností léčebné odezvy. Medián délky léčebné odezvy u neléčených osob byl 27 měsíců [53]. Výsledky klinických studií s aplikací 4 dávek rituximabu v monoterapii jsou obsaženy v tab. 5.
Tab. 5. Studie testující standardní aplikaci rutiximabu, 4 infuze v týdenních intervalech. 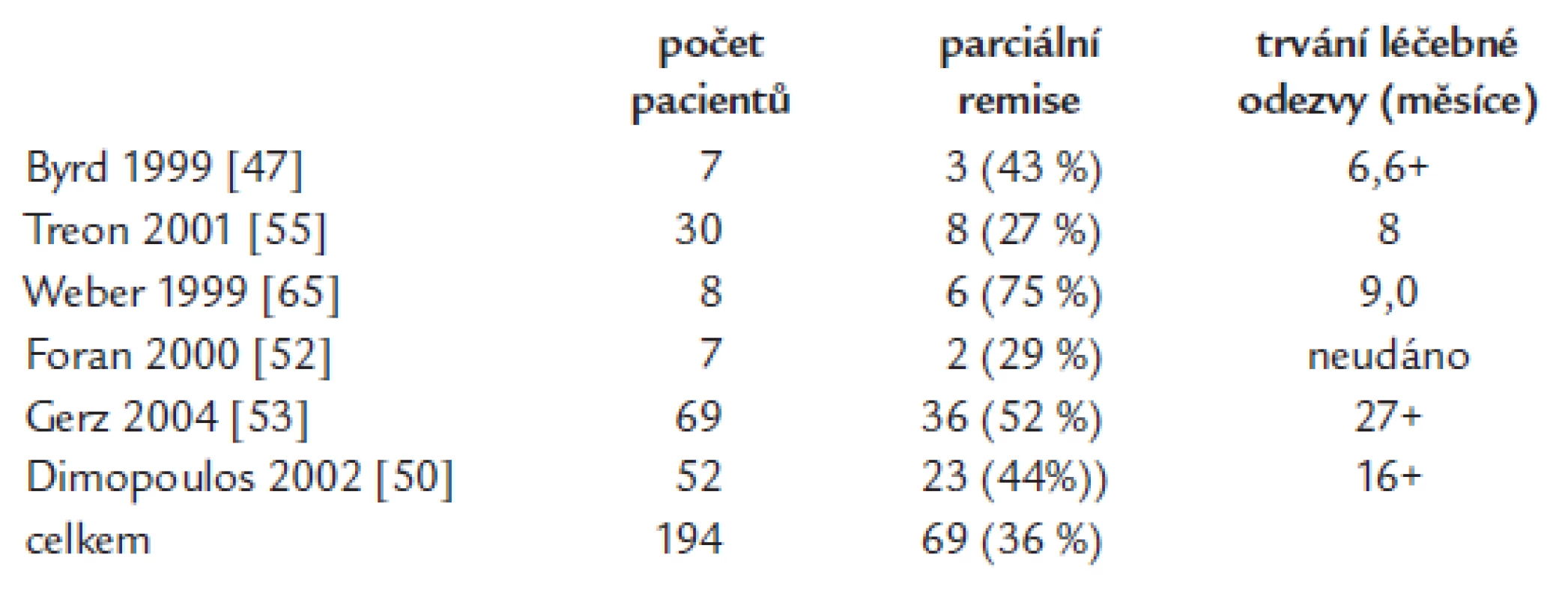
Zdvojnásobení celkové dávky rituximabu ze 4 na 8 infuzí (aplikace v 1.-4. týdnu a dále ve 12.-16. týdnu) sice nezvýšila dále četnost léčebné odezvy (44 %), autoři této studie však uvádějí, že se výrazně prodloužilo trvání léčebné odezvy u dříve léčených osob na 16 měsíců, což bylo déle než u nemocných, kteří dříve dostali pouze 4 dávky [18].
V další podobné studii u 26 již dříve léčených pacientů zaznamenali 48,3 % parciálních remisí a 17,2 % menší léčebné odezvy po aplikaci 8 infuzí rituximabu, medián intervalu do dosažení 50% léčebné odezvy byl 7 (3-19) měsíců. Medián intervalu do dosažení maximální léčebné odezvy byl 17 měsíců (3-32). Při mediánu sledování 29 měsíců došlo k progresi pouze u 2 pacientů [57].
Tyto uvedené studie potvrzují výborný efekt rituximabu u této choroby, odchylky v četnosti léčebné odezvy i trvání léčebné odezvy souvisí s menším počtem osob v jednotlivých studiích a s výběrem nemocných.
Rituximab s navázaným radioaktivním prvkem (Zavalin či Bexxar) není u Waldeströmovy makroglobulinemie používán [60,61].
Překvapivým jevem při monoterapii rutuximabem byl dočasný vzestup koncentrace monoklonálního IgM a zvýšení viskozity po léčbě (IgM flare). Pod výchozí hodnotu se monoklonální IgM dostal ve většině případů do 4 měsíců. Fenomén dočasného vzestupu monoklonálního IgM byl již popsán v souvislosti s léčbou 2-chlordeoxyadenosinem [62]. Předpokládá se, že apoptóza patologických buněk, navozená léčbou, uvolní monoklonální IgM do oběhu. Léčebná odezva byla méně častá ve skupině s tímto vzestupem (28 %) než ve skupině nemocných bez vzestupu (80 %). Tento jev nebyl pozorován při aplikaci rituximabu spolu s chemoterapií [53,56,63,64].
Prediktivní faktory účinnosti rituximabu
U pacientů s vysokou koncentrací monoklonálního IgM (> 40 g/l) byla zjištěna snížená četnost léčebné odezvy po aplikaci rituximabu - 17 %, která se dále zmenšovala na 14 % při současně nízké hodnotě albumimu < 35 g/l. To znamená, že pacienti s hodnotnou monoklonálního IgM pod 40 g/l a normálními hodnoty albuminu jsou optimálními kandidáty pro léčbu rituximabem [51].
Treon [57] pozoroval léčebnou odezvu u 75 % pacientů s koncentrací monoklonálního IgM pod 60 g/l a pouze u 20 % s hodnotou M-IgM nad touto hranicí, zatímco Gerz [53] uvedl, že koncentrace monoklonního IgM stejně jako koncentrace hemoglobinu před léčbou neměla signifikantní vliv na léčebnou odezvu.
Spekulativním vysvětlením tohoto pozorování je vyšší poměr plazmocytoidních buněk a plazmocytů, neobsahujících CD20, oproti lymfocytárním buňkám u pacientů s vysokými hodnotami monoklonálního IgM, a tak snížený počet cílových struktur.
Dále byl objeven vliv polymorfizmu FCγ IIIA (CD16) receptoru, který moduluje vazbu IgG1 a protilátkami mediovanou cytotoxicitu. Byla detekována forma Fcγ IIIA-158, jejíž přítomnost snižovala léčebnou odezvu na 9 % [58].
Rituximab v kombinaci s chemoterapií
Vzhledem k tomu, že rituximab je u této nemoci aktivní a přitom nemyelosupresivní lék, je možné jej kombinovat s chemoterapií. Podobně jako u jiných maligních lymfomů, i zde se projevil aditivní efekt rituximabu a výrazně se zvýšil četnost léčebné odezvy. Kombinovaná léčba, protilátka antiCD20 spolu s cytostatiky, dosahuje podstatně vyšší četnosti léčebné odezvy a také nezanedbatelný počet kompletních remisí. Přehled výsledků shrnuje tab. 6. Je z ní zřetelné, že výsledky této léčby převyšují předchozí léčebné postupy, kombinace rituximabu s purinovými analogy a alkylačním cytostatikem dosahují vysoká četnost léčebné odezvy a jeví se, že i délka léčebné odezvy bude delší, než dosahuje stejná kombinace cytostatika bez monoklonálního imunoglobulinu [65-74].
Tab. 6. Léčba Waldenströmovy makroglobulinemie kombinací rituximabu a cytostatik. 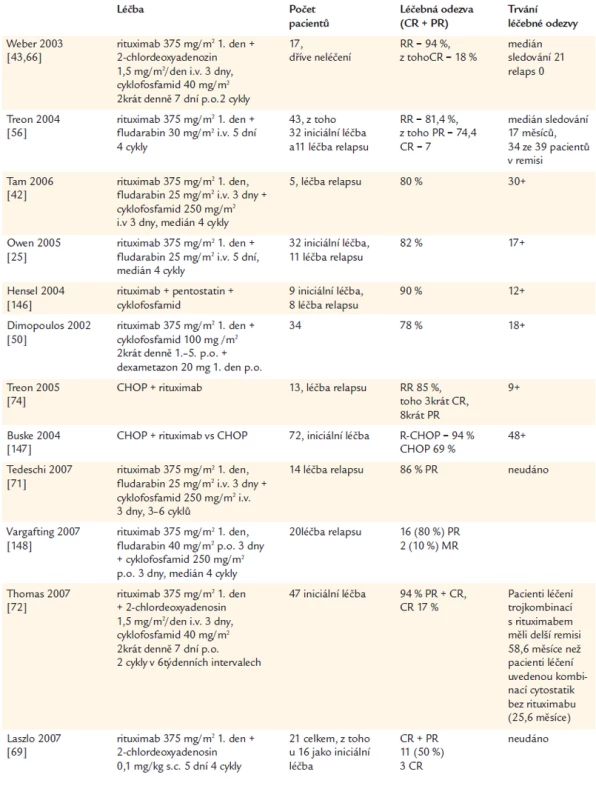
Alemtuzumab
Exprese antigenu CD52 byla prokázána na všech lymfoidních buňkách Waldenströmovy makroglobulinemie, CD52 chybí pouze na plazmocytech, náležících k patologickému klonu. Jejich denzita byl podobná jako u chronické lymfatické leukemie. Důležité bylo také zjištění, že mastocyty kostní dřeně, jejichž počet je v případě Waldenströmovy makroglobulinemie zvýšen, exprimují také antigen CD52 a jsou tedy zasažitelné alemtuzumabem. I to je přínosné, protože mastocyty mají pomocnou roli při růstu buněk lymfoplazmocytárního lymfomu.
Tato skutečnost vedla k aplikaci alemtuzumabu pacientům s Waldenströmovou makroglobulinemií. V malém souboru 5 pacientů, tvořících pilotní studii, bylo prokázáno, že alemtuzumab eradikoval patologických klon u 4 z nich. Následující studie obsahovala již 27 hodnotitelných, ve většině již dříve léčených nemocných. Alemtuzumab byl podáván v klasickém dávkování a bylo dosaženo 1 (4 %) CR a 10 (37 %) a 11 (41 %) MR (75-80,143).
Další léčebné alternativy
Thalidomid a revlimid
Thalidomid nalezl uplatnění u více hematologických chorob, standardně je v ČR používán u mnohočetného myelomu. Určitá míra aktivity byla také prokázána v monoterapii u Waldenströmovy makroglobulinemie, léčebná odezva byla zaznamenána u 5 z 25 léčených s mediánem trvání odezvy 11 měsíců. Thalidomid byl dále testován v kombinaci s dexametazonem a klaritromycinem s 25% léčebnou odezvou. Pro definitivní zhodnocení významu thalidomidu pro léčbu Waldenströmovy makroglobulinemie bude zapotřebí více zkušeností. Současné poznání lze shrnout konstatováním: thalidomid a dexametazon je u Waldenströmovy makroglobulinemie účinný, pokud je však v anamnéze neuropatie, tak je třeba zvýšené opatrnosti. Největším přínosem může být u pacientů refrakterních na jinou léčbu, nebo u závažně cytopenických pacientů.
Nemyelosupresivní alternativou léčby je současná aplikace thalidomid s rituximabem, z 25 zařazených nemocných bylo vyhodnoceno 23. Z nich dosáhlo 12 parciální remise a 1 nemocný kompletní remise. Poslední analýza této studie uvádí 1 CR a 15 PR. Při mediánu sledování 42 měsíců byl interval do progrese u všech nemocných 35 měsíců, u pacientů s léčebnou odezvou 38 měsíců. Podobě kombinace revlimidu a rituximabu vedla k příznivým léčebným výsledkům, 4 z 12 vyhodnocených dříve léčených nemocných dosáhli PR a 4 MR [81-85].
Bortezomib
Předběžné studie potvrdily účinnosti bortezomibu i u Waldenströmovy makroglobulinemie, proto se rozběhly další klinické studie. U 10 nemocných, opakovaně relabujících po léčbě alkylanciemi i adenosinovými analogy, navodil bortezomib parciální remisi u 6 z nich, a to ve velmi krátkém intervalu, medián do dosažení léčebné odezvy byl 1 měsíc. Medián intervalu do další progrese byl 11 měsíců. V další multicentrické studii byla monoterapie bortezomibem testována u 27 nemocných s relaxující nemocí. Léčebné odezvy bylo dosaženo u 85 % z nich, medián do nástupu léčebné odezvy byl 1,4 měsíce, medián intervalu do progrese byl však při této léčbě krátký, jenom 7,9 měsíce.
U 23 dříve neléčených byl použit bortezomid (1,3 mg/m2 i.v) + dexametazon (40 mg i.v.) 1., 4., 8. a 11. den, a rituximab 375 mg/m2 11. den. Výsledkem byly 2 kompletní a 13 parciálních remisí, celková léčebná odezva tedy dosáhla 91 %, interval do nástupu léčebné odezvy byl opět krátký, 1,5 měsíce [86,87].
Oblimersen
Představuje „antisepse“ oligonukleotid, které se váže na Bcl-2, jehož exprese je univerzálně zvýšená u Waldenströmovy makroglobulinemie. Testuje se přidání tohoto léku ke fludarabinu či kladribinu [88,89].
Sildenafil
Inhibice fosfodiesterázy-4 způsobuje apoptózu lymfomových buněk. Mechanizmus, jakým inhibice fosfodiesterázy-4 vede k apoptóze, není jasná. Sildenafil-citrát je silný blokátor fosfodiesterázy-5, vykazuje však také slabý inhibiční efekt na fosfodiesterázu-4.
První popis pozitivního vlivu sildenafilu, který se jinak používá k léčbě erektilní dysfunkce, uvádí Treon. První případ byl 80letý muž, který užíval tento lék v dávce 50 mg 1krát týdně se vstupní koncentrací monoklonálního IgM 28 g/l. Po 33 týdnech užívání sildenafilu monoklonální Ig zcela vymizel. Proto udělali analýzu vývoje monoklonálního IgM u mužů, kteří na stejném pracovišti užívali také pravidelně tento lék. Zjistili, že tento lék užívali další 4 muži a i u nich klesala koncentrace monoklonálního imunoglobulinu. Indukci apoptózy lymfoplazmocytárních buněk pod vlivem tohoto léku byla popsána i v in vitro studiích. Proto byla zahájena fáze II klinického zkoušení, v níž pacientům s pomalou progresí podávali denně sildenafil, iniciální dávku 25 mg denně, po týdnu zvyšovali do cílové dávky 100 mg denně. Do této studie bylo zařazeno 30 nemocných. Nejméně malou léčebnou odezvou mělo 5 (17 % hodnocených), interval do progrese u pacientů s léčebnou odezvou byl 6,1 (2,8-9,8) měsíce. Cílem dalšího farmaceutického výzkumu je tedy vyvinou použitelný cílený inhibitor fosfodiestrázy [90].
Imatibib
Vzhledem k podpůrné roli mastocytů pro proliferaci lymfoplazmocytárního lymfomu se testují také léky působící dominantně na tyto mastocyty. Jedním z důležitých signálů pro přežití mastocytů je stem cell faktor. Jedním z inhibitorů této signální cesty je imatinib, standardně jinak používaný pro léčbu chronické myeloidní leukemie. Tato léčba byla testována ve skupině 28 již dříve léčených nemocných. Dosaženy byly jen 2 PR a 5 MR s mediánem intervalu do dosažení léčebné odezvy 2,1 měsíce.
Vysokodávkovaná chemoterapie
Vysokodávkovaná chemoterapie s autologní transplantací
Podobně jako u myelomu tak byla testována vysokodávkovaná chemoterapie s autologní transplantací také u této nemoci, počet pacientů však není velký a vliv na celkovou délku přežití není jednoduché stanovit. Použity byly jak režimy používané pro folikulární lymfomy, tak režim používané pro mnohočetný myelom. Některé předtransplantační režimy zahrnovaly i celotělové ozáření.
Souhrnné analýzy publikovaných případů z roku 2003 uvádějí: ze 49 pacientů, kteří podstoupili vysokodávkovanou chemoterapii s autologní transplantací v různých fázích choroby, bylo u 9 (19 %) dosaženo kompletní remise a u 79 % parciální remise, u 24 nově diagnostikovaných nemocných bylo dosaženo 9 kompletních a 14 parciálních remisí.
Největší soubor transplantovaných nemocných publikovali Francouzi, 19 pacientů podstoupilo autologní transplantaci, z toho u 10 byla výsledkem léčby kompletní remise.
Poslední analýza Evropského transplantačního registru z roku 2007 uvádí, že vysokodávkovaná chemoterapie s autologní transplantací byla provedena u 201 pacientů. U 31 % z nich byla tato léčba provedena v první kompletní či parciální remisi, u 68 % v prvním či dalším relapsu. Ve 44 % byl použit režim BEAM, ve 28 % bylo použito předtransplantačního režimu s TBI, ve 14 % vysokodávkovaný melfalan a ve 14 % jiný režim. Při mediánu sledování 26 měsíců bylo z těchto osob 149 naživu, u 36 zemřelo na progresi nemoci a 16 zemřelo na toxicitu léčebného postupu.
Přehled výsledků studií, analyzujících vliv vysokodávkované chemoterapie s autologní transplantací uvádí tab. 7.
Tab. 7. Přehled publikací popisujících výsledky autologní transplantace u Waldneströmovy makroglobulinemie. 
Vysokodávkovaná chemoterapie s autologní transplantací však nebyla hodnocena v rámci prospektivní klinické studie a srovnávána s jinou formou klasické léčby. Uvedené publikace popisují její použití v rozličných fázích nemoci. Neznáme odpověď na otázku, jak dalece ovlivní vysokodávkovaná chemoterapie, použitá v rámci iniciální léčby, nejen bezpříznakové, ale také celkové přežití. Doposud zveřejněné zkušenosti pouze prokázaly výraznou cytoredukci a vysoký počet kompletních remisí.
Vzhledem k dlouhému přežití této skupiny nemocných by bylo žádoucí vysokodávkovanou chemoterapii s autologní transplantací zařazenou do iniciální léčby prospektivně srovnat s klasickou léčbou ve skupině nemocných se nepříznivými prognostickými faktory v době stanovení diagnózy.
Vysokodávkovaná chemoterapie s autologní transplantací je v roce 2007 považována za vhodnou léčbu pro vybranou skupinu nemocných s primárně refrakterní nebo relabující chorobou, neboli při selhání konvenční léčby. Otázku, zda je přínosné jí podání v rámci iniciální léčby nemocných s nepříznivými prognostickými faktory, zatím klinické studie nezodpověděly [94-100].
Vysokodávkovaná chemoterapie s alogenní transplantací
Počet publikací přinášejících zkušenosti s touto léčebnou alternativou je velmi malý. Studie popisující výsledky klasické alogenní transplantace obsahuje 10 pacientů s mediánem věku 46 let. S léčbou související mortalita dosáhla 40 %, v důsledku komplikací zemřel později 1 pacient a 5 nemocných žilo v kompletní remisi s délkou přežití 23-76 měsíců.
Další alternativou je takzvaná nemyeloablativní transplantace. Ve skupině 9 nemocných tato léčba navodila celkem 4 kompletní a 2 parciální remise. Nemyeloablativní terapie představuje tedy alternativu pro mladé pacienty s pokročilou chorobou, graft versus tumor efekt byl pozorován u většiny transplantovaných nemocných.
Analýza registru EBMG, zveřejněná v roce 2007, hodnotí 106 pacientů s Waldenströmovou makroglobulinemií, kteří do roku 2005 postoupili léčbu s pomocí alogenní transplantace. Klasický přípravný režim podstoupilo 44 nemocných, nemyelablativní režim 62 nemocných. Po 1, 3 a 5 letech bylo bezpříznakové přežití 61 %, 50 % a 48 %. Z uvedeného počtu nemocných zemřelo 35 (33 %) pacientů, z toho 5 na progresi nemoci, 30 % z jiných důvodů než relaps nemoci (tedy nežádoucí účinky léčby). Medián věku nemocných v době transplantace byl 49 let (21-65 let), 49 % nemocných bylo starší 50 let. Alogenní transplantace je tedy další léčebnou alternativou pro vhodné pacienty mladšího věku s relapsem nemoci či s rezistencí na iniciální léčbu [94-100].
Závěry z léčebných doporoučení International Myeloma Working Group 2006 a Britské hematologické společnosti z roku 2006
Na základě uvedených fakt vydala pracovní skupina Internatinal Myeloma Workshop [143] v roce 2006 doporučení, v němž uvádí:
V literatuře jsou publikovány četné léčebné postupy s vysokou četností léčebné odezvy, nejsou však k dispozici srovnávací studie, které by je zhodnotily formou prospektivní randomizované studie. Všechny uvedené postupy s relativně vysokou četností léčebné odezvy lze tedy považovat za vhodné léčebné alternativy.
Léčebné postupy zahrnující kombinaci účinných léčiv dosahují evidentně lepších výsledků než jednotlivé léky použité v monoterapii.
Vlivem nedostatku srovnávacích klinických studií neznáme odpověď na otázku, zda kombinovaná léčba, dosahující vyšší počet parciálních i kompletních remisí, podaná ihned na počátku nemoci, bude mít lepší výsledek než zahájení léčby monoterapii, a podání kombinace léků při relapsu nemoci.
U mnohočetného myelomu dosažení kompletní léčebné remise je spojeno s delším přežitím než dosažení parciální remise a podobě u chronické lymfatické leukemie. Lze pouze spekulovat i analogicky usuzovat, že podobná situaci by mohla být i u Waldenströmovy makroglobulinemie, nutné však bude to prokázat klinickými studiemi.
Léčebná doporučení, vytvořená Britskou hematologickou společností, ale také International Working Group on Waldenström macroglobulinaemia, vychází z důkazů definovaných v tab. 8, uvádí více léčebných postupů jako prokázaných a vhodných alternativ, neboť tyto postupy nebyly nikdy srovnány v rámci prospektivních randomizovaných studií (tab. 9 a 10).
Tab. 8. Vyjádření síly důkazu a síly doporučení určitého léčebného postupu dle US Agency for Health Care Policy and Research: level of evidence. 
Tab. 9. Doporučení léčebné postupy u nově diagnostikovaných nemocných dle Upgrade on treatment recommendation from the Third International Worskhop on Waldenstrom macroglobulinemia (Treon 2006 a Johnson 2006 [15 a 4]). ![Doporučení léčebné postupy u nově diagnostikovaných nemocných dle Upgrade on treatment recommendation from the Third International Worskhop on Waldenstrom macroglobulinemia (Treon 2006 a Johnson 2006 [15 a 4]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bbd4ec4bd1d8ef1ca405ece4b75db80d.png)
Tab. 10. Doporučené léčebné postupy pro recidivu či primární rezistenci dle Upgrade on treatment recomendation from the Third International Worskhop on Waldenstrom macroglobulinemia. (Treon 2006 [15]). ![Doporučené léčebné postupy pro recidivu či primární rezistenci dle Upgrade on treatment recomendation from the Third International Worskhop on Waldenstrom macroglobulinemia. (Treon 2006 [15]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3ba5f4e06ca0ff9c471f61c35025618c.png)
Léčba hyperviskozity a další indikace plazmaferézy
Plazmaferéza je indikovaná u pacientů s klinicky závažnými příznaky hyperviskozity, samotná fyzikální hodnota naměřené viskozity není indikací pro plazmaferézu.
Výměna 1-1,5 plazmatického objemu sníží viskozitu asi o 60-75 %. U pacientů s klinicky závažnými projevy hyperviskozity se proto doporučuje 1-2 plazmaferézy [106].
Opakované plazmaferézy s cílem udržet viskozitu v přijatelných hodnotách jsou doporučovány jednak pro nemocné, jejichž nemoc je rezistentní na medikamentózní léčbu a také pro nemocné, kteří nejsou schopni podstoupit účinnou medikamentózní léčbu. Efekt plazmaferézy nastupuje rychle a trvá v případě imunoglobulinu typu IgM 4-6 týdnů.
Dle omezených zkušeností je plazmaferéza také alternativou u nemocí způsobených monoklonálním imunoglobulinem (IgM related disorders), jako je závažná neuropatie, symptomatická kryoglobulinemie, nebo odlitková nefropatie. Může být iniciálním krokem před podáním cytoredukční léčby, která utlumí aktivitu nemoci [102,103].
Léčení chronické zánětlivé demyelinizační neuropatie související s IgM
Neuropatie může být indikací k léčebnému zásahu jak u pacienta se symptomatickou Waldenstromovou makroglobulinemií, tak u pacienta s MGUS typu IgM.
Léčebné postupy u pacientů s gamapatií a těžkou neuropatií bez přítomnosti maligní lymfoproliferace jsou shrnuty v doporučení Evropské neurologické společnosti. O plazmaferetických postupech byly publikovány pozitivní zprávy, stejně tak jako o podání vysokých dávek imungolobulinů i.v., není však jasné, jak dlouho tento účinek trvá. Interferon α zlepšil dominantně senzorické symptomy, ale tento účinek nebyl potvrzen všemi studiemi. Některé práce popisují pozitivní přínosy cytostatické imunosupresivní léčby. V posledních letech bylo zveřejněno několik studií testujících rituximab v této indikaci [104-121].
Žádný z popsaných léčebných postupů však neměl pravidelně nastupující a dlouhotrvající efekt, a proto rozhodování o léčbě těchto osoby je vždy spojeno s rozpaky.
Z doporučení Evropské neurologické společnosti citujeme:
- u pacientů bez invalidizujících potíží se doporučuje symptomatické léčba, nedoporučuje se imunosupresivní či imunomodulační léčba
- u pacientů s invalidizujícími potížemi či s rychlým zhoršováním se doporučují výměnné plazmaferézy pro začátek léčby, ačkoliv jejich dlouhodobý přínos není doložen
- u pacientů se střední nebo těžkou invalidizací se doporučuje imunosupresivní léčba, ačkoliv opět její dlouhodobý přínos není ještě jasně doložen. Současné zprávy signalizují, že rituximab může být v této indikaci přínosem [109]
Léčba Schnitzlerova syndromu
Schnitzlerův syndrom je vzácnou chorobou charakterizovanou urtikou, monoklonální gamapatií, artralgií, monoklonálním imunoglobulinem typu IgM, lymfadenopatií či splenomegalií, případně nálezem osteolyticko-osteosklerotických změn. Nemoc je sice svými projevy velmi invalidizující, ale má benigní průběh, jen asi u 15 % přejde do malignity. Léčba je symptomatická a velmi neuspokojivá. První zpráva o výrazně úspěšné léčbě je až s použitím preparátu anakinra - antagonisty receptoru interleukinu I [125,126].
Léčba kryoglobulinemie
V případě Waldneströmovy makroglobulinemie se můžeme setkat s kryoglobulinemií I. nebo II. typu. Prvním logickým krokem v případě symptomatické kryoglobulinemie je odstranění patologického paraproteinu plazmaferézou.
Prednison při kryoglobulinemii II. typu mírní projevy vaskulitidy. Mimo klasické léčby cytostatiky se při léčbě kryoglobulinemie I. i II. typu, související s maligní či benigní lymfoproliferací, osvědčil rituximab. U pacientů s kryoglobulinem při benigní gamapatii bylo pozorováno zlepšení u 6 z 8 léčených a podobné příznivé výsledky popsali i další autoři. Léčba hemolytické anémie s chladovými aglutininy může být velmi obtížná. Pozitivní efekt byl mimo jiné zaznamenán i po rituximabu i fludarabinu [127-137].
Závěr
Klasická léčba Waldenströmovy makroglobulinemie alkylačními cytostatiky se v posledních letech obohatila o nové léčebné postupy. Kombinace purinových analog se jevily velmi nadějné, ale teprve v posledních letech bylo popsáno riziko myelodysplazie s nimi spojené. Další zlepšení přinesla monoklonální protilátka rituximab a velmi nadějné se jeví nové kombinace rituximabu s novými léky typu bortezomibu nebo lenadomidu.
Podobně u nemocí, způsobených monoklonálním imunoglobulinem IgM, byť tvořeným nemaligním klonem, znamená obzvláště rituximab další pokrok.
Práce byla podpořena granty MŠMT: LC 06027 a VZ 0021622434
Addendum in Vnitřní lékařství 2007; 53(12):
Práce Adam Z. Šmardová J. Ščudla V. Waldenströmova makroglobulinemie - klinické projevy a diferenciální diagnostika a prognóza nemoci. Vnitř Lék 2007; 53(12): 1325-1337 byla také podpořena granty MŠMT: LC 06027 a VZ 0021622434
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 18. 7. 2007
Přijato po recenzi: 26. 9. 2007
Zdroje
1. Waldenström J. Incipient myelomatosis or essential hyperglobulinemia with fibrinogenopenia. A new syndrome? Acta Med Scand 1944; 117 : 217-247.
2. Pangalis GA, Kyrtsonis MCh, Kontopidu FN et al. Differential diagnosis of Waldenström’s macroglobulinemia and other B cell disorders. Clin Lymphoma 2005; 5: 235-240.
3. Rajkumar SV Monoclonal gammopathy of unknown significance, Waldenström’s macroglobulinaemia, AL-amyloidosis and related plasma cell disorders. Diagnosis and treatment. Mayo Clin Proc 2006; 81 : 893-703.
4. Johnson SA, Birchall J, Luckie C et al. Guidelines on management of Waldenström’s macroglobulinemia. Brit J Haematol 2006; 132 : 687-697.
5. Kyle RA, Treon SP, Alexanian R et al: Prognostic markers and criteria to initiate therapy in Waldenström´s macroglobulinemia. Consensus panel recommendation from the second international Workshop on Waldenström´s macroglobulinemia. Semin Oncol 2003; 30: 116-120.
6. Kimby E, Treon SP, Anagnastopoulos A et al. Update on recommendations for assessing response from the Third International Workshop on Waldenström’s macroglobulinaemia. Clin Lymphoma Myeloma 2006; 6: 380-383.
7. Weber D, Treon SP, Emmanouilides Ch et al. Uniform response criteria in Waldenström’s macroglobulinemia: Consensus panel recommendations from the second international workshop on Waldenström’s macroglobulinemia. Sem Oncol 2003; 30 : 127-131.
8. Kyle RA, Greipp PR, Gerz MA et al. Waldenström’s macroglobulinemia. A prospective study comparing daily with intermittent oral chlorambucil. Brit J Haematol 2000; 108: 737-742.
9. Kyle RA, Treon SP, Alexanian R et al: Prognostic markers and criteria to initiate therapy in Waldenström’s macroglobulinemia. Consensus panel recommendation from the second international Workshop on Waldenström´s macroglobulinemia. Semin Oncol 2003; 30: 116-120.
10. Dimopoulos MA, Kyle RA, Anagnastopoulos A et al. Diagnosis and management of Waldenström’s macroglobulinemia. J Clin Oncol 2005; 23 : 1564-1577.
11. Dimopoulos MA, Merlini G, Leblond V et al. How we treat Waldenström’s macroglobulinemia. Haematologica 2005; 90 : 117-125.
12. Annibali O, Petruci MT, Martini V et al. Treatment of 72 newly diagnosed Waldenström’s macroglobulinemia cases with oral melphalan, cyclophosphamide and prednisone. Cancer 2005; 103: 582-587.
13. Johnson SA. Waldenström macroglobulinaemia. Rev Clin Exp Hematol 2002; 6 : 421-334.
14. Gertz MA, Anagostopoulos A, Anderson K et al. Treatment recommendation in Waldenström’s macroglobulinaemia. Consensus panel recommendation from the second international workshop on Waldenström’s macroglobulinaemia. Semin Oncol 2003; 30 : 121-126.
15. Treon SP, Gertz MA, Dimopoulos M et al. Update on treatment recommendations from the Third International Worshop on Waldenström’s macroglobulinaemia. Blood 2006; 107 : 3442-3446.
16. Björkholm M. Treatment options in Waldenström’s macroglobulinemia. Clin Lymphoma 2004; 5 : 155-162.
17. Desikan KR, Li Z, Jaganath S. Waldenström’s makroglobulinemia: current therapy and future approaches. Bio Drugs 2002; 16 : 201-207.
18. Dimopoulos MA, Merlini G, Leblond V et al. How we treat Waldenström’s macroglobulinemia. Haematologica 2005; 90: 117-125.
19. O’Reilly RA, MacKanzie MR. Primary macroglobulinaemia: remission with adrenal corticosteroid therapy. Arch Intern Med 1967; 44: 889-890.
20. Jane SM, Salem HH. Treatment of resistant Waldenström’s macroglobulinaemia with high dose glucocorticosteroids. Aust NZJ Med 1988; 18 : 77-78.
21. Hensel M, Villalobos M, Kornacker M et al. Pentostatin/cyclophosphamide with or without rituximab: An effective regimen for patients with Waldenström’s macroglobulinemia/lymphoplasmocytic lymphoma. Clin Lymphoma Myeloma 2005; 6 : 131-135.
22. Dhodapkar MV, Jacobson JL, Gertz MA et al. Prognostic factors and response to fludarabine therapy in Waldenström’smacroglobulinemia: an update of a US Intergroup trial. Semin Oncol 2003; 30 : 220-225.
23. Dimopoulos MA, Alexanian R. Waldenström’s macroglobulinaemia. Blood 1994 : 83 : 1452-1459.
24. Leblond V, Choquet S at al. Fludarabine in Waldenström’s macroglobulinemia. Semin Oncol 2003; 30 : 239-242.
25. Johnson SA, Owen RG, Oscier DG et al. Phase III study of chlorambucil versus fludarabine as a initial therapy for Waldenström’s macroglobulinemia and related disorders. Clin Lymphoma 2005; 5: 294-297.
26. Enzenauer RJ, Judein PH. Purine analogues for treatment of refractory essentials mixed cryoglobulinemia. Mayo Clin Proc 1997; 72 : 92-93.
27. Giudice I, Matutes E, Osuji N et al. Deleyed response to fludarabine in lymphoplasmocytic lymphoma/Waldenström’smacroglobulinemia. Hematologia 2005; 90 : 268-270.
28. Dimopoulos MA, Kantarjian H, Weber D et al. Primary therapy of Waldenström’s macroglobulinaemia with 2-chlordeoxyadenosine. J Clin Oncol 1994; 12 : 1694-2698.
29. Delannoy A, Van den Neste E, Michaux JL et al. Cladribine for Waldenström’s macroglobulinaemia. Brit J Haematol 1999; 104: 933-935.
30. Fridrik MA, Jater G, Baldinger C et al. First line treatment of Waldenström’sdisease with cladribine. Ann Hematol 1997; 74 : 7-10.
31. Lewandowky K, Halaburda K, Hellman A et al. Fludarabine therapy in Waldenström’smacroglobulinemia patients treated previously with 2-chlordeoxyadenosine. Leuk Lymphoma 2002; 43 : 361-363.
32. Lewandowski K, Zacha JM, Bieniaszewska M et al. 2-chlordeoxyadenosine treatment of Waldenström’smacroglobulinaemia. Med Sci Monit 2000; 6: 740-745.
33. Hampshire A, Saven A. Update of bolus administration of cladribine in the treatment of Waldenström’smacroglobulinemia. Blood 2003; 102(Suppl 1): 402.
34. Foran JM, Rohatiner AZS, Coffier B et al. Multicentre phase II study of fludarabine phosphate for patients with newly diagnosed lymphoplasmocytic lymphoma, Waldenström’s macroglobulinaemia and mantle cell lymphoma. J Clin Oncol 1999; 17 : 546-553.
35. Thalhammer S, Geissler K, Schwarzinger I et al. Fludarabine in Waldenström’s macroglobulinaemia. Ann Hematol 2000; 79 : 775-779.
36. Dimopoulos MA, Weber D, Kantarjian H et al. 2-chlordeoxyadenosine therapy of Waldenström’s macroglobuliniaemia previously treated with fludarabine. Ann Oncol 1994; 5 : 288-289.
37. Bettticher DC, Hsu DC, Schmitz SF et al. Cladribine given as subcutaneous bolus injection is active in pretreated macroglobulinaemia. Brit J Haematol 1997; 99: 358-363.
38. Dimopoulos MA, O’Brien S, Kantarjian H et al. Fludarabin therapy in Waldenström’s macroglobulinemia. Amer J Med 1993; 95 : 49-52.
39. Leblond V, Ben-Othman T, Deconinck E et al. Activity of fludarabine in previously treated Waldenström’s macroglobulinaemia. J Clin Oncol 1998; 16 : 2060-2064.
40. Zinzani PL, Gherlinzon F, Bendandi M et al. Fludarabine treatment in resistent Waldenström’s macroglobulinemia. Eur J Haematol 1995; 54: 120-123.
41. Tamburini JL, Chaleteix V, Cermane JP et al. Fludarabine plus cyclophoshamide in Waldenström’s macroglobulinemia. Results in 49 patients. Leukemie 2005; 19 : 1831-1834.
42. Tam CS, Wolf M, Prince HM et al. Fludarabine, cyclophosphamide and rituximab for the treatment of patients with chronic lymphocytic leukemia or indolent lymphoma. Cancer 2006; 106 : 2412-2420.
43. Weber DM, Dimopoulos MA, Dalasalle K et al. 2-chlordeoxyadenosine alone and in combination for previously untreated Waldenström’s macroglobulinemia. Semin Oncol 2003; 30 : 243-247.
44. Bowcock SJ, Rassam SM, Lim Z et al. High incidence of therapy releated myelodysplasia and acute leukemia in general hematology clinic patients treated with fludarabine and cyclophosphamide for indolent lymphoproliferative disorders. Brit J Haematol 2006; 134 : 242-243.
45. Leleu Y, Manning R, Soumerai J et al. Increased incidence of disease transformation and development of MDS/AML in Waldenström’s macroglobulinemia patients treated with nucleoside analogs. Haematologica 2007; 92(Suppl 2): WM3.10.
46. Leblond V. Role of purine analogs in front line treatment of Waldenström’s macroglobulinemia. Haematologica 2007; 92(Suppl 2): WM2.2.
47. Byrd JC, White CA, Link B et al. Rituximab therapy in Waldenström’s macroglobulinaemia. Ann Oncol 1999; 10 : 1525-2527.
48. Capalbo S, Dargenio M, Delia M et al. Durable complete remission after chemotherapy and rituximab in a case of Waldenström’s macroglobulinemia with pleuropulmonaly involvement. Ann Hematol 2005; 84: 625-626.
49. Dimopoulos MA, Hamilos G, Efstathiou E et al. Treatment of Waldenström’s macroglobulinaemia with combination of fludarabine and cyclophosphamide. Leuk Lymphoma 2003; 44: 993-996.
50. Dimopoulos MA, Zervas C, Zomas A Extended rituximab therapy for previously untreated patients with Waldenstöm´s macroglobulinaemia. Clin Lymphoma 2002; 3 : 163-166.
51. Dimopoulos MA, Anagnostopoulos A, Zervas C et al. Predictive factors for response to rituximab in Waldenström macroglobulinemia. Clin Lymphoma 2005; 5: 270-272
52. Foran JM, Rohatinek AZ, Cunningham D et al. European phase II study of rituximab for patients with newly diagnosed mantle cell lymphoma, imunocytoma and small B-cell lymphocytic lymphoma. J Clin Oncol 2000; 18 : 317-324.
53. Gerz MA, Rue M, Blood E et al. Multicenter phase II trial of rituximab in Waldenström’s macroglobulinaemia. An Eastern Cooperative Oncology Group Study (E3A98). Leuk Lymphoma 2004; 45 : 2047-2055
54. Treon SP, Hunter ZR, Barnagan AR CHOP plus rituximab in Waldenström’s macroglobulinemia. Clin Lymphoma 2005; 5 : 273-277.
55. Treon SP, Agus DB, Link B et al. CD20 directed antibody mediated immunotherapy induces response and facilitates hematologic recovery in patients with Waldenström’s macroglobulinaemia. J Immunother 2001; 24: 272-279.
56. Treon SP, Branagan AR, Hunter Z et al. Paradoxical increase in serum IgM viscosity levels following rituximab in Waldenström’s macroglobulinaemia. Ann Oncol 2004; 15 : 1481-1483.
57. Treon SP, Emmanoulides C, Kimby E et al. Extended rituximab therapy in Waldenström’s macroglobulinaemia. Ann Oncol 2005; 16 : 132-138.
58. Treon SP, Hansen M, Branagan AR et al. Polymorphismus in FCgama (CD16) receptor expression are associated with clinical response to rituximab in Waldenström macroglobulinemia. J Clin Oncol 2005; 23: 474-481.
59. Treon SP, Kelliher A, Keele B et al. Expression of serotherapy targets in Waldenström’s macroglobulinaemia. Therapeutic application and consideration. Semin Oncol 2003; 30 : 248-252.
60. Emmanoulides Ch Radioimmunotherapy for Waldenström’s macroglobulinamia. Semin Oncol 2003; 30 : 258-261.
61. Tsai DE, Maillard I, Wowns LH et al. Use of iodine 131I tositumomab radioimmunotherapy in a patients with Waldenström’s macroglobulinaemia. Leuk Lymphoma 2004; 45: 591-595.
62. Krishna VM, Carey RW, Bloch KJ Marked increase in serum IgM during treatment of Waldenström’s macroglobulinemia with cladribine N Engl J Med 2003; 348 : 2045-2046.
63. Ghobrial IR, Fonseca R, Greipp PR et al. Initial imunoglobulin M flare after rituximab therapy in patients diagnosed with Waldenström’s macroglobulinaemia. Cancer 2004; 101 : 2593-2598.
64. Nichols GL, Sabate DG Timing of Rituximab/Fluradarabine in Waldenström’s macroglobulinaemia may influence hyperviscosity. Blood 2004; 104(Suppl): 237b
65. Weber DM, Thomas S, Wang M et al. Rituximab alone or in combination in the frontline treatment of Waldenström’s macroglobulinemia. Haematologica 2007; 92(Suppl. 2): WM2.3.
66. Weber DN, Dimopoulos MA, Dellasale J. 2-chlordeoxyadenosine alone and in combination for previsously untreated Waldenström’s macroglobulinaemia. Semin Oncol 2003; 30, 243-247.
67. Treon SP, Wasi P, Emmanoulides CA. Combination therapy with rituximab and fludarabine is highly active in Waldenström’s macroglobulinemia. Blood 2002; 100(Suppl 1): 211.
68. Kilidireas C, Anagnastopoulos A, Karandreas N et al. Rituximab therapy in monoclonal IgM releated neuropaties. Leuk Lymphoma 2006; 47 : 859-864.
69. Laszlo A, Andreola G, Rabascio C et al. Cladribine and rituximab combination treatment for patients with Waldenström’s macroglobulinemia or small lymphocytic lymphoma. Haematologica 2007; 92(Suppl 2): Po 1224 (abstr).
70. Pearlman AN, Fechner F, Constantinides M Development of nasal skin necrosis associated with rituximab treatment for Waldenström’s macroglobulinemia and subsequent spontaneuous resolution. Ear Nose Throat Journal 2006; 85 : 431-433
71. Tedeschi A, Miqueleiz AS, Ricci F et al. Fludarabine cyclophosphamide and rituximab an effective regimen characterized by high incidence of delayed responses in Waldenström’s macroglobulinaemia. Haematologica 2007; 92(Suppl 2): Po 1225 (abstr).
72. Thomas SK, Delassale KB, Gavino M et al. 2-CDA cyclophosphamide plus rutuximab for symptomatic WM. Haematologica 2007; 92(Suppl 2): Po 1227 (abstr).
73. Vargaftig J, Pegourie-Bandelier B, Mahe B et al. Fludarabine plus cyclophosphamide and rituximab in Waldenström’s macroglobulinemia. Results in 25 patients. Haematologica 2007; 92(Suppl 2): Po 1226 (abstr).
74. Treon ST, Hunter Z, Branagan AR CHOP plus rituximab therapy in Waldenström’s macroglobulinaemia. Clin Lymphoma 2005; 5 : 273-277.
75. Owen RG, Rawstron AC, Osterborg A et al. Activity of alemtuzumab in relapsed/refraktory Waldenström’s macroglobulinaemia. Blood 2003; 644: Suppl. 645.
76. Owen RG, Hillmen P, Rastron AC CD52 expression inWaldenström’s macroglobulinaemia: Implication for alemtuzumab therapy and response assessment. Clin Lymphoma 2005; 5 : 278-281.
77. Santos DD, Hatjiharisi E, Tournilhac O et al. CD52 is expressed on human mast cells and is a potential therapeutic target in Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2006; 6: 478-483.
78. Tournilhac O, Santos DD, Xu L et al. Mast cells in Waldenström’s macroglobulinemia support lymphoplasmocytic cell growth trough CD154/CD40 signaling. Ann Oncol 2006; 17 : 1275-1282.
79. Treon SR. CD52 is expressed on human mast cells and is a potentional therapeutic target in Waldenström’s macroglobulinaemia and mast cell disorders. Clin Lymphoma Myeloma 2006; 6 : 470-473.
80. Owen RG, Hillmen P, Rastron AC. CD52 expression inWaldenström’s macroglobulinaemia: Implication for alemtuzumab therapy and response assessment. Clin Lymphoma 2005; 5 : 278-281.
81. Branagan AR, Hunter Z, Santos D et al. Thalidomide and rituximab in Waldenström macroglobulinaemia. Blood 2004; 104: 415.
82. Coleman M, Leopard J, Lyons L et al. Treatment of Waldenström’s macroglobulinemia with claritromycin, low-dose thalidomid and dexamethasone. Semin Oncol 2003; 30 : 270-274.
83. Dimopoulos MA, Tsatalas A, Zomas G Treatment of Waldenström’s macroglobulinaemia with single agent thalidomid or with the combination of clarithromycin, thalidomid and dexamethasone. Semin Oncol 2003; 30 : 265-269.
84. Dimopoulos MA, Zomas A, Viniou NA. Treatment of Waldenström macroglobulinemia with thalidomide. J Clin Oncol 2001; 19 : 3596-3601.
85. Soumerai J, Branagan A, Hunter Z et al. Use of the immunomodulators thalidomide and lenalidomide tu augment rituximab activity in Waldenström’s macroglobulinaemia. Haematologica 2007; 92(Suppl 2): WM3.8 (abstr).
86. Strauss SJ, Maharaj L, Stec J et al. Phase II study of bortezomib in patients with relapsed/refraktory non-Hodgkin’s disease. Blood 2004; 104: 389.
87. Dimopoulos MA, Anagnostopoulos A, Kyrtsonis MC et al. Treatment of relapsed or refractory Waldenström macroglobulinaemia with bortezomib. Haematologica 2005; 90 : 1655-1658.
88. Gertz MA, Zeyer SM, Badros A. Early results of phase I of oblimersen sodium for relapsed or refractory Waldenström’s macroglobulinemia. Clin Lymphoma 2005; 5 : 282-284.
89. Frankel SR. Oblimersen sodium therapy in Waldenström’s macroglobulinaemia. Semin Oncol 2003; 30: 300-304
90. Treon SP, Tournihac O, Branagan AR et al. Clinical response to sildenafil in Waldenstöm´s macroglobulinemia. Clin Lymphoma 2004; 5 : 205-207.
91. Anagnostopoulos A, Dimopoulos MA, Aleman A et al. High dose chemotherapy followed by stem cell transplantation in patients with Waldenström’s macroglobulinemia. Bone Marrow Transplant 2001; 27 : 1027-1029.
92. Anagnostopoulos A, Aleman A, Gorale S et al. Autologous and allogenic stem cell transplantation in Waldenström’s macroglobulinemia. Semin Oncol 2003; 30 : 286-290.
93. Anagnostopoulos A, Parameswaran N, Waleska HH et al. Augologous or allogeneic stem cell transplantation in patients with Waldenström’s macroglobulinemia. Biol Blood Marrow Transplant 2006; 12: 845-854.
94. Tournilhac O, Leblond V, Tabrizi R et al. Transplantation in Waldenström’s macroglobulinaemia. The French Experience. Semin Hematol 2003; 30 : 291-296.
95. Munshi NC, Barlogie B. Role of high dose therapy with autologou hematopoietic stem cell support in Waldenström’s macroglobulinaemia. Semin Oncol 2003; 30 : 282-285.
96. Kyriakou C, Canals C, Taghipour G et al. Allogeneic stem cell transplantation in Waldenström macroglobulinaemia. An analysis of 106 cases from the European Bone Marrow Transplatn registry. Haematologica 2007; 92(Suppl 2): WM3.9 (abstr).
97. Kyriakou C, Canals C, Taghipour G et al. Autologous stem cell transplantation for patients with Waldenström’s macroglobulinaemia. An analysis of 201 cases from the European Bone Marrow Transplant registry. Haematologica 2007; 92(Suppl 2): 1228 (abstr).
98. Han PN. Autologous and allogeneic stem cell transplantation in patients with Waldenström’s macroglobulinemia. Biol Blood Marrow Transplant 2006; 12 : 845-854.
99. Dreger P, Glass B, Kuse R et al. Myeloablative radiochemotherapy followed by reinfusion of purged autologous stem cell for Waldenström’s macroglobulinaemia Brit J Hematol 1999; 106: 115-118.
100. Desikan MV, Dhodapkar M, Siegel D et al. High dose therapy with autologous hemopoietic stem cell support for Waldenström macroglobulinaemia. Brit J Haematol 1999; 105: 993-996
101. Yang L, Wen B, Li H et al. Autologous peripheral stem cell transplantation for Waldenström’s macroglobulinemia. Bone Marrow Transplant 1999; 24: 929-930.
102. Johnson SA. Advances in the treatment of Waldenström’s macroglobulinemia. Exp Rev Anticancer Treatment 2006; 6: 329-334.
103. Clark WF, Rock GA, Buskard N et al. Therapeutic plasma exchange: an update from the Canadian Apheresis Group. Ann Intern Med 1999; 131 : 453-462.
104. Dimopoulos MA. Rituximab therapy in monoclonal IgM related neuropaties. Leuk Lymphoma 2006; 47 : 859-864.
105. Dyck PJ, Low PA, Windeband AJ et al. Plasma exchange in polyneuropathy associated with monoclonal gammapathy of undetermined significance. J Engl J Med 1991; 325 : 1482-1486.
106. Einstein R. Therapeutic plasma exchange performed in tandem with hemodialysis for patients with M-protein disorders. J Clin Apheresis 2006; 21 : 100-104.
107. Gertz MA. Waldenström’s macroglobulinemia: review of therapy. Amer J Hematology 2005; 79 : 147-157.
108. Gordon KC. Clinical features evaluation, and treatment of paraproteinemic neuropathy associated with gammapathy of undetermined significance J Clin Apheresis 1999; 14 : 149-153.
109. Hadden RDM. European Federation of Neurological Societies, Peripheral nerve society guideline on management of paraproteinemic demyelinating neuropaties. Eur J Neurology 2006; 13 : 809-818.
110. Kazkaz H, Isenberg D. Anti B-cell therapy in the treatment of autoimmune disease. Curr Opin Pharmacol 2004; 4: 398 - 402
111. Kiprov D, Hofmann JC. Plasmapheresis in immunologicaly mediated polyneuropaties. Ther Apher Dial 2003; 7: 189-196.
112. Levine T, Pestron A, Florence J et al. Peripheral neuropathies in Waldenström’s macroglobulinemia. J Neurol Neurosurg Psychiatry 2006; 77 : 224-228.
113. Liberato B, Riethmuller A, Comenzo RL et al. Myelopathy from Waldenström’s macroglobulinaemia: improvement after rituximab therapy. J Neurooncol 2003; 63 : 207-211.
114. Lunn MPT, Nobile-Ozario E. Immunotherapy for IgM anti-myelin associated glycoprotein paraprotein-associated peripheral neuropaties. To Cochrane Library 2006 (4); www.thecochranelibrary.com
115. Nobile-Orazio E. IgM paraproteinemic neuropathies. Curr Opin Neurol 2004; 17 : 599-605.
116. Nobile-Ozario E. Immunotherapy for IgM anti-myelin associated glycoprotein associated peripheral neuropathies. The Cochrane library 2006 (4).
117. Owen RG, Parapia LA, Higginson J et al: Clinicopathological correlates of IgM paraproteinemias. Clin Lymphoma 2000; 1 : 39-43.
118. Pestrong A, Florence J, Miller T et al. Treatment of IgM antibody associated polyneuropathies using rituximab. J Neurol Neurosurgery Psychiatr 2003; 74 : 485-489.
119. Pestronk A. Peripheral neuropathy in Waldenström’s macroglobulinemia. J Neurol Neurosurg Psychiatr 2006; 77 : 224-228.
120. Latow N. Prognosis of neuropathy with monoclonal gammopathy. Musle Nerve 2000; 23: 150-152.
121. Simovic D, Gorson, KC, Ropper AH. Comparison of IgM-MGUS and IgG MGUS polyneuropathy. Acta Neurol Scand 1998; 97 : 194-200.
122. Weber DM, Gavino M, Huh Y et al. Phenotypic and clinical evidence supports rituximab for Waldenstöm´s macroglobulinaemia. Blood 1999; 94(Suppl 1): ???Abstr???.
123. Weide R, Heymanns J, Koppler H The polyneuropathy associated with Waldenström’s macroglobulinaemia can be treated effectively with chemotherapy and anti CD20 monoclonal antibody. Brit J Haematol 2000; 109 : 838-841.
124. Wicklund MP, Kissel JT. Paraproteinemic neuropaty. Curr Treat Options Neurol 2001; 3 : 147-156.
125. Koning HD, Bodar EJ, Simon A et al. Beneficial response to anakinra and thalidomide in Schnitzler’s syndrome. Ann Rheum Dis 2006; 65: 542-544.
126. Schnitzler L, Hurez D, Verret JL et al. Chronic urtika and hyperostosis in macroglobulinemia. Ann Dermatol Venereol 1989; 116: 547-550.
127. Bryce AH, Dispenzieri A, Kyle R et al. Response to rituximab in patients with type II cryoglobulinaemia. Clin Lymphoma 2006; 7: 140-144.
128. Bryce AH, Kyle RA, Dispenzieri A et al. Natural history of therapy of 66 patients with mixed cryoglobulinemia. Amer J Hematol 2006; 81: 511-518.
129. Dimopoulos MA, Panayiotis P, Moulapoulos LA et al. Waldenström’s makroglobulinemia: Clinical features, complication and management. J Clin Oncol 2000; 18 : 214-226.
130. Dispenzeri A. Symptomatic cryoglobulinemia. Curr Treat Option Oncol 2000; 2 : 105-118.
131. Enzenauer RJ, Judein PH Type II mixed cryoglobulinaemia treated with fludarabine. J Rheamatol 1996; 23 : 764-795.
132. Gertz MA. Natural history and therapy of 66 patients with mixed cryoglobulinemia. Amer J Hematol 2006; 81 : 511-518.
133. Gertz MA Overview in salvage treatment in Waldenström’s macroglobulinemia. Haematologica 2007; 92(Suppl 2): WM2.4 (abstr).
134. Roccatelo D, Baldvino S, Rossi D et al. Long-term effects of antiCD20 monoclonal antibody treatment of cryoglobulinemic glomerulonefritis. Nephrol Dial Transplant 2004; 30 : 543-561.
135. Zaja F, DeVita S, Mazzaro C et al. Efficacy and safety of rituximab in type II mixed cryoglobulinaemia. Blood 2003; 101 : 3827-3840.
136. Gobi PG, Bettini R, Montecucco C et al. Study of prognosis in Waldenström’s macroglobulinaemia. Blood 1994; 83 : 1452-1459.
137. Jacobs A A cold aglutinin hemolysis responding to fludarabine therapy. Am J Hematol 1996; 53 : 279-280.
138. Berentsen S, Ulvestad E, Gjertsen BT et al. Rituximab for primary chronic cold agglutinin disease. Prospective study of 37 courses of therapy in 27 patients. Blood 2004; 103 : 2925-2928.
139. He1lmann A, Lewandowky I, Zaucha JM. Effect of 2-hour infusion of 2-chlordeoxyadenosine in the treatment of previously untreated Waldenström’s macroglobulinemia. Brit J Hematol 1999; 104: 933-934.
140. Laurince FM, Zulian GB, Ghetty A et al. Cladribin with cyclophoshamide and prednisone in the management of low grade lymphoproliferative malignancies. Brit J Cancer 1999; 79 : 1215-1219.
141. Tam CS, Wolf MM, Westerman D et al. Fludarabine combination therapy is highly effective in fist line and salvage treatment of patients with Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2005; 6: 136-139.
142. Tam CS, Seymour JF, Prince JM. Treatment releated myelodysplasia following fludarabine combinations chemotherapy. Haematologica 2006; 91 : 1546-1550.
143. Treon SP. Mast cells in Waldenström’s macroglobulinaemia support lymphoplasmocytic cell growth through CD154CD40 signaling. Ann Oncol 2006; 17 : 1275-1282.
144. Treon SP. Update on recommendation for assessing response from the Third International Workshop on Waldenström’s macroglobulinaemia. Clin Lymphoma Myeloma 2006; 6 : 380-383.
145. Treon SP, Gertz MA, Dimopoulos M et al. Update on treatment recommendations from the Third International Worshop on Waldenström’s macroglobulinaemia. Blood 2006; 107 : 3442-3446.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Z odborné literaturyČlánek Hodnocení proliferačního a apoptotického indexu plazmatických buněk v průběhu mnohočetného myelomuČlánek Využití detekce galaktomananu pro diagnostiku invazivní aspergilózy u hematoonkologických nemocnýchČlánek Diferencovaný přístup k preskripci fyzické aktivity u nemocných s dysfunkcí levé komory srdečníČlánek Celiakální sprue - editorial
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2008 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
-
Doporučení diagnostických a léčebných postupů u arteriální hypertenze - verze 2007
Doporučení České společnosti pro hypertenzi - Z odborné literatury
- Fibrilace síní - kardiovaskulární epidemie - editorial
- Konvenční léčba fibrilace síní - editorial
- V diagnostice i terapii houbových infekcí nastal v posledních letech velký pokrok, stále však nedostačující - editorial
- Farmakogenetika léčby statiny - editorial
- Sledování účinnosti antikoagulační léčby u nemocných s fibrilací síní v závislosti na věku
- Pozitivita sérových protilátok proti endomýziu, jejunu a histopatologická diagnostika celiakie u detí
- Hodnocení proliferačního a apoptotického indexu plazmatických buněk v průběhu mnohočetného myelomu
- Konvenční léčba fibrilace síní řízená ambulantními kardiology v ČR: přehled diagnostických a léčebných výkonů, medikamentózní léčby a hospitalizací
- Využití detekce galaktomananu pro diagnostiku invazivní aspergilózy u hematoonkologických nemocných
- Medicína v roce 2008: Je vidět světlo na konci tunelu?
- Diferencovaný přístup k preskripci fyzické aktivity u nemocných s dysfunkcí levé komory srdeční
- Farmakogenetika léčby statiny
- Léčba Waldenströmovy makroglobulinemie a léčba nemocí způsobených monoklonálním IgM gamaglobulinem
- Celiakální sprue - editorial
- Celiakální sprue – Memorandum EKCS
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
-
Doporučení diagnostických a léčebných postupů u arteriální hypertenze - verze 2007
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Využití detekce galaktomananu pro diagnostiku invazivní aspergilózy u hematoonkologických nemocných
- Hodnocení proliferačního a apoptotického indexu plazmatických buněk v průběhu mnohočetného myelomu
- Farmakogenetika léčby statiny
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



