-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Injekce toxinu botulinu při léčbě hyperaktivního močového měchýře refrakterního na medikamentózní léčbu
Autoři: P. Patki; S. Wood; J. Shah
Vyšlo v časopise: Urol List 2008; 6(1): 25-28
Charakteristickým znakem hyperaktivního močového měchýře (OAB) je přítomnost volných kontrakcí močového měchýře během plnicí fáze mikčního cyklu (obr. 1). Osoby s OAB nejsou schopny tyto kontrakce potlačit, což vede ke vzniku dráždivých symptomů, jako jsou například urgence (s nebo bez úniku moči), frekvence a nykturie. V případě, že nejsme schopni příčinu vzniku zvýšené funkce detruzoru vysvětlit, popisujeme tento stav jako idiopatickou hyperaktivitu detruzoru (IDO). Pokud má tento stav neurologickou příčinu, označujeme jej jako neurogenní hyperaktivitu detruzoru (NDO). Léčba první volby (pro IDO i NDO) zahrnuje blokádu muskarinních receptorů na svalovině detruzoru pomocí aplikace anticholinergik. Tato léčba je sice u mnoha pacientů účinná, u 61 % pacientů byla však zaznamenána horší tolerance způsobená výskytem vedlejších účinků (pocit suchosti v ústech), což přispívá k horší komplianci [1]. Při aplikaci antimuskarinik a dalších medikamentů (jako například blokátorů kalciových kanálů a tricyklických antidepresiv) byla dále zaznamenána nedostatečná suprese hyperaktivity detruzoru.
Obr. 1. Urodynamický nález idiopatické hyperaktivity detruzoru. Zvýšení tlaku je zaznamenáno křivkou zaznamenávající intravezikální tlak (A) a křivkou zaznamenávající tlak detruzoru (B) bez odpovídajícího zvýšení křivky abdominálního tlaku (C). Tím dochází k mimovolní kontrakci svaloviny detruzoru během plnicí fáze, ve které pacient aktivně inhibuje každou motorickou aktivitu v močovém měchýři. 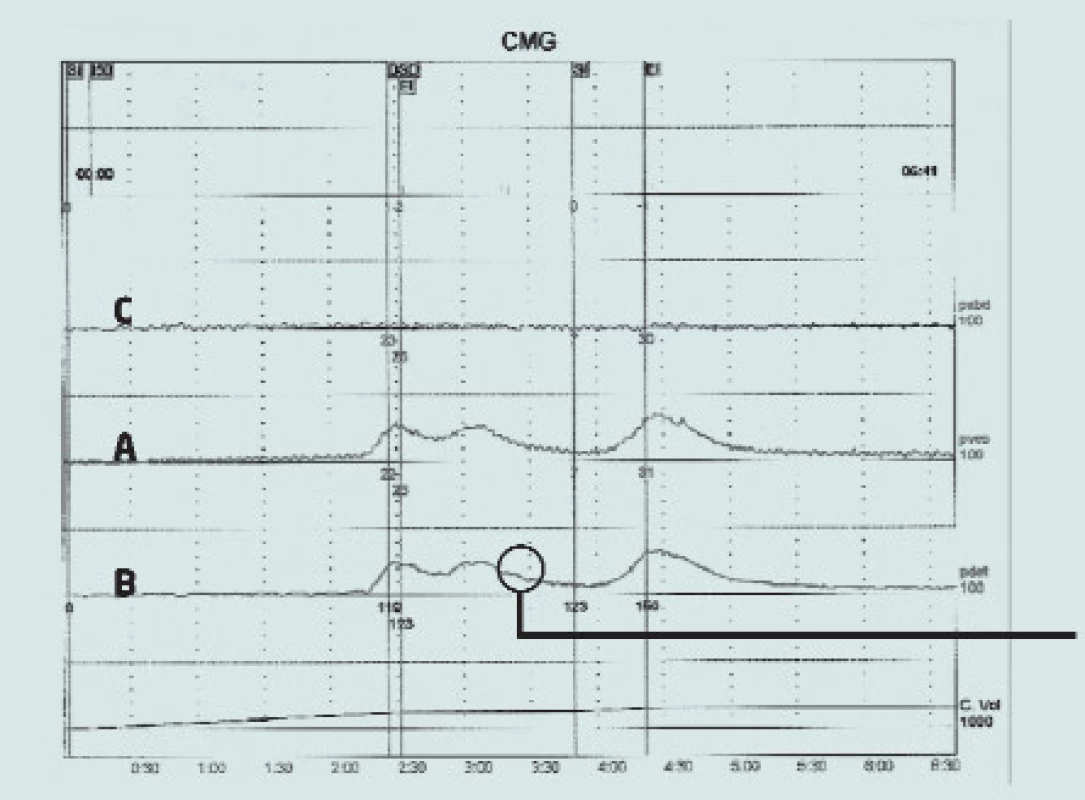
V případě, že je nutné léčbu omezit na minimálně invazivní metody, představuje OAB refrakterní na medikamentózní léčbu obrovskou klinickou výzvu. Při intravezikální aplikaci antimuskarinik a vaniloidů (resiniferatoxin) bylo zaznamenáno zlepšení symptomů [1,2]. Nedostatečná odezva na tento druh léčby a slabá kompliance však zabraňují širšímu užití těchto agens. Neuromodulace sakrálních nervů dosahuje lepších výsledků při léčbě dysfunkce nonneurogenního močového měchýře než při léčbě NDO [3,4]. Na základě těchto faktů se jako jediná možnost léčby jeví rekonstrukční operace, jako například ileocystoplastika a stimulace sakrálního anteriorního kořene.
V poslední době se jako nová modalita minimálně invazivní léčby IDO a NDO refrakterních na medikamentózní terapii užívá aplikace toxinu botulinu A (BTX-A) [5,6]. Při aplikaci ve formě cystoskopické intravezikální injekce sestává běžný protokol léčby z injikace roztoku toxinu na 30 různých míst pokrývajících většinu povrchu močového měchýře (s výjimkou trigona) [6,7]. Některé články zdůrazňují existenci důkazů prokazujících účinnost BTX-A při léčbě refrakterního OAB [6-12]. V nedávné době provedená randomizovaná kontrolovaná studie potvrdila účinek BTX-A v různých režimech dávkování [13,14]. Navíc bylo prokázáno, že aplikace BTX-A je bezpečná i u dětských pacientů [15].
DRUHY A MECHANIZMY ÚČINKU BTX
BTX je nejsilnější přirozeně se vyskytující toxin produkovaný grampozitivní anaerobní bakterií Clostridium botulinum. V závislosti na sérotypu organizmu produkujícího BTX rozlišujeme 7 imunologicky odlišných typů (označených indexem A-G) [16,17]. Komerčně dostupné pro klinické užití jsou však pouze typy A a B (tab. 1). Vzhledem k tomu, že mezi těmito 2 typy existují rozdíly, lze ve vzácných případech rezistence na typ A aplikovat BTX-B [18].
Tab. 1. Komerčně dostupné typy BTX. Ve skeletální svalovině 1 jednotky Botoxu-3 jednotek Dysportu [34,35]. ![Komerčně dostupné typy BTX. Ve skeletální svalovině 1 jednotky Botoxu-3 jednotek Dysportu [34,35].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5c5654ae741947a856bbe48519b9f8a3.png)
BTX je polypeptid s těžkým a lehkým řetězcem spojeným disulfidovou vazbou. Těžký řetězec umožňuje endocytózu v konečném nervovém vlákně a lehký řetězec štěpí jeden z rozpustných N-etyl senzitivní faktor receptorových proteinů, který se také podílí na exocytóze acetylcholinu. Následkem tohoto procesu dochází k mírné paralýze. Účinek injekce přetrvá po dobu 48–72 hodin, maximální účinek v močovém měchýři je zaznamenán přibližně 2 týdny po injekci [14]. Ke zvrácení paralýzy dochází následkem vzniku nových plně funkčních nervových vláken z Ranvierovy uzliny, což může v autonomním nervovém systému trvat až 1 rok [19].
V poslední době byla prokázána zřejmá antinociceptivní aktivita BTX způsobená inhibicí senzorické transmise, zejména v urotelu [20]. Tato aktivita je nezávislá na účinku BTX na neuromuskulární junkci a je pravděpodobně způsobena inhibicí uvolňování senzorických neurotransmiterů, jako jsou například substance P, adenozin trifosfát a peptid spojený s genem kalcitoninu [21].
BTX-A se běžně užívá k léčbě klinických stavů, jako jsou NDO, IDO a dyssynergie sfinkteru detruzoru (obr. 2). Většina studií uvádí aplikaci BTX při léčbě onemocnění jako například roztroušená skleróza, poranění míchy (SCI) a spina bifida (myelomeningokéla – MMC). Většina údajů pochází ze studií zaměřených na populaci pacientů s SCI, stále však nemáme k dispozici dostatek údajů týkajících se dalších případů neuropatického močového měchýře.
Obr. 2. Hyperaktivní neurogenní detruzor o vysokém tlaku s dyssynergií sfinkteru detruzoru a refluxem pravého močovodu. 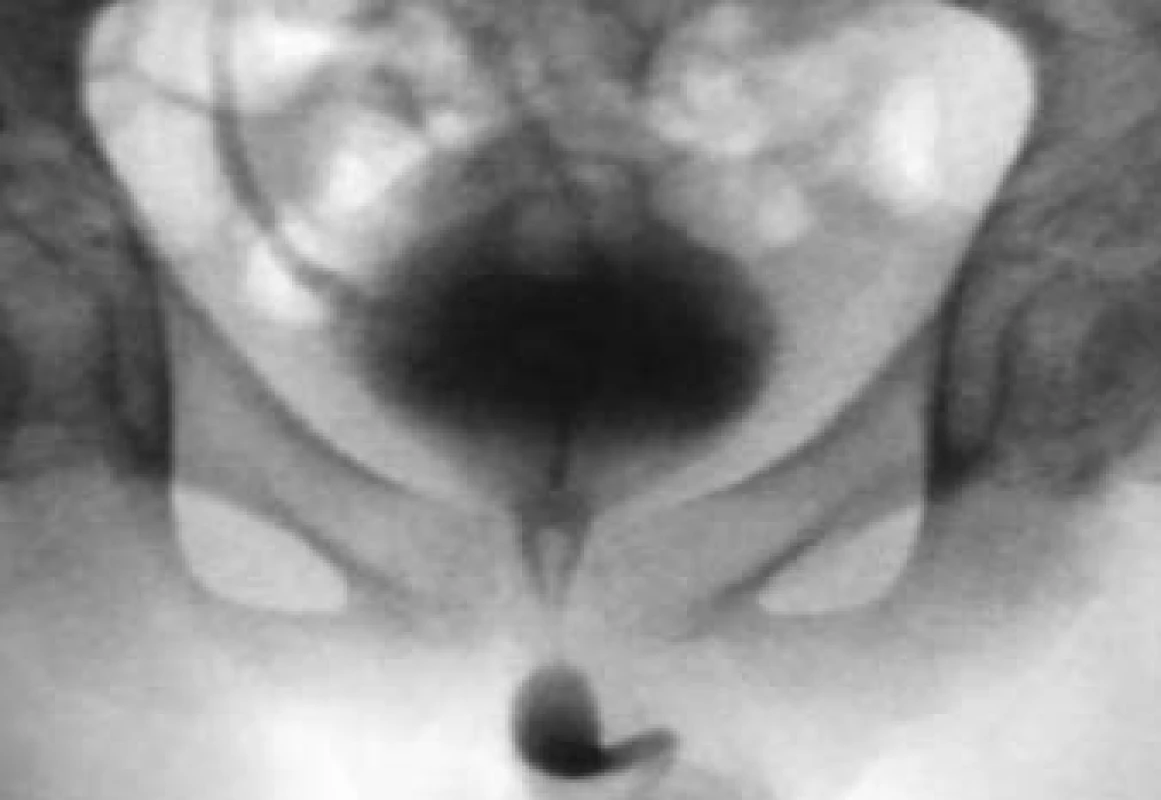
Autoři tohoto článku působící v London Spinal Cord Injury Centre (Stanmore, VB) užívají od roku 2003 k léčbě refrakterního NDO následující typ BTX-A: Dysport® (Ipsen Ltd., Slough, VB). Autoři zvolili Dysport, vzhledem k tomu, že tento preparát se v jejich centru běžně užíval k léčbě svalové spasticity u pacientů se SCI. Navíc byl tento preparát užíván k léčbě dysfunkce močových cest (dyssynergie zevního sfinkteru) s přijatelným bezpečnostním profilem.
BTX-B je poměrně nový preparát. Přestože Dykstra et al užívali BTX-B při léčbě NDO, k dispozici máme pouze velmi omezené údaje týkající se jeho aplikace [22]. Tato prospektivní studie testovala účinnost, toleranci a zlepšení kvality života aplikace BTX-B při léčbě 37 pacientů s NDO. V této studii byl užit stejný dávkovací protokol a parametry zředění toxinu jako v pilotní práci Schurcha et al [6]. Dávkování Dysportu bylo konstantní (1 000 jednotek). Po 6 týdnech léčby autoři studie hodnotili přítomnost symptomů. Po 3 měsících a poté jednou za rok pacienti podstoupili videourodynamické vyšetření a klinickou prohlídku.
Léčba vedla k významnému zvětšení kapacity močového měchýře, a tedy snížení frekvence self-intermitentní katetrizace (SIC). U všech pacientů došlo ke snížení průměrného tlaku močového měchýře během jímací fáze, u 76 % došlo k úplnému vymizení hyperreflexních kontrakcí. Tyto výsledky prokazují, že autoři této studie dosáhli primárního cíle – zajištění adekvátního rezervoáru moči při nízkém tlaku a zabezpečení kontinence. U pacientů s přetrvávající NDO umožnila léčba významné zvýšení objemu při nástupu první hyperreflexní kontrakce. Výsledky této studie ukazují, že tito pacienti nyní mohou být léčeni kombinací různých preparátů o nízké dávce a BTX-A. Tato léčba umožňuje potlačení hyperreflexie, a tedy dosažení adekvátní jímací kapacity při nízkém tlaku, čehož nelze dosáhnout při oddělené aplikaci těchto preparátů. 86 % pacientů snížilo po injikaci BTX-A dávkování, nebo úplně ukončilo aplikaci anticholinergik. Vyléčení inkontinence u 82 % pacientů a snížení dávkování anticholinergik u 86 % pacientů mělo pozitivní dopad na kvalitu života pacientů. Zmírnění symptomů onemocnění spolu s objektivním zlepšením urodynamických parametrů zvýšilo důvěru pacientů v tento druh léčby, což umožnilo lepší komplianci s protokolem SIC. Účinek léčby přetrvá průměrně po dobu 9 měsíců a vyžaduje roční dávkovací režim.
Výsledky této studie jsou srovnatelné s výsledky randomizované kontrolované studie (úroveň důkazu 2b) a kohortové studie (úroveň důkazu 3), které byly publikovány v nejnovější literatuře [6,13, 23,24].
Podobně i v populaci pacientů s IDO došlo ke snížení frekvence, urgence, počtu vložek a zlepšení inkontinence. Vzhledem k nedostatečně konzistentnímu definování a hodnocení inkontinence v různých studiích je rozmezí míry kontinence po léčbě poměrně široké (31–91 %) [10,11, 25-27]. Zlepšení symptomů je přesto u pacientů s IDO i NDO srovnatelné; u obou skupin lze pak pozorovat zlepšení kvality života [10,27].
VEDLEJŠÍ ÚČINKY BTX A RIZIKO PRO PACIENTY?
Obecně lze říci, že BTX-A je pacienty dobře snášen (při jediné i opakované aplikaci) [9]. Přesto je třeba se zabývat teoretickými obavami týkajícími se systémového šíření toxinu, které může vést k paralýze svaloviny a lokální strukturní degeneraci svaloviny močového měchýře.
Haferkamp et al provedli elegantní studii, která rozptýlila všechny obavy týkající se strukturního poškození močového měchýře po aplikaci BTX-A [28]. V této studii nebyly nalezeny žádné důkazy přítomnosti fibrózy, k níž mělo podle některých názorů docházet po opakované aplikaci BTX. Některé skupiny pacientů měly po léčbě BTX-A naopak lepší histologické nálezy než skupiny pacientů s neléčeným neuropatickým močovým měchýřem. Otázka přesnosti volby místa injikace močového měchýře však nadále zůstává předmětem diskuse.
Jiná studie prokázala po aplikaci 1 000 jednotek Dysportu 5,4% incidenci přechodné hypostenie. Autoři této studie pozorovali 2 týdny po léčbě zhoršení této svalové slabosti, která přetrvala po dobu 4–6 týdnů. Je možné, že existuje souvislost mezi dávkováním Dysportu a incidencí svalové slabosti, vzhledem k tomu, že při dávkování 300–750 jednotek Dysportu nebyl zaznamenán žádný výskyt hypostenie, zatímco při aplikaci 750–1 000 jednotek byla tato komplikace zaznamenána [29]. Těmto vedlejším účinkům lze zřejmě předejít aplikací Botoxu® (Allergan Pharmaceuticals, Irvine, CA, USA). Rozdílnost těchto 2 preparátů lze vysvětlit vyšší disperzní rychlostí, rozdílným ředěním a objemem/ injekce Dysportu.
Populace pacientů s IDO má při aplikaci BTX vyšší riziko vzniku akutní močové retence a potenciální nutnosti SIC. Přestože při aplikaci Botoxu nebyl zaznamenán žádný výskyt systémových vedlejších účinků, vznikla u 5 % pacientů akutní močová retence a 16 % z nich vyžadovalo SIC [29]. Autoři doporučují naučit SIC všechny pacienty, kteří jsou schopni před aplikací BTX normálně močit.
OBLASTI DALŠÍHO VÝZKUMU
Výše uvedené studie jasně prokazují, že BTX-A představuje účinnou možnost léčby NDO a IDO. Kombinace této léčby s použitím katétru (např. SIC nebo suprapubická katetrizace) umožňuje předejít inkontinenci u více než 80 % pacientů. Toto zlepšení (které přetrvá po dobu 9–12 měsíců) lze prokázat pomocí urodynamických parametrů. Po opakované injikaci (maximální počet je 9) zůstávají klinické parametry konstantní [30]. Léčbu lze bezpečně aplikovat jak u dospělých, tak i u dětí, s minimálním výskytem vedlejších účinků (např. přechodná hypostenie vyskytující se u 5,4-8 % pacientů).
Je praktické při limitovaném operačním čase provádět každý rok aplikaci BTX-A, pakliže bude počet aplikací pravděpodobně narůstat?
Zatím nemáme k dispozici žádné údaje o ceně podobného postupu. Dále je třeba stanovit optimální počet injikací BTX-A a poměr zředění a objem roztoku na jednu injekci. Vzhledem k odlišnému dávkování a variabilitě pacientů uvádějí některé studie účinek přetrvávající pouze po dobu 1 měsíce [7,29].
S rozšiřujícím se užíváním flexibilní cystoskopie [26] může být injekce BTX-A aplikována i ambulantně odborně vyškolenou sestrou. Cena injekce BTX-A pomocí flexibilní cystoskopie se pohybuje kolem 1 676 amerických dolarů na jednoho pacienta [31]. Prozatím nemáme k dispozici srovnání dlouhodobé léčby BTX-A a jednorázové ileocystoplastiky.
Cenu a rizika související s aplikací BTX-A lze snížit instilací toxinu do močového měchýře (namísto injekce). Počáteční údaje týkající se selektivního účinku instilace BTX-A na senzorické nervy šetřící kontrakce řízené motorickými nervy jsou povzbudivé [32,33]. Tato technika by umožnila vyléčení hyperreflexie, která je způsobena narušením senzorické větve reflexního oblouku a užíváním neurostimulace k dosažení účinného kontrahování močového měchýře a jeho vyprázdnění. Další výzkum těchto aspektů aplikace BTX-A bezesporu umožní léčbu pacientů s refrakterním NDO a IDO.
ZÁVĚR
Léčba pomocí BTX-A postupem času dozrává a indikace se upřesňují.
Pro další výzkum je nezbytná velká, dlouhodobá, randomizovaná, kontrolovaná studie testující různé režimy dávkování a ředění toxinu, která by zahrnovala standardizovaná kritéria. Výsledky takové studie by přispěly k lepšímu určení indikací, vedlejších účinků a nejlepšího protokolu pro léčbu OAB, které by umožnily vytvoření guidelines podepřených důkazy.
Dnes je aplikace BTX-A licencována v rámci studijního protokolu v některých centrech ve Velké Británii. Doposud nebyla schválena Společností pro kontrolu potravin a léčiv ani v USA a není zde hrazena zdravotními pojišťovnami. Na základě publikovaných studií a předběžných výsledků právě probíhající prospektivní multicentrické randomizované studie se tato terapeutická modalita schválení zřejmě dočká. Do té doby představuje aplikace BTX-A střední cestu mezi farmakoterapií a invazivní operací při léčbě OAB refrakterního na medikaci.
Prasad Patki, MD1
Sharon Wood, MD1
Julian Shah, MD1,2
1London Spinal Cord Injury Centre,
Royal National Orthopaedic Hospital,
Stanmore
2Institute of Urology and Nephrology,
Londýn, VB
Zdroje
1. Szollar SM, Lee SM. Intravesical oxybutynin for spinal cord injury patients. Spinal Cord 1996;34 : 284–7.
2. Lazzeri M, Spinelli M, Zanollo A et al. Intravesical vanilloids and neurogenic incontinence: ten years experience. Urol Int 2004;72 : 145–9.
3. Guys JM, Haddad M, Planche D et al. Sacral neuromodulation for neurogenic bladder dysfunction in children. J Urol 2004;172(4 Pt 2):1673–6.
4. Van Kerrebroeck PE, Van Voskuilen AC, Lycklama A et al. Long term results of InterStim therapy for voiding disorders demonstrate sustained efficacy and acceptable safety profile. Eur Urol 2004;3 : 170.
5. Radziszewski P, Dobronski P, Borkowski A. Treatment of nonneurogenic storage and voiding disorders with the chemical deneravtion caused by botulinum toxin A – a pilot study. Neurourol Urodyn 2001;20 : 410–2.
6. Schurch B, Stohrer M, Kramer G et al. Botulinum-A toxin for treating detrusor hyperreflexia in spinal cord injured patients: a new alternative to anticholinergic drugs? Preliminary results. J Urol 2000;164(3 Pt 1): 692–7.
7. Patki PS, Hamid R, Arumugam K et al. Botulinum toxin-type A in the treatment of drug-resistant neurogenic detrusor overactivity secondary to traumatic spinal cord injury. BJU Int 2006;98 : 77–82.
8. Del Popolo G, Li Marzi V, Panariello G et al. English botulinum toxin A in the treatment of neurogenic detrusor overactivity. Neurourol Urodyn 2003;22 : 498.
9. Grosse J, Kramer G, Stohrer M. Success of repeat detrusor injections of botulinum a toxin in patients with severe neurogenic detrusor overactivity and incontinence. Eur Urol 2005;47 : 653–9.
10. Kessler TM, Danuser H, Schumacher M et al. Botulinum A toxin injections into the detrusor: An effective treatment in idiopathic and neurogenic detrusor overactivity? Neurourol Urodyn 2005;24 : 231–6.
11. Kuo HC. Urodynamic evidence of effectiveness of botulinum A toxin injection in treatment of detrusor overactivity refractory to anticholinergic agents. Urology 2004;63 : 868–72.
12. Reitz A, Stohrer M, Kramer G et al. European experience of 200 cases treated with botulinum-A toxin injections into the detrusor muscle for urinary incontinence due to neurogenic detrusor overactivity. Eur Urol 2004;45 : 510–5.
13. Schurch B, de Sčze M, Denys P et al. Botulinum toxin a (botox) in neurogenic urinary incontinence: results from a multi-centre randomised controlled trial. Neurourol Urodyn 2004;23 : 609–10.
14. Schurch B, de Sčze M, Denys P et al. Botulinum toxin type A is a safe and effective treatment for neurogenic urinary incontinence: results of a single treatment, randomized, placebo controlled 6-month study. J Urol 2005;174 : 196–200.
15. Schulte-Baukloh H, Knispel HH, Stolze T et al. Repeated botulinum-A toxin injections in treatment of children with neurogenic detrusor overactivity. Urology 2005;66 : 865–70.
16. Gill DM. Bacterial toxins: a table of lethal amounts. Microbiol Rev 1982;46 : 86–94.
17. Simpson LL. Molecular pharmacology of botulinum toxin and tetanus toxin. Annu Rev Pharmacol Toxicol 1986;26 : 427–53.
18. Reitz A, Schurch B. Botulinum toxin type B injection for management of type A resistant neurogenic detrusor overactivity. J Urol 2004;171(2 Pt 1):804–5.
19. Meunier FA, Schiavo G, Molgo J. Botulinum neurotoxins: from paralysis to recovery of functional neuromuscular transmission. J Physiol Paris 2002;96 : 105–13.
20. Apostolidis A, Popat R, Yiangou Y et al. Decreased sensory receptors P2X3 and TRPV1 in suburothelial nerve fibers following intradetrusor injections of botulinum toxin for human detrusor overactivity. J Urol 2005;174 : 977–82.
21. Sheean G. Botulinum toxin for the treatment of musculoskeletal pain and spasm. Curr Pain Headache Rep 2002;6 : 460–9.
22. Dykstra DD, Pryor J, Goldish G. Use of botulinum toxin type B for the treatment of detrusor hyperreflexia in a patient with multiple sclerosis: a case report. Arch Phys Med Rehabil 2003;84 : 1399–400.
23. Bagi P, Biering-Sorensen F. Botulinum toxin A for treatment of neurogenic detrusor overactivity and incontinence in patients with spinal cord lesions. Scand J Urol Nephrol 2004;38 : 495–8.
24. Hajebrahimi S, Altaweel W, Cadoret J et al. Efficacy of botulinum-A toxin in adults with neurogenic overactive bladder: initial results. Can J Urol 2005; 12 : 2543–6.
25. Ghei M, Maraj BH, Miller R et al. Effects of botulinum toxin B on refractory detrusor overactivity: a randomized, double-blind, placebo controlled, crossover trial. J Urol 2005;174 : 1873–7.
26. Harper M, Popat RB, Dasgupta R et al. A minimally invasive technique for outpatient local anaesthetic administration of intradetrusor botulinum toxin in intractable detrusor overactivity. BJU Int 2003;92 : 325–6.
27. Popat R, Apostolidis A, Kalsi V et al. A comparison between the response of patients with idiopathic detrusor overactivity and neurogenic detrusor overactivity to the first intradetrusor injection of botulinum-A toxin. J Urol 2005;174 : 984–9.
28. Haferkamp A, Schurch B, Reitz A et al. Lack of ultrastructural detrusor changes following endoscopic injection of botulinum toxin type A in overactive neurogenic bladder. Eur Urol 2004;46 : 784–91.
29. Dmochowski R, Sand PK. Botulinum toxin A in the overactive bladder: current status and future directions. BJU Int 2007;99 : 247–62.
30. Karsenty G, Reitz A, Lindemann G et al. Persistence of therapeutic effect after repeated injections of botulinum toxin type A to treat incontinence due to neurogenic detrusor overactivity. Urology 2006;68 : 1193–7.
31. Kalsi V, Popat RB, Apostolidis A et al. Cost-consequence analysis evaluating the use of botulinum neurotoxin - A in patients with detrusor overactivity based on clinical outcomes observed at a single UK centre. Eur Urol 2006;49 : 519–27.
32. Khera M, Somogyi GT, Salas NA et al. In vivo effects of botulinum toxin A on visceral sensory function in chronic spinal cord-injured rats. Urology 2005;66 : 208–12.
33. Vemulakonda VM, Somogyi GT, Kiss S et al. Inhibitory effect of intravesically applied botulinum toxin A in chronic bladder inflammation. J Urol 2005; 173 : 621–4.
34. Ranoux D, Gury C, Fondarai J et al. Respective potencies of Botox and Dysport: a double blind, randomised, crossover study in cervical dystonia. J Neurol Neurosurg Psychiatry 2002;72 : 459–62.
35. Whurr R, Nye C, Lorch M. Meta-analysis of botulinum toxin treatment of spasmodic dysphonia: a review of 22 studies. Int J Lang Commun Disord 1998;33 Suppl:327–9.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2008 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Kvíz
- Nykturie: diagnóza, klasifikace a léčba
- Validace symptom skóre pro vyšetřování hyperaktivního močového měchýře (Overactive Bladder Symptoms Score – OABSS)
- Injekce toxinu botulinu při léčbě hyperaktivního močového měchýře refrakterního na medikamentózní léčbu
- Analýza medikamentóznej liečby stresovej inkontinencie moču u žien
- Možnosti chirurgické léčby hyperaktivního močového měchýře (OAB)
- Slovo úvodem
-
Kolposuspenze dle Burche – zlatý standard v operacích ženské močové inkontinence
Současná urogynekologická operativa I - Periuretrální implantáty u stresové inkontinence (injectables)
- Patofyziologie močového měchýře o velké kapacitě
- Praktické poznámky k implantaci umělého svěrače močové trubice
- Sfinktery implantované skrotálním přístupem
- Operace umožňující zachování dělohy: nová výzva pro korekci prolapsu pánevních orgánů
- Prolaps pánevních orgánů ženy z pohledu urologa
- Urologické konsekvence gynekologických operací
- Ze zahraničních periodik
- Aktivity Inco Fora České společnosti podpory zdraví
- Guidelines EAU pro léčbu močové inkontinence
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prolaps pánevních orgánů ženy z pohledu urologa
-
Kolposuspenze dle Burche – zlatý standard v operacích ženské močové inkontinence
Současná urogynekologická operativa I - Patofyziologie močového měchýře o velké kapacitě
- Urologické konsekvence gynekologických operací
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



