-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
Still´s disease – a rare autoinflammatory illness of adults: case report and overview of therapeutic options
Still's disease (Adult-onset Still's disease, AODS) is a very rare systemic inflammatory disease accompanied by a triad of spiking fever, maculopapular exanthema and arthralgia. To date, there is no specific laboratory or imaging test available for AODS. We report the case of a 65-year-old male who suffered from fever and arthralgia. Initial laboratory tests showed elevated CRP, leukocytosis and anaemia. Metabolically active abdominal lymphadenopathy was present. We excluded many potential differential diagnoses and the diagnosis of lymphoma was not confirmed. After an extensive workup, the patient was diagnosed with AOSD based on the Yamaguchi criteria. The first line therapy was prednisone at a dose of 1mg/kg, after which all AODS symptoms disappeared including fever. After tapering the prednisone dose, the AOSD relapsed. The patient then received anakinra, 100 mg daily as second line treatment and achieved a good response, but it was necessary to continue this treatment. Our patient has now been treated with anakinra from 2016-to date and remains asymptomatic. In this article, we describe our AOSD case and provide a brief overview of typical AOSD clinical symptoms and treatment options.
Keywords:
adult-onset Still's disease (AOSD) – anakinra
Autoři: Z. Král 1; M. Krejčí 1; Z. Řehák 2; R. Koukalová 2; L. Pour 1; M. Krtička 3; Z. Adam 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Oddělení nukleární medicíny, MOU Brno 2; Klinika úrazové chirurgie LF MU a FN Brno 3
Vyšlo v časopise: Transfuze Hematol. dnes,26, 2020, No. 4, p. 320-326.
Kategorie: Kazuistiky
Souhrn
Stillova nemoc dospělých je vzácná zánětlivá choroba provázená vysokými febriliemi, makulopapulárním exantémem a artralgiemi. Stillova nemoc nemá žádný typický diagnostický znak, její diagnóza se odvozuje od vyloučení celé řady jiných chorob. Popisujeme případ pacienta ve věku 65 let, u kterého několik měsíců přetrvávaly noční febrilie a artralgie, byla provedena řada vyšetření k objasnění příčiny obtíží. Vstupní vyšetření prokázalo vysoké hodnoty parametrů zánětu (C-reaktivní protein, leukocytóza), dále anémii a metabolicky aktivní lymfadenopatii dominantně v uzlinách kolem kardie. Po široké diferenciální diagnostice včetně vyloučení lymfoproliferativního onemocnění byl stav uzavřen jako Stillova choroba dospělých na základě Yamaguchiho kritérií. Terapie prednisonem v dávce 1 mg/kg/den vedla k ústupu příznaků, ale po snížení dávky prednisonu se opět objevily febrilie přesahující 39 °C i artralgie. Proto byla v rámci léčby druhé linie zahájena v roce 2016 terapie anakinrou v dávce 100 mg 1× denně, poté došlo ke stabilizaci stavu a ústupu obtíží. V aplikaci anakinry je však zapotřebí dlouhodobě pokračovat, jinak dochází k recidivě nemoci. V roce 2020 je pacient bez klinických obtíží, bez teplot, je stále léčen anakinrou 100 mg denně. Článek zahrnuje kromě popisu případu Stillovy nemoci také její klinické symptomy a terapii.
Klíčová slova:
Stillova nemoc dospělých – anakinra
Úvod
Stillova nemoc je vzácně se vyskytující choroba, která se projevuje teplotami přesahujícími 39 °C, artralgiemi a také kožními změnami spolu s laboratorním obrazem intenzivní zánětlivé reakce. Stanovení diagnózy Stillovy nemoci (SN) je obtížné, protože tato choroba nemá žádný typický morfologický či laboratorní znak. Diagnózu SN stanovíme při uvedených příznacích vyloučením jiných možných příčin – tedy obvykle v rámci diferenciální diagnostiky teplot nejasné etiologie. Febrilie či subfebrilie nejasného původu (fever of uknown origin, FUO) mají svoji definici, která obsahuje časové kritérium – trvání febrilií či subfebrilií déle než tři týdny, dále přítomnost laboratorních známek zánětu a absenci průkazu jiné vyvolávající příčiny při běžných vyšetřeních. Pro značný počet možných příčin FUO je nutno se řídit vhodnými doporučeními pro diferenciální diagnostiku těchto stavů [1–4].
V první řadě je nutno vyloučit infekční příčinu, dále pak nádorové onemocnění. Některé hematologické malignity na sebe často upozorní právě nespecifickými systémovými příznaky ve formě subfebrilií či febrilií. Ze solidních tumorů to bývá nejčastěji Grawitzův karcinom ledviny. Dalšími možnými příčinami horečky nejasného původu jsou autoimunitní choroby a také velmi raritní autoinflamatorní choroby. Autoinflamatorní choroby jsou podstatně častěji diagnostikovány v dětském věku a jen zcela ojediněle u dospělých. Z velmi širokého spektra autoinflamatorních chorob se lze v dospělém věku setkat se syndromem Schnitzlerové a též se Stillovou nemocí dospělých (adult onset Still disease, AOSD).
Vlastní popis případu
Muž, narozený v roce 1950, byl až do roku 2015 (tedy do svých 65 let) zcela zdráv, nebylo mu zjištěno žádné onemocnění a neužíval pravidelně žádnou medikaci. V lednu 2015 měl bolesti levého kolenního kloubu, proto byl vyšetřen na Klinice úrazové chirurgie ve Fakultní nemocnici Brno, zobrazovací vyšetření magnetickou rezonancí (MR) prokázalo degenerativní onemocnění vnitřního menisku levého kolenního kloubu a následně byla artroskopicky ošetřena trhlina mediálního menisku. Po šesti týdnech od nekomplikované operace se objevil otok obou kolenních kloubů, kterému nepředcházela žádná zvýšená zátěž ani úraz. Byly opakovaně prováděny evakuace výpotku z obou kolenních kloubů a podávána nesteroidní antiflogistika. Zánět kolenních kloubů ustoupil asi po 2 měsících léčby. Následně se pacient až do září roku 2015 cítil opět zcela zdráv. V září 2015 začaly zdravotní obtíže, objevily se recidivující febrilie. Teplota začínala vždy večer, kulminovala v noci, kdy obvykle přesahovala 39 °C, poté přišlo masivní pocení a další den dopoledne teplota klesla pod 37 °C. Noční febrilie obvykle přesahovaly 39 °C, byla snížená chuť k jídlu, nemocný se cítil unavený a nevýkonný, postupně se objevil i suchý kašel. Zpětně pacient na cílený dotaz připustil, že v průběhu roku 2015 pozoroval opakovaně vždy několik dní kožní vyrážku, která samovolně ustoupila.
V říjnu roku 2015 byl nemocný přijat na Kliniku nemocí plicních a tuberkulózy FN Brno pro febrilie nad 39 °C, patologickou únavu a kašel. Veškerá vyšetření cílená na průkaz mikrobiálního původce (virologická, bakteriologická, vyšetření na oportunní mykózy i vyšetření na tuberkulózu) byla negativní.
V rámci celkového přešetření tohoto nejasného stavu bylo provedeno i zobrazovací vyšetření kombinací počítačové tomografie a pozitronové emisní tomografie s radioaktivně značenou fluorodeoxyglukózou (FDG-PET/CT vyšetření). Při prvním PET/CT vyšetření byla patrná lymfadenopatie se zvýšenou akumulací fluorodeoxyglukózy (FDG) v uzlinách kolem kardie a u levého bráničního vazu. Akumulace FDG v patologicky zvětšených lymfatických uzlinách byla zvýšená, hodnota SUVmax (standartized uptake value, SUV) byla 6,1. V retroperitoneu byl nález mnohem diskrétnější. Mírně vyšší aktivita FDG byla také ve slezině, v kostní dřeni, v páteři, v pánvi a v proximálních částech dlouhých kostí. Vzniklo tak podezření na maligní krevní onemocnění a bylo přistoupeno k odběru kostní dřeně a lymfatických uzlin pro histopatologické vyšetření, byly však popsány jen nespecifické zánětlivé změny. Stejně tak vyšetření vzorků kostní dřeně odebraných při trepanobiopsii na histologii, cytologii a průtokovou cytometrii odpovídalo zánětlivé reakci organismu. Žádné maligní onemocnění nebylo prokázáno ani v odebraných lymfatických uzlinách, ani v kostní dřeni. Nebylo prokázáno také žádné autoimunitní onemocnění.
Febrilie a noční pocení přitom trvaly od září 2015 kontinuálně v průběhu všech vyšetření až do prosince 2015. Hodnota C-reaktivního proteinu (CRP) v této době byla středně zvýšená, pohybovala se mezi 50–70 mg/l, hodnota feritinu byla 293 ug/l, počet leukocytů byl na horní hranici normy a počet neutrofilů byl nepatrně vyšší (71 %). Po vyloučení neoplastické, autoimunitní a infekční příčiny jsme symptomy a zvýšené laboratorní markery zánětu interpretovali jako horečky při autoinflamatorním onemocnění typu Stillovy nemoci. K této diagnóze jsme dospěli vyloučením (per exclusionem) jiných možných příčin.
Léčbu Stillovy nemoci jsme zahájili v prosinci roku 2015 prednisonem. Tato léčba byla účinná jen při podávání vysoké dávky prednisonu 1 mg/kg/den, tedy 80 mg denně. Při snižování dávky prednisonu se začaly vracet příznaky SN. Při terapii prednisonem došlo k rozvoji steroidního diabetu, který vyžadoval aplikaci inzulinu. Nicméně prednison ve vysoké dávce byl schopný odstranit horečky. Při pokusech o rychlejší snižování dávky se příznaky rychle vracely, a tak bylo možné jen pozvolné snižování prednisonu. V březnu roku 2016, po 3 měsících kortikoterapie, pacient stále užíval relativně vysokou dávku prednisonu, 40 mg denně. Při postupném snižování prednisonu na 20 mg/den se v září roku 2016 febrilie vrátily a začaly dosahovat až 39 °C. Oproti situaci v roce 2015 se v období 9–11/2016 zvýraznily laboratorní zánětlivé markery, hodnoty CRP se pohybovaly při opakovaných vyšetřeních přes 100 mg/l, byla výrazná leukocytóza 18 × 109/l, přičemž 81 % leukocytů tvořily neutrofily. A hodnoty hemoglobinu i albuminu při této zánětlivé reakci výrazně klesaly. Imunoglobuliny (Ig) reagovaly jen nepatrným vzestupem koncentrace Ig typu IgG. Uvedené laboratorní hodnoty, tedy neutrofilní leukocytóza a vysoká hodnota CRP, již dosahovaly hodnot uváděných v diagnostických kritériích Stillovy nemoci. Laboratorní hodnoty našeho pacienta uvádí tabulka 1. Z popisovaných klinických symptomů SN byla u našeho pacienta přítomna oboustranná artritida kolenních kloubů v počátku nemoci. V počátku nemoci byly rovněž přítomny kožní změny. V září 2016 již léčba prednisonem ve vyšší dávce byla obtížně tolerována, došlo k dekompenzaci diabetu s občasnými hodnotami glykemií nad 20 mmol/l.
Tab. 1. Vybrané laboratorní hodnoty u našeho pacienta při terapii kortikoidy a při terapii anakinrou: časové období 2015–2019 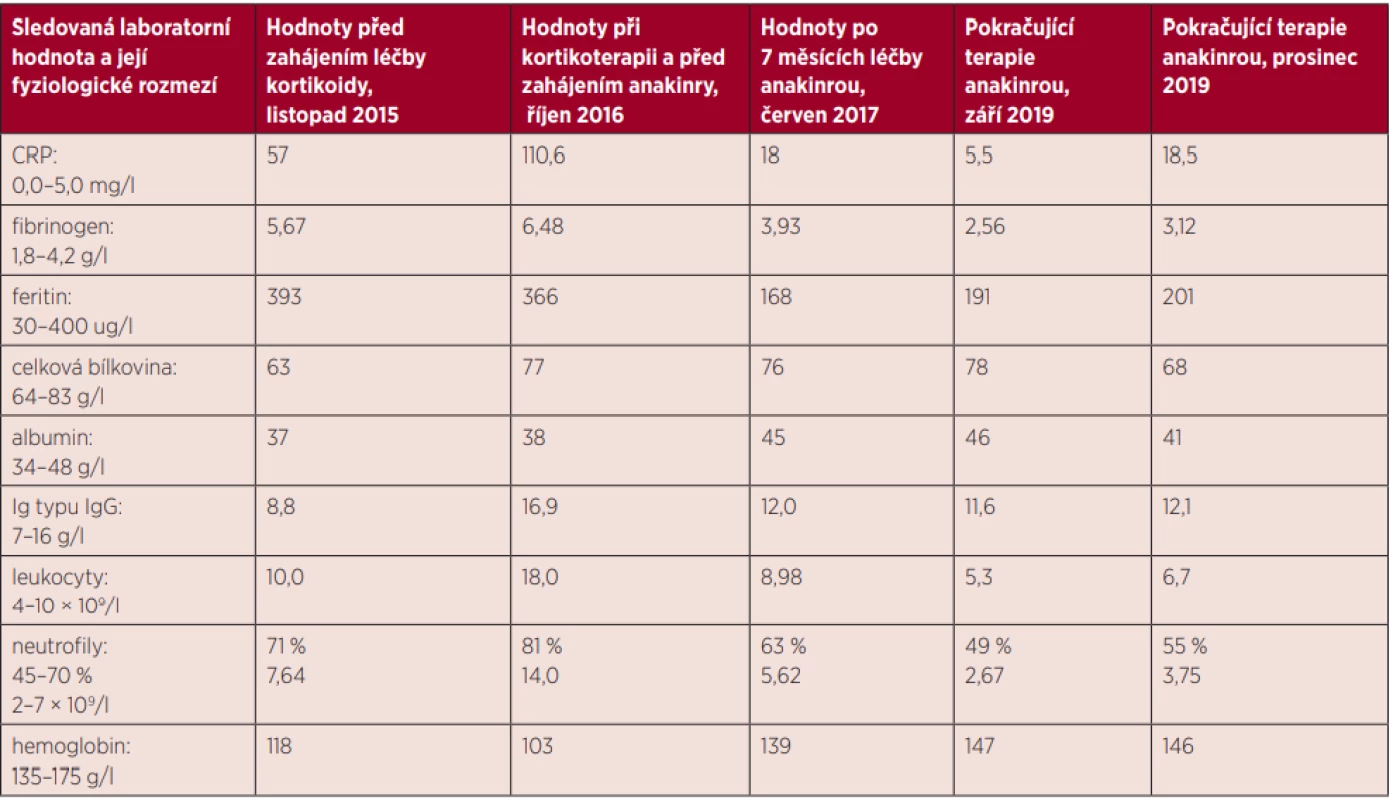
Stillova nemoc se dříve léčila metotrexátem, literatura však uvádí, že metotrexát mírní kloubní symptomy, ale málo ovlivňuje celkovou zánětlivou reakci a jeho účinek nastupuje pomalu. Proto jsme zvolili léčbu anakinrou – přípravkem Kineret v dávce 1 ampulka (100 mg) podkožně 1× denně. Tato terapie zásadním způsobem zlepšila situaci, umožnila postupnou redukci prednisonu na 5 mg a posléze nepravidelné užívání prednisonu v dávce 2,5 mg podle symptomů. Pacient začal mít při léčbě anakinrou pocit plného zdraví, kompenzace diabetu se významně zlepšila. A celkovému klinickému zlepšení odpovídaly i laboratorní parametry. Hodnota CRP se snížila (18 mg/l), snížily se hodnoty feritinu, fibrinogenu a zvýšily se hodnoty albuminu a hemoglobinu, podrobnosti uvádí tabulka 1. Nicméně hodnota CRP není pořád v normě, což signalizuje, že naše léčba – anakinra a malá dávka prednisonu – výrazně snížila aktivitu nemoci, ale neodstranila ji docela. Proto tuto terapii není možné zatím přerušit a pacient v léčbě anakinrou dlouhodobě pokračuje.
Diskuse
Typickými příznaky Stillovy nemoci dospělých jsou febrilie nad 39 °C, bolesti kloubů a kožní vyrážka prchavého charakteru. Nicméně to jsou nespecifické symptomy, kterými se mohou projevit jak infekční nemoci, tak maligní či autoimunitní nemoci. Stillova nemoc dospělých je velmi vzácné onemocnění, které nemá žádný specifický sérologický, laboratorní, histopatologický nebo molekulárně biologický znak. Diagnózu této nemoci lze stanovit pouze metodou per exclusionem neboli vyloučením jiných příčin. A proto byla vytvořena kritéria nemoci, která obsahují některé klinické a některé laboratorní znaky. Kritérií Stillovy nemoci dospělých je v literatuře možno najít více, ale nejuznávanější jsou kritéria Yamaguchiho nebo Fautrelova, které uvádí tabulka 2 [5, 6].
Tab. 2. Dvě nejčastěji používaná kritéria Stillovy nemoci [5, 6] ![Dvě nejčastěji používaná kritéria Stillovy nemoci [5, 6]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3b34fbdd97915cdfcf36d6e2d1c1447d.png)
Stillova nemoc dospělých – vzácná autoinflamatorní choroba s klíčovou úlohou interleukinu-1
Stillova nemoc je vzácná autoinflamatorní choroba nejasné etiologie. První popis zveřejnil Bywaters v roce 1971 jako zvláštní klinickou jednotku, velmi podobnou systémové juvenilní idiopatické artritidě [7]. Stillova nemoc má dva vrcholy věkové distribuce, první je ve věku 15–25 let, druhý ve věku 36–46 let, ale může se manifestovat i u starších osob. Etiopatogeneze této nemoci zůstává stále neznámá. Poslední roky je však řazena mezi autoinflamatorní choroby dospělých, podobně jako syndrom Schnitzlerové. Důležitou roli v etiopatogenezi nemoci má zvýšená tvorba četných cytokinů. Sérové hladiny tumor-nekrotizujícího faktoru (tumor necrosis factor,TNF), dále některých interleukinů (IL-1, IL-6, IL8, IL-18), interferonu gama (IFNγ) a solubilního receptoru interleukinu-2 (sIL-2R) jsou zvýšené. Klíčovou úlohu má interleukin 1β (IL-1β), který způsobuje proliferaci neutrofilů. Výše hladiny IL-1β koreluje s aktivitou a se závažností nemoci. Dalším důležitým cytokinem je IL-18, jehož hladina je obzvláště vysoká u pacientů s poškozením jater [8, 9]. Stillova nemoc je natolik vzácná choroba, že klinické studie jsou obtížně proveditelné a většina publikovaných informací má formu popisů případů či menších souborů pacientů.
Klinické příznaky Stillovy nemoci dospělých
Klasickými klinickými příznaky SN jsou horečka a artralgie, které doplňuje kožní raš a faryngitida. Horečka dosahuje ve svém vrcholu ≥ 39 °C, kulminuje obvykle večer či v noci a stav se vrací k normální teplotě následující ráno. Horečka může být provázena dalšími příznaky, ale také se může být jediným příznakem [1, 8, 9].
Dalším charakteristickým rysem pro SN je kožní raš. Je obvykle přechodný, nesvědící, makulopapulární či makulární. Kožní změny jsou nejvíce zřetelné v průběhu febrilních epizod. Exantém nejvíce postihuje trup a proximální části končetin. Kožní biopsie a histologické hodnocení obvykle prokáží nespecifický perivaskulární infiltrát. Imunofluorescenční hodnocení kožní biopsie může prokázat depozita C3 složky komplementu. Podrobně o kožních projevech autoinflamatorních chorob referují Cetkovská et al. [10]. Náš pacient měl zpočátku kožní exantém na trupu.
Intenzivní artralgie jsou běžně popisovány u všech pacientů se SN. Nejčastěji bývají postiženy klouby kolenní, loketní, dále i oblast zápěstí a kotníků. Náš pacient měl oboustranný zánět kolenních kloubů s výpotkem, trvající 2 měsíce ještě před začátkem febrilních epizod. A později, v průběhu febrilních stavů, se objevovaly stěhovavé bolesti loketních, ramenních a talokrurálních kloubů, které po vymizení teplot ustupovaly.
Myalgie bývá obvykle generalizovaná, provází febrilní epizody. Náš pacient měl bolesti svalů méně výrazné, spíše si stěžoval na celkovou slabost při vysokých teplotách.
Lymfadenopatie se rozvíjí u 44–90 % pacientů se SN dospělých a obvykle vzbuzuje podezření na lymfomy [11]. Pro její detekci je nejvhodnější detailní zobrazovací vyšetření FDG-PET/CT, které ukazuje nejen velikost a tvar lymfatických uzlin, ale i zvýšenou akumulaci FDG. Obrázek 1 ilustruje vývoj změn v období 11/2015–12/2016 při PET/CT vyšetření u našeho pacienta. V době aktivity nemoci lze pomocí FDG-PET/CT zobrazit vysokou akumulaci FDG v kostní dřeni a také ve zvětšených lymfatických uzlinách. Podobný obraz lze samozřejmě vidět u maligních onemocnění krvetvorné tkáně, pokud je toto onemocnění histologicky vyloučeno, lze FDG-PET/CT použít ke sledování aktivity SN [12]. Hepatosplenomegalie je častou manifestací SN. U našeho pacienta byla jen mírně zvětšená slezina se zvýšeným vychytáváním FDG.
Obr. 1. Vývoj Stillovy nemoci v období 11/2015–12/2016 v PET/CT zobrazení u našeho pacienta
11/2015: metabolicky aktivní lymfadenopatie při kardii a u levého bráničního crus (SUVmax 6,1), lehce pozitivní nález v retroperitoneu a v kostní dřeni
3/2016: rozvinutý nález, lymfadenopatie za pravou klíční kostí, v mediastinu SUVmax 10,1; v retroperitoneu SUVmax 10,1; kostní dřeň lehce pozitivní
7/2016: negativní PET/CT obraz, velikostně regrese uzlin, akumulace jen hraniční, remise nemoci
12/2016: progrese nemoci hlavně v mediastinu a nově ložisko v sedací kosti vlevo (před léčbou anakinrou)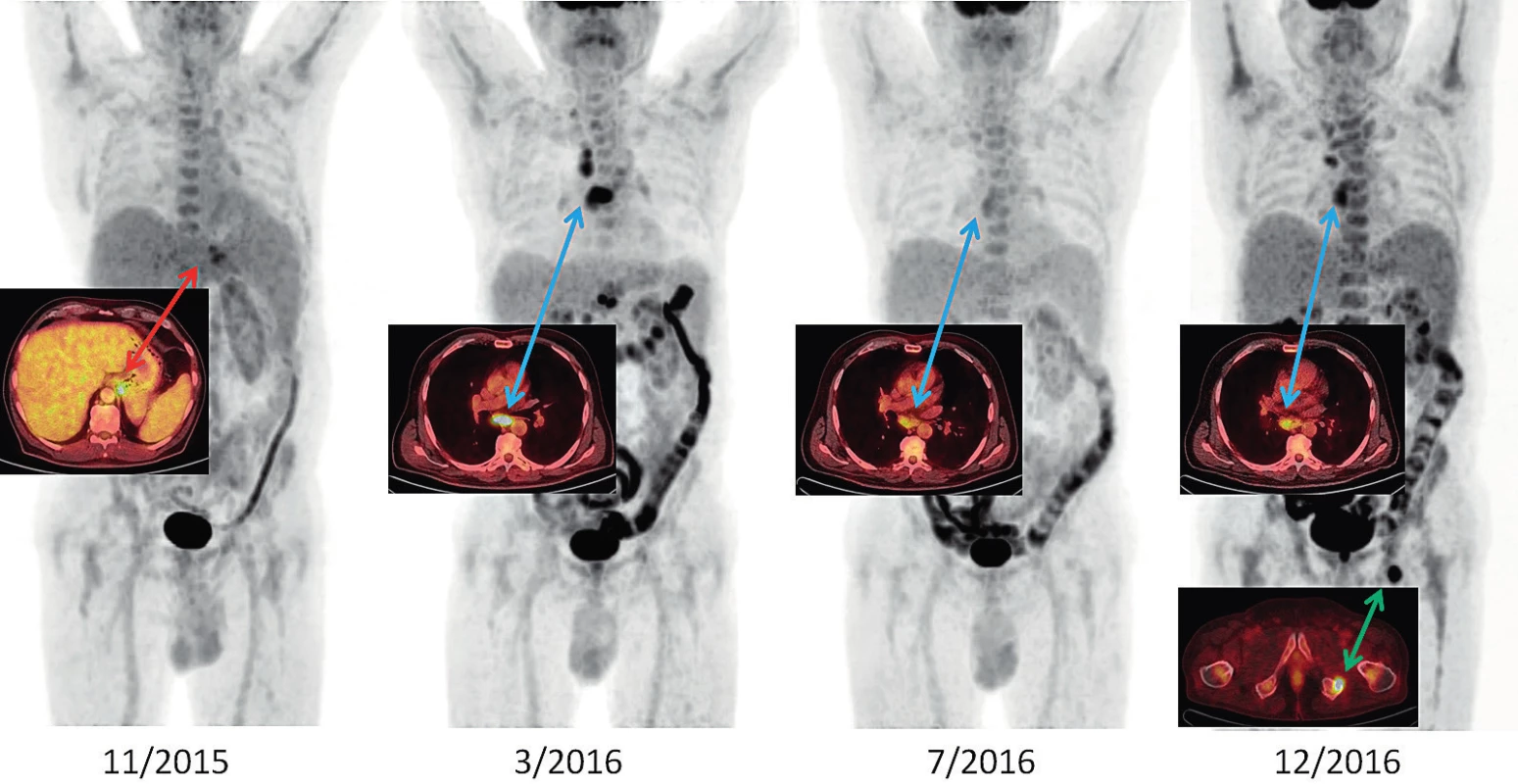
Laboratorní nálezy u Stillovy nemoci dospělých
Laboratorní nálezy jsou nespecifické a obvykle odpovídají závažné zánětlivé reakci. Typická je zvýšená sedimentace erytrocytů a leukocytóza, která obvykle dosahuje hodnot 15–30 × 109/l s dominujícím zvýšením počtu neutrofilů. Dále bývá přítomna trombocytemie > 400 × 109/l. U našeho pacienta jsme opakovaně prokázali významnou leukocytózu a v diferenciálním rozpočtu dominovaly neutrofily [1, 8, 9].
Nemoc může provázet snížení koncentrace albuminu (< 35 g/l), anémie chronických chorob a zvýšené hodnoty transamináz. Anémii chronických chorob a snížený albumin měl i náš nemocný a po léčbě anakinrou se tyto hodnoty upravily.
Revmatoidní faktor a antinukleární protilátky jsou obvykle negativní. Synoviální a serózní výpotky jsou zánětlivé s predominancí neutrofilů. Nemoc nemá žádné typické radiografické znaky. Vzhledem k tomu, že všechny uvedené klinické projevy i laboratorní odchylky mohou provázet i jiné nemoci, stanovuje se diagnóza Stillovy nemoci per exclusionem.
Diferenciální diagnostika SN dospělých
Než se dojde k závěru, že se jedná o SN dospělých, je třeba vyloučit řadu jiných onemocnění:
- virové infekce (rubeola, EBV, cytomegaloviróza, HIV, hepatitidy typu B a C, coxsackie, parvoviróza);
- bakteriální infekce (infekční endokarditida, borelióza a tuberkulóza);
- granulomatózní choroby (sarkoidóza, Crohnova nemoc, idiopatická granulomatóza);
- maligní choroby (lymfomy a leukemie);
- systémové nemoci pojiva (systémový lupus erythemathodes, smíšená nemoc pojiva,polyarteriitis nodosa, Wegenerova granulomatóza a arteritida), případně jiné vzácné autoinflamatorní choroby [1–4].
Průběh nemoci
Průběh SN dospělých je variabilní, literatura popisuje tři možné varianty průběhu:
- monocyklický průběh: jedna epizoda variabilního trvání s následnou kompletní remisí;
- polycyklický či intermitentní průběh: dvě či více epizod aktivity nemoci od sebe oddělují intervaly v délce nejméně dvou měsíců;
- chronický (kloubní) průběh: závažné celkové projevy a navíc i postupná destrukce kloubů.
Léčba
Kortikosteroidy zůstávají stále lékem první linie léčby, nezávisle na formě klinické prezentace. Kortikosteroidy zmírní či zcela odstraní příznaky asi u 60 % léčených [13–16].
Dále se v terapii SN dospělých používají imunosupresiva a některá cytostatika, tzv. disease modifying antirheumatic drugs (DMARDs), jako je metotrexát (MTX), azathioprin, cyklosporin a cyklofosfamid [13–16].
Z uvedených léků je nejčastěji v literatuře zmiňován MTX, jehož podávání umožní snížit dávky steroidů. Podávání MTX snižuje riziko artritidy. Cyklosporin lze použít u pacientů se syndromem aktivace makrofágů. Do léčby SN nemoci dospělých výrazně zasáhla biologická léčba. Byla prokázána účinnost léků blokujících účinek interleukinu-1 a dále inhibitorů TNF-alfa (infliximab, etanercept a adalimumab). V současnosti se za základ léčby považuje inhibice IL-1 [25]. Blokáda účinků IL-1 vede k zásadnímu zlepšení klinických a laboratorních parametrů SN dospělých. V současnosti jsou ve světě k dispozici tři IL-1 antagonisté: rekombinantní antagonista receptoru IL-1 (IL-1Ra, anakinra), humánní protilátka namířená proti IL-1β (canakinumab) a solubilní fúzní protein s vlastnostmi IL-1 receptoru (rilonacept). Z těchto tří IL-1 antagonistů je nejčastěji používána anakinra. Anakinra vyniká rychlým odstraněním systémových příznaků. Její účinek na kloubní projevy je méně častý. Anakinra se podává podkožně 1× denně, protože má krátký poločas účinku.
Podle názorů expertů z roku 2019 jsou inhibitory IL-1 nejúčinnější pro systémové manifestace, zatímco inhibitory IL-6 jsou vhodné pro formy s poškozením kloubů, anti-TNF přípravky se doporučuje používat pouze pro pacienty s poškozením kloubů (revmatologická podskupina nemocných). Systémové projevy po podání těchto biologických léků ustupují rychle, ale artritida obvykle ustupuje pomalu. Při nedostatečné odpovědi na anakinru je možné použít rilonacept. Použití rilonaceptu je podstatně širší: dnavé záchvaty, juvenilní atritidy, syndrom Schnitzlerové. Canakinumab má podobné použití jako rilonacept. Jeho použití je popisováno u autoinflamatorních chorob včetně juvenilní artritidy a Stillovy nemoci dospělých.
Tocilizumab je monoklonální protilátka namířená proti receptoru pro IL-6. Tocilizumab má potenciál navodit remisi u pacientů, kteří nereagují na předchozí léčbu. Tento lék je také používán u juvenilní idiopatické artritidy se systémovými projevy. Léčba tocilizumabem umožní snížit vysoké dávky kortikosteroidů. U dominantně kloubních forem se používají také TNF alfa inhibitory, zejména infliximab.
Stillova choroba dospělých zůstává stále diagnostickým i terapeutickým problémem vzácné nemoci, jejíž symptomy mohou připomínat četné jiné choroby a léčebné ovlivnění není jednoduché [17–23].
Závěry pro praxi
Pro lékaře je důležité mít na paměti, že při horečce nejasného původu, spojené s muskuloskeletálními příznaky a makulárním rašem, je vždy nutné v rámci diferenciální diagnózy myslet také na Stillovu chorobu při vyloučení celé řady jiných možných příčin.
Další vzácnou autoinflamatorní chorobou, vznikající v dospělosti, je syndrom Schnitzlerové. Zánětlivé příznaky jsou podobné, ale je přítomna urtika a také monoklonální imunoglobulin typu IgM [24].
Léčbou první volby SN jsou glukokortikoidy, případně doplněné o nízké dávky metotrexátu.
Léčbou druhé volby SN, při neúspěchu či netoleranci glukokortikoidů a výrazných systémových projevech zánětu, jsou blokátory účinku interleukinu-1, z nichž nejčastěji je používán preparát anakinra.
Lymfadenopatie se zvýšeným vychytáváním FDG nemusí mít jenom maligní či infekční etiologii, ale její příčinou mohou být neinfekční zánětlivé změny, podobně jako u některých systémových nemocí pojiva nebo u Castlemanovy nemoci.
Podíl autorů na přípravě rukopisu
KZ – příprava rukopisu
KM1, ŘZ, KR, PL, KM3, ZA – korekce a revize rukopisu, doplnění obrazové dokumentace
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 10. 5. 2020.
Přijato do tisku po recenzi dne 23. 6. 2020.
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: adam.zdenek@fnbrno.cz
Zdroje
- Lachmann HJ. Autoinflammatory syndromes as causes of fever of unknown origin. Clin Med. 2015;15 : 295–298.
- Attard L, Tadolini M, De Rose DU, et al. Overview of fever of un-known origin in adult and paediatric patients. Clin Exp Rheumatol. 2018;36 : 10–24.
- Solav SV. FDG PET/CT in evaluation of pyrexia of unknown origin. Clin Nucl Med. 2011;36:e81–e86.
- Kaya A, Ergul N, Kaya SY, et al. The management and the diagnosis of fever of unknown origin. Expert Rev Anti Infect Ther. 2013;11 : 805–815.
- Yamaguchi M, Ohta A, Tsunematsu T, et al. Preliminary criteria for classification of adult Still’s disease. J Rheumatol. 1992;19 : 424–430.
- Fautrel B, Zing E, Golmard JL, et al. Proposal for a new set of classification criteria for adult-onset still disease. Medicine. 2002;81 : 194–200.
- Bywaters E G. Still’s disease in the adult. Ann Rheumatic Dis. 1971;30 : 121–133.
- Borges T, Barbosa A, Silva S. Adult-onset systemic autoinflammatory disorders: a clinical approach. Reumatismo. 2020;71 : 177–188.
- Ruscitti P, Giacomelli R. Pathogenesis of adult onset Still’s disease: current understanding and new insights. Expert Rev Clin Immunol. 2018;14 : 965–976.
- Cetkovská P, Benáková N. Autoinflamatorní syndromy s kožními projevy. Českoslov Dermatol. 2015;90 : 144–155.
- Kojima M, Nakamura S, Miyawaki S, et al. Lymph node lesion in adult-onset Still’s disease resembling peripheral T-cell lymphoma: a report of three cases. Int J Surgical Pathol. 2002;10 : 197–202.
- Yamashita H, Kubota K, Takahashi Y, et al. Clinical value of ¹⁸F-fluoro-dexoxyglucose positron emission tomography/computed tomography in patients with adult-onset Still’s disease: a seven-case series and review of the literature. Mod Rheumatol. 2014;24 : 645–650.
- Šedivá A, Slíva J, Doležalová P, et al. Anakinra. Farmakoterapie. 2011;7 : 621–629.
- Yoo DH. Biologics for the treatment of adult-onset Still’s disease. Expert Opin Biol Ther. 2019;19 : 1173–1190.
- Mimura T, Kondo Y, Ohta A, et al. Evidence-based clinical practice guideline for adult Still’s disease. Mod Rheumatol. 2018;28 : 736–757.
- Borges T, Barbosa A, Silva S. Adult-onset systemic autoinflammatory disorders: a clinical approach. Reumatismo. 2020;71 : 177–188.
- Sfriso P, Bindoli S, Doria A, et al. Canakinumab for the treatment of adult-onset Still’s disease. Exp Rev Clin Immunol. 2020;16 : 129–138.
- Colafrancesco S, Manara M, Bortoluzzi A, et al. AOSD Consensus Group. Management of adult-onset Still’s disease with interleukin-1 inhibitors: evidence - and consensus-based statements by a panel of Italian experts. Arthritis Res Ther. 2019;21 : 275–279.
- Li S, Zheng S, Tang S, et al. Autoinflammatory pathogenesis and targeted therapy for adult-onset Still’s disease. Clin Rev Allergy Immunol. 2020;58 : 71–81.
- Hausmann JS. Targeting cytokines to treat autoinflammatory dis-eases. Clin Immunol. 2019;206 : 23–32.
- Giacomelli R, Ruscitti P, Shoenfeld Y. A comprehensive review on adult onset Still’s disease. J Autoimmun. 2018;93 : 24–36.
- Néel A, Wahbi A, Tessoulin B, et al. Diagnostic and management of life-threatening adult-onset Still disease: a French nationwide multicenter study and systematic literature review. Crit Care. 2018;22 : 88–94.
- Zhou S, Qiao J, Bai J, et al. Biological therapy of traditional therapy-resistant adult-onset Still’s disease: an evidence-based review. Clin Risk Manag. 2018;14 : 167–171.
- Adam, Z, Koukalová R, Krejčí M, et al. Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové. Transfuze Hematol Dnes. 2018;24 : 88–103.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Léčba Erdheimovy-Chesterovy choroby
- Vysazování inhibitorů tyrozinkináz u pacientů s chronickou myeloidní leukemií ve studiích a klinické praxi
- Cílený rozklad obtížně inhibovatelných proteinů způsobujících maligní hematologická onemocnění pomocí dvoufunkčních molekul využívajících polyubikvitinaci a rozklad v proteazomech
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Nekrobiotický xantogranulom asociovaný s monoklonální gamapatií: popis případu a přehled léčebných možností
- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Dědičná trombocytopenie na podkladě patogenní varianty genu MYH9 diagnostikovaná u dospělé ženy
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Dopisy redakci
- Dopisy redakci
- Za pani profesorkou MUDr. Adrienou Sakalovou, DrSc.
- Zemřela MUDr. Zdeňka Vorlová, CSc.
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Léčba Erdheimovy-Chesterovy choroby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



