-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dědičná trombocytopenie na podkladě patogenní varianty genu MYH9 diagnostikovaná u dospělé ženy
Hereditary thrombocytopenia caused by a pathogenic variant of the MYH9 gene diagnosed in an adult woman
Hereditary thrombocytopenias are rare diseases. Patients do not suffer from bleeding in many cases, which is why inherited thrombocytopenia can be diagnosed in adulthood. If hereditary aetiology is suspected, modern genomic methods should be performed to specify the diagnosis. We present a case report of an adult woman with hereditary thrombocytopenia caused by a rare pathogenic variant c.3493C>T of the MYH9 gene. Inborn thrombocytopenia with giant platelets and possible development of renal impairment, hearing loss and cataracts are typical features of MYH9 related disorders. As yet, our patient has not developed either bleeding symptoms or any relevant organ damage. We believe she has Sebastian syndrome, given the type of mutation and clinical presentation.
Keywords:
hereditary thrombocytopenia – MYH 9 – Sebastian syndrome
Autoři: M. Sýkora 1; Z. Vrzalová 2,3; J. Vondráková 1; I. Blaháková 3; J. Trizuljak 2,3; V. Motáň 1; P. Jandová 1; N. Roučková 4; M. Strusková 4; Š. Pospíšilová 2,3; I. Vonke 1,4; M. Doubek 2,3
Působiště autorů: Oddělení klinické hematologie Nemocnice České Budějovice, a. s. 1; Interní hematologická a onkologická klinika, Lékařská fakulta MU a FN Brno 2; Centrum molekulární medicíny, Středoevropský technologický institut, Masarykova univerzita, Brno 3; Centrální laboratoře Nemocnice České Budějovice, a. s., Laboratoř klinické chemie, hematologie a imunologie 4
Vyšlo v časopise: Transfuze Hematol. dnes,26, 2020, No. 4, p. 327-332.
Kategorie: Kazuistiky
Souhrn
Hereditární trombocytopenie patří mezi vzácná onemocnění. V mnoha případech nemocní netrpí významnějšími krvácivými projevy, a proto mohou být vrozené trombocytopenie diagnostikovány až v dospělosti. Při podezření na hereditární etiologii lze moderními genomickými metodami stanovit přesnou diagnózu. Představujeme kazuistiku mladé ženy s vrozenou makrotrombocytopenií, u které byla pomocí metody celoexomového sekvenování charakterizována vzácná patogenní varianta c.3493C>T v genu MYH9. Pro skupinu onemocnění způsobených patogenními variantami MYH 9 je typická vrozená trombocytopenie s makrotrombocyty a možný pozdní rozvoj renálního postižení, hluchoty či slepoty. Vyšetřovaná žena netrpí krvácivými projevy ani se u ní dosud nerozvinulo jiné orgánové postižení. Podle typu mutace a klinického stavu se u pacientky jedná o Sebastianův syndrom.
Klíčová slova:
dědičná trombocytopenie – MYH 9 – Sebastianův syndrom
Úvod
Trombocytopenie patří mezi nejčastější příčiny krvácivých stavů. V mnoha případech je ale snížený počet krevních destiček náhodným nálezem u osob bez hemoragických projevů. K objasnění etiologie trombocytopenie je nutné nejdříve podrobné odebrání anamnézy (včetně lékové a rodinné) a provedení fyzikálního vyšetření. Z laboratorních metod stojí na prvním místě vyšetření krevního obrazu z periferní krve s mikroskopickým diferenciálním rozpočtem leukocytů. Zároveň je nezbytné vyloučit pseudotrombocytopenii (zejména dependentní na kyselině etylendiaminotetraoctové, EDTA). Fakultativně lze provést mikroskopické stanovení počtu trombocytů. Dále následuje podrobnější přešetření pacienta. V případě nálezu izolované trombocytopenie bez jiné zjištěné patologie je kliniky velmi často stanovena diagnóza imunitní trombocytopenické purpury. Pod touto diagnózou mohou být vedeni i pacienti s vrozenou trombocytopenií. V některých případech jsou chybně léčeni kortikoidy nebo imunosupresivy. Byly popsány i kazuistiky osob s hereditární trombocytopenií indikovaných ke splenektomii [1]. Určité nálezy (trombocytopenie od dětství, pozitivní rodinná anamnéza trombocytopenie nebo krvácení, laboratorní záchyt makrotrombocytů nebo mikrotrombocytů) by měly být podnětem k cílenému vyšetření na hereditární etiologii. Tabulka 1 představuje přehled vrozených trombocytopenií s makrotrombocyty [2, 3].
Tab. 1. Přehled vrozených trombocytopenií s makrotrombocyty, převzato z [2] ![Přehled vrozených trombocytopenií s makrotrombocyty, převzato z [2]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/1b21cedccc473206632f55964bf79944.png)
Kazuistika
Kazuistika se zabývá případem pacientky, která byla ve svých 19 letech odeslána do hematologické ambulance pro nález středně významné asymptomatické trombocytopenie. Následně bylo v záznamech praktického lékaře dohledáno, že mírná až středně významná izolovaná trombocytopenie (50–90 × 109/l) byla přítomna již od dětství. V průběhu života nebyly u pacientky pozorovány zvýšené krvácivé projevy. Jediná významnější intervence, ortopedická operace Achillovy šlachy, proběhla nekomplikovaně i bez hematologické přípravy. Z osobní anamnézy je nutno zmínit závažnou peripartální hypoxickou komplikaci bez průkazu krvácení do centrálního nervového systému. Následkem této příhody se u nemocné rozvinula diparetická forma dětské mozkové obrny, mentální retardace a sekundární epilepsie. Léčba antiepileptikem topiramátem byla ukončena v 18 letech. V rodinné anamnéze se neobjevily nápadnější hemoragické epizody nebo trombocytopenie. Při fyzikálním vyšetření u pacientky nebyly shledány krvácivé projevy na kůži a sliznicích ani jiné známky hematologického onemocnění.
Při přístrojovém vyšetření krevního obrazu byla v laboratoři zaznamenána izolovaná trombocytopenie (54 × 109/l) s makrotrombocyty (střední objem trombocytu, mean platelet volume, MPV 16 fl). Další parametry krevního obrazu včetně diferenciálního rozpočtu leukocytů byly v normě. Při mikroskopickém vyšetření nátěru periferní krve v klasickém panoptickém barvení byla nejen potvrzena přítomnost makrotrombocytů (obr. 1), ale také vysloveno podezření na diskrétní inkluze v cytoplazmě některých neutrofilních granulocytů (obr. 2). Stanovením trombocytů v citrátu byla vyloučena EDTA dependentní pseudotrombocytopenie. Vstupní koagulační vyšetření (protrombinový čas – PT, aktivovaný parciální tromboplastinový čas – APTT, trombinový čas – TT, fibrinogen, antitrombin – AT) bylo v normě. Agregace trombocytů se základním panelem induktorů (kyselina arachidonová, adenosindifosfát – APD, epinefrin, kolagen) neprokázala významnou patologii. K agregačnímu vyšetření byla užita plazma bohatá na trombocyty, v jejím vzorku bylo množství krevních destiček v normálním rozmezí.
Obr. 1. Makrotrombocyt u pacientky se Sebastianovým syndromem. Barvení May-Grünwald a Giemsa-Romanovski, zvětšení 100× 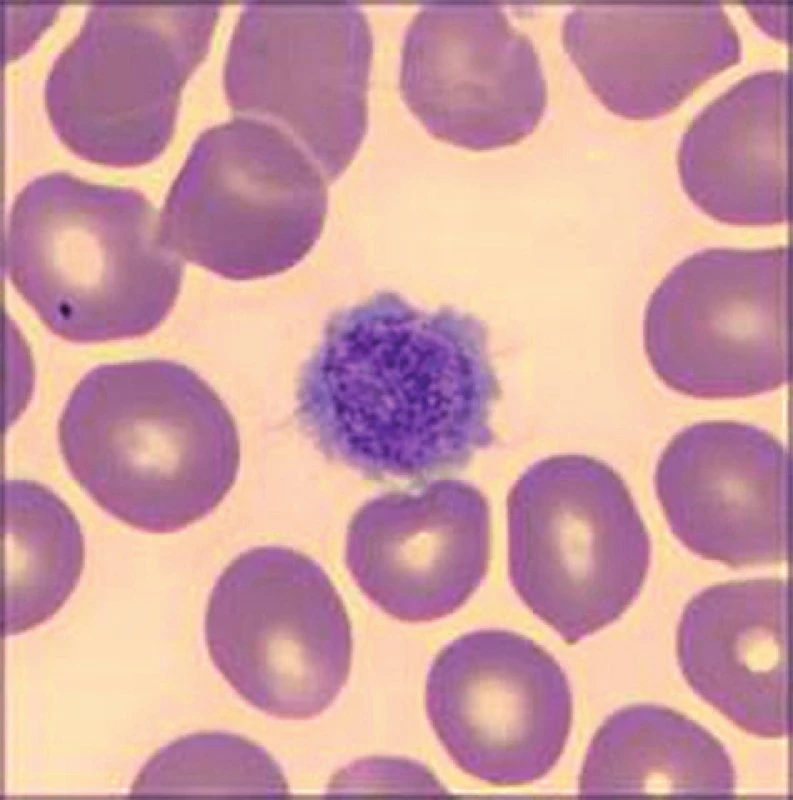
Obr. 2. Neutrofilní granulocyt u pacientky se Sebastianovým syndromem. Barvení May-Grünwald a Giemsa-Romanovski, zvětšení 100× 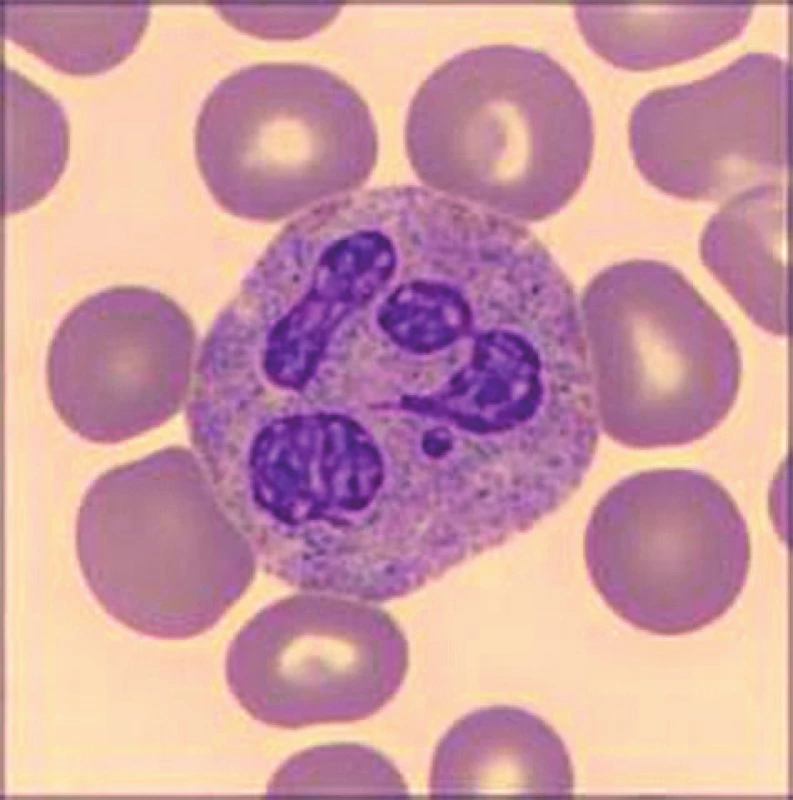
Po konzultaci s hematology z Interní hematologické a onkologické kliniky FN Brno bylo doporučeno cílené vyšetření k posouzení hereditární etiologie. Ze zaslaných vzorků periferní krve pacientky a obou rodičů byla izolována DNA použitím MagCore Genomic DNA Whole Blood Kit (RBC Bioscience, USA). Dále bylo u vzorků provedeno celoexomové sekvenování (WES) podle protokolu SeqCap EZ HyperCap Workflow v 2.1 s využitím chemie od firmy Roche (USA). Při vyhodnocení WES variant se vycházelo z cílené trioanalýzy zaměřené na fenotypové projevy u pacientky a také z předpokladů, že se může jednat o autozomálně dominantní (AD) nebo recesivní dědičnost i s možností výskytu de novo variant. Na základě těchto poznatků byl k analýze použit cílený virtuální panel 363 genů, který je asociován s dědičnými trombocytopeniemi [4]. Po odfiltrování synonymních variant, variant v intronové oblasti a variant s nízkým pokrytím (menší než 10 čtení), byla u pacientky identifikována známá heterozygotní varianta c.3493C>T (p.Arg1165Cys) ve 27. exonu MYH9 genu (referenční sekvence: NM_002473) (obr. 3). Varianta c.3493C>T pravděpodobně vznikla de novo, protože ani u jednoho z rodičů nebyla detekována. Jedná se o patogenní a již známou variantu, u které byla pomocí funkční analýzy prokázána její kauzalita zodpovědná za Sebastianův syndrom [5]. Přítomnost varianty c.3493C>T byla ověřena pomocí polymerázové řetězové reakce a klasického sekvenování. Sekvenační analýza potvrdila přítomnost varianty c.3493C>T v MYH9 genu v heterozygotním stavu pouze u pacientky.
Obr. 3. Vizualizace varianty c.3493C>T (g.36295069G>A) v genu MYH9 pomocí Intergrative Genomics Viewer (IGV). Nukleotidová sekvence je označená červeným rámem. Sekvenační čtení forward jsou označeny modře a sekevanční čtení reverse růžovou barvou. 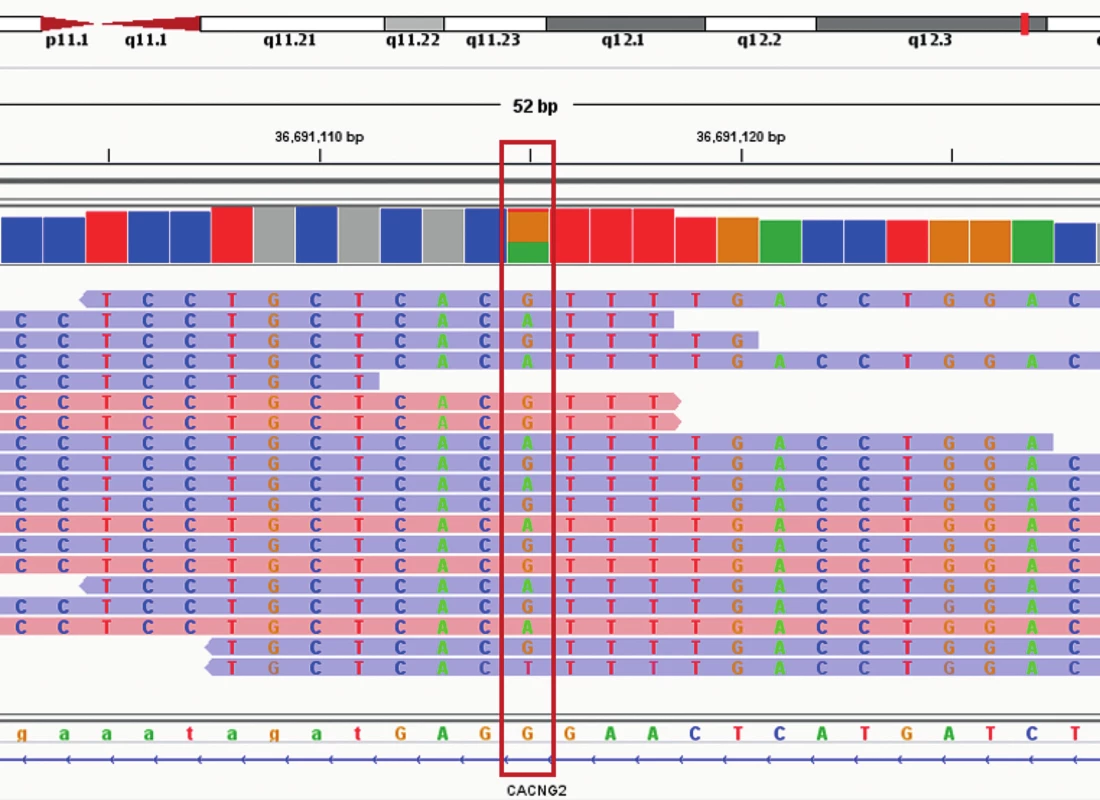
Diskuse
Gen MYH9 se nachází na dlouhém raménku 22. chromozomu (22q12.3), skládá se ze 41 exonů a jeho délka je 106,66 kilobází. Gen MYH9 kóduje protein těžkého řetězce nesvalového myozinu II A (protein NMHC II A), který je součástí cytoskeletu ve většině somatických buněk. Mimo jiné se tato bílkovina podílí na cytokinezi, adhezi a udržování tvaru buněk. V procesu megakaryogeneze způsobuje patologicky změněný myozin poruchu maturace megakaryocytu a zejména uvolňování krevních destiček [6]. V cytoplazmě neutrofilů se tento protein ukládá v granulech, které mohou být zachyceny ve světelném mikroskopu při panoptickém barvení. Jednoznačný průkaz granulí se změněným proteinem NMHC IIA umožňuje imunofluorescenční mikroskopie [7].
Onemocnění způsobená patogenními variantami v genu MYH9 (MYH9 related disorders – MYH9-RD), patří k nejčastějším příčinám vrozené trombocytopenie. Incidence přibližně 3 : 1000 000 je řadí mezi vzácná onemocnění [8]. Doposud bylo v HGMD databázi popsáno 80 různých variant genu MYH9: 50 bodových mutací, 5 malých inzercí a delecí, 9 sestřihových variant, 2 substituce v regulační oblasti genu, 5 rozsáhlých delecí a duplikací [9]. Ačkoli se u MYH9-RD uplatňuje autozomálně dominantní dědičnost, bylo popsáno relativně vysoké procento výskytu sporadických případů (cca 35 %), které mohou být způsobeny mutací de novo, mozaikou zárodečných či somatických buněk [10, 11]. Nemocní s MYH9-RD mají od narození makrotrombocytopenii různého stupně (od lehké až po těžkou). U této skupiny onemocnění nebyla zaznamenána významnější porucha funkce krevních destiček. Tíže a četnost spontánních krvácení u jedinců s MYH9-RD koreluje s počtem trombocytů. Pouze přibližně 30 % osob trpí spontánními krvácivými projevy, zejména na kůži a sliznicích (nadměrná tvorba modřin, menoragie, epistaxe). Závažnější nebo život ohrožující hemoragie jsou vzácné [11]. V průběhu života pacienta s MYH9-RD počet krevních destiček zůstává stabilní. Kolísání trombocytopenie u jednoho nemocného může být způsobeno analytickou chybou měření. V některých případech hematologické analyzátory řadí makrotrombocyty k jiným krevním elementům a výsledný počet i objem trombocytů je tak významně podhodnocen. Mikroskopické stanovení počtu krevních destiček je považováno za přesnější měření a tuto chybu koriguje [3, 12]. U naší nemocné nebylo výše zmíněné mikroskopické vyšetření provedeno. Předpokládáme, že reálný vstupní počet trombocytů byl vyšší než hodnota změřená analyzátorem. Následně nebyla ve vzorku plazmy bohaté na trombocyty před agregačním vyšetřením zjištěna trombocytopenie. Jsme toho názoru, že výsledek agregace destiček nám umožnil vyloučit většinu závažných trombocytopatií.
MYH9-RD je heterogenní skupinou onemocnění s pestrým klinickým obrazem. Kromě trombocytopenie se mohou v průběhu života postiženého jedince rozvinout i závažné nehematologické projevy. Nejobávanější komplikací je proteinurická glomerulopatie vedoucí k renálnímu selhání. Dále nemocné může postihnout senzoricko-neurální hluchota, presenilní katarakta nebo elevace jaterních testů bez významnější jaterní dysfunkce. Tíže trombocytopenie a charakter nehematologických projevů významně souvisí s typem a lokalizací MYH9 varianty. Ve studiích cílených na korelaci genotyp-fenotyp bylo jednoznačně prokázáno, že zejména určité varianty postihující hlavičku těžkého řetězce myozinu, jsou spojeny s vysokým rizikem rozvoje těžké trombocytopenie, renálního postižení a hluchoty. Klinicky tyto případy odpovídají známému Fechtnerovu syndromu (trombocytopenie, glomerulopatie, porucha sluchu, drobné inkluze neutrofilů) a Epsteinovu syndromu (trombocytopenie, glomerulopatie, porucha sluchu, bez inkluzí prokazatelných světelnou mikroskopií v cytoplazmě neutrofilů) [11]. Na druhé straně varianty postihující koncovou část molekuly těžkého řetězce myozinu nejsou příčinou významnějších zdravotních obtíží u postiženého jedince. Jedná se například o známé patogenní varianty ve 27. exonu (c.3493C>T – identifikovaná u naší pacientky) nebo ve 31. exonu (c.4270G>A). Tyto nálezy korelují pouze s rozvojem lehké neprogredující hluchoty v dospělosti, ale pravděpodobnost renálního postižení je velmi nízká [11, 13]. Případ naší pacientky klinicky odpovídá Sebastianovu syndromu, který zahrnuje vrozenou makrotrombocytopenii, drobné inkluze v cytoplazmě neutrofilů a lehkou hluchotu nastupující po 40. roku života [14, 15]. Blízkou jednotkou tohoto syndromu je Mayova-Hegglinova anomálie s Döhleho inkluzemi v cytoplazmě neutrofilních granulocytů, jež jsou ve světelném mikroskopu výraznější než granula u Sebastianova syndromu. Zřetelnější rozdíl v granulech lze pozorovat pomocí imunofluorescenční nebo elektronové mikroskopie. Varianty způsobující Mayovu-Hegglinovu anomálii se nacházejí na 39. nebo 41. exonu genu MYH9. Osoby s touto jednotkou většinou netrpí nehematologickými komplikacemi [16, 17, 18].
Trombocytární transfuzní přípravky se tradičně užívají u pacientů s vrozenými trombocytopeniemi při léčbě závažnějšího krvácení nebo preventivně před invazivními zákroky. U nemocných s MYH9-RD byly prezentovány slibné výsledky s agonisty trombopoetinového receptoru. V malých klinických studiích více než 90 % pacientů odpovědělo na léčbu eltrombopagem vzestupem počtu trombocytů a ústupem krvácivých projevů [1, 19]. Krátkodobé užívání eltrombopagu bylo rovněž úspěšné v rámci předoperační přípravy [20]. Bylo publikováno i několik kazuistik popisujících efekt romiplostimu u pacientů s MYH9-RD [21, 22].
Závěr
Ačkoli vrozené trombocytopenie patří mezi vzácná onemocnění, určité klinické a laboratorní nálezy (např. přítomnost trombocytopenie od dětství, pozitivní rodinná anamnéza trombocytopenie či krvácivých obtíží, mikroskopický nález makrotrombocytů) by měly být podnětem k cílenému vyšetření na hereditární etiologii. O nepoznanou vrozenou trombocytopenii se může jednat i tehdy, když zvažovaná imunitní trombocytopenická purpura je primárně refrakterní na kortikoidy, ale může příznivě reagovat na terapii trombomimetiky. V současnosti lze moderními genomickými metodami stanovit přesnou diagnózu mnoha hereditárních trombocytopenií, včetně MYH9-RD. Podle typu a umístění varianty v genu MYH9 je možno předpovědět prognózu pacienta, zejména riziko pozdních nehematologických komplikací. Při potvrzení přítomnosti patogenní varianty MYH9 je u pacienta indikováno vyšetření a sledování funkce ledvin, sluchu a zraku. V léčbě krvácení nebo jako příprava před invazivními zákroky u pacientů s MYH9-RD představují agonisté trombopoetinových receptorů alternativu k trombocytárním transfuzním přípravkům. Tyto moderní léky mohou být přínosné pro pacienty s recidivujícími hemoragickými projevy. Dále mohou z trombomimetik profitovat nemocní, kteří jsou refrakterní na trombokoncentráty nebo kteří měli alergickou reakci po jejich podání. Nicméně v současné době je užití trombomimetik u vrozených trombocytopenií off-label indikací a úhrada této nákladné léčby je podmíněna schválením od revizního lékaře zdravotní pojišťovny.
Použité zkratky
ADP adenosindifosfát
APTT aktivovaný parciální tromboplastinový čas
AT antitrombin
EDTA ethylenediaminetetraacetic acid
HMGD Human Gene Mutation Database
MYH9 myosine heavy chain 9
NMMHC-IIA nonmuscle myosin heavy chain IIA
PT protrombinový čas
TT trombinový čas
Podíl autorů na přípravě rukopisu
MS – klinické vyšetření pacientky, sepsání textu
ZV – sepsání textu, genomická analýza
JV – úprava a revize textu
IB – genomická analýza
JT – interpretace výsledků
PJ – klinické vyšetření pacientky, revize textu
VM – revize textu
NR – agregometrie a fotodokumentace
MS – světelná mikroskopie
ŠP – interpretace výsledků
IV – revize textu
MD – interpretace výsledků a revize textu
Poděkování
Práce byla podpořena grantovým projektem MZ ČR (grant AZV NU20-08-00137).
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 5. 2. 2020.
Přijato po recenzi dne 21. 7. 2020.
MUDr. Michal Sýkora
Oddělení klinické hematologie
Nemocnice České Budějovice, a.s.
B. Němcové 585/54
370 01 České Budějovice
e-mail: michal.sykora@nemcb.cz
Zdroje
- Zaninetti C, Gresele P, Bertomoro A, et al. Eltrombopag for the treatment of inhereted thrombocytopenias: a phase 2 clinical trial. Haematologica. 2020;105 : 820–828.
- Noris P, Pecci A. Heretidary thrombocytopenias: a growing list of disorders. Hematology; Am Soc Educ Program. 2017;385–390.
- Noris P, Klersy C, Gresele P, et al. Platelet size for distinguishing between inherited thrombocytopenias and immune thrombocytopenia: a multicentric, real life study. Br J Haematol. 2013;162 : 112–119.
- Johnson B, Lowe GC, Futterer J, et al. Whole exome sequencing identifies genetic variants in inherited thrombocytopenia with secondary qualitative function defects. Haematologica. 2016;101 : 1170–1179.
- Franke JD, Dong F, Rickoll WL, et al. Rod mutations associated with MYH9-related disorders disrupt nonmuscle myosin-IIA assembly. Blood. 2005;105 : 161–169.
- Pešová M, Kozubík S, Pál K, et al. Dědičné trombocytopenie. Transfuze Hematol Dnes. 2018;24 : 14–26.
- Pecci A, Ma X, Savoia A, el al. MYH 9: Structure, functions and role of non muscle myosin IIA in human disease. Gene. 2018;664 : 152–167.
- Stenson PD, Mort M, Ball EV, et al. The Human Gene Mutation Database: towards a comprehensive repository of inherited mutation data for medical research, genetic diagnosis and next-generation sequencing studies. Hum Genet. 2017;136 : 665–677.
- Savoia A, Pecci A. MYH9-related disorders. In: Pagon R, Adam MP, Gene Reviews. 10 ed. Seattle: University of Washington. Dostupné na: http://www.ncbi.nlm.nih.gov/books/NBK2689, publikováno 16. července 2015.
- Kunishina A, Takaki K, Ito Y, et al. Germinal mosacism MYH 9 disorders: a family with two affected siblings of normal parents. Br J Haematol. 2009;145(2):260–262.
- Pecci A, Klersy C, Gresele P, et al. MYH9-Related Disease: A novel prognostic model to predict the clinical evolution of the disease bad on genotype-phonotype correlations. Hum Mutat. 2014;35 : 236–247.
- Balduini CL, Pecci A, Savoia A. Recent advances in the understanding and management of MYH9 related inherited thrombocytopenias. Br J Haematol. 2011;154 : 161–174.
- Verver EJ, Topsakal V, Kunst HP, et al. Nonmuscle myosin heavy chain IIA mutation predicts severity and progression of sensorineural hearing loss in patients with MYH9-related disease. Ear Hear. 2016;37 : 112–120.
- Greinacher A, Nieuwenhuis HK, White JG. Sebastian platelet syndrome: a new variant of hereditary macrothrombocytopenia with leukocyte inclusions. Blut. 1990;61 : 282–288.
- Althaus K, Greinacher A. MYH9-related platelet disorders. Semin Thromb Hemost. 2009;35 : 189–203.
- Doubek M, Smejkal P, Dostálová V, et al. Vrozená trombocytopenie: diferenciální diagnostika jednoho případu. Cas Lek Cesk. 2003;142 : 683–686.
- Rodriguez V, Nichols WL, Charlesworth JE, et al. Sebastian platelet syndrome: hereditary macrothrombocytopenia. Mayo Clin Proc. 2003;78 : 1416–1421.
- Pecci A, Panza E, Pujol-Moix N, et al. Position of nonmuscle myosin heavy chain IIA (NMMHC-IIA) mutations predicts the natural history of MYH9-related disease. Hum Mutat. 2008;29 : 409–417.
- Pecci A, Gresele P, Klersy C, et al. Eltrombopag for the treatment of the inhereted thrombocytopenia deriving from MYH9 mutations. Blood. 2010;116 : 5832–5837.
- Pecci A, Barozzi S, d’Amico S, et al. Short-term eltrombopag for surgical preparation of a patient with inherited thrombocytopenia deriving from MYH9 mutation. Thromb Haemost. 2012;107 : 1188–1189.
- Gropper S, Althaus K, Najm J, et al. A patient with Fechtner syndrome successfully treated with romiplostim. Thromb Haemost. 2012;107 : 590–591.
- Yamanouchi J, Hato T, Kunishima S, Niiya T, Nakamura H, Yasukawa M. A novel MYH9 mutation in a patient with MYH9 disorders and platelet size specific effect of romiplostim on macrothrombocytopenia. Ann Hematol. 2015;94 : 1599–1600.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Dopisy redakciČlánek Dopisy redakci
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Léčba Erdheimovy-Chesterovy choroby
- Vysazování inhibitorů tyrozinkináz u pacientů s chronickou myeloidní leukemií ve studiích a klinické praxi
- Cílený rozklad obtížně inhibovatelných proteinů způsobujících maligní hematologická onemocnění pomocí dvoufunkčních molekul využívajících polyubikvitinaci a rozklad v proteazomech
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Nekrobiotický xantogranulom asociovaný s monoklonální gamapatií: popis případu a přehled léčebných možností
- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Dědičná trombocytopenie na podkladě patogenní varianty genu MYH9 diagnostikovaná u dospělé ženy
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Dopisy redakci
- Dopisy redakci
- Za pani profesorkou MUDr. Adrienou Sakalovou, DrSc.
- Zemřela MUDr. Zdeňka Vorlová, CSc.
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Léčba Erdheimovy-Chesterovy choroby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



