-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
Recommendations for screening, diagnosis, prophylaxis and treatment of hepatitis in haemato-oncological patients – CELL recommendations
Viral hepatitis affects millions of people worldwide, with host immunity deciding on the outcome of infection. In patients with haematological malignancies or recipients of haematopoietic stem cells the virus may cause life-threatening complications either due to the virus itself or to the need to interrupt or reduce the chemotherapy. The infected haematopoietic stem cell donor can also transmit viral hepatitis. Knowing complete HBV (hepatitis B virus) serostatus is essential for the right choice of treatment, prophylaxis or pre-emptive approach. Recent recommendations favour treatment using molecules with a high barrier to resistance. In HCV infection, administration of new, direct-acting antiviral agents (DAA), is safe in haematological patients. The use of DAAs in first line is recommended, either as a single treatment for indolent lymphomas or in combination with chemotherapy for aggressive lymphomas. Due to the existing risk of chronic hepatitis E in immunocompromised patients, marker screening should be performed if there are signs and symptoms of hepatitis. In the case of HEV infection, reduction in immunosuppression is recommended and if not possible or unsuccessful, treatment with ribavirin may be considered. Hepatitis A does not progress to chronicity but may be more severe in elderly and immunocompromised patients with risk of hepatic failure. The CELL (Czech Leukaemia Study Group – for Life) Working Group for the Treatment of Opportunistic Infections recommends that all patients undergo screening for hepatotropic viruses before haematological treatment and that patients or donors of haematopoietic stem cells with markers of previous or current viral hepatitis should be consulted with specialists (infectious disease specialist/hepatologists). The screening, vaccination and treatment guidelines outlined here were presented and discussed at the CELL workshop in Brno in May 2018.
Autoři: Ľ. Soják 1; Z. Ráčil 2; T. Kabut 3; B. Weinbergerová 3; J. Mayer 3; J. Haber 4; P. Žák 5; J. Radocha 5; M. Navrátil 6; R. Hájek 6; T. Kozák 7; P. Sedláček 8; P. Múdrý 9; R. Szotkowská 10; T. Papajík 10; T. Szotkowski 10; P. Cetkovský 2; D. Teiserová 11; N. Mallátová 11; J. Lukáš 12; L. Drgoňa 13
Působiště autorů: Klinika infektológie a geografickej medicíny SZU, LFUK a UN, Bratislava 1; Ústav hematologie a krevní transfuze, Praha 2; Interní hematologická a onkologická klinika FN, Brno 3; I. interní klinika – klinika hematologie 1. LF a VFN, Praha 4; IV. Interní hematologická klinika FN, Hradec Králové 5; Klinika hematoonkologie FN, Ostrava 6; Interní hematologická klinika FN Královské Vinohrady, Praha 7; Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 8; Klinika dětské onkologie FN, Brno 9; Hemato-onkologická klinika FN a LF UP, Olomouc 10; Centrální laboratoře, Nemocnice České Budějovice 11; Klinika hematológie a transfuziológie SZU, LFUK a UN, Bratislava 12; Klinika onkohematológie LFUK a NOÚ, Bratislava 13
Vyšlo v časopise: Transfuze Hematol. dnes,26, 2020, No. 4, p. 333-342.
Kategorie: Doporučené postupy
Souhrn
Vírusové hepatitídy postihujú milióny ľudí na celom svete, pričom o výsledku infekcie rozhoduje imunita hostiteľa. U pacientov s hematologickou malignitou alebo u príjemcov krvotvorných kmeňových buniek môžu spôsobiť život ohrozujúce stavy, či už kvôli samotnému vírusu alebo vďaka nevyhnutnej potrebe prerušiť alebo znížiť dávku chemoterapie. Zároveň, infikovaný darca hematopoetických kmeňových buniek môže prenášať vírusovú hepatitídu. Vedieť kompletný HBV (vírus hepatitídy B) sérostatus je nevyhnutné pre správny výber liečby, profylaxie alebo preemptívneho prístupu. Posledné odporúčania uprednostňujú liečbu molekulami s vysokou bariérou rezistencie. Pokiaľ ide o HCV infekciu (vírus hepatitídy C), podávanie nových, priamo pôsobiacich protivírusových látok (DAA) bolo u hematologických pacientov bezpečné. Odporúča sa ich použitie ako prvej línie či už ako jedinej liečby u indolentných lymfómov alebo v kombinácii s chemoterapiou v prípade agresívnych. V dôsledku existujúceho rizika chronickej E hepatitídy (HEV) u imunokompromitovaných pacientov, mal by byť vykonaný skríning markerov, ak sú príznaky a symptómy naznačujúce hepatitídu. V prípade HEV infekcie sa odporúča zníženie imunosupresie a ak to nie je možné alebo neúspešné, možno zvážiť liečbu ribavirínom. Hepatitída A neprechádza do chronicity, ale u starších imunokompromitovaných pacientov môže prebiehať závažnejšie aj s rizikom hepatálneho zlyhania. Vzhľadom k uvedenému pracovná skupina pre liečbu oportúnnych infekcií CELL (Czech Leukaemia Study Group – for Life) odporúča, aby sa všetci pacienti podrobili skríningu hepatotropných vírusov pred hematologickou liečbou a zároveň pacienti alebo donori hematopoetických kmeňových buniek s markermi predchádzajúcej alebo súčasnej vírusovej hepatitídy by mali byť konzultovaní špecialistom (infektológom/hepatológom). Pravidlá skríningu, očkovania a liečby, ktoré sú uvedené v tomto prehľade, boli prezentované a diskutované na CELL workshope v Brne v máji 2018.
Úvod
Vírusové hepatitídy sú najčastejšou príčinou chronickej choroby pečene, postihujú viac ako 300 miliónov ľudí na celom svete [1]. Veľkú väčšinu prípadov spôsobuje vírus hepatitídy B (HBV) a vírus hepatitídy C (HCV), zatiaľ čo výrazne menej časté príčiny chronickej infekcie pečene sú vírusy hepatitídy D (HDV) a hepatitídy E (HEV) [2].
Zatiaľ čo HCV infekcia je celosvetovo pomerne heterogénne distribuovaná, prevalencia HBV sa značne líši medzi rôznymi geografickými oblasťami [1]. Africký región a západné Tichomorie vykazujú najvyššiu prevalenciu HBV (definovanú prítomnosťou sérového HBV povrchového antigénu, HBsAg) v rozmedzí od 4,6 % do 8,5 % a najväčší počet ľudí žijúcich s HBV (až 84, respektíve 140 miliónov osôb) [1]. Na rozdiel od toho, miera HBV infekcie v európskom regióne je nižšia ako 2,6 %, čiže menej ako 23 miliónov osôb HBV [1]. Slovensko a Česká republika patria medzi krajiny s nízkou prevalenciou HBV infekcie. Približne 5 % HBV infikovaných ľudí je koinfikovaných vírusom HDV, defektným vírusom, ktorý vyžaduje prebiehajúcu HBV infekciu na replikáciu [3]. Celosvetová prevalencia infekcie HCV v roku 2015 bola 1,0 %, čiže približne 71 miliónov ľudí na celom svete žije s HCV [1]. Aj tu patrí Slovensko a Česká republika medzi krajiny s nízkou prevalenciou. V poslednom období pozorujeme nárast výskytu hepatitídy typu E v industrializovaných krajinách, s vysoko variabilnou mierou prevalencie, podľa geografickej oblasti v rozmedzí od 0,4 % do 52,5 % [4]. V poslednom desaťročí boli hlásené prípady chronickej HEV infekcie a doteraz nie je stanovený skutočný rozsah tejto problematiky [5]. Vírusové hepatitídy vyvolávajú obavy u hematologického pacienta z viacerých dôvodov. HCV a v menšej miere aj HBV sa spájajú so zvýšeným rizikom niektorých hematologických porúch. Existujú silné dôkazy najmä o príčinnej súvislosti medzi HCV a typom II zmiešanej kryoglobulinémie a B-bunkového non-Hodgkinovho lymfómu (B-NHL) [6, 7]. Navyše, HBV, HCV a možno aj HEV sa môžu počas imunosupresie opätovne aktivovať s klinickými príznakmi varírujúcimi od asymptomatického alebo mierneho priebehu až po významné poškodenie pečene, s následným oneskorením alebo zmenou režimov chemoterapie alebo môže dôjsť k akútnemu zlyhaniu pečene [8]. Dokonca aj v prípade vyliečenej HBV infekcie, ktorá je definovaná absenciou HBsAg v prítomnosti protilátok proti jadrovému HBV antigénu (HBcAb) s alebo bez protilátok proti HBsAg (HBsAb), môže dôjsť za určitých okolností k reaktivácii [9]. Preto je nevyhnutný skríning vírusovej hepatitídy a správny manažment, aby sa zabránilo nepriaznivému dopadu u pacienta.
Vírus hepatitídy B (HBV)
Prirodzený priebeh HBV infekcie
Pri expozícii HBV iba 5 % dospelých s akútnou infekciou prejde do chronického štádia, ktoré je definované perzistenciou HBsAg v krvi po dobu najmenej 6 mesiacov [10]. Hoci priebeh chronickej HBV infekcie môže byť variabilný a môže sa meniť z aktívneho do neaktívneho stavu a potom sa vrátiť späť na aktívne ochorenie pečene neskôr, existuje všeobecná zhoda, že infekcia HBV prebieha v štyroch fázach, ktoré nasledujú jedna po druhej: imunitno-tolerantná fáza, imunitno-aktívna fáza, neaktívna fáza a fáza obnovy [11].
Osoby, ktoré sa zbavia HBsAg, môžu dosiahnuť sérokonverziu a vytvorenie anti-HBs protilátok. Prirodzene dôjde k strate HBsAg ročne asi u 0,5–0,8 % infikovaných pacientov [12]. Protilátky proti HBc sú u týchto pacientov stále detekovateľné. Dokonca aj u pacientov s HBsAg sérokonverziou, HBV pretrváva počas celého života v jadre hepatocytov vo forme kovalentne uzatvorenej kruhovej (ccc) DNA. HBV cccDNA predstavuje základ pre reaktiváciu HBV a taktiež je základom pre okultné infekcie HBV, ktoré sú definované prítomnosťou HBV DNA v pečeni a prítomnosťou alebo neprítomnosťou HBV DNA v sére bez detekovateľného HBsAg [13].
Patogenéza HBV reaktivácie
Počas imunosupresívnej liečby sa zvyšuje replikácia HBV v hepatocytoch, čo je aj výhradné miesto replikácie vírusu. Pri obnove imunitných funkcií (väčšinou po ukončení chemoterapie), dôjde k rozpoznaniu veľkého množstva vírusu v pečeňových bunkách imunitným systémom, ktorý reaguje vyhľadávaním a zničením vírusu a pritom bohužiaľ aj hostiteľskej bunky. S cieľom zbaviť sa vírusu, imunitný systém začína napádaním a usmrcovaním rôzneho množstva hepatocytov, s následným vzostupom transamináz. Klinické dôsledky imunitnej rekonštitúcie sa môžu líšiť od miernej asymptomatickej hepatitídy až po závažné zlyhanie pečene [14–17]. Dôsledkom reaktivácie môže byť aj fibrotizujúca cholestatická hepatitída [18]. Keďže HBV je schopný vytvoriť kovalentne uzavretý kruh DNA (cccDNA), ktorá môže pretrvávať celú dobu v jadre hostiteľskej bunky, predstavuje tak trvalý vírusový rezervoár, čiže aj u pacientov s vyliečenou HBV infekciou môže dôjsť k HBV reaktivácii [19].
Definícia HBV reaktivácie sa v literatúre líši, najnovšie štúdie definujú reaktiváciu HBV ako desaťnásobné zvýšenie HBV DNA u HBsAg pozitívnych jedincov a ako séroreverziu HBsAg (znovuobjavenie) u HBsAg negatívnych a anti-HBc pozitívnych jedincov. Avšak opätovné objavenie HBsAg väčšinou predchádza opätovné objavenie sa HBV DNA [20]. Laboratórne je reaktivácia charakterizovaná viac ako 3-násobným vzostupom ALT.
Obr. 1. Riziko infekcie, reaktivácie a skríning hepatitíd u pacientov s hematologickou malignitou 
Skríning HBV u hematologických pacientov
Všetci hematologickí pacienti by mali byť vyšetrení na HBsAg, HBsAb a HBcAb pred začatím chemoterapie, resp. transplantáciou. V prípade detegovateľného HBsAg alebo HBcAb, malo by sa doplniť vyšetrenie HBV DNA [15, 21]. Izolovaná HBsAb pozitivita zvyčajne znamená humorálnu odpoveď po očkovaní proti HBV, hoci u niektorých pacientov po prekonaní akútnej HBV infekcie môže pretrvávať izolovaná HBsAb pozitivita v dôsledku straty HBcAb [22–23]. Preto nevakcinovaní HBsAb-pozitívni/HBcAb-negatívni pacienti by mali byť manažovaní ako HBcAb-pozitívni. Na druhej strane existuje možnosť falošne pozitívnych HBcAb napríklad po podaní intravenózneho imunoglobulínu [24]. Preto je dôležité vykonávať HBV skríning na začiatku diagnózy a pred akoukoľvek liečbou. Pri uvedenej stratégii skríningu je obrovská väčšina pacientov infikovaných HBV ľahko identifikovateľná, hoci sú veľmi zriedkavé prípady pacientov so séronegatívnou okultnou HBV infekciou, ktorá je definovaná prítomnosťou vírusovej DNA v pečeni s nedetekovateľnou HBV DNA v sére u pacientov negatívnych pre všetky HBV markery [9]. Pri podozrení na prebiehajúcu/prekonanú HBV infekciu by mal byť pacient promptne konzultovaný špecialistom (infektológ/hepatológ) na vyhodnotenie rizika reaktivácie a bližšej klasifikácie štádia infekcie.
Rizikové faktory reaktivácie
Riziko reaktivácie závisí predovšetkým od štádia HBV infekcie a typu imunosupresívnej liečby. HBsAg-pozitívni pacienti sú vystavení vysokému riziku HBV reaktivácie počas väčšiny imunosupresívnych režimov (až do 70 % v prípade transplantácie krvotvorných buniek, resp. použitia anti-CD20 monoklonálnych protilátok), pričom je jasná spojitosť medzi rizikom reaktivácie HBV a dávkovaní a trvaní imunosupresívnej liečby. Na rozdiel od toho HBsAg-negatívni a anti-HBc-pozitívni pacienti sú vystavení nízkemu riziku počas väčšiny imunosupresívnych režimov s výnimkou transplantácie krvotvorných buniek (TKB) alebo pri podaní anti-CD20 protilátok (riziko až do 40 %). Ďalšie faktory, ako je vek alebo pohlavie, prispievajú k riziku HBV reaktivácie menej [25]. Detekcia anti-HBs protilátok u HBsAg-negatívnych a anti-HBc-pozitívnych pacientov sa považuje za ochranný faktor proti reaktivácii HBV. Avšak, protektívny vplyv anti-HBs na reaktiváciu je malý najmä po podaní anti-CD20 protilátok alebo po TKB [26–28]. Rituximab zvyšuje riziko vzniku HBV reaktivácie a s tým súvisiace riziko zlyhania pečene a smrti keď sa podáva v kombinácii s kortikosteroidmi alebo chemoterapiou [29]. Je popísaná aj HBV reaktivácia počas monoterapie rituximabom [30]. Americká lieková asociácia (FDA) vydala upozornenie pre anti-CD20 protilátky rituximab a ofatumumab, humanizované anti-CD20 monoklonálne protilátky, kvôli zvýšenému riziku HBV reaktivácie [31]. S rozmachom cielenej liečby a imunoterapie v onkohematológii je potrebné brať do úvahy riziko reaktivácie u každého lieku atakujúceho B lymfocyty.
Manažment HBV u hematologických pacientov
Manažment HBV infekcie na základe rôzneho HBV sérostatusu a vírusovej nálože je sumarizovaný v tabuľke 1.
Tab. 1. Manažment hematologického pacienta s HBV infekciou 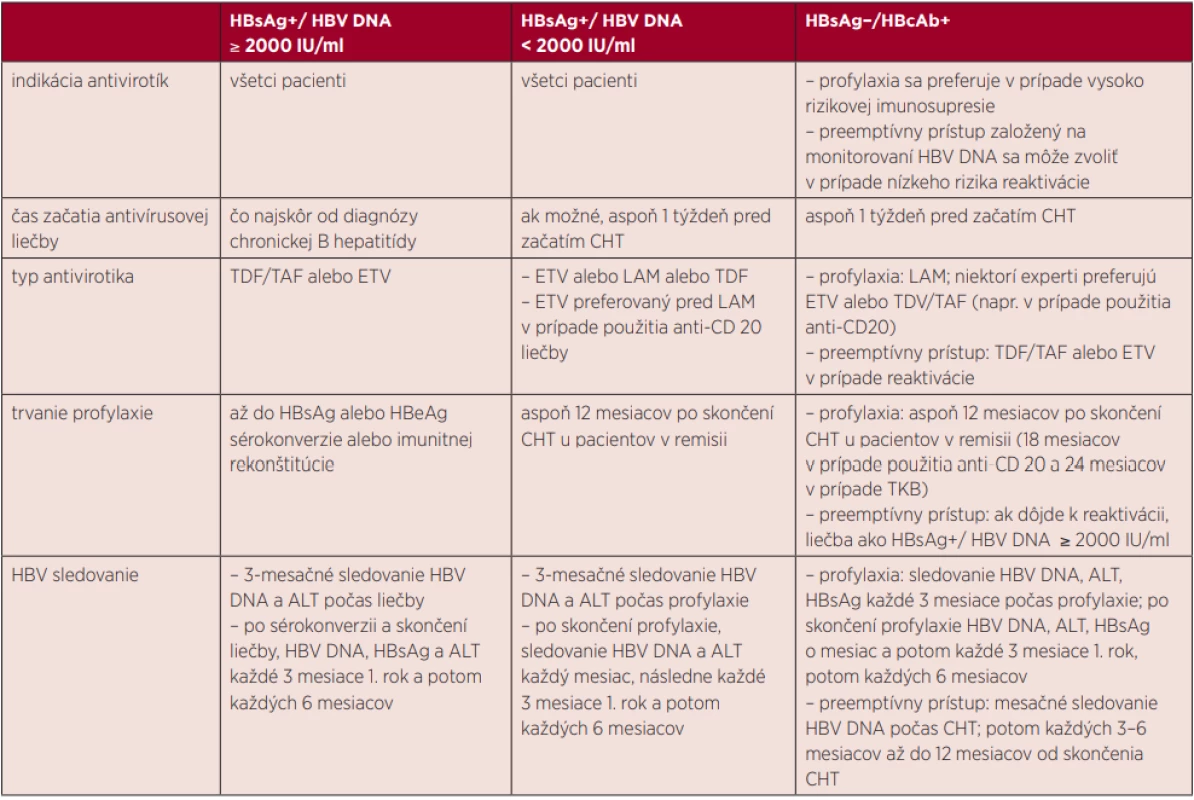
LAM – lamivudín, ETV – entekavir, TDF – tenofovir disoproxil, TAF – tenofovir alafenamid, ALT – alanín aminotransferáza, HBV – vírus hepatitídy typu B, HBsAg – povrchový HBV antigén, HBcAb – protilátky proti HBV jadrovému antigénu, TKB – transplantácia kmeňotvorných buniek, CHT – chemoterapia Hematologickí pacienti s chronickou vírusovou hepatitídou – s pozitívnou HBV DNA alebo s pozitívnou HCV RNA by mali byť vyšetrení ako každý iný chorý s chronickou hepatitídou B alebo C vrátane sonografického vyšetrenia pečene a elastografie. Pri fibróze F3 alebo F4 s sonograficky sa odporúča sledovať každých 6–12 mesiacov v rámci surveillance hepatocelulárneho karcinómu.
HBV reaktivácia u HBsAg pozitívnych pacientov
Všetci HBsAg pozitívni pacienti pred imunologickou liečbou by mali dostať HBV antivírusovú liečbu [32]. Liekom voľby je antivirotikum s vysokou genetickou bariérou, entekavir alebo tenofovir, či už ako tenofovir disoproxil (TDF) alebo tenofovir alafenamid (TAF) [15]. U pacientov s nízkou vírusovou náložou (HBV DNA < 2000 IU/ml) sa často používal aj lamivudín (LAM), hoci nové údaje predpokladajú benefit použitia vysokobariérových antivirotík. Jedná sa všetko o jednotabletkové režimy s dobrou toleranciou, dobrým bezpečnostným profilom, hoci s niekoľkými odlišnosťami. Po prvé, predchádzajúce užívanie LAM zvyšuje riziko vývoja mutácií, ktoré majú vplyv na efektívnosť ETV [33], zatiaľ čo TDF má porovnateľnú účinnosť u pacientov, ktorí už predtým mali skúsenosť s LAM [34]. Po druhé, zatiaľ čo ETV aj TDF vyžadujú úpravu dávky v prípade poškodenia funkcie obličiek, TDF sa neodporúča v prípade klírens kreatinínu pod 30 ml/min [35]. Okrem toho bol TDF spojený s prípadmi so zlyhaním obličiek a Fanconiho syndrómom, hoci tieto vedľajšie účinky boli prekonané TAF, čo je nové proliečivo tenofoviru, ktorý môže byť podávaný v nižších dávkach, čo vedie k podobným alebo dokonca aj vyšším hladinám tenofoviru a jeho metabolitov v cieľových bunkách a značne sa znižuje mimocieľová expozícia v obličkách [36, 37].
Pokiaľ ide o trvanie liečby, nie je známy spoľahlivý marker adekvátnej dĺžky liečby. V prípade pacientov s vysokou vírusovou náložou (HBV DNA ≥ 2000 IU/ml), najlepším koncovým bodom pre ukončenie HBV liečby je trvalá sérologická odpoveď, čo znamená stratu HBsAg a pre HBeAg-pozitívnych pacientov stratu HBeAg [32]. Avšak, sérologická odpoveď odráža imunitnú kontrolu HBV infekcie a je veľmi zriedkavá. Takže u väčšiny pacientov by mala antivírusová liečba pokračovať na neurčito [32]. U pacientov s vírusovou náložou HBV DNA < 2000 IU/ml ECIL odporúča pokračovať v profylaxii 12 mesiacov po ukončení imunosupresívnej liečby v prípade hematologickej remisie [21], pričom niektorí autori odporúčajú pokračovať v profylaxii 12–24 mesiacov po ukončení chemoterapie [21]. U niektorých chronických malignít sa podáva opakovaná, kontinuálna protinádorová liečba, preto v prípade absencie imunitného zotavenia by HBV profylaxia mala pravdepodobne pokračovať celoživotne.
HBV reaktivácia u HBsAg negatívnych a a-HBc pozitívnych pacientov
Vo všeobecnosti je prevalencia HBV reaktivácie nižšia u HBsAg-negatívnych a anti-HBc-pozitívnych pacientov ako u HBsAg-pozitívnych pacientov. Avšak keďže počet HBsAg-negatívnych a anti-HBc-pozitívnych pacientov výrazne prevyšuje HBsAg-pozitívnych pacientov a kvôli menej častému skríningu anti-HBc protilátok pred chemoterapiou, reaktivácia HBV u anti-HBc-pozitívnych jedincov je často neskoro diagnostikovaná a smrteľná [38].Tak ako u HBsAg-pozitívnych jedincov, riziko HBV reaktivácie závisí od typu imunosupresie. Imunosupresívnu liečbu možno rozdeliť na vysoko rizikovú (pacienti dostávajúci anti-CD20 alebo príjemcovia TKB), stredne rizikovú (anti-TNF, antracyklíny, cytokíny, tyrozín kinázové inhibítory) a nízko rizikovú (azatioprín, metotrexát alebo steroidy v akejkoľvek dávke menej ako týždeň) [39]. Vo vysoko rizikovej skupine je riziko reaktivácie okolo 41 % v prípade liečby rituximabom [40] a 40,8 % v prípade alogénnej TKB [41].
Na základe aktuálne dostupných informácií o riziku reaktivácie možno zvoliť jednu z dvoch odlišných stratégií: preemptívnu alebo profylaktickú.
Preemptívny alebo profylaktický prístup
Preemptívny prístup sa riadi opakovaným monitorovaním, zvyčajne mesačným sledovaním HBV-DNA spolu s HBsAg, a antivírusová liečba sa podáva hneď po detekcii HBV-DNA alebo HBsAg s cieľom zabráneniu výskytu vírusovej hepatitídy [42–44]. Táto stratégia sa vyhýba dlhodobému podávaniu protivírusového lieku v profylaxii, ale vyžaduje prísnu adhéziu k monitorovaciemu protokolu a konzultáciu špecialistu v prípade zvýšenia HBV-DNA. Nie je úplne jasné, či u pacientov s vysokým rizikom, progresia ku klinicky významnej hepatitíde môže trvať menej ako 1 mesiac, takže pre - emptívny prístup nemusí byť dostatočne rýchly, aby sa zabránilo hepatitíde. Preto by táto stratégia mala byť pravdepodobne vyhradená iba pre pacientov s nízkym rizikom reaktivácie.
Profylaxia spočíva v podávaní antivírusovej liečby od začiatku imunosupresie, tým pádom sa vyhýba potrebe častého sledovania HBV DNA ale s nevýhodou tabletového zaťaženia. Aj keď žiadna randomizovaná štúdia neporovnáva tieto dva prístupy, pre pacientov so stredne vysokým až vysokým rizikom reaktivácie HBV, by sa mala uprednostniť profylaxia, obzvlášť v prípade dlhotrvajúcej imunosupresívnej liečby alebo horšou compliance k monitorovaniu.
Vzhľadom k v súčasnosti preferovaným intenzívnejším chemoterapeutickým režimom väčšina súčasných kandidátov na chemoterapiu sa hodí skôr na profylaktickú ako preemptívnu stratégiu. Zhrnutie manažmentu pacientov s vyliečenou HBV infekciou poskytuje tabuľka 1.
Pokiaľ ide o voľbu antivirotika, vďaka svojmu priaznivému farmakoekonomickému profilu je možnosť podania LAM, zatiaľ čo ETV alebo TDF/TAF sú preferované niektorými odporúčaniami [21, 45]. V prípade preemptívnej liečby sú výhodné antivirotiká s vysokou genetickou bariérou, pretože je potrebná rýchla a efektívna virologická kontrola [45, 46].
Počas profylaxie sa odporúča sledovanie HBV DNA, HBsAg a ALT každé 3 mesiace. Profylaxia by mala vo všeobecnosti trvať aspoň 12 mesiacov od skončenia imunosupresívnej liečby a dlhšie (t.j. aspoň 18, resp. 24 mesiacov) v prípade použitia molekúl anti-CD20, resp. po TKB [15].
Obr. 2. Profylaxia HBV reaktivácie pacientov, vakcinácia a liečba pacientov a darcov 
HBV reaktivácia a transplantácia krvotvorných buniek
Kvôli hlbokej imunosupresii navodenej chemoterapiou pred alogénnou TKB a (vo väčšine prípadov) implementáciou nového imunitného systému, ktorý je naivný proti HBV po TKB, je riziko závažných komplikácií, vrátane fibrotizujúcej cholestatickej hepatitídy, spôsobených reaktiváciou HBV, veľmi vysoké v prípade HBsAg-pozitívnych pacientov [47, 48]. Riziko reaktivácie HBV je taktiež vysoké u HBsAg-negatívnych a anti-HBc pozitívnych pacientov, pričom oneskorenie medzi TKB a HBV reaktiváciou môže byť pomerne dlhé – až 40 % reaktivácií so objavilo po 4 rokoch od transplantácie v najväčšej štúdii [27] a do 85 % po 3 rokoch v malých sériách [26, 49].
Rizikové faktory pre reaktiváciu HBV u pacientov, ktorí podstúpili TKB sú nízke anti-HBs titre, použitie viacerých chemoterapeutík, GvHD a trvanie imunosupresie [50].
Odporúča sa očkovanie HBV séronegatívnych pacientov. Na dosiahnutie anti-HBs odpovede môžu byť potrebné vyššie dávky vakcíny u pacientov s oslabenou imunitou. Pacienti s anti-HBc protilátkami a bez anti-HBs protilátok môžu dosiahnuť ochrannú imunitu (protilátky proti HBs ≥10 IU/ l) prostredníctvom očkovania proti HBV [51].
HBsAg-pozitívni príjemcovia transplantátu s chronickou hepatitídou by mali dostať protivírusovú liečbu čo najskôr, pričom neaktívni nosiči by mali dostať profylaxiu. Vzhľadom na transplantáciu a stav s predĺženou a intenzívnou imunosupresiou a následným vysokým rizikom HBV reaktivácie, ETV alebo TDF by sa mali uprednostniť pred LAM, na základe údajov prenesených zo štúdií u lymfómov. Príjemcovia TKB s vyliečenou HBV infekciou by mali dostať prolongovanú anti-HBV profylaxiu (až do 24 mesiacov od transplantácie) a mali by byť monitorovaní ako pacienti vo vysokom riziku reaktivácie [32].
Anti-HBc-pozitívny darca kmeňových buniek
Existujú jasné dôkazy o tom, že HBV môže byť prenášaná z HBsAg-pozitívneho darcu na HBV-naivného príjemcu alebo na tých príjemcov, ktorí stratili ochrannú imunitu [52]. Následná infekcia má tendenciu k závažnému priebehu [53]. HBsAg-negatívne a anti-HBc-pozitívne transplantáty môžu tiež prenášať HBV na príjemcu, aj keď v nižšej frekvencii [54]. Rizikovým faktorom je detekcia HBV DNA v sére u darcu. Liečba oboch – darcu aj príjemcu a očkovanie príjemcu môže zabrániť prenosu HBV. Ako antivirotikum voľby možno použiť LAM [32], pričom trvanie podávania nie je jasne určené. Adoptívna imunita proti HBV môže byť prenesená z anti-HBs pozitívnych darcov. Imunizácia HBV naivných donorov kmeňových buniek môže indukovať HBV imunitu u príjemcov v priebehu niekoľkých dní až týždňov po transplantácii [55, 56]. Imunizácia darcov krvotvorných buniek je teoreticky jednoducho vykonateľná a prakticky bez rizika, hoci nemusí byť dostatok času dokončiť vakcinačnú schému pred zberom kmeňových buniek. Možnou alternatívou je zrýchlená vakcinačná schéma (dni 0, 10 a 21).
HCV
Najdôležitejším princípom HCV infekcie u hematologického pacienta je riziko významného zvýšenia pečeňových enzýmov spôsobených HCV exacerbáciou, ktorú možno definovať ako trojnásobné alebo výraznejšie zvýšenie sérových hladín ALT v neprítomnosti iných možných príčin pečeňového poškodenia [57]. HCV samotný bol uznaný za príčinu niektorých lymfoproliferatívnych porúch, vrátane indolentných (ako je lymfóm z marginálnych buniek, lymfoplazmocytový a folikulárny lymfóm, extranodálny so sliznicou asociovaný lymfóm) aj agresívnych (hlavne DLBCL) lymfómov [58, 60].
Exacerbácia HCV je imunitne sprostredkovaná a môže spôsobiť oneskorenie, prerušenie alebo zníženie dávok protinádorovej liečby. To môže znižovať celkové prežívanie a zriedkavo môže vyústiť aj do fulminantnej hepatitídy [58, 59]. Riziko akútnych vzplanutí u pacientov podstupujúcich chemoterapiu pre hematologické malignity sa zdá byť vyššie u tých, ktorí sú liečení režimami obsahujúcimi rituximab [58, 60]. Vzplanutia pečeňovej choroby a zriedkavé prípady zlyhania pečene boli tiež publikované u HCV RNA pozitívnych príjemcov kmeňotvorných buniek [61]. Riziko je však malé a vzhľadom na fakt, že TKB môže byť život zachraňujúci výkon, prítomnosť HCV RNA u príjemcov nepredstavuje kontraindikáciu pre TKB, obzvlášť v ére dostupných priamo pôsobiacich antivirotík (DAA) [58, 60].
Väčšina pacientov s chronickou HCV infekciou má HCV protilátky (HCV-Ab). Preto sa testovanie HCV-RNA zvyčajne neodporúča ako prvolíniový test v prípade negativity HCV-Ab, normálnych pečeňových enzýmoch a v neprítomnosti rizikových faktorov pre HCV infekciu [15]. Na druhej strane, najmä u príjemcov TKB, ale aj u iných hematologických pacientov môže dôjsť k strate HCV-Ab [62], preto v niektorých prípadoch, najmä ak je podozrenie na akútnu infekciu, alebo došlo k expozícii HCV, je nevyhnutné testovanie HCV RNA [63]. Anti-HCV protilátky môžu pretrvávať aj v prípade spontánneho alebo liečbou navodeného vyliečenia (HCV RNA je v tomto prípade negatívna).
Liečba HCV
V minulosti boli základom liečby interferón alfa, s použitím ribavirínu alebo bez neho. Boli však asociované s nízkou trvalou virologickou odpoveďou (SVR) a výraznými nežiaducimi účinkami. Od roku 2013, kedy boli schválené priamo pôsobiace antivirotiká (DAA), došlo k výraznému nárastu SVR, ktorá v súčasnosti presahuje 90 %, a taktiež k redukcii nežiaducich účinkov. Liečba sa skrátila na zvyčajných 8–12 týždňov. Väčšina molekúl je vysoko aktívna proti jednému alebo dvom HCV genotypom, zatiaľ čo iné, ako napríklad sofosbuvir a velpatasvir, majú pan-genotypovú aktivitu [64]. V prípade použitia DAA treba sledovať možné interakcie s liečivami a v prípade súbežnej HBV koinfekcie treba myslieť na možné riziko HBV reaktivácie [65, 66].
Cieľom liečby HCV infekcie je najmä prevencia významného zvýšenia pečeňových enzýmov počas chemoterapie, prevencia HCV exacerbácií a možnosť eradikácie HCV-asociovaných lymfoproliferatívnych porúch [67]. Možno zvoliť dve rozdielne stratégie liečby: DAA ako liečbu prvej línie pre hematologické ochorenie (v prípade indolentných lymfómov, ktoré nevyžadujú okamžitú chemoterapiu) alebo DAA ako liečbu druhej línie po chemoterapii (u pacientov s agresívnymi lymfómami) [68–70].
HCV a TKB
Ak nie je iná možnosť, je možný aj HCV RNA pozitívny donor. Mal by však byť ihneď konzultovaný so špecialistom a liečený DAA. Boli publikované prípady úspešnej liečby DAA v počiatočnej fáze po TKB. Cieľom by mala byť eradikácia HCV, pričom sa musí zvažovať výber antivirotík, ktoré nemajú žiadnu alebo málo interakcií s imunosupresívami [71].
HEV
Hepatitída typu E sa prenáša dominantne fekálno-orálne, najmä bravčovým mäsom, možný je však aj prenos krvnou transfúziou. Často prebieha subklinicky, u imunokompromitovaného pacienta je určité riziko chronickej infekcie. Diagnostika sa zakladá na stanovení protilátok a-HEV, prípadne HEV RNA [72, 73]. Liečba sa zakladá na znížení imunosupresie, prípadne podávaní ribavirínu [74]. HEV reaktivácia v hematológii je zriedkavá [75].
HAV
Prenos hepatitídy typu A je dominantne fekálno-orálny, priebeh ochorenia u imunokompromitovaného pacienta môže byť závažnejší najmä v prítomnosti preexistujúcej pečeňovej choroby. Diagnóza sa potvrdzuje serologicky dôkazom IgM protilátok, ktoré môžu byť falošne negatívne u imunosuprimovaných pacientov. TKB v prípade donora alebo recipienta s HAV virémiou sa neodporúča. Anti-HAV IgG negatívni pacienti by mali byť vakcinovaní proti A hepatitíde.
Záver
V posledných rokoch sa zmenili odporúčania a manažment vírusových hepatitíd u hematologických pacientov. Pribúdajú správy o riziku HBV reaktivácie aj v súvise s novými možnosťami protinádorovej liečby. Treba povedať, že napriek pokrokom v terapii aj vakcinácii, HBV zostáva naďalej nevyliečiteľnou, „záludnou“ chorobou a HBV reaktivácia pretrvávajúcim problémom, pričom chýbajú jasné prediktory rizika reaktivácie a markery imunologického zotavenia. Vzhľadom k uvedenému sú v rámci jednotlivých odporúčaní rôznych odborných spoločností určité rozdiely najmä v trvaní antivírusovej profylaxie, ako dlho a často má trvať monitoring HBV DNA najmä po ukončení profylaxie a podobne. Takisto nie sú stanovené najlepšie schémy vakcinácie a z nových antivírusových liekov bol v poslednom období zavedený do praxe iba nový derivát tenofoviru – TAF. Naopak v prípade hepatitídy typu C sa v praxi úspešne etablovali vysoko účinné a bezpečné priamo pôsobiace antivirotiká a pribúdajú aj správy o ich úspešnom použití u hematologických pacientov. CELL odporúča u každého pacienta pred transplantáciou vyšetriť HBsAg, a-HBc, a-HBs, a-HCV, a-HAV IgG. V prípade pozitivity HBsAg, a-HBc alebo a-HCV sa doplňuje vyšetrenie HBV DNA resp. HCV RNA, konzultuje sa špecialista (infektológ/hepatológ). V rámci profylaxie HBV reaktivácie sa vo väčšine prípadov preferujú vysoko bariérové antivirotiká (ETV, TDF, TAF), v prípade liečby HCV infekcie nové priamo pôsobiace antivirotiká. Vakcináciu proti B hepatitíde je ideálne začať 1–2 týždne pred chemoterapiou, resp. 3 mesiace po jej skončení. Možno použiť troj-dávkovú schému (0., 1. a 6. mesiac) alebo štvor-dávkovú (0., 1., 2., 6. mesiac), prípadne zrýchlenú schému (0., 10., 21. deň, 12. mesiac).
Vyhlásenie autorov o konflikte záujmov
Autori práce vyhlasujú, že v súvislosti s témou, vznikom a publikáciou tohto článku nemajú žiaden stret záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou.
Podiel autorov na príprave rukopisu
Príprava a písanie rukopisu: Soják Ľ, Drgoňa Ľ.
Pripomienky, revízia a schválenie finálnej verzie: všetci autori.
Do redakce doručeno dne 28. 7. 2020.
Přijato po recenzi dne 3. 8. 2020.
doc. MUDr. Luboš Drgoňa, CSc.
Klinika onkohematológie LFUK
Národný onkologický ústav
Klenová 1
833 10 Bratislava
e-mail: Lubos.Drgona@nou.sk
Zdroje
- WHO. Global hepatitis report. Geneva: 2017.
- Versluis J, Pas SD, Agteresch HJ, et al. Hepatitis E virus: an underestimated opportunistic pathogen in recipients of allogeneic hematopoietic stem cell transplantation. Blood. 2013;122(6):1079–1086.
- Wedemeyer H, Manns MP. Epidemiology, pathogenesis and management of hepatitis D: update and challenges ahead. Nat Rev Gastroenterol Hepatol. 2010;7(1):31–40.
- Kamar N, Dalton HR, Abravanel F, et al. Hepatitis E virus infection. Clin Microbiol Rev. 2014;27(1):116–138.
- Fujiwara S, Yokokawa Y, Morino K, et al. Chronic hepatitis E: a review of the literature. J Viral Hepat. 2014;21(2):78–89.
- Dalia S, Chavez J, Castillo JJ, et al. Hepatitis B infection increases the risk of non-Hodgkin lymphoma: a meta-analysis of observational studies. Leuk Res. 2013;37(9):1107–1115.
- Dal Maso L, Franceschi S. Hepatitis C virus and risk of lymphoma and other lymphoid neoplasms: a meta-analysis of epidemiologic studies. Cancer Epidemiol Prev Biomark. 2006;15(11):2078–2085.
- Salah-Eldin MA, Ebrahim MA, El-Sadda W. Clinical outcome of HCV--positive patients with diffuse large B-cell lymphoma treated with rituximab-based chemotherapy. Ann Hematol. 2014;93(11):1903–1911.
- Raimondo G, Allain JP, Brunetto MR, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection. J Hepatol. 2008;49(4):652–657.
- Lok AS, McMahon BJ. Chronic hepatitis B. Hepatology (Baltimore, MD). 2007;45(2):507–539.
- Terrault NA, Bzowej NH, Chang KM, Hwang JP, Jonas MM, Murad MH. AASLD guidelines for treatment of chronic hepatitis B. Hepatology. 2016;63 : 261–83.
- Chu CM, Liaw YF. HBsAg seroclearance in asymptomatic carriers of high endemic areas: appreciably high rates during a long-term follow-up. Hepatology. 2007;45 : 1187–1192.
- Raimondo G, Allain JP, Brunetto MR, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection. J Hepatol. 2008;49 : 652–657.
- Perrillo RP. Acute flares in chronic hepatitis B: the natural and unnatural history of an immunologically mediated liver disease. Gastroenterology. 2001;120(4):1009–1022.
- Mallet V, Van Bommel F, Doerig C, et al. Management of viral hepatitis in patients with haematological malignancy and in patients undergoing haemopoietic stem cell transplantation: recommendations of the 5th European Conference on Infections in Leukaemia (ECIL-5). Lancet Infect Dis. 2016;16(5):606–617.
- Torres HA, Davila M. Reactivation of hepatitis B virus and hepatitis C virus in patients with cancer. Nat Rev Clin Oncol. 2012;9(3):156–166.
- Hwang JP, Lok AS. Management of patients with hepatitis B who require immunosuppressive therapy. Nat Rev Gastroenterol Hepatol. 2014;11(4):209–219.
- McIvor C, Morton J, Bryant A, et al. Fatal reactivation of precore mutant hepatitis B virus associated with fi brosing cholestatic hepatitis after bone marrow transplantation. Ann Intern Med. 1994;121 : 274–275.
- Lenci I, Marcuccilli F, Tisone G, et al. Total and covalently closed circular DNA detection in liver tissue of long-term survivors transplanted for HBV-related cirrhosis. Dig Liver Dis. 2010; 42(8):578–584.
- Lok AS, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology. 2009;50 : 661–662.
- Sarmati L, Andreoni M, Antonelli G, et al. Recommendations for screening, monitoring, prevention, prophylaxis and therapy of hepatitis B virus reactivation in patients with haematologic malignancies and patients who underwent haematologic stem cell transplantation-a position paper. Clin Microbiol Infection. 2017;23(12):935–940.
- Awerkiew S, Daumer M, Reiser M, et al. Reactivation of an occult hepatitis B virus escape mutant in an anti-HBs positive, anti-HBc negative lymphoma patient. J Clinic Virol. 2007;38(1):83–86.
- Gärtner BC, Jung W, Welsch C, et al. Permanent loss of anti-HBc after reactivation of hepatitis B virus infection in an anti-HBs and anti-HBc-positive patient after allogeneic stem cell transplantation. J Clin Virol. 2007;38(2):146–148.
- Benwell N, Boan P, Raby E, et al. False positive hepatitis B virus core and surface antibodies due to intravenous immunoglobulin. Intern Med J. 2017;47(1):119–120.
- Yeo W, Chan TC, Leung NW, et al. Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab. J Clin Oncol. 2009;27 : 605–611.
- Knöll A, Boehm S, Hahn J, et al. Long-term surveillance of haematopoietic stem cell recipients with resolved hepatitis B: high risk of viral reactivation even in a recipient with a vaccinated donor. J Viral Hepat. 2007;14 : 478–483.
- Hammond SP, Borchelt AM, Ukomadu C, et al. Hepatitis B 9virus reactivation following allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant. 2009;15 : 1049–1059.
- Seto WK, Chan TS, Hwang YY, et al. Hepatitis B reactivation in patients with previous hepatitis B virus exposure undergoing rituximab-containing chemotherapy for lymphoma: a prospective study. J Clin Oncol. 2014;32 : 3736–3743.
- Evens AM, Jovanovic BD, Su YC, et al. Rituximab-associated hepatitis B virus (HBV) reactivation in lymphoproliferative diseases: meta-analysis and examination of FDA safety reports. Ann Oncol. 2011;22 : 1170–1180.
- Pyrpasopoulou A, Douma S, Vassiliadis T, et al. Reactivation of chronic hepatitis B virus infection following rituximab administration for rheumatoid arthritis. Rheumatol Int. 2011;31 : 403–404.
- Mitka M. FDA: Increased HBV reactivation risk with ofatumumab or rituximab. JAMA. 2013;310 : 1664.
- EASL. Clinical practice guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370–398.
- Lee J-H, Cho Y, Lee DH, et al. Prior exposure to lamivudine increases entecavir resistance risk in chronic hepatitis B Patients without detectable lamivudine resistance. Antimicrob Agents Chemother. 2014;58(3):1730–1737.
- Baran B, Soyer OM, Ormeci AC, et al. Efficacy of tenofovir in patients with Lamivudine failure is not different from that in nucleoside/nucleotide analogue-naive patients with chronic hepatitis B. Antimicrob Agents Chemother. 2013;57(4):1790–1796.
- European, Medicines, Agency. Tenofovir disoproxil fumarate – Drug monograph.
- European, Medicines, Agency. Tenofovir alafenamide – Drug monograph.
- Ray AS, Fordyce MW, Hitchcock MJ. Tenofovir alafenamide: a novel prodrug of tenofovir for the treatment of human immunodeficiency virus. Antiviral Res. 2016;125 : 63–70.
- Dervite I, Hober D, Morel P. Acute hepatitis B in a patient with antibodies to hepatitis B surface antigen who was receiving rituximab. N Engl J Med. 2001;344 : 68–69.
- Reddy KR, Beavers KL, Hammond SP, et al. American Gastroenterological Association Institute guideline on the prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy. Gastroenterology. 2015;148(1):215–219.
- Seto WK, Chan TS, Hwang YY, et al. Hepatitis B reactivation in patients with previous hepatitis B virus exposure undergoing rituximab-containing chemotherapy for lymphoma: a prospective study. J Clin Oncol. 2014;32 : 3736–3743.
- Mikulska M, Nicolini L, Signori A, et al. Hepatitis B reactivation in HBsAg-negative/HBcAb-positive allogeneic haematopoietic stem cell transplant recipients: risk factors and outcome. Clin Microbiol Infect. 2014;20:O694–O701.
- Hsu C, Tsou HH, Lin SJ, et al. Chemotherapy-induced hepatitis B reactivation in lymphoma patients with resolved HBV infection: a prospective study. Hepatology (Baltimore, MD). 2014;59(6):2092–2100.
- Fukushima N, Mizuta T, Tanaka M, et al. Retrospective and prospective studies of hepatitis B virus reactivation in malignant lymphoma with occult HBV carrier. Ann Oncol. 2009;20(12):2013–2017.
- Law MF, Ho R, Cheung CK, et al. Prevention and management of hepatitis B virus reactivation in patients with hematological malignancies treated with anticancer therapy. World J Gastroenterol. 2016;22(28):6484–6500.
- Buti M, Manzano ML, Morillas RM, et al. Randomized prospective study evaluating tenofovir disoproxil fumarate prophylaxis against hepatitis B virus reactivation in anti-HBc-positive patients with rituximab-based regimens to treat hematologic malignancies: the Preblin study. PloS One. 2017;12(9):e0184550.
- Nakamoto S, Kanda T, Nakaseko C, et al. Reactivation of hepatitis B virus in hematopoietic stem cell transplant recipients in Japan: efficacy of nucleos(t)ide analogues for prevention and treatment. Int J Mol Sci. 2014;15(11):21455–21467.
- Chen PM, Fan S, Liu CJ, et al. Changing of hepatitis B virus markers in patients with bone marrow transplantation. Transplantation. 1990;49 : 708–713.
- Reed EC, Myerson D, Corey L, Meyers JD. Allogeneic marrow transplantation in patients positive for hepatitis B surface antigen. Blood. 1991;77 : 195–200.
- Onozawa M, Hashino S, Izumiyama K, et al. Progressive disappearance of anti-hepatitis B surface antigen antibody and reverse seroconversion after allogeneic hematopoietic stem cell transplantation in patients with previous hepatitis B virus infection. Transplantation. 2005;79 : 616–619.
- Viganò M, Vener C, Lampertico P, et al. Risk of hepatitis B surface antigen seroreversion after allogeneic hematopoietic SCT. Bone Marrow Transplant. 2011;46 : 125–131.
- Chakvetadze C, Bani-Sadr F, Le Pendeven C, et al. Serologic response to hepatitis B vaccination in HIV-Infected patients with isolated positivity for antibodies to hepatitis B core antigen. Clin Infect Dis. 2010;50 : 1184–1186.
- Locasciulli A, Alberti A, Bandini G, et al. Allogeneic bone marrow transplantation from HBsAg+ donors: a multicenter study from the Gruppo Italiano Trapianto di Midollo Osseo (GITMO). Blood. 1995;86 : 3236–3240.
- Lau GKK, Lie AKW, Kwong YL, et al. A case-controlled study on the use of HBsAg-positive donors for allogeneic hematopoietic cell transplantation. Blood. 2000;96 : 452–458.
- Hui CK, Sun J, Au WY, et al. Occult hepatitis B virus infection in hematopoietic stem cell donors in a hepatitis B virus endemic area. J Hepatol. 2005;42 : 813–819.
- Lindemann M, Barsegian V, Runde V, et al. Transfer of humoral and cellular hepatitis B immunity by allogeneic hematopoietic cell transplantation. Transplantation. 2003;75 : 833–838.
- Lau GK, Suri D, Liang R, et al. Resolution of chronic hepatitis B and anti-HBs seroconversion in humans by adoptive transfer of immunity to hepatitis B core antigen. Gastroenterology. 2002;122 : 614–624.
- Mahale P, Thomas SK, Kyvernitakis A, et al., Management of multiple myeloma complicated by hepatitis c virus reactivation: The role of new antiviral therapy. Open Forum Infect Dis. 2016;3(1):ofv211.
- Mahale P, Kontoyiannis DP, Chemaly RF, et al. Acute exacerbation and reactivation of chronic hepatitis C virus infection in cancer patients. J Hepatol. 2012;57(6):1177–1185.
- Besson C, Canioni D, Lepage E, et al. Characteristics and outcome of diffuse large B-cell lymphoma in hepatitis C virus-positive patients in LNH 93 and LNH 98 Groupe d’Etude des Lymphomes de l’Adulte programs. J Clin Oncol. 2006;24(6):953–960.
- Coppola N, Pisaturo M, Guastafi E, et al. Increased hepatitis C viral load and reactivation of liver disease in HCV RNA-positive patients with onco-haematological disease undergoing chemotherapy. Dig Liver Dis. 2012;44 : 49–54.
- Watanabe T, Tanaka Y. Reactivation of hepatitis viruses following immunomodulating systemic chemotherapy. Hepatol Res. 2013;43 : 113–121.
- De Rosa G, Gobbo ML, De Renzo A, et al. High prevalence of hepatitis C virus infection in patients with B-cell lymphoproliferative disorders in Italy. Am J Hematol. 1997;55(2):77–82.
- Kyvernitakis A, Mahale P, Popat UR, et al. Hepatitis C virus infection in patients undergoing hematopoietic cell transplantation in the era of direct-acting antiviral agents. Biol Blood Marrow Transpl. 2016;22(4):717–722.
- Asselah T, Boyer N, Saadoun D, et al. Direct-acting antivirals for the treatment of hepatitis C virus infection: optimizing current INF-free treatment and future perspectives. Liver Int. 2016;36(S1):47–57.
- Ende AR, Kim NH, Yeh MM, et al. Fulminant hepatitis B reactivation leading to liver transplantation in a patient with chronic hepatitis C treated with simeprevir and sofosbuvir: a case report. J Med Case Rep. 2015;9(1):164.
- Burgess S, Partovi N, Yoshida EM, et al. Drug interactions with direct-acting antivirals for hepatitis C: implications for HIV and transplant patients. Ann Pharmacother. 2015;49(6):674–687.
- Peveling-Oberhag J, Arcaini L, Bankov K, et al. The anti-lymphoma activity of antiviral therapy in HCV-associated B-cell non-Hodgkin lymphomas: a meta-analysis. J Viral Hepat. 2016;23(7):536–544.
- Arcaini L, Vallisa D, Rattotti S, et al. Antiviral treatment in patients with indolent B-cell lymphomas associated with HCV infection: a study of the Fondazione Italiana Linfomi. Ann Oncol. 2014;25(7):1404–1410.
- Galati G, Rampa L, Vespasiani-Gentilucci U, et al. Hepatitis C and double-hit B cell lymphoma successfully treated by antiviral therapy. World J Hepatol. 2016;8(29):1244–1250.
- Persico M, Aglitti A, Caruso R, et al. Efficacy and safety of new direct antiviral agents in HCV infected patients with diffuse large B cell nonhodgkin lymphoma. Hepatology (Baltimore, MD). 2017;67(1):48–55.
- Piñana J, Serra M, Hernández-Boluda J, et al. Successful treatment of hepatitis C virus infection with sofosbuvir and simeprevir in the early phase of an allogeneic stem cell transplant. Transpl Infect Dis. 2016;18(1):89–92.
- Versluis J, Pas SD, Agteresch HJ, et al. Hepatitis E virus: an underestimated opportunistic pathogen in recipients of allogeneic hematopoietic stem cell transplantation. Blood. 2013;122(6):1079–1086.
- Tavitian S, Péron J-M, Huynh A, et al. Hepatitis E virus excretion can be prolonged in patients with hematological malignancies. J Clin Virol. 2010;49(2):141–144.
- DebingY, Emerson SU, Wang Y, et al. Ribavirin inhibits in vitro hepatitis E virus replication through depletion of cellular GTP pools and is moderately synergistic with alpha interferon. Antimicrob Agents Chemother. 2014;58(1):267–273.
- Le Coutre P, Meisel H, Hofmann J, et al. Reactivation of hepatitis E infection in a patient with acute lymphoblastic leukaemia after allogeneic stem cell transplantation. Gut. 2009;58(5):699–702.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Léčba Erdheimovy-Chesterovy choroby
- Vysazování inhibitorů tyrozinkináz u pacientů s chronickou myeloidní leukemií ve studiích a klinické praxi
- Cílený rozklad obtížně inhibovatelných proteinů způsobujících maligní hematologická onemocnění pomocí dvoufunkčních molekul využívajících polyubikvitinaci a rozklad v proteazomech
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Nekrobiotický xantogranulom asociovaný s monoklonální gamapatií: popis případu a přehled léčebných možností
- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Dědičná trombocytopenie na podkladě patogenní varianty genu MYH9 diagnostikovaná u dospělé ženy
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Dopisy redakci
- Dopisy redakci
- Za pani profesorkou MUDr. Adrienou Sakalovou, DrSc.
- Zemřela MUDr. Zdeňka Vorlová, CSc.
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Léčba Erdheimovy-Chesterovy choroby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



