-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
Characteristics and results of treatment of younger patients less than 60 years old with AML: analysis of real data from the Czech DATOOL-AML database
The aim of this work was to analyse retrospectively real clinical data from AML patients aged 18-60 years diagnosed and treated over the past 13 years in one of the six haemato-oncology centres in the Czech Republic that form the collaborative CELL group. Data from these centres was compared with the survival results of patients treated in clinical trials and data from renowned institutions abroad. The DATOOL-AML database was used as a source of this data. A total of 940 patients aged 18-60 years were diagnosed and treated for de novo AML in the CELL group centres between 2007 and 2018. Based on cytogenetic and molecular genetic results, it was possible to determine some type of known genetically defined prognostic marker in 66% of patients. An intensive therapeutic approach was initiated in 93.6% of patients (N=788), of which 93.4% (N=736) received the “3+7” induction regimen as first line therapy. Complete remission after induction therapy was achieved in 72% of patients. The risk of early death during induction chemotherapy was 4%. Allogeneic haematopoietic stem cell transplantation (HSCT) was performed in first remission in 53.8% with intermediate-I risk; 57.3% of patients with intermediate-II risk and 49.3% of patients with high risk. Allogeneic HSCT in first complete remission led to significant prolongation of overall survival in patients with normal karyotype and concurrent FLT3-ITD+/NPM1-, as well as in patients with intermediate risk and complex karyotype. The median survival of all patients in our sample was 26.5 months and 39.2% were alive five years from diagnosis. The results of care for younger AML patients in Czech haemato-oncology centres correspond to those of large clinical trials as well as renowned international institutions. It is the authors´ view that despite all the limitations of such a comparison this is to a certain extent due to centralisation of such type of care in the Czech Republic in highly specialised centres.
Keywords:
AML – younger patients – database – register – standard clinical practice – clinical study – centralised care – centre effect
Autoři: L. Semerád 1; Z. Šustková 1; P. Cetkovský 2; P. Jindra 7; Z. Kořístek 6; J. Novák 4; T. Szotkowski 5; Z. Ráčil 2; J. Vydra 2; B. Weinbergerová 1; P. Žák 3; J. Mayer 1
Působiště autorů: Interní hematologická a onkologická klinika FN Brno 1; Ústav hematologie a krevní transfuze, Praha 2; IV. interní hematologická klinika FN Hradec Králové 3; Interní hematologická klinika FN Královské Vinohrady a 3. LF UK 4; Hemato-onkologická klinika FN Olomouc 5; Klinika hematoonkologie FN Ostrava 6; Hemato-onkologické oddělení FN Plzeň 7
Vyšlo v časopise: Transfuze Hematol. dnes,26, 2020, No. 3, p. 212-225.
Kategorie: Původní práce
Cílem této práce je retrospektivní analýza reálných klinických dat nemocných s akutní myeloidní leukemií (AML) ve věku 18–60 let, kteří byli za uplynulých 13 let diagnostikováni a léčeni v některém ze šesti hemato-onkologických center v České republice, která v tomto období spolupracovala v rámci skupiny CELL. Data z těchto center byla porovnána s výsledky přežití nemocných léčených v klinických studiích a oproti datům z renomovaných zahraničních pracovišť. Jako zdroj dat pro analýzu byla použita databáze DATOOL-AML. V období 2007–2018 bylo v centrech skupiny CELL diagnostikováno celkem 940 nemocných ve věku 18–60 let s novou AML. U 66 % nemocných bylo možné na základě cytogenetického a molekulárně genetického vyšetření určit některý ze známých geneticky definovaných prognostických markerů. Intenzivní léčebný přístup byl zahájen u 93,6 % nemocných (N = 788), z nichž u 93,4 % (N = 736) nemocných byla jako první terapie podána indukční chemoterapie v režimu „3+7“. Kompletní remise onemocnění po ukončení indukční léčby bylo dosaženo u 72 % nemocných. Riziko časného úmrtí v průběhu indukční chemoterapie byla 4 %. Alogenní transplantace krvetvorby (HSCT) byla v první kompletní remisi provedena u 53,8 % nemocných ve středním-I riziku, 57,3 % nemocných ve středním-II riziku a 49,3 % nemocných ve vysokém riziku. Provedení alogenní HSCT v první kompletní remisi vedlo k významnému prodloužení celkového přežití nemocných s normálním karyotypem a zároveň FLT3-ITD+/NPM1-, stejně jako nemocných se středně rizikovými a komplexními změnami karyotypu. Medián přežití všech nemocných v našem souboru byl 26,5 měsíce, 5 let od zjištění diagnózy se dožilo 39,2 % nemocných. Výsledky péče o mladší nemocné s AML v českých hemato-onkologických centrech korespondují s výsledky léčby dosahovanými ve velkých klinických studiích i na renomovaných zahraničních pracovištích, k čemuž podle názoru autorů při vědomí všech limitací tohoto srovnání přispívá centralizace péče o tyto nemocné do center vysoce specializované péče v České republice.
Souhrn
Cílem této práce je retrospektivní analýza reálných klinických dat nemocných s akutní myeloidní leukemií (AML) ve věku 18–60 let, kteří byli za uplynulých 13 let diagnostikováni a léčeni v některém ze šesti hemato-onkologických center v České republice, která v tomto období spolupracovala v rámci skupiny CELL. Data z těchto center byla porovnána s výsledky přežití nemocných léčených v klinických studiích a oproti datům z renomovaných zahraničních pracovišť. Jako zdroj dat pro analýzu byla použita databáze DATOOL-AML. V období 2007–2018 bylo v centrech skupiny CELL diagnostikováno celkem 940 nemocných ve věku 18–60 let s novou AML. U 66 % nemocných bylo možné na základě cytogenetického a molekulárně genetického vyšetření určit některý ze známých geneticky definovaných prognostických markerů. Intenzivní léčebný přístup byl zahájen u 93,6 % nemocných (N = 788), z nichž u 93,4 % (N = 736) nemocných byla jako první terapie podána indukční chemoterapie v režimu „3+7“. Kompletní remise onemocnění po ukončení indukční léčby bylo dosaženo u 72 % nemocných. Riziko časného úmrtí v průběhu indukční chemoterapie byla 4 %. Alogenní transplantace krvetvorby (HSCT) byla v první kompletní remisi provedena u 53,8 % nemocných ve středním-I riziku, 57,3 % nemocných ve středním-II riziku a 49,3 % nemocných ve vysokém riziku. Provedení alogenní HSCT v první kompletní remisi vedlo k významnému prodloužení celkového přežití nemocných s normálním karyotypem a zároveň FLT3-ITD+/NPM1-, stejně jako nemocných se středně rizikovými a komplexními změnami karyotypu. Medián přežití všech nemocných v našem souboru byl 26,5 měsíce, 5 let od zjištění diagnózy se dožilo 39,2 % nemocných. Výsledky péče o mladší nemocné s AML v českých hemato-onkologických centrech korespondují s výsledky léčby dosahovanými ve velkých klinických studiích i na renomovaných zahraničních pracovištích, k čemuž podle názoru autorů při vědomí všech limitací tohoto srovnání přispívá centralizace péče o tyto nemocné do center vysoce specializované péče v České republice.
Klíčová slova:
AML – mladší nemocní – databáze – registr – běžná klinická praxe – klinické studie – centralizace péče – centrový efekt
ÚVOD
Akutní myeloidní leukemie (AML) patří mezi onkologická onemocnění s velmi závažnou prognózou. Základ kurativní léčby AML tvoří již od sedmdesátých let 20. století podání několika cyklů agresivní cytostatické chemoterapie a u nemocných s vysokým rizikem relapsu provedení alogenní transplantace krvetvorby [1, 2]. Kurativní léčba je spojena s rizikem úmrtí v důsledku toxicity na straně jedné a rizikem relapsu onemocnění z důvodu nedostatečné efektivity na straně druhé. Profylaktické podávání posakonazolu v průběhu indukční chemoterapie a vysoce účinná antibiotická léčba umožnily snížení rizika časného úmrtí v důsledku toxicity kurativní léčby z 16–18 % v devadesátých letech 20. století na 3–4 % v letech 2006–2009 [3]. Avšak i tak se pěti let od stanovení diagnózy dožívá pouze 40–50 % kurativně léčených nemocných [4]. Problémem zůstává závažná prognóza nemocných s relabovaným, případně primárně refrakterním onemocněním a úmrtí v důsledku komplikací spojených s alogenní transplantací krvetvorby (HSCT) [5].
V nedávné době byly v Evropské unii registrovány dva nové přípravky cílené léčby určené pro intenzivní léčbu mladších nemocných s de novo AML. Jedná se o midostaurin a gemtuzumab ozogamicin, které je možno kombinovat se standardní cytostatickou léčbou a které umožňují dosáhnout lepšího přežití některým skupinám nemocných s AML [7, 8, 9]. Efektivita a bezpečnost obou těchto léčivých přípravků byla před uvedením do klinické praxe prokázána v klinických studiích. Výsledky klinických studií však mohou být zkresleny faktory, mezi které patří omezení pro zařazení nemocných do studie a tzv. centrový efekt. Účinnost nových léčivých přípravků v běžné klinické praxi tak nemusí odpovídat účinnosti dosahované v klinických studiích.
Ve vyspělých zemích Evropy a Severní Ameriky je v rámci klinických studií léčeno cca 25 % dospělých nemocných s AML [10]. Nemocní s AML zařazení do klinických studií jsou v průměru mladší, mají lepší ECOG skóre, méně komorbidit a méně zastoupený sekundární typ onemocnění oproti nemocným, se kterými se setkáváme v běžné klinické praxi [11]. Bylo prokázáno, že přežití nemocných s AML, kterým nebyla účast v klinické studii nabídnuta a byli léčeni standardní kurativní léčbou mimo studii, je horší oproti nemocným, kteří v rámci stejného pracoviště léčeni v klinické studii byli. Naproti tomu nemocní, kterým účast v klinické studii nabídnuta byla, ale účast odmítli, vykazují podobné výsledky jako nemocní léčení ve studii [12]. Klinické studie, především fáze I a II, jsou navíc prováděny ve vysoce specializovaných univerzitních centrech, která mají zkušenosti s léčbou desítek leukemických nemocných ročně. Je prokázáno, že centralizace léčby nemocných s AML na vysoce specializovaná pracoviště hematologické péče s velkým ročním obratem nemocných je spojena s nižším rizikem časného úmrtí v průběhu intenzivní chemoterapie [13, 14], vyšší pravděpodobností dosažení kompletní remise onemocnění [15] a nižší úmrtností v průběhu alogenní HSCT [16–18].
Zkreslení výsledků klinických studií je možné korigovat analýzou reálných dat z databází a národních registrů nemocných s AML [19]. Ve světě je největším registrem nemocných s maligními chorobami americký registr SEER (Surveillance, Epidemiology and End Results registry), který vznikl v roce 1973 a který v současné době pokrývá 34,6 % populace Spojených států amerických [20]. Registr SEER obsahuje kromě základních epidemiologických dat také podrobné informace o podané léčbě a přežití nemocných. V Evropě se vyznačují vysokou kvalitou i rozsahem dat švédský a dánský registr akutních leukemií, které fungují od roku 1997 [21], respektive od roku 2000 [22]. Dalším dobrým příkladem jsou registry hematologických malignit v Nizozemsku [23] a anglický Národní onkologický registr, jehož počátky zasahují až do roku 1971 [24]. Všechny tyto registry obsahují podrobné informace o podané léčbě, komplikacích a sledují přežití nemocných. V České republice (ČR) poskytuje elementární data o epidemiologii a přežití nemocných český Národní onkologický registr (NOR) s povinným hlášením všech případů maligních onemocnění diagnostikovaných na území ČR [25]. Na rozdíl od výše uvedených zahraničních registrů však český NOR neumožňuje provádět detailní analýzy dat týkajících se hematologických malignit, a to z toho důvodu, že neobsahuje informace o cytogenetických a molekulárně genetických abnormalitách a informace o přesném typu podané chemoterapie.
Stále sílící potřeba dostupnosti kvalitních dat z běžné klinické praxe v České republice vyústila v roce 2007 k vytvoření databáze DATOOL-AML (Database of Acute Leukemia Tool), obsahující detailní informace o přesném typu AML, rizikové skupině, podané léčbě, komplikacích a o přežití nemocných s AML léčených na českých hemato-onkologických pracovištích univerzitního typu. Všechna tato pracoviště spolupracují v rámci České leukemické skupiny pro život – skupiny CELL (the Czech Leukemia Study Group for Life) [26]. Vzhledem k centralizaci péče o mladší nemocné s AML do těchto center vysoce specializované péče v ČR dosáhla databáze DATOOL-AML celonárodního charakteru. Cílem naší práce je retrospektivní analýza reálných epidemiologických, genetických a klinických charakteristik nemocných s AML ve věku 18–60 let, kteří byli intenzivně léčeni v letech 2007–2019 v hematologických centrech spolupracujících v rámci České leukemické skupiny pro život (CELL) a kteří byli zadáni do databáze DATOOL-AML. Data z běžné klinické praxe byla následně porovnána s výsledky přežití nemocných léčených výhradně v rámci klinických studií a dále s reálnými výsledky přežití nemocných v jiných vyspělých zemích. Na základě těchto informací byl poté s vědomím všech limitací hodnocen vliv organizace hemato-onkologické péče v České republice na výsledky léčby mladších nemocných s AML.
METODY
Pacienti
Do analýzy byli zařazeni všichni pacienti ve věku 18–60 let s nově zjištěnou AML, kteří byli diagnostikováni v období od 1. 1. 2007 do 31. 12. 2018 v některém ze šesti hematologických center v České republice spolupracujících v tomto období v rámci skupiny CELL. Data pro analýzu byla získána z databáze DATOOLAML. Diagnóza AML byla u jednotlivých nemocných stanovena lokálně na základě vyšetření kostní dřeně, případně periferní krve, tak jak vyžaduje definice Světové zdravotnické organizace (WHO) z roku 2008 [27].
Vstupní vyšetření a stanovení rizika AML
U všech nemocných byl vstupně vyšetřen imunofenotyp a stanoven karyotyp leukemických buněk. Vyšetření molekulárně genetických markerů nebylo mezi jednotlivými centry standardizováno a probíhalo podle zvyklostí daného centra. Ve sledovaném období byl u většiny nemocných v době diagnózy znám mutační stav genu FLT3-ITD a NPM1, který byl brán v potaz při stanovení rizika onemocnění, a byl použit v analýzách přežití. Kromě těchto dvou genů byl nepravidelně u nemocných vyšetřován mutační stav celé řady dalších genů; některé z těchto genů jsou uvedeny ve výsledcích, nejsou však použity pro analýzu přežití nemocných. Informace o alelickém poměru mutace FLT3-ITD nebyla ve většině případů dostupná a taktéž není v analýze zohledněna. Riziko onemocnění bylo stanoveno jednak na základě čistě cytogenetické klasifikace MRC z roku 1998 [6] a dále na základě doporučení Evropské leukemické sítě (European LeukemiaNet, ELN) z roku 2010 [28], která byla použita jako nosná prognostická klasifikace pro analýzy přežití jednotlivých skupin nemocných. Vzhledem ke sledovanému období není v analýze uváděna pozdější klasifikace ELN z roku 2017 [29], která bere v potaz alelický poměr mutace FLT3-ITD a mutační stav genů RUNX1, ASXL1, TP53, který ve většině případů není znám.
Léčebné postupy
Léčba nemocných zařazených do analýzy nebyla standardizována společným léčebným protokolem, probíhala podle zvyklostí jednotlivých center, které principiálně vycházejí z platných doporučení ELN [28, 29]. Nové přípravky cílené léčby midostaurin a gemtuzumab ozogamicin nebyly ve sledovaném období registrovány pro léčbu AML a nemocným nebyly rutinně podávány. Indikace k provedení alogenní transplantace krvetvorných buněk (HSCT) rovněž nebyly standardizovány společným protokolem. Přístup k alogenní HSCT ve většině případů vycházel z platných doporučení EBMT (European Society for Blood and Marrow Transplantation) [30]. Pro analýzu výsledků léčby byli vynecháni pacienti s akutní promyelocytární leukemií (APL).
Statistické zpracování
Jednotlivé rozdíly mezi dvěma věkovými skupinami (18–49 let a 50–60 let) byly statisticky hodnoceny pomocí Fisherova exaktního testu. Stejný statistický test byl zvolen i v případě hodnocení rozdílů efektu jednotlivých typů cyklu indukční chemoterapie. Pro hodnocení přežití byl u jednotlivých rizikových skupin a podskupin podle klasifikace ELN 2010 stanoven medián EFS (event free survival) a medián OS (overall survival). Pro větší přesnost výsledků je u jednotlivých hodnot mediánu EFS i OS uvedeno interkvartilové rozpětí (IQR) dané hodnoty. Pokud mediánu přežití v době sledování souboru nebylo dosaženo, ve výsledcích je uvedeno N.R. (not reached). Hodnoty tříletého a pětiletého celkového přežití jsou uvedeny v procentech spolu s hodnotami 95% intervalu spolehlivosti (95% CI). Rozdíly v přežití mezi jednotlivými rizikovými skupinami byly statisticky hodnoceny pomocí standardního log-rank testu. Pro hodnocení vlivu alogenní transplantace krvetvorby na přežití nemocných byla použita landmark analýza.
VÝSLEDKY
V období 1. 1. 2007 až 31. 12. 2018 bylo v centrech CELL diagnostikováno a do databáze DATOOL-AML zařazeno celkem 940 nemocných ve věku 18–60 let s novou AML. Medián sledování byl 27,8 měsíce. Muži tvořili mírnou většinu nemocných (51,3 %), medián věku sledované skupiny byl 49 let. Základní charakteristiky souboru jsou popsány v tabulce 1, ve které byli nemocní za účelem sledování trendů rozděleni podle mediánu věku do dvou přibližně stejně velkých věkových kategorií, a to kategorie 18–49 let a kategorie 50–60 let. Ve věkové kategorii 50–60 let bylo více nemocných se sekundárním typem AML, vzniklých v terénu myelodysplastického syndromu nebo Ph-negativního myeloproliferativního onemocnění (17,3 % vs. 7,4 %, P = 0,0001). Nemocní ve věku 50–60 let jsou na základě těchto skutečností častěji klasifikováni do kategorie AML spojené s myelodysplazií (23,1 % vs. 12,5 %, P = 0,0102), a to zejména na úkor úbytku nemocných v kategorii AML s rekurentní genetickou abnormalitou, která je naopak častější u nemocných mladších (38,8 % vs. 47,2 %, P = 0,0001). Jak EFS (12,4 vs. 16,7 měsíce, P = 0,0066), tak OS (17,8 vs. 53,8 měsíce, P = 0,0000) nemocných ve věku 50–60 let bylo významně kratší oproti nemocným ve věku 18–49 let.
Tab. 1. Základní charakteristika souboru 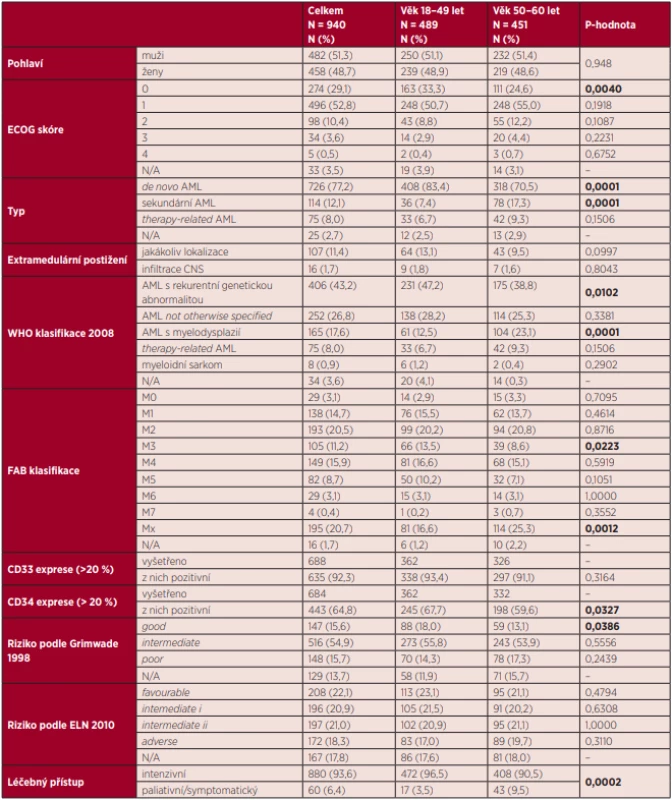
ECOG – Eastern Cooperative Oncology Group, N/A – neuvedeno, AML – akutní myeloidní leukemie, CNS – centrální nervový systém, WHO – World Health Organization, FAB – francouzsko- -americko-britská, ELN – European LeukemiaNet Molekulární markery vyšetřované a sledované u nemocných s AML v době diagnózy jsou uvedeny v grafu 1. Nejčastěji byla prokazována mutace v genu NPM1 (29,0 %) a mutace FLT3-ITD (21,8 %). Mutace genu CEBPA byla v době diagnózy prokázána méně často, a to pouze u 7,2 % nemocných, přičemž bialelická mutace, která je spojena s dobrou prognózou onemocnění, byla zjištěna pouze u 2,4 % nemocných. Procentuální zastoupení nemocných v jednotlivých rizikových skupinách podle ELN klasifikace z roku 2010 je v obou sledovaných věkových kategoriích podobné. V našem souboru bylo zařazeno 26,9 % nemocných do nízkého rizika, 25,4 % nemocných do středního-I rizika a 25,5 % do středního-II rizika, ve vysokém riziku bylo 22,3 % nemocných. Na základě výsledků cytogenetického vyšetření a vyšetření mutací NPM1, FLT3-ITD a CEBPA bylo možno stanovit některý z geneticky definovaných prognostických markerů u 66 % nemocných, zbylých 34 % nemocných nemělo v době diagnózy zjištěn nebo vyšetřen žádný genetický prognostický marker. Podrobné zastoupení jednotlivých rizikových skupin vycházející z ELN 2010 klasifikace je uvedeno v grafu 2.
Graf 1. Frekvence záchytu nejčastěji vyšetřovaných markerů v době stanovení diagnózy AML
Pozn.: N značí, u kolika nemocných v souboru byl daný marker vyšetřen.
Graf 2. Zastoupení jednotlivých cytogeneticky a molekulárně geneticky definovaných skupin
Pozn.: V době diagnózy byl prokázán některý z cytogenetických nebo molekulárně genetických prognostických markerů u 66 % nemocných. Na základě vyšetření těchto markerů bylo 30 % nemocných zařazeno do nízce rizikové skupiny (značeno zelenou barvou), 19 % nemocných bylo zařazeno do skupiny s vysokým rizikem onemocnění (značeno červenou barvou) a 17 % nemocných do středně rizikové skupiny (značeno modrou barvou). U 34 % nemocných nebyl prokázán žádný ze sledovaných genetických prognostických markerů.
Intenzivní léčebný přístup byl zahájen u 93,6 % (N = 788) nemocných s AML (mimo M3). Z těchto nemocných byla 93,4 % (N = 736) nemocným podána indukční chemoterapie v režimu „3+7“, u 1,8 % (N = 14) nemocných byla rovnou provedena alogenní transplantace krvetvorných buněk bez podání předchozí indukční chemoterapie. U zbylých 4,8 % (N = 38) nemocných nejsou v databázi uvedeny informace o léčbě. Leukaferéza před zahájením intenzivní léčby byla provedena u 10,7 % (N = 94) nemocných, cytoredukce hydroxyureou byla podána 29,4 % (N = 232) nemocným. V rámci indukce byl nemocným aplikován jeden nebo dva cykly chemoterapie podle zvyklostí daného pracoviště. Po prvním cyklu indukční chemoterapie dosáhlo 59,4 % (N = 437) nemocných kompletní remise AML, 4,5 % (N = 33) parciální remise, 25,4 % (N = 187) nemocných mělo rezistentní onemocnění a 2,9 % (N = 21) zemřelo v aplazii. Druhý cyklus indukční chemoterapie byl podán 21,6 % (N = 159) nemocným, kteří byli léčeni indukční terapií. Nejčastěji byl v rámci druhé indukce volen opět režim „3 + 7“ (50,3 %, N = 80), dále režim FLA-IDA (23,3 %, N = 37) a režim FLAG (8,2 %, N = 13). V našem souboru nebyl zjištěn statisticky významný rozdíl v efektivitě jednotlivých režimů podaných v rámci indukční terapie. Podrobné informace o efektivitě indukční terapie jsou uvedeny v tabulce 2 a grafu 3. Pravděpodobnost dosažení kompletní remise onemocnění po ukončení celé indukční fáze léčby, to znamená po podání jednoho nebo dvou cyklů indukční chemoterapie, byla 72 %. Primárně refrakterní onemocnění bylo klasifikováno u 14 % nemocných a 4 % nemocných zemřela v průběhu indukce v aplazii. Pravděpodobnost dosažení kompletní remise onemocnění u jednotlivých rizikových ELN skupin byla 88,1 % u nízkého rizika, 78,8 % u středního - -I a 64,7 % u středního-II rizika. Nejhorší výsledky indukční terapie byly dosahovány u vysokého rizika, kde byla pravděpodobnost dosažení CR pouze 53,4 %.
Tab. 2. Efektivita a riziko úmrtí v průběhu jednotlivých cyklů indukční chemoterapie u nemocných s AML (mimo APL) 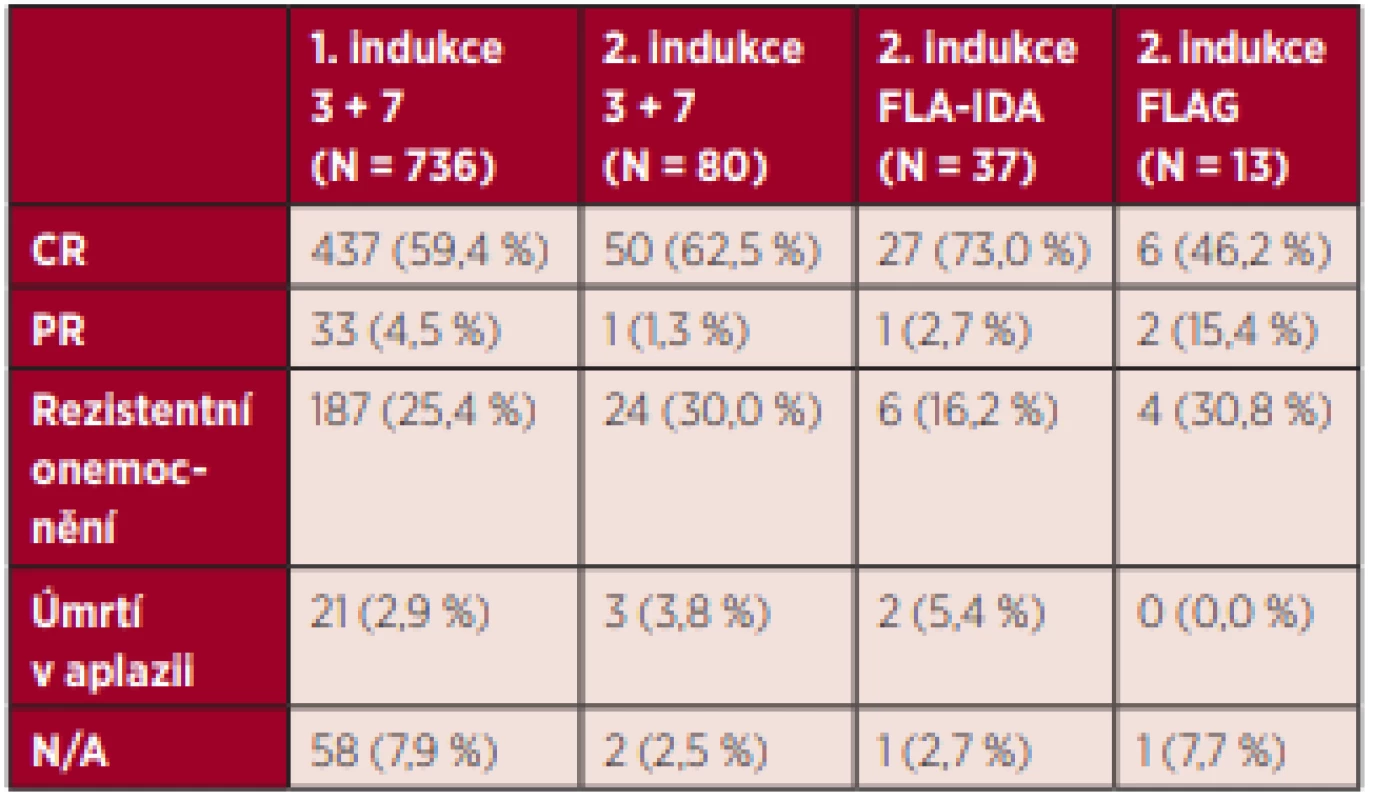
Pozn.: Druhý cyklus indukční terapie byl podán v případě nedostatečné efektivity prvního cyklu indukční terapie. CR – kompletní remise, PR – parciální remise, N/A – neuvedeno Graf 3. Celková efektivita indukční terapie u mladších nemocných s AML (mimo APL) Pozn.: Celková efektivita indukční terapie je hodnocena po dokončení indukční fáze první léčebné linie (po podání jednoho nebo maximálně dvou cyklů chemoterapie). CR – kompletní remise, PR – parciální remise, RD – rezistentní onemocnění, N/A – neuvedeno 
Graf 4. Kaplanovy-Meierovy křivky přežití mladších nemocných s AML (mimo APL) podle věku Pozn.: A. EFS sledovaných věkových skupin. B. OS sledovaných věkových skupin. EFS – přežití bez události, OS – celkové přežití 
Medián celkového přežití celé skupiny nemocných byl 26,5 měsíce, 5 let od stanovení diagnózy se dožilo 39,2 % nemocných. Přežití nemocných se lišilo v rámci jednotlivých skupin ELN klasifikace. Pěti let od diagnózy se dožilo 60,7 % nemocných v nízkém riziku, 34,7 % ve středním-I riziku, 41,0 % nemocných ve středním-II riziku a pouze 16,5 % nemocných ve vysokém riziku podle ELN 2010 (graf 5). U nemocných ve středním-I a středním-II riziku nebyl zjištěn rozdíl v mediánu EFS (12,0 vs. 12,5 měsíce, P = 0,240) ani v mediánu OS (20,4 vs. 22,8 měsíce, P = 0,367). Podrobné informace o přežití jednotlivých podskupin definovaných cytogenetickým nálezem a mutačním stavem genů NPM1 a FLT3-ITD jsou uvedeny v tabulce 3. Za povšimnutí stojí vysoké riziko relapsu onemocnění (35,4 %) v prvním roce po dosažení kompletní remise u všech nemocných ve středním-I riziku, kteří jsou FLT3-ITD pozitivní. Velmi nízkých hodnot celkového přežití je dosahováno u nemocných ve vysokém riziku, přičemž v této skupině nemocných mají nejhorší prognózu nemocní s komplexním karyotypem, kterých se 5 let od diagnózy dožívá pouze 15,9 %. Naopak nejlepší přežití bylo v našem souboru pozorováno u nemocných s fúzním genem RUNX1/RUNX1T1, kterých se 5 let od zjištění diagnózy dožilo 61,4 %. Vliv alogenní transplantace krvetvorných buněk (HSCT) provedené v první remisi onemocnění na přežití nemocných je uveden v tabulce 4 a grafu 6. U nemocných s normálním karyotypem, pozitivitou mutace NPM1 a negativitou mutace FLT3-ITD nevedlo provedení alogenní HSCT v rámci první léčebné linie k významnému prodloužení mediánu celkového přežití (N.R. vs. 63,3 měsíce; p = 0,706). Statisticky významného rozdílu nebylo dosaženo ani u nemocných s normálním karyotypem a negativitou mutací NPM1 a FLT3-ITD (39,2 vs. 23,2 měsíce; P = 0,486). Trend ve zlepšení přežití nemocných po provedení alogenní transplantace v první remisi je patrný u nemocných s normálním karyotypem a zároveň pozitivitou mutací NPM1 a FLT3-ITD (N.R. vs. 6,9 měsíce; p = 0,059) a dále u nemocných s nekomplexními vysoce rizikovými cytogenetickými abnormalitami (27,4 vs. 7,5 měsíce; p = 0,150). Nutno však upozornit, že v případě první zmíněné skupiny není v analýze brán ohled na alelický poměr mutace FLT3-ITD. Jasně pozitivní vliv alogenní transplantace na přežití nemocných je patrný u nemocných s normálním karyotypem a mutací FLT3-ITD bez mutace NPM1 (42,9 vs. 5,6 měsíce; p = 0,005) a také u všech nemocných se středně rizikovými (N.R. vs. 9,9 měsíce; p = 0,000) a komplexními (13,2 vs. 7,5 měsíce; p = 0,003) cytogenetickými abnormalitami.
Tab. 3. Efektivita intenzivní léčby první linie u jednotlivých rizikových podskupin podle ELN 2010 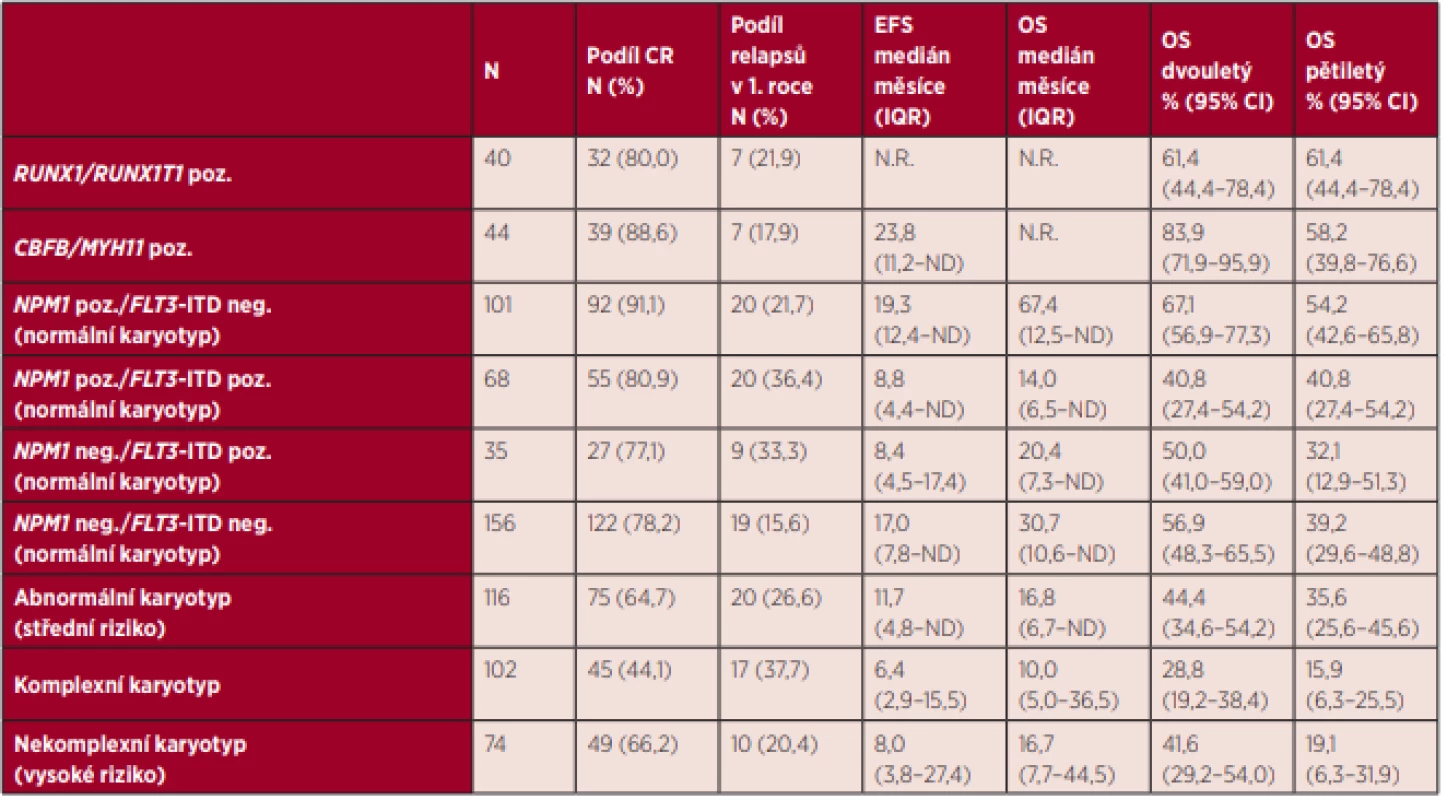
CR – kompletní remise, EFS – přežití bez události, OS – celkové přežití, IQR – mezikvartilové rozpětí, CI – interval důvěryhodnosti, N.R. – nedosaženo, ND – neprovedeno Tab. 4. Vliv alogenní transplantace krvetvorby provedené v první kompletní remisi onemocnění u vybraných ELN rizikových podskupin na celkové přežití nemocných 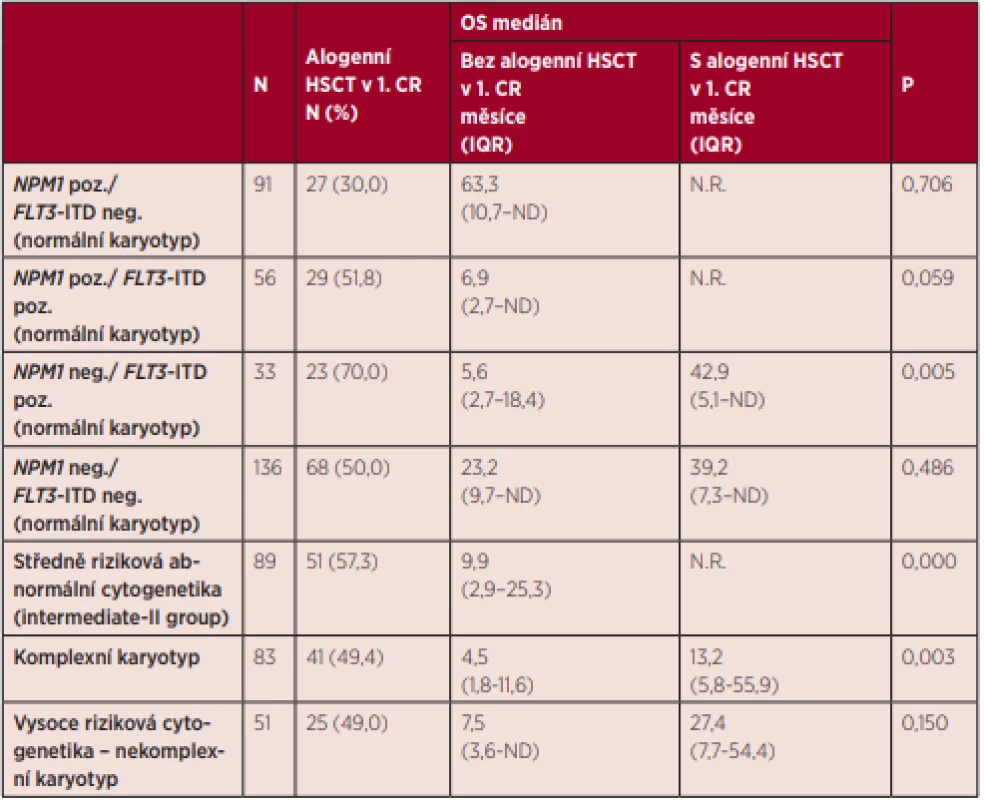
OS – celkové přežití, HSCT – transplantace krvetvorných buněk, CR – kompletní remise, IQR – mezikvartilové rozpětí, N.R. – nedosaženo, ND – neprovedeno Graf 5. Kaplanovy-Meierovy křivky přežití mladších nemocných s AML (mimo APL) podle ELN 2010
Pozn.: A. EFS jednotlivých rizikových skupin podle ELN 2010. B. OS jednotlivých rizikových skupin podle ELN 2010. Nebyl zjištěn rozdíl v EFS (12,0 vs. 12,5 měsíce, P = 0,240) ani OS (20,4 vs. 22,8 měsíce, P = 0,367) u nemocných v rizikové skupině Intermediate-I a Intermediate-II. Mezi ostatními rizikovými skupinami významný rozdíl v přežití nemocných prokázán byl.
EFS – přežití bez události, OS – celkové přežití, ELN – European LeukemiaNet
Graf 6. Vliv alogenní transplantace krvetvorby provedené v první kompletní remisi onemocnění u vybraných ELN rizikových podskupin na celkové přežití nemocných Pozn.: A. NPM1 poz./ FLT3-ITD neg. (normální karyotyp), B. NPM1 poz./FLT3-ITD poz. (normální karyotyp), C. NPM1 neg./FLT3-ITD poz. (normální karyotyp), D. NPM1 neg./ FLT3- -ITD neg. (normální karyotyp), E. středně rizikové cytogenetické abnormality, F. Komplexní karyotyp, G. Nekomplexní vysoce riziková cytogenetika 
AloTx – alogenní transplantace krvetvorných buněk, CR – kompletní remise Nemocní s primárně refrakterním onemocněním a relapsem choroby mají obecně velmi špatnou prognózu. V našem souboru bylo možné provést alogenní transplantaci v rámci terapie R/R AML u 46,0 % nemocných s primárně refrakterním onemocněním, u 39,1 % nemocných s časným relapsem choroby a u 52,9 % nemocných s pozdním relapsem choroby. Ve všech případech má provedení alogenní transplantace krvetvorby pozitivní vliv na přežití těchto nemocných. Nejvyšší šanci na dlouhodobé přežití mají pacienti s pozdním relapsem AML, u kterých byla provedena transplantace krvetvorby v rámci terapie relapsu. Podrobné informace týkající se přežití nemocných s primárně refrakterní AML a relapsem onemocnění v závislosti na provedení alogenní HSCT v rámci terapie relapsu jsou uvedeny v tabulce 5 a grafu 7.
Tab. 5. Celkové přežití nemocných s AML (mimo APL) s primárně refrakterním onemocněním a relapsem onemocnění v závislosti na provedení alogenní HSCT v rámci terapie relapsu 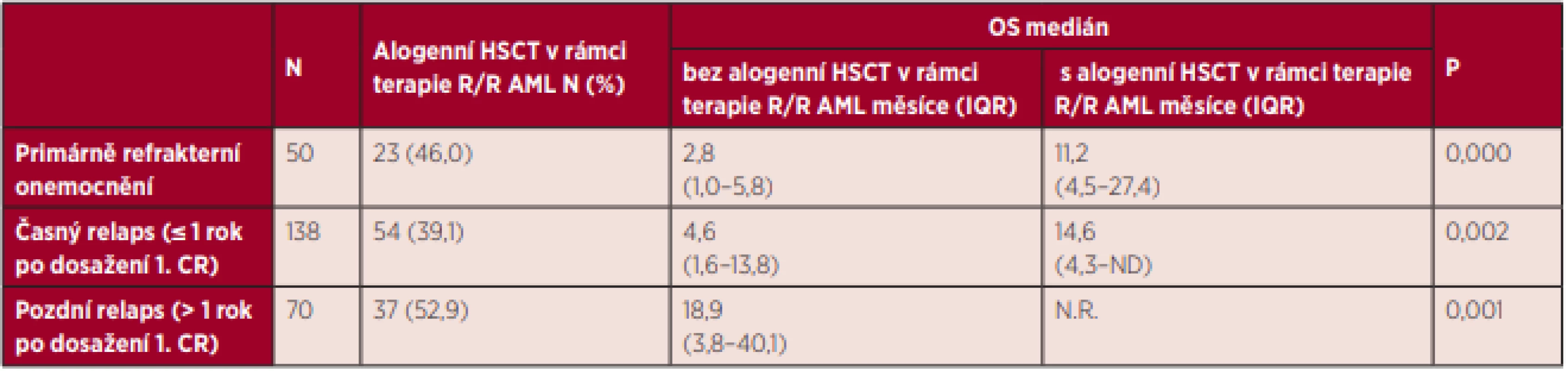
Pozn.: Celkové přežití hodnoceno od data primární refrakce či relapsu. OS – celkové přežití, HSCT – transplantace krvetvorných buněk, CR – kompletní remise, R/R AML – rezistentní/relabovaná akutní myeloidní leukemie, IQR – mezikvartilové rozpětí Graf 7. Celkové přežití nemocných s AML (mimo APL) s primárně refrakterním onemocněním a relapsem onemocnění v závislosti na provedení alogenní HSCT v rámci terapie relapsu
Pozn.: A. primárně refrakterní onemocnění, B. časný relaps (≤ 1 rok po dosažení 1. CR), C. pozdní relaps (>1 rok po dosažení 1. CR).
AloTx – alogenní transplantace krvetvorných buněk DISKUSE
Péče o nemocné s AML v období intenzivní terapie je velmi náročná a vyžaduje dostupnost vysoce sofistikovaného laboratorního zázemí a především vysoce profesionální přístup klinického pracoviště. Rolí laboratoří je stanovení diagnózy AML a zároveň prognostických markerů, které jsou důležité pro určení individuální prognózy nemocného. Nejčastěji vyšetřované molekulární markery v našem souboru byly mutace v genu pro NPM1, mutace FLT3-ITD, méně často potom mutace v genu CEBPA. Frekvence mutace genu NPM1 v našem souboru odpovídá frekvenci zachycené sekvenováním nové generace (NGS) ve velkých souborech nemocných s nově diagnostikovanou AML. Jinak je tomu v případě frekvence mutace FLT3, která je v našem souboru nižší oproti tomu, co je uváděno v jiných pracích [31, 32, 33]. To je částečně dáno nezapočítáním mutace v tyrozinkinázové doméně genu FLT3 (FLT3-TKD), jejíž frekvence u nově diagnostikované AML je uváděna kolem 8 %. Rovněž zastoupení nízce rizikové skupiny je v našem souboru nižší oproti jiné práci hodnotící přežití nemocných podle klasifikace ELN 2010 [34]. Toto může být z části vysvětleno tím, že ne u všech nemocných zadaných do databáze DATOOL-AML jsou dostupné výsledky cytogenetického vyšetření a mutačního stavu genu CEBPA.
Léčba nemocných ve sledovaném období odpovídala mezinárodním doporučením [28, 29]. Naprostá většina nemocných byla léčena intenzivně s kurativním záměrem, jako první indukce byla nejčastěji volena chemoterapie v režimu „3 + 7“. Riziko časného úmrtí v průběhu indukční chemoterapie bylo ve všech rizikových skupinách do 5 %, což je velmi nízké číslo a odpovídá riziku časného úmrtí nemocných, které je dosahováno na renomovaných pracovištích ve Spojených státech amerických [13] nebo v Nizozemsku [23]. Riziko časného úmrtí v londýnské univerzitní Nemocnici svatého Bartoloměje bylo u nemocných léčených v rámci klinické studie AML15 až 8 % [12]. O něco vyšší riziko časného úmrtí v této klinické studii mohlo být dáno použitím agresivnějších chemoterapeutických režimů.
Pravděpodobnost dosažení celkové remise po ukončení indukční terapie v našem souboru rovněž koresponduje s výsledky klinických studií. V již zmíněné klinické studii AML15 bylo kompletní remise onemocnění dosaženo u 72 % nemocných bez ohledu na riziko [12], stejně jako v našem souboru. V klinické studii prováděné v letech 2004–2009 na pracovištích americké skupiny SWOG (Southwest Oncology Group) byla pravděpodobnost dosažení kompletní remise onemocnění u mladších nemocných s AML 70 % [15]. V klinické studii jiné americké skupiny ECOG-ACRIN (Eastern Cooperative Oncology Group – American College of Radiology Imaging Network) bylo dosaženo v letech 2002–2008 kompletní remise u 65 % mladších nemocných s AML [15]. V klinických studiích obou zmíněných amerických skupin bylo navíc vícerozměrnou analýzou prokázáno, že pravděpodobnost dosažení kompletní remise byla vyšší u nemocných, kteří byli léčeni na větších pracovištích, která zařadila do zmíněných klinických studií 10 a více nemocných, oproti pracovištím, která zařadila méně nemocných.
U nemocných ve středním-I riziku a ve středním-II riziku byl v našem souboru nemocných zjištěn statisticky významný rozdíl v pravděpodobnosti dosažení kompletní remise onemocnění (78,8 % vs. 64,7 %, P = 0,0048). Tento rozdíl v některých pracích prokázán nebyl [34]. U středně rizikových nemocných s mutací FLT3-ITD byla pravděpodobnost dosažení celkové remise v našem souboru 77,1–80,9 % v závislosti na přítomnosti mutace NPM1, což je dokonce více než u FLT3 pozitivních nemocných ve studii RATIFY [8].
Medián celkového přežití všech nemocných s AML (mimo APL) v našem souboru odpovídá mediánu přežití nemocných, kteří byli léčeni, nebo jim alespoň byla nabídnuta účast v klinické studii AML15 [12]. V klinické studii skupiny SWOG dosahoval medián celkového přežití 47 měsíců, přičemž vyšší medián celkového přežití je pravděpodobně dán frekventním podáváním gemtuzumabu v této klinické studii [15]. Celkové přežití nemocných léčených v klinické studii skupiny ECOG-ACRIN, ve které byl gemtuzumab podáván méně často, a to pouze jednorázově před provedením autologní HSCT, odpovídá našim výsledkům [15].
Pěti let od zjištění diagnózy se v našem souboru dožívá 54,2–61,4 % nemocných v nízkém riziku v závislosti na konkrétní genetické změně, což odpovídá přežití nemocných v nízkém riziku léčených standardní chemoterapií v metaanalýze hodnotící efekt gemtuzumabu [34]. Medián celkového přežití (20,4 vs. 22,8 měsíce; P = 0,367) ani pětileté přežití (34,7 % vs. 41,0 %; P = 0,291) nemocných ve středně rizikových skupinách (střední-I a střední-II) se v našem souboru statisticky významně neliší. Rozdělení středně rizikové skupiny na dvě podkategorie tedy z našeho pohledu nemá klinický význam. Nutno však podotknout, že v některých pracích bylo přežití nemocných ve středním-II riziku statisticky významně lepší [35].
Ve středním riziku mají nejnižší pravděpodobnost pětiletého dožití nemocní s normálním karyotypem a FLT3-ITD+/NPM1-. Medián celkového přežití těchto nemocných je pouze 20,4 měsíce, což je méně oproti FLT3 pozitivním nemocným léčeným v randomizované klinické studii RATIFY [8], kteří byli léčeni standardní chemoterapií bez midostaurinu. U středně rizikových nemocných jak s pozitivitou mutace FLT3-ITD (bez ohledu na přítomnost mutace NPM1), tak se středně rizikovými cytogenetickými abnormalitami hraje důležitou roli časné provedení alogenní transplantace krvetvorby v první kompletní remisi. Nutno však upozornit, že v naší analýze nebyl brán v potaz alelický poměr mutace FLT3-ITD, který podle aktuální ELN klasifikace začleňuje nemocné NPM1 pozitivní s nízkým alelickým poměrem mutace FLT3-ITD do nízce rizikové skupiny [29].
Stejně jako u nemocných s pozitivitou mutace FLT3-ITD a středně rizikovými cytogenetickými abnormalitami hraje provedení alogenní transplantace v první remisi velmi důležitou roli také u všech nemocných s vysoce rizikovými cytogenetickými abnormalitami. Velmi špatná prognóza těchto nemocných však zůstává i po jejím provedení. Pětileté přežití všech nemocných ve vysokém riziku 15–19 měsíců odpovídá přežití nemocných léčených v klinických studiích [35].
Souhrnně lze tedy konstatovat, že léčebné výsledky a přežití mladších nemocných s AML léčených v českých centrech skupiny CELL korespondují s výsledky léčby v klinických studiích a výsledky léčby, které jsou dosahovány na renomovaných zahraničních pracovištích univerzitního typu. Domníváme se, že vliv na výsledky péče o mladší nemocné s touto závažnou diagnózou má s velkou pravděpodobností centralizace péče do několika velkých center v České republice. Zkušený personál a technické možnosti velkých nemocnic umožňují rychlé a kvalifikované provádění vysoce specializovaných diagnostických a léčebných výkonů, jako je například léčebná leukaferéza, imunofenotypizace leukocytů, cytogenetické vyšetření, vyšetření DNA masivně paralelním sekvenováním příští generace (NGS) a další. Celá řada prací prokázala, že léčba komplikací v průběhu chemoterapie či alogenní HSCT, jako je závažná bronchopneumonie, respirační selhání, sepse nebo srdeční selhání po podání antracyklinů, je spojena s nižší mortalitou, pokud je centralizována právě na specializované jednotky intenzivní péče či ARO kliniky velkých nemocnic [36–38]. Snížení mortality závažných komplikací léčby a vyšší pravděpodobnost dosažení kompletní remise onemocnění má pozitivní vliv na celkové výsledky léčby nemocných s onkologickými chorobami včetně AML [39].
Centralizace v současné době plně dostačuje zajistit kvalitní péči o nemocné s AML mladší 60 let. Nicméně medián věku v době stanovení diagnózy AML je 68 let. Je tedy zřejmé, že tato práce shrnuje výsledky péče o méně než polovinu nemocných s AML v České republice. Pacientů nad 60 let stále přibývá, řada z nich je v dobrém klinickém stavu a vyžadují stejně specializovanou péči včetně provedení alogenní transplantace kostní dřeně jako pacienti mladší [40]. Kapacita hemato-onkologických center však toto v současné době neumožňuje.
Podíl autorů na přípravě manuskriptu
LS – příprava manuskriptu, sběr dat, analýza dat, péče o pacienty s AML
ZŠ – sběr dat, péče o pacienty s AML
PC – sběr dat, péče o pacienty s AML
PJ – revize manuskriptu, sběr dat, péče o pacienty s AML
ZK – sběr dat, péče o pacienty s AML
JN – sběr dat, péče o pacienty s AML
TS – sběr dat, péče o pacienty s AML
ZR – revize manuskriptu, sběr dat, péče o pacienty s AML
JV – revize manuskriptu, sběr dat, péče o pacienty s AML
BW – sběr dat, péče o pacienty s AML
PŽ – sběr dat, péče o pacienty s AML
JM – příprava a revize manuskriptu, sběr dat, analýza dat, péče o pacienty s AML
Všichni autoři viděli manuskript a souhlasili s jeho finální verzí.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Všem lékařům, laboratorním pracovníků, zdravotním sestrám a datamanažerům, kteří se podílí na péči o nemocné s AML v České republice a kteří aktivně přispívají k vysoké úrovni databáze DATOOL-AML.
Do redakce doručeno dne 15. 5. 2020.
Přijato po recenzi dne 25. 5. 2020.
MUDr. Lukáš Semerád
Interní hematologická a onkologická klinika FN Brno
Jihlavská 20
625 00 Brno
e-mail: semerad23@gmail.com
Zdroje
1. Yates JW, Wallace HJ, Ellison RR, Holland JF. Cytosine arabinoside (NSC-63878) and daunorubicin (NSC-83142) therapy in acute nonlymphocytic leukemia. Cancer Chemother Rep. 1973;57(4):485–488.
2. Čerňan M, Szotkowski T. Moderní léčba akutní myeloidní leukémie. Transfuze Hematol Dnes. 2017;23(1):16–28.
3. Othus M, Kantarjian H, Petersdorf S, et al. Declining rates of treatment-related mortality in patients with newly-diagnosed AML given “intense” induction regimens: a report from SWOG and MD Anderson. Leukemia. 2014;28(2):289–292.
4. Kantarjian H. Acute myeloid leukemia - major progress over four decades and glimpses into the future. Am J Hematol. 2016;91(1):131–145.
5. Schetelig J, Schaich M, Schäfer-Eckart K, et al. Hematopoietic cell transplantation in patients with intermediate and high-risk AML: results from the randomized Study Alliance Leukemia (SAL) AML 2003 trial. Leukemia. 2015;29(5):1060–1068.
6. Grimwade D, Walker H, Oliver F, et al. The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 patients entered into the MRC AML 10 trial. The Medical Research Council Adult and Children’s Leukaemia Working Parties. Blood. 1998;92(7):2322–2333.
7. Státní ústav pro kontrolu léčiv. Accessed October 29, 2019. http:// www.sukl.cz/
8. Stone RM, Mandrekar SJ, Sanford BL, et al. Midostaurin plus chemotherapy for acute myeloid leukemia with a FLT3 mutation. N Engl J Med. 2017;377(5):454–464.
9. Lambert J, Pautas C, Terré C, et al. Gemtuzumab ozogamicin for de novo acute myeloid leukemia: final efficacy and safety updates from the open-label, phase III ALFA-0701 trial. Haematologica. 2019;104(1):113–119.
10. Dechartres A, Chevret S, Lambert J, Calvo F, Lévy V. Inclusion of patients with acute leukemia in clinical trials: a prospective multicenter survey of 1066 cases. Ann Oncol. 2011;22(1):224–233.
11. Unger JM, Hershman DL, Fleury ME, Vaidya R. Association of patient comorbid conditions with cancer clinical trial participation. JAMA Oncol. 2019;5(3):326–333.
12. Stevens JM, Macdougall F, Jenner M, et al. Patterns of recruitment into acute myeloid leukaemia (AML) 15 and outcome for young patients with AML at a single referral centre. Br J Haematol. 2009;145(1):40–44.
13. Ho G, Wun T, Muffly L, et al. Decreased early mortality associated with the treatment of acute myeloid leukemia at National Cancer Institute-designated cancer centers in California. Cancer. 2018;124(9):1938–1945.
14. Giri S, Pathak R, Aryal MR, et al. Impact of hospital volume on outcomes of patients undergoing chemotherapy for acute myeloid leukemia: a matched cohort study. Blood. 2015;125(21):3359–3360.
15. Medeiros BC, Othus M, Tallman MS, et al. The relationship between clinical trial accrual volume and outcomes in acute myeloid leukemia: A SWOG/ECOG-ACRIN study (S0106 and E1900). Leuk Res. 2019;78 : 29–33.
16. Horowitz MM, Przepiorka D, Champlin RE, et al. Should HLAidentical sibling bone marrow transplants for leukemia be restricted to large centers? Blood. 1992;79(10):2771–2774.
17. Loberiza FR, Zhang M-J, Lee SJ, et al. Association of transplant center and physician factors on mortality after hematopoietic stem cell transplantation in the United States. Blood. 2005;105(7):2979–2987.
18. Majhail NS, Mau L-W, Chitphakdithai P, et al. Transplant center characteristics and survival after allogeneic hematopoietic cell transplantation in adults. Bone Marrow Transplant. 2020;55(5):906–917.
19. Juliusson G, Lazarevic V, Hörstedt A-S, et al. Acute myeloid leukemia in the real world: why population-based registries are needed. Blood. 2012;119(17):3890–3899.
20. SEER Registries - About SEER. SEER. Accessed October 29, 2019. https://seer.cancer.gov/registries/index.html
21. Juliusson G, Antunovic P, Derolf A, et al. Age and acute myeloid leukemia: real world data on decision to treat and outcomes from the Swedish Acute Leukemia Registry. Blood. 2009;113(18):4179–4187.
22. Østgård LSG, Nørgaard JM, Raaschou-Jensen KK, et al. The Danish National Acute Leukemia Registry. Clin Epidemiol. 2016;8 : 553–560.
23. Dinmohamed AG, Visser O, van Norden Y, et al. Treatment, trial participation and survival in adult acute myeloid leukemia: a population-based study in the Netherlands, 1989-2012. Leukemia. 2016;30(1):24–31.
24. Shah A, Andersson TM-L, Rachet B, et al. Survival and cure of acute myeloid leukaemia in England, 1971-2006: a population-based study. Br J Haematol. 2013;162(4):509–516.
25. Národní onkologický registr (NOR) | ÚZIS ČR. Accessed October 29, 2019. https://www.uzis.cz/registry-nzis/nor
26. Informace o projektu – Portál české leukemické skupiny. Accessed October 29, 2019. http://www.leukemia-cell.org/index.php?pg=datool-aml--informace-o-projektu
27. Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood. 2009;114(5):937–951.
28. Döhner H, Estey EH, Amadori S, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 2010;115(3):453–474.
29. Döhner H, Estey E, Grimwade D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017;129(4):424–447.
30. Duarte RF, Labopin M, Bader P, et al. Indications for haematopoietic stem cell transplantation for haematological diseases, solid tumours and immune disorders: current practice in Europe, 2019. Bone Marrow Transplant. 2019;54(10):1525–1552.
31. Papaemmanuil E, Gerstung M, Bullinger L, et al. Genomic classification and prognosis in acute myeloid leukemia. N Engl J Med. 2016;374(23):2209–2221.
32. Folta A, Culen M, Jeziskova I, et al. Prognostic significance of mutation profile at diagnosis and mutation persistence during disease remission in adult acute myeloid leukaemia patients. Br J Haematol. 2019;186(2):300–310.
33. Metzeler KH, Herold T, Rothenberg-Thurley M, et al. Spectrum and prognostic relevance of driver gene mutations in acute myeloid leukemia. Blood. 2016;128(5):686–698.
34. Hills RK, Castaigne S, Appelbaum FR, et al. Addition of gemtuzumab ozogamicin to induction chemotherapy in adult patients with acute myeloid leukaemia: a meta-analysis of individual patient data from randomised controlled trials. Lancet Oncol. 2014;15(9):986–996.
35. Mrózek K, Marcucci G, Nicolet D, et al. Prognostic significance of the European LeukemiaNet standardized system for reporting cytogenetic and molecular alterations in adults with acute myeloid leukemia. J Clin Oncol. 2012;30(36):4515–4523.
36. Kahn JM, Goss CH, Heagerty PJ, et al. Hospital volume and the outcomes of mechanical ventilation. N Engl J Med. 2006;355(1):41–50.
37. Ross JS, Normand S-LT, Wang Y, et al. Hospital volume and 30 - day mortality for three common medical conditions. N Engl J Med. 2010;362(12):1110–1118.
38. Shahul S, Hacker MR, Novack V, et al. The effect of hospital volume on mortality in patients admitted with severe sepsis. PloS One. 2014;9(9):e108754.
39. Hillner BE, Smith TJ, Desch CE. Hospital and physician volume or specialization and outcomes in cancer treatment: importance in quality of cancer care. J Clin Oncol. 2000;18(11):2327–2340.
40. Šustková Z, Semerád L, Procházková J, et al. Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML. Transfuze Hematol Dnes. 2019;25(4):340–348.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2020 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- COVID-19 a transfuzní služba v ČR
- Regenerující krvetvorba se podobá embryonální krvetvorbě nezávislé na kmenových buňkách
- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
- Léčba multicentrické a unicentrické formy Castlemanovy nemoci
- Tematizace problémů komplexní péče z perspektivy osob s hemofilií
- Hodnocení znalosti transfuzního lékařství u lékařů po promoci v Turecku
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Vzácné kožní změny asociované s monoklonální gamapatií: skleredém, skleromyxedém a IgA pemfigus – popis pěti případů a přehled léčebných možností
- Doporučený postup pro použití rekonvalescentní plazmy v léčbě dospělých pacientů s COVID-19
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií, vydání 2., rok 2020
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



