-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií, vydání 2., rok 2020
Consensual guidelines of the Czech National Haemophilia Programme (CNHP) for replacement treatment of patients with haemophilia during invasive procedures and surgery, 2nd edition, year 2020
Haemophilia A and B are rare congenital bleeding disorders. Invasive procedures and surgery can be performed safely in patients with haemophilia without inhibitors due to the availability of coagulation factors VIII and IX. The aim of these guidelines is to summarize experience and recommendations for treatment including optimal factors VIII/IX levels during surgery, laboratory monitoring and replacement treatment duration after these procedures. A special attention is drawn to the procedures in patiens being treated by the bispecific monoclonal antibody emicizumab.
Keywords:
haemophilia – surgery – factor VIII – factor IX – emicizumab – replacement treatment
Autoři: R. Hrdličková 1; P. Smejkal 2; J. Blatný 3; Z. Hajšmanová 4; A. Hluší 5; E. Zápotocká 6; M. Penka 2; B. Blažek 7; Z. Čermáková 1; Z. Černá 8; P. Ďulíček 9; J. Hak 10; D. Pospíšilová 11; D. Procházková 12; P. Timr 13; J. Ullrychová 14; I. Vonke 15; L. Walterová 16
Působiště autorů: Krevní centrum a Klinika hematoonkologie, Fakultní nemocnice Ostrava 1; Oddělení klinické hematologie, Fakultní nemocnice Brno 2; Oddělení dětské hematologie, Fakultní nemocnice Brno 3; Ústav klinické biochemie a hematologie, Fakultní nemocnice Plzeň 4; Hemato-onkologická klinika, Fakultní nemocnice Olomouc 5; Klinika dětské hematologie a onkologie, Fakultní nemocnice v Motole, Praha 6; Klinika dětského lékařství, Fakultní nemocnice Ostrava 7; Dětská klinika, Fakultní nemocnice Plzeň 8; IV. Interní hematologická klinika, Fakultní nemocnice Hradec Králové 9; Dětská klinika, Fakultní nemocnice Hradec Králové 10; Dětská klinika, Fakultní nemocnice Olomouc 11; Dětská klinika, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem 12; Dětské oddělení, Nemocnice České Budějovice 13; Oddělení klinické hematologie, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem 14; Oddělení klinické hematologie, Nemocnice České Budějovice 15; Oddělení klinické hematologie, Krajská nemocnice Liberec 16
Vyšlo v časopise: Transfuze Hematol. dnes,26, 2020, No. 3, p. 257-262.
Kategorie: Doporučené postupy
Souhrn
Hemofilie A a B jsou vzácná vrozená krvácivá onemocnění. Díky dostupnosti koagulačních faktorů VIII a IX mohou být u pacientů s hemofilií bez inhibitoru bezpečně prováděny operační a invazivní výkony. Cílem těchto doporučení je shrnutí zkušeností a doporučení pro zajištění operací včetně optimální aktivity faktorů VIII a IX, laboratorního monitorování a doby trvání substituční léčby po chirurgických výkonech. Zvláštní pozornost je věnována postupu u pacientů léčených bispecifickou monoklonální protilátkou emicizumabem.
Klíčová slova:
hemofílie – operace – faktor VIII – faktor IX – emicizumab – substituční léčba
PREAMBULE
Ačkoli doporučení a informace obsažené v následujícím textu jsou formulovány v dobré víře a na základě znalostí aktuálně dostupných v době zveřejnění dokumentu, autoři, ČNHP (Český národní hemofilický program), žádná ze zainteresovaných odborných společností ani vydavatel tohoto doporučení nenesou žádnou právní zodpovědnost za obsah tohoto textu.
Cílem standardu je stanovit základní terapeutické postupy k hematologickému zajištění chirurgických/ ortopedických a jiných invazivních výkonů u pacientů s vrozenou hemofilií A nebo vrozenou hemofilií B. Navazuje, rozšiřuje a aktualizuje doporučení z roku 2016 s ohledem na již v praxi používané nové léky pro pacienty s hemofilií [1].
ZÁKLADNÍ PŘEDPOKLADY
- Před operačním výkonem je nezbytná přesná diagnóza typu a závažnosti vrozeného krvácivého onemocnění včetně znalosti základní aktivity faktoru VIII (FVIII) nebo faktoru IX (FIX) a stanovení inhibitoru [1, 2, 3, 4]. Před elektivní operací je doporučeno vyloučit současnou přítomnost jiné poruchy krevního srážení, zejména von Willebrandovy choroby, trombocytopatie, trombocytopenie či kombinovaného deficitu koagulačních faktorů.
- Běžné a akutní operační výkony u pacientů s hemofilií lze provádět v hemofilických centrech, kde je možnost rutinního stanovení hladiny koagulačního faktoru a vyšetření inhibitoru.
- Operační výkony u osob s hemofilií a inhibitorem, u osob léčených emicizumabem a totální kloubní náhrady u všech osob s hemofilií jsou prováděny vždy v rámci center vysoce specializované hemofilické péče (CVSHP, viz Věstník MZd č. 8/2014), optimálně v rámci jejich HCCC (haemophilia comprehensive care centres). Ostatní operační výkony, včetně elektivních, mohou být prováděny jak v HCCC, tak v HTC (haemophilia treatment centres) podle možností daného centra. Pokud však daný výkon nelze provést v HTC, musí být jeho provedení zajištěno některým z HCCC [1].
- Operační výkony u pacientů s hemofilií a inhibitorem jsou řešeny samostatným doporučeným postupem.
- Před elektivním operačním výkonem je vhodné znát odpověď pacienta na podání koncentrátu koagulačního faktoru, případně desmopresinu (DDAVP) [2, 3].
- Elektivní chirurgické a ortopedické výkony by měly být plánovány v první polovině týdne a v ranních/ dopoledních hodinách z důvodu spolehlivého zajištění laboratorních vyšetření a případné transfuzní podpory [2].
- Invazivní výkon je možné provést až po korekci koagulační poruchy podáním koncentrátu koagulačního faktoru nebo DDAVP [2, 3, 4, 5]. U pacientů léčených emicizumabem lze některé malé výkony (viz samostatnou kapitolu) provést i bez další substituce FVIII nebo v případě hemofiliků s inhibitorem FVIII bez aplikace rFVIIa jen s podporou antifibrinolytik za předpokladu pečlivého pooperačního sledování s možností rychlé aplikace faktorů v případě krvácení.
- Intenzita a doba trvání substituce koagulačními faktory záleží na charakteru operace, hojení rány a délce případné intenzivní rehabilitace.
- Nedílnou součástí pooperační péče jsou lokální opatření (polohování, podle potřeby chlazení a komprese), úprava pohybového režimu a aktivní rehabilitace.
- Invazivní výkony u pacientů s vrozenou hemofilií jsou spojeny se zvýšeným rizikem vývoje inhibitoru a je doporučeno opakované vyšetření inhibitoru v průběhu 2–12 týdnů po operaci.
- Pokud je to možné, je doporučeno neprovádět plánované chirurgické výkony u dětí s těžkou formou hemofilie během prvních 20 expozičních dnů (zvýšené riziko vývoje inhibitoru) [6].
- Novorozenci a zejména nedonošené dětí mají sníženou aktivitu i ostatních koagulačních faktorů (nedostatek vitamínu K, nezralá játra). Kromě léčby hemofilie je tedy nutné zohlednit i tento fyziologický fakt [6].
KLASIFIKACE CHIRURGICKÝCH VÝKONŮ
Chirurgické výkony rozlišujeme na malé a velké podle jejich rozsahu a s ním spojeného krvácivého rizika a nutné doby zajištění potřebné hemostatické podpory. U malých výkonů je hemostatická podpora podávána obvykle méně než 5 po sobě jdoucích dnů (např. odstranění kožní léze, zubní extrakce menšího rozsahu…). U velkých operačních výkonů je hemostatická podpora nutná více než 5 po sobě jdoucích dnů, obvykle 7–14 dnů, případně déle. Mezi ně patří všechny operace s významným rizikem velkých krevních ztrát nebo s rizikem krvácení do anatomicky ohraničeného prostoru (velké břišní operace, intrakraniální, spinální, kardiovaskulární a ortopedické endoprotetické výkony…).
SUBSTITUCE KOAGULAČNÍMI FVIII/IX
Základním předpokladem nekomplikovaného chirurgického výkonu a hojení rány u osoby s hemofilií je dostatečná substituce koagulačními faktory se standardním (SHL – standard half - life) nebo prodlouženým (EHL – extended half-life) biologickým eliminačním poločasem, při které aktivita FVIII/IX neklesá pod minimální doporučenou hranici FVIII/IX (tab. 1–3).
Tab. 1. Doporučená aktivita FVIII k operacím při substituci formou kontinuální infuze FVIII 
Tab. 2. Doporučená minimální aktivita FVIII/FIX k operaci a v pooperačním průběhu při substituci hemofiliků podstupujících malé chirurgické výkony s bolusovou aplikací faktorů 
Tab. 3. Doporučená minimální aktivita FVIII/FIX k operaci a v pooperačním průběhu při substituci hemofiliků podstupujících velké chirurgické výkony s bolusovou aplikací faktorů 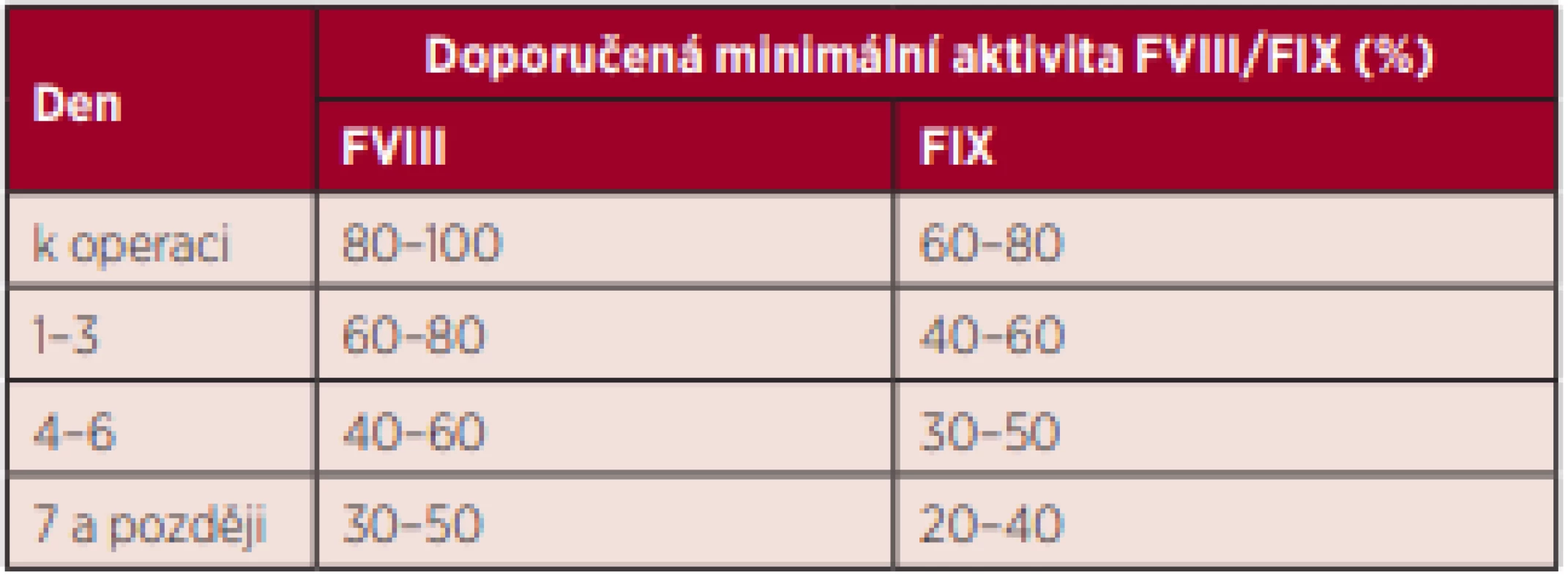
Maximální (peak) aktivitou FVIII/IX je myšlena nejvyšší aktivita faktorů naměřená 15–30 minut od ukončení infuze bolusu FVIII/IX, minimální aktivita je hodnota FVIII/IX naměřená těsně před aplikací následující bolusové dávky. Při monitorování substituční léčby je nutné používat doporučené a ověřené laboratorní koagulační metody (chromogenní nebo jednofázové koagulační metody včetně doporučených činidel) s ohledem na použitý substituční preparát tak, aby nedocházelo k nadhodnocení či podhodnocení měřené aktivity FVIII/FIX [7, 8, SPC jednotlivých produktů]. Zejména monitorování EHL preparátů a některých rekombinantních FVIII bez B-domény může vyžadovat odlišný postup, proto je nezbytné mít laboratorní testy a jejich postupy pro daný preparát jasně stanovené a ověřené před výkonem. Informujte laboranty předem o použitém substitučním preparátu. Zvláštních vyšetřovacích postupů je rovněž třeba tam, kde je koncentrát FVIII podáván společně s léčbou emicizumabem (viz níže).
- U malých operačních výkonů – krátce (< 30 min) před zahájením operace je nutné podat takovou dávku koncentrátu koagulačního faktoru, která zvýší aktivitu deficitního faktoru na 50–80 % FVIII/FIX. Podle typu výkonu je doporučeno udržovat aktivitu FVIII/ IX minimálně 30–80 % po dobu 1–5 dnů.
- U velkých operačních výkonů – krátce (< 30 min) před zahájením operace je nutné podat takovou dávku koncentrátu koagulačního faktoru, která zvýší aktivitu deficitního faktoru na 80–100 % FVIII, resp. na 60–80 % FIX. První tři pooperační dny je doporučeno udržovat aktivitu FVIII na minimálně 60–80 %, aktivitu FIX na minimálně 40–60 %. Poté potřebná udržovací aktivita klesá na 40–60 % FVIII, resp. 30–50 % FIX, od 7. dne na 30–50 % FVIII, resp. 20–40 % FIX.
Celková doba podávání substituční terapie je doporučena do zhojení rány – u velkých operací až 10–14 dnů, u některých typů ortopedických výkonů a zejména po neurochirurgických operacích je uvedená substituce nutná i třetí pooperační týden s následnou intenzivní profylaktickou aplikací faktorů minimálně po dobu rekonvalescence (v případě operací CNS 3–6 měsíců), případně dlouhodobě [2, 3, 5].
- U elektivních ortopedických výkonů je doporučena profylaxe FVIII/FIX 2–3 týdny před výkonem a následně minimálně po dobu rehabilitace i u pacientů léčených dosud v režimu on-demand. U velkých ortopedických výkonů (endoprotetické výměny kloubů) je doporučena profylaxe FVIII/FIX v délce 1–3 měsíce po operaci, minimálně však po dobu trvání intenzivní rehabilitace, na zvážení je pokračující dlouhodobá profylaxe [9, 10].
- Koncentráty FVIII a FIX jsou podávány formou intermitentních i. v. bolusů 1–3× denně. V závislosti na individuální farmakokinetice může být v pooperačním období od cca 3.–4. pooperačního dne při substituci FIX-EHL k udržení doporučované aktivity FIX dostatečná i nižší frekvence aplikace. Legitimní možností je i aplikace faktorů SHL formou kontinuální infuze (CI) s denní adjustací dávky podle aktuálních hladin aktivity FVIII, resp. FIX [2, 3, 11, 12]. Tento způsob aplikace umožňuje podle některých studií snížit celkovou dávku perioperačně aplikovaného preparátu při stejném nebo dokonce nižším výskytu krvácivých komplikací výkonu. I když obavy ze zvýšeného rizika vzniku inhibitoru u pacientů s těžkou formou hemofilie léčených kontinuální infuzí nebyly potvrzeny, aplikace faktorů CI není doporučena u pacientů do 20 expozičních dnů a u pacientů s lehkou formou hemofilie s mutací rizikovou pro rozvoj inhibitoru FVIII [12, 13]. S aplikací EHL preparátů v kontinuální infuzi jsou zatím jen ojedinělé zkušenosti a při současné úrovni znalostí se nejedná o standardní postup. U pacientů s výraznou nadváhou či obezitou je doporučeno při výpočtu substituční dávky vycházet z ideální tělesné hmotnosti místo aktuální hmotnosti [14].
- Jako pomocnou terapii, zejména při operacích v oblasti sliznic (ORL operace, stomatochirurgie, operace trávicího traktu, dolních močových cest apod.), je vhodné použít antifibrinolytika: kyselinu tranexamovou (Exacyl) 10–15 mg/kg i. v. 3× denně nebo 20–25 mg/ kg 3× denně p. o., případně 1 g co 6 h ve formě roztoku k výplachu dutiny ústní. Někteří autoři uvádějí možnost použití tzv. tkáňových lepidel ke zlepšení hemostázy u chirurgických výkonů, s výhodou je lze použít ve stomatochirurgii [2, 3, 15, 16].
Extrakce zubů
- Extrakce stálých zubů u osoby s hemofilií musí být jednoznačně indikována. Je-li možnost konzervativního řešení, je třeba dát mu přednost.
- Před extrakcí zubů a v případě konzervativního ošetření zubu za použití některých typů lokální anestezie (svodná anestezie, infiltrační anestezie jazyka), se obecně doporučuje krátce před zákrokem jednorázové podání koncentrátu koagulačního faktoru (aktivitu FVIII zvýšit na 80–100 %, FIX na 60–80 %). U vícečetných extrakcí, především u pacientů s těžkou formou hemofilie, je nutná i následná substituční léčba. Délka terapie a její intenzita je individuální a závisí na charakteru výkonu a klinickém stavu pacienta. U nemocných s těžkým deficitem FVIII/FIX je celková doba terapie 3–10 dnů a aplikační interval od 12 do 48 h [2, 3, 15, 16].
- U některých skupin pacientů (lehká a výjimečně i středně těžká forma hemofilie A, přenašečky hemofilie A) lze k zajištění extrakce zubů použít DDAVP (dávka 0,3 ug/kg i. v. nebo s. c. bezprostředně před zákrokem, event. 300 μg intranazálně 1–2 h před zákrokem à 12–24 h, další opakování dávky může mít snížený účinek!). V ČR je DDAVP v současné době dostupný pro hemofilická centra v rámci specifického léčebného programu. Před použitím DDAVP je nutné provést test k průkazu hemostatické aktivity po podání DDAVP u daného pacienta.
- Substituční léčba koncentráty koagulačních faktorů se kombinuje s podáváním antifibrinolytik – kyselina tranexamová (Exacyl) 10–15 mg/kg i. v. 3× denně nebo 20–25 mg 3× denně p. o. po dobu cca 7 dnů p. o. Roztok antifibrinolytika lze aplikovat i formou výplachů ústní dutiny po extrakci.
- Další opatření k zajištění hemostázy při extrakcích zubů zahrnují techniku extrakce (s minimální traumatizací gingivy), zajištění rány suturou, je-li to ze stomatologického hlediska možné (vstřebatelným či nevstřebatelným stehem) a zvážení použití lokálních hemostyptik či tkáňových lepidel.
Chirurgické a invazivní výkony u pacientů s hemofilií A léčených emicizumabem
Emicizumab je indikován k rutinní profylaktické léčbě osob s těžkou formou hemofilie A s/bez inhibitoru FVIII. Není primárně určen k léčbě akutního krvácení nebo k zajištění chirurgického výkonu. Akutní či elektivní chirurgický výkon ale není indikací k vysazení či přerušení léčby emicizumabem nebo ke změně intervalu aplikace či dávky v rámci předoperační přípravy.
- Pacient léčený emicizumabem a/nebo osoba o něj pečující musí být poučeni o tom, že o každém elektivním či akutním chirurgickém nebo invazivním výkonu musí být informováno příslušné hemofilické centrum, které doporučí další postup včetně nutnosti další substituce faktory a/nebo antifibrinolytiky.
- Emicizumab interferuje s některými koagulačními testy, což může vést k zavádějícím výsledkům a v rámci předoperačního vyšetření pacienta je nutné na to myslet! Jedná se zejména o test aktivovaného parciálního tromboplastinového času (aPTT), kdy normální či subnormální hodnoty při použití standardních vyšetřovacích postupů a reagencií neodpovídají stavu hemostázy. Ovlivněné jsou i další testy na bázi aPTT, jako aktivita FVIII i dalších faktorů (FIX, FXI, FXII), vyšetření titrů inhibitorů FVIII Bethesda (koagulační) metodou. Vliv emicizumabu na laboratorní testy přetrvává až 6 měsíců po poslední dávce (vzhledem k jeho dlouhému poločasu ~30 dní). Chromogenní testy aktivity FVIII používající bovinní reagencie na emicizumab nereagují a lze je používat ke sledování aktivity endogenního či substitučně aplikovaného FVIII. K měření inhibitorů FVIII lze použít chromogenní Bethesda test na bázi bovinního FVIII (podrobně viz SPC emicizumabu). Vyšetřování vzorků pacientů léčených emicizumabem musí být prováděno v laboratoři komplexního hemofilického centra (HCCC), nebo v jiné specializované laboratoři, která má s tímto vyšetřením zkušenost a má zavedeny potřebné laboratorní metody.
- Elektivní výkony by měly být plánovány až po dokončení úvodní nasycovací dávky a dosažení ustáleného stavu hladiny emicizumabu na udržovacích dávkách.
- Některé malé výkony s malým rizikem krvácení (např. zavedení/odstranění centrálního žilního katétru, jednoduchá zubní extrakce, endoskopie bez biopsie) mohou být provedeny i bez přídatné aplikace FVIII/ rFVIIa, záleží na konkrétním pacientovi, lokalizaci a přídatných rizicích. Pro případ krvácivých komplikací však musí být koagulační faktory na daném pracovišti neodkladně a trvale dostupné. Jako pomocná léčba jsou doporučena antifibibrinolytika (kyselina tranexamová).
- V případě abnormálního krvácení po výkonu: u pacientů bez inhibitoru substituce FVIII (SHL nebo EHL) ve standardní dávce, u pacientů s inhibitorem iniciální dávka rFVIIa (45–90 μg/kg). Eventuální další dávky podle potřeby, hladin a klinického stavu [17, 18].
- Pro velké chirurgické výkony a výkony s vysokým rizikem krvácení je nutné konkomitantní zajištění koagulačními faktory před výkonem i po výkonu do zhojení rány. U pacientů bez inhibitoru FVIII substitucí FVIII (SHL nebo EHL) podle potřeby s kyselinou tranexamovou. U pacientů s inhibitorem FVIII je lékem první linie iniciální dávka rFVIIa (90 μg/kg) a následně rFVIIa co 2–3 h s postupným prodlužováním intervalu [17, 18, 19, SPC emicizumabu]. Podrobně viz samostatný doporučený postup o léčbě osob s hemofilií a inhibitorem.
Antitrombotická profylaxe v pooperačním období u pacientů s hemofilií
U pacientů s hemofilií je obecně nižší riziko trombembolické choroby (TEN), není však nulové. V otázce nutnosti profylaxe v pooperačním období zatím neexistuje shoda názorů. Obecně jsou zejména u velkých chirurgických a ortopedických výkonů doporučeny nefarmakologické postupy – dostatečná hydratace pacienta, elastické kompresivní punčochy, intermitentní pneumatická komprese, časná rehabilitace a mobilizace pacienta. U rizikových pacientů, např. ve věku nad 40 let, obézních, s hormonální léčbou, s potvrzeným trombofilním stavem či osobní nebo rodinnou anamnézou TEN, ischemické choroby srdeční, vysokým rizikem infarktu myokardu a podobně, by mělo být zváženo použití farmakologické profylaxe nízkomolekulárním heparinem v redukované dávce za předpokladu pečlivé kontroly substituce koagulačními faktory. U hemofilických pacientů s inhibitorem není farmakologická profylaxe TEN doporučena [20, 21, 22].
Invazivní vyšetřovací metody
Před invazivními diagnostickými výkony (např. lumbální punkce, vyšetření arteriálních krevních plynů, endoskopie s odběrem biopsie apod.) je indikováno podání koncentrátu koagulačního faktoru. V současné době není jednoznačně dána minimální požadovaná aktivita FVIII/FIX stejně jako doba, po kterou je nutná substituce po výkonu. V literatuře se objevují tato doporučení na základě klinických zkušeností:
Kolonoskopie – úvodní substituce faktory na 70–80 % FVIII/IX (pro případ invazivního výkonu). Pokud byla provedena biopsie či polypektomie, je doporučeno pokračovat v substituci faktory à 12 h, aktivitu FVIII/FIX udržovat ≥ 40–50 % po dobu 4–8 dnů (8 dnů při endoskopické mukosální resekci), podávání antifibrinolytika 5–10 dnů. Při zvýšeném riziku krvácení je potřebná profylaxe 7–14 dnů. Na zvážení endoskopisty je profylaktické nasazení klipu v místě poranění sliznice [23].
Biopsie prostaty – úvodní substituce faktory na ≥ 80 % FVIII/IX, s následným udržováním aktivity FVIII/ IX ≥ 50 % po dobu 3–7 dnů, případně déle [24].
Biopsie jater – úvodní substituce na 80–100 % FVIII/ IX, s následným udržováním aktivity FVIII/IX 50–70 % po dobu minimálně 3 dnů [5].
Implantace Port-A-Cath® – úvodní substituce nad 80 % FVIII/IX, s následným udržováním aktivity FVIII/ IX ≥ 50 % po dobu minimálně 5 dnů, respektive do zhojení rány [5].
Podíl autorů na přípravě rukopisu
HR – příprava první verze rukopisu
SP, BJ, HA, EZ, ZH, MP – kritická revize rukopisu a schválení konečné verze
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
MUDr. Radomíra Hrdličková
Krevní centrum Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: radomira.hrdlickova@fno.cz
Zdroje
1. Hrdličková R, Smejkal P, Blatný J, et al. Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií. Transfuze Hematol. Dnes. 2016;22(1):39–43.
2. Guidelines for the Management of Hemophilia. World Federation of Hemophilia 2012; publikováno elektronicky 6. června 2012. DOI: 10.1111/j.1365-2516.2012.02909.
3. Australian Haemophilia Centre Directors´ Organisation (AHCDO). Guideline for the management of patients with haemophilia undergoing surgical procedures. November 2010. https://www.ahcdo. org.au/documents/item/13.
4. Bátorová A, Jankovičová D, Žarnovičanová M, et al. Národné štandardné postupy pre liečbu hemofilie a iných vrodených koagulopatií v Slovenskej republike. Lek Obz. 2008; 56 : 330–340.
5. Hermans C, Altisent C, Batorova A, et al. Replacement therapy for invasive procedures in patients with haemophilia: literature review, European survey and recommendation. Haemophilia. 2009;15 : 639–658.
6. Ljung RC, Knobe K. How to manage invasive procedures in children with haemophilia. Br J Haematol. 2012;157 : 519–528.
7. Pruthi RK. Laboratory monitoring of new hemostatic agents for hemophilia. Semin Hematol. 2016;53 : 28–44.
8. Gray E, Kitchen S, Bowyer A, et al. Laboratory measurement of factor replacement therapies in the treatment of congenital haemophilia: A United Kingdom Haemophilia Centre Doctors‘ Organisation guideline. Haemophilia. 2020;26(1):6–16.
9. Wallny TA, Strauss AC, Goldmann G, et al. Elective total knee arthroplasty in haemophilic patients. Proposal for a clinical pathway. Hamostaseologie. 2014;34(Suppl 1): S23–S29.
10. Wiedel J, Stabler S, Geraghty S, Funk S. Joint replacement surgery in hemophilia. World Federation of Hemophilia. 2010. http://www1. wfh.org/publication/files/pdf-1210.pdf
11. Batorova A, Holme P, Gringeri A, et al. Continuous infusion in haemophilia: current practice in Europe. Haemophilia. 2012;18(5):753–759.
12. Holme PA, Tjønnfjord GE, Batorova A. Continuous infusion of coagulation factor concentrates during intensive treatment. Haemophilia. 2018;24 : 24–32.
13. Bidlingmaier C, Demi MM, Kurnik K. Continuous infusion of factor concentrates in children with haemophilia A in comparison with bolus injections. Haemophilia. 2006;12 : 212–217.
14. Collins PW, Fischer K, Morfini M, et al. Implications of coagulation factor VIII and IX pharmacokinetics in the prophylactic treatment of haemophilia. Haemophilia. 2011;17 : 2–10.
15. Australian Haemophilia Centre Directors’Organisation (AHCDO). A consensus statement on the dental treatment of patients with inherited bleeding disorders July 2010. https://www.ahcdo.org.au/ documents/item/14
16. Anderson JAM, Brewer A, Creagh D, et al. Guidance on the dental management of patients with haemophilia and congenital bleeding disorders. Br Dent J. 2013;215 : 497–504.
17. Susen S, Gruel Y, Godier A, et al. Management of bleeding and invasive procedures in haemophilia A patients with inhibitor treated with emicizumab (Hemlibra®): Proposals from the French network on inherited bleeding disorders (MHEMO), the French Reference Centre on Haemophilia, in collaboration with the French Working Group on Perioperative Haemostasis (GIHP). Haemophilia. 2019;00 : 1–7.
18. MASAC document #258. Recommendation on the use and management of emicizumab - KXWH (HEMLIBRA®) for hemophilia A with and without inhibitors. https://www.hemophilia.org/sites/ default/files/document/files/258_emicizumab.pdf
19. Levy GG, Asikanius E, Kuebler P, et al. Safety analysis of rFVIIa with emicizumab dosing in congenital hemophilia A with inhibitors: Experience from the HAVEN clinical program. J Thromb Haemost. 2019;17(9):1470–1477.
20. Ozelo MC. Surgery in patients with hemophilia: is thromboprophylaxis mandatory? Thromb Res. 2012;130(Suppl 1):S23–S26.
21. Zakarija A, Aledort L. How we treat: venous trombembolism prevention in haemophilia patients undergoing major orthopaedics surgery. Haemophilia. 2009;15 : 1337–1338.
22. Hermans C. Venous thromboembolic disease in patients with haemophilia. Thromb Res. 2012;130(Suppl 1):S50-S52.
23. Tintillier V, Branche J, Maunoury V, et al. Colonoscopy in patients with haemophilia: the duration of factor coverage must be adjusted to suit the procedure. Haemophilia. 2013;19:e296–e323.
24. Fogarty PF, Koudide P. How we manage prostate biopsy and prostate cancer therapy in men with haemophilia. Haemophilia. 2012;18:e88–e90.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2020 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- COVID-19 a transfuzní služba v ČR
- Regenerující krvetvorba se podobá embryonální krvetvorbě nezávislé na kmenových buňkách
- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
- Léčba multicentrické a unicentrické formy Castlemanovy nemoci
- Tematizace problémů komplexní péče z perspektivy osob s hemofilií
- Hodnocení znalosti transfuzního lékařství u lékařů po promoci v Turecku
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Vzácné kožní změny asociované s monoklonální gamapatií: skleredém, skleromyxedém a IgA pemfigus – popis pěti případů a přehled léčebných možností
- Doporučený postup pro použití rekonvalescentní plazmy v léčbě dospělých pacientů s COVID-19
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií, vydání 2., rok 2020
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



