-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL)
Recommendations for the diagnosis and treatment of chronic lymphocytic leukaemia
Chronic lymphocytic leukaemia (CLL) is a disease with a remarkably heterogeneous clinical course. Because diagnosis and therapy must be tailored individually according to patient age, comorbidities and therapeutic gaols and as the understanding of CLL has been deepening at considerable speed, the Czech CLL Study Group, the working party of the Czech Haematological Society, has developed the following guidelines to facilitate the diagnostic and therapeutic decision-making process in clinical practice. These guidelines are based on a comprehensive analysis of current literature and follow the principles of evidence-based medicine.
Key words:
chronic lymphocytic leukaemia, diagnostics, treatment
Autoři: L. Smolej 1; M. Doubek 2; M. Špaček 3; R. Urbanová 4; P. Obrtlíková 3; J. Schwarz 5; D. Lysák 6; Š. Pospíšilová 2; M. Jarošová 4; S. Peková 7; T. Kozák 8
Působiště autorů: IV. interní hematologická klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy Hradec Králové 1
Vyšlo v časopise: Transfuze Hematol. dnes,19, 2013, No. 2, p. 61-68.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Add autoři: Česká skupina pro chronickou lymfocytární leukemii, sekce České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně
Souhrn
Chronická lymfocytární leukemie (CLL) je onemocnění s mimořádně různorodým klinickým průběhem. Vzhledem k tomu, že diagnostiku a léčbu je nutno individualizovat s přihlédnutím k věku nemocných, přidruženým onemocněním a cílům léčby a vzhledem k tomu, že nové poznatky o CLL přibývají v posledních letech obrovským tempem, vytvořila Česká skupina pro CLL, sekce České hematologické společnosti ČLS JEP, tato doporučení k usnadnění rozhodování o diagnostických a léčebných postupech v klinické praxi. Doporučení se zakládají na důkladné analýze současné literatury a vycházejí z principů medicíny založené na důkazech (evidence-based medicine, EBM).
Klíčová slova:
chronická lymfocytární leukemie, diagnostika, léčba1. Stanovení diagnózy chronické lymfocytární leukemie
Diagnóza chronické lymfocytární leukemie (CLL) je založena na aktuálních kritériích National Cancer Institute-Sponsored Working Group (NCI-WG) uvedených v tabulce 1 (1). Zakládá se tedy na provedení krevního obrazu s diferenciálním rozpočtem a průtokové cytometrie periferní krve. Vzhledem k tomu, že maligní klon je možno jednoznačně identifikovat v periferní krvi, není pro stanovení diagnózy CLL nutné vyšetření kostní dřeně či mízní uzliny. Vyšetření kostní dřeně je zpravidla prováděno k objasnění etiologie anémie či trombocytopenie – odlišení infiltrace při CLL, autoimunitní příčiny nebo útlumu po proběhlé léčbě. Exstirpace a histologické vyšetření mízní uzliny je indikováno v případě, kdy není diagnóza CLL jednoznačná (např. netypický imunofenotyp) či při podezření na transformaci do jiné lymfoproliferace (Richterův syndrom). Diferenciálně diagnosticky je třeba od CLL odlišit zej-ména prolymfocytární leukemii, leukemizovaný lymfom z plášťových buněk, leukemii z vlasatých buněk, leukemizovaný folikulární lymfom a další indolentní lymfoproliferace. K tomu lze při imunofenotypizaci využít skóre dle Matutes založené na expresi znaků CD5, CD23, FMC7, sIg a CD79b (tab. 2). Zatímco CLL má zpravidla skóre 4-5, většina ostatních lymfoproliferací má zpravidla skóre 0-2 (2). V případě záchytu klonu B-lymfocytů pod hranicí 5x109/l a zároveň nepřítomnosti cytopenie, lymfadenopatie či splenomegalie nejde o CLL, ale o monoklonální lymfocytózu z B-lymfocytů (MBL). Pouze část z těchto nemocných progreduje do CLL (zhruba 1–2 % ročně). Lymfom z malých lymfocytů (small lymphocytic lymphoma, SLL) má identický imunofenotyp, nejzásadnějším rozdílem vůči CLL je nesplnění kritéria periferní lymfocytózy. Aktuální klasifikace Světové zdravotnické organizace uvádí CLL a SLL jako společnou jednotku CLL/SLL.
Tab. 1. Diagnostická kritéria CLL dle National Cancer Institute-Sponsored Working Group (1). 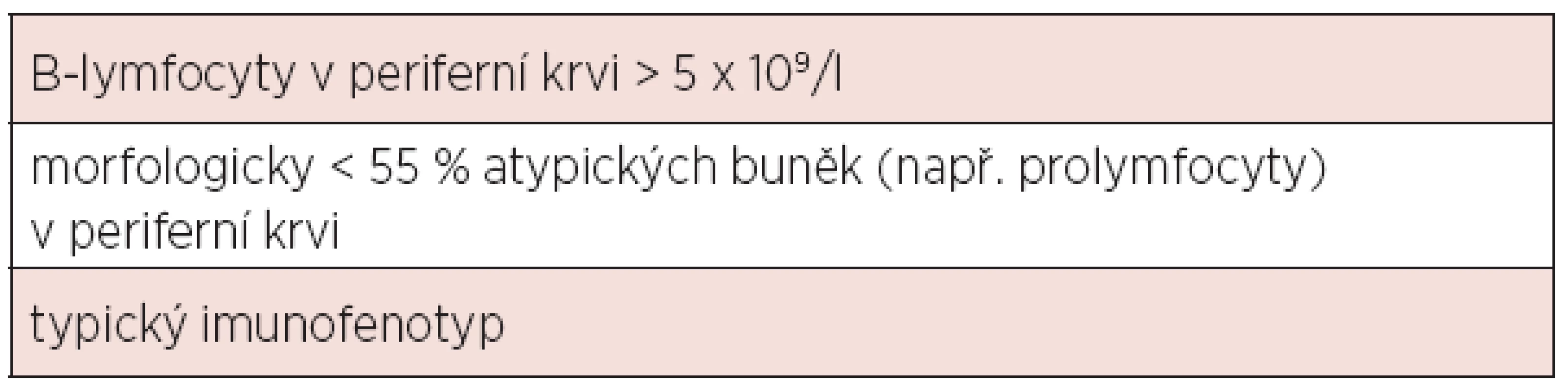
Tab. 2. Skóre pro stanovení diagnózy CLL průtokovou cytometrií. Většina případů CLL má skóre 4–5, naopak většina ostatních lymfoproliferací skóre 0–2 (2). 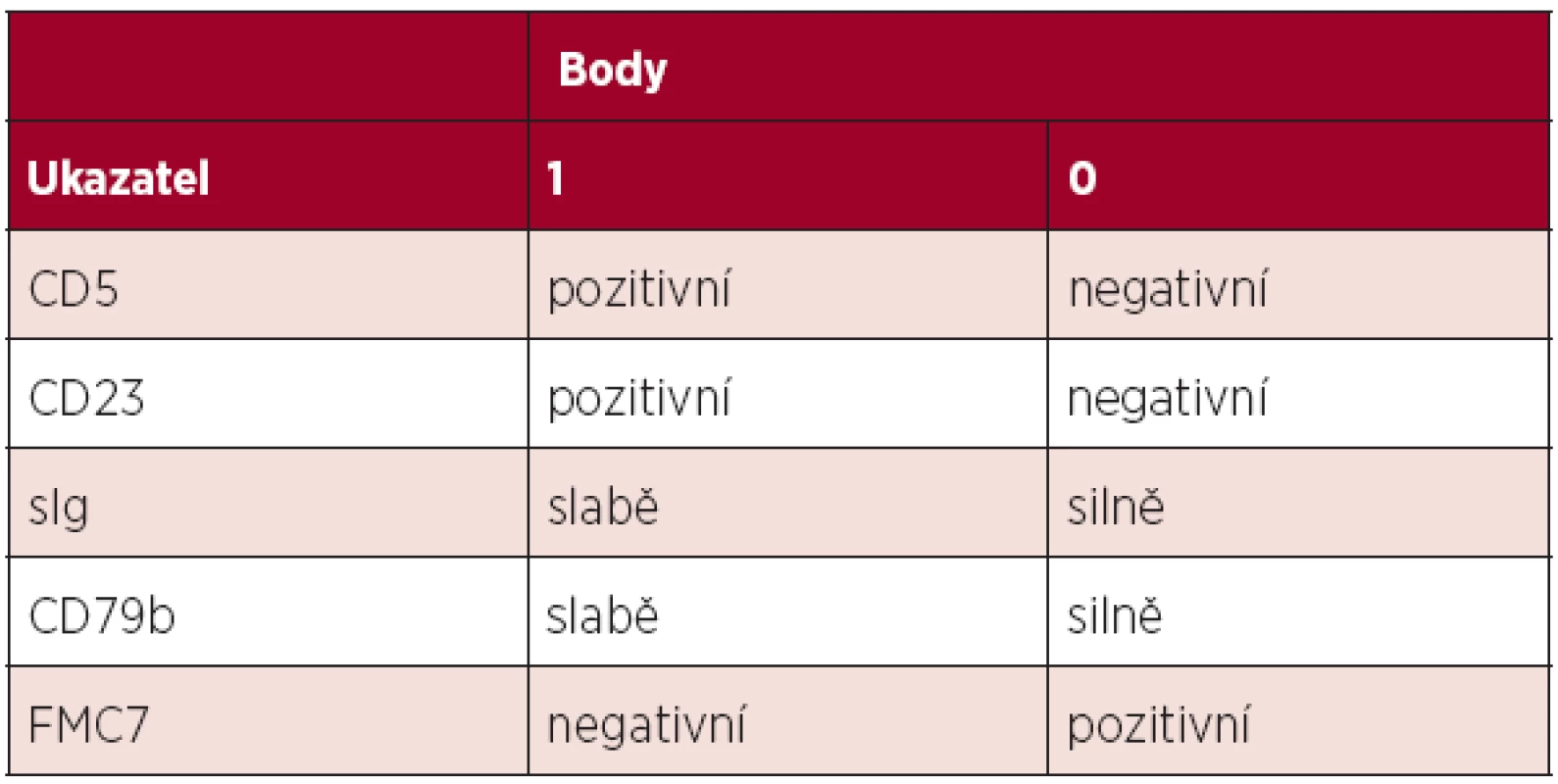
2. Vyšetření u nemocných s nově diagnostikovanou CLL
Kromě pečlivé anamnézy, fyzikálního vyšetření (s dvourozměrným změřením lymfatických uzlin v každé oblasti) a stanovení klinického stadia (dle Raie či Bineta) by měla být u nemocných s nově zjištěnou CLL provedena vyšetření uvedená v tabulce 3.
Tab. 3. Vyšetření vhodná u nemocných s nově zjištěnou CLL. 
Vysvětlivky: LDH – laktátdehydrogenáza, B2M – beta 2-mikroglobulin. 3. Prognostická vyšetření u CLL
Vzhledem k mimořádné klinické variabilitě nemocných s CLL, a to i v rámci jednoho klinického stadia, je vhodné u nemocných, kteří jsou možnými kandidáty intenzivní léčby, zvážit diagnostické testy umožňující individuální prognózu zpřesnit. Mezi tyto testy patří zejména: vyšetření genetických aberací fluorescenční in situ hybridizací (FISH – delece 13q, 11q, 17p, trizomie 12), stanovení mutačního stavu genů pro variabilní část těžkého řetězce imunoglobulinu (IgVH), vyšetření abnormalit v genu TP53 (zpravidla technikami DNA sekvenování), event. vyšetření exprese CD38 a ZAP-70 (3–6). Tyto prognostické faktory mají zásadní vliv na období bez léčby, období do progrese a celkové přežití. V současné době považujeme za velmi vhodné u nemocných vhodných k intenzivním léčebným modalitám (kombinované fludarabinové režimy, alemtuzumab, alogenní transplantace) provést vyšetření chromozomálních abnormalit pomocí FISH a analýzu mutací TP53 vždy před zahájením 1. linie léčby a také před každou novou linií léčby (6, 7); u stejné skupiny nemocných též doporučujeme vyšetření mutačního stavu IgVH (vyšetřuje se jednorázově).
Význam zobrazovacích vyšetření u CLL není dosud zcela jasný, avšak vzhledem k častému výskytu zejména nitrobřišní lymfadenopatie a jejímu nepříznivému prognostickému významu je vhodné v rámci posuzování stadia onemocnění před léčbou a při hodnocení léčebné odpovědi zvážit ultrasonografii břicha, u mladších nemocných eventuálně CT hrudníku a břicha (7).
4. Léčba CLL
Léčba nemocných s CLL mimo klinické studie je individuální s přihlédnutím ke všem okolnostem aktuálního stavu nemocného, přidruženým onemocněním, přáním apod. Vzhledem k tomu, že pouze klinický výzkum vede ke zlepšování výsledků léčby, měla by být každému vhodnému nemocnému s CLL nabídnuta účast v některé z klinických studií probíhajících v České republice. Zásadní je dobrá komunikace mezi regionálními hematologickými pracovišti a centry intenzivní hematologické péče (CIHP). Velice důležité je do CIHP včas referovat mladší nemocné s vysoce nepříznivým průběhem CLL ke zvážení alogenní transplantace krvetvorných buněk.
4.1 Indikace k léčbě CLL
Řídíme se dle obecně uznávaných kritérií NCI-WG (1). Nemocní s pokročilým onemocněním (stadium III a IV dle Raie nebo stadium C dle Bineta) jsou indikováni k zahájení léčby. Pouze u malé skupiny nemocných se stabilní mírnou anémií či trombocytopenií je možno léčbu nezahajovat a pacienta pečlivě monitorovat. U nemocných se středně pokročilým onemocněním (Rai I/II či Binet B) by měla být léčba zahájena pouze při průkazu aktivity CLL.
K definici aktivního onemocnění a zahájení léčby je nutné splnit alespoň jedno z následujících kritérií:
- Průkaz progresivního selhání kostní dřeně, které se projevuje rozvojem nebo zhoršením anémie a/nebo trombocytopenie.
- Masivní (tj. > 6 cm pod levým žeberním obloukem) nebo progresivní nebo symptomatická splenomegalie.
- Masivní lymfadenopatie (tj. > 10 cm v nejdelším průměru) nebo progresivní nebo symptomatická lymfadenopatie.
- Progresivní lymfocytóza se vzestupem > 50 % po dobu 2 měsíců nebo doba zdvojnásobení počtu lymfocytů (LDT) kratší než 6 měsíců. Zejména u nemocných s úvodní lymfocytózou pod 50 x 109/l je třeba vyloučit jiné faktory, které mohou přispívat k lymfocytóze nebo lymfadenopatii, např. infekce. Progrese lymfocytózy se může u některých nemocných zpomalit, proto je vhodné zejména při absenci ostatních známek aktivity CLL pečlivě sledovat klinický vývoj.
- Autoimunitní anémie a/nebo trombocytopenie špatně odpovídající na kortikosteroidy nebo jinou standardní léčbu.
- Nejméně jeden z následujících systémových příznaků souvisejících s onemocněním:
Nechtěný úbytek hmotnosti ≥ 10 % v průběhu předchozích 6 měsíců.
Významná únava (tj. výkonnostní stav dle ECOG 2 nebo horší, nemožnost pracovat nebo provádět obvyklé činnosti).
Horečky nad 38,0 °C po dobu 2 nebo více týdnů bez průkazu infekce.
Noční pocení po dobu delší než 1 měsíc bez průkazu infekce.
Autoimunitní hemolytická anémie a autoimunitní trombocytopenie nejsou indikací k cytoredukční léčbě, nejsou-li současně splněna jiná kritéria aktivity CLL. Nemocní s autoimunitními cytopeniemi by měli být léčeni imunosupresivní léčbou, např. kortikoterapií. Hypogamaglobulinemie nebo monoklonální/oligoklonální paraproteinemie není sama o sobě důvodem zahájení léčby. U nemocných s CLL může být značně zvýšený počet leukocytů, avšak u CLL jsou příznaky z leukostázy extrémně velmi vzácné. Proto by neměl být absolutní počet leukocytů používán jako samostatný indikátor léčby u asymptomatických nemocných. Samotná přítomnost nepříznivých prognostických faktorů (nemutované IgVH geny, del 17p apod.) bez klinické aktivity CLL není v žádném případě indikací k zahájení léčby.
4.2 Vyšetření před léčbou
Před zahájením léčby je vhodné provést tato vyšetření:
- stanovení rozsahu onemocnění: fyzikální vyšetření + zvážit ultrasonografii břicha, u mladších nemocných event. CT hrudníku a břicha. Vyšetření kostní dřeně – je nutné zejména u nemocných s anémií či trombocytopenií k posouzení etiologie. Dále je doporučeno provést vyšetření FISH, zejména del 17p a analýzu mutací TP53, jejichž přítomnost může ovlivnit volbu léčby (6).
- vyšetření nutná ke stanovení bezpečnosti léčby: kromě základních biochemických ukazatelů zejména přímý antiglobulinový (Coombsův) test + ukazatele hemolýzy (bilirubin, laktátdehydrogenáza, retikulocyty, haptoglobin) (4). U nemocných s aktivní auto-imunitní hemolýzou není zpravidla použití fludarabinu doporučováno. Samotná pozitivita Coombsova testu bez aktivní hemolýzy však není důvodem fludarabin nepoužít (8). Dále vyšetřujeme sérologie hepatitid k vyloučení chronické hepatitidy B či C. Velmi důležité je stanovení funkce ledvin vzhledem k renálnímu vylučování řady cytostatik, zejména fludarabinu a cyklofosfamidu. Lze použít např. vypočtenou clearance kreatininu dle Cockroftovy a Gaultovy rovnice (9).
- Posouzení celkového stavu a přidružených onemocnění je velice důležité pro stanovení cílů léčby. Důležitější než kalendářní je biologický věk. Stanovujeme výkonnostní stav dle ECOG, vhodné je však také určit skóre přidružených onemocnění, např. Cumulative Illness Rating Scale (CIRS) (10). Základním způsobem lze rozdělit nemocné do tří skupin: a) nemocní v dobrém stavu bez závažných přidružených onemocnění, skóre CIRS ≤ 6; b) nemocní s významnými přidruženými onemocněními, ale v uspokojivém stavu, CIRS = 7–18; c) nemocní ve špatném stavu s těžkými komorbiditami, CIRS ≥ 18.
- Zásadní je také vzít v úvahu přání nemocného. Cíle a představy lékaře a nemocného se nemusí vždy shodovat, proto je důležité s nemocným prodiskutovat všechny vhodné možnosti léčby a podrobně vysvětlit výhody a nevýhody jednotlivých postupů.
4.3 Hodnocení léčebné odpovědi
Řídí se publikovanými doporučeními NCI-WG (1). Hodnocení léčebné odpovědi je vhodné provést po 2–3 měsících od ukončení léčby z důvodu umožnění regenerace v krevním obraze po myelotoxických režimech typu FCR. Hodnocení léčebné odpovědi se opírá o fyzikální vyšetření a vyšetření krevního obrazu s diferenciálním rozpočtem leukocytů. Tato vyšetření mohou být doplněna o vyšetření kostní dřeně a vyšetření zobrazovacími metodami. Ideálním cílem léčby je dosažení kompletní remise (CR), pro kterou je nutné provedení biopsie kostní dřeně bez průkazu leukemické infiltrace. Jednotlivé kategorie léčebné odpovědi a jejich definice jsou shrnuty v tabulce 4.
Tab. 4. Hodnocení léčebné odpovědi u CLL, upraveno dle (1). 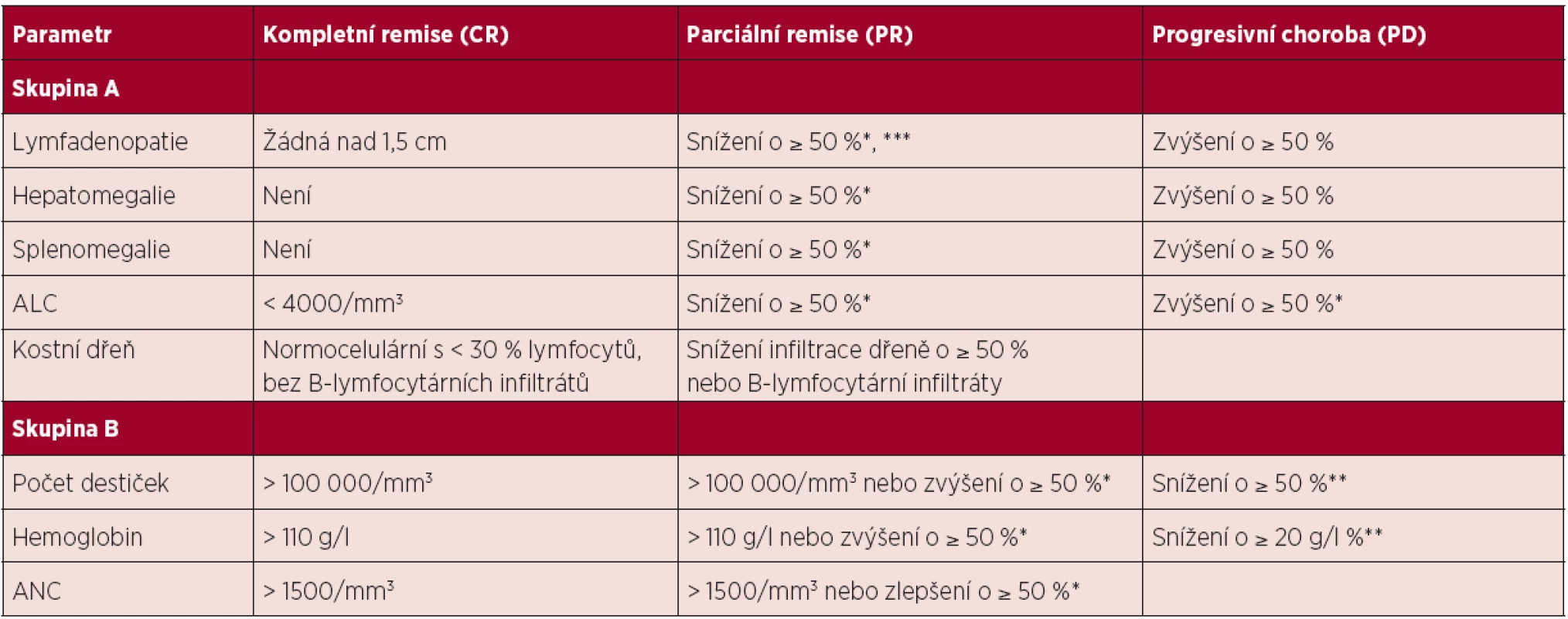
Poznámky a vysvětlivky k tabulce: * oproti vstupnímu stavu před léčbou; ** v důsledku CLL; ***aniž by se některá z uzlin zvětšila (povolenou výjimkou je zvětšení u malých uzlin do průměru 2 cm o maximálně 25 %); ALC – absolutní počet lymfocytů, ANC – absolutní počet neutrofilů Definice kompletní remise (CR): splněna veškerá kritéria skupiny A i B a nemocný nesmí mít systémové příznaky spojené s CLL. Definice parciální remise (PR): splněna nejméně 2 kritéria ze skupiny A + nejméně jedno kritérium ze skupiny B. Definice stabilní choroby (SD): nedosažení léčebné odpovědi (tedy CR či PR), zároveň nejsou splněna kritéria progresivní choroby. Definice progresivní choroby (PD): splněno nejméně jedno z kritérií skupiny A či B. Pro splnění definice CR a PR musí být hodnocené parametry stabilní nejméně 2 měsíce. Kompletní remise s neúplnou restitucí krevního obrazu (CRi) je definována stejně jako CR s výjimkou sníženého absolutního počtu neutrofilů a/nebo hemoglobinu a/nebo trombocytů. Pokud bylo dosaženo PR na základě hodnocení krevního obrazu a organomegalie, je vyšetření kostní dřeně irelevantní, neboť nezmění kategorii léčebné odpovědi. Do kategorie „Progresivní choroba“ se řadí také transformace do lymfoproliferace vyšší malignity. Relaps je stav, kdy u nemocného, jenž dosáhl po léčbě CR nebo PR, dojde za ≥ 6 měsíců od skončení léčby k progresi nemoci (viz definice PD). Refrakterní onemocnění je definováno jako nedosažení CR nebo PR či relaps/progrese do 6 měsíců od ukončení léčby. 4.4 Léčba 1. linie
Na základě výsledků randomizované studie CLL-8 je v současné době považována za standard léčby u nemocných v dobrém stavu a bez závažných přidružených onemocnění chemoimunoterapie kombinující fludarabin, cyklofosfamid a rituximab (FCR) (10). U nemocných s významnými komorbiditami je hlavní léčebnou možností léčba chlorambucilem. U těžce komorbidních nemocných ve špatném celkovém stavu je vhodná pouze podpůrná léčba (10, 12–13).
Další možnosti léčby 1. linie
Vzhledem ke klinické variabilitě a častým komorbiditám u nemocných s CLL je často nutno léčbu individualizovat. K dispozici jsou další léčebné možnosti, například:
- Bendamustin v monoterapii u nemocných, kteří nejsou vhodní pro léčbu fludarabinovým režimem (14).
- Fludarabin + cyklofosfamid v redukovaných dávkách v kombinaci s rituximabem (nízkodávkovaný FCR) u starších či komorbidních nemocných s CLL, u kterých by protokol FCR v plných dávkách byl nepřijatelně toxický (13).
- Kombinace rituximabu s chemoterapií (např. chlorambucil, COP, CHOP) u nemocných, kteří nemohou být léčeni fludarabinovými režimy (renální insuficience, aktivní autoimunitní hemolytická anémie apod.) (7, 15).
- Alemtuzumab u nemocných, u kterých není možno použít fludarabinové režimy (15, 16).
- Rituximab v monoterapii, zejména u nemocných, kteří mají masivní postižení dřeně a kvůli komorbiditám nemohou absolvovat chemoterapii, či u nemocných s autoimunitní cytopenií nereagující na 1. linii imunosupresivní léčby (16).
4.5 Léčba relapsu/refrakterní CLL
Obecně je možné zopakovat původní léčbu, trvala-li léčebná odpověď minimálně 12 měsíců (u kombinovaných fludarabinových režimů alespoň 24 měsíců). Na základě randomizované studie REACH je základní možností léčby relapsu CLL režim FCR, zejména pokud léčebná odpověď na předchozí linii trvala méně než 12 měsíců a nemocný nebyl dosud léčen rituximabem či kombinovaným fludarabinovým režimem (17). V případě refrakterní choroby je vždy nutné změnit léčebný přístup. Nemocní s refrakterní CLL by měli být včas konzultováni v některém z center intenzivní hematologické péče (CIHP), které by mělo řídit další strategii léčby, a mělo by být zváženo provedení alogenní transplantace krvetvorných buněk.
Tab. 5. Možnosti léčby CLL. 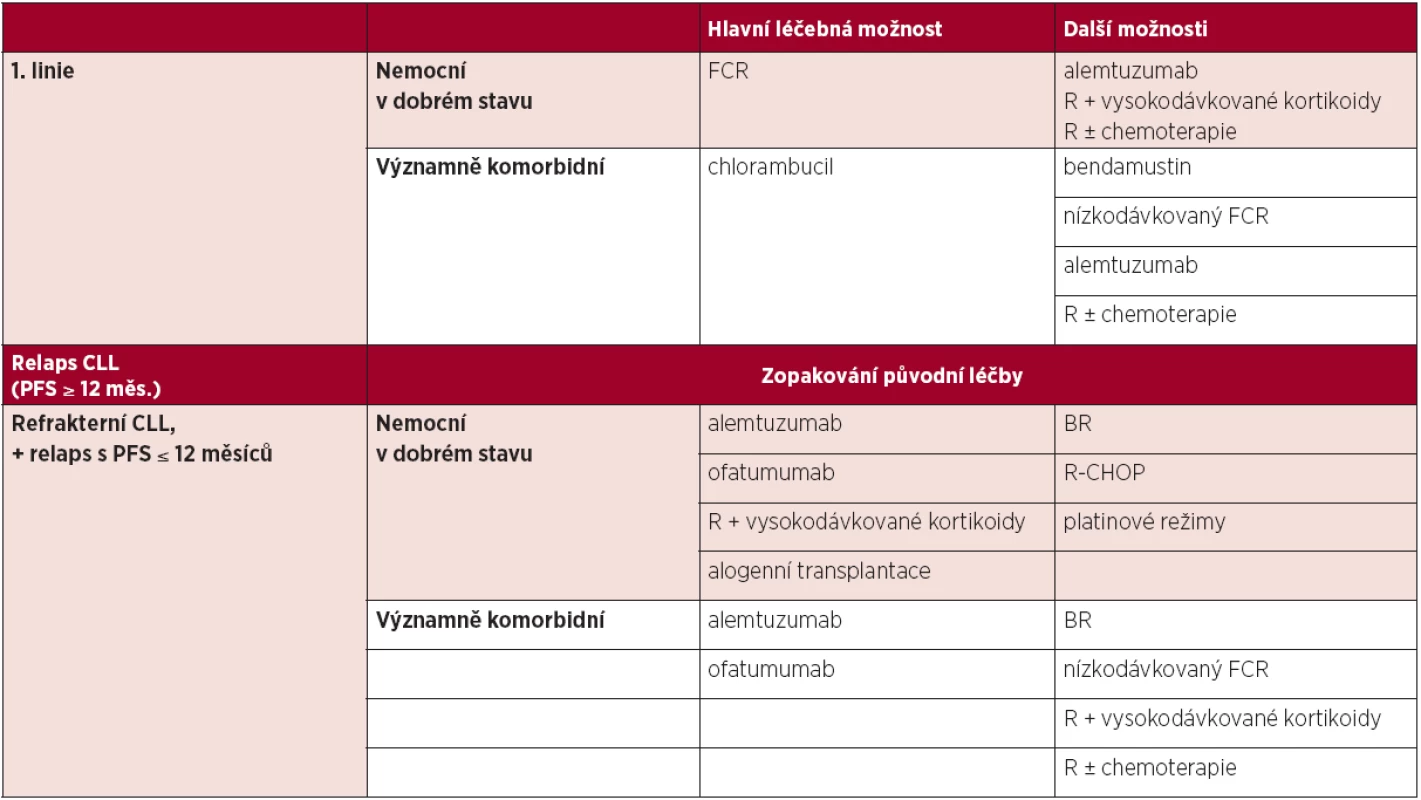
Podrobnější informace uvedeny v části 4.4 a 4.5 Vysvětlivky: FCR – fludarabin + cyklofosfamid + rituximab, R – rituximab, R-CHOP – rituximab + cyklofosfamid + doxorubicin + vinkristin + prednison, BR – bendamustin + rituximab, PFS – přežití bez progrese. Alemtuzumab je základní možností léčby u nemocných, u kterých selhal fludarabinový režim (18, 19). U nemocných s refrakterní CLL refrakterních na fludarabin i alemtuzumab je lékem volby ofatumumab (20).
Dalšími možnostmi léčby relapsu/refrakterní CLL jsou:
- Vysokodávkované kortikoidy (dexametazon, metylprednizolon) v monoterapii či kombinaci s dalšími léky (rituximab, alemtuzumab) zejména u refrakterních nemocných (21, 22);
- Bendamustin v kombinaci s rituximabem – tento režim je možné použít i u nemocných refrakterních na fludarabin (23);
- Ofatumumab u nemocných refrakterních na fludarabin s masivní lymfadenopatií (nad 5 cm) (20);
- Fludarabin + cyklofosfamid v redukovaných dávkách v kombinaci s rituximabem u starších či komorbidních nemocných s CLL, u kterých by chemoterapie v plných dávkách byla nepřijatelně toxická (13);
- Rituximab v monoterapii, zejména u nemocných, kteří mají masivní postižení dřeně a kvůli komorbiditám nemohou absolvovat chemoterapii, či u nemocných s autoimunitní cytopenií nereagující na 1. linii léčby (15);
- Kombinace rituximabu s chemoterapií (chlorambucil, COP, CHOP) u nemocných s aktivní CLL splňující kritéria léčby, kteří však nemohou být léčeni fludarabinovými režimy (renální insuficience, aktivní autoimunitní hemolytická anémie) (15);
- Alemtuzumab v monoterapii u nemocných s refrakterní a život ohrožující autoimunitní hemolytickou anémií a autoimunitní trombocytopenií (19);
- Kombinace rituximabu s intenzivními režimy (např. DHAP) u refrakterních nemocných mladšího věku v dobrém stavu (24);
- Alemtuzumab v kombinaci s fludarabinem (25).
4.6 Minimální reziduální nemoc
Moderní léčebné protokoly vedou u významné části nemocných ke snížení leukemického klonu pod úroveň detekce běžnými metodami; zbytkové leukemické elementy (minimální reziduální nemoc, MRN) mohou být zjistitelné pouze velmi citlivými metodami. V literatuře přibývá důkazů o prodloužení přežití bez progrese a celkového přežití u nemocných, u kterých bylo dosaženo negativity MRN. Sledování MRN (pomocí vícebarevné průtokové cytometrie s citlivostí až 10-5 nebo polymerázové řetězové reakce s individuálně připravenými primery s citlivostí až 10-5) je tedy vhodné zvážit u nemocných léčených intenzivní léčbou (např. kombinované fludarabinové režimy, alemtuzumab, alogenní transplantace) (7, 26). Dosud se nejedná o vyšetření povinné, ale význam MRN v budoucnu pravděpodobně významně vzroste.
4.7 Transplantace krvetvorných buněk
Alogenní transplantace krvetvorných buněk by měla být včas nabídnuta každému nemocnému s CLL s nepříznivým klinickým průběhem. Tito nemocní by měli být včas konzultováni v některém z CIHP, které by mělo řídit další strategii léčby. Použití nemyeloablativního přípravného režimu (s redukovanou intenzitou) přináší nižší peritransplantační mortalitu a možnost provést transplantaci u nemocných do 65 (výjimečně 70) let. Tato metoda je v současné praxi upřednostňována před klasickým myeloablativním přístupem (27). Vysokodávkovaná chemoterapie s autologní transplantací periferních kmenových buněk byla v současné době prakticky opuštěna (28).
4.8 Transformace CLL (Richterův syndrom)
Transformace CLL do jiné lymfoproliferace, nejčastěji difuzního velkobuněčného lymfomu, je prognosticky vysoce nepříznivý jev. Na transformaci CLL je nutno pomýšlet při následujících nálezech: významné zvýšení laktátdehydrogenázy, progrese lymfadenopatie, zejména asymetrické v jedné oblasti, rozvoj B-příznaků, progrese při terapii. Při podezření na Richterův syndrom je možné využít vyšetření PET/CT. K potvrzení Richterovy transformace je rozhodující exstirpace mízní uzliny s histologickým vyšetřením. U nemocných s Richterovým syndromem je indikována léčba pro agresivní lymfomy (chemoimunoterapie využívající rituximab u CD20+ pozitivních lymfomů) včetně léčby transplantační (29).
4.9 Podpůrná léčba
U každého nemocného léčeného protokoly obsahujícími fludarabin či kortikoidy by měla být zvážena protiinfekční profylaxe (sulfametoxazol + trimetoprim, antivirotika, event. antimykotika). Kombinace sulfametoxazol/ trimetoprim + antivirotika je povinná u protokolů obsahujících alemtuzumab či vysokodávkované kortikoidy (19, 22, 30). U nemocných s opakovanými bakteriálními infekcemi a sníženou koncentrací IgG pod 5 g/l by měla být individuálně zvážena substituce nitrožilními imunoglobuliny (7). U pacientů s CLL léčených chemoterapií, imunoterapií či imunochemoterapií, u kterých dojde k rozvoji anémie, je indikována léčba erytropoézu-stimulujícími proteiny (erytropoetin, darbepoetin) v souladu s mezinárodními doporučeními (31). U nemocných, kteří jsou těžce imunosuprimováni, zejména po léčbě fludarabinem či alemtuzumabem a po alogenní transplantaci, stejně jako u nemocných, u kterých se uvažuje o provedení alogenní transplantace v budoucnu, by měly být používány ozářené transfuzní přípravky vzhledem ke zvýšenému riziku rozvoje reakce štěpu proti hostiteli spojené s transfuzí (7). Vzhledem k tomu, že intenzivní léčebné protokoly, zejména protokoly obsahující fludarabin či alemtuzumab, jsou spojeny s vysokým rizikem febrilní neutropenie, je vhodné na základě individuálního rizika zvážit primární profylaxi febrilní neutropenie pomocí granulocytové kolonie stimulujícího faktoru (G-CSF) v souladu s doporučeními mezinárodních společností (32). V případě výskytu těžké neutropenie při léčbě je také vhodné podat G-CSF.
Seznam použitých zkratek
ANC absolutní počet neutrofilů
ALC absolutní počet lymfocytů
aloT alogenní transplantace krvetvorných buněk
B2M beta 2-mikroglobulin
BR bendamustin+rituximab
CHOP cyklofosfamid, doxorubicin, vinkristin, prednizon
CIHP centrum intenzivní hematologické péče
CIRS Cumulative Illness Rating Scale
COP cyklofosfamid, vinkristin, prednizon
CR kompletní remise
DHAP dexametazon, cytosin arabinosid, cisplatina
ECOG Eastern Cooperative Oncology Group
EGIL European Group for the Immunological Characterization of Leukemias
EORTC European Organisation for Research and Treatment of Cancer
ESMO European Society for Medical Oncology
FC fludarabin + cyklofosfamid
FCR fludarabin + cyklofosfamid + rituximab
FISH fluorescenční in situ hybridizace
G-CSF granulocytární kolonie stimulující faktor
IgVH variabilní část těžkého řetězce imunoglobulinu
LDH laktátdehydrogenáza
MRN minimální reziduální nemoc
NCI-WG National Cancer Institute-Sponsored Working Group
PD progresivní choroba
PR parciální remise
R rituximab
SD stabilní onemocnění
Upozornění: Tato doporučení jsou pouze návodem, jak je možno u nemocných s CLL postupovat. Autoři nenesou žádnou právní zodpovědnost za obsah těchto doporučení ani volbu konkrétního postupu u konkrétního nemocného – ta je plně zodpovědností ošetřujícího lékaře.
Práce byla podpořena granty IGA MZ ČR NT13412-4/2012 a NT 13493-4/2012, programem PRVOUK P37/08/400 Lékařské fakulty Univerzity Karlovy v Hradci Králové, programem rozvoje vědních oborů Univerzity Karlovy (projekt P36), výzkumným záměrem MZ ČR 00179906 a projekty MŠMT CEITEC (CZ.1.05/1.1.00/02.0068), SuPReMMEe (CZ.1.07/2.3.00/20.0045) a VZ MSM0021622430.
Doručeno do redakce: 15. 2. 2013
Přijato: 20. 2. 2013
Doc. MUDr. Lukáš Smolej, Ph.D.
IV. interní hematologická klinika
Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy v Hradci Králové
Sokolská 581
500 05 Hradec Králové
Zdroje
1. Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia (IWCLL) updating the National Cancer Institute-Working Group (NCI-WG) 1996 guidelines. Blood 2008; 111 : 5446-5456.
2. Moreau EJ, Matutes E, A‘Hern RP, et al. Improvement of the chronic lymphocytic leukemia scoring system with the monoclonal antibody SN8 (CD79b). Am J Clin Pathol 1997; 108(4): 378-382.
3. Cramer P, Hallek M. Prognostic factors in chronic lymphocytic leukemia-what do we need to know? Nat Rev Clin Oncol 2011; 8(1): 38-47.
4. Eichhorst B, Dreyling M, Robak T, Montserrat E, Hallek M. Chronic lymphocytic leukemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2011; 22(Suppl 6): vi50-54.
5. Ghia P, Stamatopoulos K, Belessi C, et al. ERIC recommendations on IGHV gene mutational status analysis in chronic lymphocytic leukemia. Leukemia 2007; 21(1): 1-3.
6. Pospisilova S, Gonzalez D, Malcikova J, et al. ERIC recommendations on TP53 mutation analysis in chronic lymphocytic leukemia. Leukemia 2012; 26(7): 1458-1461.
7. Oscier D, Dearden C, Erem E, et al. British Committee for Standards in Haematology. Guidelines on the diagnosis, investigation and management of Chronic Lymphocytic Leukaemia. Br J Haematol 2012; 159 : 541-564.
8. Catovsky D. Assessment of fludarabine plus cyclophosphamide for patients with chronic lymphocytic leukaemia (the LRF CLL4 Trial): a randomised controlled trial. Lancet 2007; 370 : 230-239.
9. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976; 16(1): 31-41.
10. Salvi F, Miller MD, Grilli A, et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly patients. J Am Geriatr Soc 2008; 56(10): 1926-1931.
11. Hallek M, Fischer K, Fingerle-Rowson G, et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet 2010; 376(9747): 1164-1174.
12. Eichhorst BF, Busch R, Stilgenbauer S, et al. First-line therapy with fludarabine compared with chlorambucil does not result in a major benefit for elderly patients with advanced chronic lymphocytic leukemia. Blood 2009; 114(16): 3382-3391.
13. Smolej L. Therapy of elderly/comorbid patients with chronic lymphocytic leukemia. Curr Pharm Des. 2012; 18(23): 3399-3405.
14. Knauf WU, Lissitchkov T, Aldaoud A, et al. Bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukaemia: updated results of a randomized phase III trial. Br J Haematol 2012; 159(1): 67-77.
15. Mauro FR, Bandini G, Barosi G, et al. SIE, SIES, GITMO updated clinical recommendations for the management of chronic lymphocytic leukemia. Leuk Res 2012; 36(4): 459-466.
16. Hillmen P. Alemtuzumab compared with chlorambucil as first-line therapy for chronic lymphocytic leukemia. J Clin Oncol 2007; 25 : 5616-5623.
17. Robak T, Dmoszynska A, Solal-Celigny P, et al. Rituximab plus fludarabine and cyclophosphamide prolongs progression-free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010; 28(10): 1756-1765.
18. Keating MJ, Flinn I, Jain V, et al. Therapeutic role of alemtuzumab (Campath-1H) in patients who have failed fludarabine: results of a large international study. Blood 2002; 99(10): 3554-3561.
19. Smolej L, Procházka V, Špaček M, et al. Doporučení pro léčbu alemtuzumabem u chronické lymfocytární leukémie (CLL). Vnitř Lék 2012; 58(3): 232-236.
20. Wierda WG, Kipps TJ, Mayer J, et al. Ofatumumab as single-agent CD20 immunotherapy in fludarabine-refractory chronic lymphocytic leukemia. J Clin Oncol 2010; 28(10): 1749-1755.
21. Smolej L. The role of high-dose corticosteroids in the treatment of chronic lymphocytic leukemia. Expert Opin Investig Drugs 2012; 21(7): 1009-1017.
22. Smolej L, Doubek M, Panovska A, et al. Rituximab in combination with high-dose dexamethasone for the treatment of relapsed/refractory chronic lymphocytic leukemia. Leuk Res 2012; 36(10): 1278-1282.
23. Fischer K, Cramer P, Busch R, et al. Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2011; 29(26): 3559-3566.
24. Tonino SH, van Gelder M, Eldering E, van Oers MH, Kater AP. R-DHAP is effective in fludarabine-refractory chronic lymphocytic leukemia. Leukemia 2010; 24(3): 652-654.
25. Elter T, Gercheva-Kyuchukova L, Pylylpenko H, et al. Fludarabine plus alemtuzumab versus fludarabine alone in patients with previously treated chronic lymphocytic leukaemia: a randomised phase 3 trial. Lancet Oncol 2011; 12(13): 1204-1213.
26. Bottcher S, Ritgen M, Fischer K, et al. Minimal residual disease quantification is an independent predictor of progression-free and overall survival in chronic lymphocytic leukemia: a multivariate analysis from the randomized GCLLSG CLL8 trial. J Clin Oncol 2012; 30(9): 980-988.
27. Delgado J, Duarte RF. Practical aspects of allogeneic hematopoietic cell transplantation for patients with poor-risk chronic lymphocytic leukemia. ScientificWorldJournal 2011; 11 : 161-172.
28. Montserrat E, Gribben JG. Autografting CLL: the game is over! Blood 2011; 117(23): 6057-6058.
29. Rossi D, Gaidano G. Richter syndrome: molecular insights and clinical perspectives. Hematol Oncol. 2009;27(1):1-10.
30. Osterborg A, Foa R, Bezares RF, et al. Management guidelines for the use of alemtuzumab in chronic lymphocytic leukemia. Leukemia 2009; 23(11): 1980-1988.
31. Bokemeyer C, Aapro MS, Courdi A, et al. EORTC guidelines for the use of erythropoietic proteins in anaemic patients with cancer: 2006 update. Eur J Cancer 2007; 43(2): 258-270.
32. Aapro MS, Bohlius J, Cameron DA, et al. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours. Eur J Cancer 2011; 47(1): 8-32.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2013 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Diagnostika a léčba hemofilie
- XXVII. Olomoucké hematologické dny s mezinárodní účastí
- Clinical aspects and pathogenesis of congenital dyserythropoietic anemias: from morphology to molecular approach
- New autoimmune diseases after cord blood transplantation: a retrospective study of EUROCORD and the Autoimmune DiseaseWorking Party of the European Group for Blood and Marrow Transplantation
- Finding the origin of pulmonary emboli with a total-body magnetic resonance direct thrombus imaging technique
- Safety and efficacy of eltrombopag for treatment of chronic immune thrombocytopenia: results of the long-term, open-label EXTEND study
- Extramedullary relapse of acute myeloid leukemia following allogeneic hematopoietic stem cell transplantation: incidence, risk factors and outcomes
- Characteristics and outcome of early-onset, severe forms of Wiskott-Aldrich syndrome
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL)
- Praktický pohled na význam HLA shody pro transplantaci krvetvorných buněk od dospělých nepříbuzných dárců
- Klinické a biologické prognostické faktory u maligních lymfomů
- Separace plné krve a výroba krevních složek gravitací soupravou ErySep® s filtrem z dutých vláken
-
Standardy péče o nemocné s hemofilií
1. revize, vydání 2012
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Praktický pohled na význam HLA shody pro transplantaci krvetvorných buněk od dospělých nepříbuzných dárců
- Separace plné krve a výroba krevních složek gravitací soupravou ErySep® s filtrem z dutých vláken
- Diagnostika a léčba hemofilie
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



