-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaStanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
Assessment of minimal residual disease in B-cell chronic lymphocytic leukemia: options and advancement of techniques based on PCR and RT-PCR
Detection of minimal residual disease (MRD) persistence provides essential information on the treatment response in hematologic malignancies including chronic lymphocytic leukemia (CLL). Improved quantitative techniques for MRD quantification on molecular basis with sufficient sensitivity are warranted to monitor the therapeutical goal - complete erradication of MRD. In addition to international standardized four-color flow cytometric CLL-MRD assay, real time polymerase chain reaction (RQ-PCR) represents one of the most sensitive methods for MRD assesment. The malignant clone can be identified by its unique immunoglobulin heavy chain (IgH) gene rearrangement; allele-specific (ASO) IgH RQ-PCR allows to achieve higher sensitivity limit up to two orders of magnitude. Currently, the monitoring of MRD is based on combination of patient specific primers and two different consensus TaqMan probes recognizing the JH subgenes 1, 4, 5, 6 and is applicable to just about 90 % of all CLL cases. The updated approach is based on limited number of LNA-modified (Locked Nucleic Acid) TaqMan probes designed to consensus sequences in the framework region 3 (FR3) of the seven VH gene families. LNA-modified probes and IgH-RQ PCR represent highly specific and sensitive method of MRD assessment in patiens with CLL.
Key words:
chronic lymphocytic leukemia (CLL), immunoglobulin heavy-chain gene (IgVH), minimal residual disease (MRD), real-time quantitative PCR (RQ PCR)
Autoři: H. Skuhrová Francová; B. Tichý; K. Malinová; J. Mayer; Š. Pospíšilová
Působiště autorů: Centrum molekulární biologie a genové terapie, Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 4, p. 197-203.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Stanovení minimální zbytkové nemoci (MRD) poskytuje důležitou informaci o léčebné odpovědi u hematologických malignit včetně chronické lymfocytární leukemie (CLL). Pro kontrolu dosažení remise onemocnění probíhá vývoj dostatečně citlivých kvantitativních metod detekce MRD na molekulární úrovni. Vedle mezinárodního protokolu na detekci minimální zbytkové nemoci u CLL pomocí čtyřbarevné průtokové cytometrie představuje jednu z nejcitlivějších kvantitativních metod metoda polymerázové řetězové reakce v reálném čase (RQ-PCR). Identifikace maligního klonu je založena na unikátní VH-D-JH přestavbě variabilní části genu těžkého imunoglobulinového řetězce (IgVH) a kvantitativní alelově specifické (ASO – allele specific oligonucleotide) PCR, která umožňuje příznivý posun detekčního limitu MRD o jeden až dva řády. Metoda detekce MRD je založena na využití kombinace pacient specifických primerů a dvou TaqMan sond rozeznávajících sekvence JH subgenů 1, 4, 5, 6 a lze ji použít u 90 % pacientů s diagnózou CLL. Aktualizovaný přístup využívá LNA (Locked Nucleic Acid) TaqMan sondy rozeznávající VH subgeny. Kombinace LNA modifikované sondy a pacient specifických primerů představuje dostatečně specifický a sensitivní přístup ke stanovení MRD u pacientů.
Klíčová slova:
chronická lymfocytární leukemie (CLL), gen pro těžký imunoglobulinový řetězec (IgVH), minimální reziduální nemoc (MRD), PCR v reálném čase (RQ-PCR)Úvod
Chronická lymfocytární leukemie (CLL) zůstává nejčastějším typem hematologické malignity diagnostikované u dospělých jedinců v západní populaci. U pacientů dochází v krvi a lymfoidních orgánech ke kumulaci malých zralých lymfocytů s typickým imunofenotypem. CLL buňky exprimují povrchové antigeny CD5, CD19 a CD23 a současně jsou negativní pro povrchové markery CD22 a FCM7 (1). Onemocnění je charakteristické proměnlivým klinickým průběhem s celkovým přežitím v rozpětí měsíců až desítek let (2).
Po zavedení moderních léčebných režimů, které zahrnují léčbu monoklonálními protilátkami i alogenní transplantaci kostní dřeně nebo periferních kmenových buněk krvetvorby, je možné u významné části pacientů dosáhnout kompletní klinické remise (CR) (3). Přesto mnoho z těchto pacientů časem relabuje, což znamená, že dosažení CR nevylučuje přežívání zbytkové populace maligních buněk, které se stávají příčinou opakovaného nástupu onemocnění.
Kritériem pro minimální zbytkovou nemoc je počet maligních buněk, které jsou po terapii detekovatelné nejcitlivějšími dostupnými metodami (4). V současnosti je vypracován a standardizován mezinárodní protokol detekce MRD pomocí čtyřbarevné průtokové cytometrie (5) a zároveň citlivější přístup pomocí alelově specifické (ASO) polymerázové řetězové reakce v reálném čase (RQ-PCR). MRD negativita je definována jako přítomnost méně než jedné CLL buňky na 10 000 leukocytů v krvi nebo kostní dřeni a tato hodnota je spolehlivě detekovatelná oběma uvedenými metodami (4, 6).
Nové detekční technologie vícebarevné průtokové cytometrie a RQ-PCR prokázaly, že mnoho pacientů, kteří dosáhli CR podle doporučení 1996 NCI-WG, mělo detekovatelnou MRD. Ačkoli eradikace MRD může zlepšit prognózu, je třeba provést další klinické studie k upřesnění, zda by další léčba zaměřená výhradně na eliminaci MRD poskytovala zásadní přínos pro klinický stav pacienta (6).
Detekce MRD po léčbě je důležitou součástí sledování pacientů. Kvantifikace klonální reziduální populace leukemických buněk poskytuje cennou informaci o průběhu onemocnění v delším časovém horizontu, zvláště u pacientů, kteří dosáhli kompletní klinické remise. Umožňuje včasný záchyt nárůstu nádorové buněčné populace a upozornění na riziko možného relapsu.
V předkládaném článku uvádíme přehled metodik stanovení MRD založených na PCR včetně vlastních zkušeností: PCR s využitím konsensuálních primerů a alelově specifické ASO RQ-PCR pro monitorování reziduální nemoci po léčbě.
Detekční metody MRD založené na PCR a RQ-PCR
Pro sledování zbytkové populace maligních buněk je nutné mít k dispozici vhodný molekulární marker příp. sadu markerů jednoznačně odlišujících maligní buňku od zdravých buněk organismu. Flow-cytometrické stanovení MRD využívá typický imunofenotyp nádorových buněk, u některých leukemií je možné použít typické genomové aberace vedoucí ke vzniku fúzních genů (např. BCR/ABL u CML). U CLL je vhodným markerem sekvence těžkého řetězce imunoglobulinu (7), která je navíc běžně určována při vyšetření významného prognostického markeru CLL – mutačního stavu IgVH.
Geny pro těžké a lehké řetězce imunoglobulinů (IgL, IgK) a TCR (T-cell receptor) jsou v rámci lidského genomu unikátní. Funkční gen vzniká až úspěšnou přestavbou jednotlivých subgenů na úrovni DNA. Každý z těchto genů (IgH, IgK, IgL, TRA, TRB, TRG a TRD) je složen z desítek subgenů čtyř kategorií – V (variable), D (diversity), J (joining) a C (constant), přičemž geny pro lehké řetězce imunoglobulinů IgK a IgL a pro podjednotky TCR TRA a TRG jsou složeny pouze ze subgenů V, J a C. Během vyzrávání lymfocytů dochází k procesu rekombinace, kterým vzniká výsledný gen. Při rekombinaci je spojen jeden V subgen s jedním D subgenem, J subgenem a C subgenem (obr. 1). Velké množství především V subgenů dovoluje vytvoření tisíců různých kombinací. Tento mechanismus umožňuje zakódovat do poměrně krátkého úseku DNA informaci pro produkci širokého spektra různých specifických antigeních receptorů (protilátek).
Obr. 1. Schématické znázornění procesu přestavby genu pro těžký řetězec imunoglobulinu. Gen pro těžký řetězec imunoglobulinu je složen ze subgenů V, D, J a C. Během vyzrávání B-lymfocytu dochází nejprve ke spojení subgenů D a J, poté je připojen subgen V. K připojení subgenu C dochází až po přepisu informace do molekuly RNA. Výběr konkrétních V, D a J subgenů je náhodný. 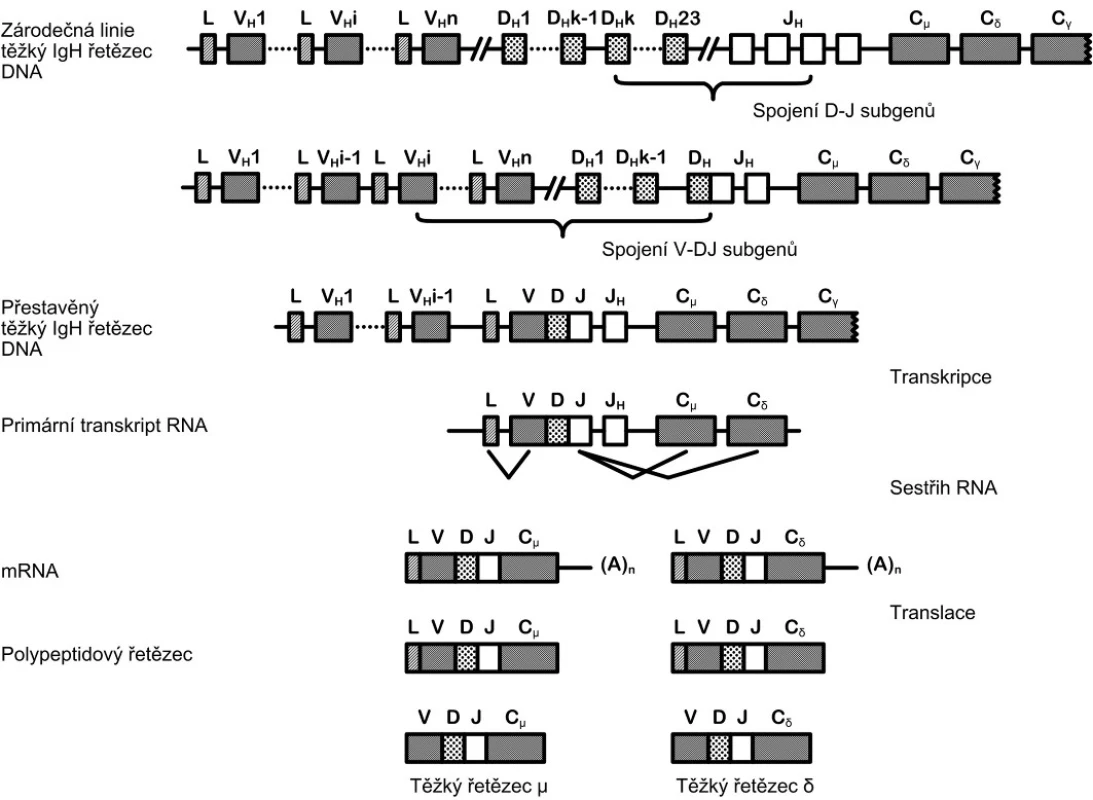
Gen pro těžký řetězec imunoglobulinu (IgH) je složen z V, D, J a C subgenů. Na přeskupeném genu je rozlišováno několik oblastí – FR1-3 a CDR1-3. Pro využití IGH jako cíle při stanovení MRD je nejvýznamnější oblast CDR3 (obr. 2). Jde o oblast spoje V-D a D-J subgenů. Při rekombinaci dochází k náhodné inzerci nebo deleci různého počtu nukleotidů právě v místech spojů jednotlivých subgenů a tak pro konkrétní lymfocyt i z něj vycházející klon vzniká charakteristická nukleotidová sekvence velmi dobře využitelná pro návrh specifických oligonukleotidů – PCR primerů nebo hybridizačních sond.
Obr. 2. Oblasti genu těžkého řetězce imunoglobulinu. Na nukleotidové sekvenci přeskupených VDJ subgenů je rozeznáváno několik funkčně významných oblastí: FR1-3 a CDR1-3. Aminokyseliny kódované v CDR (complementarity determining regions) oblastech jsou zodpovědné za vazbu protilátky na antigen, sekvence těchto oblastí má tedy největší význam pro specifitu výsledné protilátky. CDR3 oblast je nejvíce variabilní, zahrnuje D subgen a náhodně včleněné nukleotidy (N, N‘) ve spojích V-D a D-J. 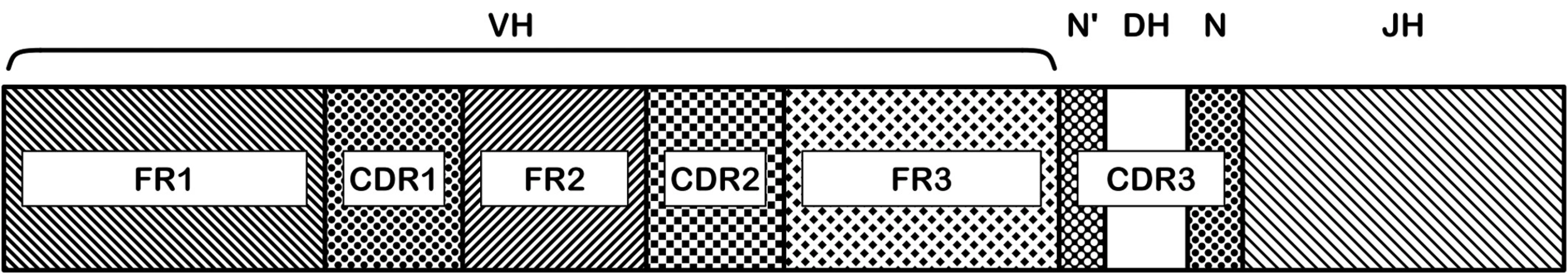
Protilátková diverzita je ještě zvětšena dalším pro lymfocyty specifickým procesem somatické hypermutace, kdy jsou do DNA sekvence imunoglobulinových genů záměrně vnášeny mutace. Přítomnost či nepřítomnost somatických hypermutací – tzv. mutační status IgVH – je významným prognostickým markerem CLL (1, 8-12).
Výběr vstupního materiálu významně ovlivňuje interpretaci výsledků monitorování MRD. Detekce MRD ze vzorku periferní krve je obecně ekvivalentní stanovení z kostní dřeně. Výjimkou jsou pacienti léčení monoklonálními protilátkami, u nich dochází k výrazné redukci počtu leukemických buněk především v periferní krvi. Detekce MRD z periferní krve u těchto pacientů není zcela spolehlivá v průběhu prvních tří měsíců po terapii, kdy kostní dřeň může zůstávat vysoce MRD pozitivní, přestože výsledky vyšetření periferní krve jsou negativní (13). Dosažení MRD negativity v kostní dřeni je jedním z nejdůležitějších faktorů pro predikci trvání remise (14).
Technika detekce MRD pomocí konsensuálních primerů
Metoda konsensuální (konzervativní) PCR je kvalitativní metoda s poměrně variabilní senzitivitou (1 CLL buňka na 102-104 leukocytů) (10, 15, 16) a dnes se považuje za překonanou. Analýza je limitována přítomností zdravých polyklonálních B-lymfocytů. Detekce buněk CLL je rovněž omezena, pokud představují méně než 2 % z celkového počtu B-lymfocytů (17, 18). Technika konsensuální PCR je založena na amplifikaci CDR3 klonotypové oblasti za použití FR1-IgH sady primerů nebo konsensuálního FR3 primeru a jednoho konsensuálního fluorescenčně značeného JH primeru (19, 20). Klonální PCR produkt je detekován kapilární elektroforézou nebo elektroforézou v polyakrylamidovém gelu. Sledované vzorky jsou označené jako pozitivní, jestliže jsou detekovány PCR produkty identických délek ve srovnání se vzorky před zahájením léčby (10). Tato metoda může být uplatněna pouze u 70 – 80 % pacientů, protože přítomnost mutací v IgVH genu narušuje vazbu konsensuálních (konzervativních) primerů (16). Aubin a kol. (17) publikoval práci o detekci klonality u B-buněčných malignit založenou na PCR amplifikaci IgH a srovnání citlivosti metody při použití různých kombinací FR a JH primerů. Je také možné použít dvoukolovou klonotypovou PCR s vnitřními pro pacienta specifickými primery a konsensuálními JHprimery pro specifickou amplifikaci maligního klonu (21). Další varianty dvoukolové PCR popsali Voena a kol. (22) a Schulze a kol. (23).
Alelově specifická RQ-PCR
Kvantitativní detekce klonální přestavby IgVH je založena na PCR v reálném čase (RQ-PCR) za použití alelově specifických primerů a TaqMan sondy. TaqMan sonda, která specificky hybridizuje se sekvencí mezi primery, je na 5ę konci značena kovalentně navázaným fluorescenčním barvivem (reporter, „R“), jehož emise světla je zhášena druhým fluorescenčním barvivem (zhášedlo, quencher, “Q”) navázaným na 3ę konec sondy. Sonda je rovněž na 3ę konci modifikována fosfátem, který zabraňuje extenzi sondy během PCR. Technologie je založena na měření fluorescenčního signálu reporteru. Při PCR dochází vlivem 5ęexonukleázové aktivity DNA polymerázy k odštěpení reportérového barviva a jeho uvolnění z blízkosti zhášedla, což vede k nárůstu fluorescence. Cyklus, ve kterém dojde k nárůstu fluorescence na stanovenou úroveň, se nazývá Ct (treshold cycle) a je nepřímo úměrný koncentraci vzorku DNA. Příprava alelově specifické (ASO) RQ-PCR zahrnuje návrh pro pacienta specifických primerů a sondy, a přípravu plazmidu s IgVH sekvencí daného pacienta pro kalibraci. Standardní křivku je možné také získat postupným ředěním vzorku DNA odebraného v době diagnózy (odpovídajícího 100 % buněk CLL) do směsi polyklonální DNA v rozmezí 10–10-6 (24). Jako referenční gen je možné zvolit např. gen pro albumin nebo ß-aktin. Pro každou reakci je nutné nejprve otestovat limit senzitivity a na směsi alespoň 5 polyklonálních DNA ověřit specifitu každé PCR. Senzitivita individuální ASO IgH RQ-PCR je definována jako poslední ředění standardu poskytující specifický fluorescenční signál. V případě nespecifické amplifikace, jako poslední ředění standardu s Ct hodnotou o více než jeden cyklus nižší než Ct hodnota polyklonální směsi DNA. Specifitu a následně senzitivitu reakce ovlivňuje CDR3 oblast klonu (délka vložených N, Nęnukleotidů).
Návrh klonově specifické TaqMan sondy pro každého pacienta je finančně a časově velmi nákladný a v současnosti se obecně využívá modifikovaná strategie RQ-PCR. Metodika používá pouze dvě JH hybridizační sondy (JHQ1/4/5 a JH6) a čtyři reverzní JH primery homologní k zárodečným JH genovým segmentům. Sondy jsou komplementární ke konzervativní oblasti JH genových segmentů čtyř nejčastěji využívaných JH rodin v rámci IgH přestavby (obr. 3). Kombinací ASO (Nę - D - N) primerů, konsensuálních JH sond a primerů je možné detekovat přibližně 90 % možných IgH klonálních přestaveb (24). Uvedený přístup nelze použít pro klonální přestavby IgVH s JH2 a JH3 segmentem. Důležitý je návrh pro pacienta specifického primeru do klonotypové CDR3 oblasti a optimalizace reakčních teplot. Nicméně JH sondy mohou detekovat nepříbuzné přestavby IgH a specifita reakce některých analýz je nízká. Maximální dosažená senzitivita metody je 10-5 (1 leukemická buňka mezi 100 000 zdravými) (24, 25).
Obr. 3. Porovnání přístupů RQ-PCR pro IgH řetězec. Metoda SYBRGreen využívá pro pacienta specifický reverzní primer R1 a forward primer F1; Metoda ASO RQ-PCR používá kombinaci jednoho ze čtyř reverzních primerů R2, pro pacienta specifického primeru F2 a jedné ze dvou konsensuálních TaqMan sond; Metoda ASO RQ-PCR s LNA TaqMan sondami kombinuje primer F3, pro pacienta specifický reverzní primer R3 a jednu ze šesti LNA TaqMan sond. 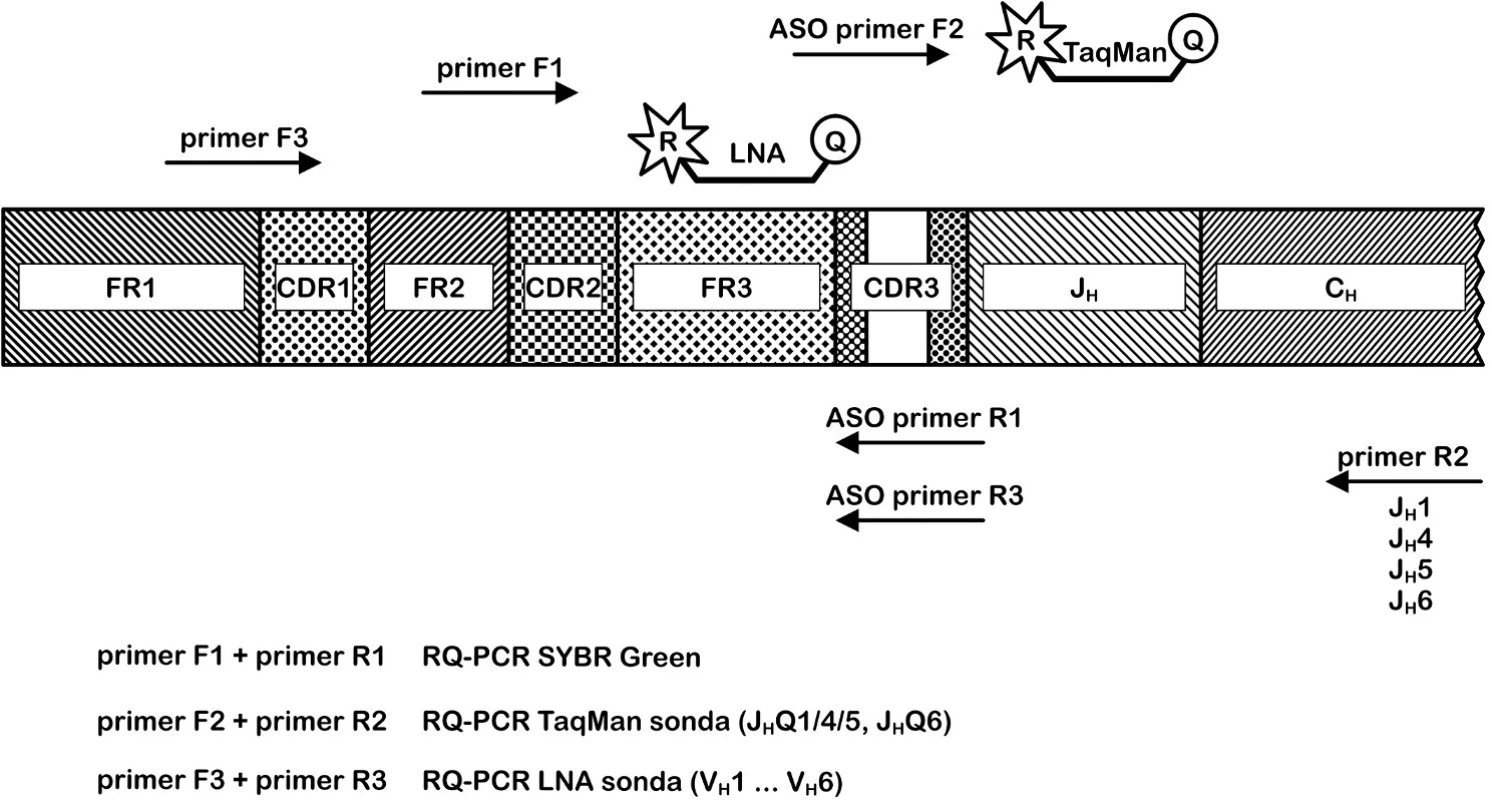
Další modifikaci detekce MRD popsal Gribben (26). Navržená analýza využívá omezenou sadu sond navrženou do konzervativní FR3 oblasti VH genových rodin a aplikace je možná u většiny pacientů.
Principiálně podobné metodě využívající TaqMan sondy je použití dvojic značených sond pro LightCycler (Roche). Shodný přístup se sadou šesti sond umístěných do FR3 oblati VH rodin popsal Pfitzner a kol. (27, 28).
Flexibilnější přístup ke stanovení MRD u pacientů s diagnózou CLL umožňují TaqMan LNA (Locked Nucleic Acid) sondy. LNA je nový typ analogu nukleových kyselin, který obsahuje 2ęO, 4ęC metylenový můstek. Ten omezuje flexibilitu ribofuranosového kruhu a uzavírá strukturu v rigidní konformaci. Tento systém zaručuje biologickou stabilitu LNA monomeru a zvýšenou stabilitu a specifitu hybridizace. Jde o krátké sondy s vysokou teplotou tání (Tm), zvýšenou diskriminační schopností a vazebnou afinitou (29). TaqMan sondy mohou obsahovat až 6 LNA monomerů a teplota tání (Tm) duplexu je o několik ľC vyšší na každý zařazený LNA nukleotid. To umožňuje návrh kratších sond pro problematické cílové sekvence, v případě IgH kratší sondy dovolují snadnější návrh konsensuálních oligonukleotidů a snižují riziko poklesu hybridizace vyplývající z procesu hypermutace.
Ke sledování MRD se ve většině laboratoří používá jako templát DNA. Výhodou je větší stabilita a přímé použití na rozdíl od přípravy cDNA reverzní transkripcí z RNA a také menší nároky na rychlost transportu odběru a jeho zpracování. Dosahovaná senzitivita detekce MRD při použití DNA a klasických i LNA TaqMan sond je obecně 10-5. Použitím cDNA jako templátu lze dosáhnout zvýšení senzitivity vyšetření až o tři řády (30). Nicméně počet transkriptů IgVHnemusí reálně odpovídat počtu buněk CLL.
Alternativní princip kvantitativní RQ-PCR je založen na využití fluorescenčního barviva SYBRGreenII interkalujícího se do dvouřetězcové DNA a detekci vzniklé fluorescence. Tento přístup neodstraňuje problémy spojené s nespecifickou amplifikací, protože je detekována každá dvouřetězcová DNA (primerové dimery, nespecifické produkty) a může docházet ke zkreslení vlastní kvantifikace (falešné zvýšení měřené fluorescence). Specifita reakce je zajištěna pro pacienta specifickými primery (ASO), jeden vždy navržen do hypervariabilní CDR3 oblasti (30). Výhodou aplikace SYBRGreenu je nízká cena ve srovnání s náklady na syntézu značených sond a univerzální použití.
RQ-PCR – naše zkušenosti
Pro monitorování MRD u pacientů s diagnózou CLL jsme nejprve používali kvantitativní metodu RQ-PCR se SYBRGreenII fluorescenční značkou. Při nízkých finančních nákladech metoda umožňovala sledování MRD u všech pacientů bez omezení. Pro každého pacienta byl navržen specifický pár primerů, jeden oligonukleotid vždy lokalizován do CDR3 oblasti expandovaného maligního klonu. Pro přesnou kalibraci byl připraven plazmid s IgVH sekvencí daného pacienta. Jako referenční gen standardně používáme fragment albuminového genu. Výsledky jsou vyjádřeny jako poměr klonálního IgVH a referenčního albuminového genu.
Vzhledem k problémům s nedostatečnou specifitou reakce jsme nejprve převzali metodiku RQ-PCR založenou na kombinaci dvou JH-genově specifických TaqMan sond (JHQ1/4/5, JHQ6) a čtyř JH primerů homologních k zárodečným JH genovým segmentům (24). Pro dosažení optimálních výsledků bylo nutné modifikovat složení reakční směsi – množství templátu a reagencií. Specifita tohoto typu RQ-PCR u konkrétního pacienta vždy závisí na návrhu ASO oligonukleotidu a optimalizaci reakčních teplot.
Následně jsme zvolili nový přístup ke stanovení MRD – RQ-PCR využívající LNA (Locked Nucleic Acid) sondy a TaqMan technologii. Pro jednotlivé VH rodiny byly do FR3 oblasti navrženy LNA modifikované TaqMan sondy (TIB MolBiol, Berlín) specifické pro všechny klony dané VH rodiny (obr. 3). Pro každého pacienta byly navrženy specifické oligonukleotidy, jeden vždy lokalizován do klonotypové CDR3 oblasti. Pro konstrukci standardní křivky byl připraven plazmid se sekvencí IgVH pacienta. Jako referenční gen jsme zvolili gen pro albumin. Senzitivita metody dosahuje 10-5 a u žádného ze sledovaných pacientů nevznikl problém s nespecifickou amplifikací. Tato metoda přináší v porovnání s předchozím přístupem řadu výhod k nimž patří především vyšší specifita reakce. Z toho vyplývá i podstatně kratší doba optimalizace a testování analýzy pro konkrétního pacienta.
Dynamiku MRD jsme sledovali výlučně u pacientů po alogenní transplantaci krvetvorných buněk (obr. 4a-d). V transplantované skupině byli pouze pacienti s nemutovaným IgVH. V případě pacientů s hypermutovaným IgVH, u nichž by nebylo možné použít navrženou VH specifickou LNA sondu, lze pro sledování navrhnout specifickou LNA sondu pro daného pacienta.
Obr. 4. Kinetika detekce MRD pomocí RQ-PCR. a) Pacientka s dg. CLL 3/2005. Po polychemoterapii a biologické léčbě (rituximab, alemtuzumab) dosaženo v 2/2006 parciální remise. Pro alergickou reakci léčba přerušena. V 8/2007 provedena nepříbuzenská alogenní transplantace PBSCT. U pacientky po transplantaci zůstávala na molekulární úrovni detekovatelná hladina MRD, 10/2008 došlo k nárůstu MRD, který je následován 11/2008 i hematologickým relapsem onemocnění. Následně podání rituximabu ve 4 dávkách. Po krátkodobém poklesu MRD následuje výrazná progrese choroby, Richterův syndrom. b) Pacient s dg. CLL 3/2000. Po polychemoterapii, kortikoterapii a biologické léčbě (rituximab, alemtuzumab) indikována příbuzenská alogenní transplantace PBSCT (8/2007). Engraftment štěpu byl uspokojivý a rychlý, ale nebylo dosaženo remise onemocnění. Přetrvával smíšený chimérismus, RQ-PCR pozitivita a pozitivní MRD dle FCM. Nárůst buněk nádorového klonu CLL byl prokázán metodou RQ-PCR i FCM. Pacient zemřel v 3/2008, podle FCM na akutní prekurzorovou B-ALL. c) Pacient s dg. CLL 12/2000.V 11/2005 proběhla nepříbuzenská alogenní transplantace PBSCT. Dosaženo kompletní remise, která dlouhodobě přetrvává. Pacient bez známek GVHD. 11/2007 pomocí RQ-PCR detekován opětovný nárůst počtu buněk nádorového klonu CLL. 6/2009 hematologický relaps onemocnění. d) Pacient s dg. CLL 4/1999. Po terapii B-CLL u pacienta došlo k rozvoji sekundární AML (10/2006), vývoj ze sek. MDS dg. 7/2006. V 2/2007 proběhla nepříbuzenská alogenní transplantace PBSCT. Molekulární monitoring specifického nádorového klonu umožnil detekci buněk CLL po transplantaci, postupně dosaženo remise CLL na molekulární úrovni. Hodnoty jsou vyjádřeny jako počet buněk nádorového klonu CLL z jednoho milionu leukocytů. Pro přehlednost byla vybrána k prezentaci jen část sledovaných hodnot, které kopírují celkový trend průběhu MRD. 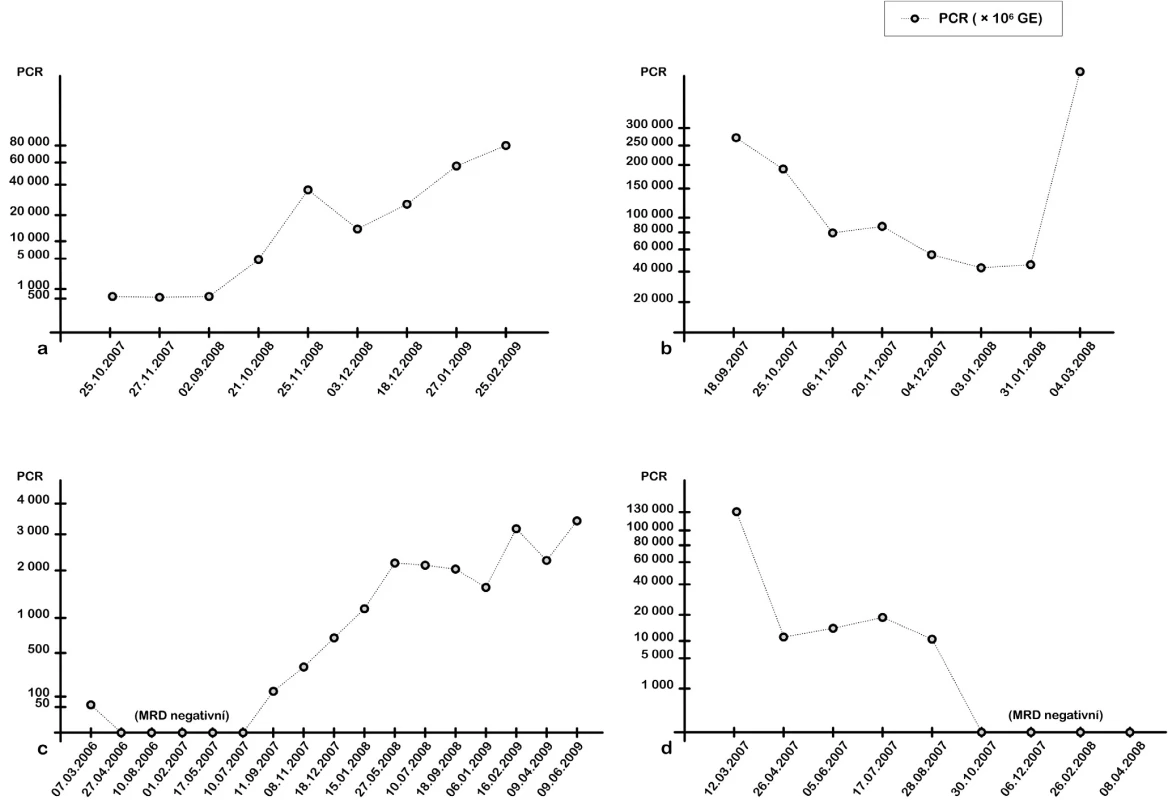
Prezentujeme zde monitorování MRD na příkladu čtyř vybraných pacientů. Dynamika MRD na molekulární úrovni byla souběžně srovnávána s výsledky stanovení MRD metodou čtyřbarevné průtokové cytometrie podle mezinárodně standardizovaného protokolu A. Rawstrona (2007). Analýzou fenotypu CLL buněk je možné určit hladinu MRD v periferní krvi a kostní dřeni s citlivostí až 0,01 % z leukocytů, přičemž vzorek může být analyzován, pokud je zastoupení CD5+19+ populace menší než 5 % z leukocytů. Srovnání hladiny MRD oběma metodami spolehlivě korelovalo, přičemž molekulární vyšetření je o řád citlivější a dříve upozornilo na opětovný výskyt nebo malý nárůst buněk nádorového klonu CLL. Odběry se u jednotlivých pacientů prováděly v měsíčních intervalech a při přesvědčivém nárůstu sledovaného klonu umožnily včasnou léčebnou intervenci (obr. 4a). Molekulární vyšetření není ovlivněno fenotypovými změnami buněk CLL, například důsledkem léčby, a jde v současné době o přístup s maximální senzitivitou, kterým lze na základě častého sledování dynamiky nádorového klonu CLL předvídat hematologický relaps. Sledování minimální reziduální nemoci vysoce citlivými metodami u pacientů po terapii má zásadní prognostický význam a umožňuje včasnou modifikaci terapie při incipientním relapsu nemoci.
Závěr
V roce 2008 byly vydány aktualizované směrnice mezinárodní pracovní skupiny pro CLL (International Workshop on CLL, IWCLL) (6), podle kterých je doporučeno zařadit sledování MRD do klinických studií. I když klinický význam stanovení MRD bude možné zhodnotit až na základě probíhajících studií, dá se předpokládat, že především u pacientů po transplantaci krvetvorných buněk bude toto vyšetření přínosem. Molekulární remise tj. dosažení negativity MRD má nepochybně pozitivní dopad na další vývoj onemocnění, záchyt opětovného nárůstu maligního klonu může být impulsem pro včasnou léčebnou intervenci. Podle našich zkušeností časté monitorování buněk nádorového klonu CLL citlivější metodou RQ-PCR spolehlivě upozorní na budoucí nástup hematologického relapsu onemocnění.
Zkratky
CLL - chronická lymfocytární leukemie
IgVH - variabilní část těžkého řetězce imunoglobulinového genu
CDR1-3 - complementarity determining region 1-3
FR1-3 - framework region 1-3
VH-D-JH - variabilní (variable) – rozlišovací (diverzity) – spojovací (joining) segment genu těžkého imunoglobulinového řetězce
PCR - polymerázová řetězová reakce
ASO RQ-PCR - alelově specifická polymerázová řetězová reakce v reálném čase
MRD - minimální zbytková nemoc (minimal residual disease)
BCR - B buněčný receptor
FCM - průtoková cytometrie (flow cytometry)
Práce byla podpořena grantem IGAMZČR No. NS10439-3/2009 a výzkumným záměrem MSM 0021622430.
Mgr. Hana Skuhrová Francová
Centrum molekulární biologie a genové terapie
Interní hematoonkologická klinika LF MU a FN Brno
Černopolní 9
613 00 Brno
Do redakce doručeno: 1. 6. 2009
Přijato: 14. 10. 2009
Zdroje
1. Hamblin T, Davis Z, Gardiner A, Oscier D, Stevenson F. Unmutated Ig V(H) genes are associated with a more aggressive form of chronic lymphocytic leukemia. Blood 1999; 94 : 848-854.
2. Byrd J, Stilgenbauer S, Flinn I. Chronic lymphocytic leukemia. Hematology Am Soc Hematol Educ Program 2004; 163-183.
3. Brüggemann M, Pott C, Ritgen M, Kneba M. Significance of minimal residual disease in lymphoid malignancies. Acta Haematol 2004; 112 : 111-119.
4. Sayala H, Rawstron A, Hillmen P. Minimal residual disease assessment in chronic lymphocytic leukaemia. Best Pract Res Clin Haematol 2007; 20 : 499-512.
5. Rawstron A, Villamor N, Ritgen M, et al. International standardized approach for flow cytometric residual disease monitoring in chronic lymphocytic leukaemia. Leukemia 2007; 21 : 956-964.
6. Hallek M, Cheson B, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 2008; 111 : 5446-5456.
7. Arnold A, Cossman J, Bakhshi A, Jaffe E, Waldmann T, Korsmeyer S. Immunoglobulin-gene rearrangements as unique clonal markers in human lymphoid neoplasms. N Engl J Med 1983; 309 : 1593-1599.
8. Ritgen M, Lange A, Stilgenbauer S, et al. Unmutated immunoglobulin variable heavy-chain gene status remains an adverse prognostic factor after autologous stem cell transplantation for chronic lymphocytic leukemia. Blood 2003; 101 : 2049-2053.
9. Oscier DG, Gardiner AC, Mould SJ, et al. Blood 2002; 100 : 1177-1184.
10. Böttcher S, Ritgen M, Pott C, et al. Comparative analysis of minimal residual disease detection using four-color flow cytometry, consensus IgH-PCR, and quantitative IgH PCR in CLL after allogeneic and autologous stem cell transplantation. Leukemia 2004; 18 : 1637-1634.
11. Ritgen M, Stilgenbauer S, von Neuhoff N, et al. Graft-versus-leukemia activity may overcome therapeutic resistance of chronic lymphocytic leukemia with unmutated immunoglobulin variable heavy-chain gene status: implications of minimal residual disease measurement with quantitative PCR. Blood 2004; 104 : 2600-2602.
12. Itälä M, Huhtinen A, Juvonen V, et al. Stem Cell Transplantation in Poor-Risk Chronic Lymphocytic Leukemia: Assessment of Post-transplant Minimal Residual Disease Using Four-Color and Six-Color Flow Cytometry and Allele-Specific RQ-PCR. Eur J Haematol 2008; 81 : 100-106.
13. Hillmen P. MRD in CLL. Clin Adv Hematol Oncol 2006; 4 : 6-7.
14. Hillmen P. Beyond detectable minimal residual disease in chronic lymphocytic leukemia. Semin Oncol 2006; 33: S23-28.
15. Provan D, Bartlett-Pandite L, Zwicky C, et al. Eradication of polymerase chain reaction-detectable chronic lymphocytic leukemia cells is associated with improved outcome after bone marrow transplantation. Blood 1996; 88 : 2228-2235.
16. Rawstron A, Kennedy B, Evans P, et al. Quantitation of minimal disease levels in chronic lymphocytic leukemia using a sensitive flow cytometric assay improves the prediction of outcome and can be used to optimize therapy. Blood 2001; 98 : 29-35.
17. Aubin J, Davi F, Nguyen-Salomon F, et al. Description of a novel FR1 IgH PCR strategy and its comparison with three other strategies for the detection of clonality in B cell malignancies. Leukemia 1995; 9 : 471-479.
18. Liang R, Chan V, Chan T, et al. Detection of immunoglobulin gene rearrangement in lymphoid malignancies of B-cell lineage by seminested polymerase chain reaction gene amplification. Am J Hematom 1993; 43 : 24-28.
19. Linke B, Bolz I, Fayyazi A, et al. Automated high resolution PCR fragment analysis for identification of clonally rearranged immunoglobulin heavy chain genes. Leukemia 1997; 11 : 1055-1062.
20. Maloum K, Pritsch O, Dighiero G. Minimal residual disease detection in B-cell malignancies by assessing IgH rearrangement. Hematol Cell Ther 1997; 39 : 119-124.
21. Noy A, Verma R, Glenn M, et al. Clonotypic polymerase chain reaction confirms minimal residual disease in CLL nodular PR: results from a sequential treatment CLL protocol. Blood 2001; 97 : 1929-1936.
22. Voena C, Ladetto M, Astolfi M, et al. A novel nested-PCR strategy for the detection of rearranged immunoglobulin heavy-chain genes in B cell tumors. Leukemia 1997; 11 : 1793-1798.
23. Schultze J, Donovan J, Gribben J. Minimal residual disease detection after myeloablative chemotherapy in chronic lymphatic leukemia. J Mol Med 1999; 77 : 259-265.
24. Brüggemann M, Droese J, Bolz I, et al. Improved assessment of minimal residual disease in B cell malignancies using fluorogenic consensus probes for real-time quantitative PCR. Leukemia 2000; 14 : 1419-1425.
25. Moreno C, Villamor N, Colomer D, et al. Clinical significance of minimal residual disease, as assessed by different techniques, after stem cell transplantation for chronic lymphocytic leukemia. Blood 2006; 107 : 4563-4569.
26. Gribben J. Monitoring disease in lymphoma and CLL patients using molecular techniques. Best Pract Res Clin Haematol 2002; 15 : 179-195.
27. Pfitzner T, Engert A, Wittor H, et al. A real-time PCR assay for the quantification of residual malignant cells in B cell chronic lymphatic leukemia. Leukemia 2000; 14 : 754-766.
28. Pfitzner T, Reiser M, Barth S, et al. Quantitative molecular monitoring of residual tumor cells in chronic lymphocytic leukemia. Ann Hematom 2002; 81 : 258-266.
29. Peková S, Bezdícková L, Smolej L, et al. Quantitation of minimal residual disease in patients with chronic lymphocytic leukemia using locked nucleic acid-modified, fluorescently labeled hybridization probes and real-time PCR technology. Mol Diagn Ther 2007; 11 : 325-335.
30. Peková S, Marková J, Pajer P, Dvorák M, Cetkovský P, Schwarz J. Touch-down reverse transcriptase-PCR detection of IgV(H) rearrangement and Sybr-Green-based real-time RT-PCR quantitation of minimal residual disease in patients with chronic lymphocytic leukemia. Mol Diagn 2005; 9 : 23-34.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2009 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Definice a klasifikace chronického onemocnění ledvin dle KDIGO
-
Všechny články tohoto čísla
- Klinický přínos stanovení zbytkové choroby u nemocných s B-chronickou lymfocytární leukemií
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Analýza nemocných s myelodysplastickým syndromem (MDS) s delecí dlouhého ramene 5. chromozomu (del(5q), sledovaných Českou MDS pracovní skupinou. Význam pro diagnostické zařazení a určení prognózy
- Využitie sekundárnej profylaxie s rekombinantným aktivovaným faktorom VII u hemofílie A s inhibítorom: naše skúsenosti a prehľad literatúry
- Vrozené polycytemie
- Význam polymorfismu buněčné protinádorové imunity u pacientů s B-nehodgkinským lymfomem léčených rituximabem
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
- Alogenní transplantace krvetvorných buněk u pacientů s mnohočetným myelomem – zkušenosti centra
- Zpráva z 12. pracovních dnů v transfuzním lékařství
- Výběr z tisku a zprávy o knihách
- Výběr z tisku a zprávy o knihách
- Výběr z tisku a zprávy o knihách
- Vybrané odborné akce v roce 2010
- OBSAH ROČNÍKU 15/2009 Transfuze a hematologie dnes
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vrozené polycytemie
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



