-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
Detection of the t(14;18) chromosomal translocation from fine-needle aspiration in follicular lymphoma and the significance of so called molecular nodal remission
Aim:
To prove, if fine needle aspiration (FNA) is sufficient for detection of t(14;18) in lymph node infiltrated by follicular lymphoma (FL). To determine value of molecular remission in lymph node in patients in complete and molecular remission.Methods:
First we tested t(14;18) in paired-specimens taken by FNA and by classical biopsy (from autopsies and operation biopsies). We continued to perform FNAs guided by ultrasound (US) in patients with easy accessible lymphadenopathy, t(14;18) was tested by FISH (fluorescent in situ hybridization) and by PCR (polymerase chain reaction). FNA of near the same lymph node was repeated in suitable patients in complete (CR) and molecular remission.Results:
We tested for t(14;18) 22 paired samples (FNA vs. biopsy). 1/22 (4.5 %) FNA was negative compared to the biopsy. 31 FNA of lymph node guided by US were done, success of FNA was 100 % in advanced FL. FISH identified t(14;18) in 89 %, PCR in 67 %. 12 cases of FNA were done in CR (CT and PET) and molecular remission in blood (PCR): in 4/12 cases samples were not taken for technical reason, in 3/12 FNA fibrosis was detected. 6/7 patients with non-diagnostic FNA are in remission (median 19 months), 1 patient relapsed. 5/12 FNA were diagnostic (in 4 patients), t(14;18) was identified in 5/5 (100%) cases. 3 patients relapsed 3, 6 and 12 months later, 1 patient remains in remission (>20 months), in spite of repeated FNA identified t(14;18) after 12 months again.Conclusion:
FNA is potentially suitable for detection t(14;18) in lymph nodes in FL. Persistence of t(14;18) in lymph node in CR is relatively frequent and this could be considered as real minimal residual disease. Further study is needed to define its biological importance, because persistence of t(14;18) in lymph node does not mean clinical relapse. Key words: t(14;18), follicular lymphoma, fine needle aspiration, minimal residual disease, FISH, PCR
Autoři: A. Janíková-Obořilová; J. Mayer; L. Křen; I. Kroupová 1; J. Šmardová 1; D. Dvořáková 1; P. Mejstřík; J. Neubauer; I. Vášová 2
Působiště autorů: Interní hematoonkologická klinika FN Brno, 1Patologicko anatomický ústav FN Brno, 2Radiodiagnostická klinika FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,13, 2007, No. 2, p. 79-87.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Cíl:
Ověřit, zda punkční biopsie (FNA) dostačuje pro detekci t(14;18) v uzlině postižené folikulárním lymfomem (FL). Pokusit se stanovit význam molekulární remise měřené v uzlině u pacientů v kompletní i molekulární remisi.Metody:
Nejprve jsme t(14;18) testovali v párových vzorcích z FNA a klasické biopsie (z autopsií a peroperačních biopsií). U pacientů s dobře dostupnou periferní lymfadenopatií jsme provedli FNA pod kontrolou ultrazvuku (UZV), t(14;18) byla testována FISH (fluorescent in situ hybridization) anebo PCR (polymerase chain reaction). U vhodných pacientů byla FNA z přibližně téže uzliny provedena v kompletní (CR) a molekulární remisi po léčbě. Výsledky: t(14;18) jsme testovali u 22 párových vzorků (FNA vs. biopsie). 1/22 (4,5 %) FNA-vzorků byl negativní oproti biopsii. FNA uzliny pod kontrolou UZV bylo provedeno 31, u rozvinutého FL byla úspěšnost FNA 100 %. FISH ve FNA identifikovala t(14;18) v 89 %, PCR v 67 %. 12 FNA bylo provedeno v CR (CT i PET) a bez detekovatelné t(14;18) v krvi: ve 4/12 případů nebyl vzorek z technických důvodů odebrán, ve 3/12 odběrů bylo zastiženo vazivo. 6/7 těchto pacientů je v CR s mediánem 19 měsíců, 1/7 pacientů zrelaboval. 5/12 FNA (u 4 pacientů) bylo diagnostických, v 5/5 (100%) případů jsme detekovali t(14;18). 3 pacienti zrelabovali za 3, 6 a 12 měsíců, avšak 1 nemocná zůstává v CR více než 20 měsíců, při opakované FNA (za 12 měsíců) byla prokázána opět t(14;18) v uzlině.Závěry:
FNA je potenciálně vhodná pro detekci t(14;18) v uzlinách u FL. Přetrvávání t(14;18) v uzlině v CR je relativně častý jev, který lze považovat za skutečnou minimální zbytkovou nemoc. Jeho biologický význam bude třeba dále zkoumat, neboť průkaz t(14;18) v uzlině neznamená vždy klinický relaps.Klíčová slova:
t(14;18), folikulární lymfom, punkční biopsie, minimální reziduální nemoc, FISH, PCRÚvod
Translokace t(14;18) je téměř pravidelně asociována s folikulárním lymfomem (FL) (1–3). Z literatury i na základě vlastních zkušeností víme, že t(14;18) je možné nalézt často i u jiných lymfoproliferací, „zdravých“ dobrovolníků i pacientů s neonkologickým onemocněním (4–10). Přestavba zahrnuje gen pro těžký imunoglobulinový řetězec (IgH) na chromozomu 14q32 a gen B-leukemie/ lymfomu-2 (bcl-2) na chromozomu 18q21 (4, 11). Ke zlomu na lokusu 14q32 dochází relativně konstantně v oblasti IgH J-segmentů (12). Na lokusu 18q21 je situace složitější, 50–60 % zlomů spadá do oblasti 150 bp zvané MBR (major breakpoint region) (13), 10–20 % do oblasti 500 bp zvané mcr (minor cluster region), která je cca 20 kilobazí vzdálena od MBR (14). Zbývajících 10–20 % tvoří „atypická“ zlomová místa, která jsou většinou roztroušena mezi oběma oblastmi MBR a mcr (15, 16). Pro vysokou variabilitu zlomových míst PCR (polymerase chain reaction) užívající konvenční primery pro MBR, mcr a JH zachytí obvykle t(14;18) jen u 60–70 % pacientů (17, 18, vlastní nepublikovaná data). Pro pokrytí všech zlomových míst t(14;18) je možné použít speciální modifikace jako jsou multiplex PCR (19) nebo longdistance PCR (15), které jsou nejen finančně ale i časově náročné a pro rutinní praxi se zatím příliš nehodí. Nejúspěšnější metoda v identifikaci t(14;18) je FISH (fluorescent in situ hybridization) z tkáně uzliny (záchyt 85–100 %) (20, 21, 22, vlastní nepublikovaná data). FISH využívá hybridizace nukleových kyselin velmi podobné primární (tj. sekvence nukleotidů) struktury. Testovací definované úseky DNA (próby) o délce v řádech set kilobazí jsou označeny fluoroscenčním barvivem. V místě translokace dojde k hybridizaci prób specifických pro oba úseky translokace, což se projeví dvojitým barevným signálem v cytologickém nebo histologickém preparátu. FISH je schopna pokrýt prakticky celou přestavbu t(14;18), oproti PCR má však nepoměrně nižší citlivost (cca 1 : 1000 buněk), metodu lze využít pouze u vzorků uzlin respektive extranodálních infiltrátů.
Relativně konstantní průkaz t(14;18) u folikulárního lymfomu se přímo nabízí ke sledování minimální zbytkové nemoci. Za posledních 20 let bylo publikováno několik desítek prací zabývajících se významem cirkulujících t(14;18)-pozitivních buněk u folikulárního lymfomu. Převládá názor, že dlouhodobá molekulární negativita v periferní krvi je sdružena s lepší prognózou a delším obdobím bez nemoci (10, 23, 24, 25), naopak perzistující pozitivita je asociována s rekurencí choroby (26, 27, 28, 29, 30). Existují však autoři, kteří žádnou korelaci záchytu t(14;18) v krvi s klinickým chováním FL nepozorovali (31, 32, 33, 34). Prognostický význam t(14;18) pro konkrétního pacienta s folikulárním lymfomem zůstává tedy stále nejasný. Folikulární lymfom svým charakterem kolísá od leukemie k solidnímu nádoru. Lze se proto oprávněně domnívat, že periferní krev není naprosto spolehlivým kompartmentem pro sledování minimální zbytkové nemoci u FL. Optimálním zdrojem informací o vztahu t(14;18) a folikulárního lymfomu je velmi pravděpodobně původně postižená uzlina, systematické sledování tohoto kompartmentu je však technicky velmi složité. Informací z literatury zabývající se pouhým srovnáním t(14;18) v různých tkáních je málo a pocházejí prakticky výhradně z jednorázového odběru v době stanovení diagnózy. Dle jedné práce nebyl pozorován rozdíl v záchytu t(14;18) mezi tkání uzliny a krví, jinde byl popsán lepší záchyt t(14;18) v kostní dřeň než v krvi (16, 35, 36, 37).
Punkční biopsie (FNA = fine needle aspiration) je známa jako diagnostická metoda od 30. let minulého století (38). Ne-Hodgkinské lymfomy (NHL) lze punkční biopsií úspěšně diagnostikovat až v 80–90 %, přičemž přesná klasifikace je možná v 67–86 % (39). S pokrokem imunofenotypizačních, cytogenetických a molekulárně biologických technik v diagnostice jednotlivých typů lymfomů prožívá FNA určitou renesanci (40, 41). Aspirační biopsie má ale mnohá úskalí a nelze ji jako jedinou diagnostickou metodu použít u lymfomů s vysokým podílem fibrózní tkáně, zánětlivým infiltrátem a nerovnoměrnou infiltrací (42, 43). Zlatým standardem diagnostiky a přesné klasifikace NHL zůstává klasické histologické vyšetření z kvalitní chirurgické biopsie.
Metodou FISH lze z punkčního odběru zachytit t(14;18) u pacientů s folikulárním lymfomem v 85 %, což odpovídá nálezům z klasické biopsie (41). Punkční vzorek by tedy dostatečně vyhovoval v případě v (molekulární) rekurence již definovaného lymfomu.
Cílem naší práce bylo ověřit, zda FNA poskytne dostatečný materiál z uzliny pro stanovení t(14;18). Dále jsme chtěli zjistit, zda a s jakým výsledkem jsme schopni provést opakovanou FNA po ukončení léčby z původně postižené uzliny a zda má stanovení „molekulární remise respektive relapsu“ na úrovni uzliny prognostický význam.
Metody
Pacienti a materiál
K testování t(14;18) ve tkáni uzlin byly užity vzorky od pacientů s folikulárním lymfomem, kteří byli léčeni a sledováni na Interní hematoonkologické klinice Fakultní nemocnice Brno. Vhodné pacienty k odběrům jsme vybrali z více než 100 nemocných sledovaných systematicky od roku 2001 včetně monitorování t(14;18) v periferní krvi a kostní dřeni (tato problematika bude předmětem samostatného sdělení). Zde pro úplnost uvádíme kvantitativní srovnání t(14;18) mezi periferní krví, kostní dření a tkání uzliny postižené lymfomem.
Jako první krok jsme si chtěli ověřit, zda punkční biopsie poskytne shodné výsledky, pokud jde o záchyt t(14;18) ve srovnání s klasickým bioptickým vzorkem. Než jsme přistoupili k provádění FNA uzlin u pacientů, testovali jsme nejprve vzorky z autopsií. Srovnání punkční aspirace a biopsie uzlin jsme provedli v rámci autopsií pacientů zemřelých s rozvinutým folikulárním lymfomem, u kterých jsme již dříve identifikovali t(14;18) metodou PCR v krvi nebo kostní dřeni. Vzorky byly odebírány z makroskopicky postižených uzlin za asistence graduovaného patologa. Do vybrané uzliny (nebo infiltrátu) byl nejprve učiněn vpich jehlou identickou pro aspirační biopsie pod ultrazvukovou kontrolou. Po té byla provedena excise kousku tkáně kolem vpichu. Oba vzorky pak byly vyšetřeny na přítomnost t(14; 18) a bioptický vzorek i kompletně histologicky.
V další fázi jsme odebírali srovnávací vzorky z operačních biopsií pacientům, kteří podstupovali biopsii uzliny pro suspektní relaps nebo novou diagnózu folikulárního lymfomu. Z excidované uzliny byl odebrán ihned za sterilních podmínek punkční vzorek. Oba vzorky pak byly vyšetřeny na přítomnost t(14; 18) a bioptický vzorek i histologicky.
Po ověření spolehlivosti FNA ve srovnávacích vzorcích jsme přistoupili k přímé punkční biopsii z postižené periferní uzliny pod kontrolou ultrazvuku (UZV) u pacientů v době stanovení diagnózy respektive relapsu.
K vyšetření t(14;18) pomocí FNA pod ultrazvukem byli vybráni konsekutivně pacienti s histologicky ověřeným folikulárním lymfomem a s periferní lymfadenopatií (snadno dostupnou uzlinou). U vhodných pacientů byla FNA pod ultrazvukem opakována z téže uzliny (respektive přibližně z téže uzliny, neboť jistota 100 % není reálná) po léčbě v kompletní remisi. Pro identifikaci t(14;18) jsme použili obou metod detekce: PCR i FISH. Pro opakovaný odběr byli definováni jako vhodní pouze pacienti s původně infiltrovanou dobře dostupnou periferní uzlinou po konstatování kompletní remise klinicky dle standardních kritérií (44), s negativním PET vyšetřením a bez prokazatelné t(14;18) v periferní krvi (buďto dosáhli „molekulární remise“, nebo nebyla vstupně t(14;18) PCR vůbec detekována). Pacienti podstupující FNA uzliny byli řádně poučeni a vyjádřili písemný souhlas s výkonem.
PCR
DNA byla izolována standardní metodou štěpením proteinázou-K, extrakcí organickými rozpouštědly (fenol/chloroform) a precipitací etanolem. Pro zachycení bcl-2/IgH zlomových oblastí MBR a mcr jsme použili metodu dvoukolové nested PCR, modifikovanou podle publikovaných údajů (16, 35). V případě negativního výsledku jsme použili protokol multiplexové PCR, navržený jako standardní postup umožňující záchyt zlomových oblastí také v méně častých regionech 3’oblasti MBR a 5’oblasti mcr. Tato detekce probíhala ve třech oddělených setech celkem s 9 primery lokalizovanými v genu bcl-2 v kombinaci s jedním společným konvenčním primerem v genu JH. Při reakci se amplifikovalo 100 ng genomové DNA v 35 cyklech, detekce PCR produktu probíhala po elektroforetickém rozdělení a fluorescenčním obarvení na agarózovém gelu (18).
Pro kvantitfikaci byla použita real-time PCR (RQPCR) na principu technologie TaqMan sond (45) a výsledky byly normalizovány k přítomnosti genu pro lidský albumin. Primery a sonda pro bcl-2/IgH MBR oblast byly navrženy pomocí Primer Express v.2.0 software, TaqMan systém pro albumin byl publikován dříve (46). Sekvence bcl-2/IgH genu a genu pro albumin byly klonovány pomocí TA Cloning kit (Invitrogen, Carlsbad, CA, USA) a použity pro sestrojení standardních křivek. Normalizované hodnoty bcl-2/IgH genu byly vyjádřeny jako počet kopií bcl-2/IgH na 106 buněčných ekvivalentů (CE). S každým novým odběrem u daného pacienta byl opakovaně testován i jeho předchozí odběr a toto „komparativní” testování RQPCR nám umožnilo minimalizovat rozdíly, které mohly být způsobeny rozdílnou kvalitou získané DNA nebo variabilitou PCR, a zvýšit tímto přesnost kvantifikace.
FISH
Ze vzorků byly standardním způsobem připraveny formol-parafinové bloky. Z každého bloku bylo připraveno několik tkáňových řezů, které byly umístěny na podložní skla s pozitivně nabitým povrchem (SUPERFROST PLUS) a inkubovány přes noc při 56 ºC. FISH byla provedena s využitím sondy LSI IGH/BCL2 firmy Abbott/VYSIS podle návodu výrobce jen s drobnými modifikacemi, které zde uvádíme. Tkáňové řezy byly deparafinizovány xylenem. Buňky v tkáni byly permeabilizovány působením HCl, NaSCN a proteolytickým natrávením pepsinem při 38 ºC po dobu 30 až 35 minut. Vzorky byly fixovány paraformaldehydem a před nanesením sondy byla cílová DNA denaturována působením 70% formamidu při 74 C po dobu 7 minut. Próba byla denaturována při 74 C po dobu 5 minut těsně před aplikací na ošetřenou tkáň. Hybridizace probíhala přes noc při 37 ºC. Po vymytí próby byla jádra dobarvena pomocí DAPI. Výsledky byly odečítány na fluorescenčním mikroskopu Leica DMRXA2.
Pro jednoznačnou interpretaci našich výsledků jsme museli určit hranici pozitivity respektive negativity.
Vyšetřili jsme 4 vzorky uzlin s jinou diagnózou než lymfom, podíly buněk s fúzním signálem činily 3,7–5,5 %. Hranici pro ještě negativní FISH jsme definovali jako aritmetický průměr 4,9 % + SD 0,83 %. V jednotlivých vzorcích (n = 31) jsme vyhodnotili signály ve 49 až 85 buněčných jádrech (v průměru 60 jader/vzorek), kde jsme zachytili průměrně 82 % buněk s fúzním signálem (17–100 %). Jedinou výjimku představoval vzorek, v němž bylo i přes opakované provedení pouze 15 hodnotitelných jader. Z toho 14 jader bylo negativních, v jednom (7 %) byl detekován pozitivní, fúzní signál. Tento vzorek byl zařazen mezi negativní výsledky.
Provádění biopsií uzlin za navigace ultrazvukem
Punkční biopsie byly prováděny lékařem-sonografistou specializovaným na punkční výkony. FNA byla prováděna v lokální anestezii za aseptických podmínek, byl zvolen přístup s nejmenším rizikem krvácení. Vždy bylo užito přídavné zařízení na sondu, které drží přesně vymezenou trajektorii punkce (obr. 1). Biopsie povrchových uzlin byly provedeny lineární sondou s vysokým rozlišením (10–12 MHz), která umožňuje kvalitnější kompresi plochy tkání s minimalizací pohybu uzliny v podkoží nebo hlubších strukturách.
Obr. 1. Fotografie z ultrazvukem řízené punkce axilární uzliny. 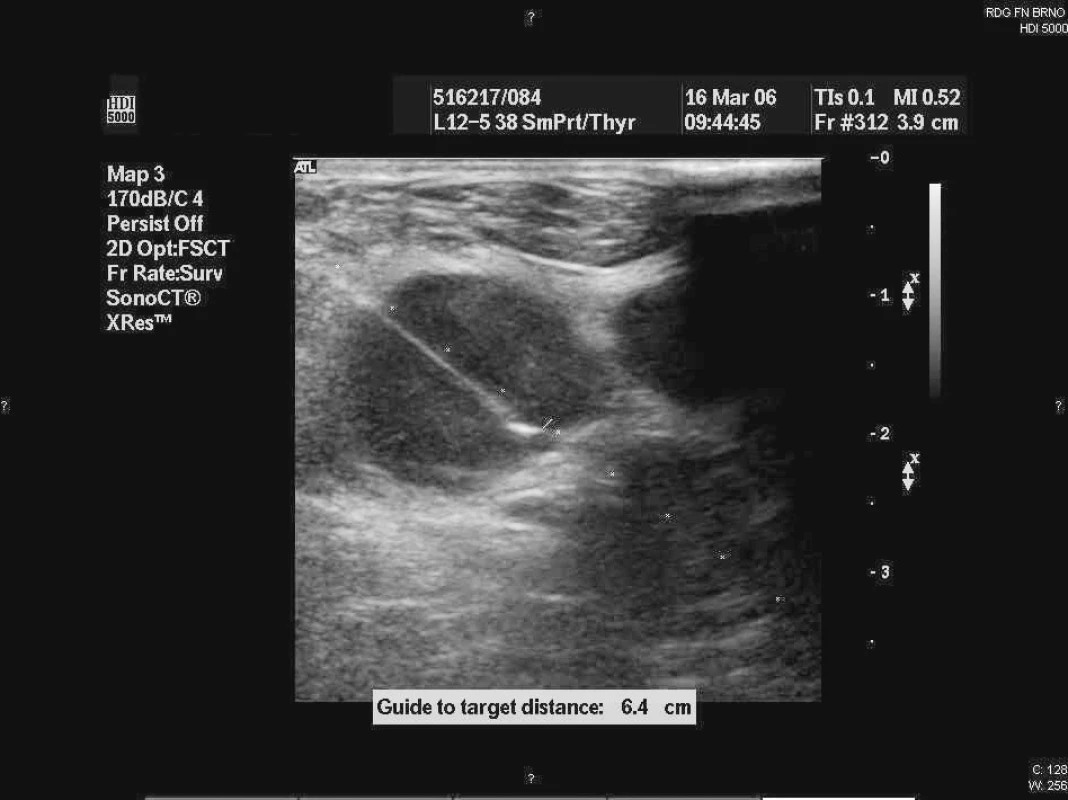
Podle anatomických poměrů byla zvolena technika odběru:
- true cut
- bioptickými nůžkami v okolí cévních svazků.
- bioptickým dělem (biopty gun) v případě tuhých a objemných lézí.
- aspirační biopsie automatickou aspirační jehlou Biomol u velmi malých ložisek v rozmezí 5–10 mm.
Průsvit jehly byl zvolen dle velikosti léze 16–21 G, hloubka v rozmezí 15–25 mm.
Odebraný materiál byl vložen do sterilní zkumavky s fyziologickým roztokem (pro PCR vyšetření) anebo s 10% formalinem pro vyšetření histologická a FISH. Použité bioptické jehly byly jednorázové. Po FNA bylo provedeno kontrolní ultrazvukové vyšetření k odhalení časného krvácení a naloženo kompresní krytí rány.
Použité statistické metody
Ke srovnání naměřených počtů kopií v různých tkáních jsme použili párový Wilcoxonův test. Vzhledem k vícenásobnému použití Wilcoxonova testu ke srovnání více souborů (srovnání všech možných dvojic u tří souborů; tři testy) byla použita Bonfferoniho korekce a hladina významnosti byla upravena na 1,67 % (5/3).
Výsledky
1. Srovnání záchytu t(14;18) metodou PCR ve vzorcích získaných FNA a klasickým odběrem
Provedli jsme 5 autopsií s odběrem párových vzorků. V rámci jedné autopsie jsme odebrali 5 párových vzorků z různých skupin makroskopicky postižených uzlin nebo orgánů. 2 z 5 autopsií byly nehodnotitelné, neboť DNA podlehla degradaci ještě před vyšetřením. Pouze 3 z 5 autopsií, z nichž jsme získali 15 párových vzorků (FNA vs. klasická biopsie), bylo kompletně vyšetřeno (tab. 1). Párové vzorky z peroperačních biopsií byly odebrány z čerstvě odebrané uzliny (infiltrátu) u 7 pacientů s folikulárním lymfomem (tab. 2). Celkem bylo odebráno a vyšetřeno 22 párových vzorků. Ve 20 z 22 vzorků byl shodný záchyt t(14;18) metodou PCR. Diskrepance mezi klasickým odběrem a FNA byla pozorována ve 2 z 22 (9 %) odběrů, přičemž negativní FNA oproti standardnímu odběru byla pozorována jen v 1 z 22 případů (4,5 %).
Tab. 1. Srovnání kvalitativního záchytu t(14;18) polymerázovou řetězovou reakcí (PCR) v párových vzorcích odebraných punkční (FNA) a klasickou biopsií. 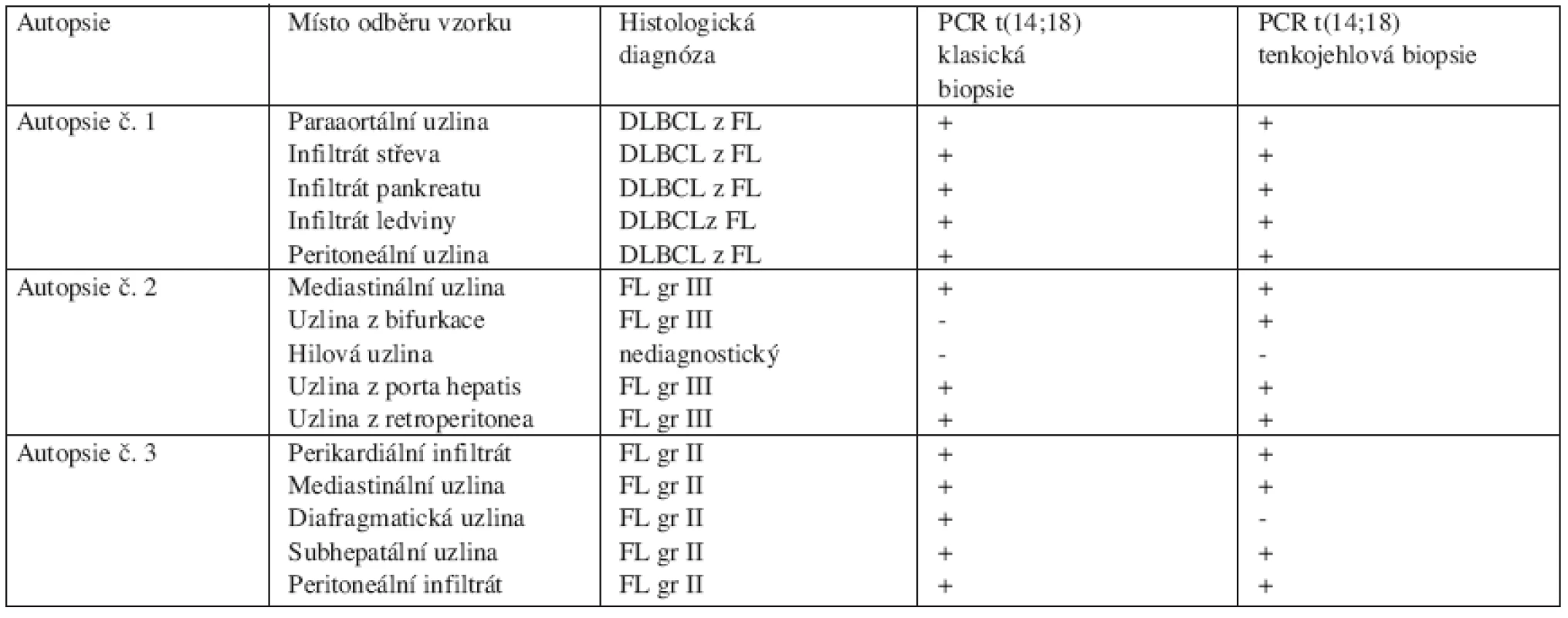
Vysvětlivky: FL = folikulární lymfom, DLBCL = difuzní velkobuněčný B-lymfom, + = pozitivita t(14;18), - = nepřítomnost t(14;18) Tab. 2. Průkaz t(14;18) a srovnání vzorků uzlin získaných klasickou biopsií a punkční biopsií (FNA) pod kontrolou ultrazvuku. 
Vysvětlivky: PCR = polymerázová řetězová reakce, FISH = fluorescent in situ hybridization, FL = folikulární lymfom, + = pozitivita t(14;18) ve vzorku, - = nepřítomnost t(14;18) ve vzorku 2. Hodnocení punkčních biopsií pod kontrolou ultrazvuku
Celkem bylo provedeno 31 (u 26 nemocných) FNA uzlin pod kontrolou ultrazvuku. Zákrok byl prováděn ambulantně, nebyly pozorovány žádné komplikace po výkonu. Výkon byl pacienty výborně tolerován. Ve 4 z 31 (13 %) případů byla FNA technicky neúspěšná, uzlinu nebylo možné pro malou velikost zaměřit, materiál nebyl odebrán. Ve 3/31 (10 %) případů byla punkce úspěšná, avšak v odebraném vzorku nebyla zastižena lymfatická tkáň (fibróza nebo vazivo). Hodnoceno na přítomnost t(14;18) ve FNA bylo zbývajících 24/31 (77 %) odběrů. Pokud jsme analyzovali FNA dle úspěšnosti odběru, zjistili jsme, že všech 7 případů nediagnostických FNA (materiál nebyl odebrán, nezachycena lymfatická tkáň) byly odběry prováděné v kompletní remisi (CR). 24 úspěšných FNA bylo provedeno u 10 z 24 pacientů s nově diagnostikovaným folikulárním lymfomem, u 9 z 24 v relapsu a u 5 z 24 pacientů v remisi po léčbě (tab. 3).
Tab. 3. Celkový přehled výsledků z punkčních (FNA) biopsií periferních uzlin pod kontrolou ultrazvuku. 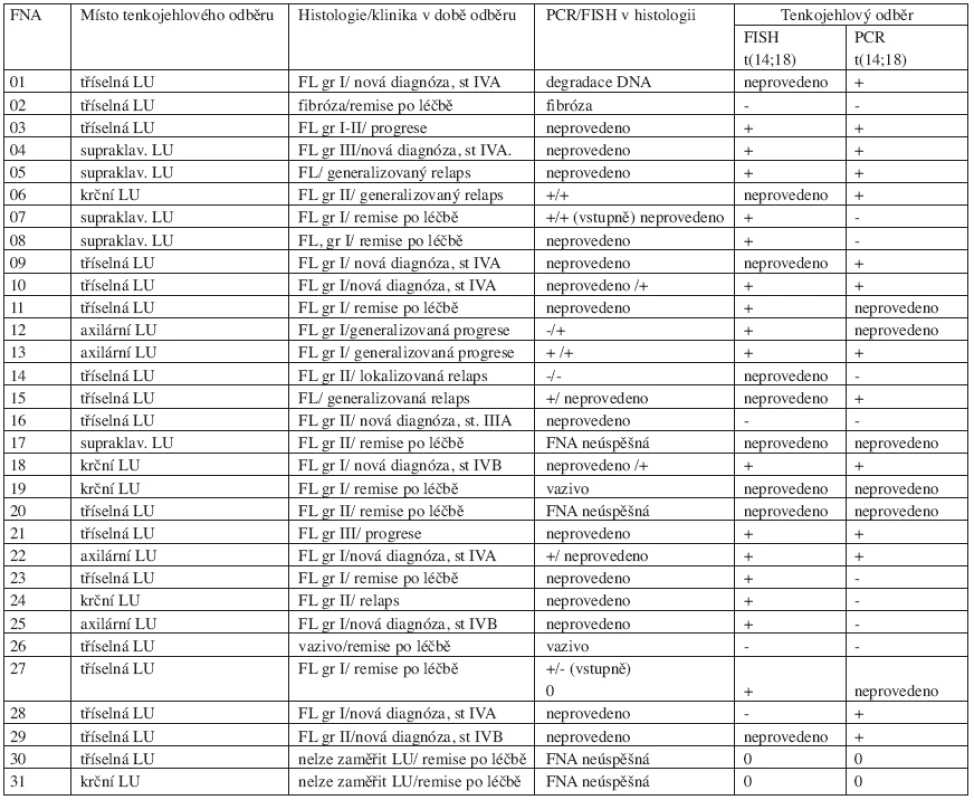
Vysvětlivky: PCR = polymerázová řetězová eakce, FISH = fluorescence in situ ybridization, FL = folikulární lymfom, + = pozitivita t(14;18) ve vzorku, - = nepřítomnost t(14;18) ve vzorku, LU = lymfatická uzlina, 0 = vzorek nebylo možné hodnotit 3. Srovnání záchytu t(14;18) FISH a PCR v punkčních vzorcích
U 28 vzorků získaných FNA (z tab. 2 a 3) jsme srovnávali záchyt t(14;18) metodou FISH a PCR. Jeden vzorek neobsahoval lymfatickou tkáň (orchitida), do srovnání bylo tudíž zahrnuto pouze 27 punkčních vzorků. FISH jsme vyšetřili u 18 z 27 vzorků a t(14;18) jsme identifikovali v 16 z 18 (89 %) odběrů. PCR jsme testovali u 24 z 27 FNA a t(14;18) jsme zachytili v 16 z 24 (67 %) případů. PCR a FISH současně z jednoho vzorku jsme testovali u 15 odběrů, FISH zde zachytila t(14;18) ve 13 z 15 a PCR v 8 z 15 vzorků. Pokud jsme využili obou metod současně celkový záchyt t(14;18) byl 24 z 27 (89 %). Podrobně viz tabulka 3.
4. Srovnání kvantity t(14;18) v různých vzorcích u pacientů s folikulárním lymfomem
Provedli jsme srovnání kvantitativního záchytu t(14;18) v různých tkáních u 31 pacientů s rozvinutým folikulárním lymfomem v době stanovení diagnózy nebo relapsu metodou RQ-PCR. Všechny vzorky (tkáň uzliny, kostní dřeň i periferní krev) byly odebírány s minimálním časovým odstupem (maximálně v rozmezí několika dní). Uzliny pravidelně čítaly miliony kopií (medián 2,3.106/106 CE), kostní dřeň desetitisíce (medián 16000/106 CE) a periferní krev pouhé tisíce kopií (medián 4200/106 CE). Rozdíly dosáhly statistické významnosti při porovnání uzlin oproti periferní krvi (p = 0,014) a téměř dosáhly hranice statistické významnosti při srovnání uzlin oproti kostní dřeni (p = 0,036). Nebyly zjištěny rozdíly mezi nově diagnostikovanými a relabovanými pacienty (tab. 4).
Tab. 4. Přehledné kvantitativní srovnání t(14;18) mezi periferní krví, kostní dření a tkání infiltrované uzliny u pacientů s rozvinutým folikulárním lymfomem. 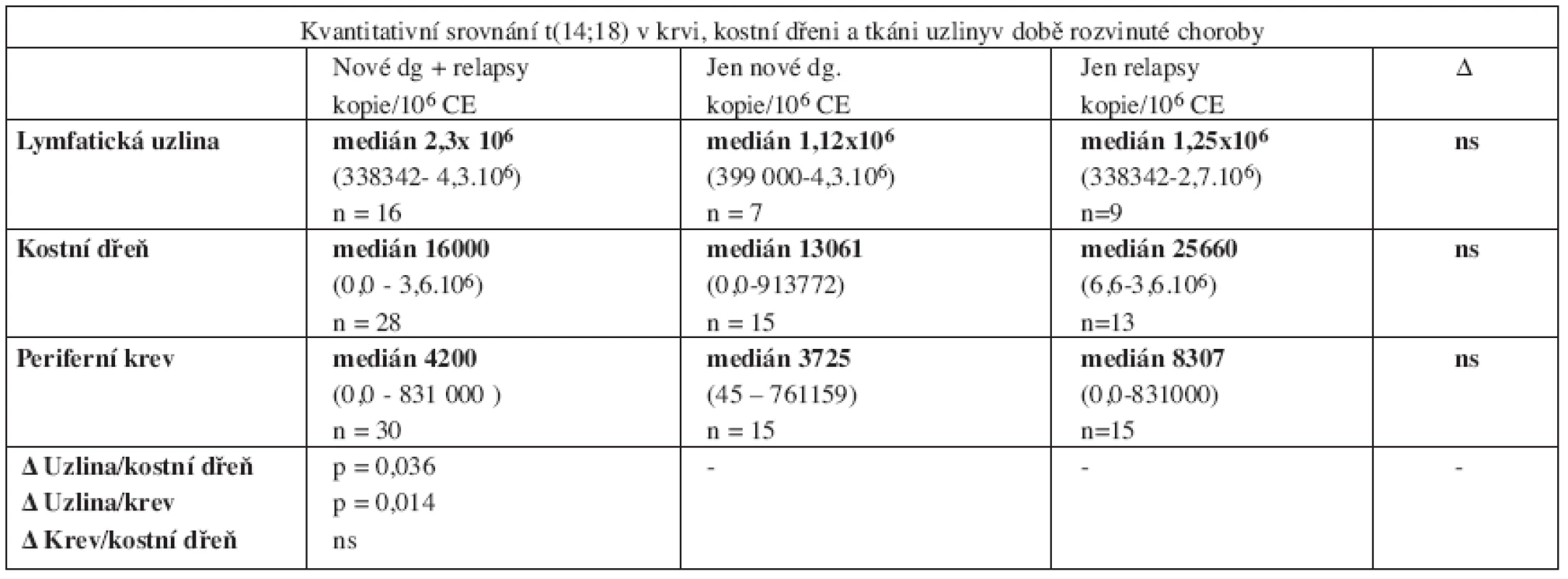
Vysvětlivky: Δ = rozdíl, ns = statisticky nevýznamný 5. FNA z původně postižené uzliny u pacientů v kompletní remisi FL
Celkem jsme provedli 12 FNA pod kontrolou ultrazvuku z původně infiltrované uzliny (respektive přibližně z téže uzliny skupiny původně postižených uzlin) u 11 nemocných, kteří se po léčbě dostali do kompletní remise. Všichni tito pacienti nevykazovali žádnou pozitivitu t(14;18) v periferní krvi po léčbě bez ohledu na jejich vstupní hodnoty (podrobně je rozvedeno níže).
U 4 z 12 FNA se odběr nezdařil, neboť uzlinky byly velmi drobné. Tito 4 nemocní jsou všichni v dlouhodobé remisi (medián trvání CR je 21 měsíců, medián od FNA 19 měsíců). Tři pacienti byli vstupně bez záchytu t(14;18) PCR, proto jsme testování t(14;18) v periferní krvi po léčbě neopakovali. U zbývající pacientky byla zachycena t(14;18) PCR (kvantita v periferní krvi byla při stanovení diagnózy 2900/106CE kopií a v uzlině 770 000/106 CE kopií), avšak po léčbě (v době provedení FNA) nebyla t(14;18) PCR detekovatelná. Pacientka setrvává i v molekulární remisi.
U 3 z 12 pacientů byla FNA provedena, ale ve vzorku byla prokázána jen fibróza nebo vazivová tkáň. Jeden vzorek byl hodnocen FISH, avšak DNA byla degradována, vzorek byl PCR negativní. Další vzorek byl FISH i PCR negativní. U zbývajícího vzorku nebyla provedena ani FISH, ani PCR (po předchozích zkušenostech jsme od testování fibrózního vzorku upustili). Všichni tito pacienti měli vstupně záchyt t(14;18) PCR v periferní krvi (20, 9700 a 130 800/106 CE kopií), po léčbě (v CR) v periferní krvi neměli detekovatelnou t(14;18) PCR. Medián sledování od FNA je 18 měsíců (3–20 měsíců). Jedna pacientka zrelabovala po 11 měsících od FNA, přičemž v periferní krvi byla po celou dobu včetně relapsu konstatována trvající molekulární remise. Zbývající dva pacienti setrvávají dále v molekulární i klinické remisi.
V 5 z 12 odběrů (u 4 pacientů) byla odebrána diagnostická tkáň a nalezena t(14;18) v 5 z 5 (100 %) případů. U 2 pacientů byla t(14;18) vstupně zachycena v periferní krvi (4600 a 250/106 CE kopií) i uzlině (340 000/106 CE kopií, netestován). V době odběru FNA po léčbě (v kompletní remisi včetně negativní PET) byli oba pacienti bez záchytu t(14;18) v periferní krvi. Uzlinová tkáň těchto dvou nemocných byla testována PCR pozoruhodně s negativním výsledkem t(14;18), avšak FISH zachytila t(14;18) ve všech třech vzorcích (60 %, 73 % a 82 % pozitivních buněk). Jeden z těchto dvou pacientů za 3 měsíce po FNA klinicky zrelaboval, přičemž došlo současně k nárůstu kopií t(14;18) v periferní krvi (z 0 na 246/106 CE kopií v průběhu dvou měsíců). Druhý z těchto dvou zůstává v molekulární i klinické remisi (včetně negativní PET) více než 23 měsíců, i když má opakovaně ve FNA uzliny jednoznačný záchyt t(14;18) metodou FISH. Další dva pacienti byli vstupně testováni PCR na t(14;18) s negativním výsledkem, FNA uzliny po léčbě byla proto testována pouze FISH (32 a 17 %). Tito 2 pacienti zrelabovali za 6 a 12 měsíců po FNA. Přehledně viz tabulka 5.
Tab. 5. Přehled čtyř pacientů s průkazem t(14;18) ve FNA uzliny provedené po léčbě v době kompletní a molekulární remise. 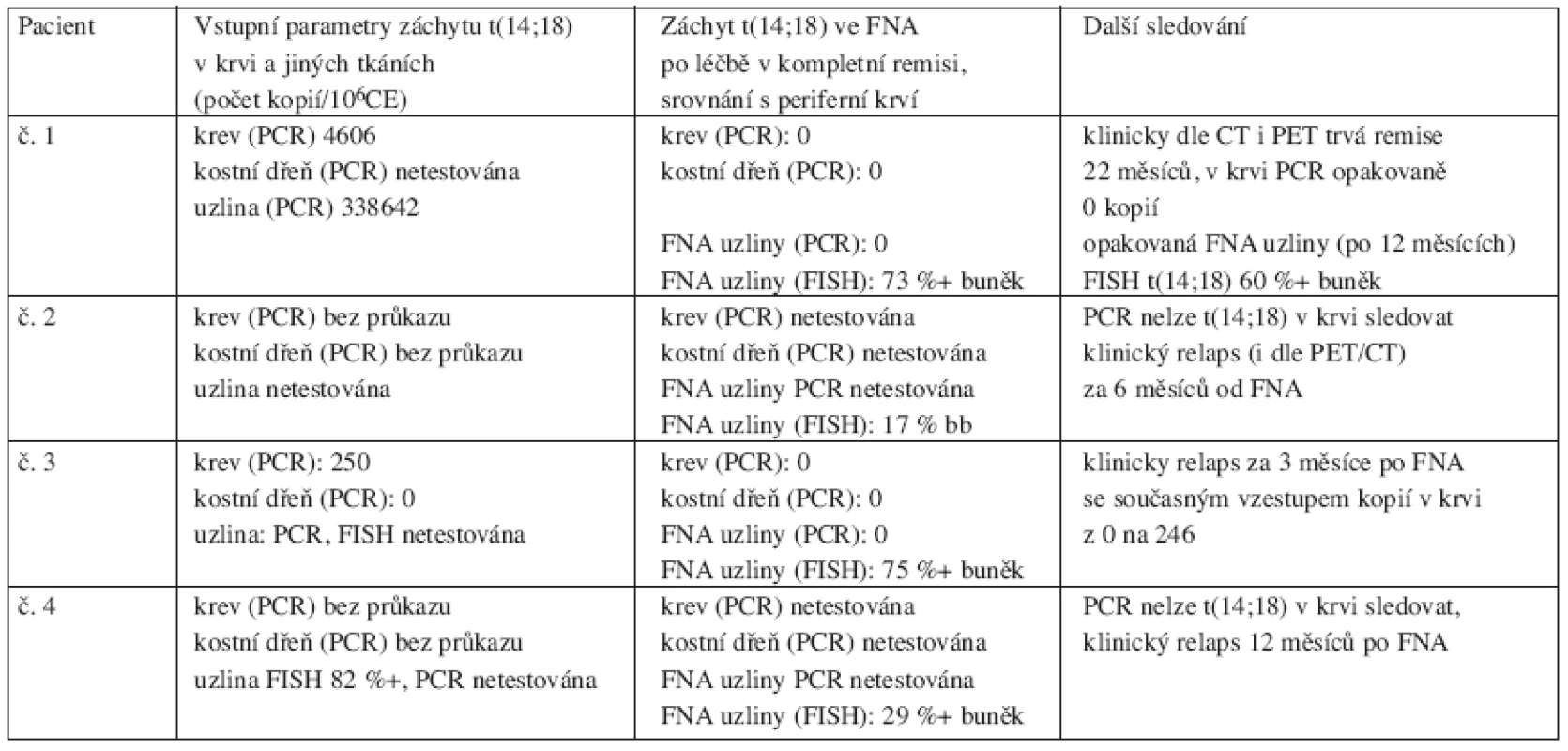
Vysvětlivky: PCR-polymerase chain reaction, FISH- fluorescence in situ hybridization Diskuse
Předkládané sdělení je pilotní práce, která svými skromnými výsledky otvírá další možnosti studia folikulárního lymfomu u samé jeho podstaty. Snažili jsme se krok po kroku zmapovat možnosti zkoumání a opakovaného monitorování folikulárního lymfomu v jeho primárním kompartmentu – lymfomem postižené uzlině. Naši teorii podporuje nález významného rozdílu v kvantitě t(14;18) nalezené uzliny ve tkáni oproti krvi a dřeni. Takovéto podrobné srovnání mezi jednotlivými tkáněmi jsme v literatuře nenalezli.
Prvním krokem bylo vyšetření a porovnání vzorků FNA se vzorky bioptickými (respektive autoptickými). Výběr pacientů pro punkční biopsii uzliny byl prováděn konsekutivně přibližně ze stovky pacientů s folikulárním lymfomem léčených na Interní hematoonkologické klinice FN Brno. Vzhledem k nepoměrně složitější technice odběru lymfatické tkáně uzliny, nežli je odběr krve, byl výběr zásadním způsobem omezen pouze na pacienty s chorobou v dobře přístupných periferních uzlinách. Na základě našich výsledků konstatujeme, že punkční vzorek je srovnatelný s klasickou biopsií, pokud jde o průkaz t(14;18) metodou PCR. Srovnání záchytu t(14;18) mezi punkční a klasickou biopsií jsme v literatuře nenalezli. Jeffers et al. srovnávali FNA versus klasickou biopsii, předmětem srovnání byla však průtoková cytometrie a klonalita u lymfoproliferací a lymfoidní hyperplazie (40). Gong et al. prokázali t(14;18) v 85 % vzorků FNA u folikulárních lymfomů metodu I-FISH, vzorky byly srovnány pouze s histologicky zpracovanou biopsií (41). FISH má větší možnosti záchytu t(14;18) než PCR, protože umožní detekci zlomových míst i mimo oblasti MBR a mcr. PCR má oproti FISH o několik řádů vyšší citlivost (1 : 105–106 vs 1 : 103). Ze srovnání záchytu t(14;18) u 27 FNA metodami FISH a PCR vyplývá, že FISH je solidní metodou průkazu této přestavby v punkčním vzorku. Dosažený záchyt t(14;18) FISH byl v 89 % a PCR v 67 % FNA u pacientů s folikulárním lymfomem. Pokud byly obě metody kombinovány dosáhla identifikace t(14;18) necelých 90 %. Kombinaci metod FISH a PCR doporučují i další autoři jako optimální pro detekci t(14;18) (47).
Punkční biopsie uzliny pod kontrolou UZV je bezpečná, dobře tolerovaná a minimálně invazivní technika. Proveditelnost a výtěžnost v době rozvinutého onemocnění je absolutní, avšak u pacientů v kompletní remisi po léčbě se úspěšnost FNA pohybuje (alespoň prozatím) kolem 40 %.
Stanovení zbytkové molekulární nemoci v tkáni uzlin přineslo překvapující poznatky. Je pozoruhodné, že 6 ze 7 případů „neúspěšných FNA“ je sdruženo s poměrně dlouhými remisemi, pouze jedna pacientka zrelabovala. Zdá se, že průkaz t(14;18) v uzlinách po léčbě u pacientů v remisi není nic neobvyklého, na rozdíl od periferní krve, kde pozitivita velmi ochotně již během léčby mizí u většiny nemocných často bez ohledu na skutečnou léčebnou odpověď (32, 48, 49). V našem pozorování 5 z 5 (100 %) diagnostických FNA v remisi obsahovaly t(14;18)-pozitivní buňky. 3 ze 4 pacientů dle očekávání zrelabovali, avšak jedna nemocná dokonce s opakovaně prokázanou molekulární pozitivitou v uzlině setrvává v kompletní a molekulární (v krvi a kostní dřeni) remisi. Sledování zbytkové nemoci u folikulárního lymfomu na úrovni uzlin je logická úvaha, neboť jen tak lze získat nezkreslený obraz o nemoci vznikající pravděpodobně prvotně v uzlinách. Na rozdíl od periferní krve nebo kostní dřeně je však nesrovnatelně obtížnější opakovaně získat vzorky uzlin k posouzení zbytkové nemoci. Výsledky naší pilotní studie podporují myšlenku monitorování zbytkové choroby v uzlinách. FNA uzlin lze získat dostatečné diagnostické vzorky na cytogenetické a molekulárně biologické vyšetření. FNA lymfomové uzliny lze jistě využít i pro jiné účely než vyšetření t(14;18) například kryokonzervace vzorků pro pozdější speciální diagnostiku, pokud je původní biopsie nedostupná a opakovaná biopsie eticky neúnosná.
Prognostický význam průkazu t(14;18) v uzlině v klinické tzv. kompletní remisi není zatím jasný. Zdá se, že přetrvávání pozitivity t(14;18) v uzlině u pacientů v remisi nevede nutně ke klinickému relapsu. Může jít o reziduální tkáň, snad neschopnou další nádorové proliferace. Může také ale jít o přetrvávající lymfomovou progenitorovou (nádorovou kmenovou?) buňku (50), z níž potom choroba relabuje. Interakce mezi nádorovou buňkou a organizmem je velmi komplexní a zjištění povahy této reziduální t(14;18) pozitivní populace a podmínek, za nichž dochází k další proliferaci, by mělo být předmětem dalšího velmi intenzivního studia, neboť by tyto poznatky výrazným způsobem přispěly k pochopení biologie folikulárního lymfomu a zracionalizovaly terapii, zvláště tzv. udržovací.
Podpořeno částečně Výzkumným záměrem MSM 0021622430.
MUDr. Andrea Janíková
Interní hematoonkologická klinika Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: aoboril@fnbrno.cz
Došlo do redakce: 18. 12. 2006
Přijato: 17. 4. 2007
Zdroje
1. Bosga-Bouwer AG, van Imhoff GW, Boonstra R, et al. Follicular lymphoma grade 3B includes 3 cytogenetically defined subgroups with primary t(14;18), 3q27, or other translocation: t(14;18) and 3q27 are mutually exclusive. Blood 2003; 101 : 1149–1154.
2. Horsman DE, Okamoto I, Ludkovski O, et al. Follicular lymphoma lacking the t(14;18) (q32;q21): identification of two disease subtypes. Br J Haematol 2003; 120 : 424–433.
3. Jardin F, Gaulard P, Buchmnont G, et al. Follicular lymphoma without t(14;18) and with bcl-6 rearrangement: a lymphoma subtype with distinct pathological, molecular and clinical characteristics. Leukemia 2002; 16 : 2309–2317.
4. Tilly H, Rossi A, Stamatoullas A, et al. Prognostic value of chromosomal abnormalities in follicular lymphoma. Blood 1994; 84 : 1043–1049.
5. Meijerink JPP. T (14;18), a journey to eternity. Leukemia 1998; 11 : 2175–87.
6. Aster JC, Kobayashi Y, Shiota M, et al. Detection of the t(14;18) at similar frequencies in hyperplastic lymphoid tissues from American and Japanese patients. Am J Pathol 1992; 141 : 291–299.
7. Delage R, Roy J, Jacques L, et al. Multiple bcl-2/Ig gene rearrangements in persistent polyclonalB-cell lymphocytosis. Br J Haematol 1997; 97 : 589–595.
8. Dölken G, Illerhaus G, Hirt C, et al. BCL-2/JH rearrangements in circulating B cells of healthy blood donors and patients with nonmalignant diseases. J Clin Oncol 1996; 14 : 1333–1344.
9. Ladetto M, Drandi D, Compagno M, et al. PCR-detectable nonneoplastic Bcl-2/IgH rearrangement are common in normal subjects and cancer patients at diagnosis but rare in subjects treated with chemotherapy. J Clin Oncol 2003; 21 : 1398–1403.
10. Tsimberidou AM., McLaughlin P., Younes A, et al. Fludarabine, mitoxantrone, dexamethasone (FND) compared with an alternating triple therapy (ATT) regimen in patients with stage IV indolent lymphoma. Blood 2002; 100 : 4351–4357.
11. Tsujimoto Y, Finger LR, Yunis J, et al. Cloning of the chromosome breakpoint of neoplastic B cells with t(14;18) chromosomal translocation. Science 1984; 226 : 1097–1099.
12. Tsujimoto Y, Cossman J, Jaffe E, et al. Involvement of the bcl - 2 gene in human follicular lymphoma. Science 1985; 228 : 1440–1443.
13. Cleary ML, Sklar J. Nucleotide sequence of t(14;18) chromosomal breakpoint in follicular lymphoma and demonstration of breakpoint - cluster region near a transcriptionally active locus on chromosome 18. Proc Natl Acad Sci USA 1985; 82 : 7439–7443.
14. Cleary ML, Galili N, Sklar J. Detection of second t(14;18) breakpoint cluster region in human follicular lymphomas. J Exp Med 1986; 164 : 315–320.
15. Akasaka T, Akasaka H. Yonetani N, et al. Refinement of the Bcl2/imunoglobulin heavy chain fusion gene in t(14;18)(q32;q21) by polymerase chain reaction amplification for long targets. Genes Chromosomes cancer 1998; 21 : 17–29.
16. Tsujimoto Y, Bashir MM, Givol I, et al. DNArearrangements in human follicular lymphoma can involve the 5’ or the 3’region of the bcl-2 gene. Proc Natl Acad Sci USA 1987; 84 : 1329–1331.
17. Gribben JG, Freedman AS, Woo SD, et al. All advanced stage Non-Hodgkin’s lymphomas with a polymerase chain reaction amplifiable breakpoint of bcl-2 have residual cells containing the bcl-2 rearrangement at evaluation and after treatment. Blood 1991; 78 : 3275–3280.
18. Horsman DE, Gascoyne RD, Coupland RW, et al. Comparison of cytogenetic analysis, southern analysis and polymerase chain reaction for detection of t(14;18) in follicular lymphoma. Am J Clin Pathol 1995; 103 : 472–478.
19. van Dongen JM, Langerak AW, Bruggemann M, et al. Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: Report of the BIOMED-2 concerted action BMH4-CT98-3936. Leukemia 2003; 17 : 2257–2317.
20. Vaandrager JW, Schuuring E, Raap T, et al. Interphase FISH detection of BCL2 rearragement in follicular lymphoma using breakpoint-flanking probes. Genes, Chromosomes Cancer 2000; 27 : 85–94.
21. Godon A, Moreau A, Talmant P, et al. Is t(14;18) (q32;q21) a constant finding in follicular lymphoma? In interphase FISH study on 63 patients. Leukemia 2003; 17 : 255–259.
22. Yao-Shan F, Rizkalla K. Comprehensive cytogenetic analysis including multicolor spectral karyotyping and interphase fluorescence in situ hybridization in lymphoma diagnosis: a summary of 154 cases. Cancer Genetics and Cytogenetics 2003; 27 : 85–94.
23. López-Guillermo A, Cabanillas F, McLaughlin P, et al. The clinical significance of molecular response in indolent follicular lymphoma. Blood 1998; 8 : 2955–2960.
24. López-Guillermo A, Cabanillas F, McLaughlin P, et al. Molecular response assessed by PCR is the most important factor predicting failure-free survival in indolent follicular lymphoma: Update of the MDACC series. Annals of Oncology 2001; 11 (Suppl.1): S137–140.
25. Montoto S, López-Guillermo A, Colomber D, Esteve J, et al. Incidence and and clinical significance of bcl-2/IgH rearrangements in follicular lymphoma. Leuk Lymphoma 2003; 44 : 71–76.
26. Apostolidis J, Gupta R, Grenzelias D, et al. High-dose therapy with autologous bone marrow support as consolidation of remission in follicular lymphoma: long-term clinical and molecular follow - up. J Clin Oncol 2000; 18 : 527–536.
27. Freedman A, Gribben J, Neuberg D, et al. High-dose therapy and autologous bone marrow transplantation in patients with follicular lymphoma during first remission. Blood 1996; 88 : 2780–2786.
28. Ladetto M, Corradini P, Vallet S, et al. High rate of clinical remissions in follicular lymphoma patients receiving high-dose sequential chemotherapy and autografting at diagnosis: a multicenter prospective study by Gruppo Italiano Trapianto Midollo Osseo (GITMO). Blood 2002; 100 : 1559–1565.
29. Hirt C, Dölken G. Quantitative detection of t(14;18)-positive cells in patients with follicular lymphoma before and after autologous bone marrow transplantation. BMT 2000; 25 : 419–426.
30. Meijerink JPP, Goverde GJ, Smetsers TFCM, et al. Quantitation of follicular non-Hodgkin’s lymphoma cells carrying t(14;18) in a patient before and after allogeneic bone marrow transplantation. Annals of Oncology 1994; 5(Suppl 1): S43–S45.
31. Foran JM, Gupta RK, Cunningham D, et al. A UK multicenter phase II study of rituximab (chimaeric anti-CD20 monoclonal antibody) in patients with follicular lymphoma, with PCR monitoring of molecular response. Br J Haematol 2000; 109 : 81–88.
32. Mandingers CMPW, Meijerink JPP, Mensink EJBM, et al. Lack of correlation between numbers of circulating t(14;18)-positive cells and response to first-line treatment in follicular lymphoma. Blood 2001; 98 : 940–944.
33. Lambrechts A, Hupkes P, Dorssers L, et al. Clinical significance of t(14;18)-positive cells in the circulation of patients with stage III or IV follicular non-Hodgkin’s lymphoma during first remission. J Clin Oncol 1994; 12 : 1541–1546.
34. Price C, Meerabux J, Murtagh S, et al. The significance of circulating cells carrying t(14;18) in long remission from follicular lymphoma. J Clin Oncol 1991; 9 : 1527–1532.
35. Gribben JG, Neuberg D, Barber M, et al. Detection of residual lymphoma cells by polymerase chain reaction in peripheral blood is significantly less predictive for relapse than detection in bone marrow. Blood 1994; 83 : 3800–3807.
36. Rambaldi A, Carlotti E, Oldani E, et al. Quantitative PCR of bone marrow BCL2/IgH+ cells at diagnosis predicts treatment response and long-term outcome in follicular non-Hodgkin lymphoma. Blood 2005; 105 : 3428–3433.
37. Summers KE, Davise AJ, Matthews J, et al. The relative role of peripheral blood and bone marrow for monitoring molecular evidence of disease in follicular lymphoma by quantitative real-time polymerase chain reaction. British Journal of Haematology 2002; 118 : 563–566.
38. Steward FW. The diagnosis of tumors by aspiration. Am J Pathol 1933; 9 : 801–815.
39. Das DK. Value and limitations of fine-needle aspiration cytology in diagnosis and classification of lymphomas: A Review Diagn Cytopathol 1999; 21 : 240–249.
40. Jeffers MD, Milton J, Herriot R, McKean M. Fine needle aspiration cytology in the investigation of non-Hodgkin’s lymphoma. J Clin Pathol 1998; 51 : 189–196.
41. Gong Y, Caraway N, Gu J, et al. Evaluation of interphase fluorescence in situ hybridization for the t(14;18)(q32;q21) translocation in the diagnosis of follicular lymphoma on fine-needle aspirates. Cancer (Cancer Cytopathol) 2003; 99 : 385–393.
42. Mayall F, Darlington A, Harrison B. Fine needle aspiration cytology in the diagnosis of uncommon types of lymphoma. J Clin Pathol 2003; 56 : 821–825.
43. Wakely PE. Fine-needle aspiration cytopathology in diagnosis and classification of malignant lymphoma: Accurate and reliable? Diagn Cytopathol 2000; 22 : 120–125.
44. Cheson B, Horning S, Coiffier B, et al. Report of international workshop to standardize response criteria for non-Hodgkin’s lymphomas. J Clin Oncol 1999; 17 : 1244–1253.
45. Dolken L, Schuler F, Dolken G. Quantitative detection of t(14;18)-positive cells by real-time quantitative PCR using fluorogenic probes. Biotechniques 1998; 25 : 1058–1064.
46. Chiu RW, Murphy MF, Fidler C, et al. Determination of RhD zygosity: comparison of a double amplification refractory mutation system approach and a multiplex real-time quantitative PCR approach. Clinical Chemistry 2001; 47 : 667–672.
47. Shaminie J, Peh SC, Tant MJA. Improvement in the detection rate of t(14;18) translocation on paraffin embedded tissue: a combination approach using PCR and FISH. Pathology 2003; 35 : 414–421.
48. Schmitt C, Grundt A, Buchholtz C, et al. One single dose of rituximab added to a standard regimen of CHOP in primary treatment of follicular lymphoma appears to result in a high clearance rate from circulating bcl-2/IgH positive cells: Is the end of molecular monitoring near? Leuk Res 2006; 9: in press.
49. Czuczman MS, Grillo-Lopez AJ, McLaughlin P, et al. Clearing of cells bearing the bcl-2 [ t(14;18)] translocation from blood and marrow of patients treated with rituximab alone or in combination with CHOP chemotherapy. Ann Oncol 2001; 12 : 109–114. 50. Hart J, Turner AR, Larratt LM, et al. Transmission of a follicular lymphoma by allogeneic bone marrow transplantation – evidence to support the existence of a lymphoma progenitor cell. Blood 2006; 108 : 683a (Abstract No 2415).
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2007 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Chronická B-lymfocytární leukemie Část IV: Možnosti léčby s použitím monoklonálních protilátek alemtuzumabu a rituximabu
- Zprávy o knihách
- Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
- Zprávy o knihách
- Léčba recidivující multifokální histiocytózy z Langerhansových buněk 2-chlordeoxyadenosinem u osob dospělého věku. Zkušenosti jednoho pracoviště
- Alogenní transplantace krvetvorných buněk po přípravném režimu redukované intenzity v léčbě lymfoproliferací (výsledky ÚHKT 1999–2005)
- Zprávy o knihách
- Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
- Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
- První nález fenotypu Gy(a-) v České republice od jeho objevu v r. 1967. Možné příbuzenství s původními nositeli tohoto fenotypu v USA v letech 1967–1968
- LYFE Meeting, Mnichov 29.–30. 3. 2006
- Prof. MUDr. Pavel Klener, DrSc. se v dubnu 2007 dožil 70 let
- GRATULUJEME
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
- Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
- Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
- Léčba recidivující multifokální histiocytózy z Langerhansových buněk 2-chlordeoxyadenosinem u osob dospělého věku. Zkušenosti jednoho pracoviště
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



