-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chronická B-lymfocytární leukemie Část IV: Možnosti léčby s použitím monoklonálních protilátek alemtuzumabu a rituximabu
B-cell chronic lymphocytic leukemia. Part IV: Monoclonal antibody treatment options with alemtuzumab and rituximab
B-cell chronic lymphocytic leukemia (B-CLL) is conventionally incurable lymphoproliferative disease. Modern chemotherapy can effectively affect disease course and survival in only small proportion of patients. Monoclonal antibodies represent new category of anticancerdrugs that mediate cell death utilizing several mechanism different from classical chemotherapy including direct pro-apoptotic effect, complement – mediated cytotoxicity and antibody-dependent cellularcytotoxicity. Alemtuzumab (anti-CD52) and rituximab (anti-CD20) are currently widely used monoclonal antibodies in B-CLL. Alemtuzumab is approved forthe treatment of relapsing and resistant patients and recent pilot reports demonstrate its activity in eliminating the minimal residual disease. Rituximab have synergistic
anti-leukemic effect with fludarabine and cyclophosphamide and this combination will probably become gold standard in the first-line treatment of B-CLL.Key words:
B-cell chronic lymphocytic leukemia, monoclonal antibodies, rituximab, alemtuzumab, residual disease
Autoři: kT. Papají; R. Urbanová; V. Procházka
; K. Indrák
Působiště autorů: Hemato-onkologická klinika LF UPaFN Olomouc
Vyšlo v časopise: Transfuze Hematol. dnes,13, 2007, No. 2, p. 48-55.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Chronická B-lymfocytární leukemie (B-CLL) je dosud považována za konvenčně nevyléčitelné lymfoproliferativní onemocnění. Moderní chemoterapie dovede účinně ovlivnit průběh choroby jen umalé části nemocných. Monoklonální protilátky reprezentují novou skupinu protinádorových přípravků, jež působí cíleně na leukemickou buňku adovedou indukovat její apoptózu apomocí komplementu efektorových buněk ijejí přímé zničení. Alemtuzumab (anti-CD52) arituximab (anti-CD20) jsou dnes dostupné astandardně používané onoklonální protilátky vléčbě B-CLL. Alemtuzumab je indikován především vléčbě relabujících arefrakterních nemocných aukazuje se, že by mohl být účinným lékem minimalizujícím zbytkovou chorobu po předchozí chemoterapii. Rituximab se díky synergnímu působení skonvenčními cytostatiky stává stále častěji používaným lékem1. linie aje nanejvýš pravděpodobné, že se kombinace protilátky anti-CD20, fludarabinu acyklofosfamidu stane zlatým standardem iniciální terapie nemocných sB-CLL.
Klíčová slova:
chronická B-lymfocytární leukemie, monoklonální protilátky, rituximab, alemtuzumab, reziduální chorobaÚvod
Chronická B-lymfocytární leukemie (B-CLL) je dosud považována za onemocnění, u něhož i moderní kombinovaná chemoterapie pouze zmírní příznaky choroby, dočasně utlumí progresi nádorové populace, ale ve většině případů nevede k výraznějšímu prodloužení celkového přežití. Tradiční konzervativní přístup je většinou charakterizován paliativní léčbou se snahou po minimální toxicitě pro nemocného s ohledem na vyšší věk většiny nemocných a předpokládanou nevyléčitelnost onemocnění.
Použití fludarabinu (FLU) a dalších purinových analog v léčbě B-CLL zvýšilo počet léčebných odpovědí včetně kompletních remisí a významně prodloužilo délku jejich trvání (1–3). Kombinace FLU a cyklofosfamidu (CFA) se stala historicky nejúčinnější chemoterapií používanou v léčbě B-CLL, u drtivé většiny nemocných však ani tato léčba nevedla k dosažení minimální zbytkové choroby (MZCH), resp. potlačení nádorového klonu pod hladinu detekce současnými citlivými molekulárně-biologickými metodami (4, 5). Až možnosti rutinního klinického použití monoklonálních protilátek v posledních letech přinesly pro terapii nemocných s B-CLL nový impuls a hematologům poskytly potřebnou dávku entuziasmu, jež pomohla měnit klinický pohled na toto onemocnění.
Alemtuzumab (humanizovaná anti-CD52 monoklonální protilátka)
CD52 antigen se vyskytuje ve vysokém počtu (5x105/buňku) na povrchu všech fyziologických B - i Tlymfocytů, monocytů, makrofágů, eosinofilů, epiteliálních buněk epidermis a mužských pohlavních orgánů. Jedná se o glykoprotein dosud neznámé funkce, který se nenachází na kmenových buňkách krvetvorby a na plazmatických buňkách, ale na druhé straně zůstává přítomen na nádorových elementech B-CLL a dalších lymfoidních neoplázií vycházejících z B - i T-lymfocytů (6). Experimentálně zkonstruovaná protilátka proti CD52 antigenu (nejprve IgM, později IgG2 krysí protilátka) v laboratořích v Cambridgi v roce 1979 dokázala velmi účinně snižovat počty fyziologických lymfocytů v periferní krvi a první experimenty prokázaly také její možnou účinnost proti nádorovým elementům B-CLL (7). Teprve vývoj humanizované CD52 protilátky a výběr jejího izotypu IgG1 pro klinické použití (označené jako Campath 1H, později alemtuzumab) umožnil dosáhnout hledaný léčebný efekt díky zvýšení aktivace komplementu a cytotoxicity efektorových buněk spolu s eliminací nevýhodných vlastností protilátky krysí (8–10). Přesný mechanismus účinku alemtuzumabu není znám. V první fázi jde především o vazbu protilátky na nádorové buňky, což umožní jejich opsonizaci a následné vychytání v retikuloendotelovém systému jater, sleziny a plic. Tento proces je rychlý a způsobuje významný pokles cirkulujících nádorových lymfocytů v periferní krvi. Na rozdíl od jiných protilátek však v této fázi nedochází k destrukci buněk a proto se v tomto případě nemusíme obávat syndromu rozpadu nádoru. Na druhé straně je patrné, že skutečná likvidace nádoru zde probíhá až v následné fázi, a to poměrně pomalu. Mechanismy cytotoxického působení protilátky jsou založeny na aktivaci komplementu a protilátkově závislé buněčné toxicity pomocí vazby na Fc receptor protilátky, v menší míře dochází i k přímé indukci apoptózy lymfoidní buňky (11, 12). Zdá se, že efekt protilátky na nádorové buňky je přímo úměrný počtu antigenních míst na jejich povrchu. Nejvyšší počet CD52 antigenů se nachází na buňkách T-prolymfocytární leukemie (T-PLL) (13).
První údaje o použití alemtuzumabu u B-CLL v klinických studiích byla publikována v roce 1997, kdy Österborg s kolegy publikoval data o 29 nemocných s relabující nebo refrakterní B-CLL (14). Všichni nemocní byli léčeni alemtuzumabem v dávce 30 mg 3x týdně (i.v. infuze) po dobu maximálně 12 týdnů. 3 z 8 relabujících (38 %) a 9 z 21 refrakterních (43 %) pacientů dosáhlo objektivní léčebné odpovědi. U 97 % pacientů došlo k vymizení patologických buněk z periferní krve, ale jen u 36 % nemocných došlo k eliminaci leukemických buněk z kostní dřeně. Redukce splenomegalie byla přítomna u 32 % nemocných a vymizení patologicky zvětšených lymfatických uzlin bylo pozorováno jen u 7 % případů. Medián doby trvání odpovědi byl 12 měsíců, u 2 nemocných byla popsána oportunní infekce, 4 prodělali bakteriální sepsi.
Následující americká studie fáze II popsala efekt alemtuzumabu u 24 nemocných s relabující B-CLL (n = 23) a T-PLL (n = 1), kteří byli v minulosti léčeni režimem obsahujícím fludarabin (15). 71 % nemocných bylo na FLU refrakterní nebo zrelabovali/progredovali do 6 měsíců od ukončení jeho podávání. 33 % pacientů ve studii dosáhlo parciální remise (PR), ta trvala v mediánu 15 měsíců. Protože nebyla podávána preventivní protiinfekční terapie, 42 % nemocných prodělalo oportunní infekt, vysoký byl výskyt pneumocystové pneumonie. V obou studiích byl vysoký počet nežádoucích toxických reakcí vázaných na infuzi protilátky, třes, křeče a teplota se vyskytovaly téměř u všech nemocných. Na základě těchto dat byla před podáním alemtuzumabu doporučena premedikace (antipyretika, antihistaminika), dodržení eskalace prvních dávek (3 mg 1. den, 10 mg 2. den a 30 mg 3. den) a protiinfekční profylaxe cotrimoxazolem, acyklovirem a u rizikových nemocných i antimykotikem.
Výsledky stěžejní multicentrické studie hodnotící použití alemtuzumabu u 93 předléčených nemocných s B - -CLL byly zveřejněny Keatingem a kol. v roce 2002 (16). 92 nemocných mělo v předchozí terapii FLU, všichni nemocní byli navíc léčeni alkylační látkou. Terapie alemtuzumabem byla plánována na maximum 12 týdnů, jednotlivá dávka 30 mg, podání 3x týdně. 33 % pacientů dosáhlo léčebné odpovědi, 31 % PR a 2 % kompletní remise (CR). Opět bylo dosaženo vysoké procento vymizení leukemických buněk z periferní krve (83 %), a u 48 % nemocných s léčebnou odpovědí i vymizení nádorového klonu z kostní dřeně. Pravděpodobnost léčebné odpovědi byla nepřímo úměrná počáteční velikosti lymfatických uzlin. Nemocní s uzlinami do 2 cm reagovali vymizením lymfadenomegalie v 64 %, s velikostí 2–5 cm v 15 % (u 56 % z nich se uzliny zmenšily na 50 %) a u nemocných s uzlinami většími jak 5 cm nebyla nalezena žádná kompletní léčebná odpověď, respektive částečně reagovalo 59 % těchto pacientů. Křeče a teploty vázané na infuzi byly dokumentovány v 90 %, resp. 85 %, těžká granulocytopenie u 30 % nemocných, u všech sledovaných došlo k výraznému poklesu CD3+ a CD4+ T-lymfocytů. Infekce se vyskytly v 55 % případů, u 25 nemocných byly hodnoceny jako těžké či život-ohrožující, 11 nemocných prodělalo oportunní infekty. Varovné bylo zjištění, že u 7 nemocných došlo k reaktivaci cytomegalovirové (CMV) infekce, poměrně časté byly invazivní plísňové nákazy. Celkově zemřelo na infekt 17 pacientů. Doba trvání remise byla v mediánu téměř 9 měsíců, celkové přežití pak 16 měsíců.
V témže roce publikovali němečtí autoři zajímavé kazuistické sdělení o možné úloze a účinku alemtuzumabu v léčbě nemocného s B-CLL a mutací genu p53 (17). Větší soubor FLU – refrakterních pacientů s B-CLL a mutacemi p53 či delecí 17p, kteří byli následně léčeni alemtuzumabem, publikoval Lozanski s kolektivem (18). 6 z 15 nemocných (40 %) na tuto léčbu reagovalo (2 dosáhli CR choroby), medián trvání odpovědi byl 8 měsíců. Parciální remise dosáhli ještě 3 z 11 nemocných s delecí 11q (27 %). Autoři své pozorování uzavřeli předpovědí, že alemtuzumab by se mohl stát lékem volby pro nemocné s defekty genu p53, u kterých ostatní typy konvenční léčby vesměs selhávají.
Dyer (19), Rai (20) a po něm Moreton s kolegy (21) si položili zajímavou otázku, zda alemtuzumab dokáže eradikovat MZCH a prodloužit tím přežití nemocných.
V první práci britští autoři dosáhli u 5 z 6 nemocných CR, 1 nemocný dosáhl velmi dobré PR s noduly zbytkové choroby v trepanobioptickém vzorku (19). Všichni nemocní byli předléčeni nejméně 6 cykly chemoterapie, 5 z nich mělo v léčbě FLU.
Rai s kolegy (20) referovali o výsledcích protokolu, ve kterém byly podávány 4 cykly i.v. FLU v měsíčních intervalech 56 nemocným s neléčenou B-CLL. 4 % z nich dosáhli CR, 52 % PR. Po 2měsíčním odstupu od skončení terapie byl nemocným se stabilním onemocněním, PR a CR (36 nemocných) podáván i.v. alemtuzumab 3x týdně po dobu 6 týdnů. 33 z těchto nemocných (92 %) dosáhlo léčebnou odpověď, u 15 byla zjištěna CR a u 18 PR choroby. U 12 nemocných byly zaznamenány vážné infekční komplikace, u 8 nemocných CMV infekce (1 s fatálním průběhem).
Reprezentativní data shromážděná v letech 1996–2003 publikoval Moreton v roce 2005, kdy 91 předléčených nemocných (44 z toho mělo již dříve v terapii FLU) dostávalo v mediánu 9 týdnů léčbu anti-CD52 protilátkou (21). U 32 pacientů (36 %) bylo dosaženo CR choroby. PR byla zaznamenána u 17 nemocných (19 %). Pomocí průtokové cytometrie autoři zjistili, že u 18 sledovaných (20 %) nebylo možno detekovat nádorový klon v kostní dřeni. Tuto skupinu označili jako MZCH-negativní CR, ostatní pacienti byli zařazeni do společné skupiny MZCH pozitivní CR, PR a stabilní choroby. Pokud srovnali celkové přežití těchto skupin, zjistili, že se významně liší a že 14 z 18 MZCH negativních CR nemocných přežívá bez nutnosti další léčby v mediánu 36 měsíců (interval 3–61 měsíců). Autoři také potvrdili údaje z předchozích studií, že léčba alemtuzumabem u nemocných s uzlinami většími jak 5 cm je neúspěšná. Jen 1 z 11 nemocných s velkými uzlinami dosáhl ve studii částečné léčebné odpovědi (9 %). Křeče a teplota spojené s infuzí protilátky se vyskytly v 76 % případů, těžká neutropenie v 30 %, 43 % pacientů prodělalo jednu nebo více epizod infekce, v 8 % byla zaznamenána reaktivace CMV infekce. U všech nemocných došlo k významnému poklesu Tlymfocytů. Medián doby nejhlubšího poklesu se pohyboval kolem 17. dne od zahájení terapie.
Na tyto práce tematicky navázala i studie italských autorů, ve které Montillo se spolupracovníky sledoval 34 nemocných mladších jak 65 let s dobrou odpovědí po léčbě FLU (10 CR, 25 PR), kterým byl 8 týdnu po skončení léčby FLU podáván podkožně alemtuzumab v dávce 10 mg 3x týdně po dobu 6 týdnů (22). Počet CR se zvýšil z původních 35 % (po léčbě FLU) na 79,4 % po konsolidaci alemtuzumabem a 56 % pacientů dosáhlo negativity MZCH. U 18 nemocných (53 %) byla zjištěna reaktivace CMV, nemocní dostávali pre-emptivně p.o. ganciklovir a u žádného z nich se nerozvinula CMV infekce. U 24 z 26 nemocných byly úspěšně separovány periferní kmenové buňky, 18 z nich bylo úspěšně autologně transplantováno. 17 nemocných žilo v po transplantaci v CR v mediánu sledování 15 měsíců. Z 16 nemocných, kteří nebyli transplantováni 7 progredovalo brzy po skončení léčby (medián 7 měsíců).
Podkožní podání alemtuzumabu, jež bylo použito u nemocných ve výše komentované práci, bylo s úspěchem testováno již dříve. Sám Montillo popsal úspěšnou podkožní aplikaci u 9 nemocných v rámci léčby residuální nemoci po podání FLU (23). 5 z 9 nemocných dosáhlo CR a podkožní podání bylo velmi dobře tolerováno. Pokud přihlédneme k jeho pozdější publikaci (22), lze shrnout, že nežádoucí účinky podkožního podání se objevily jen jako lehká kožní reakce v místě vpichu (76 %), teplota (41 %) a exantém (23 %). Nebyly zaznamenány křeče, třesavky, hypotenze a hyperpyrexie, které velmi často provázejí i.v. podání léku. Podobné zkušenosti byly zveřejněny i britskými autory v malém pilotním sledování (24).
Německá CLL skupina iniciovala CLL2H studii, ve které byl aplikován alemtuzumab podkožně v dávce 3x týdně 30 mg po dobu maximálně 12 týdnů FLU – refrakterním nemocným (25). Schéma protokolu v podstatě kopírovalo podmínky a kritéria studie Keatingovy, jen s oním rozdílem podkožního podání protilátky. Interim analýza prvních 50 nemocných ukázala dosažení 4 % CR a 33 % PR s mediánem do progrese choroby 11 měsíců. Předběžné výsledky byly plně srovnatelné s původní prací podávající alemtuzumab i.v.
Zajímavý cíl si vytkli švédští autoři, když ve svém protokolu fáze II zkoumali bezpečnost a účinnost podkožního podání alemtuzumabu u nepředléčených nemocných se symptomatickou, klinicky aktivní B-CLL (26). 41 nemocných dostávalo protilátku 3x týdně v dávce 30 mg (s úvodní eskalací léku), plánovaná doba podávání byla maximálně 18 týdnů. Celkový počet odpovědí dosáhl 87 %, z toho 19 % CR a 68 % PR. Leukemické buňky vymizely z periferní krve u 95 % pacientů, CR či nodulární PR v kostní dřeni byla popsána u 66 % sledovaných. 87 % odpovědí bylo zaznamenáno při hodnocení ústupu lymfadenomegalie. Zvětšené uzliny kompletně vymizely u 29 % jedinců. Medián do doby selhání odpovědi zatím nebyl dosažen (> 18 měsíců). Nežádoucí účinky podání léku byly velmi zřídkavé, resp. většinou jen stupně I a II dle WHO škály. Hematologická toxicita se vyskytovala zvykle (21 % těžkých granulocytopenií), ale všichni nemocní měli dlouhotrvající těžkou lymfocytopenii. Reaktivace CMV byla popsána u 4 pacientů, u 1 nemocného se rozvinula pneumocystová pneumonie (pro alergii na cotrimoxazol neměl nasazenu profylaxi). Autoři konstatovali vysokou účinnost a bezpečnost léčby alemtuzumabem v první linii, nutnost prodlouženého podávání léku pro dosažení maximální odpovědi a výrazně nižší procento nežádoucích účinků při podkožní aplikaci alemtuzumabu.
Kombinované podávání alemtuzumabu s jinými léky bylo testováno jen v ojedinělých studiích a na malých souborech pacientů. Kennedy s kolegy popsal kombinované podání FLU a anti-CD52 protilátky u 6 nemocných s refrakterní B-CLL, kteří již dříve byli léčeni oběma přípravky (27). 5 ze 6 nemocných dosáhlo odpovědi, 1 z toho CR choroby. Elter a jeho kolegové navrhli kombinované podání alemtuzumabu a FLU u relabovaných pacientů s B-CLL (FLU 30 mg/m2/den i.v. den 1–3 a alemtuzumab 30 mg i.v. den 1–3), opakované každých 28 dní, s plánovaným počtem 6 cyklů (28). Autoři zhodnotili výsledky u 34 pacientů, kdy konstatovali, že 85 % léčených dosáhlo odpovědi, z toho bylo 29 % CR a 56 % PR. 2 nemocní reaktivovali CMV infekci, u 2 byla zjištěna mykotická penumonie. 1 nemocný zemřel na bakteriální sepsi, další závažné komplikace nebyly pozorovány. Tyto slibné výsledky bude nutné prověřit ve fázi III randomizované studie, která teprve zhodnotí přínos alemtuzumabu v kombinaci s FLU u nepředléčených nemocných s B-CLL.
V poslední době vyšly souborné práce, jež shrnují návody k indikaci, sledování, péči a doporučení k profylaxi infektů u nemocných léčených alemtuzumabem (29, 30). Nejčastější doporučení jsou shrnuta v tabulkách 1, 2, 3.
Tab. 1. Indikace k podání alemtuzumabu a trvání jeho léčby u nemocných s chronickou B-lymfocytární leukemií. 
Tab. 2. Dávkovací schéma alemtuzumabu u nemocných chronickou B-lymfocytární leukemií. 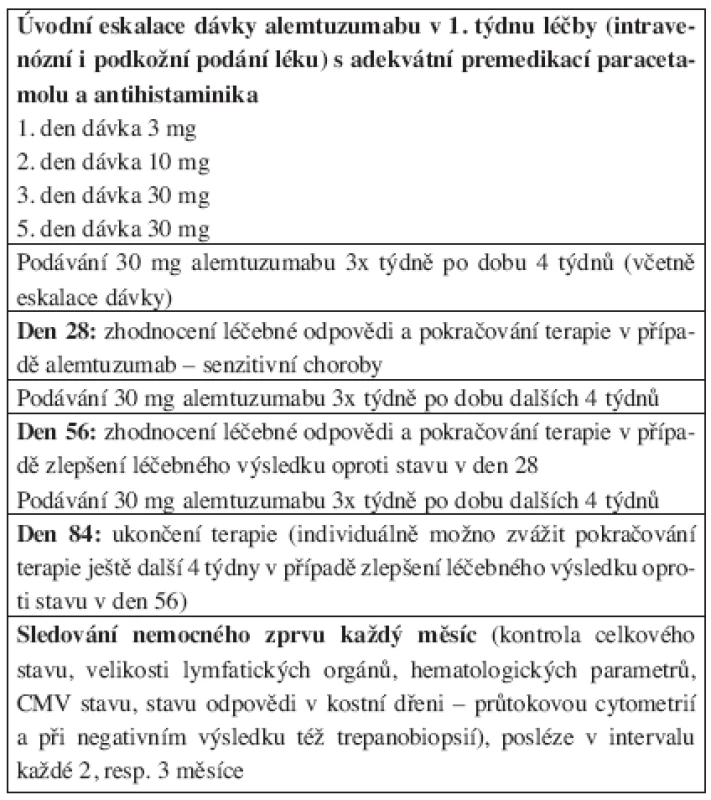
Tab. 3. Doporučení protiinfekční profylaxe u nemocných s chronickou B-lymfocytární leukemií léčených alemtuzumabem. 
Rituximab (chimerická anti-CD20 monoklonální protilátka)
Antigen CD20 je neglykosylovaný fosfoprotein vyskytující se na povrchu B-lymfocytů od pre-B stadia jejich vývoje až po zralé buňky, vyjma plazmocytů, na kterých se vyskytuje jen velmi zřídka. Antigen není přítomen na kmenových buňkách krvetvorby (31). Přesné funkce CD20 molekuly dnes známe jen zčásti. CD20 antigen má úlohu v přenosu signálu, reguluje kalciový kanál a podílí se zřejmě i na regulaci programové smrti buňky (apoptózy) (32). Četnost výskytu na povrchu nádorových B-lymfocytů kolísá nejen mezi různými chorobnými jednotkami, ale také interindividuálně (33). U B-CLL buněk se antigen CD20 oproti jiným B-buněčným lymfoproliferacím nachází v poměrně malém množství, ale jeho exprese může být u jednotlivých nemocných velmi variabilní. Na povrchu některých leukemických buněk se nachází sotva 2000 molekul antigenu, zatímco u jiných klonů to může být až 70 000 vazebných míst (34). První léčebná protilátka namířená proti tomuto antigenu byla myšího původu. Dokázala spolehlivě eliminovat patologické lymfocyty z periferní krve, infiltraci kostní dřeně a lymfatických orgánů redukovala jen velmi slabě díky své špatné penetraci do těchto orgánů, krátkému poločasu a špatné mediátorové funkci myšího konstantního regionu ve vztahu ke komplementu a efektorovým buňkám. Navíc se u řady nemocných vyvinuly protilátky proti cizorodé myší bílkovině (human anti-murine antibody – HAMA) (35). Molekulárně biologickými manipulacemi a genovým inženýrstvím se podařilo vyvinout chimerickou IgGκ anti-CD20 protilátku, jejíž variabilní region pochází z myší protilátky, zatímco zbytek molekuly je lidského původu, včetně Fc fragmentu. Ten efektivně váže C1q složku komplementu, čímž aktivuje komplementem zprostředkovanou lýzu B-buněk, a efektorové buňky imunitního systému (makrofágy a přirozené zabíječe přes jejich Fc receptor), které dále destruují označené cílové buňky (36). Preklinické studie navíc demonstrovaly významné interakce mezi rituximabem a řadou konvenčních cytostatik, které mají za následek deregulaci onkogenu bcl-2 a senzitizaci lymfomových a leukemických buněk k chemoterapiíindukované apoptóze (37, 38).
Pilotní studie McLaughlina prokázala léčebnou odpověď jen u 4 ze 30 (13 %) relabujících a rezistentních nemocných s lymfomem z malých lymfocytů (SLL) (39). Řada menších studií tento poznatek potvrdila i u klasické B-CLL, když na konvenční režim 4 dávek á 375 mg/m2 reagovalo jen velmi malé procento relabovaných jedinců (40). Na druhé straně u nepředléčených nemocných dosahovalo množství léčebných odpovědí 51 % (CR 4 %) a po udržovací léčbě 58 % (CR 9 %), i když medián do progrese choroby byl 19 měsíců, což odpovídá zhruba polovině mediánu sledovatelného u nemocných s folikulárním lymfomem (41). Autoři řady prací hypoteticky odvozovali horší odpověď u B-CLL řídkým výskytem CD20 antigenu na povrchu leukemických buněk či velkým množstvím těchto buněk v obvodové krvi nemocných s následkem zrychlení odbouráním protilátky z oběhu. O’Brienová s kolegy proto zkonstruovali léčebný protokol s eskalací dávek rituximabu (až 2250 mg/m2/týden), jimž léčili 60 nemocných s relabovanou B-CLL a ostatními lymfatickými leukemiemi (42). Počet léčebných odpovědí činil 40 % (žádný léčený nedosáhl CR) a autoři nalezli pozitivní korelaci mezi eskalací dávky a zlepšením léčebné odpovědi. Byrd s kolektivem vyzkoušeli alternativní postup, když aplikovali rituximab 33 nemocným s relabovanou B-CLL a SLL 3x týdně v dávce 250 nebo 375 mg/m2 po dobu 4 týdnů. Studie nalezla 45 % odpovědí na léčbu (3 % CR) s mediánem trvání terapeutické reakce 10 měsíců.
Řada fází II studií posléze testovala rituximab v kombinaci s chemoterapií založenou na FLU, a to zprvu jak u relabovaných, tak později i u dosud neléčených nemocných s B-CLL. Schulz ve svém protokolu kombinoval podání rituximabu a FLU (celkem 4 cykly FLU a 4 podání protilátky) u předléčených i dosud neléčených nemocných (44). Počet odpovědí byl statisticky shodný u obou skupin pacientů (90 % u neléčených vs. 85 % u relabovaných), počet kompletních remisí byl vyšší ve stadiu B než ve stadiu C (43 % vs. 11 % CR). Podobných výsledků dosáhl Savage s kolegy, když FLU a rituximab podával do plánovaného počtu 8 cyklů a u relabovaných nemocných dosáhl 69 % odpovědí (z toho 25 % CR) (45). Wierda a kolegové z M.D. Anderson Cancer Center léčili 177 relabovaných nemocných s B-CLL režimem kombinujícím FLU, cyklofosfamid (CFA) a rituximab (režim FCR) (46). Terapií dosáhli 73 % léčebných odpovědí, u 25 % nemocných byl stav po léčbě hodnocen jako CR choroby. Nemocní, kteří byli při předchozí terapii hodnoceni jako FLU-rezistentní, dosáhli uvedenou kombinací 58 % odpovědí, i když počet CR byl u nich jen 6 %. V multivariantní analýze koreloval s léčebnou odpovědí počet trombocytů před zahájením terapie, hladina β2-mikroglobulinu a počet předchozích prodělaných chemoterapií. Léčebné selhání bylo asociováno s předchozí dokumentovanou refrakterností na FLU. Medián sledování nemocných dosáhl 28 měsíců, medián doby do relapsu či progrese choroby byl 39 měsíců pro pacienty v CR, 33 měsíců pro pacienty v nodulární CR a 15 měsíců pro pacienty v PR. Pravděpodobnost celkového přežití byla vypočítána na 42 měsíců, nedostatečná odpověď na terapii, vysoká hladina β2-mikroglobulinu a nepříznivé cytogenetické změny byly v příčinné souvislosti s jeho zkrácením.
Byrd a kolektiv iniciovali fázi II studie, ve které podávali dříve neléčeným nemocným souběžně nebo následně po FLU rituximab. Nemocní se souběžným podáním léků dosáhli 90 % léčebných odpovědí (47 % CR, 43 % PR), u následného podání to bylo 77 % odpovědí (28 % CR, 49 % PR), i když počet podání rituximabu byl v rameni se souběžným podáním léku více než dvojnásobný (47). V další práci porovnali autoři tuto skupinu pacientů se souborem nemocných léčených v předchozí studii samotným FLU. V multivariantní analýze dokázali, že přidání rituximabu k FLU prodlužuje dobu do progrese onemocnění a celkové přežití nemocných a přitom nedochází ke zvýšení toxicity léčby ani frekvence závažných infektů (48). Titíž autoři dále zkoumali, jestli existuje skupina nemocných s rizikovými faktory, u nichž ani léčba imunochemoterapií není dostatečně či dlouhodobě účinná (49). Podrobnou multivariantní analýzou bylo zjištěno, že nemocní s nemutovaný stavem IgVH řetězců, delecí 17p nebo mutací p53 nebo delecí 11q dosahují při imunochemoterapii stejného počtu léčebných odpovědí i CR, ale doba do opětovné progrese jejich choroby je kratší než u pacientů bez těchto rizikových faktorů (32 vs 45 měsíců, p = 0,004). K podobnému zjištění dospěl i DelPrincipe se spoluautory, když prokázal, že nemocní s nadměrnou expresí ZAP-70 proteinu mají po sekvenční léčbě FLU+rituximab výrazně kratší dobu do progrese onemocnění (38 % vs. 100 % ve 3 letech, p = 0,003) (50).
Když byly poznán příznivý terapeutický efekt FLU a rituximabu rozhodl se Keating s kolektivem provést studii fáze II hodnotící podávání již dříve osvědčené kombinace FLU + CFAnově spolu s rituximabem u nemocných s neléčenou B-CLL (51). Celkem bylo hodnoceno 224 nemocných (33 % pacientů ve stadiu III a IV dle Raie). Počet léčebných odpovědí dosáhl 95 % (70 % CR!) a 2/3 nemocných měli v kostní dřeni méně než 1 % CD5+/CD19+ buněk detekovaných pomocí průtokové cytometrie. Neutropenie stupně 3 a 4 se vyskytla u 52 % podaných cyklů, závažné infekce byly zaznamenány u méně než 3 % cyklů. Analýza doby do progrese onemocnění ukázala, že 69 % pacientů žije bez selhání léčby více jak 4 roky od zahájení terapie.
Více méně obdobné výsledky dosáhli na menším souboru 18 nemocných Casula a spol., kteří podávali FLU i CFA v orální tabletové formě spolu s infuzí rituximabu (52). Počet léčebných odpovědí byl 100 %, 62 % nemocných dosáhlo molekulární CR choroby, medián sledování 6 měsíců zatím neumožňuje činit závěry ohledně pravděpodobnosti relapsu/progrese onemocnění.
Výsledky největších studií použití kombinace chemoterapie a rituximabu a srovnání s výsledky léčby samotnou chemoterapií shrnují přehledně tabulky 4, 5.
Tab. 4. Srovnání výsledků léčby chronické B-lymfocytární leukemie založené na fludarabinu s/bez rituximabu u relabovaných nemocných. 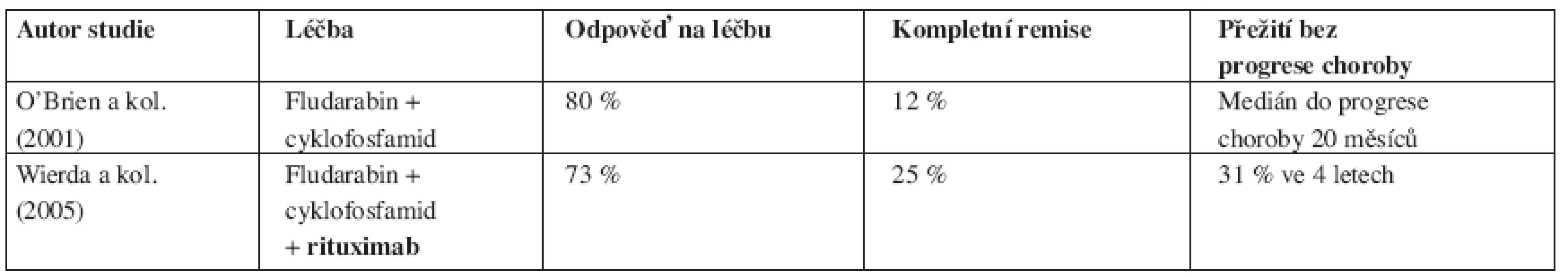
Tab. 5. Srovnání výsledků léčby chronické B-lymfocytární leukemie založené na fludarabinu s/bez rituximabu v 1. linii. 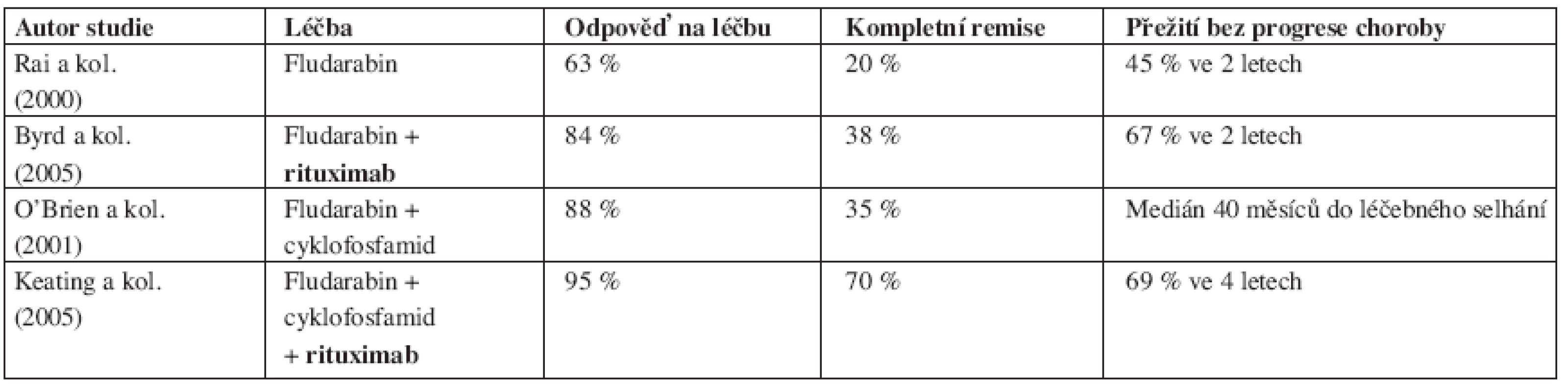
Ve všech uvedených studiích autoři konstatují velmi příznivý profil toxicity chemoterapie kombinované s podáním rituximabu. Závažná systémová toxicita je vázaná z naprosté většiny na působení chemoterapie a přidání rituximabu k ní toxický profil nezvyšuje. Výjimku mohou tvořit reakce vázané většinou na první podání protilátky. U nemocných s vysokým počtem cirkulujících leukemických buněk byl popsán po podání anti-CD20 protilátky syndrom z uvolnění cytokinů (53). Ten se vyskytl především u nemocných s počtem lymfocytů v periferní krvi vyšším jak 50x109/l a byl spojen s nárůstem hladin interleukinu-6 (IL-6) a faktoru nekrotizujícího nádory alfa (TNF-α). U takových nemocných je popisována i možnost syndromu lýzy nádoru a dalších infuzních reakcí, které zasluhují pozornost ošetřujícího lékaře (54). Proto bývá doporučované podávat první dávku rituximabu u nemocných s B-CLL až při nižších hodnotách patologických lymfocytů v obvodové krvi (např. až při druhém cyklu při chemoterapii FCR) nebo jej podat při prvním cyklu léčby s řádnou premedikací (paracetamol, antihistaminikum a ev. kortikosteroid) rozděleně ve dvou po sobě následujících dnech (1. den 100 mg/m2, 2. den 275 mg/m2).
V literatuře najdeme také řadu zpráv o úspěšném podání rituximabu u autoimunitně podmíněných cytopenií, které se u nemocných s B-CLL poměrně často vyskytují. U kortikosteroid-rezistentní formy autoimunitní hemolytické anémie spojené s B-CLL byla úspěšnost rituximabu referována jak u forem s tepelnými, tak i u variant s chladovými protilátkami (55). Obdobné malé soubory nemocných nebo kazuistická sdělení máme k dispozici pro dokumentaci úspěšné léčby rituximabem u jedinců s B-CLL a autoimunitní trombocytopenií nebo čistou aplázií červené krevní řady (56, 57).
Zajímavá může být myšlenka kombinovat monoklonální protilátky v léčbě B-CLL navzájem. V M. D. Anderson Cancer Center se pokusili o léčbu relabujících a refrakterních nemocných rituximabem (dávka 375 mg/m2 opakovaná po 1 týdnu, celkem 4 dávky), po které v týdenním odstupu následovalo 4týdenní podání alemtuzumabu (3x týdně 30 mg včetně úvodní eskalace dávky) (58). Podle reakce choroby a stavu nemocného byl zvážen další 4týdenní cyklus anti-CD52 protilátky. Celkový počet odpovědí dosáhl 52 % (8 % CR), medián do progrese onemocnění dosáhl u reagujících jedinců však jen 6 měsíců.
Závěr
Použití monoklonálních protilátek, kombinace rituximabu s chemoterapií, minimalizace zbytkové choroby alemtuzumabem, další metody konsolidační či udržovací imunoterapie a testování nových účinných molekul jsou příslibem, který by mohl vést k dalšímu zlepšení prognózy nemocných s B-CLL.
Podpořeno VZ MŠM 619 895 9205. MUDr. Tomáš Papajík, CSc.
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: tomas.papajik@fnol.cz
Došlo do redakce: 28. 11. 2006
Přijato: 17. 4. 2007
Zdroje
1. Leporrier M, Chevret S, Cazin B, et al. Randomized comparison of fludarabine, CAP, and ChOP in 938 previously untreated
stage B and C chronic lymphocytic leukemia patients. French Cooperative Group on Chronic Lymphocytic Leukemia. Blood
2001; 98 : 2319–2325.
2. Robak T. Therapy of chronic lymphocytic leukemia with purine nucleoside analogues. Drugs Aging 2005; 22 : 983–1012.
3. Keating MJ, O’Brien S, Lerner S, et al. Long-term follow-up of patients with chronic lymphocytic leukemia (CLL) receiving fludarabine
regimens as initial therapy. Blood 1998; 92 : 1165–1171.
4. Flinn IW, Jemiai Y, Bennett JM, et al. Fludarabine and cyclophosphamide achieves high complete response rate in patients with
previously untreated chronic lymphocytic leukemia. Blood 2001; 98 : 633a.
5. Eichhorst B, Busch R, Hopfinger G, et al. Fludarabine plus cyclophosphamide versus fludarabine alone in first-line therapy of
younger patients with chronic lymphocytic leukemia. Blood 2006; 107 : 885–891.
6. Gilleece MH, Dexter TM. Effect of campath – 1H antibody on human hematopoietic progenitors in vitro. Blood 1993; 82 : 807–812.
7. Hale G. CD52 (Campath1). J Biol Regul Homeost Agents 2001; 15 : 386 – 391.
8. Dyer MJS, Hale G, Marcus RE, Waldmann H. Effects of Campath - 1 antibodies in vivo in patients with lymphoid malignancies:
influence of antibody isotype. Blood 1989; 73 : 1431–1439.
9. Riechmann L, Clark M, Waldmann H, Winter G. Reshaping human antibodies for therapy. Nature 1988; 332 : 323–327.
10. Hale G, Dyer MJS, Clark MR, et al. Remission induction in non-Hodgkin’s lymphoma with reshaped human monoclonal antibody
Campath-1H. Lancet 1988; 2 : 1394–1399.
11. Flynn JM, Byrd JC. Campath-1H monoclonal antibody therapy. Curr Opin Oncol 2000; 12 : 574–581.
12. Rowan W, Tite J, Topley P, Brett SJ. Cross-linking of the Campath - 1 antigen (CD52) mediates growth inhibition in human Band
T-lymphoma cell lines, and subsequently emergence of CD52 – deficient cells. Immunology 1998; 95 : 427–436.
13. Ginaldi L, De Martinis M, Matutes E, et al. Levels of expression of CD52 in normal and leukemic B and T cells: correlation with
in vivo therapeutic responses to Campath-1H. Leuk Res 1998; 22 : 185–191.
14. Österborg A, Dyer MJ, Bunjes D, et al. Phase II multicenter study of human CD52 antibody in previously treated chronic lymphocytic leukemia. European Study Group of Campath-1H treatment in chronic lymphocytic leukemia. J Clin Oncol 1997; 15 : 1567–1574.
15. Rai KR, Freter CE, Mercier RJ, et al. Alemtuzumab in previously treated chronic lymphocytic leukemia patients who also had received fludarabine. J Clin Oncol 2002; 20 : 3891–3897.
16. Keating MJ, Flinn I, Jain V, et al. Therapeutic role of alemtuzumab (Campath-1H) in patients who have failed fludarabine: results of a large international study. Blood 2002; 99 : 3554–3561.
17. Stilgenbauer S, Döhner H. Campath-1H induced complete remission of chronic lymphocytic leukemia despite p53 gene mutation and resistance to chemotherapy. N Engl J Med 2002; 347 : 452–453.
18. Lozanski G, Nyla A, Flin IW, et al. Alemtuzumab is an effective therapy for chronic lymphocytic leukemia with p 53 mutations and deletions. Blood 2004; 103 : 3278–3281.
19. Dyer MJS, Kelsey SM, Mackay HJ, et al. In vivo purging of residual disease in CLL with Campath-1H. Br J Haematol 1997; 97 : 669–672.
20. Rai KR, Byrd JC, Peterson BL, Larson LA. A phase II trial of fludarabine followed by alemtuzumab (Campath-1H) in previously untreated chronic lymphocytic leukemia (CLL) patients with active disease: Cancer and Leukemia Group B (CALGB) study 19901. Blood 2002; 100 : 205a.
21. Moreton P, Kennedy B, Lucas M, et al. Eradication of minimal residual disease in B-cell chronic lymphocytic leukemia after alemtuzumab therapy is associated with prolonged survival. J Clin Oncol 2005; 23 : 2971–2979.
22. Montillo M, Tedeschi A, Miqueleiz S, et al. Alemtuzumab as consolidation after a response to fludarabine is effective in purging residual disease in patients with chronic lymphocytic leukemia. J Clin Oncol 2006; 24 : 2337–2342.
23. Montillo M, Cafro AM, Tedeschi A, et al. Safety and efficacy of subcutaneous Campath-1H for untreating residual disease in patients with chronic lymphocytic leukemia responding to fludarabine. Haematologica 2002; 87 : 695–700.
24. Bowen AL, Zomas A, Emmett E, et al. Subcutaneous Campath - 1H in fludarabine-resistant/relapsed chronic lymphocytic and Bprolymphocytic leukaemia. Br J Haematol 1997; 96 : 617–619.
25. Stilgenbauer S, Winkler D, Krober A, et al. Subcutaneous Campath - 1H (alemtuzumab) in fludarabine-refractory CLL; interim analysis of the CLL2H study of the German CLL Study Group (GCLLSG). Blood 2004; 104 : 478a.
26. Lundin J, Kimby E, Björkholm M, et al. Phase II trial of subcutaneous anti-CD52 monoclonal antibody alemtuzumab (Campath - 1H) as first-line treatment for patients with B-cell chronic lymphocytic leukemia (B-CLL). Blood 2002; 100 : 768–773.
27. Kennedy B, Rawstron A, Carter C, et al. Campath-1H and fludarabine in combination are highly active in refractory chronic lymphocytic leukemia. Blood 2002; 99 : 2245–2247.
28. Elter T, Bochmann P, Schulz H, et al. FluCam – a new, 4-weekly combination of fludarabine and alemtuzumab for patients with relapsed chronic lymphocytic leukemia. Blood 2004; 104 : 2517a.
29. Thursky KA, Worth LJ, Seymour JF, et al. Spectrum of infection, risk and recommendations for prophylaxis and screening among patients with lymphoproliferative disorders treated with alemtuzumab. Br J Haematol 2005; 132 : 3–12.
30. Keating M, Coutré S, Rai K, et al. Management guidelines for use of alemtuzumab in B-cell chronic lymphocytic leukemia. Clin Lymphoma 2004; 4 : 220–227.
31. Stashenko P, Nadler LM, Hardy R, et al. Characterization of a human B lymphocyte-specific antigen. J Immunol 1980; 125 : 1678–1685.
32. Deans JP, Li H, Polyak MJ. CD20-mediated apoptosis: signaling through lipid rafts. Immunology 2002; 107 : 176–182.
33. Anderson KC, Bates MP, Slaughenhoupt BL, et al. Expression of human B cell-associated antigens on leukemias and ymphomas: a model of human B cell differentiation. Blood 1984; 63:
1424–1433.
34. Golay J, Lazzari M, Facchinetti V, et al. CD20 levels determine the in vitro susceptibility to rituximab and complement of B-cell chronic lymphocytic leukemia: further regulation by CD55 and CD59. Blood 2001; 98 : 3383–3389.
35. Press OW, Appelbaum F, Ledbetter JA, et al. Monoclonal antibody 1F5 (anti-CD20) serotherapy of human B cell lymphomas. Blood 1987; 69 : 584–591.
36. Grillo – López AJ, White CA, Varns C, et al. Overview of the clinical development of rituximab: first monoclonal antibody approved for the treatment of lymphoma. Semin. Oncol. 1999; 5 (Suppl. 14): 66–73.
37. Alas S, Emmanouilides S, Bonavida B, et al. Inhibition of interleukin - 10 by rituximab results in down – regulation of bcl-2 and senzitization of B-cell non-Hodgkin’s lymphoma to apoptosis. Clin. Cancer Res. 2001; 7 : 709–723.
38. Di Gaetano N, Xiao Y, Erba E, et al. Synergism between fludarabine and rituximab revealed in a follicular lymphoma cell line resistant to the cytotoxic activity of either drug alone. Br J Haematol 2001; 114 : 800–809.
39. McLaughlin P, Grillo-Lopez AJ, Link BK, et al. Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four-dose treatment program. J Clin Oncol 1998; 16 : 2825–2833.
40. Lin TS, Byrd JC. Monoclonal antibody therapy in lymphoid leukemias. Adv Pharmacol 2004; 51 : 127–167.
41. Hainsworth JD, Litchy S, Barton JH, et al. Single-agent rituximab as first-line and maintenance treatment for patients with chronic lymphocytic leukemia or small lymphocytic lymphoma: a phase II trial of the Minnie Pearl Cancer Research Network. J Clin Oncol 2003; 21 : 1746–1751.
42. O’Brien SM, Kantarjian H, Thomas DA, et al. Rituximab doseescalation trial in chronic lymphocytic leukemia. J Clin Oncol 2001; 19 : 2165–2170.
43. Byrd JC, Murphy T, Howard RS, et al. Rituximab using a thrice weekly dosing schedule in B-cell chronic lymphocytic leukemia and small lymphocytic lymphoma demonstrates clinical activity and acceptable toxicity. J Clin Oncol 2001; 19 : 2153–2164.
44. Schultz H, Klein SK, Rehwald U, et al. Phase 2 study of a combined immunochemotherapy using rituximab and fludarabine in patients with chronic lymphocytic leukemia. Blood 2002; 100 : 3115–3120.
45. Savage DG, Cohen NS, Hesdorffer CS, et al. Combined fludarabine and rituximab for low grade lymphoma and chronic lymphocytic leukemia. Leuk Lymphoma 2003; 44 : 477–481.
46. Wierda W, O’Brien S, Wen S, et al. Chemoimmunotherapy with fludarabine, cyclophosphamide, and rituximab for relapsed and refractory chronic lymphocytic leukemia. J Clin Oncol 2005; 23 : 4070–4078
47. Byrd JC, Peterson BL, Morrison VA, et al. Randomized phase 2 study of fludarabine with concurrent versus sequential treatment with rituximab in symptomatic, untreated patients with B-cell chronic lymphocytic leukemia: results from Cancer and Leukemia Group B 9712 (CALGB 9712). Blood 2003; 101 : 6 – 14.
48. Byrd JC, Rai K, Peterson BL, et al. Addition of rituximab to fludarabine may prolong progression-free survival and overall survival in patients with previously untreated chronic lymphocytic leukemia: an updated retrospective comparative analysis of CALGB 9712 and CALGB 9011. Blood 2005; 105 : 49–53.
49. Byrd JC, Gribben JG, Peterson BL, et al. Select high risk genetic features predict earlier progression following chemoimmunotherapy with fludarabine and rituximab in chronic lymphocytic leukemia (CLL): Preliminary justification for risk-adapted therapy. Blood 2004; 104 : 476a.
50. Del Principe MI, Del Poeta G, Maurillo L, et al. Addition of rituximab to fludarabine improves progression free survival in untreated ZAP-70 negative chronic lymphocytic leukemia. Blood 2004; 104 : 477a.
51. Keating MJ, O’Brien S, Albitar M, et al. Early results of a chemoimmunotherapy regimen of fludarabine, cyclophosphamide, and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol; 2005 : 4079–4088.
52. Casula P, Sorano G, Pulixi D, et al. Oral fludarabine and cyclophosphamide plus rituximab in the treatment of the chronic lymphocytic leukemia. Blood 2005; 106 : 5039a.
53. Winkler U, Jensen M, Manzke O, et al. Cytokine-release syndrome in patients with B-cell chronic lymhocytic leukemia and high lymphocyte counts after treatment with anti-CD20 monoclonal antibody (rituximab, IDEC-C2B8). Blood 1999; 94 : 2217–2224.
54. Byrd JC, Waselenko JK, Maneatis TJ, et al. Rituximab therapy in hematologic malignancy patients with circulating blood tumor cells: association with increased infusion-related side effects and rapid blood tumor clearance. J Clin Oncol 1999; 17 : 791–795.
55. Gupta N, Kavuru S, Patel D, et al. Rituximab-based chemotherapy for steroid-refractory autoimmune hemolytic anemia of chronic lymphocytic leukemia. Leukemia 2002; 16 : 2092–2095.
56. Zaja F, Vianelli N, Sperotto A, et al. Anti-CD20 therapy for chronic lymphocytic leukemia - associated autoimmune diseases. Leuk Lymphoma 2003; 44 : 1951–1955.
57. Ghazal H. Succesful treatment of pure red cell aplasia with rituximab in patients with chronic lymphocytic leukemia. Blood 2002; 99 : 1092–1094.
58. Faderl S, Thomas AD, O’Brien SM, et al. Experience with alemtuzumab plus rituximab in patients with relapsed and refractory lymphoid malignancies. Blood 2003; 101 : 3413–3415.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2007 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Chronická B-lymfocytární leukemie Část IV: Možnosti léčby s použitím monoklonálních protilátek alemtuzumabu a rituximabu
- Zprávy o knihách
- Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
- Zprávy o knihách
- Léčba recidivující multifokální histiocytózy z Langerhansových buněk 2-chlordeoxyadenosinem u osob dospělého věku. Zkušenosti jednoho pracoviště
- Alogenní transplantace krvetvorných buněk po přípravném režimu redukované intenzity v léčbě lymfoproliferací (výsledky ÚHKT 1999–2005)
- Zprávy o knihách
- Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
- Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
- První nález fenotypu Gy(a-) v České republice od jeho objevu v r. 1967. Možné příbuzenství s původními nositeli tohoto fenotypu v USA v letech 1967–1968
- LYFE Meeting, Mnichov 29.–30. 3. 2006
- Prof. MUDr. Pavel Klener, DrSc. se v dubnu 2007 dožil 70 let
- GRATULUJEME
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
- Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
- Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
- Léčba recidivující multifokální histiocytózy z Langerhansových buněk 2-chlordeoxyadenosinem u osob dospělého věku. Zkušenosti jednoho pracoviště
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



