-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zhoubné nádory mimojaterních žlučových cest
Extrahepatic bile duct malignancies
Introduction: Biliary tract malignancies belong to very aggressive malignancies of the gastrointestinal tract. The only radical treatment is surgical resection which is possible only in a limited number of cases due to late diagnosis. The aim of this report was to present the experience of our own department with the diagnosis and treatment of these tumours.
Methods: In the years 2005–2021 radical (R0) resection was performed in 27 (28.4%) patients, the same number were managed only symptomatically and in 41 (43.2%) patients we used biliary stenting and external-internal drainage as the definitive procedure. Adjuvant oncological treatment was indicated in 16 (59.3%) of the radically operated and 49 (72.1%) of the non-operated patients.
Results: Median overall survival and median progression-free survival in the operated patients were 19.9 months and 15.7 months, respectively. Overall survival in the operated patients was significantly better (p<0.0001) than in patients managed palliatively. Median overall survival for drainage and palliative treatment was 5.8 and 3.6 months, respectively. Overall survival did not differ between symptomatic and drainage treatment (p<0.3383).
Conclusion: In addition to their histopathological aggressiveness, late diagnosis is the main cause of poor treatment outcomes in extrahepatic biliary tract malignancies. Treatment should be guided by a multidisciplinary team. Currently, there is a great development of endoscopic methods, which, together with further development of personalized oncological treatment, may bring improved results in the future. Surgical, radical treatment remains the method of choice with the best long-term results.
Keywords:
diagnosis – treatment – outcomes – extrahepatic bile duct malignancies
Autoři: V. Třeška 1; J. Fichtl 1; J. Ferda 2
; J. Fínek 3; T. Skalický 1; V. Liška 1; P. Hošek 4
Působiště autorů: Chirurgická klinika, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Plzni 1; Klinika zobrazovacích metod, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Plzni 2; Onkologická a radioterapeutická klinika, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Plzni 3; Biomedicínské centrum Lékařské fakulty Univerzity Karlovy v Plzni 4
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 9, s. 428-435.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2022.101.9.428–435Souhrn
Úvod: Zhoubné nádory žlučových cest patří k velmi agresivním malignitám gastrointestinálního traktu. Jedinou radikální léčbou je chirurgická resekce, která je však možná jen u omezeného počtu případů vzhledem k pozdní diagnostice. Cílem sdělení bylo podat zkušenosti vlastního pracoviště s diagnostikou a léčbou těchto nádorů.
Metody: V letech 2005–2021 autoři řešili celkem 95 nemocných s diagnózou zhoubného nádoru mimojaterních žlučových cest. Radikální (R0) resekcí bylo operováno 27 (28,4 %) nemocných, stejný počet byl řešen jen symptomaticky a u 41 (43,2 %) nemocných byl použit jako definitivní výkon stent žlučových cest, nebo zevně – vnitřní drenáž. Adjuvantní onkologická léčba byla indikována u 16 (59,3 %) radikálně operovaných a 49 (72,1 %) neoperovaných nemocných.
Výsledky: Medián celkového přežití a přežití do progrese u operovaných nemocných byl 19,9 měsíce, resp. 15,7 měsíce. Celkové přežití u operovaných nemocných bylo významně lepší (p<0,0001) než u nemocných řešených paliativně. Medián celkového přežití u drenážní, resp. paliativní léčby byl 5,8, resp. 3,6 měsíce. V celkovém přežití nebyl rozdíl mezi symptomatickou a drenážní léčbou (p<0,3383).
Závěr: Příčinou špatných výsledků léčby zhoubných nádorů mimojaterních žlučových cest je vedle jejich histopatologické agresivity především pozdní diagnostika. Léčba má být vedena multidisciplinárním týmem. V současnosti dochází k velkému rozvoji endoskopických metod, které společně s dalším rozvojem personalizované onkologické léčby může v budoucnu přinést zlepšení výsledků. Chirurgická, radikální léčba zůstává metodou volby s nejlepšími dlouhodobými výsledky.
ÚVOD
Zhoubné nádory žlučových cest – tzv. cholangiokarcinomy – dělíme na intrahepatální a extrahepatální, jejichž nejčastější variantou je Klatskinův nádor, což je perihilární nádor zaujímající bifurkaci společného žlučovodu a šířící se na oba žlučovody. Tzv. distální typ cholangiokarcinomu zaujímá ductus cysticus a ductus choledochus, Vaterskou papilu a pankreatickou část žlučového stromu. Do distálního typu je řadou autorů řazen i karcinom žlučníku, nicméně ten má na rozdíl od nádorů žlučových cest specifický etiopatogenetický, histopatologický a klinický obraz, a proto se přikláníme spíše k jeho samostatné klasifikaci. I když všechny cholangiokarcinomy vznikají z epitelu žlučových cest, pak prognóza intra - a extrahepatálních nádorů se liší v závislosti na anatomické lokalizaci. Výskyt cholangiokarcinomu závisí na geografické lokalizaci a v současnosti má severovýchodní Thajsko v celosvětovém měřítku nejvyšší výskyt. Současné údaje z USA hovoří o roční incidenci 0,72–1,62/100 000 obyvatel, zatímco země jihovýchodní Asie uvádějí až 80 případů/100 000 obyvatel. Závažným faktem je, že celosvětově výskyt cholangiokarcinomu významně narůstá. USA uvádějí 7000 a Čína dokonce 65 000 nových případů ročně. Bohužel ve více než 60 % případů jsou tyto nádory neresekabilní v době diagnózy. Cílem našeho sdělení je podat vlastní a literární zkušenosti se současnými postupy v diagnostice a léčbě tohoto závažného onemocnění.
METODA
V letech 2005–2021 jsme hospitalizovali na Chirurgické klinice FN v Plzni celkem 95 nemocných s diagnózou zhoubného nádoru mimojaterních žlučových cest typu cholangiokarcinomu. Mužů bylo 53 (55,8 %), žen 42 (44,2 %). Průměrný věk nemocných byl 64,9±9,7 roku (rozmezí 35,7–80,9 roku, medián 64,7 roku). Dle Bismuth-Corlette klasifikace se jednalo o 35 (36,8 %) nádorů typu I, 17 (17,9 %) typu II, 20 (21,1 %) typu III a 18 (18,9 %) typu IV (Tab. 1, Obr. 1–4). Z celkového počtu 95 nemocných jsme radikálně (R0) operovali 27 (28,4 %) nemocných. 68 (71,6 %) nemocných nebylo možné z hlediska pokročilosti procesu radikálně operovat. 27 nemocných jsme řešili jen symptomaticky, u ostatních jsme provedli drenážní výkon (14× zevně-vnitřní drenáž, 14× plastikové stenty, 13× metalický stent). Indikací k radikální operaci byl lokalizovaný nález na žlučových cestách bez vzdálených metastáz, celkově příznivý stav nemocného a souhlas nemocného s operačním výkonem. Radikální resekci s Rouxovou rekonstrukcí jsme provedli u 20 (74,1 %), s resekcí jater u 3 nemocných, duodenopankreatektomii u 7 (25,9 %) nemocných. Indikací k drenážnímu výkonu byl dobrý celkový stav s předpokládanou životní expektací delší 6 měsíců při lokálně radikálně neřešitelném nálezu. Neoadjuvantní onkologická léčba nebyla indikována před R0 resekcí. Adjuvantní onkologickou léčbu jsme primárně indikovali u 16 (59,3 %) radikálně operovaných nemocných na základě celkového stavu a histopatologického vyšetření. Onkologická léčba byla také indikována u nemocných s recidivou po radikální léčbě. Z 68 neoperovaných nemocných bylo onkologicky řešeno 49 (72,1 %) nemocných. Symptomatickou léčbu jsme indikovali u pokročilých případů s životní expektací kratší 6 měsíců. U každého nemocného jsme postupovali individuálně a léčba byla indikována multidisciplinárním týmem. Charakteristika souboru byla shrnuta prostřednictvím standardních popisných statistik a četností. Statistická významnost rozdílů průměrného věku mezi skupinami byla testována Studentovým t-testem, asociace pohlaví a skupiny byla testována Fisherovým přesným testem. Pro potřeby analýzy přežití bylo celkové přežití (overall survival, OS) definováno jako interval od výkonu do exitu pacienta; přežití bez progrese (progression-free survival, PFS) pak jako interval od výkonu do progrese onemocnění, případně do smrti pacienta, nebyla-li zaznamenána předchozí progrese. Pacienti, u nichž nedošlo k výše popsaným koncovým událostem, byli cenzorováni k datu poslední kontroly. PFS a OS byly analyzovány pomocí Kaplan-Meier metody s Gehanovým-Wilcoxonovým dvouvýběrovým testem. Všechny uvedené p hodnoty jsou oboustranné a hladina statistické významnosti byla stanovena na α=0,05.
Tab. 1. Typy Klatskinova tumoru dle Bismuth-Corlette klasifikace
Tab. 1: Types of Klatskin tumour according to Bismuth-Corlette classification
Obr. 1. Krátká cirkulární stenóza oblasti junkce pravého a levého dc. hepaticus typu Bismuth II, výpočetní tomografie rekonstrukce v rovině porta hepatis, vlevo arteriální fáze, vpravo portální fáze
Fig. 1: Short circular stenosis of right and left dc. hepaticus junction area type Bismuth II, computed tomography reconstruction in the plane of porta hepatis, left: arterial phase, right: portal phase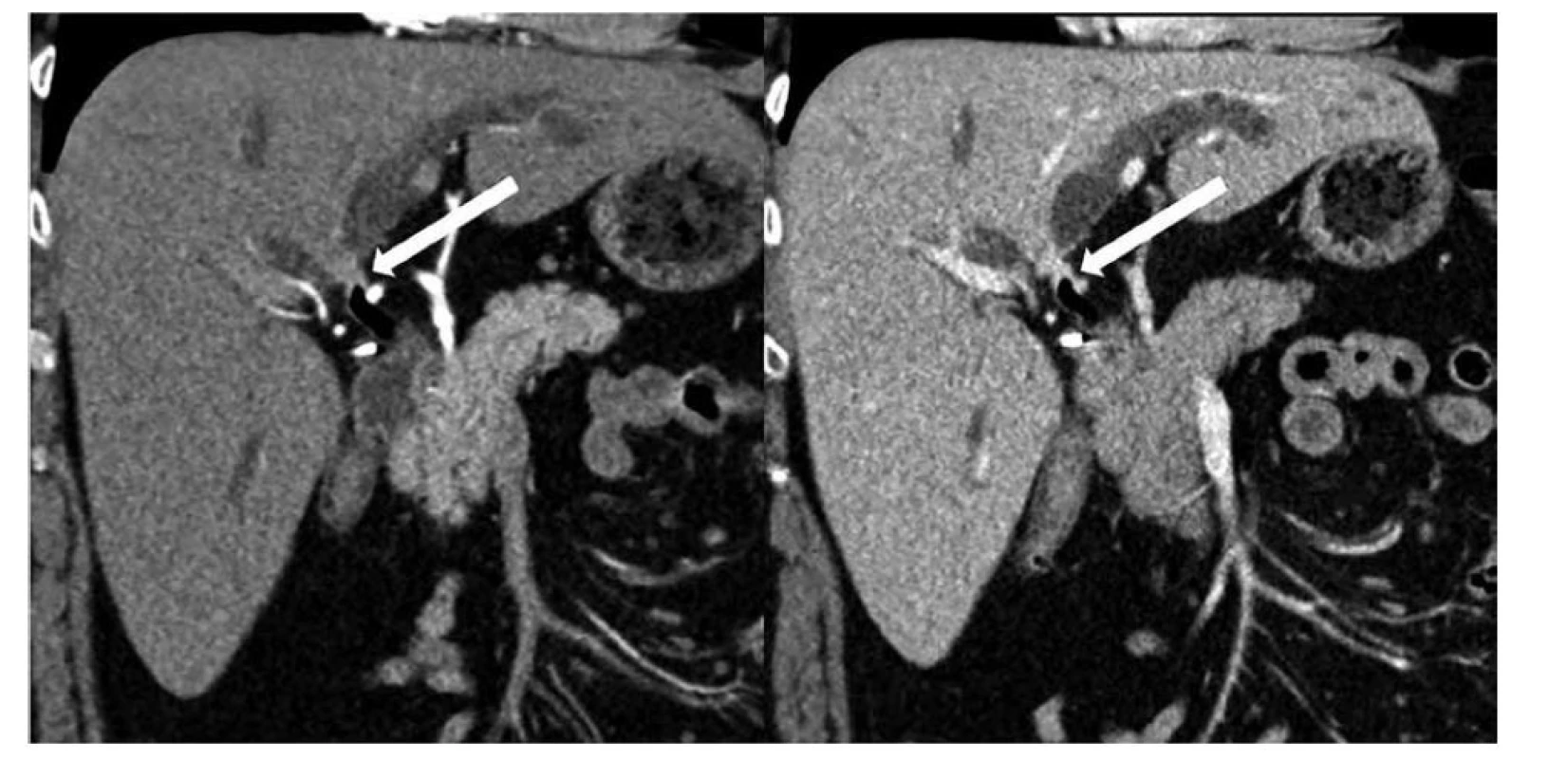
Obr. 2. Stenóza junkce hepatiků s přechodem na distální konce pravého a levého dc. hepaticus typu Bismuth IV, MRCP − vlevo koronární T2 vážený obraz HASTE, vpravo rekonstrukce MRCP typu maximum intensity projection (MIP)
Fig. 2: Hepatic stenosis with transition to the distal end of the right and left: dc. hepaticus Bismuth IV type, MRCP − left coronary T2 weighted HASTE image, right maximum intensity projection (MIP) MRCP reconstruction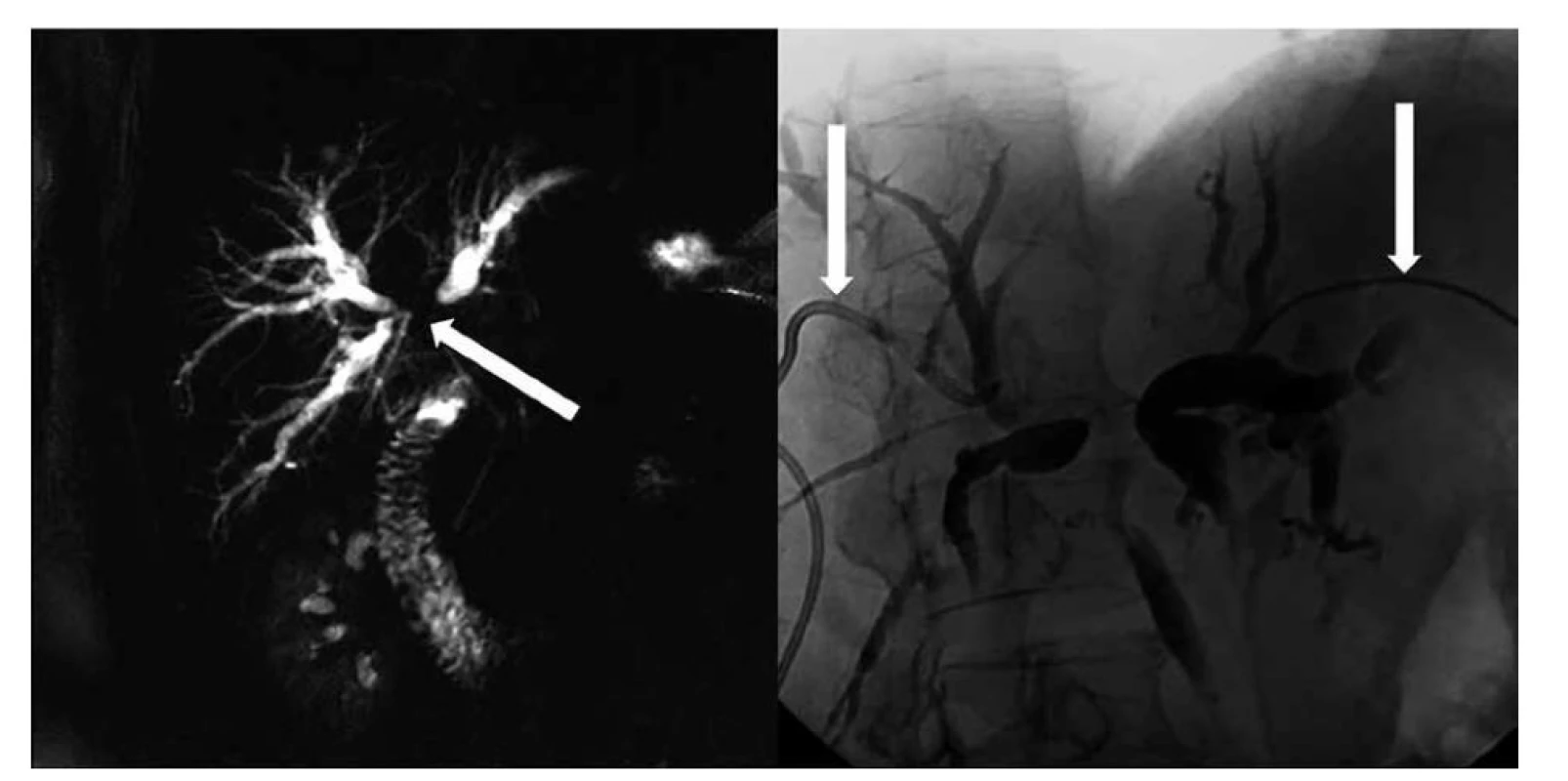
Obr. 3. Stenóza junkce hepatiků s oboustranným přechodem na sekundární větve pravého i levého dc. hepaticus typu Bismuth IV, vlevo rekonstrukce MRCP typu maximum intensity projection (MIP), vpravo zevní drenáž žlučových cest zvlášť z povodí levého a z pravého dc. hepaticus
Fig. 3: Stenosis of hepatic junction with bilateral transition to secondary branches of right and left dc. hepaticus of Bismuth IV type, on the left: maximum intensity projection (MIP) MRCP reconstruction, on the right: external drainage of bile ducts separately from left and right dc. hepaticus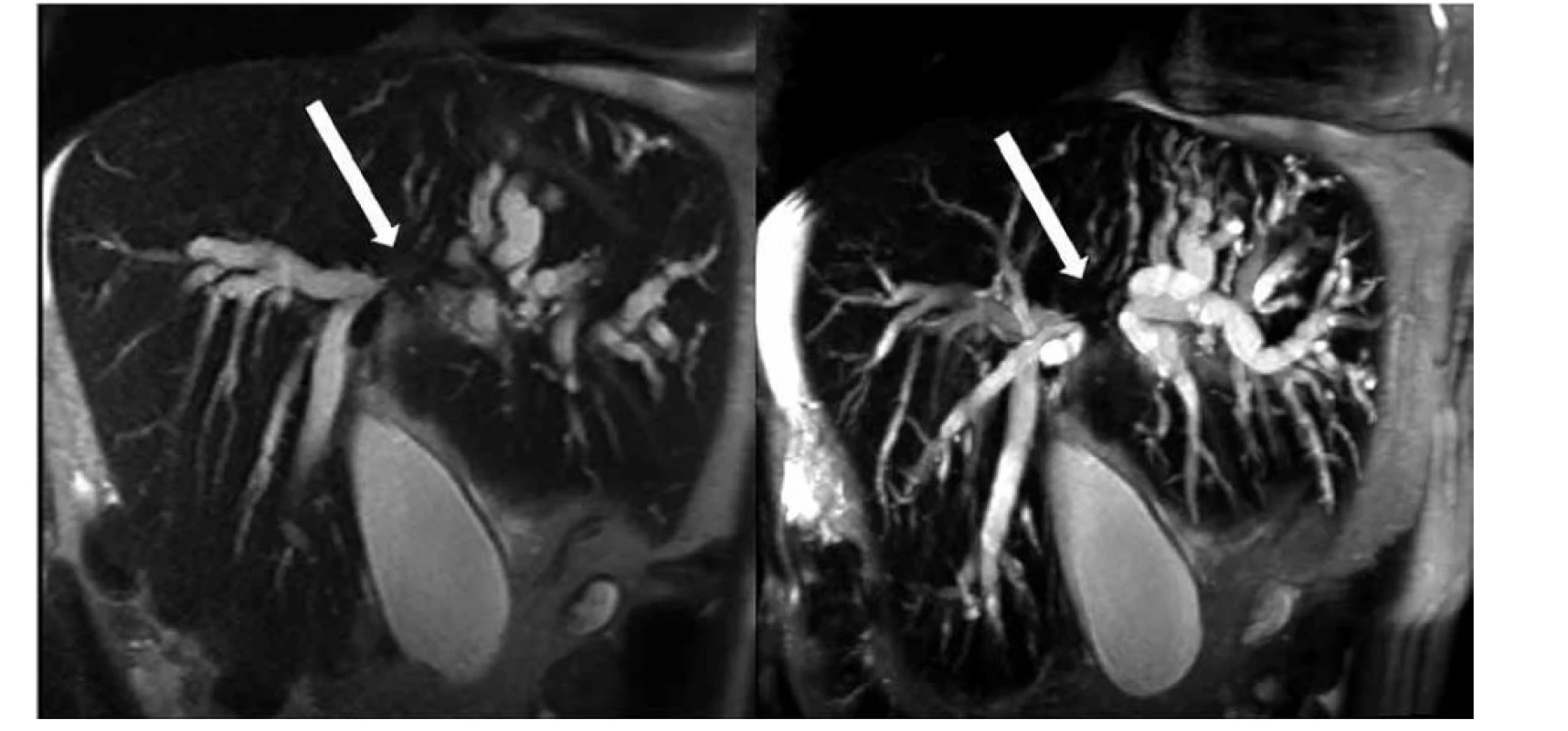
Obr. 4. Stenóza junkce hepatiků s jednostranným přechodem na sekundární větve levého dc. hepaticus typu Bismuth IIIb, současně infiltrace hepatoduodenálního ligamenta, diseminace v peritoneální dutině a následkem diseminace ascites − zobrazení výpočetní tomografií v rovině porta hepatis, vlevo větvení v. portae hepatis, vpravo infiltrace podél větví levého dc. hepaticus
Fig. 4: Stenosis of the hepatic junction with unilateral transition to the secondary branches of the left dc. hepaticus of Bismuth IIIb type, simultaneous infiltration of the hepatoduodenal ligament, dissemination in the peritoneal cavity and ascites as a result of dissemination− computed tomography imaging in the porta hepatis plane, on the left branching of the v. portae hepatis, on the right infiltration along the branches of the left dc. hepaticus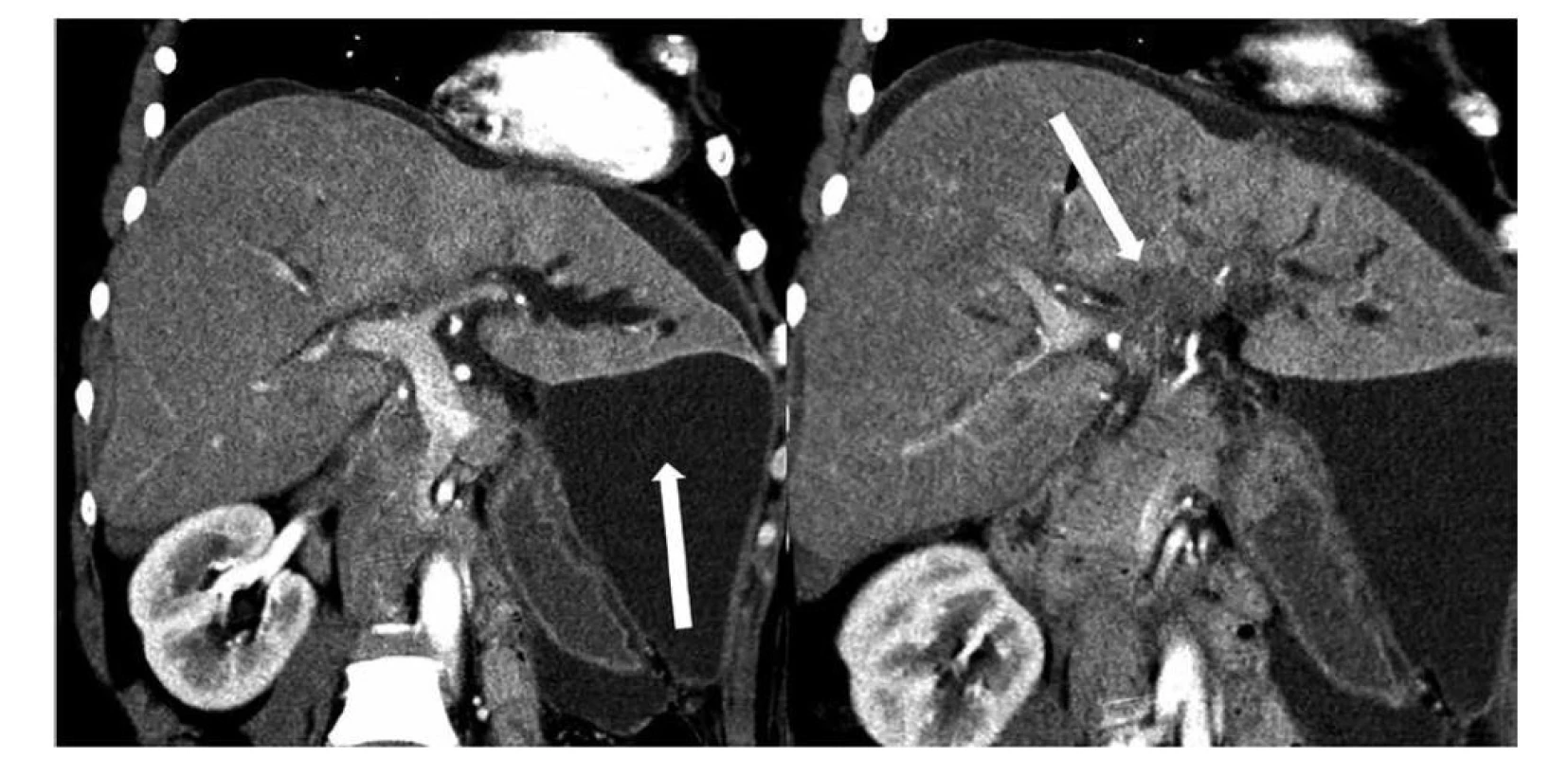
VÝSLEDKY
OS operovaných nemocných bylo významně lepší než u nemocných řešených paliativně, symptomaticky (Gehan-Wilcoxon test p<0,0001), medián přežití u operovaných byl 19,9 měsíce (95% CI: 15,4–28,5), u nemocných s paliativní, symptomatickou léčbou pak 7,2 měsíce (95% CI: 3,4–6,9) – Tab. 2, Graf 1. Medián PFS u operovaných nemocných byl 15,7 měsíce (95% CI: 8,5–19,9) – Tab. 3, Graf 2. OS se nelišilo mezi symptomatickou a drenážní léčbou (Kaplan-Meier p=0,3383), s mediánem přežití u drenážní, resp. paliativní léčby 5,8, resp. 3,6 měsíce (95% CI 2,6–10,8; resp. 2,6–5,7) – Tab. 4, Graf 3.
Tab. 2. Celkové přežívání celého souboru operovaných a neoperovaných nemocných
Tab. 2: Whole group, operated and non-operated patients overall survival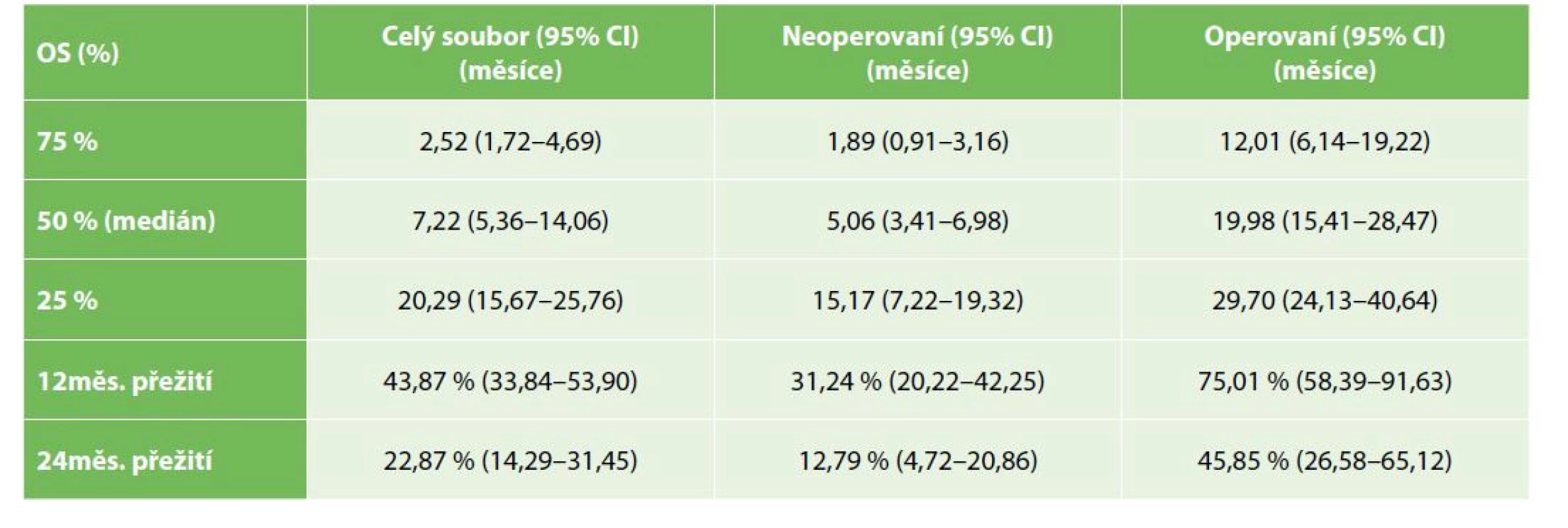
Graf 1. Celkové přežívání nemocných
Graph 1: Patients overal survival
Tab. 3. Interval do progrese u radikálně operovaných nemocných
Tab. 3: Progression free survival in radical resections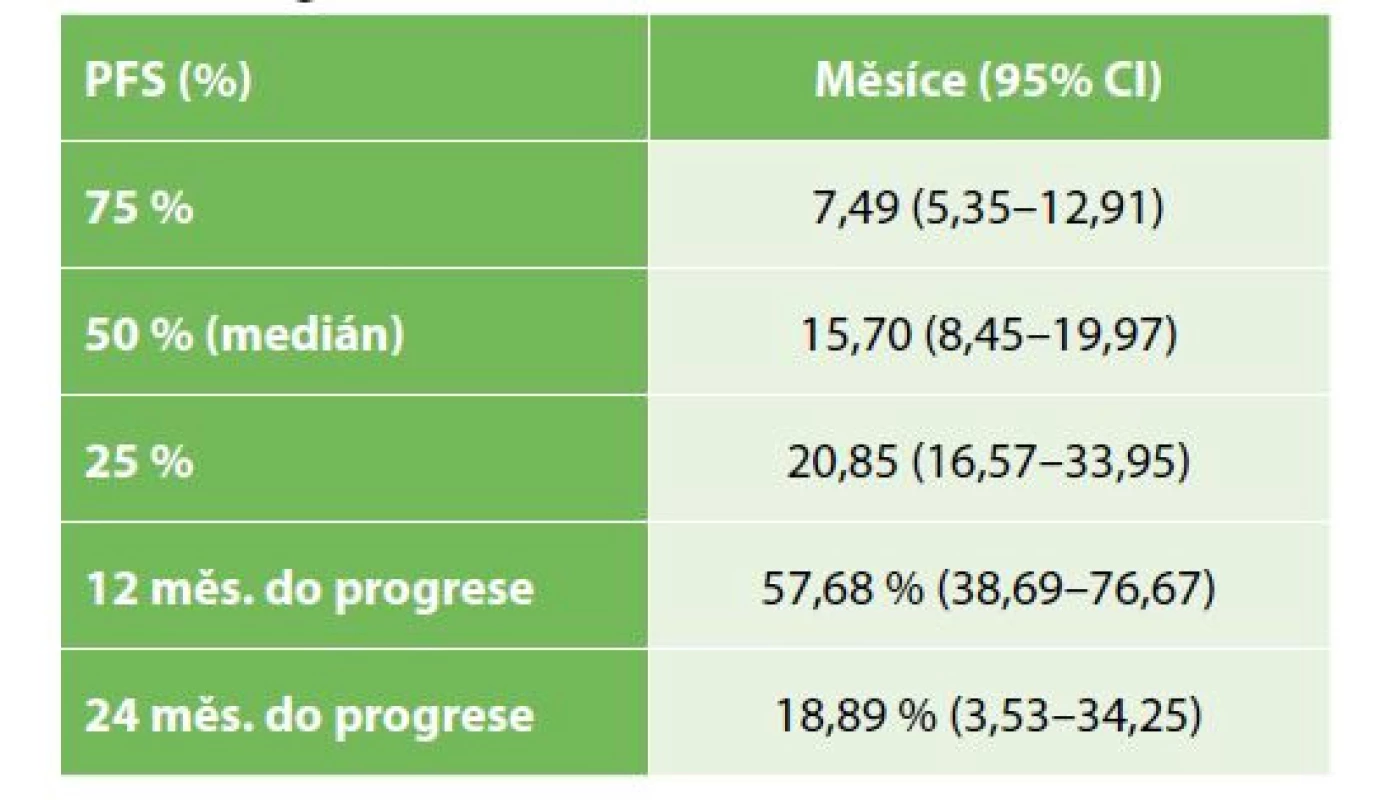
Graf 2. Doba do progrese u operovaných nemocných
Graph 2: Progression free survival in operated patients
Tab. 4. Celkové přežívání u skupiny neoperovaných nemocných − porovnání symptomatické léčby a drenážních výkonů
Tab. 4: Overall survival in the group of non-operated patients − comparison of symptomatic and drainage treatment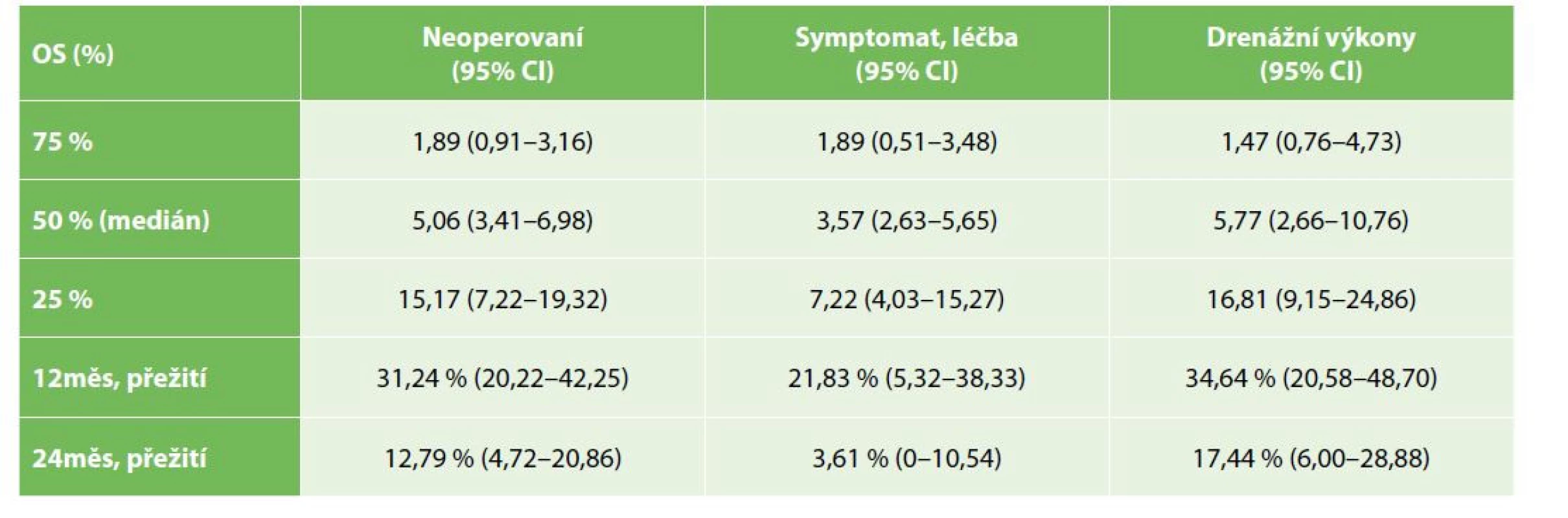
Graf 3. Celkové přežívání nemocných u paliativní a drenážní léčby
Graph 3: Patients overall survival for paliative and drainage treatment
DISKUZE
Nádory extrahepatálních žlučových cest patří k velmi agresivním nádorům gastrointestinálního traktu s velmi špatnou prognózou. Nádor se rychle asymptomaticky šíří nejen ve vlastních žlučových cestách, ale zejména do okolních cév a lymfatických uzlin. V době vyjádřené symptomatologie je většina nádorů chirurgicky, radikálně neodstranitelná a jedinou možností je pak symptomatická léčba ať už čistě konzervativní, endoskopická, či onkologická.
K epidemiologickým faktorům vzniku nádorů žlučových cest patří především chronický zánět, ať už na podkladě primární sklerozující cholangoitidy, nebo osídlením žlučových cest parazity typu Clonorchis sinensis či Opisthorchis viverrini s výskytem v endemických oblastech jihovýchodní Asie. K dalším vyvolávajícím faktorům patří hepatikolithiáza a kongenitální malformace žlučových cest (Carolliho choroba, cysty choledochu). Incidence těchto karcinomů roste s věkem a je častější u mužů [1,2].
Z hlediska histopatologie se velmi obecně rozdělují nádory extrahepatálních žlučových cest na dobře a špatně diferencované adenokarcinomy. AJCC (American Joint Committee for Cancer) pak toto obecné dělení dále definuje dle histopatologické charakteristiky nádoru [3].
Symptomatologie nádorů mimojaterních žlučových cest je dlouho němá, proto je jejich diagnostika často velmi pozdní při příznacích, jako jsou obstrukční ikterus, bolesti v nadbřišku, ztráta na váze, únava, svědění kůže, tmavá moč, světlá stolice či symptomatologie cholangoitidy.
K diagnostickým metodám patří vedle klinického vyšetření laboratorní testy (jaterní testy, bilirubin a látky produkované žlučovými cestami – gamma glutamyl transpeptidáza a alkalická fosfatáza, z nádorových markerů pak CK 7, CK 19, CEA a CA 19-9) a především radiodiagnostické a endoskopické metody (ultrasonografie – USG, zejména endoskopická USG, magnetická rezonanční cholangiopankreatografie – MRCP, endoskopická retrográdní cholangiopankreatografie – ERCP, perkutánní transhepatální cholangiografie – PTC, computerová tomografie – CT, magnetická rezonance – MRI nebo cholangioskopie). U endoskopických metod se k potvrzení diagnózy provádí odběr biopsie tzv. brushing technikou. Některé z výše uvedených metod jsou nejen diagnostické, ale i léčebné s možností zavedení vnitřní drenáže [4−6].
Základní klasifikací nejen z diagnostického hlediska, ale i z léčebného hlediska je klasická Bismuth-Corlette klasifikace, která umožňuje jednoduchou orientaci v lokalizaci a rozsahu nádoru extrahepatálních žlučových cest.
Chirurgická léčba je jedinou léčebnou alternativou nabízející radikální (R0) resekci s prognosticky lepšími výsledky v porovnání s ostatními víceméně paliativními postupy (onkologická léčba, endoskopické zavedení stentů, zevně – vnitřní drenáž pomocí PTC). V současnosti převládá klasický otevřený přístup cestou laparotomie, nicméně především v asijských zemích roste i počet laparoskopických a robotických resekcí. Obecným principem chirurgické resekce je radikální odstranění nádoru (někdy s nutností resekce jater nebo portální žíly), lymfadenektomie a biliodigestivní rekonstrukce. Peroperačně je vždy nutná úzká spolupráce s patologem, který zhodnotí resekční okraje preparátu. Při pozitivním resekčním okraji (přítomnost nádoru v resekční linii žlučovodu) je nutné žlučovod doresekovat do zdravé tkáně ve smyslu R0 resekce (1 mm zdravé tkáně), která je v některých případech možná jen za cenu hepatektomie. Zcela se v současné době ustoupilo na základě dlouhodobých výsledků od dřívějších názorů o zachování alespoň 10mm okraje zdravé tkáně a nutnosti vždy provést i resekci jater. V některých případech, kde nelze z různých důvodů provést R0 resekci, je přípustná i R1 resekce s mikroskopicky pozitivním okrajem žlučovodu s následnou onkologickou léčbou. Musíme však počítat s horšími dlouhodobými výsledky. Předoperační drenáž žlučových cest nemá jasné indikace, nicméně by měla být provedena u ikterických nemocných s příznaky cholangoitidy, u ikterických nemocných indikovaných k jaterní resekci, kde je plánována PVE (embolizace větve portální žíly), kde zbytkový objem jater (FLRV – future liver remnant volume) je <30 %, a dále u nemocných s malnutricí. Dlouhodobé výsledky resekcí závisejí na radikalitě resekce, postižení lymfatických uzlin, přítomností cévní invaze a histologické agresivitě nádoru. 5leté přežívání nemocných po resekční léčbě se pohybuje v rozmezí 24–49 % s mediánem 23–57 měsíců [7,8]. U přibližně 50 % nemocných i přes R0 resekci dochází v různém časovém intervalu po operaci k recidivě nádoru. Pokud je možná chirurgická léčba, pak dle NCCN (National Comprehensive Cancer Network) pravidel není při negativních resekčních okrajích doporučována adjuvantní chemo-, radioterapie. Nicméně u nemocných s pozitivními resekčními okraji a/nebo pozitivními lymfatickými uzlinami je doporučována adjuvantní chemoradiační onkologická léčba na bázi 5-fluorouracilu. K hlavním kritériím neresekability nádoru patří místně pokročilý nádor infiltrující hlavní cévní kmeny, metastázy ve vzdálených lymfatických uzlinách mimo hepatoduodenálního ligamenta, vzdálené metastázy a špatný celkový stav nemocného.
Transplantace jater pro nádory mimojaterních žlučových cest je v současné době podporována řadou autorů a je možné ji využít v případech selhávání jaterních funkcí nebo lokálně pokročilého neresekabilního nádoru bez vzdálených metastáz a nádorů vzniklých na podkladě sklerozující cholangoitidy. 5leté přežití u nemocných po transplantaci se pohybuje mezi 50–69 % s mediánem 53 měsíců [9,10]. Problémem širšího využití transplantace jater u nemocných s mimojaterním nádorem je nedostatek dárců.
Nechirurgická léčba spočívá v zavedení plastikových nebo metalických stentů s cílem uvolnění biliární obstrukce, zlepšení jaterních funkcí a s tím spojené kvality života nemocných [11]. Tato léčba využívá buď endoskopickou vnitřní, nebo perkutánní zevní drenáž žlučových cest. V současnosti není konsenzu, jaký typ (plastikový, metalický) drenáže použít a zda drenáž má být uni - nebo bilaterální). Obecnou indikací k aplikaci metalického stentu je prognóza nemocného delší 3 měsíců, zatímco hlavní indikací k plastikovým stentům je dočasná drenáž při cholangoitidě ať již u resekabilních nálezů, nebo neresekabilních s krátkou životní expektací [12]. Recentní studie spíše preferují z hlediska méně častých komplikací využití plastikových stentů před stenty metalickými [13−16].
K paliativním metodám patří radio - a chemoterapie, intra-arteriální chemoembolizace, fotodynamická terapie a ablační metody.
Paliativní chemoterapie je založena na gemcitabinu, cisplatině a kapecitabinu kombinovanými se zevní radioterapií. Některé novější práce pak uvádějí využití tzv. triple-chemoterapie (kombinace cisplatiny-gemcitabinu s nab-paclitaxelem a FOLFIRINOXem) v první linii chemoterapie [17,18]. Využití druhé linie chemoterapie na bázi FOLFOXu může nabídnout nemocným zlepšení jednoročního přežití (11,4 versus 25,9 %). Role cílené onkologické léčby a imunoterapie je zatím nejasná a čeká se na výsledky některých studií s IDH1,2 nebo FGFR inhibitory [19,20].
Vzhledem k vysoké variabilitě molekulárních prediktorů a vzácnosti onemocnění je indikováno testování NGS. Výsledek testování může v případě prokázání „targetovatelných“ mutací zásadně ovlivnit výběr léčby ve druhé linii. Nejčastěji se jedná o FGFR2 fúzi (10−16 %), IDH1/ IDH2 mutaci (19 %), NTRK fúzi (4 %), HER-2 overexpresi (4−16 %) a BRAF V600E mutaci (1−5 %), MSI-H (2−5 %). V případě průkazu fúze FGFR2 je efektivní léčba pemigatinibem, který je registrován již i v EU, nicméně o úhradu léčby z prostředků zdravotního pojištění je nutno žádat. V případě IDH1/IDH2 mutace je efektivní léčba ivosidenibem, ten však nemá registraci v EU [21].
U nemocných s pokročilým, inoperabilním nebo metastazujícím karcinomem žlučových cest je indikovaná externí radioterapie, nebo brachyterapie, či stereotaktická radioterapie s nebo bez konkomitantní chemoterapie, jejímž cílem je zmírnit symptomatoloigii nádoru a prodloužit celkové přežívání nemocných. Současné studie uvádějí při využití těchto terapeutických modalit medián přežívání nemocných kolem 16 měsíců. Nicméně radiační léčba je zatížena vyšším procentem závažných gastrointestinálních komplikací, jako je vředová choroba gastroduodena s krvácivými projevy. Tyto komplikace by měla snížit nová alternativa radioterapie, tzv. CIRT (carbon ion radiotheraphy), umožňující vyšší koncentraci záření v tumoru a snížení působení na okolní tkáně. Zatím je jen málo prací zabývajících se metodou CIRT, a tak si na skutečné výsledky budeme muset ještě počkat [22].
Intra-arteriální chemoembolizace využívá chemoterapeutika na bazi cisplatiny, 5 - fluorouracilu a gemcitabinu kombinované s radioterapií po implantaci stentů do oblasti nádorové stenózy žlučových cest. Medián přežití je kolem 20 měsíců.
Z ablačních metod jsou využívány metoda IRE (ireversibilní elektroporace), PDT (fotodynamická terapie) a ERFA (endobiliární radiofrekvenční ablace).
IRE je metodou využívající krátkých vysokovoltážních elektrických impulzů k destrukci buněčných membrán nádoru s následnou apoptózou nádorových buněk. Jedná se o nontermální metodu s aplikací speciálních sond do oblasti nádoru. Využívá se u inoperabilních nádorů žlučových cest nebo u lokálních recidiv po předchozí radikální chirurgické léčbě. Její efektivita je vyšší u nádorů o průměru <3 cm. Nicméně vzhledem k lokalizaci nádorů v těsné blízkosti hlavních cévních struktur může být IRE spojena se závažnými komplikacemi v této oblasti. Průměrné celkové přežití nemocných při využití IRE se uvádí kolem 24 měsíců [23].
PDT je metoda využívající buď perkutánní transhepatickou cholangioskopii, nebo endoskopickou retrográdní cholangioskopii k zavedení laserové sondy do místa nádoru s intravenózní aplikací fotosenzitivní látky, která se akumuluje v nádorové tkáni. Medián celkového přežití se uvádí kolem 15 měsíců [24].
ERFA rovněž využívá k zavedení radioablační sondy perkutánní nebo endoskopický přístup. Principem metody je termoablace nádoru s omezením jeho následného růstu a zlepšením dlouhodobé průchodnosti stentů. Její určitou nevýhodou je „heat sink effect“, tj. ochlazování termoablačního účinku proudící krví v okolních vysokoprůtokových cévních kmenech [25 - 27].
Všechny výše uvedené metody jsou bohužel zatíženy i závažnými komplikacemi, jako jsou perforace žlučových cest, akutní cholecystitida, pankreatitida, trombóza portální žíly nebo krvácivé komplikace.
ZÁVĚR
Zhoubné nádory žlučových cest mají i přes četné léčebné pokroky velmi špatnou prognózu, která je dána jejich histopatologickou heterogenitou, a především pozdní diagnostikou. Současný diagnosticko-léčebný postup by měl být postaven na personalizovaném přístupu v rámci multidisciplinárního týmu. Radikální chirurgická léčba je jednoznačnou prioritou a měla by být prováděna jen ve velkých centrech s komplexním zajištěním nemocného. Cílem histopatologické diagnostiky a následné onkologické léčby má být identifikace nádorového genomu s následnou personalizovanou léčbou nebo imunoterapií prodlužující celkové přežívání ať již radikálně operovaných, nebo konzervativně léčených nemocných. Rovněž rozvoj endoskopických technik, kterého jsme svědky v poslední době, jistě významnou měrou přispěje ke zlepšení prognózy těchto nemocných.
Práce byla podpořena Výzkumným záměrem Programem COOPERATIO, vědní oblasti SURG Univerzity Karlovy v Praze a Projektem institucionálního výzkumu MZČR – FNPI, 00669806
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
Prof. MUDr. Vladislav Třeška, DrSc.
Chirurgická klinika LFUK a FN v Plzni
e-mail: treska@fnplzen.cz
Zdroje
1. Zamani Z, Fatima S. Biliary tract cancer. StatPearls Publishing 2022.
2. Banales JM, Marin JJG, Lamarca A, et al. Cholangiocarcinoma 2020: The next horizon mechanisms and management. Nat Rev Gastroenterol Hepatol. 2020;17(9):557−588. doi:10.1038/ s41575-020-0310-z.
3. Lee JW, Lee JH, Park Y, et al. Prognostic predictability of American Joint Committee on Cancer 8th staging system for perihilar cholangiocarcinoma: Limited improvement compared with the 7th staging system. Cancer Res Treat. 2020;52(3):886−895. doi: 10.4143/ crt.2020.023.
4. Skalický T, Třeška V, Šnajdauf J, et al. Hepatopankreatobiliární chirurgie. Praha, Maxdorf Jessenius 2011.
5. Lewis HL, Rahnemai-Azar AA, Dillhoff M, et al. Current management of perihilar cholangiocarcinoma and future perspectives. Chirurgia (Bucur) 2017;112(3):193−207. doi:10.21614/ chirurgia.112.3.193.
6. Mansour JC, Aloia TA, Crane ChH, et al. Hilar cholangiocarcinoma: expert consensus statement. HPB (Oxford) 2015;17 : 691−699. doi:10.1111/hpb.12450.
7. van Keulen AM, Olthof PB, Cescon M, et al. Actual 10-year survival after resection of perihilar cholangiocarcinoma: What factors preclude a chance for cure? Cancers (Basel) 2021;13(24):6260. doi:10.3390/ cancers13246260.
8. Rassam F, Roos E, van Lienden KP, et al. Modern work-up and extended resection in perihilar cholangiocarcinoma: the AMC experience. Langenbecks Arch Surg. 2018;403(3):289−307. doi:10.1007/ s00423-018-1649-2.
9. Mueller M, Breuer E, Mizuno T, et al. Protocol for liver transplantation in hilar cholangiocarcinoma. Arq Bras Cir Dig. 2022;34(3):e1618. doi:10.1590/0102 - 672020210002e1618.
10. Cambridge WA, Fairfield C, Powell JJ, et al. Response to the comment on „Meta-analysis and meta-regression of survival after liver transplantation for unresectable perihilar cholangiocarcinoma“. Ann Surg. 2021;274(6):e921−e922. doi:10.1097 / SLA. 0000000000005190.
11. Jingdong L, Yongfu X, Yang G, et al. Minimally invasive surgery for hilar cholangiocarcinoma: a multicenter retrospective analysis of 158 patients. Surg Endosc. 2021;35(12):6612−6622. doi:10.1007/ s00464-020-08161-8.
12. Inchingolo R, Acquafredda F, Ferraro V, et al. Non-surgical treatment of hilar cholangiocarcinoma. World J Gastrointest Oncol. 2021;13(11):1696−1708. doi:10.4251/wjgo.v13.i11.1696.
13. Fukasawa M, Takano S, Shindo H, et al. Endoscopic biliary stenting for unresectable malignant hilar obstruction. Clin J Gastroenterol. 2017;10(6):485−490. doi:10.1007/s12328-017-0778-4.
14. Razumilava N, Gores GJ. Building a staircase to precision medicine for biliary tract cancer. Nat Genet. 2015;47(9):967−968. doi:10.1038/ng.3386.
15. Kim JY, Lee S, Kang D, et al. The comparison of endoscopic biliary drainage in malignant hilar obstruction by cholangiocarcinoma: Bilateral metal stents versus multiple plastic stents. Gut Liver 2021;15(6):922−929. doi:10.5009/gnl20257.
16. Lee TH, Moon JH, Park SH. Biliary stenting for hilar malignant biliary obstruction. Dig Endosc. 2020;32(2):275−286. doi:10.1111/den.13549.
17. McNamara MG, Bridgewater J, Palmer DH, et al. A phase Ib study of NUC-1031 in combination with cisplatin for the firstline treatment of patients with advanced biliary tract cancer (ABC-08). Oncologist 2021;26(4):e669−e678. doi: 10.1002/ onco.13598.
18. Lamarca A, Ross P, Wasan HS, et al. Advanced intrahepatic cholangiocarcinoma: Post hoc analysis of the ABC-01, -02, and -03 clinical trials. J Natl Cancer Inst. 2020;112(2):200−210. doi:10.1093/jnci/ djz071.
19. Sota Y, Einama T, Kobayashibayashi K, et al. Recurrent cholangiocarcinoma with long-term survival by multimodal treatment: A case report. Mol Clin Oncol. 2021 Apr;14(4):72. doi:10.3892/mco.2021.2234.
20. Soares KC, Kamel I, Cosgrove DP, et al. Hilar cholangiocarcinoma: diagnosis, treatment options, and management. Hepatobiliary Surg Nutr. 2014;3(1):18−34. doi:10.3978/j.issn.2304-3881.2014.02.05.
21. Modrá kniha České onkologické společnosti, Masarykův onkologický ústav, 2022, ISBN: 978-80-86793-53-5.
22. Makita Ch, Nakamura T, Takada A, et al. Preliminary treatment results of proton beam therapy with chemoradiotherapy for stage I-III esophageal cancer. Cancer Med. 2016;5(3):506−515. doi:10.1002/ cam4.607.
23. Coelen RJS, Vogel JA, Vroomen LG, et al. Ablation with irreversible electroporation in patients with advanced perihilar cholangiocarcinoma (ALPACA): a multicentre phase I/II feasibility study protocol. BMJ Open 2017;7(9):e015810. doi:10.1136/ bmjopen-2016-015810.
24. Chen P, Yang T, Shi P, Shen J, et al. Benefits and safety of photodynamic therapy in patients with hilar cholangiocarcinoma: A meta-analysis. Photodiagnosis Photodyn Ther. 2022;37 : 102712.
25. Andrašina T, Rohan T, Hustý J, et al. Interventional radiology therapies for liver cancer. Cas Lek Cesk. 2018;157(4):195−202.
26. Rohan T, Andrasina T, Matkulcik P. Percutaneous endoluminal radiofrequency ablation of occluded biliary metal stent in malignancy using monopolar technique: A feasibility study. Cardiovasc Intervent Radiol. 2022. doi: 10.1007/s00270-022 - 03097-z.
27. Mizandari M, Pai M, Xi F, et al. Percutaneous intraductal radiofrequency ablation is a safe treatment for malignant biliary obstruction: feasibility and early results. Cardiovasc Intervent Radiol. 2013;36(3):814−819. doi:10.1007/ s00270-012-0529-3.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína Gastroenterologie a hepatologie
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 9- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Sekce HPB a biliární chirurgie
- Chirurgická léčba karcinomu extrahepatálních žlučových cest – aktuální důkazy a doporučení
- Chirurgie iatrogenních poranění žlučových cest
- Zhoubné nádory mimojaterních žlučových cest
- Karcinom středního a distálního žlučovodu, retrospektivní analýza, krátkodobé a dlouhodobé výsledky chirurgické léčby
- Intrahepatický cholangiokarcinom: rizikové faktory přežití operovaných nemocných
- Masivní nitrohrudní krvácení jako komplikace difúzní alveolární hemoragie a antikoagulační léčby při covid 19 – 2 kazuistiky
- Allen-Mastersův syndrom jako příčina ileózního stavu – kazuistika
- Parciální resekce jako možnost řešení pozdní infekce nativního i protetického arteriovenózního zkratu – kazuistiky
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgie iatrogenních poranění žlučových cest
- Zhoubné nádory mimojaterních žlučových cest
- Allen-Mastersův syndrom jako příčina ileózního stavu – kazuistika
- Chirurgická léčba karcinomu extrahepatálních žlučových cest – aktuální důkazy a doporučení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



