-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta
Evaluation of safe resection margins in rectal carcinoma
The fact that surgically well performed total mesorectal excision with negative circumferential resection margin represents one of the most important prognostic factors in colorectal carcinoma is already well known. These parameters significantly affect the incidence of local tumour recurrence as well as distant metastasis, and are thus related to the duration of patient survival. The surgeon’s task is to perform mesorectal excision as completely as possible, i.e., to remove the rectum with an intact cylinder of mesorectal fat. The approach of the pathologist to evaluation of total mesorectal excision specimens differs greatly from that of resection specimens from other parts of the large bowel. Besides evaluation of the usual parameters for colon cancer staging, it is essential to assess certain additional factors specific to rectal carcinomas, namely tumour distance from circumferential (radial) resection margins and the quality of the mesorectal excision. In order to accurately evaluate these parameters, knowledge of a wide range of clinical data is indispensable (results of preoperative imaging, intraoperative findings). For objective evaluation of these parameters it is necessary to introduce standardized procedures for resection specimen processing and macro and microscopic examination. This approach is based mainly on standardized macroscopic photo-documentation of the integrity of the mesorectal surface. Parallel transverse sections of the resection specimens are made with targeted tissue sampling for histological examination. It is essential to have close cooperation between surgeons and pathologists within a multidisciplinary team enabling mutual feedback.
Key words:
rectosigmoid cancer – total mesorectal excision – circumferential resection margin – mesorectal excision quality assessment – interdisciplinary approach
Autoři: E. Hovorková 1; D. Hadži-Nikolov 1; A. Ferko 2; J. Örhalmi 2; M. Chobola 2; A. Ryška 1
Působiště autorů: Fingerlandův ústav patologie LF a FN Hradec Králové, přednosta: Prof. MUDr. A. Ryška, PhD. 1; Chirurgická klinika, LF a FN Hradec Králové, přednosta: Prof. MUDr. A. Ferko, CSc. 2
Vyšlo v časopise: Rozhl. Chir., 2014, roč. 93, č. 2, s. 92-99.
Kategorie: Postgraduální vzdělávání
Podpořeno grantem IGA MZ ČR (NT13726-4/2012), grantem IGA MZ ČR (NT14150-3/2013) a projektem BBMRI LM2010004.
Práce je určena k postgraduálnímu vzdělávání lékařů.Souhrn
Fakt, že negativní cirkumferentní resekční okraj a chirurgem kvalitně provedená totální mezorektální excize patří u karcinomu rektosigmoidea k nejdůležitějším prognostickým faktorům, je již všeobecně známý. Oba parametry výrazně ovlivňují výskyt lokální recidivy nádoru i vzdálených metastáz a souvisejí tak s délkou přežití pacienta. Úlohou chirurga je provést co možná nejkompletnější mezorektální excizi, tedy odstranit rektum i s neporušeným válcem mezorektálního tuku. Úlohou patologa při hodnocení totálních mezorektálních excizí je v první řadě uplatnění zcela odlišného postupu zpracování vzorku ve srovnání s ostatními resekáty tlustého střeva s karcinomem. Při hodnocení resekátu je vedle tradičně stanovovaných parametrů naprosto zásadní posouzení dalších aspektů specifických právě pro karcinom rekta, jmenovitě vzdálenost nádoru od cirkumferentního (radiálního) resekčního okraje a kvalita mezorektální excize. Pro kvalifikované zhodnocení všech parametrů je nutná znalost celé řady klinických údajů (výsledky předoperačních zobrazovacích vyšetření, peroperační nález). K následnému objektivnímu vyhodnocení těchto parametrů je nutné zavedení standardizovaného postupu zpracování resekátu i jeho makroskopického a mikroskopického vyšetření. Tento postup se opírá zejména o standardizovanou makroskopickou fotodokumentaci celistvosti mezorektálního povrchu, zpracování formou paralelních řezů a cílený odběr vzorků tkáně k histologickému vyšetření. Zcela nezbytná je velmi úzká mezioborová spolupráce chirurga a patologa v rámci multidisciplinárního týmu, poskytující oboustrannou zpětnou vazbu.
Klíčová slova:
karcinom rektosigmoidea – totální mezorektální excize – cirkumferentní resekční okraj – kvalita mezorektální excize – interdisciplinární spolupráceÚvod
Stejně důležité, jako je kvalifikované provedení operace, je následné vyhodnocení a standardizované extenzivní zpracování resekátu tak, aby operatérovi poskytlo všechny relevantní informace o stupni pokročilosti nádoru (pTNM stadium), jeho vztahu k resekčním okrajům a v neposlední řadě o kvalitě totální mezorektální excize, tedy o celistvosti odstraněného tukového mezorektálního obalu.
Pro objektivní vyhodnocení těchto parametrů je nutné zavedení standardizovaného postupu zpracování resekátu i jeho makroskopického a mikroskopického vyšetření. Následující text se věnuje popisu způsobu zpracování resekátů rekta tak, jak byl rozpracován na pracovišti autorů. Nečiní si rozhodně nároky na to být jediným správným řešením, opírá se nicméně o zkušenosti se zpracováním několika set případů totálních mezorektálních excizí pro karcinom konečníku [1,2].
METODIKA
Postup zpracování resekátu rekta:
Zpracování a kvalitativní zhodnocení resekátů rekta je poměrně specializovaný výkon, který by na pracovišti patologie měl být prováděn erudovaným patologem znalým celé problematiky, který si detailně osvojil standardizovaný postup zpracování. Tento výkon by tedy, pokud je to možné, neměl spadat mezi rutinní zpracování vzorků. Hodnocení cirkumferentního resekčního okraje (CRO), tedy jeho celistvosti a vzdálenosti nádoru od okraje, do značné míry modifikuje již sám chirurg způsobem dodání vzorku i s ním spojených informací [1,2,3].
- 1. Požadavky kladené na chirurga
Pro optimální zpracování vzorku je nezbytná informace o výsledcích předoperačních zobrazovacích vyšetření, stejně tak jako peroperačního nálezu. Optimální je zasílání těchto informací spolu s resekátem ve strukturované formě, což zabrání opomenutí uvedení některého z důležitých údajů.
- Na žádance o histologické vyšetření je nezbytné uvést následující údaje:
- informace o předoperační radioterapii/radiochemoterapii, zahrnující rovněž klinické hodnocení odpovědi nádoru na léčbu a údaj o jeho původní velikosti před zahájením léčby
- klinické stadium TNM (u cT4 nádorů také informaci, kam nádor prorůstá)
- přibližná velikost a poloha nádoru (rektum horní – střední – dolní, růst cirkulární – necirkulární se specifikací uložení)
- přibližná vzdálenost nádoru od distálního resekčního okraje (DRO)
- uvést všechny případné další odstraněné orgány (či jejich části), dodané v jednom celku s resekátem (např. semenné váčky, prostata apod.).
- Naprosto zásadní je také způsob, jak je resekát zaslán k vyšetření. Jako optimální se jeví dodání orgánu, který není:
- 1) podélně rozstřižený.
Podle potřeby je možné případné příčné nastřižení resekátu těsně podél distální staplerové sutury k pohmatové kontrole vzdálenosti nádoru od distálního resekčního okraje operatérem.
Částečné podélné nastřižení může provést po fotodokumentaci vzorku u delších resekátů patolog; tento krok usnadní lepší profixování luminálních partií střeva formaldehydem. Je třeba zdůraznit, že je naprosto nezbytné vždy ponechat nerozstřiženou celou oblast nádoru s 2cm lemem zdravé tkáně nad i pod nádorem pro zhotovení celistvých příčných lamel po fixaci.
Hlavním důvodem, proč nestříhat celý nativní resekát podélně, je rozdílná retrakce tkání během fixace ve formolu s následnou deformací vzorku, ovlivňující zejména hodnotu vzdálenosti nádoru od CRO. U příčných lamel zhotovených z resekátu před fixací nerozstřiženého je zachován původní relativní poměr šíře lemu tukové tkáně ve všech částech obvodu střeva; u příčných řezů zhotovených z resekátu, jenž byl fixován až po jeho podélném rozstřižení, mají příčné lamely tvar písmene U, kdy dochází k významné retrakci tukového obalu – v oblasti, kde byl resekát rozstřižen, tuková tkáň retrahuje směrem do centra resekátu a ve vlastních okrajích pak prakticky chybí, poměr výšky tuku v různých částech obvodu střeva se tak významně změní a původní anatomické poměry pak prakticky nelze zodpovědně zrekonstruovat. Pokud je navíc resekát (byť i neúmyslně), podélně rozstřižen právě v místě nádoru, bude výsledná naměřená hodnota vzdálenosti nádoru od CRO zcela nespolehlivá.
Ve výjimečných případech, zejména u nádorů po neoadjuvantní radio(chemo)terapii (NCHRT), kdy nádor již nebyl identifikován palpací na nativním resekátu, je možné střevo až po důkladné fixaci podélně rozstřihnout k revizi celé sliznice a ozřejmení místa původního nádoru. Při rozstřižení střeva po fixaci již k deformačním artefaktům tukové tkáně nedochází.
- 2) fixovaný (dle možností a domluvy s patologem)
Resekát lze v nativním stavu odesílat pouze tehdy, pokud je možné jeho okamžité dodání na patologii v chladicím boxu, je minimalizovaná fáze studené ischemie bez fixace a nehrozí tak poškození tkání – a zejména pak vlastního nádoru – autolýzou!
Hlavním důvodem odeslání nefixovaného materiálu není jenom provedení fotodokumentace nativního resekátu patologem; tu je možné zajistit již na operačním sále chirurgem a následně fotodokumentaci dodat patologovi jako jeden z podkladů pro posouzení kvality mezorektální excize.
Nespornou výhodou dodání nativního resekátu je pro patologa zejména možnost palpačního ozřejmení polohy a velikosti nádoru, což je důležité zejména u drobných nádorů a v případech, kdy proběhla NCHRT s významnou odpovědí na tuto léčbu. Zde bývá často jediným nálezem jen drobná indurace stěny s vyhlazením sliznice; tyto diskrétní změny již nejsou po fixaci a ztuhnutí celého resekátu palpačně identifikovatelné, drobné léze se navíc na příčných lamelách hůře identifikují. V případech téměř kompletní odpovědi na léčbu tak hrozí riziko minutí vlastního reziduálního nádorového ložiska s následnou nesprávnou diagnózou kompletní patologické odpovědi na NCHRT.
- 2. Postup makroskopického zpracování resekátu patologem [1,2,3,4,5]
- V první fázi patolog, který obdrží nativní resekát (v den operace), musí zajistit:
Fotodokumentaci celého nativního resekátu z ventrální a dorzální strany spolu s měřítkem a cílenou fotodokumentaci detailů povrchu (trhliny, defekty ke svalovině, perforace apod.), pokud již toto nebylo provedeno chirurgem na operačním sále (Obr. 1a, b).
Obr. 1. Makrofotodokumentace resekátu a) ventrální strana, b) dorzální strana, c) natušovaný mezorektální tuk, d) sada příčných lamel z místa nádoru. Fig. 1: Macrophotographs of resection specimen a) ventral aspect, b) dorsal aspect, c) inked mesorectal surface, d) transverse sections of the resection specimen with tumour. 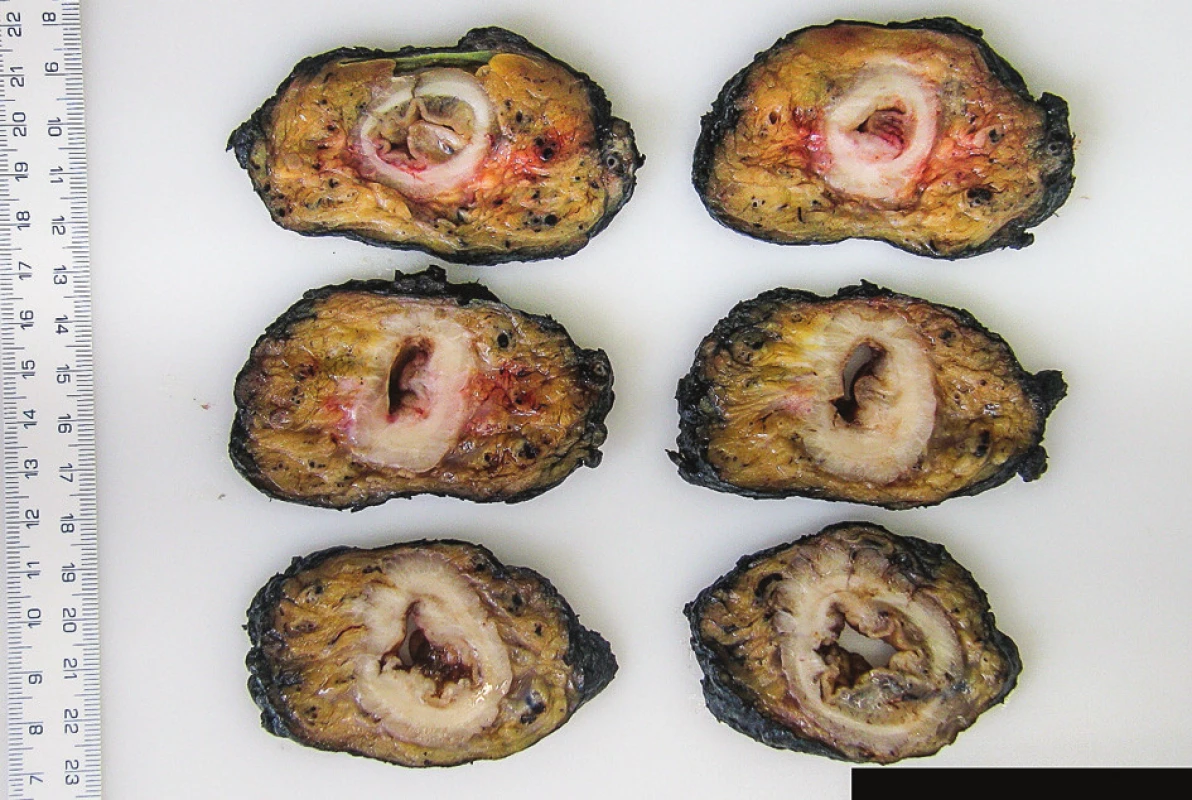
Následnou fixaci resekátu v 10% roztoku formaldehydu (optimální délka fixace je 48 hodin). Jak bylo zmíněno výše, je vhodné zajistit, aby fixační roztok pronikl do lumen střeva a fixace tak probíhala z obou stran resekátu. Tím se výrazně sníží riziko autolytických změn v nádorové tkáni, jejímž důsledkem může být nejen obtížné stanovení stupně diferenciace tumoru, ale rovněž poškození nádorové DNA, komplikující či dokonce znemožňující vyšetření molekulárně genetické mutačního stavu genů rodiny RAS.
- Fixovaný resekát je 2 dny po operaci následně zpracován:
Prvním krokem je označení celé neperitonealizované oblasti mezorektálního tuku tuší. Tato oblast sahá nejníže ventrálně, zatímco dorzálně trojúhelníkovitě vybíhá kraniálním směrem; hranice tuše tak kopíruje okraj přípojky peritonea (Obr. 1c).
Následuje zhotovení příčných lamel širokých 3–5 mm, které postihují celou délku nádoru a jak orálně, tak aborálně od nádoru zasahují až do zdravé tkáně.
Nezbytnou součásti je fotodokumentace celé sady zhotovených lamel (vždy spolu s měřítkem). Orientace lamel musí být standardizována dle vzájemné domluvy operatéra s patologem tak, aby byla možná následná jednoznačná orientace v pořízené fotodokumentaci (Obr. 1d). Kromě snímku celé sady lamel je nutné také pořízení fotodokumentace detailů jednotlivých lamel se zaměřením na trhliny v tuku, defekty zasahující až ke svalovině, nádor v blízkosti CRO, uzliny či nádorové satelity v blízkosti CRO apod.
Po detailní fotodokumentaci následuje vlastní odběr vzorků na mikroskopické vyšetření: odebírány jsou nejen vícečetné vzorky z nádoru (z míst nejhlubší invaze, nejbližší vzdálenosti nádoru k CRO), ale rovněž z proximálního a distálního resekčního okraje a také ze všech ostatních abnormálních nálezů na sliznici (polypy, defekty, divertikly apod.).
Dalším krokem je projasnění tuku v Carneyově roztoku (zpravidla postačuje expozice po dobu 24 hodin), poté prokrájení tuku na tenké lamely 2–3 mm silné a jejich pečlivá inspekce a identifikace všech přítomných lymfatických uzlin za pomoci palpace. Pro histologii jsou odebrány všechny uzliny a také případné nádorové satelity v tukové tkáni (po 1 vzorku z každé uzliny).
Odebrané vzorky jsou standardně přes noc zpracovány v autotechnikonu, tkáň je zalita do parafinu a jsou zhotoveny histologické řezy.
- 3. Mikroskopické hodnocení resekátu
Jak vyplývá z výše uvedeného, kompletní sadu zhotovených preparátů obdrží patolog k mikroskopickému hodnocení nejdříve za 4 dny od operace.
Po mikroskopickém vyhodnocení všech histologických řezů a korelaci nálezů s veškerou makrofotodokumentací a klinickými údaji jsou jednotlivé zjištěné parametry sumarizovány nejlépe ve formě jednotného strukturovaného výsledkového protokolu, který je přehledný nejen pro patologa, ale také pro chirurga a onkologa.
4. Struktura výsledkového protokolu [5]
- makroskopický popis:
- délka resekátu (případně i délka neperitonealizovaného úseku ventrálně)
- kvalita mezorektální excize (I-III)
- poloha nádoru:
- nad peritoneální přípojkou – v místě úponu peritonea – pod úponem peritonea
- cirkulárně – necirkulárně (kde?)
- velikost nádoru
- přítomnost případné perforace střeva (mimo nádor, v místě nádoru = pT4)
- histologický nález:
- typ a grade nádoru
- hloubka invaze (vrstva)
- vzdálenost nádoru od proximálního a distálního resekčního okraje
- vzdálenost nádorových struktur od CRO (≤ 1 mm = pozitivní CRO)
- přítomnost angioinvaze a perineurálního šíření
- po RT/CHRT stupeň regrese nádoru (např. hodnocení dle Dworaka) [6,7]
- počet všech uzlin / počet pozitivních uzlin
- přítomnost nádorových satelitů (vztah k CRO)
- vedlejší nálezy:
- polypy, divertikly…
- závěrečná klasifikace:
- MKNO
- (y) pTNM.
Hodnocení kvality mezorektální excize (ME):
Správně indikovaný a radikálně provedený chirurgický zákrok hraje v úspěšnosti onkologické terapie karcinomu rekta klíčovou roli. Zejména u excizí nádorů s negativním CRO se právě kvalita mezorektální excize stává důležitým prognostickým faktorem lokální recidivy nádoru [1,3,4,8,9].
Podle kvality jsou mezorektální excize děleny do tří kategorií – I. kompletní, II. téměř kompletní a III. inkompletní.
Pro posouzení kvality, které pro zachování naprosté objektivity provádí vždy patolog, není využívána pouze fotodokumentace povrchu celého resekátu a jeho detailů; neméně důležitá je také fotodokumentace příčných lamel, kde lépe vynikne hloubka jednotlivých defektů, zvýrazněných tuší zatékající z povrchu do hloubi trhlin. Toto hodnocení objektivizuje skutečnou radikalitu provedeného chirurgického výkonu.
Vlastní kritéria hodnocení [4,8,10]:
- I. kompletní ME – povrch hladký či jen s mělkými defekty < 5 mm, bez konizace resekátu; CRM hladký, pravidelný.
- II. téměř kompletní ME – povrch nepravidelný, s trhlinami a defekty, které nedosahují ke svalovině muscularis propria; CRM nepravidelný, s hlubšími defekty.
- III. inkompletní ME – nepravidelná vrstva potrhaného mezorektálního tuku, s defekty až ke svalovině muscularis propria; CRM nepravidelný, tuš zatéká ke svalovině.
Hodnocení vzdálenosti nádoru od CRO:
Cirkumferentní resekční okraj je specifický parametr používaný pouze pro hodnocení resekátů karcinomu rekta. Vzdálenost nádoru od CRO je definována jako nejbližší zjištěná vzdálenost nádorových struktur od cirkulární resekční linie mezorektálního tuku. Nejedná se však o hodnotu odečítanou z makrofotografií příčných řezů, kde není možné odlišit vlastní nádorové struktury od vazivového stromatu a jizvení v okolí nádoru. Jde vždy o mikroskopicky naměřenou vzdálenost vlastních nádorových buněk od otušovaného CRO, který je v histologickém řezu při odebrání vzorků přes celou tloušťku stěny v místě nádoru zřetelně černě zvýrazněný (Obr. 2).
Obr. 2. a) Příčná lamela z místa nádoru; nádorový infiltrát se blíží těsně k CRO (šipka), b) mikroskopicky stanovená vzdálenost nádorových žlázek od černě zvýrazněného CRO Fig. 2: a) Transverse section of the resection specimen with tumour infiltration near the circular resection margin (CRM) (arrow), b) microscopic evaluation of the distance between tumour glands and inked CRM 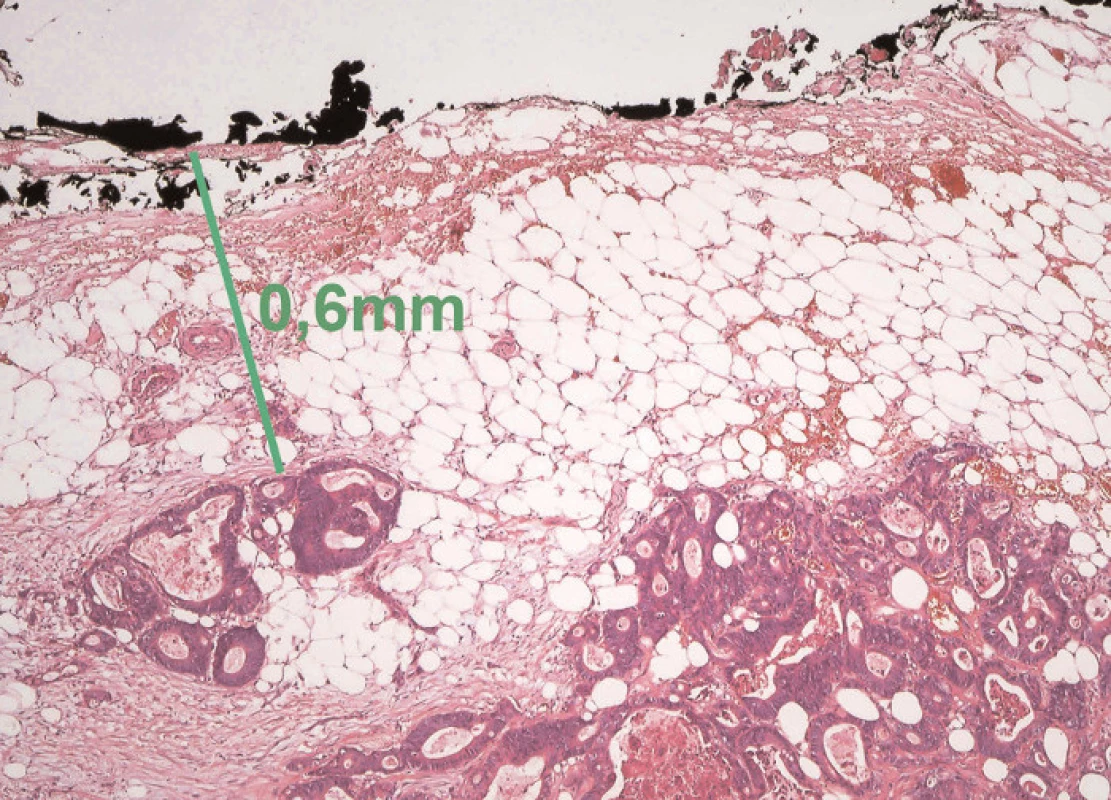
Naměřená vzdálenost ≤ 1 mm je hodnocena jako pozitivní CRO, s následným vyšším rizikem výskytu lokální recidivy nádoru [2,4,9,11].
Je třeba si uvědomit, že vzdálenost nádoru od CRO hodnotíme nejenom u vlastního primárního nádoru, ale také u případných nádorových satelitů v jeho okolí (tedy u sekundárních nádorových ložisek vzniklých invazí cév či perineurálním šířením nádoru), případně u postižení lymfatických uzlin s perinodálním šířením nádoru do tukové tkáně. I tato sekundární nádorová ložiska mohou být příčinou pozitivního CRO, rozhodujícím údajem je tedy vždy nejbližší naměřená vzdálenost [11].
Hodnocení vzdálenosti nádoru od DRO:
Vzdálenost nádoru od DRO je důležitou hodnotou zejména u karcinomů dolního rekta. Při přítomnosti nádorových buněk ve vlastním DRO je tento okraj hodnocen jako pozitivní. Vzhledem k možnému intramurálnímu mikroskopickému šíření nádoru za hranice makroskopicky patrného okraje nádoru je za bezpečný úsek považován lem zdravé tkáně 1–2 cm distálně od nádoru [4,11,12].
Pokud nádor leží zřetelně v bezpečné vzdálenosti od DRO, je tento údaj hodnocen makroskopicky změřením vzdálenosti nádoru k distální staplerové sutuře; u nádorů ≤ 2 cm od DRO je vhodnější tuto vzdálenost vyhodnotit přesně mikroskopicky, jak bude podrobněji vysvětleno níže.
Možná úskalí při hodnocení resekčních okrajů:
- Nádory v blízkosti DRO
U nádorů s nezřetelnými okraji či u nádorů ≤ 2 cm od DRO je nutné modifikovat postup zpracování resekátu – při zhotovení příčných lamel je třeba nekrájet tyto lamely až do zdravé tkáně pod nádorem, ale naopak ponechat dolní lamelu vcelku, širokou od distálního okraje nádoru až k vlastnímu DRO. Tento široký kroužek tkáně postihující celý distální konec resekátu je následně zpracován v radiálně uspořádaných řezech orientovaných paralelně s podélnou osou střeva; jednotlivé lamely tedy zasahují od nádoru na straně jedné k DRO na straně druhé. Výsledkem je pak přesná mikroskopicky změřená vzdálenost nádoru od DRO (Obr. 3).
Obr. 3. Nádor po NCHRT a) Drobná exulcerace sliznice (šipka) v těsné blízkosti DRO, b) detail zhotovené podélné lamely od exulcerace (*) směrem k DRO, k následnému mikroskopickému zhodnocení vzdálenosti reziduí nádoru od DRO (dvojitá šipka). Fig. 3: Tumour after NCHRT a) Small mucosal ulcer (arrow) near the distal resection margin (DRM), b) detail of longitudinal section taken from ulcer (asterisk) to DRM for microscopic evaluation of the distance between the residual tumour and the DRM (double arrow). 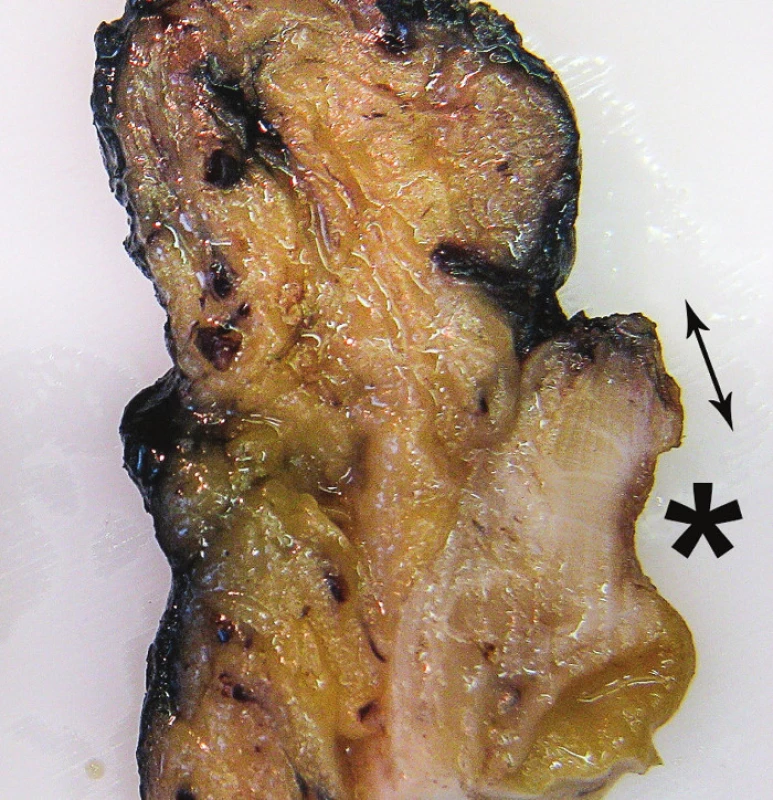
U velmi malých nádorů či drobné jizvy po NCHRT v těsné blízkosti distálního resekčního okraje je třeba postup zpracování podle aktuálního nálezu modifikovat. Zhotovení příčných lamel z místa nádoru je v tomto případě nevhodné, protože nádor by byl často jen v jedné či dvou lamelách. Vhodnější je v tomto případě celou oblast nádoru vyšetřit v paralelních podélných řezech k distálnímu okraji, na kterých je možné mikroskopicky zhodnotit jak vzdálenost nádoru od DRO, tak od CRO.
- Vyšetřování resekátů po NCHRT
Resekáty nádorů po NCHRT s dobrou odpovědí nádoru na terapii představují zvláštní kapitolu problematiky zpracování ME. V některých případech je přesné vyhodnocení jednotlivých parametrů, zejména hloubky invaze reziduálních nádorových struktur a jejich vzdálenosti od CRO a DRO, velmi obtížné.
Důvodů pro to je několik. V první řadě dochází v místě regredovaného nádoru k výraznému jizvení, makroskopicky je ale zcela nemožné odlišit jizvení po terapii od vlastních reziduí nádoru (Obr. 4). Stěna střevní má v obou případech setřelou strukturu, je bělavá a tužší; nezbytné je pak důkladné mikroskopické vyšetření celé jizevnatě změněné oblasti, kde jsou často zastiženy jen drobné reziduální ostrůvky vitálních nádorových buněk, disperzně rozptýlené v jizevnatém pojivu [7].
Obr. 4. Lamela z místa cirkulárního nádoru po NCHRT Struktura střevní stěny je setřelá, jizvení od reziduí nádoru nelze makroskopicky rozlišit. Potrhaný mezorektální tuk s defekty ke svalovině (kvalita ME 3). Fig. 4: Transverse section from circular tumour after NCHRT The structure of the bowel wall is effaced. Macroscopically, it is impossible to distinguish residual tumour from scar tissue. Torn mesorectal surface with defects extending to the muscularis propria (quality of mesorectal specimen 3). 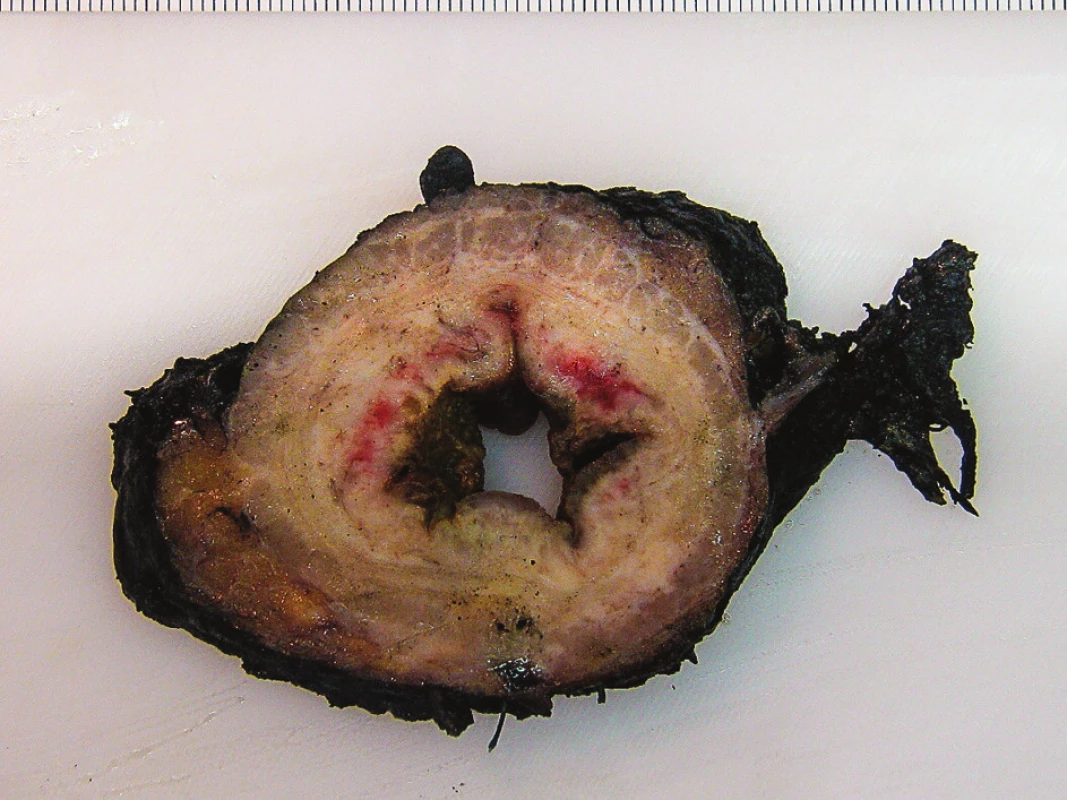
Dalším problémem bývá kompletní regrese nádoru po NCHRT, kdy zejména původně malý nádor již prakticky nelze v resekátu identifikovat. V tomto případně je naprosto zásadní údaj chirurga o původní velikosti a lokalizaci nádoru před terapií; takto specifikovaná oblast je pak vyšetřena velmi extenzivně. K definitivnímu potvrzení kompletní odpovědi nádoru na terapii patologem (ypT0) je nezbytné zpracovat celou oblast původního nádoru, případně imunohistochemicky vyloučit přítomnost jednotlivých reziduálních nádorových buněk.
U resekátů po NCHRT by měl patolog vždy určit stupeň regrese nádoru za použití standardního skórovacího systému, který vychází z poměru jizvení a vitálních nádorových struktur v místě původního nádoru. Příkladem je hodnocení dle Dworaka s pěti stupni možné odpovědi na léčbu: 0 = bez regrese nádoru (bez jizvení, nádor zcela vitální), 1 = mírná regrese (fibróza < 25 %, dominuje vitální nádor), 2 = střední regrese (fibróza 26–50 %), 3 = výrazná regrese (dominuje fibróza > 50 %, přetrvávají rezidua nádoru), 4 = totální regrese (pouze fibróza, žádné vitální nádorové buňky) [6,7].
- Resekáty s částmi sousedních orgánů u cT4 nádorů
U nádorů s hlubokou invazí do tukové tkáně je možnou komplikací prorůstání do sousedních orgánů, zejména do semenných váčků, prostaty a močového měchýře u mužů, u žen pak do dělohy a pochvy. Pokud je některý z těchto orgánů odstraněn radikálně a dodán v jednom celku s vlastním resekátem rekta či rektosigmoidea, jeho identifikace obvykle nečiní problém. Pokud je však dodána v rámci resekátu jen malá část přiléhajícího orgánu, může být bez současné informace na průvodce při makroskopickém vyhodnocení nerozpoznána či se povrch resekátu v tomto místě stává nepřehledným a obtížně makroskopicky interpretovatelným; struktury dalšího orgánu jsou pak obvykle identifikovány až mikroskopicky a následuje dodatečné extenzivnější vyšetření této oblasti po revizi vzorku, který je však již po primárním zpracování a odběru tkáně pro histologii hůře přehledný, navíc se zbytečně prodlužuje doba vyšetření. Je proto nezbytně nutné, aby údaj o všech přilehlých strukturách, které jsou součástí resekátu, uvedl chirurg vždy na odesílané žádance o vyšetření.
I u nádorů bez předchozí NCHRT dochází v okolí nádorových čepů k desmoplastické reakci s proliferací jizevnatého stromatu, které často pevně fixuje k nádoru přiléhající orgány, a to i bez jejich přímé invaze vlastními nádorovými buňkami; makroskopicky však přítomnost nádorové invaze od pouhé jizevnaté fixace nádoru k okolí není možné odlišit. Zpracování vzorku se pak neliší od běžného postupu vyšetření resekátu, včetně značení tuší a zhotovení příčných lamel, případně lze využít několik různých barev tuše k cílenému značení přilehlých orgánů pro lepší orientaci na příčných lamelách; místa suspektní invaze nádoru do těchto orgánů jsou pak extenzivně mikroskopicky vyšetřena.
Topografické zpracování resekátu:
Existují případy, kdy je vyšetření resekátu velmi obtížné, příčné lamely jsou nepřehledné a velikost, rozsah a hloubku invaze nádoru prakticky není možné posoudit. Nejčastěji se jedná o resekáty s masivním projizvením stěny střeva po NCHRT, případy, kdy je resekát makroskopicky zcela bez nálezu s kompletně zregredovaným nádorem, či právě o resekáty se suspektní invazí nádoru do okolních orgánů.
Takovéto případy vyžadují extenzivní vyšetření resekátu, kdy je pro patologa velmi přínosné využít právě fotodokumentaci příčných lamel již během vlastního cíleného odběru vzorků tkáně na histologické vyšetření. Do vytisknutého obrázku všech nafocených lamel lze přesně schematicky zakreslit místa odběru jednotlivých histologických vzorků, které jsou číslovány, při mikroskopickém vyšetření je pak možné podle čísla preparátu přesně identifikovat místo původu vzorku. Do obrázku je pak již snadné zakreslovat místa mikroskopicky zastiženého nádoru, případně vzdálenosti k okrajům a hloubku invaze. Jednotlivé dílky této skládačky do sebe zapadnou a výsledkem je zmapování celé suspektní oblasti s relevantními údaji o rozsahu i hloubce nádoru (Obr. 5).
Obr. 5. Topografické zpracování karcinomu rekta po NCHRT se suspektní invazí semenných váčků a) Příčné lamely z oblasti nádoru a semenných váčků (šipka), b) schéma odběru vzorků k mikroskopickému vyšetření, c) zakreslení mikroskopického nálezu se vzdálenostmi nádoru od CRO do schématu; semenné váčky jsou pouze projizvené, bez nádoru. Fig. 5: Topographic processing of rectal carcinoma after NCHRT with possible invasion of seminal vesicles a) Transverse sections of the resection specimen with seminal vesicles (arrow), b) diagram of specimen sampling for microscopic evaluation, c) drawings with microscopic findings showing the distances between the tumour and CRM; seminal vesicles only show scarring without tumour. 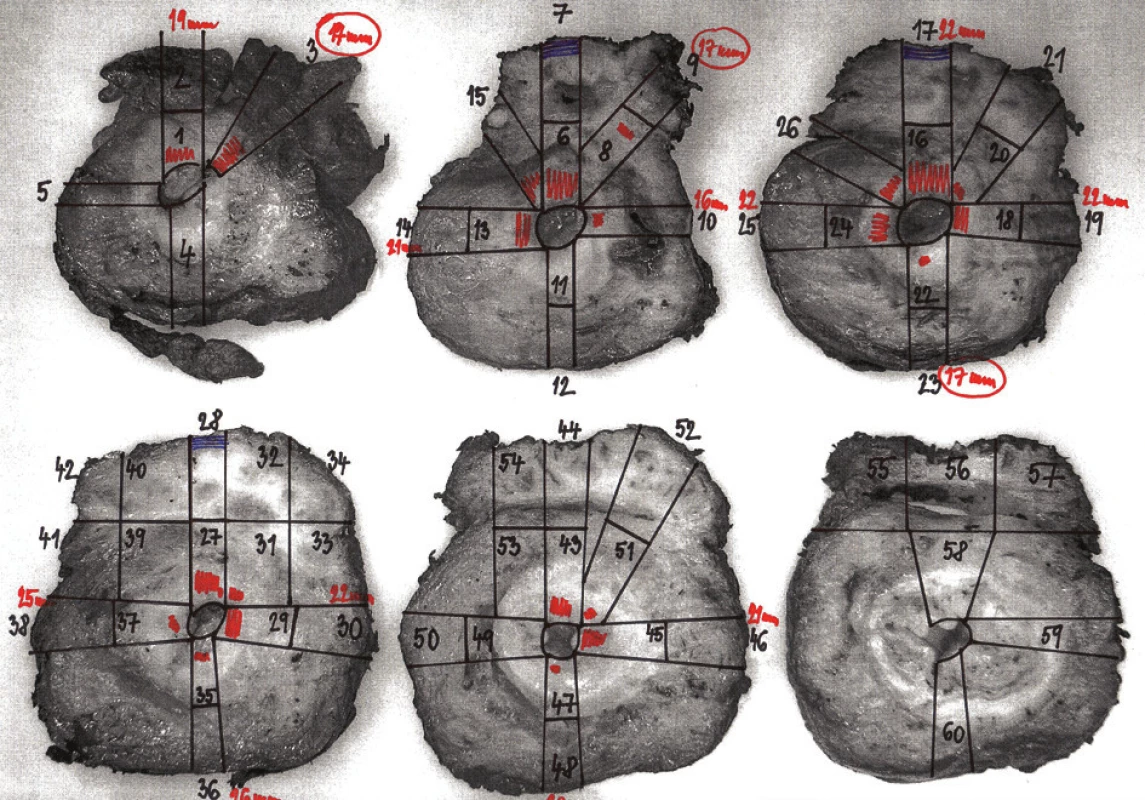
Vyšetření takovýchto resekátů je v porovnání s „běžným“ postupem technicky nepoměrně náročnější, počty vyšetřených bloků z místa nádoru dosahují i mnoha desítek a celkový čas patologa věnovaný makroskopickému a následně mikroskopickému vyšetření jediného resekátu se snadno vyšplhá na 3–4 hodiny. Přesto je výhodnější raději extenzivnější vyšetření nepřehledného resekátu již v první etapě, kdy lze všechny odebrané vzorky přesně orientovat, než dodatečné pokusy o odběr tkáně ze zbytkového materiálu „naslepo“ po nezastihnutí nádoru v původně odebraných vzorcích.
Závěr
Přesné makroskopické a mikroskopické zhodnocení resekátu patologem hraje klíčovou roli pro stanovení prognózy onemocnění. Vzdálenost nádoru od CRO je signifikantní prediktivní faktor lokální recidivy nádoru, u nádorů s negativním CRO je riziko recidivy úzce spjaté právě s kvalitou mezorektální excize [1,2,4,9].
Zhodnocením všech parametrů (ať už standardním postupem, či modifikovanými metodami podle aktuálního nálezu) a odesláním výsledkového protokolu by role patologa neměla končit; optimálním závěrem každého případu by měla být jeho prezentace na mezioborovém semináři, kterého se účastní kromě chirurga a patologa také onkolog.
Společný rozbor kompletní fotodokumentace resekátu s vyhodnocením kvality mezorektální excize přináší důležitou objektivní zpětnou vazbu pro chirurga; navíc jakékoliv pochybnosti či nejasnosti v nálezu je možné si vzájemně vysvětlit. Patolog se tak stává nezávislým auditorem kvality práce chirurga.
Výsledné parametry (zejména vzdálenost nádoru od CRO, DRO, pTNM klasifikace a stupeň regrese po NCHRT) přinášejí zásadní informace také pro onkologa ohledně optimální volby následné terapie.
Bez úzké vazby a vzájemné informovanosti tohoto týmu nemůže být péče o pacienty s karcinomem rektosigmoidea na špičkové úrovni. Její dosažení je však výsledkem dlouhodobé spolupráce a zejména vzájemné otevřené komunikace, s přesně definovanými povinnostmi i požadavky jednotlivých členů týmu. Odměnou za vynaložené úsilí je vyladění optimálního postupu „šitého na míru“ danému pracovišti, příjemným „vedlejším“ efektem jsou pak fungující mezioborové vztahy.
MUDr. Eva Hovorková
Fingerlandův ústav patologie a LF UK a FN Hradec Králové
Sokolská 581,
500 05 Hradec Králové
e-mail: eva.hovorkova@fnhk.cz
Zdroje
1. Ferko A, Örhalmi J, Nikolov DH, Hovorková E, Chobola M, et al. Radikalita resekční léčby pro karcinom rekta. Analýza prediktivních faktorů spojených s nekompletní mezorektální excizí. Rozhl Chir 2013;92 : 304–10.
2. Dušek T, Ferko A, Örhalmi J, Chobola M, Nikolov DH, et al. Karcinom rekta do 10 cm. Srovnání radikality laparoskopické a otevřené operační techniky s ohledem na cirkumferentní resekční okraj a na kompletnost mezorektální excize. Rozhl Chir 2013;92 : 313–9.
3. Quirke P, Durdey P, Dixon MF, Williams NS. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection. Histopathological study of lateral tumour spread and surgical excision. Lancet 1986;2 : 996–9.
4. Parfitt JR, Driman DK. The total mezorectal excision specimen for rectal cancer: a review of its pathological assessment. J Clin Pathol 2007;60 : 849–55.
5. Burroughs SH, Williams GT. Examination of large intestine resection specimens. J Clin Pathol 2000;53 : 344–9.
6. Dworak O, Keilholz L, Hoffmann A. Pathological features of rectal cancer after preoperative radiochemotherapy. Int J Colorect Dis 1997;12 : 19–23.
7. Gosens MJ, Klaassen RA, Tan-Go I, Rutten HJ, Martijn H, et al. Circumferential margin involvement is the crucial prognostic factor after multimodality treatment in patients with locally advanced rectal carcinoma. Clin Cancer Res 2007;13 : 6617–23.
8. Quirke P, Steele R, Monson J, Grieve R, Khanna S, et al. Effect of the plane of surgery achieved on local recurrence in patients with operable rectal cancer: a prospective study using data from the MRC CR07 and NCIC-CTG CO16 randomised clinical trial. Lancet 2009;373 (9666):821–8.
9. Nagtegaal ID, Quirke P. What is the role for the circumferential margin in the modern treatment of rectal cancer? J Clin Oncol 2008;26 : 303–12.
10. Nagtegaal ID, van de Velde CJ, van der Worp E, Kapiteijn E, Quirke P, et al. Macroscopic evaluation of rectal cancer resection specimen: clinical significance of the pathologist in quality control. J Clin Oncol 2002;20 : 1729–34.
11. Guillem JG, Chessin DB, Shia J, Suriawinata A, Riedel E, et al. A prospective pathologic analysis using whole-mount sections of rectal cancer following preoperative combined modality therapy. Implications for sphincter preservation. Ann Surg 2007;245 : 88–93.
12. Mezhir JJ, Shia J, Riedel E, Temple LK, Nash GM, et al. Whole-mount pathologic analysis of rectal cancer following neoadjuvant therapy. Ann Surg 2012;256 : 274–9.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Koncentrace chirurgické péče
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2014 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Problematika stanovení bezpečných resekčních okrajů u nádorů parenchymatózních orgánů
- Problematika stanovení bezpečných resekčních okrajů patologem v mamární onkochirurgii
- Koncentrace chirurgické péče
- Deset let endovenózní ablace varixů, úspěchy, neúspěchy a budoucnost
- Transarteriální chemoembolizace pomocí „drug eluting beads“ (TACE DEB) u nemocných s radikálně neodstranitelným hepatocelulárním karcinomem (HCC)
- Problematika klostridiové kolitidy na chirurgickém pracovišti
- Monografie Vladislava Hytycha věnovaná plicní chirurgii
- Využití acelulárních biologických xenotransplantátů v lokální léčbě Lyellova syndromu
- Využití telemetrického monitorování intrakraniálního tlaku v diferenciální diagnostice idiopatické nitrolební hypertenze – kazuistika
- Akademik Vladimír Balaš se dožívá 90 let
- Resekční okraje – onkologicky významný parametr R
- Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Resekční okraje – onkologicky významný parametr R
- Problematika stanovení bezpečných resekčních okrajů u nádorů parenchymatózních orgánů
- Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta
- Problematika stanovení bezpečných resekčních okrajů patologem v mamární onkochirurgii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání










