-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rýchla prenatálna diagnostika chromozómových aneuploidií
Rapid prenatal aneuploidy testing.
Rapid prenatal aneuploidy testing has been introduced as a validated diagnostic method. Quantitative fluorescent polymerase chain reaction (QF PCR) allows to confirm or exclude aneuploidy 13, 18, 21 and sex chromosomes in pregnant at risk within 24 – 48 hours. If the chromosomal pathology is confirmed the termination of pregnancy can be reduced in 2 – 3 weeks. Our objective was the implementation of QF PCR into clinical praxis. The principle of the method is elucidated, series of 184 tests follows. The abnormality rate was 4,9 % and an optimal management was established. Comparison of QF PCR and FISH method, residual pathology and the role of QF PCR in clinical praxis is discussed (Fig. 1, Tab. 2) [26].
Key words:
prenatal diagnosis – QF PCR – STR – rapid aneuploidy detection, residual risk
Autoři: K. Melišová 1; V. Ferák 2; M. Ondrejčák 1; J. Hinšt 3; P. Kleskeň 3; J. Matušek 2
Působiště autorů: Oddelenie klinickej genetiky ŽNaP NOVAPHARM s. r. o. Bratislava 1; DNA TEST s. r. o. Bratislava 2; I. gynekologicko-pôrodnícka klinika SZU a FNsP Bratislava 3
Vyšlo v časopise: Prakt Gyn 2009; 13(4): 234-238
Souhrn
Rýchla prenatálna diagnostika chromozómových aneuploídií sa stala v indikovaných prípadoch valídnou vyšetrovacou metódou. Kvantitatívna flourescenčná polymerázová reťazová reakcia (QF PCR) umožňuje u rizikových tehotných v priebehu 24 – 48 hodín potvrdiť alebo vylúčiť aneuploídiu chromozómov 13, 18, 21 a pohlavných chromozómov. Pri potvrdenej chromozómovej patológii je možné skrátenie termínu ukončenia tehotnosti o 2 – 3 týždne. Cieľom našej práce bolo zaviesť do klinickej praxe metódu QF PCR. V úvode predstavujeme princíp metódy, nasleduje vyhodnotenie súboru 184 vyšetrených tehotných – 4,9 % záchyt patologického nálezu a management starostlivosti. V diskusii porovnávame QF PCR s metódou fluorescenčnej in situ hybridizácie (FISH), zaoberáme sa reziduálnou patológiou a uplatnením metódy QF PCR v klinickej praxi (obr. 1, tab. 2) [26].
Kľúčové slová:
prenatálna diagnostika – QF PCR – STR – rýchla detekcia aneuploídií – reziduálne rizikoÚvod
Tri roky po zavedení dlhodobej kultivácie amniocytov [1] bola uskutočnená prvá diagnostika Downovho syndrómu v prenatálnom období [2]. Na Slovensku bola prenatálna diagnostika chromozómových aberácií zavedená do klinickej praxe na prelome 70. a 80. rokov [3]. Klasická kultivačná metóda má na jednej strane výhodu vyhodnotenia počtu a štruktúry všetkých chromozómov, na druhej strane má aj svoje nevýhody. Predovšetkým ide o dĺžku troch týždňov od odberu plodovej vody po výsledok. Nie zanedbateľnou nevýhodou je neúspešnosť kultivácie, s nutnosťou opakovania amniocentézy, a tým predĺženia doby čakania na výsledok. V klinickej praxi je preto 21. týždeň gravidity limitujúcim faktorom pre amniocentézu. V prípade neúspešnosti kultivácie alebo v prípade nejasného výsledku je tehotná postavená pred rozhodnutie podstúpiť podstatne invazívnejšiu kordocentézu. V prípade diagnostikovania chromozómovej patológie plodu je časový faktor takisto významný. Začiatkom 90. rokov sa do prenatálnej diagnostiky dostáva fluorescenčná in situ hybridizácia (FISH) a o niečo neskôr QF PCR (kvantitatívna fluorescenčná polymerázová reťazová reakcia). Tieto metódy umožňujú rýchlu diagnostiku vybraných chromozómových aberácií [4 – 6]. FISH využíva špecifické DNA sondy značené nukleotidmi, s fluorescenčnou aktivitou, alebo môžu byť naviazané na fluorensenčne označenú molekulu [7 – 9].
Princíp metódy QF PCR
QF PCR je metóda, umožňujúca rýchlu a spoľahlivú diagnózu najčastejších aneuploídií bez potreby kultivovať bunky a študovať v nich chromozómy počas bunkového delenia. Východiskovým materiálom pre túto metódu je DNA, ktorú možno získať aj z interfázových – teda nedeliacich sa buniek. Metóda je založená na vyšetrení vysoko variabilných úsekov DNA tých chromozómov, ktorých aneuploídie chceme diagnostikovať (v našom prípade chromozómy č. 21, 18 a 13 a pohlavné chromozómy X a Y). Vysoko variabilné úseky DNA sú nazývané krátke tandemové repetície (STR, z angl. short tandem repeats). Sú to miesta v DNA, na ktorých sa určitá krátka sekvencia základných stavebných jednotiek DNA – báz A, C, G, T – nachádza u rôznych jedincov v rozličnom počte opakovaní. Jedinec môže mať na obidvoch chromozómoch príslušného chromozómového páru buď rovnaké alely (napr. 6 – 6, 8 – 8, apod.) – teda je pre tento marker homozygotný, alebo má na každom chromozóme inú alaelu (napr. 6 – 9, 7 – 10 a pod.) – je heterozygotný. Homozygot má úseky (alely) iba jednej dĺžky, heterozygot má úseky (alely) dvoch rozličných dĺžok – kratší a dlhší. Dĺžku akéhokoľvek úseku DNA možno merať s vysokou presnosťou pomocou kapilárovej elektroforézy, ktorá využíva skutočnosť, že čím je meraný úsek DNA kratší, tým rýchlejšie sa pohybuje v elektrickom poli. Zariadenie, ktoré takéto meranie dĺžky fragmentov umožňuje, je génový analyzátor. Každý fragment DNA znázorní ako pík, ktorého poloha na súradnici zodpovedá dĺžke meraného fragmentu, a ktorého obsah približne zodpovedá počtu fragmentov. Ide teda o kvantitatívnu metódu (obr. 1). Pred samotnou analýzou pomocou elektroforézy je potrebné študované úseky z DNA „vystrihnúť“ a namnožiť ich na taký počet kópií, aby boli detegovateľné pomocou elektroforézy. To umožňuje polymerázová reťazová reakcia (PCR).
Obr. 1. Možnosti usporiadania alel STR markera znázornené na monitore génového analyzátora pri QF PCR.<br>Hore: u jedincov s dvomi chromozómami daného páru (dizómia) je buď jedna alela (homozygot, vľavo), alebo dve alely (heterozygot, vpravo). Dole: u jedincov s tromi chromozómami daného páru (trizómia) je buď jedna alela (vpravo), alebo dve alely v kvantitatívnom pomere 2 : 1 (v strede), alebo tri alely (vpravo). Ak je prítomná len jedna alela (ľavý stĺpec), nemožno rozlíšiť, či ide o dizómiu alebo trizómiu. 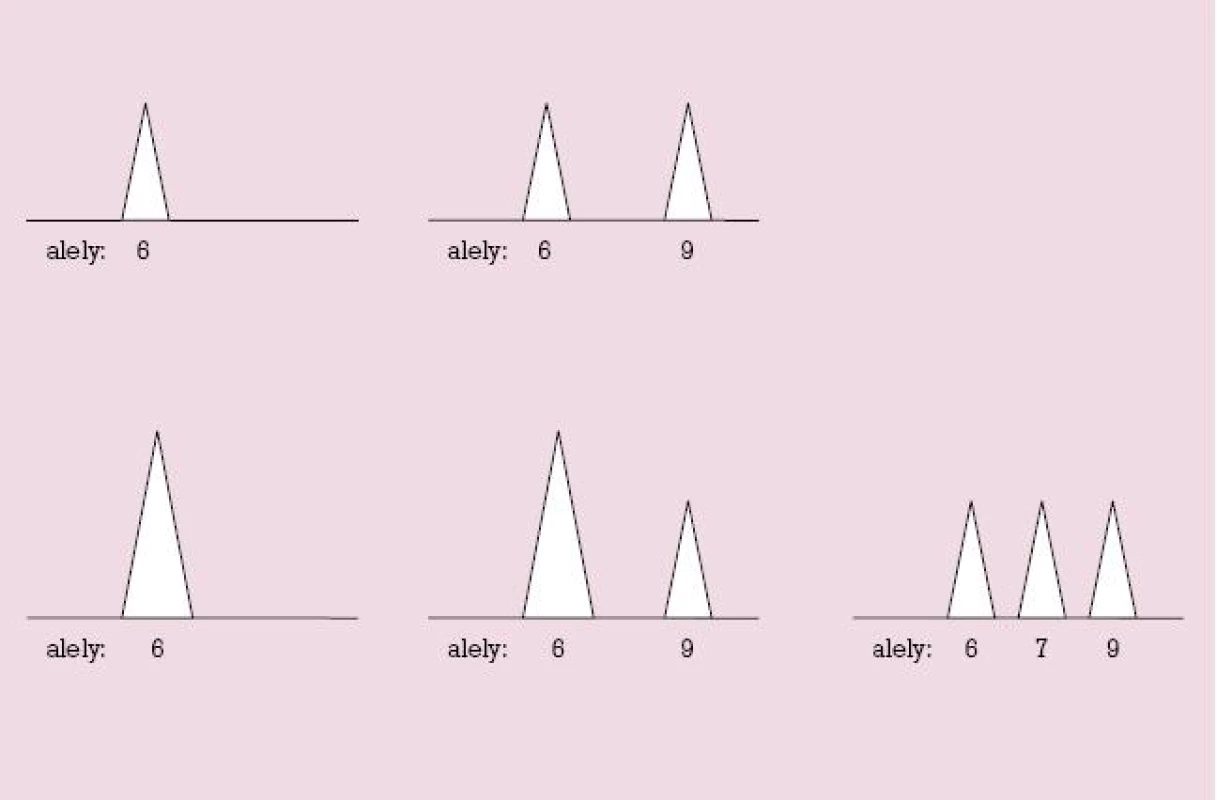
Na obrázku 1 hore sú znázornené dve možnosti usporiadania alel STR markera u jedinca s dvomi chromozómami – homozygota a heterozygota. V dolnej časti obrázku sú tri možné spôsoby usporiadania alel STR markera u jedinca s tromi chromozómami daného páru, teda u jedinca s trizómiou. Vidno, že ak je jedinec homozygotný, (monoalelický), nedokážeme rozlíšiť, či má dva alebo tri chromozómy, teda daný marker je neinformatívny. Informatívne sú preto také STR markery, pre ktoré existuje veľký počet rozličných alel, lebo vtedy je v populácii veľa heterozygotov, kým (neinformatívni) homozygoti sú zriedkaví.
V praxi sa postupuje tak, že na každom chromozóme, ktorého aneuploídie diagnostikujeme, sa vyšetria najmenej štyri STR markery, pričom najmenej dva z nich musia byť informatívne, aby bola diagnóza spoľahlivá. Ak tieto štyri markery nestačia (napr. tri, či dokonca všetky štyri sú neinformatívne), je potrebné vyšetriť ďalšie STR markery z daného chromozómu. Keďže v súčasnosti sú známe na každom chromozóme desiatky STR markerov, nie je to zvyčajne problém.
Výsledky
V období 5/ 2007 až 8/ 2008 sme vyšetrili metódou QF PCR pomocou kitu AneufastTM (molGENTIX, S.L) 184 vzoriek plodovej vody. Z 1 ml plodovej vody sme extrahovali DNA. Izoláciu sme uskutočnili kitom Chelex - 100 (BIORAD) podľa protokolu s malými modifikáciami. Použili sme vysokopolymorfné STR markery pre chromozómy 21, 18, 13, X a Y. Po amplifikácii prebehlo 28 cyklov v termocykleri (2720 THERMAL CYCLER AB) Analýzu QF PCR produktov sme uskutočnili na prístroji ABI Prism 310 GENETIC analyser. V dvoch prípadoch bola viacplodová tehotnosť (1× gemini monoamniales monochoriales a 1× gemini biamniales bichoriales). Monoamniálne monochoriálne gemini vznikajú rozdelením jednej zygoty, považovali sme ich preto za geneticky identické, tj. za jedného pacienta. Priemerné vekové zloženie súboru predstavovalo 33,3 r. (najmladšia pacientka 17 r., najstaršia 44 r.). Odber plodovej vody bol uskutočňovaný priemerne v 18,5 týždni, pričom najskorší termín bol v 14. týždni a najneskorší v 23. gestačnom týždni. V 122 prípadoch sa odber plodovej vody uskutočnil v ŽNaP Novapharm s. r. o. v rámci jednodňovej gynekologickej starostlivosti, vo zvyšných 62 prípadoch sme vzorku plodovej vody dostali z bratislavských a mimobratislavských pracovísk. Po 22. gestačnom týždni bolo vykonaných 23 DNA analýz vzoriek plodovej vody. V prípade zlyhania dlhodobej kultivácie na iných pracoviskách sme v 4 prípadoch analyzovali záložné vzorky plodovej vody po 21 týždni gravidity. V 40 % (74/ 184) prípadov prebehla súčasne dlhodobá kultivácia, ktorá reziduálnu patológiu neodhalila (tab. 1).
Tab. 1. Indikácie k odberu plodovej vody. 
T 21 – trizomia 21. chromozómu T 18 – trizómia 18. chromozómu ICSI – intracytoplazmatická spermatická injekcia CHA – chromozómová aberácia V našom súbore 184 vzoriek sme zachytili 9 patologických chromozómových nálezov (4,9 %). Všetky probandky sa rozhodli pre termináciu gravidity. V prípadoch, keď neprebiehala dlhodobá kultivácia amniocytov, sme pri diagnostike Downovho syndrómu u oboch partnerov indikovali stanovenie karyotypu na vylúčenie prenášateľstva zriedkavej translokačnej formy tohto syndrómu.
V troch prípadoch pri masívnej kontaminácii vzorky plodovej vody maternálnou krvou bola DNA analýza neúspešná. Jedna pacientka opakovanie odberu plodovej vody odmietla (tab. 2).
Tab. 2. Chromozómová patológia podľa indikačných skupín. 
CHA – chromozómová aberácia BS – biochemický skríning NTD – defekt neurálnej trubice NB – nosová kostička NT – šijové prejasnenie V dvoch prípadoch sme zachytili patológiu z indikácie UZ marker chromozómovej aberácie, pričom biochemický screening v II. trimestri bol negatívny. U jednej tehotnej sme diagnostikovali trizómiu 21 v 23. gestačnom týždni.
Manažment starostlivosti
Tehotná prichádza na naše pracovisko, kde absolvuje klinicko genetickú konzultáciu, tj. je indikovaná k prenatálnej genetickej diagnostike. V prípade pozitívneho biochemického screeningu v ambulancii primárnej praxe, ak to gestačný týždeň umožňuje, treba biochemický screening opakovať na akreditovanom pracovisku akreditovanou metódou. V prípade negatívneho výsledku pacientku vyšetrí UZ konziliár – konzultant. Na základe výsledkov a so súhlasom pacientky, nastáva rozhodnutie o eventuálnej invazívnej diagnostike. Na rozhodovacom procese participuje lekár materno - fetálnej medicíny, UZ konziliár – konzultant, klinický genetik. Súčasťou indikácie je rozhodnutie o diagnostickom postupe, tj. rozhodnutie o DNA diagnostike samostatne, prípadne súčasne prebieha dlhodobá kultivácia amniocytov. V každej vzorke plodovej vody stanovujeme hladinu alfa fetoproteínu (Eclia, Roche Diagnostics GmbH, Mannheim). V deň indikácie je možné uskutočniť odber plodovej vody. Probadka o 2 hod po odbere odchádza domov, do 3 pracovných dní, spravidla do 24 hod je telefonicky informovaná o výsledku rýchlej prenatálnej diagnostiky. Týždeň po amniocentéze pacientka absolvuje morfologické UZV a dostáva písomný záver DNA diagnostiky.
Vzorku plodovej vody je možné takisto zaslať z iného odberového pracoviska spolu s indikáciou od klinického genetika a identifikačnými údajmi o pacientke.
Diskusia
QF PCR je spoľahlivá a presná metóda, ktorá neomylne diagnostikuje trizómiu chromozómov 13, 18, 21, pohlavných chromozómov a polyploidiu. Hlavnou výhodou QF PCR je, že počas 24 – 36 hod od odberu vzorky môžeme informovať rodičov o výsledku. V prípade normálneho výsledku redukujeme ich úzkosť, v prípade diagnostiky závažnej chromozómovej patológie môže byť gravidita skoro ukončená. Pri neúspešnej kultivačnej metóde je možné vyšetrenie záložnej vzorky metódou QF PCR, čím sa vyhneme opakovaniu invazívneho zákroku.
Limitujúcim faktorom metódy je, že detekuje hlavné chromozómové aneuploídie. Metóda nemôže zachytiť zriedkavé trizómie, a štruktúrové aberácie iných, ako uvedených chromozómov. Vo vybraných prípadoch by takáto diagnostika bola možná pridaním cielených STR markerov.
Metóda FISH nekultivovaných buniek plodovej vody je alternatívou rýchlej prenatálnej diagnostiky. Oproti QF PCR má niekoľko nevýhod. Vzorky plodovej vody kontaminované maternálnou krvou nie je možné metódou FISH jednoznačne vyhodnotiť [10 – 11]. QF PCR je mimoriadne citlivá, už 0,5 ml plodovej vody spravidla stačí na diagnostiku. Pomocou automatizovaného DNA analyzátora môže jeden pracovník vyšetrovať súčasne niekoľko desiatok vzoriek naraz (počet závisí od typu analyzátora). FISH metóda je pracnejšia, po štandardnej hybridizácii je potrebné individuálne mikroskopické vyšetrenie každej vzorky (približne 0,5 h/ 1 vzorku) [12]. QF PCR je navyše schopná pri viacpočetnej gravidite pomocou analýzy STR profilu vyšetriť zygótnosť plodov [13].
Aneuploídia chromozómov 21, 13, 18 a pohlavných chromozómov predstavuje väčšinu patológie v II. trimestri gravidity. Najčastejšie sú tie anomálie chromozómov, ktorých frekvencia sa zvyšuje s vekom tehotnej a sú výsledkom non - disjunkcie, tj. trizómie alebo monozómie buď v čistej línii, alebo v mozaikovej forme.
Na posúdenie reziduálnej patológie tj. patológie, ktorú QF PCR nezachytí, bolo vypracovaných niekoľko veľkých prospektívnych [20 – 21] a retrospektívnych štúdií [19,22 – 23]. Reziduálnu patológiu možno rozdeliť na: 1. patológiu s potenciálne klinickým významom – de novo balansované chromozómové prestavby, nebalansované chromozómové prestavby, zriedkavé trizómie ostatných chromozómov a marker chromozómy a na 2. patológiu bez klinického významu – balansované chromozómové prestavby, markery familiárneho pôvodu, balansované Robertsonovské prestavby de novo). Výška reziduálneho rizika závisí od samotnej indikácie k prenatálnej genetickej diagnostike. Pri indikácii pozitívny biochemický screening pre T 21 výška klinicky významného reziduálneho rizika predstavuje 0,06 % (1/ 1659) prípadov. Treba brať v úvahu, že reziduálne riziko sa zvyšuje na 0,12 % (1/ 833), ak boli u plodu prítomné anomálie, alebo v skupine s nejasnou prognózou. (Súbor 32 674 tehotných) [24]. Pri indikácii k prenatálnej genetickej diagnostike je nevyhnutné informovať tehotnú o možnostiach a limitáciách rýchlej prenatálnej diagnostiky, a následne zvoliť QF PCR samostatne, alebo duálne s dlhodobou cytogenetickou analýzou.
V súčasnosti neexistuje jednoznačný pohľad na miesto QF PCR v prenatálnej diagnostike. Niektorí autori navrhujú používať QF PCR ako doplňujúci test ku konvenčnej cytogenetickej analýze na zníženie anxiozity tehotnej [15 – 16]. Naopak vo Veľkej Británii je pri špecifických indikáciách akceptovateľné nahradenie kultivačnej metódy samotnou QF PCR aneuploídií. K obdobnému názoru sa klonia aj autori Mann [17] a Putzová [14]. Pri prenatálnej diagnostike je dôležité používanie individuálneho prístupu. Tehotné s abnormálnym ultrazvukovým nálezom plodu alebo s chromozómovou prestavbou v rodine vyžadujú chromozómovú analýzu. Tehotným s pozitívnym biochemickým screeningom pre T 21, s vekovou indikáciou, a s psychologickou indikáciou navrhujú absolvovať QF PCR samotnú [18 – 19].
Záver
Rýchla prenatálna diagnostika aneuploídií metódou QF PCR je metódou, ktorá bola na Slovensku úspešne zavedená. Má slúžiť pri odhaľovaní závažnej chromozómovej patológie v indikovaných prípadoch. Jej úlohou nie je a ani nemôže byť nahradenie dlhodobej kultivácie a analýzy chromozómov. Svoje miesto valídnej metódy si našla v mnohých európskych centrách [15,25 – 26]. Čas ukáže, ako sa uplatní v našej klinickej praxi.
MUDr. Katarína Melišová, CSc.1
doc. RNDr. Vladimír Ferák, CSc.2
doc. MUDr. Michal Ondrejčák, CSc., MPH1
doc. MUDr. Jaroslav Hinšt, CSc., mim. prof. 3
MUDr.Peter Kleskeň, CSc., MPH.3
RNDr. Ján Matušek2
1 Oddelenie klinickej genetiky ŽNaP NOVAPHARM s. r. o. Bratislava
2 DNA TEST s. r. o. Bratislava
3 I. gynekologicko-pôrodnícka klinika SZU a FNsP Bratislava
Zdroje
1. Steele MV, Breg VR jr. Chromosome analysis of human amniotic fluid cells. Lancet 1966; 1 : 383 – 385.
2. Valenti C, Schutta EF, Kehaty T. Cytogenetic diagnosis of Down’s syndrome in utero. Am J Med Assoc 1969; 207 : 1513.
3. Ondrejčák M. Prenatálna cytogenetická diagnostika z buniek plodovej vody. Lek Obzor 1985; 34(6): 329 – 333.
4. von Eggeling F, Freytag M, Fahsold R et al. Rapid detection of trisomy 21 by quantitative PCR. Hum Genet 1993; 91(6): 567 – 570.
5. Divane A, Carter NP, Spathas DH et al. Rapid prenatal diagnosis of aneuploidy from unculltured amniotic fluid cells using five – colour fluorescence in situ hybridization. Prenat Diagn 1994; 14(11): 1061 – 1069.
6. Pertl B, Yau SC, Sherlock J et al. Rapid molecular method for prenatal detection of Down’s syndrome. Lancet 1994; 343 : 1197 – 1198.
7. Kuo WL, Temjin H, Segraves R et al. Detection of aneuploidy involving chromosomes 13, 18 and 21 by fluorescence in situ hybridization (FISH) to interphase and metaphase amniocytes. Am J Hum Genet 1991; 49(1),: 112 – 119.
8. Roberts E, Ely A, Hulten M et al. The impact of FISH/ PCR technology on routine prenatal diagnosis for chromosome abnormality. Cytogenet Cell Genet 1999; 85 : 57 – 58.
9. Leung WC, Chitayat D, Seaward G et al. Role of amniotic fluid interphase fluorescence in situ hybridization (FISH) analysis in patient management. Prenat Diagn 2001; 21(4): 327 – 332.
10. Bryndorf T, Christensen B, Vad M et al. Prenatal detection of chromosome aneuploidies by fluorescence in situ hybridization: experience with 2000 uncultured amniotic fluid samples in a prospective preclinical trial. Prenat Diagn 1997; 17(4): 333 – 341.
11. Eiben B, Trawicki W, Hammans W et al. Rapid prenatal diagnosis of aneuploidies in uncultured amniocytes by fluorescence in situ hybridization. Evaluation of ≥ 3,000 cases. Fetal Diagn Ther 1999; 14(4), 193 – 197.
12. Witters I, Devriendt K, Legius E et al. Rapid prenatal diagnosis of trisomy 21 in 5049 consecutive uncultured amniotic fluid samples by fluorescence in situ hybridisation (FISH). Prenat Diagn 2002; 22(1): 29 – 33.
13. Chen CP, Chern SR, Wang W. Rapid determination of zygosity and common aneuploidies from amniotic fluid cells using quantitative fluorescent polymerase chain reaction following genetic amniocentesis in multiple pregnancies. Hum Reprod 2000; 15(4): 929 – 934.
14. Putzova M, Soldatova I, Pecnova L et al. QF‑PCR‑based prenatal detection of common aneuploidies in the Czech population: five years of experience. Eur J Med Genet 2008; 51(3): 209 – 218.
15. Levett LJ, Liddle S, Meredith R. A large scale evaluation of amnio‑PCR for the rapid prenatal diagnosis of fetal trisomy. Ulrasound Obstet Gynecol 2001; 17(2): 115 – 118.
16. Billi C, Divane A, Apessos A et al. Prenatal diagnosis of common aneuploidies using quantitative fluorescent PCR. Prenat Diagn 2002; 22(5): 360 – 365.
17. Mann K, Fox SP, Abbs SJ et al. Development and implementation of a new rapid aneuploid diagnostic service within the UK National Health service and implication for the future of prenatal diagnosis. Lancet 2001; 358 : 1057 – 1061.
18. Ogilvie CM. Prenatal diagnosis for chromosome abnormalities: past, present and future. Path Biol 2003; 51(3): 156 – 160.
19. Leung WC, Lau ET, Lao TT et al. Rapid aneuploidy screening (FISH or QF‑PCR): the changing scene in prenatal diagnosis? Expert Rev Mol Diagn 2004; 4(3): 333 – 337.
20. Homer J, Bhatt S, Huang B et al. Residual risk for cytogenetic abnormalities after prenatal diagnosis by interphase fluorescence in situ hybridization (FISH). Prenat Diagn 2003; 23(7): 566 – 571.
21. Cirigliano V, Voglino G, Marongiu A et al. Rapid prenatal diagnosis by QF‑PCR: Evaluation of 30,000 consecutive clinical samples and future application. Ann NY Acad Sci 2006; 1075 : 288 – 298.
22. Evans MI, Henry GP, Miller WA et al. International, collaborative assessment of 146,000 prenatal karyotypes: expected limitations if only chromosome - specific probes and fluorescent in‑situ hybridization are used. Hum Reprod 1999; 14(5): 1213 – 1216.
23. van Zwieten MC, Willems DL, Litjens LL et al. How unexpected are unecpected findings in prenatal cytogenetic diagnosis? A literature review. Eur J Obstet Gynecol Reprod Biol 2005; 120(1): 15 – 21.
24. Ogilvie CM, Lashwood A, Chitty L et al. The future of prenatal diagnosis: rapid testing or full karyotype? An audit of chromosome abnormalities and pregnancy outcomes for women referred for Down’s syndrome testing. Br J Obstet Gynecol 2005; 112(10): 1369 – 1375.
25. Schmidt W, Jenderny J, Hecher K et al. Detection of aneuploidy in chromosomes X, Y, 13, 18 a 21 by QF‑PCR in 662 selected pregnancies at risk. Mol Hum Reprod 2000; 6(9): 855 – 860.
26. Cirigliano V, Ejarque M, Canadas MP et al. Clinical application of multiplex quantitative fluorecsent polymerase chain reaction (QF‑PCR) for the rapid prenatal detection of common chromosome aneuploidies. Mol Hum Reprod 2001; 7(10): 1001 – 1006.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2009 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Úvodní slovo
- Edukační kazuistika
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Molekulovo- genetická analýza tumorsupresorových génov PTEN a TP53 u pacientky s karcinómom endometria
- Biologická léčba karcinomu prsu
- Tradiční peruánská medicína v léčbě neplodnosti
- Rýchla prenatálna diagnostika chromozómových aneuploidií
- Porodní plán
- Northwestern University’s Feinberg School of Medicine Northwestern Memorial Hospital – Department of Obstetrics and Gynecology Chicago, USA Termín: 5.– 26. září 2009
- 5th International Symposium on Diabetes and Pregnancy
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



