-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Perspektiva zobrazování duktálního adenokarcinomu pankreatu pomocí 68Ga-analogů neurotenzinu
Perspective of pancreatic ductal adenocarcinoma imaging with 68Ga neurotensin analogues
Cells of pancreatic ductal adenocarcinoma (PDAC) express neurotensin receptors. Preclinical trials have successfully shown that neurotensin analogues have the potential for PET imaging of PDAC. Based on the published data, NTR-1 is promising target for the development of radioactive analogues for both imaging and therapy in patients with primary and metastatic pancreatic ductal adenocarcinoma. However, the first in vivo studies using 68Ga DOTA-NT-20.3 in patients did not image PDAC tumours in all cases with very high contrast to surrounding tissue. Peptid research in the field of neurotensin analogues continues in an effort to further enhance the affinity of PET peptide radiopharmaceuticals for neurotensin receptors.
Keywords:
PET/CT – ancreatic cancer – neurotensin – in vivo human study
Autoři: Marina Hodolič 1,3; Feng Wang 2; Wenyu Wu 2; Pavel Koranda 3
Působiště autorů: Nuclear Medicine Research Department IASON, Graz, Austria, 2 Department of Nuclear Medicine, Nanjing First, Hospital, Nanjing, Medical University, Nanjing, China, 3 Klinika nukleární medicíny, LF UP Olomouc, ČR 1
Vyšlo v časopise: NuklMed 2021;10:63-67
Kategorie: Přehledová práce
Souhrn
Buňky duktálního adenokarcinomu pankreatu (PDAC) exprimují neurotenzinové receptory. Preklinické testy úspěšně ukázaly, že analogy neurotenzinu značené radionuklidy mají potenciál pro PET zobrazování duktálního adenokarcinomu pankreatu. První in vivo vyšetření pacientů s užitím 68Ga DOTA-NT-20.3 však na rozdíl od preklinických studií nezobrazily nádory PDAC ve všech případech s vysokým kontrastem vůči okolí. Pro praktické užití bude tedy nutno pokračovat v nadějném výzkumu na poli analogů neurotenzinu se snahou modifikovat postupy s cílem dále zvýšit afinitu peptidových radiofarmak k neurotenzinovým receptorům.
Klíčová slova:
PET/CT – adenokarcinom pankreatu – neurotenzin – in vivo studie
Úvod
Incidence rakoviny pankreatu vzrůstá 1 a přitom pouze 5% pětileté přežívání ukazuje, že prognóza u pacientů s rakovinou pankreatu se za posledních 20 let významně nezlepšila. 2 Většina pacientů s rakovinou pankreatu i v raně symptomatickém stadiu má neresekovatelné nádory a progreduje do metastatického nebo lokálně pokročilého onemocnění. Chirurgie může být nejlepší volbou s přibližně 20% přežitím po 5 letech. 2
Zcela základní roli v diagnostice karcinomu pankreatu má endoskopická sonografie (EUS) s biopsií s diagnostickou přesností 95 %. 2 Potenciální účelem zobrazování u pacientů s rakovinou pankreatu je stážování nádoru, spoluúčast při plánování radioterapie nebo chirurgického výkonu, hodnocení odpovědi na léčbu a sledování recidivy. U pacientů s duktální dilatací nebo s podezřením na rakovinu pankreatu považuje doporučení NCCN vyšetření CT a MRI za zobrazovací metody první volby. 3
PET/CT je v onkologii široce používána kvůli své vysoké citlivosti pro detekci 18F-FDG avidních nádorových lézí. Diagnostická přesnost tohoto vyšetření je však omezena nespecifičností při rozlišování zánětlivých a maligních procesů. Současné pokyny Evropské společnosti pro lékařskou onkologii uvádějí, že 18F-FDG PET/CT v současné době nepřidává mnoho stagingových informací u většiny pacientů s resekovatelným onemocněním a nelze je doporučit. 2 Novější PET radiofarmaka pro charakterizaci pankreatických lézí zahrnují inhibitor proteinu aktivujícího fibroblasty značený 68Ga (68Ga-FAPI).
V posledních desetiletích bylo identifikováno několik peptidových receptorů jako potenciální diagnostické a terapeutické cíle. Nadměrná exprese neurotenzinových receptorů na pankreatickém duktálním adenokarcinomu (PDAC) nabízí příležitosti pro zobrazovací a peptidově zaměřenou terapii.
Neurotenzin a neurotenzinové receptory u duktálního karcinomu prostaty
Peptid neurotenzin (NT) byl izolován z hovězího hypotalamu Carrawayem a kol. v roce 1973. Neurotenzin je distribuován v centrálním nervovém systému s nejvyššími hladinami v hypotalamu, amygdale a nucleus accumbens. Vyvolává řadu účinků, včetně analgezie, hypotermie a zvýšené pohybové aktivity. Podílí se také na regulaci dopaminových drah. Na periferii se neurotenzin nachází v enteroendokrinních buňkách tenkého střeva, kde vede k sekreci a kontrakci hladkého svalstva. 4,5
NT je účinný také jako mitogen nejen u kolorektálního karcinomu, ale stimuluje růst i karcinomu prostaty, pankreatu, prsu, hepatocelulárního karcinomu, nemalobuněčného karcinomu plic a gliomů. 6–12
Jako hormon se neurotenzin účastní každého kroku progrese rakoviny, od buněčné transformace, proliferace a přežití maligních buněk až po metastatické šíření. NT přitom působí prostřednictvím NT receptoru (NTR). Pomocí in vitro autoradiografie byl NTR poprvé popsán v roce 1998. Jak ukazuje buněčné barvení, NTR je přítomen hlavně na plazmatické membráně. Studie in vitro na buněčné linii duktálního adenokarcinomu pankreatu pak ukázaly, že NT indukuje syntézu DNA a buněčnou proliferaci prostřednictvím proteinkinázy C 13, která zprostředkovává mitogenní signalizaci. Komplex ligand-NTR je rychle internalizován a degradován na lysozomy prostřednictvím váčků potažených clathrinem. 14 Byly klonovány tři podtypy NTR: NTR-1 (vysoce afinitní NTR), NTR-2 (nízkoafinitní NTR) a NTR-3 (Sortilin 1), přičemž NTR-1 je nejčastěji exprimovaný NTR. NTR-2 je 64% homologní s NTR-1. NTR-3 není specifický pro NT a váže různé ligandy.
Vysoká exprese NTR-1 byla pozorována u různých nádorů. 6–12 Imunohistochemicky byla potvrzena vysoká míra exprese NTR-1 v PDAC, NTR-1 je přítomen v 75 % až 90 % PDAC. 14–16 Proměnlivá přítomnost NTR-1 je s největší pravděpodobností způsobena různým množstvím nenádorových NTR-1 negativních buněk v PDAC, včetně mezenchymálních buněk a stromatu. Abnormální exprese NTR-1 se objevuje již v raných stádiích transformace maligních buněk 17, ale neexistuje korelace mezi expresí NTR-1 a agresivitou nádoru. Nijak se neliší u dobře nebo středně diferencovaných (stupně 1 a 2) a špatně nebo nediferencovaných (stupně 3 a 4) PDAC. 5 Hladiny mRNA NTR-1 jsou však vyšší u pokročilých (stádia III a IV) než u časných nádorů PDAC. 18 Exprese NTR-1 v PDAC je mnohem vyšší než v neuroendokrinních pankreatických nádorech, normální slinivce břišní nebo chronické pankreatitidě. Normální pankreas neexprimuje NTR. Dle autoradiografie při pankreatitidě exprimuje 22,7 % vzorků tkáně NTR. 19,22 Inzulinom exprimuje NTR-1 pouze v 33,3 % případů. 19 Uvedené skutečnosti mohou pomoci vyřešit nejčastější PET zobrazovací problém – tj. rozlišení benigních a maligních pankreatických lézí. Na základě relativní selektivity exprese NTR-1 v PDAC může být NTR použit jak pro diagnostiku, tak pro terapeutické cílení.
Diagnostika duktálního adenokarcinomu pankreatu radioaktivně značenými analogy neurotenzinu – preklinické údaje
NT je peptid o 13 aminokyselinách. Carboxy-konec NT (8-13) představuje zkrácenou sekvenci přirozeného agonisty NT. Úpravou této sekvence byla vyrobena celá řada zobrazovacích i teranostických látek s afinitou k NTR-1. 20 Chemicky modifikované deriváty přirozeně se vyskytujícího NT lze značit radionuklidy emitujícími záření gama (111In, 67Ga) nebo pozitrony (64Cu, 89Zr, 44Sc a 68Ga) a účinně je používat v diagnostické nukleární medicíně, přitom stabilita analogu NT in vivo má zásadní vliv na absorpci nádorem.
Při preklinické studii byl použit NT peptidový fragment 6-13, Ac-Lys (DOTA)-Pro-Arg (NCH3)-Arg-Pro-Tyr-Tle-Leu, vhodně modifikovaný a chelatovaný pomocí DOTA (Obr. 1). Uvedená sloučenina, která dostala název DOTA-NT-20.3 (IASON GmbH, Graz, Rakousko), je označitelná pomocí 68Ga.
Obr. 1. 68Ga-DOTA-NT-20.3 (Ac-Lys(DOTA)-Pro-Me-Arg-Arg-Pro-Tyr-Tle-Leu-OH). 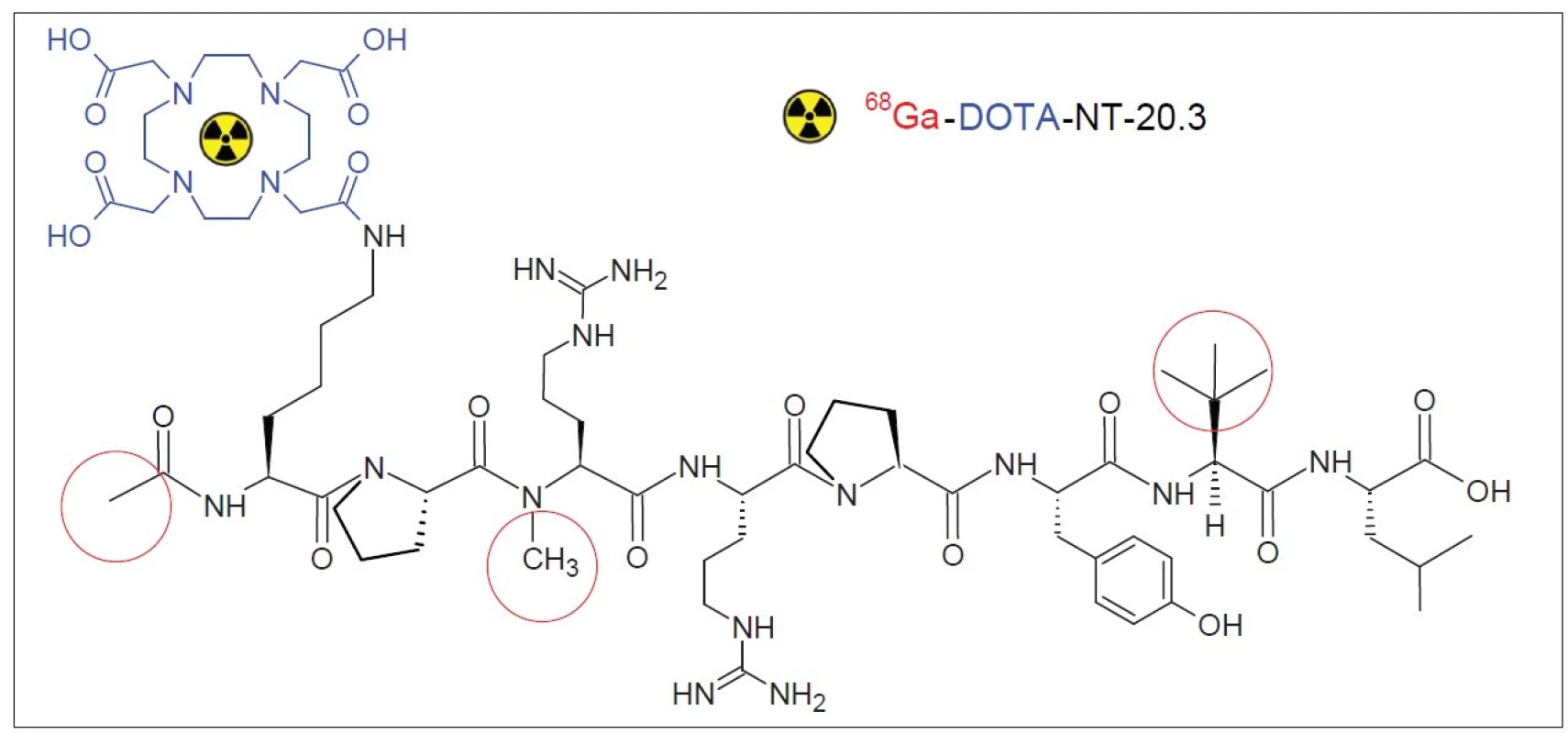
Před použitím radioaktivně značených analogů NT u lidí byly provedeny experimenty s buněčnými liniemi a zvířaty. Byla přitom syntetizována řada NT analogů značených 18F a 68Ga 21–23, ale pouze některé z nich byly testovány v tkáňových kulturách PDAC a na zvířatech. Nejběžnějšími buňkami PDAC testovanými na expresi NTR jsou AsPC-1, Panc-1 a SW1990. Imunohistochemické barvení ukázalo silnou expresi NTR-1 jak na AsPC-1, tak na Panc-1 xenograftové nádorové tkáni, zatímco exprese na buňkách SW1990 je mnohem nižší. Proto byla studována absorpce analogu NT 68Ga-DOTA-NT-20.3 na buňkách AsPC-1. 24 AsPC-1 byl odvozen z nahých myších xenoštěpů založených na užití buněk z ascitu pacienta s PDAC. Křivka čas – aktivita ukázala rychlé vychytávání 68Ga-NT-DOTA-20.3 buňkami AsPC-1 v čase od 40 minut do 60 minut (plató bylo dosaženo po 80 minutách). Tyto předběžné výsledky in vitro naznačovaly, že se jedná o radiofarmakum s potenciálem pro zobrazování rakoviny pankreatu in vivo.
Po prokázání vazebné afinity k buněčným liniím byla i na zvířecím modelu úspěšně použit NT analog značený 68Ga. Skupina z Francie ukázala, že na rozdíl od 18F-FDG může 68Ga-DOTA-NT-20.3 odlišit PDAC od pankreatitidy u myší 23, což by mohlo řešit nespecificitu 18F-FDG PET – omezenou schopnost odlišit malignitu od zánětu. Navíc 68Ga-DOTA-NT-20.3 poskytl vysoce kvalitní PET skeny s vysokou absorpcí radiofarmaka nádorem při nízké četnosti aktivity v pozadí a rychlé renální clearanci.
Na základě těchto údajů bylo možno uzavřít, že 68Ga-DOTA -NT-20.3 vykazuje vysokou vazebnou afinitu k buňkám rakoviny pankreatu AsPC-1 24 a na myších modelech může rozlišovat PDAC od pankreatitidy. 25
Diagnostika duktálního adenokarcinomu pankreatu radioaktivně značenými analogy neurotenzinu – in vivo klinické údaje
První humánní použití 68Ga-DOTA-NT-20.3 26 bylo provedeno v souladu se zásadami Helsinské deklarace. Schválení bylo uděleno etickou komisí v Nanjing First Hospital v Číně dne 11. prosince 2019. Do pilotní studie byli zavzati tři pacienti s histologicky potvrzeným PDAC: jeden pacient měl nemetastatický PDAC a dva měli PDAC s jaterními metastázami. Přítomnost NTR ve vzorcích PDAC byla prokázána imunohistochemicky a všechny nádory exprimovaly NTR. Po aplikaci 68Ga-DOTA-NT-20.3 nedošlo k žádným fyziologickým změnám (sledováno EKG, krevní tlak, srdeční frekvence, respirační frekvence a tělesná teplota), nevyskytly se žádné nežádoucí účinky.
U jednotlivých pacientů byla stanovena absorbovaná dávka v jednotlivých orgánech, celková efektivní dávka byla 2.2 mSv, 2.4 mSv a 3.5 mSv. Tato pilotní studie u pacientů s PDAC prokázala, že PET radiofarmakum 68Ga-DOTA-NT-20.3 je bezpečné a dobře snášené a že jej lze použít ke zkoumání exprese NTR-1 u pacientů s pankreatickým duktálním adenokarcinomem a potenciálně i u jiných malignit exprimujících neurotenzinové receptory.
Bohužel ložiska nádoru se nezobrazila u všech 3 zkoumaných pacientů dostatečně kontrastně, aby byl ve všech případech dosažen předpoklad obecně dobré sensitivity PET/CT vyšetření (Obr. 2).
Obr. 2. CT a 68Ga-DOTA-NT- 20.3 PET pacienta 1 s PDAC vykazuje jen mírně zvýšenou akumulaci radiofarmaka v tumoru (Department of Nuclear Medicine, Nanjing First Hospital, Nanjing, Medical University, Nanjing, China). 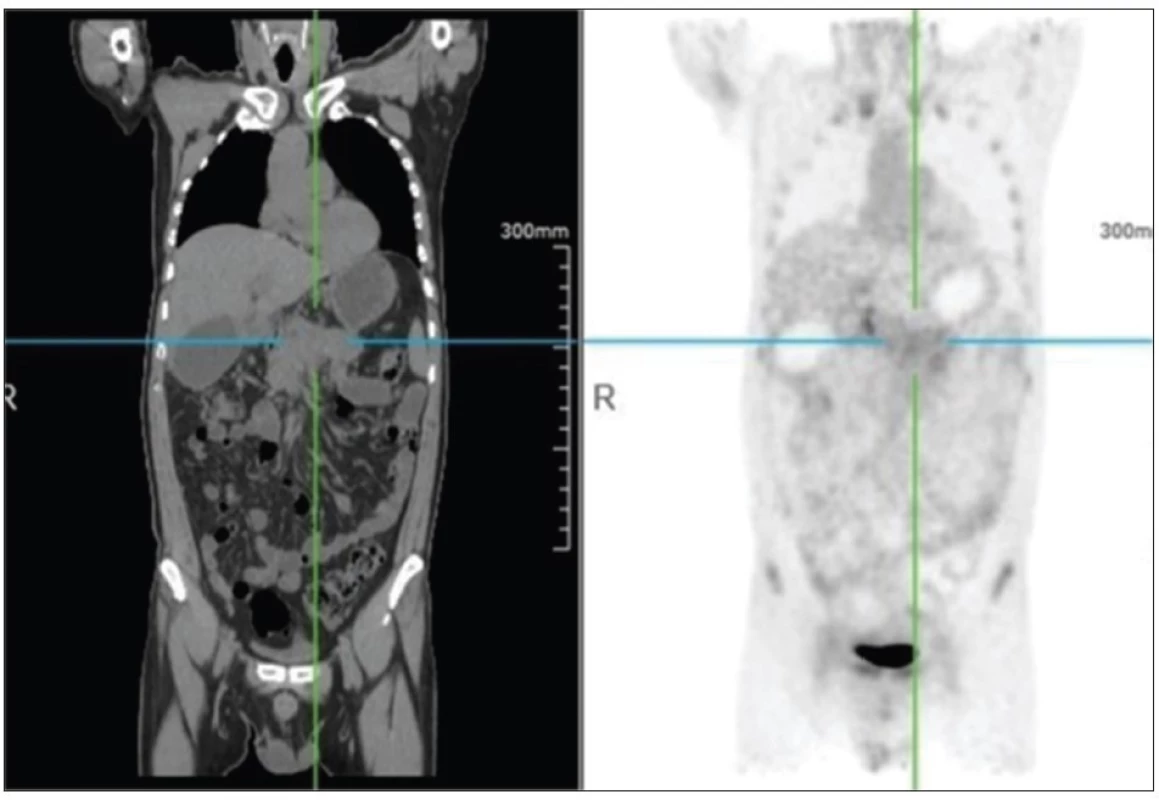
Závěr
Analogy neurotenzinu značené radionuklidy mají význam pro PET zobrazování duktálního adenokarcinomu pankreatu v případě exprese neurotenzinu v tomto tumoru. Významný potenciál mají tato radiofarmaka i pro oblast teranostiky. Na rozdíl od preklinických studií nebyla však při pilotní PET/CT in vivo studii prokázána u všech 3 zkoumaných pacientů zcela dostatečná, klinicky významná akumulace 68Ga DOTA-NT-20.3 a k ověření tohoto diagnostického konceptu jsou nutné další studie.
Zdroje
- Siegel RL, Miller KD, Jemal A. Cancer statistics. CA Cancer J Clin 2019;69 : 7-34
- Ducreux M, Cuhna AS, Caramella C, et al. Cancer of the Pancreas: ESMO Clinical Practice Guidelines. Ann Oncol 2015;26 : 56-68
- National Comprehensive Cancer Network Website. NCCN guidelines version 1.2012: pancreatic adenocarcinoma. Available via [online]. 2011. [cit. 2021-05-22]. Dostupné na: http://nccn.org/professionals/physician_gls/pdf/pancreatic.pdf.
- Sakamoto T, Newman J, Fujimura M, et al. Role of neurotensin in pancreatic secretion. Surgery 1984;96 : 146 –153
- Thor K, Rosell S. Neurotensin increases colonic motility. Gastroenterology 1986;90 : 27–31
- Alifano M, Souazé F, Dupouy S, et al. Neurotensin receptor 1 determines the outcome of non-small cell lung cancer. Clin Cancer Res 2010;16 : 4401-4410
- Wang JG, Li NN, Li HN, et al. Pancreatic cancer bears overexpression of neurotensin and neurotensin receptor subtype-1 and SR 48692 counteracts neurotensin induced cell proliferation in human pancreatic ductal carcinoma cell line PANC-1. Neuropeptides 2011;45 : 151-156
- Baxendale IR, Cheung S, Kitching MO, et al. The synthesis of neurotensin antagonist SR 48692 for prostate cancer research. Bioorg Med Chem 2013;21 : 4378-4387
- Yu J, Ren X, Chen Y, et al. Dysfunctional activation of neurotensin/IL-8 pathway in hepatocellular carcinoma is associated with increased inflammatory response in microenvironment, more epithelial mesenchymal transition in cancer and worse prognosis in patients. PloS One 2013;8 : 56069
- Bugni JM, Rabadi LA, Jubbal K, et al. The neurotensin receptor-1 promotes tumor development in a sporadic but not an inflammation-associated mouse model of colon cancer. Int J Cancer 2012;130 : 1798-1805
- Dupouy S, Doan VK, Wu Z, et al. Activation of EGFR, HER2 and HER3 by neurotensin/neurotensin receptor 1 renders breast tumours aggressive yet highly responsive to lapatinib and metformin in mice. Oncotarget 2014;5 : 8235-8251
- Qing Ouyang, Xueyang Gong, Hualiang Xiao, et al. Neurotensin promotes the progression of malignant glioma through NTSR1 and impacts the prognosis of glioma patients. Mol Cancer 2015;14 : 21
- Guha S, Rey O, Rozengurt E. Neurotensin induces protein kinase C-dependent protein kinase D activation and DNA synthesis in human pancreatic carcinoma cell line PANC-1. Cancer Res 2002;62 : 1632-1640
- Wu Z, Martinez-Fong D, Trédaniel J, et al. Neurotensin and its high affinity receptor 1 as a potential pharmacological target in cancer therapy. Front Endocrinol (Lausanne) 2013; doi: 10.3389/fendo.2012.00184
- Ehlers RA, Kim Sh, Zhang Y, et al. Gut peptide receptor expression in human pancreatic cancers. Ann Surg 2000;231 : 838–848
- Reubi JC, Waser B, Friess H, et al. Neurotensin receptors: a new marker for human ductal pancreatic adenocarcinoma. Gut 1998;42 : 546–550
- Ouyang Q, Zhou J, Yang W, et al. Oncogenic role of neurotensin and neurotensin receptors in various cancers. Clin Exp Pharmacol Physiol 2017;44 : 841-846
- Wang L, Friess H, Zhu Z, et al. Neurotensin receptor-1 mRNA analysis in normal pancreas and pancreatic disease. Clin Cancer Res 2000;6 : 566-571
- Yin X, Wang M, Wang H, et al. Evaluation of neurotensin receptor 1 as a potential imaging target in pancreatic ductal adenocarcinoma. Amino Acids 2017;49 : 1325-1335
- He T, Wang M, Wang H, et al. Evaluation of neurotensin receptor 1 as potential biomarker for prostate cancer theranostic use. Eur J Nucl Med Mol Imaging 2019;46 : 2199-2207
- Maschauer S, Einsiedel J, Hocke C, et al. Synthesis of a 68Ga-Labeled Peptoid−Peptide Hybrid for Imaging of Neurotensin Receptor Expression in Vivo. ACS Med Chem Lett 2010;1 : 15224-15228
- Maschauer S, Einsiedel J, Haubner R, et al. Labeling and glycosylation of peptides using click chemistry: a general approach to 18F-glycopeptides as effective imaging probes for positron emission tomography. Angew Chem Int Ed 2010;49 : 976-979
- Maschauer S, Einsiedel J, Hübner H, et al. 18F - and 68Ga-Labeled Neurotensin Peptides for PET Imaging of Neurotensin Receptor 1. J Med Chem 2016;59 : 6480-6492
- Marenco M, Lodola L, Persico MG, et al. Evidence of 68Ga-DOTA-NT-20.3 Uptake in Pancreatic Adenocarcinoma AsPC-1 Cell Line - in vitro study. Curr Pharm Biotechnol 2018;19 : 754-759
- Prignon A, Provost C, Alshoukr F, et al. Preclinical Evaluation of 68Ga-DOTA-NT-20.3: A Promising PET Imaging Probe To Discriminate Human Pancreatic Ductal Adenocarcinoma from Pancreatitis. Mol Pharm 2019;16 : 2776-2784
- Hodolic M, Wu WY, Zhao Z, et al. Safety and tolerability of 68Ga-NT-20.3, a radiopharmaceutical for targeting neurotensin receptors, in patients with pancreatic ductal adenocarcinoma: the first in-human use. Eur J Nucl Med Mol Imaging. 2020;10.1007/s00259-020-05045-w. Epub ahead of print. PMID: 33006657.
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek Dalšími jubilanty jsouČlánek Noví členové společnostiČlánek Zrušené členstvíČlánek Historický kvízČlánek Sonda do historie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2021 Číslo 4- Biochemoterapie agresivního karcinomu rekta – kazuistika z českého prostředí
- MDT Board: unikátní projekt pro lékaře pečující o pacienty s onemocněním plic a dalšími patologiemi v oblasti hrudníku
- Kolorektální karcinom a jeho léčba v pokročilém stadiu dle aktuální Modré knihy ČOS
- Idiopatická plicní fibróza a refluxní choroba: silný vztah plný nejasností
- Konverzní léčba hraničně resekabilních jaterních metastáz kombinací mFOLFOX6 + panitumumab – kazuistika
-
Všechny články tohoto čísla
- Dynamický SPECT a kvantifikace coronary flow reserve na CZT kameře
- Perspektiva zobrazování duktálního adenokarcinomu pankreatu pomocí 68Ga-analogů neurotenzinu
- Historie, současnost a budoucnost používání 68Ge/68Ga generátorů – 1. část
- Ústav nukleární medicíny 1. LF UK a VFN v Praze
- Dalšími jubilanty jsou
- Noví členové společnosti
- Zrušené členství
- Významné životní jubileum v tomto čtvrtletí slaví
- Historický kvíz
- Sonda do historie
- KoronaVIRtuální Dny nukleární medicíny
- XLII. Pracovní den Radiofarmaceutické sekce ČSNM, Husinec – Řež
- Nukleární medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dynamický SPECT a kvantifikace coronary flow reserve na CZT kameře
- Ústav nukleární medicíny 1. LF UK a VFN v Praze
- Historie, současnost a budoucnost používání 68Ge/68Ga generátorů – 1. část
- Perspektiva zobrazování duktálního adenokarcinomu pankreatu pomocí 68Ga-analogů neurotenzinu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



