-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Scintigrafie u diabetické kardiomyopatie
Scintigraphy and diabetic cardiomyopathy
Introduction:
Scintigraphy is an optimal method for molecular imaging; therefore, it is useful for evaluation of patients with metabolic disorders. Diabetic cardiomyopathy is a heart failure without evidence of coronary atherosclerosis, hypertension or valvular disease. The cause is still not fully clarified; most probably it is multifactorial and involves metabolic changes including insulin resistance, microcirculation disorder including endothelial dysfunction, autonomic neuropathy and interstitial fibrosis.Material and methods:
Scintigraphy makes possible to assess many pathophysiological processes that can participate in the progression of diabetic cardiomyopathy. Glucose, fatty acids and acetate can be used as substrates mainly in basal experiments. Scintigraphy can also be used to detect impairment of microcirculation with subsequent decrease of myocardial perfusion mainly in clinical practice. Labeled metabolic analogues of norepinephrine or direct labeling of catecholamines can be used for assessment of autonomous neuropathy.Results:
Metabolic plasticity of myocardium is impaired; there is compromised glucose utilization with increased accumulation of fatty acids. Myocardial contractility is decreased due to lower energy production; lipotoxicity causes apoptosis with subsequent myocardial fibrosis. Myocardial perfusion deficit was detected in 20 % to 40 % of asymptomatic diabetics. They also have decreased vasodilatation capacity even without impairment of epicardial vessels. Regional disorder of sympathetic innervation in diabetics was also proved.Conclusion:
Scintigraphic methods have a high diagnostic potential. They make possible timely and effective therapy. However, they should be used with caution in clinical practice and mainly in symptomatic or high-risk patients.Key words:
scintigraphy, diabetic cardiomyopathy, glucose, fatty acids, lipotoxicity
Autoři: Otto Lang
Působiště autorů: Klinika nukleární medicíny, UK 3. LF a FNKV, Praha 10
Vyšlo v časopise: NuklMed 2013;2:62-67
Kategorie: Přehledová práce
Souhrn
Úvod:
Scintigrafie je optimální metodou pro molekulární zobrazování, je tedy vhodná pro vyšetřování pacientů s me-tabolickými poruchami. Diabetická kardiomyopatie se klinicky projevuje jako srdeční selhání bez přítomnosti koronární aterosklerózy, hypertenze či chlopenní vady. Její příčina není zcela objasněna, nejspíše je multifaktoriální s podílem poruchy buněčného metabolismu včetně inzulinové rezistence, poškození mikrocirkulace či endoteliální dysfunkce, autonomní neuropatie a intersticiální fibrózy.Materiál a metody:
Scintigrafie umožňuje sledovat řadu patofyziologických mechanismů, které se mohou na rozvoji diabetické kardiomyopatie podílet. V experimentu se jedná především o poruchy buněčného metabolismu. Ze substrátů lze použít glukózu, mastné kyseliny, acetát. Scintigrafické metody jsou také vhodné pro diagnostiku poruchy mikrocirkulace s následnou poruchou prokrvení myokardu. K tomu slouží zejména perfuzní radiofarmaka nejvíce používaná v rutinní klinické praxi. Pro vyšetřování poruch autonomní inervace se používají metabolická analoga noradrenalinu nebo přímé značení katecholaminů.Výsledky:
U diabetiků je narušena metabolická plasticita myokardu, snižuje se schopnost utilizace glukózy se zvýšeným hromaděním mastných kyselin. To má za následek poruchu funkce myocytů. Jednak dochází ke snížení produkce energie se snížením kontraktility, jednak se zvyšuje lipotoxicita vedoucí až k apoptóze s následnou fibrózou myokardu. Prokázaná porucha prokrvení myokardu se vyskytuje u 20 - 40 % asymptomatických diabetiků. Rovněž se u diabetiků prokázala snížená vasodilatační kapacita i bez postižení epikardiálních tepen. U diabetiků byla rovněž prokázaná změna regionální distribuce sympatické inervace v myokardu levé komory.Závěr:
Scintigrafické metody mají velký diagnostický potenciál. Mohou umožnit včasné zahájení efektivní léčby. V klinické praxi se však musí používat uvážlivě a cíleně zejména u symptomatických a vysoce rizikových pacientů.Klíčová slova:
scintigrafie, diabetická kardiomyopatie, glukóza, mastné kyseliny, lipotoxicitaÚvod
Diabetická kardiomyopatie (DiKMP) je obvykle definovaná jako porucha funkce nebo struktury srdce způsobená cukrovkou, kdy současně není přítomná ischemická choroba srdeční (ICHS), hypertenze nebo jiná srdeční patologie. 1-6 Existenci DiKMP jako samostatné jednotky podporuje řada experimentálních i epidemiologických studií 7, ačkoli kardiologické klasifikační systémy kardiomyopatií ji neuvádějí. 8 Podle Framinghamské studie je výskyt ICHS u pacientů s cukrovkou dvojnásobný ve srovnání s populací nediabetických pacientů bez ohledu na pohlaví, počet úmrtí na srdeční příhodu je však trojnásobný. Frekvence výskytu srdečního selhání u diabetiků je významně vyšší (19 - 26 %) než výskyt cukrovky v populaci (6 - 8 %). Tyto údaje ukazují na to, že u diabetiků musí existovat ještě další negativní faktor, který zvyšuje stupeň poškození myokardu s následným vznikem srdečního selhání, a potvrzují to i zvířecí modely. 9 Je ovšem potřeba zdůraznit, že spolupřítomná ICHS i hypertenze zvýrazňují poškození myokardu způsobené cukrovkou, zhoršují hypertrofii levé komory, zvyšují citlivost svalových buněk na ischemii a zvyšují pravděpodobnost vzniku srdečního selhání. 5 (Tab. 1) Poprvé byla DiKMP popsána již před více než 40 lety Rublerem na souboru 4 pacientů. 10 Může pravděpodobně probíhat dlouho asymptomaticky. Podle posledních výzkumů je centrální příčinou jejího rozvoje porucha metabolismu srdeční svalové buňky, která má za následek funkční a následně i strukturální změny v myokardu. (Tab. 2)
Tab. 1. Potenciace poškození myokardu diabetem u vybraných chorob. 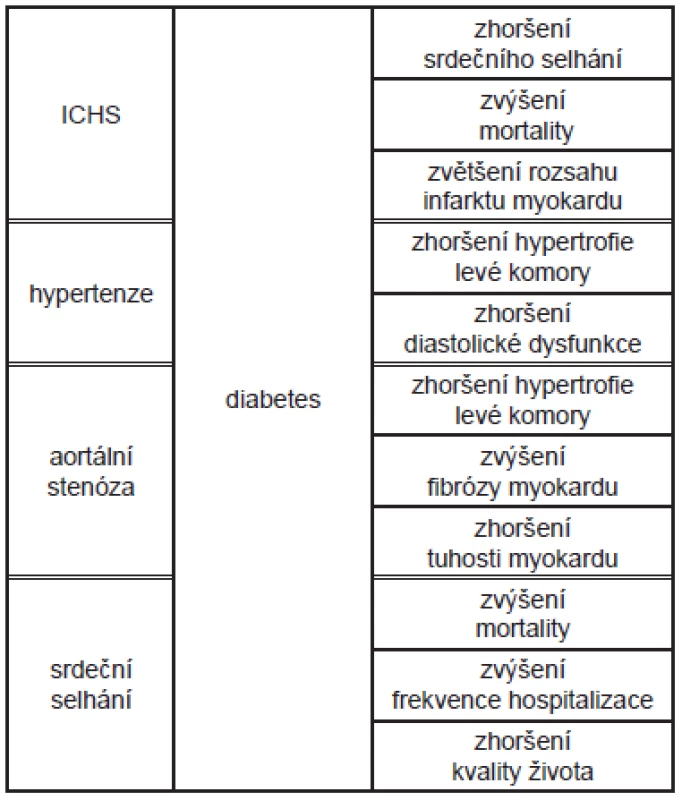
Tab. 2. Metabolické a funkční změny u DiKMP a jejich následky - schéma. 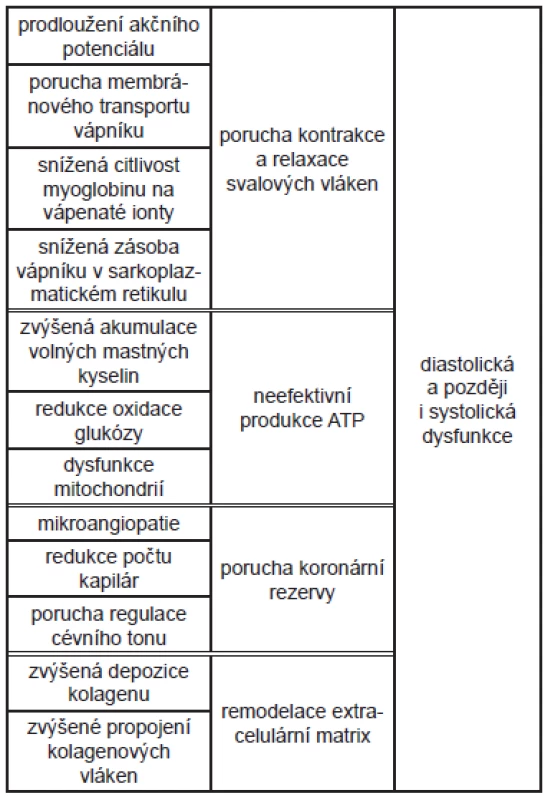
Srdeční svalová buňka musí trvale vytvářet dostatek energie pro mechanickou práci srdce. K tomu potřebuje dostatek krevního zásobení, správnou skladbu energetických substrátů v krvi a správnou funkci různých bílkovin, které se podílejí jednak na přenosu chemické energie, jednak na kontraktilitě a vedení vzruchu. 11 Vzhledem k energetickým nárokům na srdce je svalová buňka schopna využít pro tvorbu energie různé oxidovatelné substráty. 12 Základním zdrojem energie je glukóza a mastné kyseliny, které vstupují do buňky cestou usnadněného transportu. 13, 14 Při běžných nárocích na myokard (rychlé změny v potřebě energie) se mění pouze využití stávajících metabolických cest, zatímco při cukrovce (chronické změny zevních podmínek) dochází k přestavbě metabolických cyklů změnou složení a funkce enzymatických bílkovin, které je realizují. 11
Mastné kyseliny jsou hlavním zdrojem energie pro dospělé srdce v klidu, glukóza je hlavním zdrojem energie při zátěži (také pro fetální myokard). To je pro srdce energeticky výhodné, neboť účinnost oxidace glukózy převyšuje účinnost oxidace mastných kyselin až o 40 %. Srdce tedy využívá jako zdroj energie ten substrát, který je v daném okamžiku energeticky nejvýhodnější. U cukrovky je však situace srdeční svalové buňky zhoršena, protože v důsledku metabolických změn se mění koncentrace energetických substrátů v krvi. 6, 9, 15 Jedná se o zejména o zvýšenou hladinu glukózy, inzulinu a mastných kyselin. Do buňky se tak dostává méně glukózy a více mastných kyselin, jejichž oxidace vyžaduje více kyslíku. Může také dojít k rozpojení dýchacího řetězce v mitochondriích (kyslík není využit k tvorbě ATP, ale tvoří se kyslíkové radikály, které narušují metabolismus vápníku) s následnou poruchou svalové kontrakce. 5
Z funkčních změn je nejčastěji přítomné diastolické srdeční selhání (porucha relaxace v diastole při normální ejekční frakci (EF)) v důsledku zvýšené tvorby vaziva v myokardu. 2, 16 Jeho přítomnost zvyšuje mortalitu 5 - 8 krát ve srovnání se zdravými jedinci. Pokud dojde k manifestnímu systolickému srdečnímu selhání (snížená EF), je prognóza pacientů špatná, roční mortalita se pohybuje v rozmezí 15 - 20 %. Citlivým parametrem systolické dysfunkce je porucha kontraktilní rezervy (pokles EF při zátěži). Vered a kol. vyšetřili již téměř před 30 lety 30 diabetiků ve věku 21 - 35 let zátěžovou radionuklidovou ventrikulografií a porovnali je s 20 zdravými jedinci. EF LK při zátěži u 17 % diabetiků ve srovnání s klidovou klesla, u 27 % zůstala stejná a pouze u 56 % se zvýšila. U všech zdravých jedinců se EF při zátěži zvýšila, zvýšení bylo u zdravých jedinců vyšší než u diabetiků (10 % vs 6 %). Přitom nebyla pozorovaná žádná regionální porucha kinetiky ani porucha perfuze. 17
Z hlediska strukturálních změn je pro cukrovku typická hypertrofie myokardu (má vyšší hmotnost a větší tloušťku stěny). 16 Hypertrofie komory je však pozdním znakem DiKMP a je způsobena dlouhotrvajícími metabolickými změnami s podílem obezity. Svoji roli zde může hrát i zvýšená hladina inzulinu, kdy inzulin funguje jako růstový faktor. 5 Kromě toho je zde přítomné vyšší množství kolagenu jak v intersticiu (kolem cév i mezi svalovými buňkami) tak ve stěně cév, což dále zhoršuje zásobení svalových buněk krví, zhoršuje poddajnost a zvyšuje tuhost srdeční stěny. 9
Kromě toho může být přítomna autonomní neuropatie a uplatnit se může i aktivace sytému renin-angiotensin-aldosteron. 1, 3, 6, 16, 18
Frekvence výskytu cukrovky v populaci stoupá, zejména cukrovka 2. typu sleduje populační nárůst obezity. Ta se přesouvá do stále mladších věkových skupin, lze tedy očekávat, že bude přibývat pacientů s DiKMP. To představuje výzvu pro nalezení postupu, jak tuto poruchu včas diagnostikovat a zavést účinnou léčbu, která může ovlivnit její nepříznivou prognózu. Scintigrafické metody díky svým vlastnostem zde mohou hrát důležitou úlohu. 4
Scintigrafické metody při zobrazování myokardu
Z hlediska hodnocení metabolických změn máme k dispozici radiofarmaka pro měření krevního průtoku, pro měření vstupu substrátů do buňky a jejich intracelulární retence (substrátová analoga), pro měření výkonnosti celého metabolického řetězce (substráty) a pro měření aktivity Krebsova cyklu. (Tab. 3) Základní výhodou je, že je zde jednoduchý přenos poznatků z laboratoře do kliniky i naopak (stejný přístroj, stejné radiofarmakum).
Tab. 3. Příklady radiofarmak pro zobrazování myokardu. 
Z hlediska kvantifikace sledovaných dějů je nejvhodnější pozitronová tomografie (PET). Umožňuje přesné měření radioaktivity v zobrazovaném orgánu a sledování její časové distribuce. Kromě toho máme k dispozici vhodné pozitronové zářiče – izotopy biogenních prvků (11C, 15O, 13N a 18F, který nahrazuje vodík). Můžeme tedy označit skutečné substráty a přímo sledovat konkrétní metabolický děj, aniž ho jakkoli ovlivňujeme. K tomu přispívá také velmi malé množství indikátoru (pikomolární nebo femtomolární koncentrace). Vlastní měření se pak provádí matematickým modelováním pomocí analýzy dynamických křivek, které popisují časové změny distribuce radiofarmaka (vychytávání, rychlé a pomalé vyplavování). Z hlediska dostupnosti a možnosti sledovat více substrátů současně je vhodnější použít SPECT. Oba zobrazovací systémy jsou dostupné také v provedení pro malá laboratorní zvířata i v hybridním provedení.
Použití SPECT
Hlavní výhodou SPECT je všeobecná dostupnost a možnost sledovat více radiofarmak současně, pokud je označíme různými radionuklidy. 19 Hlavní nevýhodou SPECT je nedostupnost vhodných metabolických indikátorů a horší časové a polohové rozlišení, takže tuto techniku nelze použít pro kvantifikaci metabolických dějů v myokardu. Podle posledních informací se však zdá, že technika spěje kupředu i v této oblasti a někteří výrobci již dnes nabízejí kamery, které spolu s příslušným softwarem kvantifikaci umožňují.
V současné době není k dispozici vhodné radiofarmakum pro sledování metabolismu glukózy v myokardu technikou SPECT, zejména pro její kvantifikaci. Je však možné zobrazit distribuci metabolismu glukózy v myokardu pomocí 18F-FDG alespoň kvalitativně, pokud máme gamakameru vybavenou vhodnými kolimátory pro ultravysoké energie. 20, 21 V tomto uspořádání se metoda používala pro detekci viabilního myokardu u pacientů po infarktu myokardu nebo se srdečním selháním. Sloužila jako alternativa k jiným metodám, zejména zátěžové echokardiografii 22 nebo scintigrafii s 201Tl chloridem. 23 Vzhledem k tomu, že ischemický myokard využívá přednostně jako energetický zdroj glukózu, nabízí se možnost detekce ischemického myokardu, který se zobrazí jako zvýšeně akumulující oblast. (Obr. 1) Hodnocení je však problematické, protože akumulace FDG v myokardu není konstantní a mění se v závislosti na metabolickém stavu pacienta – glykémie, inzulinémie, spotřeba glukózy v myokardu, plazmatická hladina volných mastných kyselin, hladina katecholaminů. 3, 11, 19, 24
Obr. 1. Zvýšená akumulace <sup>18</sup>F-FDG v ischemickém myokardu. Zvýšená akumulace glukózy je patrná v místě perfuzního defektu v basální části přední stěny. Horní řada perfuze myokardu v klidu (<sup>99m</sup>Tc-MIBI), dolní řada metabolismus glukózy v myokardu (<sup>18</sup>F-FDG), vlevo SA řezy, vpravo VLA řezy. Snímáno technikou SPECT. 
Metabolismus mastných kyselin je pro zobrazení technikou SPECT dostupnější, protože je k dispozici několik radiofarmak. Patří sem např. p-jodofenyl-pentadekanová kyselina s dlouhým lineárním řetězcem, jejíž clearance koreluje s intenzitou betaoxidace mastných kyselin. 24 Její oxidace je však příliš rychlá pro zobrazování technikou SPECT. Jako nejvhodnější se jeví její derivát 123I-β-metyl-p-jodofenyl-pentadekanová kyselina (BMIPP), která je i komerčně dostupná. Má rozvětvený řetězec s metylovou skupinou, což způsobí, že po vstupu do buňky není dále metabolizovaná, ale v buňce se hromadí. Retence v buňce tak umožňuje zobrazení v delším čase, což je pro SPECT nezbytné. Rovněž delší fyzikální poločas 123I umožňuje centrální produkci s následnou distribucí na jednotlivá pracoviště podobně jako u jiných radiofarmak. BMIPP se v klinické praxi využívá zejména u pacientů s ICHS a s chronickým renálním selháním. Její buněčná retence je ukazatelem produkce ATP z mastných kyselin. Oxidace mastných kyselin však vyžaduje velké množství kyslíku, je proto při ischemii snížená. Ischemický myokard se tedy vyznačuje sníženou akumulací BMIPP. Po krátkodobé epizodě ischemie může porucha oxidace přetrvávat až 30 hodin, BMIPP je tedy vhodná pro detekci subakutní ischemie myokardu. 25 U uremických pacientů dochází k difuzní ischemii myocytů a k přesunu energetických substrátů z mastných kyselin na glukózu. BMIPP tedy potenciálně může v této skupině identifikovat pacienty se zvýšeným rizikem srdeční smrti. 26
Z hlediska hodnocení autonomní inervace myokardu máme k dispozici komerčně dostupný falešný mediátor sloužící k hodnocení presynaptické sympatické inervace 123I-metaidobenzylguanidin (MIBG). Protože je porucha inervace velmi citlivým parametrem pro DiKMP, můžeme autonomní neuropatii srdce (cardiac autonomous neuropathy (CAN)) detekovat v časných stadiích, což má velký terapeutický význam. Bylo totiž prokázáno, že včasná terapeutická intervence jako je fyzická aktivita, léčba rizikových faktorů aterosklerózy a intenzifikovaná inzulinová terapie se zlepšenou kontrolou glykémie zlepšuje v dlouhodobém výhledu sympatickou inervaci srdce. 27 Sympatická dysfunkce diabetického srdce je způsobená ztrátou sympatických neuronů (denervací), nikoli zvýšenou aktivitou sympatiku. 3 Důsledkem je zhoršení krevního průtoku (pokles koronární rezervy), pokles kontraktility, větší náchylnost k arytmiím a k náhlé smrti. U pokročilých forem CAN je denervace spojena s ostrůvky hyperinervace. 2 Denervace postihuje nejčastěji oblast hrotu, spodní a boční stěny. Toto segmentární postižení bylo detekováno také u pacientů s porušenou glukózovou tolerancí. Segmentární postižení bylo rovněž spojeno s regionální poruchou diastolické funkce, takže je možný přímý vliv CAN na komorovou dysfunkci u diabetiků. 28 Snížená akumulace MIBG byla rovněž prokázaná u diabetiků s normálními autonomními reflexy a s normálním prokrvením myokardu bez koronární aterosklerózy.
Zobrazování distribuce krevního toku k myocytům myokardu patří k nejčastějším rutinním vyšetřením technikou SPECT v nukleární medicíně. Používají se především 99mTc značená radiofarmaka, ale stále je k dispozici také 201Tl chlorid. Primárním cílem zátěžové perfuzní scintigrafie myokardu (PSM) je zobrazit poruchu perfuze při zátěži a zhodnotit její rozsah a závažnost. 29 Význam zátěžové PSM v rizikové stratifikaci pacientů byl prokázán na velkých souborech. 39 173 pacientů s normálním nálezem na PSM a dobou sledování 2,3 roku mělo roční výskyt srdečního úmrtí nebo infarktu myokardu 0,6 %, zatímco 69 655 pacientů s poruchou perfuze 5,9 %. Kromě údajů o vlastní perfuzi je také informativní typ zátěže. Pacienti s fyzickou zátěží měli při normálním nálezu frekvenci srdečních příhod 0,7 %, při farmakologické zátěži 1,2 %. Podobně pacienti s poruchou perfuze při fyzické zátěži měli frekvenci srdečních příhod 5,6 % a při farmakologické zátěži 8,3 %. Stejně tak je informativní typ perfuzní poruchy, kdy fixní defekt ukazuje vyšší riziko úmrtí, zatímco reversibilní defekt ukazuje vyšší riziko infarktu. Pokud jde o negativní předpovědní hodnotu (NPV) normálního nálezu, je u diabetiků horší než u pacientů bez diabetu. U diabetiků je NPV 1,2 - 2 %, zatímco u pacientů bez diabetu je pod 1 %. Na druhou stranu je frekvence srdečních příhod u diabetiků s perfuzní poruchou tři až osmkrát vyšší než u diabetiků s normálním nálezem. 30 K podobným závěrům jsme dospěli také u našich pacientů. 31-33
Studie DIAD ukázala, že intenzivní farmakologická léčba asymptomatických diabetiků s prokázanou poruchou perfuze vede ke zlepšení perfuze myokardu a k ústupu ischemie. 34 Intenzifikace farmakologické léčby anopyrinem, statiny a ACE inhibitory u asymptomatických diabetiků s prokázanou poruchou perfuze myokardu vede v průběhu 3 let k regresi těchto perfuzních změn (u 56/71 tj. 79 %). Autoři se domnívají, že je to díky zlepšení endoteliální dysfunkce a stabilizaci aterosklerotických plátů při intenzifikované farmakologické léčbě. Proto je včasná diagnóza ischemie myokardu pomocí neinvazivních metod spojená s rizikovou stratifikací velmi důležitá. Umožní totiž správnou volbu terapie včetně invazivního vyšetření. 30
Použití PET
Hlavní výhodou pozitronové tomografie je schopnost kvantifikace sledovaných dějů analýzou kinetických křivek sledovaných radiofarmak pomocí vhodných matematických modelů. 19
Metabolismus glukózy můžeme zobrazovat technikou PET přímo pomocí glukózy značené 11C nebo pomocí jejího analoga – fluorodeoxyglukózy značené 18F (FDG). Použití analoga je sice jednodušší (snazší dostupnost), ale vzhledem k modifikaci molekuly umožňuje sledovat pouze část metabolického řetězce. V buňce je FDG fosforylovaná, nikoli však dále metabolizovaná a v buňkách se hromadí, je ji tedy možné použít pro měření transportu glukózy přes buněčnou membránu a její fosforylaci. Tento model byl ověřen na izolovaném pracujícím krysím srdci. Ke kvantitativnímu měření slouží poměrně složité vícekompartmentové kinetické modely, provedení je náročné na laboratorní práci. K měření metabolismu glukózy in vivo můžeme použít vlastní substrát, práce je však ještě náročnější, vyžaduje krevní odběry včetně analýzy metabolitů. 35 Na druhé straně umožňuje také měření syntézy glykogenu, glykolýzy a oxidace glukózy. Její použití však vyžaduje cyklotron na pracovišti. Pomocí 11C glukózy bylo zjištěno, že vychytávání glukózy je u diabetiků 1. typu snížené v důsledku snížené transportní kapacity a že pro stejnou úroveň vychytávání a oxidace glukózy potřebují diabetici vyšší hladinu inzulinu než nediabetici (inzulinová rezistence). 24 FDG se experimentálně používá pro měření akumulace glukózy u hlodavců. Bylo prokázáno, že její vychytávání v buňkách dobře koreluje s expresí GLUT-4. Na myším modelu diabetických změn se zvýšenou expresí jaderného receptoru PPARalfa (hlavní regulátor akumulace, oxidace a ukládání mastných kyselin) byla prokázaná suprese vychytávání glukózy a zvýšené vychytávání mastných kyselin. Naopak zvýšená exprese receptoru PPARbeta/delta způsobila zvýšené vychytávání glukózy a sníženou utilizaci mastných kyselin. 36
Z radiofarmak pro analýzu metabolismu mastných kyselin pomocí PET je k dispozici několik substrátů. Experimentálně se nejvíce používá 11C palmitát. Bylo např. zjištěno, že pacienti s diabetem 1. typu mají vyšší úroveň vychytávání a oxidace mastných kyselin ve srovnání s nediabetiky v důsledku jejich zvýšené plazmatické hladiny. 24 Rovněž obézní pacienti mají zvýšené vychytávání i oxidaci mastných kyselin. Také bylo zjištěno, že metabolická odpověď na obezitu je závislá na pohlaví. Např. obezita méně ovlivňuje metabolismus mastných kyselin v myokardu u mužů (na druhou stranu obézní muži mají zvýšenou inzulinovou rezistenci). K dispozici je také několik dalších metabolických analogů značených 18F (fluoro-thio-heptadekanová kyselina (FTHA)).
Pro měření spotřeby kyslíku v myokardu jsou k dispozici kyslík a acetát. Pomocí 15O je možné měřit extrakci kyslíku přímo. Vzhledem ke krátkému poločasu přeměny je vhodný pro opakovaná měření, např. při farmakologických intervencích. Nevýhodou je nutnost složitého kompartmentového modelování. Preferovaným radiofarmakem pro měření spotřeby kyslíku v myokardu je 11C acetát. Je rychle metabolizován v Krebsově cyklu, který je těsně spjat s oxidativní fosforylací, takže obrat acetátu je odrazem celkového oxidativního metabolismu, tedy spotřeby kyslíku. 24
Nejčastěji užívaným radiofarmakem pro vyšetřování autonomní inervace je falešný mediátor sloužící k hodnocení presynaptické sympatické inervace 11C hydroxyefedrin (HED). 3 Přítomnost autonomní neuropatie se projeví sníženou akumulací radiofarmaka. Klinické použití je stejné jako při použití MIBG, ale vzhledem k nutnosti značení 11C jsou tyto metody omezené na pracoviště, která mají k dispozici cyklotron.
Pro analýzu perfuze myokardu metodou pozitronové tomografie máme v současné době k dispozici dvě radiofarmaka. 37 Nejdéle se používá 13N amoniak, nověji 82Rb chlorid. Amoniak vstupuje do buněk pasivní difuzí, jeho množství v myokardu je mírou koronárního krevního průtoku. 82Rb se chová jako 201Tl. Základní výhodou pozitronové tomografie je možnost kvantifikace. Dosud se tato metoda používala spíše experimentálně při studiu koronární patofyziologie u časných stadií aterosklerózy a endoteliální dysfunkce 38, s rozvojem komerčně dostupného programového vybavení se však stále více uplatňuje i v klinické praxi. 39 V poslední době je k dispozici i radiofarmakum pro perfuzi myokardu značené 18F (18F-flurpiridaz). 40-42 Měření koronární rezervy může hodnotit hemodynamickou významnost jednotlivých anatomických stenóz, může hodnotit efektivitu kolaterálního řečiště, může identifikovat endoteliální dysfunkci v předklinické fázi aterosklerózy a také může spolehlivě hodnotit efektivitu různých terapeutických intervencí. 43
Závěr
Diabetická kardiomyopatie je choroba, která vede k srdečnímu selhání i bez přítomné koronární aterosklerózy. Svědčí pro to epidemiologická i experimentální data, která ukazují na souvislost mezi cukrovkou a srdečním selháním. Přesná příčina není dosud známa, nejpravděpodobněji se jedná o multifaktoriální poruchu. Na počátku nejspíše stojí metabolická porucha se zvýšenou oxidací mastných kyselin a ketolátek a se sníženým využitím glukózy, porucha mitochondrií a narušený energetický metabolismus. To má za následek zvýšenou fibrózu, endoteliální dysfunkci, autonomní neuropatii a koronární aterosklerózu.
Význam scintigrafických metod v experimentu spočívá především v tom, že umožňují měřit výše popsané metabolické i fyziologické funkce a jejich změny způsobené cukrovkou na živém organismu, aniž by měřené funkce nějakým způsobem ovlivňovaly. Je to dáno jejich vysokou citlivostí, takže množství použitého radiofarmaka je z hlediska sledovaných procesů zanedbatelné a nedochází tak k jejich modifikaci. V tomto ohledu je scintigrafie užitečnější než zobrazování magnetickou rezonancí, jejíž citlivost je o několik řádů nižší. Důsledkem je pak změna metabolických procesů způsobená velkým množstvím indikátoru v průběhu jejich sledování.
Rovněž v klinické praxi mají scintigrafické metody velký význam. Uplatňují se ve stadiu diagnostiky, sledování progrese chorobných změn nebo hodnocení léčebného efektu.
Hlavní limitací v současné době je nedostatečné přístrojové vybavení. Bylo by potřeba zlepšit kvalitu současných kamer pro přesnější kvantifikaci použitých indikátorů jak u laboratorních zvířat, tak u lidí. Technické zlepšení SPECT zejména v hybridním uspořádání s CT by rovněž umožnilo přesnější kvantifikaci a vedlo k jejímu širšímu využití, zejména při možnosti sledovat více indikátorů současně. Pro zvířecí modely bude zapotřebí vyvinout nová radiofarmaka, která by umožnila charakterizovat klíčové metabolické procesy, zejména vztahy mezi metabolickými substráty a růstem a přežíváním buněk. Pro klinické studie metabolického zobrazování je nezbytná dostupnost vhodných radiofarmak značených 18F nebo 123I, jejichž použití by umožnilo zhodnotit efektivitu metabolického zobrazování v diagnostice, rizikové stratifikaci i monitoraci léčby. Pochopení molekulárních a patofyziologických změn rovněž umožní efektivnější a cílenější léčbu, která by mohla zlepšit dosud značně nepříznivou prognózu pacientů s diabetickou kardiomyopatií.
Otto Lang
Klinika nukleární medicíny, UK 3. LF a FNKV, Praha 10
otto.lang@fnkv.cz
Zdroje
1. Khavandi K, Khavandi A, Asghar O et al. Diabetic cardiomyopathy – a distinct disease? Best Practice & Research Clinical Endocrinology & Metabolism 2009;23 : 347-360
2. Voulgari C, Papadogiannis D, Tentolouris N. Diabetic cardiomyopathy: from the pathophysiology of the cardiac myocytes to current diagnosis and management strategies. Vasc Health Risk Manag 2010;6 : 883-903
3. Sasso FC, Rambaldi PF, Carbonara O et al. Perspectives of nuclear diagnostic imaging in diabetic cardiomyopathy. Nutrition, Metabolism & Cardiovascular Diseases 2010;20 : 208-216
4. Maya L, Villarreal FJ. Diagnostic approaches for diabetic cardiomyopathy and myocaradial fibrosis. J Mol Cell Cardiol 2010;48 : 524-529
5. Boudina S, Abel ED. Diabetic cardiomyopathy, causes and effects. Rev Endocr Metab Disord 2010;11 : 31-39
6. Tarquini R, Lazzeri C, Pala L et al. The diabetic cardiomyopathy. Acta Diabetol 2011;48 : 173-181
7. Fisher BM, Gillen G, Lindop GB et al. Cardiac function and coronary arteriography in asymptomatic type-1 (insulin-dependent) diabetic patients: evidence for a specific diabetic heart disease. Diabetologia 1986;29 : 706-712
8. Maron BJ. Is the 2006 American Heart Association classification of cardiomyopathies the gold standard? Circ Heart Fail 2008;1 : 72-76
9. Duncan JG. Mitochondrial dysfunction in diabetic cardiomyopathy. Biochimica et Biophysica Acta 2011;1813 : 1351–1359
10. Rubler S, Dlugash J, Yuceoglu YZ et al. New type of cardiomyopathy associated with diabetic glomerulosclerosis. Am J Cardiol 1972;30 : 595-602
11. Taegtmeyer H. Tracing Cardiac Metabolism In Vivo: One Substrate at a Time. J Nucl Med 2010; 51 : 80S-87S
12. Hue L, Taegtmeyer H. The randle cycle revisited: a new head for an old hat. Am J Physiol Endocrinol Metab 2009;297:E578-E591
13. Russell LK, Finck BN, Kelly. Mouse models of mitochondrial dysfunction and heart failure. J Mol Cell Cardiol DP 2005;38 : 81-91
14. Steinbusch LKM, Schwenk RW, Ouwens DM et al. Subcellular trafficking of the substrate transporters GLUT4 and CD36 in cardiomyocytes. Cell Mol Life Sci 2011;68 : 2525-2538
15. Heather LC, Clarke K. Metabolism, hypoxia and the diabetic heart. Journal of Molecular and Cellular Cardiology 2011;50 : 598-605
16. Murarka S, Movahed MR. Diabetic cardiomyopathy. J Cardiac Fail 2010;16 : 971-979
17. Vered A, Battler A, Segal P et al. Exercise-induced left ventricular dysfunction in young men with asymptomatic diabetes mellitus (diabetic cardiomyopathy). Am J Cardiol 1984;54 : 633-637
18. Aneja A, Tang WH, Bansilal S et al. Diabetic cardiomyopathy: insights into pathogenesis, diagnostic challenges, and therapeutic options. Am J Med 2008;121 : 748-757
19. Gropler RJ, Beanlands RSB, Dilsizian V, et al. Imaging myocardial metabolic remodeling. J Nucl Med 2010;51 : 88S-101S
20. Lang O, Malá M, Kleisner I et al. Detekce anihilačního záření 18F technikou SPECT - klinické zkušenosti s 18F-fluorodeoxyglukosou (FDG) u pacientů po infarktu myokardu. Cor Vasa 1999;41S:34
21. Lang O, Kamínek M. Radionuklidové zobrazování viability myokardu. Kardiol prax 2006;4 : 230-233
22. Lang O, Malá M, Kleisner I et al. Viabilita myokardu hodnocená pomocí průkazu přítomnosti metabolizmu nebo kontraktilní rezervy - srovnání principiálně odlišných metod. Cor Vasa 2000;42S:42
23. Lang O, Malá M, Kleisner I et al. Srovnání 201Tl-chloridu s 18F-FDG pro detekci viability myokardu. Cardio3 2003 05:A01
24. Bashir A, Gropler RJ. Translation of Myocardial Metabolic Imaging Concepts into the Clinics. Cardiol Clin 2009;27 : 291-319
25. Kontos MC, Dilsizian V, Weiland F et al. Iodofiltic acid I 123 (BMIPP) fatty acid imaging improves initial diagnosis in emergency department patients with suspected acute coronary syndromes: a multicenter trial. J Am Coll Cardiol 2010;56 : 290-299
26. Nishimura M, Tsukamoto K, Hasebe N et al. Prediction of cardiac death in hemodialysis patients by myocardial fatty acid imaging. J Am Coll Cardiol 2008;51 : 139–145
27. Flotats A, Carrió I. Is Cardiac Autonomic Neuropathy the Basis of Nonischemic Diabetic Cardiomyopathy? JACC Cardiovasc Imaging 2010;3 : 1216-1218
28. Sacre JW, Franjic B, Jellis CL et al. Association of cardiac autonomic neuropathy with subclinical myocardial dysfunction in type 2 diabetes. J Am Coll Cardiol Img 2010;3 : 1207–1215
29. Djaberi R, Beishuizen ED, Pereira AM, et al. Non-invasive cardiac imaging techniques and vascular tools for the assessment of cardiovascular disease in type 2 diabetes mellitus. Diabetologia 2008;51 : 1581-1593
30. Freeman, M. Myocardial perfusion imaging in diabetes mellitus. Can J Cardiol 2006;22(S):22A-25A
31. Lang O, Malá M, Trešlová L et al. Zobrazení myokardiální perfuze metodou SPECT v souboru pacientů se suspektní nebo potvrzenou ICHS – srovnání pacientů s diabetem a bez diabetu. Diabetologie, metabolismus, endokrinologie, výživa 2000;3S:28-29
32. Kamínek M, Mysliveček M, Škvařilová M et al. Prognostický význam zátěžové tomografické scintigrafie myokardiální perfuze u diabetických pacientů. Vnitř. Lék. 2001;45 : 739-743
33. Metelková I, Kamínek M, Sovová E et al. Stratifikace rizika pomocí zátěžového SPECT zobrazení myokardu v kombinaci se stanovením koronárního kalciového skóre u rizikových pacientů s diabetem a/nebo ledvinným selháním. Vnitř Lék 2010; 56 : 1122-1129
34. Wackers FJT, Chyun DA, Young LH, et al. Resolution of asymptomatic myocardial ischemia in patients with type 2 diabetes in the Detection of Ischemia in Asymptomatic Diabetics (DIAD) study. Diabetes Care 2007;30 : 2892-2898
35. Dence CS, Herrero P, Schwarz SW et al. Imaging myocardium enzymatic pathways with carbon-11 radiotracers. Methods Enzymol 2004;385 : 286–315
36. Burkart EM, Sambandam N, Han X et al. Nuclear receptors PPARbeta/delta and PPARalpha direct distinct metabolic regulatory programs in the mouse heart. J Clin Invest 2007;117 : 3930–3939
37. Bengel FM, Higuchi T, Javadi MS, et al. Cardiac positron emission tomography. J Am Coll Cardiol 2009;54 : 1–15
38. Schindler TH, Zhang XL, Mhiri L, et al. Role of PET in the evaluation and understanding of coronary physiology. J Nucl Cardiol 2007;14 : 589-603
39. Graf S, Khorsand A, Gwechenberger M, et al. Typical chest pain and normal coronary angiogram: cardiac risk factor analysis versus PET for detection of microvascular disease. J Nucl Med 2007; 48 : 175–181
40. Sherif HM, Nekolla SG, Saraste A et al. Simplified quantification of myocardial flow reserve with flurpiridaz F 18: validation with microspheres in a pig model. J Nucl Med 2011;52 : 617-624
41. Berman DS, Germano G, Slomka PJ. Improvement in PET myocardial perfusion image quality and quantification with flurpiridaz F 18. J Nucl Cardiol 2012;19S1:S38-45
42. Berman DS, Maddahi J, Tamarappoo BK et al. Phase II safety and clinical comparison with single-photon emission computed tomography myocardial perfusion imaging for detection of coronary artery disease: flurpiridaz F 18 positron emission tomography. J Am Coll Cardiol 2013;61 : 469-477
43. Lang O, Kamínek M. PET/CT v kardiologii. Cor Vasa 2010;52 : 506-512
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2013 Číslo 4- Biochemoterapie agresivního karcinomu rekta – kazuistika z českého prostředí
- Intersticiální plicní procesy a jejich fibrotická progrese
- MDT Board: unikátní projekt pro lékaře pečující o pacienty s onemocněním plic a dalšími patologiemi v oblasti hrudníku
- Časná regrese nádoru jako marker celkového přežití v 1. linii léčby mCRC
- Kolorektální karcinom a jeho léčba v pokročilém stadiu dle aktuální Modré knihy ČOS
Nejčtenější v tomto čísle- Pyogenní stafylokoková sakroileitida diagnostikovaná pomocí třífázové scintigrafie skeletu
- Metastáza maligního melanomu v páteři detekovaná pomocí SPECT/CT při galliové scintigrafii
- Scintigrafie u diabetické kardiomyopatie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



